Авторы: Richard D. Bellah, Monica S. Epelman, Kassa Darge
КЛЮЧЕВЫЕ СЛОВА
Мочевыводящий, инфекция, оценка, тракт, сонография
Инфекция мочевыводящих путей (ИМВП) является распространенной патологией у детей и одной из наиболее частых причин детской заболеваемости. Золотым стандартом диагностики ИМВП является выявление культуры патогенных бактерий (обычно Escherichia coli, Klebsiella, Proteus и Pseudomonas) в моче. Однако, в амбулаторных условиях часто используются скрининговые методы (например, определение уровня лейкоцитарной эстеразы или нитритов в моче).
В патогенезе ИМВП у детей играют роль разнообразные составляющие. Когда такие факторы бактериальной вирулентности как, например, факторы адгезивности и подвижности, перевешивают факторы резистентности организма, вероятность развития ИМВП повышается. Большую роль играют также анатомические, гуморальные и генетические факторы. Наибольшая заболеваемость ИМВП, как для мальчиков, так и для девочек встречается в возрасте до одного года жизни, а затем постепенно уменьшается. В течение первых нескольких месяцев жизни заболеваемость ИМВП у мальчиков превышает таковую у девочек, вероятно, из-за колонизации уропатогенными бактериями крайней плоти, у детей без кругового иссечения крайней плоти. Однако, первичная и рецидивирующая ИМВП чаще встречаются у девочек. Оценка показателей инфицирования в первые 24 месяца жизни приводит следующие данные заболеваемости: 3% мальчиков менее 1 года, 2% мальчиков старше 1 года (< 0,5% для мальчиков с иссеченной крайней плотью), 7% девочек менее 1 года и 8% девочек в возрасте от 1 до 2 лет. В некоторых исследованиях также была показана тенденция к снижению ИМВП у белокожих, по сравнению с чернокожими девочками.
Симптомы ИМВП у детей могут быть весьма разнообразными, что зависит от того, ограничена ли инфекция мочеиспускательным каналом, мочевым пузырем или проксимальным отделом мочевыводящих путей (мочеточник, чашечно-лоханочная система или паренхима почки). Однако истинная заболеваемость достоверно неизвестна из-за неспецифичности и частого отсутствия симптоматики. В случае отсутствия данных визуальных исследований, младенцу с лихорадкой, или ребенку с клинически значимой бактериемией без каких-либо других явных очагов инфекции, чисто с клинической точки зрения предварительно ставится диагноз ИМВП проксимальных отделов (пиелонефрит). Когда у ребенка развиваются симптомы ИМВП и на фоне проблем с мочеиспусканием, с незначительным повышением (или без) температуры и отсутствием системных проявлений, предварительно ставится диагноз ИМВП дистальных отделов (цистит). Однако различие не всегда очевидно, особенно у маленьких детей. В результате, заболевания, связанные с ИМВП, могут быть весьма разнообразными: от системного поражения, связанного с острым пиелонефритом, до симптомов нарушения мочеиспускания – цистита. Хотя данные длительного динамического наблюдения в литературе ограничены, в нескольких исследованиях детской популяции отмечается связь между почечным фиброзом, который вызывается острым пиелонефритом с гипертонией, и поздней стадией почечной недостаточности. Хотя в современных исследованиях поднимается вопрос о подобной взаимосвязи, высокая распространенность и частая заболеваемость, связанные с ИМВП у детей, определили необходимость продолжения изучения роли визуальных методов исследования в алгоритме диагностики и лечения.
ЦЕЛЬ И ЗАДАЧИ ПРОВЕДЕНИЯ ВИЗУАЛЬНОГО ИССЛЕДОВАНИЯ
Цель исследования мочевыводящей системы у пациентов детского возраста при развитии инфекции заключается в том, чтобы: (1) обнаружить возможную причину инфицирования, чтобы предотвратить рецидив и уменьшить риск распространения болезни; (2) определить, имеют ли почки нормальную структуру, вовлечены ли в патологический процесс или подвержены риску развития фиброзного процесса; (3) определить, имеет ли место пузырно-мочеточниковый рефлюкс (ПМР), что способствует развитию восходящей инфекции от мочевого пузыря; (4) идентифицировать конкременты мочевыводящих путей, которые могут длительно сохраняться и служить причиной повторной ИМВП; (5) выявлять зоны обструкции оттока мочи. Хотя ПМР считается основным фактором риска развития ИМВП и поражения почек, было показано, что ИМВП и фиброзный процесс в почках могут возникать без ПМР, равно как и некоторые дети с ИМВП и ПМР могут никогда не иметь признаков фиброзного процесса в почках. Алгоритм визуальной диагностики, который обычно включает ультразвуковое исследование (УЗИ), радионуклидное исследование (с димеркаптоянтарной кислотой [DMSA – dimercaptosuccinic acid]) и микционную цистоуретрографию (МЦУГ), постепенно подвергается изменениям. Несмотря на это, многие организации, такие как Американское сообщество радиологов и Европейское общество детской радиологии, стандартизировали диагностические визуальные исследования, и подготовили рекомендации и руководства для оценки ребенка с ИМВП. Однако общеизвестным является тот факт, что ни одна визуальная техника диагностики не может ответить на все основные вопросы. Еще более противоречивым является то, что некоторые исследователи недавно поставили под сомнение использование УЗИ, несмотря на его привлекательность в качестве неинвазивного метода. Это происходит главным образом из-за неспособности ультразвука обнаруживать воспалительные изменения, мелкие поврежденные участки в почках или перемежающуюся дилатацию, которая связана с ПМР. В одном из исследований, в котором было поставлено под сомнение необходимость проведения рутинного УЗИ, были получены следующие показатели для обнаружения ПМР: чувствительность – 17%, специфичность – 88%, положительная прогностическая ценность – 24% и отрицательная прогностическая ценность – 83%. В другом исследовании чувствительность составляла 10%, при этом ни у одного из пациентов с аномальной ультразвуковой картиной почек не было необходимости в изменении тактики лечения. Однако, учитывая тот факт, что появляются и развиваются новые методы УЗИ, а качество техники ультразвукового исследования в серой шкале и цветной доплерографии продолжает совершенствоваться, радиологические организации и детские урологические радиологические общества всегда включают УЗИ в качестве важного этапа алгоритма визуальной диагностики. Практикующие педиатры по-прежнему неохотно отказываются от традиционного стандартного УЗИ, потому что оно не представляет никакого риска или дискомфорта для пациентов младшего возраста. Ниже разбираются основные базовые особенности УЗИ для постановки диагноза ИМВП у детей, а также описываются преимущества потенциальных дополнительных ультразвуковых методов и приложений, таких как ультразвуковое исследование высокого разрешения, гармоническая визуализация и микционная уросонография (МУС) с контрастным усилением.
ИНФЕКЦИЯ МОЧЕВЫВОДЯЩИХ ПУТЕЙ: ТЕХНИКА УЛЬТРАСОНОГРАФИИ И ИНТЕРПРИТАЦИЯ РЕЗУЛЬТАТОВ
Оценка состояния мочевыводящих путей у детей с ИМВП должна включать исследование почек; мочеточников (если они видны) и мочевого пузыря. Следует использовать высокочастотный датчик, который достигает по глубине зону интереса. Для младенцев используется конвексный датчик от 8 до 13 МГц, для детей младшего возраста, конвексный датчик от 4 до 9 МГц, а для подростков может использоваться конвексный датчик от 2 до 5 МГц.
Для младенцев и детей младшего возраста сначала следует осматривать мочевой пузырь, потому что ребенок может самовольно опорожнить свой мочевой пузырь, что затрудняет дальнейшее получение полезной информации о самом пузыре, о стенке мочевого пузыря и дистальном отделе мочеточников (их диаметр и место впадения). Мочевой пузырь должен быть достаточно хорошо растянут и исследоваться в поперечных и сагиттальных плоскостях. В поперечной плоскости изображения должны быть получены от верхушки мочевого пузыря до дна в зоне внутреннего отверстия уретры. В сагиттальной плоскости изображения должны включать внутреннее отверстие уретры, дистальный отдел мочеточников с двух сторон, а также места впадения мочеточников. Цветная доплерография может быть эффективна при идентификации места впадения мочеточников в виде струйки мочи.
У пациента с ИМВП целью сонографии мочевого пузыря является получение информации о возможной причине предрасположенности ребенка к инфекции. Толщина стенки мочевого пузыря обычно считается нормальной до 0,3 см при полном мочевом пузыре, и 0,5 см – при пустом. Патологические состояния, которые могут вызвать утолщение стенки мочевого пузыря и быть провоцирующим фактором развития инфекции включают: обструкцию выходного отверстия мочевого пузыря (внутреннего отверстия уретры) и дисфункцию мочеиспускания (с или без нейрогенной дисфункции мочевого пузыря) (рис. 1).
Рис. 1. Синдромом элиминаторной дисфункции. УЗИ мочевого пузыря (поперечная проекция) до мочеиспускания (А) и после мочеиспускания (В) у 6-летней девочки с частым мочеиспусканием тонкой струйкой и рецидивирующей ИМВП. Показано утолщение стенки мочевого пузыря, и умеренное количество остаточной мочи.
У ребенка с так называемым «Синдромом элиминаторной дисфункции», в дополнение к дисфункции мочеиспускания, в развитии ИМВП также может играть определенную роль запор. Большие дивертикулы мочевого пузыря также могут приводить к дисфункции мочеиспускания из-за невозможности полного или эффективного опорожнения мочевого пузыря (рис. 2).
Рис. 2. Большой дивертикул мочевого пузыря, который приводит к неполному опорожнению мочевого пузыря. (A) УЗИ (поперечная проекция) мочевого пузыря (bl) демонстрирует большой правосторонний дивертикул мочевого пузыря (d). (B, C) МЦУГ показывает большой правосторонний дивертикул мочевого пузыря (d), который увеличивается во время мочеиспускания, что приводит к неполному опорожнению мочевого пузыря.
При остром начале заболевания, утолщение стенки мочевого пузыря может быть вызвано циститом, который может иметь бактериальное или вирусное происхождение. На изображениях в оттенках серого наблюдается неравномерное утолщение стенки мочевого пузыря, а при цветной доплерографии определяется гиперваскуляризация стенки мочевого пузыря (рис. 3).
Рис. 3. Бактериальный цистит. Цветная доплерография мочевого пузыря (поперечная проекция) показывает значительное неравномерное утолщение стенки мочевого пузыря с гиперваскуляризацией основания мочевого пузыря (стрелки).
Утолщение стенки мочевого пузыря при цистите, вызванное аденовирусом, может быть настолько выраженным в некоторых случаях, что визуально имитирует картину опухоли мочевого пузыря (рис. 4) .
Рис. 4. Вирусный цистит, имитирующий новообразование мочевого пузыря. УЗИ мочевого пузыря в оттенках серого (A) и цветная доплерография (B) демонстрируют неравномерное опухолеобразное утолщение с гиперваскуляризацией, которое охватывает левую стенку мочевого пузыря (стрелки). (C) УЗИ мочевого пузыря через 4 недели показывает исчезновение очагового утолщения стенки мочевого пузыря.
Помимо определения функциональных нарушений мочевого пузыря, УЗИ мочевого пузыря требуется для выявления потенциальных сопутствующих аномалий мочевыводящего тракта, таких как: эктопия мочеточника, уретероцеле или мегауретер. При этом оцениваются диаметр и место впадения дистального отдела мочеточников. Низкоуровневый эхосигнал или внутренний клеточный дебрис в пределах расширенного просвета могут указывать на суперинфекцию или пиоуретеронефроз (рис. 5).
Рис. 5. Пиоуретеронефроз (верхний полюс) в удвоенной почке с уретероцеле. УЗИ левой почки (сагиттальная проекция) (А) и мочевого пузыря (поперечная проекция) (В) показывают расширенный эхогенный верхний полюс (стрелки), расширенный мочеточник (и) и уретероцеле (uc), которое генерирует внутренние эхо-сигналы.
Обычное УЗИ в серой шкале дистальных отделов мочеточников и чашечно-лоханочной системы обычно считается слабым методом скрининга для выявления ПМР. Hoberman и его коллеги изучили 309 детей в возрасте от 1 до 24 месяцев с помощью УЗИ, DMSA и МЦУГ. При этом они обнаружили, что чувствительность ультразвука для обнаружения ПМР при проведении МЦУГ составляла 10%, а положительное прогностическое значение составляло 40%. Диагностика ПМР может быть улучшена с помощью точных и усовершенствованных ультразвуковых методов. МУС с контрастным усилением, которая использует внутрипузырное ультразвуковое контрастное вещество, набирает широкое применение, особенно в Европе, в качестве безопасной альтернативы традиционным рентгенологическим методам диагностики ПМР – МЦУГ и радионуклидной цистографии. Если рассматривать методику МЦУГ в качестве эталонного стандарта, техника МУС для диагностики ПМР имеет следующее показатели: чувствительность от 57% до 100%, специфичность от 85% до 100%, положительное и отрицательное прогностическое значение от 58% до 100% и 87% до 100%, а также диагностическую точность от 78% до 96%. В настоящее время предпринимаются попытки ввести МУС в Канаде, где уже доступны соответствующие контрастные вещества. Однако в Соединенных Штатах отсутствие подходящих контрастных веществ для детей, которые одобрены Управлением по контролю за продуктами и лекарствами, задерживает внедрение этого метода. МУС включает в себя следующие четыре основных этапа: (1) предварительное исследование, стандартное УЗИ мочевыводящего тракта в положении лежа на спине, (2) катетеризация или надлобковая пункция мочевого пузыря в стерильных условиях с введением физиологического раствора и контрастного ультразвукового вещества, (3) постконтрастное исследование, повторение стандартного сонография мочевыводящих путей, (4) постконтрастное исследование после мочеиспускания, сонография почек и терминальных отделов мочеточников (уретры) во время и после мочеиспускания. Рефлюкс диагностируется при обнаружении эхогенных микропузырьков в мочеточниках или в чашечно-лоханочной системе. Во время постконтрастного обследований поочередно сканируются правая и левая почечные лоханки. Исследование во время мочеиспускания может выполняться, когда пациент лежит или сидит на подкладном судне, или встает и мочится в бутылку. Тяжесть рефлюкса оценивается аналогично международной системе оценки рефлюкса для МЦУГ (степень 1-5).
В зависимости от доступного оборудования, при проведении МУС используются различные методы ультразвуковой визуализации для отображения микропузырьков при рефлюксе. Варианты визуализации не только влияют на видимость микропузырьков, но и на общую диагностическую точность исследования. Стандартное (фундаментальное) УЗИ широко используется для проведения МУС. Его можно комбинировать с цветной доплерографией, чтобы улучшить качество обнаружения рефлюкса. При использовании гармонических изображений микропузырьки становятся значительно более заметными по сравнению со стандартным режимом, что повышает чувствительность определения рефлюкса. Самые современные методы МУС, которые значительно усовершенствуют методику обнаружения микропузырьков при рефлюксе, используют контраст-специфическую модальность визуализации, которая настроена на конкретное контрастное вещество с использованием низкого или высокого механического индекса.
Данные контрастные вещества не только усиливают изображение и окрашиваются в определенный цвет на сонограмме, они также позволяют визуализировать только микропузырьки при рефлюксе, при этом блокируя фоновое изображение в оттенках серого (рис. 6).
Рис. 6. Везикоуретеральный рефлюкс (микционная уросонография). Микционная уросонография (МУС) до (А) и после (В, С) внутрипузырного введения контрастного вещества на основе галактозы. Для исследования используется контраст-специфическая модальность визуализации с высоким механическим индексом. (A) В почке определяется выраженная чашечно-лоханочная дилатация и истончение коркового вещества. Микропузырьки при рефлюксе изображаются в виде наложения цвета, без (B) и частично с устранением фона на сонограмме в серой шкале (C).
Потенциальными недостатками МУС в сравнении с МЦУГ являются: (1) уретральная сонография выполняется только в нескольких центрах и до сих пор не получила широкого распространения, (2) более длительная продолжительность исследования и (3) ограничение оценки функции мочевого пузыря.
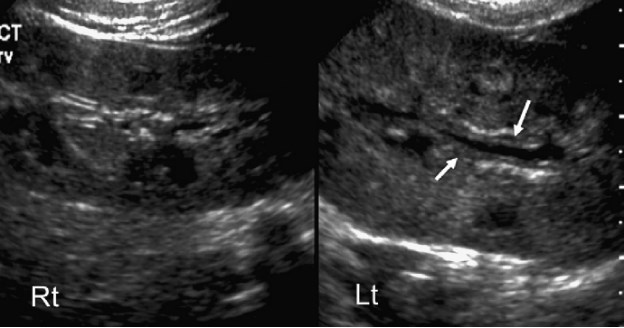
Сонография почек преследует несколько целей при проведении первичной оценки ребенка с ИМВП. Основная её задача – это выявления структурных нарушений (врожденных или приобретенных). При остром процессе, когда у младенца или ребенка младшего возраста диагностируется ИМВП, целью ультразвукового исследования почек является определение признаков инфицирования и выявление врожденных аномалий почек, которые могут способствовать развитию инфекции. Среди них выделяют обструктивные уропатии, уролиты, аномалии размера почек, аномалии положения или формы, удвоение чашечно-лоханочной системы с эктопией мочеточника с или без уретероцеле. Длину почки (и объем) следует измерять рутинно и сравнивать с нормальными значениями в соответствии с возрастом, весом и, возможно, площадью поверхности тела. Сагиттальная плоскость почек является наиболее легко воспроизводимой проекцией для измерения их длины, поскольку длина почек может варьировать в зависимости от положения пациента. Увеличение почек при остром пиелонефрите может быть очень вариабельным. Первоначально объем почек может быть нормальным, но со временем он может увеличиваться по мере прогрессирования воспалительного процесса. Увеличение почек может быть локальным или глобальным (весь орган), в последнем случае оно варьирует от 120 до 175% от нормального размера (рис. 7).
Рис. 7. Острый пиелонефрит, диффузный процесс. Сонограмма почек с обеих сторон демонстрирует нормальную правую почку. Левая почка равномерно увеличена, при этом также увеличена и её общая эхогенность. Определяется утрата нормальной кортико-медуллярной дифференциации. Обратите внимание на утолщение эпителия почечной лоханки (стрелки).
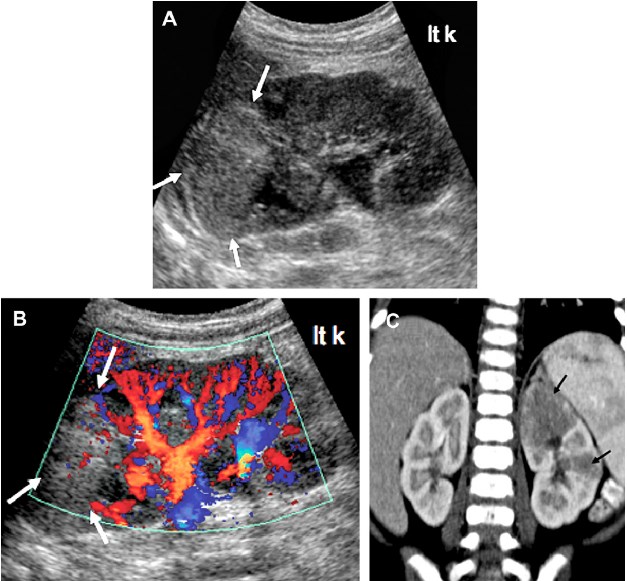
Увеличение почек может уже не определяться на сонограмме через 1 – 2 недели от начала лечения, после устранения очага инфекции. Помимо одностороннего или двустороннего увеличения почек, также определяются и другие патологические признаки, которые особенно выражены при тяжелых инфекциях: утрата кортико-медуллярной дифференциации, локальные гипоэхогенные или гиперогенные очаги в почечной паренхиме (рис. 8).
Рис. 8. Острый пиелонефрит, локальный процесс. (A) Сонограмма в серой шкале левой почки демонстрирует большую локальную область (стрелки) гиперэхогенности и утрату кортико-медуллярной дифференцировки в зоне верхнего полюса левой почки. (B) Цветная доплерография демонстрирует значительное уменьшение поток в пределах пораженного эхогенного верхнего полюса (стрелки). (C) Контрастная КТ (коронарная реконструкция) подтверждает локальный острый пиелонефрит в левом верхнем полюсе и меньшую область в средней части (стрелки) левой почки.
Утолщение эпителия чашечно-лоханочной системы почек или мочеточников может наблюдаться при инфекции (пиелите), а также при ПМР (см. рис. 7). На гармоническом изображении значительно лучше выделяется заднее затенение, акустическое усиление или артефакт «хвост кометы», что способствует улучшению качества и разрешения изображения небольших очаговых поражений почек (рис. 9).
Рис. 9. Острый пиелонефрит, ультрасонография высокого разрешения. (A) Ультрасонограмма (сагиттальная проекция) левой почки с использованием конвексного матричного датчика показывает нормальную эхогенность кортикального слоя, кортико-медуллярную дифференциацию и отсутствие локальных аномалий. (B) Линейное изображение высокого разрешения показывает мультифокальные области (стрелки) коркового слоя в виде гипоэхогенных полос, которые характеризуют острый пиелонефрит.
С помощью гармонического изображения также может быть улучшено контрастное и боковое разрешение, при этом в педиатрической урологической практике гармоническая визуализация значительно превосходит обычную сонографию при исследовании почек со стороны спины. В некоторых случаях, когда пациент может находиться в покое и практически не двигаться, цветная и энергетическая доплерография могут дополнять данные исследования для диагностики острого пиелонефрита, путем отображения областей плохой или отсутствующей перфузии. Эти области гипоперфузии отражают васкулит или вазоконстрикцию периферических артериол в ответ на бактериальную инфекцию (рис. 10).
Рис. 10. Острый пиелонефрит, энергетическая допплерография. (A) Сонография в серой шкале демонстрирует незначительное увеличение эхогенности верхнего полюса левой почки (стрелки). (B) Энергетическая допплерография демонстрирует снижение перфузии в верхнем и нижнем полюсах (стрелках) левой почки, что характеризует мультифокальный острый пиелонефрит.
Эта методика особенно важна для младенцев в возрасте до 3 месяцев, у которых использование Tc-99m DMSA сцинтиграфии, эталонного стандарта для оценки острого пиелонефрита, обычно не рекомендуется. Однако в целом, при диагностике острого пиелонефрита без осложнений, УЗИ имеет худшие показатели по сравнению со стандартным методом визуализации, таким как Tc-99m DMSA сцинтиграфия (рис. 11).
Рис. 11. Острый пиелонефрит, ультрасонография/DMSA. (A) Сонография правой почки демонстрирует нормальную эхогенность кортикального слоя, кортико-медуллярную дифференциацию и отсутствие очаговых аномалий. (B). Одновременно проведенная DMSA (задняя проекция) показывает область слабого накопления в середине нижнего полюса левой почки (стрелки), которая характеризует острый пиелонефрит.
В одном из исследований было показано, что патологические изменения, которые были диагностированы при DMSA у 63% из 91 ребенка с острой ИМВП, идентифицированы только у 24% этой же группы по данным сонографии. Однако хорошо известно и подтверждено исследованиями, что ИМВП у детей с повышением температуры может указывать либо на наличие врожденной анатомической аномалии, либо на ПМР, поэтому многие клиницисты считают, что УЗИ почек остается необходимым исследованием в алгоритме диагностики первого эпизода ИМВП с фебрилитетом. УЗИ мочевого пузыря и почек чаще всего является первоначальным исследованием для выявления основных патологических состояний, которые являются предрасполагающими факторами развития инфекции у младенца или ребенка младшего возраста. Следует, однако, отметить, что некоторые авторы ставят под сомнение эту тактику для тех младенцев, которым проводилась пренатальная сонография в специализированном центре после 30-32 недели беременности. В большинстве случаев предрасполагающим фактором является одна из форм врожденной обструктивной уропатии или выраженного ПМР. Интересен тот факт, что хотя обструкция лоханочно-мочеточникового сегмента является наиболее распространенной врожденной формой обструкции мочевыводящего тракта, в нашей практике мы редко отмечали обструкцию лоханочно-мочеточникового сегмента в качестве основной причины развития ИМВП у детей. Пиоуретеронефроз, при котором инфекция или гнойный дебрис проявляется в виде низкоуровневого эхосигнала в расширенных зонах собирательной системы, предпочтительно развивается на фоне таких аномалий, как мегауретер и удвоение почки с эктопией уретры или уретероцеле, которые, в свою очередь, связаны с расширением мочеточника (см. рис. 5). При определенных условиях, таких как преждевременные роды или длительное использование антибиотиков, может возникать грибковая инфекция почек, которая проявляется в виде слепков или комков эхогенного материала (грибковых шариков) в расширенных зонах верхнего отдела мочевыводящего тракта (рис. 12).
Рис. 12. Кандидоз почек (у новорожденного). Сонограмма (коронарная проекция) правой почки у недоношенного младенца демонстрирует слепки эхогенного дебриса в умеренно расширенной чашечно-лоханочной системе внутри почки.
В редких случаях токсин E. coli может вызывать мочеточниковую атонию, что приводит к изолированной дилатации мочеточника.
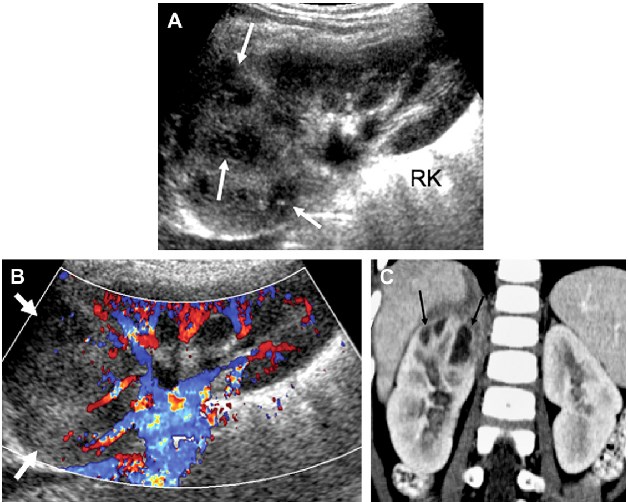
При сонографии можно выявлять осложнения, связанные с острым пиелонефритом. Среди них: абсцесс почек, перинефральный абсцесс, ксантогранулематозный пиелонефрит и почечные конкременты (рис. 13). Абсцессы могут быть одиночными или множественными, при этом они являются результатом острого пиелонефрита или гематогенной инфекции. Небольшие паренхиматозные или перинефральные абсцессы могут плохо визуализироваться на сонограмме в оттенках серого. Большие абсцессы определяются как четко отграниченные гипоэхогенные жидкостные скопления с внутренним эхосигналом. В большинстве случаев ультразвуковое исследование может быть дополнено дополнительной визуализацией почечных срезов в поперечных проекциях, которые могут быть полезны для проведения вмешательства под ультразвуковым наведением (рис. 14).
Рис. 13. Ксантогранулематозный пиелонефрит. (A) Сонограмма левой почки (сагиттальная, поперечная проекция) демонстрирует увеличение левой почки с большими гипоэхогенными регионами, вторичными по отношению к умеренной пиелокаликоэктазии. Небольшой конкремент (стрелка) определяется в левой лоханке. (B) Отсроченная контрастная КТ показывает нормальную правую почку, увеличение левой почки с воспалительными изменениями фасции Герота, минимальное кортикальное усиление без экскреции, значительную пиелокаликоэктазию и небольшие почечные конкременты. (C) Tc-99m Mag-3 сцинтиграфия почек (задняя проекция) демонстрирует нефункционирующую левую почку и нормальную функцию правой почки
Рис. 14. Острый пиелонефрит с абсцессами почки. (A) На сонограмме (сагиттальная проекция) правой почки наблюдается увеличение почки, с утратой нормальной архитектоники в зоне верхнего полюса с несколькими очаговыми гипоэхогенными областями (стрелки). (B) Цветная доплерография показывает выраженную перфузию верхнего полюса (стрелки). (C) Контрастная КТ (коронарная проекция) показывает признаки острого пиелонефрита с мультифокальными абсцессами (стрелки) в верхнем полюсе правой почки.
Перинефральные абсцессы обычно возникают в результате прорыва кортикальных абсцессов в смежные перинефральные мягкие ткани.
Другая задача первичного ультразвукового исследования почек, не обязательно в период острого процесса, заключается в выявлении приобретённых изменений, например, паренхиматозный фиброз, вызванный ранее неизвестным или недиагностированным инфекционным процессом в почках. Существенное очаговое истончение коры может быть заподозрено, если эхосигнал почечного синуса (жировая ткань) достигает края коркового слоя пораженной почки. Эти изменения чаще всего проявляют себя в области почечных полюсов (рис. 15).
Рис. 15. Хронический пиелонефрит. На сонограмме обеих почек показана очаговая зона истончения коркового слоя (стрелка) в верхнем полюсе правой почки (левая почка без патологии).
Фиброзный процесс небольшого и среднего размера не легко обнаруживается при сонографии. Степень кортикального истончения может быть достаточно серьезной, чтобы привести к значительному замещению здоровой почечной ткани. Как и в случае с острым пиелонефритом, DMSA является стандартным методом выявления почечного фиброза. Только около 4% детей имеют визуальные признаки поражения паренхимы в результате ИМВП, которые видны при DMSA сканировании. В исследовании Luk и коллег из 55 детей с фиброзным процессом в почках по данным DMSA, только у 29 % были патологические изменения при сонографии (чувствительность – 29%, положительная прогностическая ценность – 41%, точность – 89%). В своем исследовании они обнаружили, что отрицательная прогностическая ценность сонографии в сочетании с МЦУГ была высокой в прогнозировании отсутствия фиброза, что предполагает, что DMSA не обязательно выполнять детям в возрасте менее 2 лет, если данные УЗИ и МЦУГ являются нормальными. Аналогичным образом, Christian и коллеги изучили риск ложно-отрицательной диагностики кортикального фиброза почки (который обнаруживается при DMSA сцинтиграфии) если использовать только ультразвуковое исследование, факторинг для клинических признаков (верхних или нижних отделов мочевыводящего тракта), рецидивы ИМВП и возрастную группу. Они выяснили, что риск отсутствия ультразвуковых признаков кортикального фиброза почки, который обнаруживается при DMSA, варьирует от 0,4% (у детей школьного возраста с изолированной ИМВП нижних отделов), до 11% (у младенцев с рецидивирующей ИМВП верхних отделов). Однако, как и в случае с ультразвуковыми методами, DMSA сцинтиграфия также развивается. Акцентируя особое внимание на почечном фиброзе, некоторые авторы полагают, что детям в возрасте до 2 лет, с документально подтвержденной ИМВП, должно выполняться и ультразвуковое исследование, для исключения основных анатомических аномалий, и DMSA сцинтиграфия, для исключения фиброзного процесса в почках, а также, возможно, необходимо проведение МЦУГ.
РЕЗЮМЕ
За прошедшее десятилетие алгоритм визуальной диагностики детей с ИМВП был поставлен под сомнение на основе данных доказательной медицины и опыта врачей. Среди рассматриваемых практических рекомендаций, которые включают в себя каждый из методов визуализации, рутинное использование УЗИ для первоначальной оценки неосложненной ИМВП у детей стало спорным вопросом. Это мнение является результатом нескольких исследований, которые показали, что ультразвук имеет низкую эффективность для получения дополнительной, клинически полезной информации. Тем не менее, учитывая все преимущества ультразвуковой методики, в том числе её эффективность для выявления структурных нарушений мочеиспускательного тракта, многие практикующие специалисты продолжают включать УЗИ в качестве стандартного исследования в алгоритм диагностики ИМВП в педиатрической практике. А для этих исследований прекрасно подойдет УЗИ аппарат от компании Toshiba </ strong> – Aplio 300 .
Рекомендуем ознакомиться с нашим обновленным каталогом УЗ аппаратов.