Резюме
Предусловия
Трансректальная (ТР) биопсия простаты под контролем УЗИ и трансперинеальная (ТП) биопсия простаты под контролем УЗИ – два самых распространенных метода выявления рака предстательной железы, причем частота обнаружения при этих двух методах биопсии может отличаться у пациентов с различными клиническими характеристиками. В этом исследовании мы имели целью сравнить частоту выявления рака предстательной железы и частоту положительных биопсийных ядер при ТР и ТП биопсии предстательной железы у пациентов с различными клиническими характеристиками.
Методы
Мы ретроспективно проанализировали и сравнили клинические данные 452 пациентов, которым была выполнена ТР или ТП биопсия простаты в нашей больнице с июня 2017 года по сентябрь 2021 года. Пациенты были стратифицированы по нескольким клиническим характеристикам (уровень ПСА в сыворотке крови, объем простаты, плотность ПСА, стадия Т и степень МОУП), частота выявления рака и частота выявления положительных пунктатов сравнивались в различных стратифицированных группах.
Результаты
Не было достоверной разницы в возрасте, уровне ПСА, объеме простаты и плотности ПСА между группами ТР и ТП. В группе ТР был выше общий уровень выявления рака и положительный уровень биопсийных ядер, чем в группе ТП. Дальнейший анализ подгрупп показал, что группа ТР имела более высокий уровень выявления рака у пациентов с объемом простаты 30-80 мл и что группа ТР имела более высокий уровень положительных результатов биопсии среди пациентов со стадиями Т3-Т4, тогда как группа ТП имела более высокий уровень положительных результатов биопсии среди пациентов со стадиями Т1-Т2. Не было достоверных различий между группами ТР и ТП для каждой подгруппы при стратификации по уровню ПСА, плотности ПСА и степени МОУП.
Выводы
ТР подход может иметь преимущество у пациентов с объемом простаты 30-80 мл и стадиями T3-T4, тогда как ТП подход может иметь преимущество у пациентов со стадиями T1-T2.
Предусловия
Уровень диагностики рака предстательной железы растет с каждым годом [1]. В 2021 году рак предстательной железы является первой самой распространенной злокачественной опухолью, диагностируемой у мужчин во всем мире [2]. При подозрении на рак простаты стандартным методом диагностики остается биопсия простаты [3]. Впервые о трансректальной (ТР) биопсии под контролем УЗИ сообщили Cooner с соавт. и в дальнейшем усовершенствовали Hodge с соавт. [4, 5]. Трансперинеальная (ТП) биопсия простаты предложила альтернативный подход, и спустя десятилетия после описания, ТП биопсия простаты получает все большее распространение благодаря более низкому риску инфекционных осложнений и более высокой частоте диагностики рака предстательной железы [6, 7].
Было проведено несколько исследований для сравнения частоты выявления и осложнений ТР и ТП подходов. Во-первых, ТП биопсия значительно уменьшает количество инфекционных осложнений по сравнению с ТР биопсией [8,9,10], а также улучшает частоту выявления рака предстательной железы [11, 12]. Более того, в большинстве исследований не было выявлено существенных различий как в частоте обнаружения рака, так и в частоте обнаружения ядра рака между ТР и ТП подходами к биопсии предстательной железы [13,14,15,16]. Однако частота выявления рака при этих двух методах биопсии может отличаться у пациентов разного возраста, с разным уровнем ПСА и объемом простаты [17, 18].
Для достижения баланса между частотой выявления рака и неблагоприятными побочными эффектами рекомендуется проводить 12-контактную мультифокальную биопсию [19]. В нашем центре почти все биопсии предстательной железы выполняются с помощью 12-контактной мультифокальной биопсии плюс 1 пунктирование в подозрительном участке. Трансректальная биопсия простаты была единственным выбором до мая 2020 года в нашей больнице, а в мае 2020 года наш центр начал выполнять ТП фри хенд биопсию простаты под ультразвуковым контролем. В этом исследовании были ретроспективно проанализированы клинические данные 452 пациентов нашей больницы, которым была проведена биопсия простаты, чтобы сравнить показатели обнаружения между ТП и ТР подходами. Кроме того, сравнивая показатели обнаружения пациентов с различными клиническими характеристиками, мы имели целью выяснить оптимальный подход к биопсии у пациентов с различными клиническими характеристиками.
Материалы и методы
Выборка пациентов
В этом исследовании приняли участие 452 пациента, которым была проведена биопсия простаты ТР или ТП в отделении урологии больницы Чжуннань Университета Уханя с июня 2017 г. по сентябрь 2021 г. Пациенты с ПСА ≥ 100 нг/мл были исключены, поскольку частота выявления рака предстательной железы у них была близкой к 100%. Все методы, использованные для анализа в этом исследовании, были проведены в соответствии с утвержденными положениями Комитета по медицинской этике больницы Чжуннань Университета Уханя. Показания к биопсии предстательной железы базируются на “Китайском руководстве по диагностике и лечению урологических заболеваний”, включая пациентов с: (1) подозрительные поражения, обнаруженные при цифровом ректальном исследовании (ЦРИ); (2) подозрительные поражения при визуализации; (3) ПСА > 10 нг/мл; (4) 10 нг/мл ≥ ПСА > 4 нг/мл и аномальное соотношение свободного/общего ПСА или плотность ПСА.
Биопсия
Почти все биопсии предстательной железы (как ТР, так и ТП подходы) в нашей больнице выполняются с использованием 12-ти контактной мультифокальной биопсии плюс 1 пунктирование в подозрительном участке. Биопсии выполняли “веерообразно” [20], для получения образцов использовали одноразовый инструмент для биопсии 18 калибра (Bard Healthcare Science, Shanghai, CO, LTD.). Каждый биопсийный материал маркировали и упаковывали с учетом особенностей участка и присваивали отдельный балл по шкале Глисона. Биопсию предстательной железы в основном выполняют д-р И Ло и д-р Чжунхуа Ян, которые хорошо владеют обоими методами биопсии. Трансректальная биопсия простаты была единственным выбором до мая 2020 года. С тех пор, как в мае 2020 года в нашей больнице начали проводить фри хенд ТП биопсию простаты под контролем УЗИ. ТП биопсия простаты преимущественно рекомендуется пациентам из-за более низкого уровня инфицирования согласно действующим рекомендациям Европейской ассоциации урологов (ЕАУ). А трансректальная биопсия простаты, с более низкой стоимостью из-за отсутствия потребности в анестезии, была альтернативным подходом, когда пациент выбирал ее.
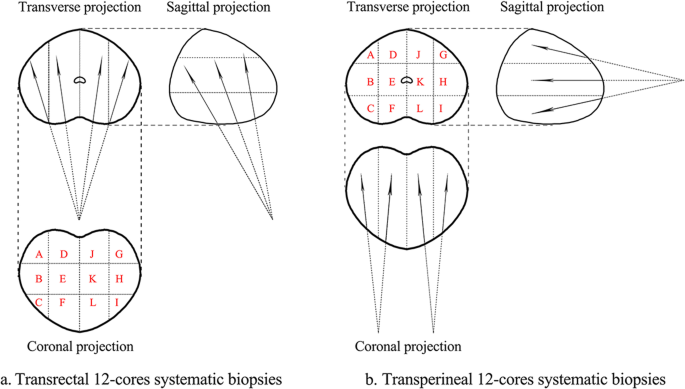
В соответствии с теми же этапами, что описаны в литературе [21], пациентов, которым выполняли трансректальную процедуру, укладывали в левое боковое положение декубитуса. Анестезию не применяли. Для размещения иглы и наведения использовали трансректальный ультразвуковой датчик (ТУЗИ). Стандартная процедура биопсии включала забор образцов парасагиттальной средней линии и латеральной апикальной, медиальной и базальной областей с обеих сторон, всего 12 пунктатов, а также дополнительные пунктаты из подозрительных участков (Рис. 1а). Пациента, которому выполняли трансперинеальную процедуру, располагали в литотомическом положении и вводили общую анестезию. Лишние волосы были выбриты, а промежность подготовлена с помощью 1% повидон-йода. Для визуализации уретры на ультразвуковых изображениях использовали постоянный катетер Фолея. Мошонку поднимали спереди с помощью хирургической драпировки, чтобы обеспечить доступ к промежности. Криволинейный ультразвуковой датчик (трансперинеальный ультразвук, ТПУЗИ) прижимали вертикально к нижней части промежности и визуализировали железу. Иглу вводили с верхнего края датчика в плоскости с ультразвуковым лучом. Простату разделяли на левую и правую доли. Для каждой доли брали по шесть пунктатов из передней, средней и задней зон латеральной и медиальной области, дополнительные пунктаты брали из подозрительных участков (Рис. 1б).
Рис. 1
Модельная схема трансректальной и трансперинеальной биопсии предстательной железы: поперечная, сагиттальная и коронарная проекции мультифокальных биопсий ТР (а) и ТП (б) 12-контактными мультифокальными биопсиями.
Сбор данных
Путем ретроспективного анализа медицинской документации были получены следующие клинические данные, которые сравнивали между двумя группами: возраст, уровень ПСА в сыворотке крови (нг/мл), объем простаты (мл), частота диагностики рака простаты и частота положительных результатов биопсии, объем простаты рассчитывали по формуле: высота × ширина × длина × 0,52 (в см). Далее пациенты были стратифицированы по нескольким клиническим характеристикам, включая: уровень ПСА в сыворотке крови, объем простаты, плотность ПСА, стадию Т и класс МОУП (Международное общество урологической патологии), частоту выявления рака и частоту положительных пунктатов сравнивали в различных стратифицированных группах.
Статистический анализ
Постоянные переменные были описаны как средние значения, диапазоны и медианы. Возраст сравнивали с помощью независимого t-критерия, тогда как уровень ПСА, объем простаты и плотность ПСА сравнивали с помощью U-критерия Манна-Уитни, поскольку они не соответствовали нормальному распределению. Нормальность распределения каждого набора данных проверяли с помощью критерия Колмогорова-Смирнова. Для сравнения частоты диагностики рака предстательной железы и частоты положительных результатов биопсийных ядер в разных группах использовали критерий хи-квадрат. Тест Кокрана-Мантеля-Хензеля (КМГ) был проведен для сравнения частоты выявления рака после контроля искажающих переменных, таких как уровень ПСА и плотность ПСА. Результаты были выражены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ). Для проведения всех статистических анализов использовали SPSS 22.0, а значение p < 0,05 считалось значимым.
Результаты
Из 452 пациентов, которым была проведена биопсия простаты (табл. 1), в 230 (50,9%) случаях был диагностирован рак простаты, общий положительный показатель биоптатов составил 24,6% (1416 из 5759 биоптатов). Средний возраст составил 70,1 года, средний уровень ПСА – 22,0 нг/мл, средний объем простаты – 57,0 мл, средняя плотность ПСА – 0,51 нг/мл2. Не было достоверной разницы в возрасте, уровне ПСА, объеме простаты и плотности ПСА между двумя группами. Общая частота выявления в группе ТР оказалась выше, чем в группе ТП в нашем исследовании (56,3% против 44,4%, ОШ: 1,612, 95% ДИ: 1,111-2,340, р = 0,012). Чтобы минимизировать влияние уровня ПСА и плотности ПСА в двух группах, был проведен КМГ-тест, который показал, что частота обнаружения рака в группе ТР все еще была выше, чем в группе ТП, как при поправке на уровень ПСА, так и при поправке на плотность ПСА (ОШ: 1. 529, 95% ДИ: 1,036-2,255, р = 0,032), или при поправке на плотность ПСА (ОШ: 1,514, 95% ДИ: 1,030-2,226, р = 0,035). Аналогично, частота положительных результатов биопсии была выше в группе ТР, чем в группе ТП (27,5% против 21,0%, ОШ: 1,429, 95% ДИ: 1,264-1,616, р < 0,001).
Таблица 1 Клинические характеристики пациентов, которым выполнили трансректальную или трансперинеальную биопсию простаты
| Переменные | Все пациенты (n = 452) | Трансректальная биопсия (n = 245) | Трансперинеальная биопсия (n = 207) | p value |
|---|---|---|---|---|
| Возраст при биопсии (лет) | ||||
| Среднее/медианное значение | 70.1 ± 8.4/70 | 70.0 ± 8.7/70 | 70.3 ± 8.1/70 | 0.769 |
| Диапазон | 45–88 | 45–88 | 51–88 | |
| ПСА (нг/мл) | ||||
| Среднее/медианное значение | 22.0 ± 20.6/13.8 | 23.2 ± 21.8/14.1 | 20.6 ± 19.0/13.7 | 0.634 |
| Диапазон | 0.3–99.2 | 0.3–99.2 | 0.8–97.6 | |
| Объем простаты (мл) | ||||
| Среднее/медианное значение | 57.0 ± 36.0/49 | 54.4 ± 31.6/46 | 60.0 ± 40.3/52 | 0.151 |
| Диапазон | 10–334 | 11–204 | 10–334 | |
| Плотность ПСА (нг/мл2) | ||||
| Среднее/медианное значение | 0.51 ± 0.59/0.27 | 0.55 ± 0.64/0.29 | 0.47 ± 0.51/0.26 | 0.181 |
| Диапазон | 0.01–3.63 | 0.01–3.63 | 0.02–2.40 | |
| Уровень диагностики рака предстательной железы (n, %) | 230/452 (50.9%) | 138/245 (56.3%) | 92/207 (44.4%) | 0.012 |
| Положительная частота обнаружения в биопсийном материале (n, %) | 1416/5759 (24.6%) | 876/3185 (27.5%) | 540/2574 (21.0%) | < 0.001 |
Кроме того, для сравнения частоты выявления рака предстательной железы при двух методах биопсии у пациентов с различными клиническими характеристиками был проведен подгрупповой анализ по уровню ПСА в сыворотке крови, объему простаты и плотности ПСА. Как показано в Таблице 2, при анализе подгрупп, стратифицированных по уровню ПСА, не было выявлено достоверных различий в частоте выявления рака между группами ТР и ТП для каждой подгруппы. При стратификации по объему простаты, группа ТР имеет более высокий уровень выявления рака, чем группа ТП, среди пациентов с объемом простаты 30-80 мл (56,3% против 40. 5%, ОШ: 1,892, 95% ДИ: 1,165-3,073, р = 0,010), а также в подгруппе с объемом простаты > 80 мл (36,6% против 16,3%, ОШ: 2,967, 95% ДИ: 1,060-8,305, р = 0,034). Однако не было выявлено существенной разницы между двумя подходами к биопсии в частоте выявления рака среди пациентов с объемом простаты ≤ 30 мл. Аналогично, показатели выявления рака достоверно не отличались между группами ТР и ТП в соответствии с различной плотностью ПСА. Для минимизации влияния уровня ПСА в анализе подгрупп с разным объемом простаты был проведен КМГ-тест, который показал, что группа ТР все еще имеет более высокий уровень выявления рака, чем группа ТП с объемом простаты 30-80 мл (ОШ: 1,838, 95% ДИ: 1,086-3,112, р = 0,023), тогда как в подгруппе с объемом > 80 мл достоверной разницы в уровне выявления рака не было (р = 0,087).
Таблица 2 Сравнение частоты выявления рака простаты по уровню ПСА, объему простаты и плотности ПСА между трансректальной и трансперинеальной биопсией простаты
| Переменные | Все пациенты (n, %) | Трансректальная биопсия (n, %) | Трансперинеальная биопсия (n, %) | p value |
|---|---|---|---|---|
| ПСА (нг/мл) | ||||
| ≤ 10 | 63/152 (41.4) | 40/87 (46.0) | 23/65 (35.4) | 0.190 |
| 10–20 | 56/140 (40.0) | 29/63 (46.0) | 27/77 (35.1) | 0.188 |
| 20–100 | 111/160 (69.4) | 69/95 (72.6) | 42/65 (64.6) | 0.280 |
| Объем простаты (мл) | ||||
| ≤ 30 | 74/96 (77.1) | 38/53 (71.7) | 36/43 (83.7) | 0.163 |
| 30–80 | 134/272 (49.3) | 85/151 (56.3) | 49/121 (40.5) | 0.010 |
| > 80 | 22/84 (26.2) | 15/41 (36.6) | 7/43 (16.3) | 0.034 |
| Плотность простаты (нг/мг2) | ||||
| ≤ 0.15 | 23/92 (25.0) | 14/42 (33.3) | 9/50 (18.0) | 0.091 |
| > 0.15 | 207/360 (57.5) | 124/203(61.1) | 83/157 (52.8) | 0.118 |
Среди 230 пациентов с диагнозом рака предстательной железы, установленным с помощью биопсии, стадии Т можно было оценить у 175 пациентов (104/138 в группе ТР, 71/92 в группе ТП). Далее мы проанализировали разницу в частоте положительных результатов в биопсийном материале между двумя методами биопсии у пациентов с различными Т стадиями. Как показано в таблице 3, группа ТР имеет более высокий показатель положительных результатов биопсии среди пациентов со стадиями Т3 и Т4 (72,4% против 62,5%, ОШ: 1,573, 95% ДИ: 1,213-2,038, р = 0,001), тогда как группа ТП имеет более высокий показатель среди пациентов со стадиями Т1 и Т2 (30,6% против 36,9%, ОШ: 0,754, 95% ДИ: 0,585-0,972, р = 0,029). Кроме того, за исключением 1 пациента в группе ТР с диагнозом нейроэндокринная карцинома, классы МТУП (Международное общество урологической патологии) были получены в соответствии с самой высокой степенью патологии в биоптате для каждого отдельного пациента. При стратификации по классу МОУП не было выявлено значимых различий в положительных результатах биопсии между группами ТР и ТП для каждой подгруппы.
Таблица 3 Сравнение частоты положительных результатов биопсии в соответствии со стадией Т и классом МОУП между трансректальной и трансперинеальной биопсией предстательной железы
| Переменные | Все пациенты (n, %) | Трансректальная биопсия (n, %) | Трансперинеальная биопсия (n, %) | p value |
|---|---|---|---|---|
| T стадия | ||||
| T1 + T2 | 381/1160 (32.8) | 231/754 (30.6) | 150/406 (36.9) | 0.029 |
| T3 + T4 | 725/1065 (68.1) | 433/598 (72.4) | 292/467 (62.5) | 0.001 |
| МОУП оценка | ||||
| 1 | 79/542 (14.6) | 49/351 (14.0) | 30/191 (15.7) | 0.582 |
| 2–3 | 369/853 (42.3) | 192/455 (42.2) | 177/398 (44.5) | 0.504 |
| 4–5 | 955/1520 (62.8) | 622/975 (63.8) | 333/545 (61.1) | 0.297 |
Обсуждение
С тех пор, как биопсия под контролем УЗИ была представлена Hodge и соавт. [5], она постепенно стала основным методом диагностики рака предстательной железы во всем мире. Несмотря на рутинное применение антимикробной профилактики, примерно 3-5% пациентов, которым выполняется биопсия с помощью ТУЗИ, повторно госпитализируются по поводу инфекции [22, 23]. Биопсия под контролем УЗИ была рекомендована как более безопасная альтернатива из-за более низкого уровня инфицирования [9, 10]. В нашем исследовании у 4,1% (10/245) пациентов в группе ТР после процедуры биопсии развилась лихорадка (> 38,0 °C), тогда как в группе ТП лихорадка развилась у 1,0% (2/207) пациентов. Статистически, в группе ТР пациенты имели более высокий уровень инфицирования, чем в группе ТП (ОШ: 4,362, 95% ДИ: 0,945-20,137, р = 0,040). Из-за более низкого уровня инфицирования при ТП биопсии согласно действующим рекомендациям ЕАУ, ТП биопсию преимущественно рекомендуют пациентам с тех пор, как ее начали выполнять в нашей больнице в мае 2020 года. И именно поэтому более 90% пациентов предпочли выбрать ТП биопсию, когда она была доступна, тогда как несколько пациентов выбрали ТР биопсию, которая дешевле и не требует анестезии. За последние десятилетия, с усовершенствованием мультипараметрической МРТ (магнитно-резонансной томографии) диагностики, МРТ становится все более чувствительной для выявления рака предстательной железы [24]. МР/УЗИ в сочетании с управляемой биопсией, (комбинированная прицельная биопсия и мультифокальная биопсия), выявила больше случаев рака простаты, чем биопсия, управляемая ультразвуком, особенно клинически значимого рака [25, 26]. Однако, из-за высокой стоимости МР/УЗИ биопсии, системная биопсия под контролем ТУЗИ все еще остается основным методом биопсии предстательной железы для ее легкой популяризации.
Было проведено несколько предварительных исследований для сравнения частоты выявления рака предстательной железы при ТР и ТП подходах, которые не выявили существенной разницы в общей частоте выявления рака между этими двумя подходами [13, 14, 27, 28, 29]. Jiang и соавт. [17] сообщили, что частота выявления при ТР подходе была выше, чем при ТП подходе у пациентов с уровнем ПСА 20,1-100,0 нг/мл (80,8% против 69,1%, р = 0,040). В нашем исследовании общая частота выявления в группе ТР оказалась выше, чем в группе ТП (56,3% против 44,4%, ОШ: 1,612, р = 0,012). Мы предполагаем, что эта разница может быть связана с тем, что средний уровень ПСА (22,0 ± 20,6 нг/мл) в нашем исследовании был значительно выше, чем в большинстве ранее опубликованных исследований [13, 14, 15, 16, 17, 27, 28, 29]. Кроме того, поскольку криволинейный ультразвуковой датчик легче получить, не нужно проводить подготовку кишечника, и его легче внедрить в больницах первичного уровня, биопсию простаты ТП в нашем исследовании проводили свободной рукой и под контролем трансперинеального ультразвукового датчика, что может быть еще одной причиной различной общей частоты обнаружения между группами ТР и ТП в нашем исследовании. Однако при стратификации по уровню ПСА не было выявлено достоверных различий в частоте выявления рака между группами ТР и ТП для пациентов с уровнем ПСА 20-100 нг/мл (72,6 против 64,6%, р=0,280), что может быть связано с небольшим размером выборки в этой подгруппе.
В Китае доля впервые диагностированных больных раком предстательной железы с высоким риском и распространенной стадией рака предстательной железы выше, чем в Европе и США, что более распространено в более бедных районах [30]. Среди 410 пациентов с диагнозом рака предстательной железы в нашей больнице (180 пациентов, у которых объем простаты был недоступен, или с ПСА ≥ 100 нг/мл были исключены из исследования), пациенты с уровнем ПСА > 20 нг/мл составляли 68,3% (280/410), пациенты с 4-5 классом по МОУП – 66,3% (272/410), а пациенты со стадиями Т3 и Т4 – 67,2% (197/293). В соответствии с более высокой диагностической частотой ТР подхода у пациентов с ПСА > 20 нг/мл, о которой сообщается в литературе [17], группа ТР имела более высокую частоту положительных результатов биопсии среди пациентов со стадиями Т3 и Т4 (72,4% против 62. 5%, ОШ: 1,573, р = 0,001) в нашем исследовании, что свидетельствует о том, что ТР подход может иметь преимущество у пациентов с вероятным диагнозом рака предстательной железы высокого риска (уровень ПСА > 20 нг/мл, стадия опухоли cT3-T4 по данным визуализации или цифрового ректального исследования). В противоположность этому, группа ТП имеет более высокий процент положительных результатов биопсии среди пациентов со стадиями Т1 и Т2 (30,6% против 36,9%, ОШ: 0,754, p = 0. 029), а в литературе также сообщается о преимуществе ТП подхода у пациентов с уровнем ПСА 4,01-10,00 нг/мл. [6, 27], что указывает на то, что ТП подход может иметь преимущество у пациентов с раком предстательной железы низкого и промежуточного риска. Более высокие показатели положительных результатов при исследовании биопсийного материала при ТП биопсии на стадиях Т1-Т2 могут быть результатом преимущества ТП биопсии для выявления рака передней зоны. В то время как при ТП биопсии большее количество биопсийного материала проникает через обширные участки раковых поражений предстательной железы в периферической зоне, что может быть причиной ее преимущества у пациентов с Т3 и Т4 стадиями.
По нашим результатам, группа ТР имела более высокий уровень выявления рака, чем группа ТП, у пациентов с объемом простаты 30-80 мл ( ОШ: 1,838, 95% ДИ: 1,086-3,112, р = 0,023). Как известно, увеличение объема простаты происходило преимущественно за счет гиперплазии переходной зоны, что приводило к сжатию периферической зоны (зоны с высокой частотой рака простаты) к задней части железы. При проведении ТУЗИ-биопсии в гиперплазированной простате большинство биопсийного материала пройдет через периферическую зону, поскольку ее иглы входят в простату с задней части железы. В то время как вентральные иглы (A, D, J, G на рис.. 1) при ТП биопсии пропустят периферическую зону в гиперплазированной простате, поскольку ее иглы входят в предстательную железу со стороны верхушки простаты. Это может быть причиной более высокого уровня выявления рака в группе ТР у пациентов с объемом простаты 30-80 мл. Koparal и соавт. сообщили, что при ТП биопсии частота выявления рака была выше, чем в группе ТР, у пациентов с объемом простаты > 100 мл (средний уровень ПСА 6,6 нг/мл) [18]. Более того, при увеличении объема простаты до более 80 мл в нашем исследовании не было существенной разницы в выявлении рака между двумя методами биопсии. Мы предполагаем, что причиной такого результата могут быть ограничения и интенсивная боль при трансректальной биопсии у пациентов с большим объемом простаты [31]. Наше исследование имело определенные ограничения. Во-первых, это одноцентровое ретроспективное исследование с низким уровнем доказательности. Кроме того, для некоторых пациентов в этом исследовании отсутствовала частичная информация, например, о Т-стадии. Для дальнейшей проверки этих выводов необходимы дополнительные исследования.
Выводы
На основе данных 452 пациентов, которым в нашей больнице была проведена биопсия простаты, группа ТР имела более высокий общий показатель выявления рака и положительный показатель при исследовании биопсийного материала, чем группа ТП. Дальнейший анализ подгрупп показал, что группа ТР имела более высокий уровень выявления рака у пациентов с объемом простаты 30-80 мл, и что группа ТР имела более высокий процент положительных результатов биопсии среди пациентов со стадиями Т3-Т4, тогда как группа ТП имела более высокий процент положительных результатов биопсии среди пациентов со стадиями Т1-Т2. Не было достоверных различий между группами ТР и ТП для каждой подгруппы при стратификации по уровню ПСА, плотности ПСА и степени МОУП.
Аббревиатуры
ТР: Трансректально
ТП: Трансперинеально
ПСА: Простатспецифический антиген
ЦРИ: Цифровое ректальное исследование
ТУЗИ: Трансректальное УЗИ
ТПУЗИ: Трансперинеальное УЗИ
МОУП: Международное общество урологической патологии
КМГ: Кокран-Мантел-Гензель
ОШ: Отношение шансов
ДИ: Доверительный интервал
МРТ: Магнитно-резонансная томография
Ссылки
- Ilic D, Neuberger MM, Djulbegovic M, Dahm P. Screening for prostate cancer. Cochrane Database Syst Rev. 2013;1:CD004720.
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021;71(1):7–33.
- Litwin MS, Tan HJ. The diagnosis and treatment of prostate cancer: a review. JAMA. 2017;317(24):2532–42.
- Cooner WH, Mosley BR, Rutherford CL Jr, Beard JH, Pond HS, Bass RB Jr, et al. Clinical application of transrectal ultrasonography and prostate specific antigen in the search for prostate cancer. J Urol. 1988;139(4):758–61.
- Hodge KK, McNeal JE, Terris MK, Stamey TA. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol. 1989;142(1):71–4.
- Chang DT, Challacombe B, Lawrentschuk N. Transperineal biopsy of the prostate—is this the future? Nat Rev Urol. 2013;10(12):690–702.
- Thomson A, Li M, Grummet J, Sengupta S. Transperineal prostate biopsy: a review of technique. Transl Androl Urol. 2020;9(6):3009–17.
- Pradere B, Veeratterapillay R, Dimitropoulos K, Yuan Y, Omar MI, MacLennan S, et al. Nonantibiotic strategies for the prevention of infectious complications following prostate biopsy: a systematic review and meta-analysis. J Urol. 2021;205(3):653–63.
- Grummet JP, Weerakoon M, Huang S, Lawrentschuk N, Frydenberg M, Moon DA, et al. Sepsis and “superbugs”: should we favour the transperineal over the transrectal approach for prostate biopsy? BJU Int. 2014;114(3):384–8.
- Berry B, Parry MG, Sujenthiran A, Nossiter J, Cowling TE, Aggarwal A, et al. Comparison of complications after transrectal and transperineal prostate biopsy: a national population-based study. BJU Int. 2020;126(1):97–103.
- Stefanova V, Buckley R, Flax S, Spevack L, Hajek D, Tunis A, et al. Transperineal prostate biopsies using local anesthesia: experience with 1,287 patients. prostate cancer detection rate complications and patient tolerability. J Urol. 2019;201(6):1121–6.
- Cowan T, Baker E, McCray G, Reeves F, Houlihan K, Johns-Putra L. Detection of clinically significant cancer in the anterior prostate by transperineal biopsy. BJU Int. 2020;126(Suppl 1):33–7.
- Cerruto MA, Vianello F, D’Elia C, Artibani W, Novella G. Transrectal versus transperineal 14-core prostate biopsy in detection of prostate cancer: a comparative evaluation at the same institution. Arch Ital Urol Androl. 2014;86(4):284–7.
- Shen PF, Zhu YC, Wei WR, Li YZ, Yang J, Li YT, et al. The results of transperineal versus transrectal prostate biopsy: a systematic review and meta-analysis. Asian J Androl. 2012;14(2):310–5.
- Xiang J, Yan H, Li J, Wang X, Chen H, Zheng X. Transperineal versus transrectal prostate biopsy in the diagnosis of prostate cancer: a systematic review and meta-analysis. World J Surg Oncol. 2019;17(1):31.
- Abdollah F, Novara G, Briganti A, Scattoni V, Raber M, Roscigno M, et al. Trans-rectal versus trans-perineal saturation rebiopsy of the prostate: is there a difference in cancer detection rate? Urology. 2011;77(4):921–5.
- Jiang CY, Shen PF, Wang C, Gui HJ, Ruan Y, Zeng H, et al. Comparison of diagnostic efficacy between transrectal and transperineal prostate biopsy: a propensity score-matched study. Asian J Androl. 2019;21(6):612–7.
- Koparal MY, Sözen TS, Karşıyakalı N, Aslan G, Akdoğan B, Şahin B, et al. Comparison of transperineal and transrectal targeted prostate biopsy using Mahalanobis distance matching within propensity score caliper method: a multicenter study of Turkish urooncology association. Prostate. 2022;82(4):425–32.
- Eichler K, Hempel S, Wilby J, Myers L, Bachmann LM, Kleijnen J. Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: a systematic review. J Urol. 2006;175(5):1605–12.
- Emiliozzi P, Longhi S, Scarpone P, Pansadoro A, DePaula F, Pansadoro V. The value of a single biopsy with 12 transperineal cores for detecting prostate cancer in patients with elevated prostate specific antigen. J Urol. 2001;166(3):845–50.
- Guo LH, Wu R, Xu HX, Xu JM, Wu J, Wang S, et al. Comparison between ultrasound guided transperineal and transrectal prostate biopsy: a prospective, randomized, and controlled trial. Sci Rep. 2015;5:16089.
- Wagenlehner FM, van Oostrum E, Tenke P, Tandogdu Z, Çek M, Grabe M, et al. Infective complications after prostate biopsy: outcome of the global prevalence study of infections in urology (GPIU) 2010 and 2011, a prospective multinational multicentre prostate biopsy study. Eur Urol. 2013;63(3):521–7.
- Loeb S. Infection after transrectal ultrasonography-guided prostate biopsy: increased relative risks after recent international travel or antibiotic use. BJU Int. 2012;109(12):1785–6.
- Borofsky S, George AK, Gaur S, Bernardo M, Greer MD, Mertan FV, et al. What are we missing? false-negative cancers at multiparametric MR imaging of the prostate. Radiology. 2018;286(1):186–95.
- Siddiqui MM, Rais-Bahrami S, Turkbey B, George AK, Rothwax J, Shakir N, et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer. JAMA. 2015;313(4):390–7.
- Cauni VM, Stanescu D, Tanase F, Mihai B, Persu C. Magnetic resonance/ultrasound fusion targeted biopsy of the prostate can be improved by adding systematic biopsy. Med Ultrason. 2021;23(3):277–82.
- Hara R, Jo Y, Fujii T, Kondo N, Yokoyoma T, Miyaji Y, et al. Optimal approach for prostate cancer detection as initial biopsy: prospective randomized study comparing transperineal versus transrectal systematic 12-core biopsy. Urology. 2008;71(2):191–5.
- Takenaka A, Hara R, Ishimura T, Fujii T, Jo Y, Nagai A, et al. A prospective randomized comparison of diagnostic efficacy between transperineal and transrectal 12-core prostate biopsy. Prostate Cancer Prostatic Dis. 2008;11(2):134–8.
- Lo KL, Chui KL, Leung CH, Ma SF, Lim K, Ng T, et al. Outcomes of transperineal and transrectal ultrasound-guided prostate biopsy. Hong Kong Med J. 2019;25(3):209–15.
- Zhu Y, Mo M, Wei Y, Wu J, Pan J, Freedland SJ, et al. Epidemiology and genomics of prostate cancer in Asian men. Nat Rev Urol. 2021;18(5):282–301.
- Yun TJ, Lee HJ, Kim SH, Lee SE, Byun SS, Hong SK, et al. Prospective analysis on the relation between pain and prostate volume during transrectal prostate biopsy. Korean J Radiol. 2007;8(3):231–5.