Резюме
Последние достижения в технологии ультразвукового исследования (УЗИ) создали такие методы, как допплеровское УЗИ, гистосканирование, усиленное контрастом УЗИ, эластография и микроультразвук. Первые результаты этих методов УЗИ были многообещающими, хотя существуют определенные ограничения, в частности потребность в специализированном оборудовании, непоследовательность результатов, отсутствие стандартизации и внешней валидации. В этом обзоре мы определили исследования, которые оценивают мультипараметрическую ультрасонографию (мпУЗИ), комбинацию нескольких методов УЗИ, для диагностики рака предстательной железы (РПЖ). За последние 5 лет растет количество исследований, которые показывают, что использование мпУЗИ приводит к высокой эффективности выявления РПЖ и клинически значимого рака предстательной железы (КЗРПЖ), используя гистологию радикальной простатэктомии в качестве эталонного стандарта.
Недавние исследования продемонстрировали роль мпУЗИ в улучшении выявления КЗРПЖ и рекомендаций по биопсии и лечению простаты. Кроме того, некоторые аспекты, такие как более низкая стоимость, визуализация в реальном времени, применение для некоторых пациентов, имеющих противопоказания к магнитно-резонансной томографии (МРТ), и доступность в офисных условиях, являются явными преимуществами мпУЗИ. огласованность между наблюдателями по мпУЗИ была в целом низкой; однако это ограничение можно улучшить, используя стандартизированные и объективные системы оценки, такие как модель машинного обучения. Превосходит ли мпУЗИ МРТ, пока неясно. Необходимо провести многоцентровые рандомизированные контролируемые исследования, которые бы непосредственно сравнивали мпУЗИ и мультипараметрическую МРТ.
Ключевые слова
мультипараметрическая ультразвуковая диагностика, биопсия простаты, рак простаты, рак простаты
Вступление
Рак предстательной железы (РПЖ) является вторым по распространенности онкологическим заболеванием и пятой по частоте причиной смерти от рака среди мужчин во всем мире в 2020 году. 1 Трансректальная ультразвуковая биопсия (ТУЗБ) предстательной железы (ПЖ) является золотым стандартом диагностики РПЖ. 2 Хотя ТУЗБ имеет ряд преимуществ, включая доступность, экономическую эффективность, удобство для урологов и возможность предоставления рекомендаций в режиме реального времени, сам по себе ТУЗБ не может надежно выявить РПЖ. 3 Таким образом, необходим более точный метод диагностики.
На сегодняшний день магнитно-резонансная томография (МРТ) позволяет получить анатомическую/функциональную визуализацию предстательной железы и визуализировать большинство клинически значимых форм рака предстательной железы (РПЖ).4–7 Интерпретация последовательностей мультипараметрической магнитно-резонансной томографии (мпМРТ) стандартизирована Системой отчетности и данных о визуализации предстательной железы (PIRADS). 8 Используя программное обеспечение для объединения ранее полученных изображений МРТ и ТУЗИ в реальном времени, БП совмещенная с МРТ/ТУЗИ интегрирует преимущества, как и МРТ с ее способностью выявлять поражения так и ТУЗИ с ее визуализацией в реальном времени. 6,9 Повреждение, видимое на МРТ, может быть точно отобрано с помощью прицельной БП совмещенной с МРТ/ТУЗИ, а каждая траектория биопсии с пространственными координатами в простате записывается в программное обеспечение объединения МРТ/ТУЗИ для просмотра. На самом деле, сочетание МРТ/ТУЗИ с прицельной БП приобрело популярность, и проведение мпМРТ перед БП у всех мужчин с подозрением на РПЖ рекомендовано руководствами (например, Европейской ассоциацией урологов), Американской ассоциации урологов и Общества абдоминальной радиологии). Однако мпМРТ имеет ряд ограничений, включая доступность, высокую стоимость, сложность визуализации в реальном времени и низкую согласованность между читателями. 4,5 Кроме того, движение пациента/простаты, деформация простаты и ошибка регистрации между МРТ и ТУЗИ изображениями могут влиять на обнаружение и локализацию опухоли. 10, 11
Недавние достижения в технологии ультразвукового исследования (УЗИ) создали такие методы УЗИ, как допплеровское УЗИ, гистосканирование, ультразвуковое исследование с контрастированием (УЗИК), эластография и микроультразвуковое исследование (микро-УЗИ). 12–17 Несмотря на то, что эти новые методы имеют некоторые ограничения, включая потребность в специализированном оборудовании, непоследовательные результаты, отсутствие стандартизации и внешней валидации, первые результаты мультипараметрического УЗИ являются многообещающими (Таблица 1). 18–23 “Мультипараметрическое ультразвуковое исследование (мпУЗИ)” привлекает внимание в области урологии и радиологии. В рекомендациях Европейской ассоциации урологов (ЕАУ) по РПЖ упоминается мультипараметрическое ультразвуковое исследование как перспективный метод визуализации для диагностики РПЖ, но также отмечается, что его недостатком является недостаточная стандартизация и отсутствие широкомасштабной оценки. 24 В настоящее время в рекомендациях не указано, должно ли мпУЗИ быть дополнительным или самостоятельным методом визуализации для диагностики РПЖ. В этой статье мы рассматриваем исследования, посвященные роли новых методов УЗИ и мпУЗИ в диагностике РПЖ, и описываем будущие направления.
Таблица 1. Особенности методов УЗИ.
|
Метод |
Целевые аспекты |
Преимущества |
Недостатки |
|
B-mode |
Анатомия |
Доступность |
Ограниченная эффективность при опухолях ТЗ |
|
Допплер-УЗИ |
Макроваскулярность |
Доступность |
Ограниченная эффективность при опухолях ТЗ |
|
HistoScanning |
Программный анализ радиочастотных данных УЗИ |
Автоматизированный анализ гетерогенности тканей, клеточной плотности и сосудистости |
Зависит от размера простаты и опыта оператора для моторизированного ТУЗИ для моторизированного ТУЗИ |
|
УЗИУК |
Микроваскулярность |
Возможность отображения площади абляции с помощью ОТ |
Ограниченная эффективность при опухолях ПЗ Нужен усилитель ультразвука |
|
Эластография |
Жесткость |
Экономичность |
Ограниченная эффективность при опухолях ПЗ |
|
Микро-УЗИ |
Анатомия |
Втрое более высокое пространственное разрешение |
Существование кривой обучения |
|
мпУЗИ |
Сочетание использованных методов |
Способность оценивать комплексные аспекты РПЖ |
Сложность для стандартизированного оценивания |
B-mode, режим яркости; УЗИУК, УЗИ усиленное контрастом; ОТ, Очаговая терапия; мпУЗИ, мультипараметрическое УЗИ; РПЖ, рак предстательной железы; ПЗ, периферическая зона; ТУЗИ, трансректальное УЗИ; ТЗ, транзитная зона; УЗИ, Ультразвуковая диагностика; УЗИ, Ультразвуковая диагностика.
Ультразвуковые методы, используемые для диагностики РПЖ
ТУЗИ в режиме “brightness“
Обычные УЗ-изображения обычно генерируются в brightness (В) режиме. 25 Характеристика тканей на УЗ-изображениях в режиме В возможна с помощью оценки акустических параметров, таких как коэффициенты ослабления и обратного рассеивания, полученных из радиочастотных (РЧ) эхо-сигналов. 26 Изображения УЗИ в B-режиме отображают карты амплитуды эхо-сигнала на мониторе с серой шкалой и значениями яркости пикселей, которые являются функцией видеосигнала. 27 Сначала датчик излучает короткий УЗ-импульс, который проникает глубоко в ткань или, при соприкосновении с тканью с другим акустическим импедансом, отражается по направлению к датчику. Изображения затем создаются путем обнаружения этих обратно рассеянных ультразвуковых волн. Длина ультразвуковых волн и различные акустические импедансы влияют на формирование изображения в В-режиме. 28, 29
Визуализация в B-режиме имеет ограничения в выявлении ПСА, поскольку сигналы обратного рассеивания от РПЖ и нормальной простаты могут быть похожими (Рисунок 1(a)). Сигналы, генерируемые из переходной зоны в этом режиме сонографии, также имеют тенденцию к неоднородности. 30 Кроме того, при использовании различных компенсаторных настроек для получения изображений одной и той же ткани в В-режиме, таких как усиление и временное усиление, ожидается визуализация различных изображений. Использование одинаковых настроек визуализации различными операторами может помочь больше всего смягчить эту проблему. 28
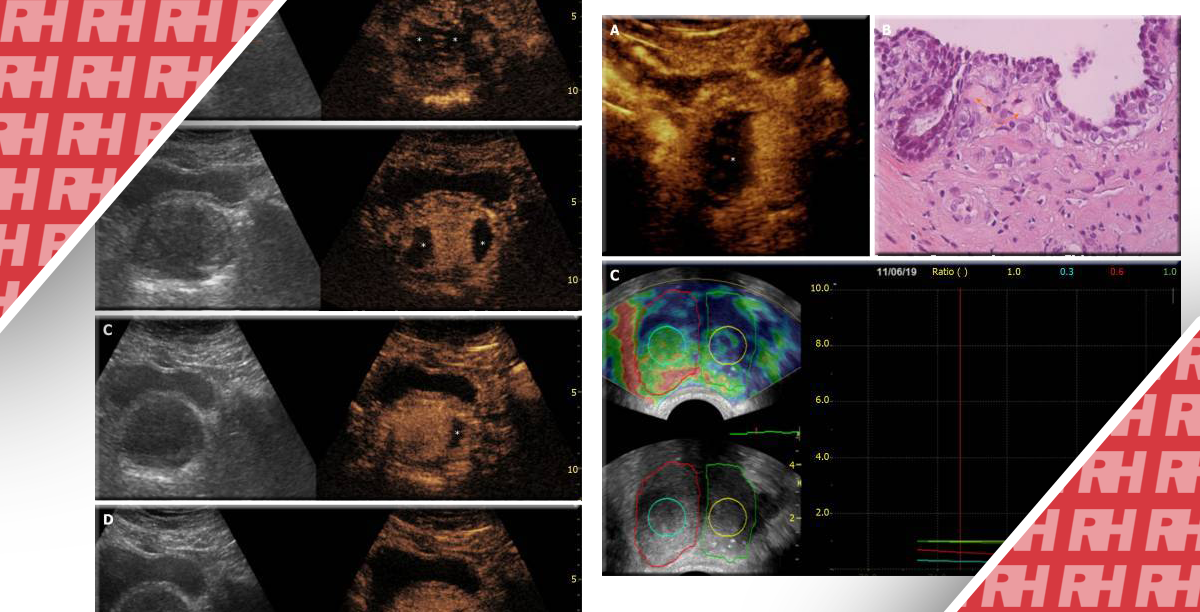
Рисунок 1. Репрезентативные изображения В-режима, ЦДУЗИ и УЗИУК. Мужчина 55 лет с уровнем ПСА 6,8 нг/мл на активном наблюдении по поводу рака ГО1. Дальнейшая биопсия обнаружила рак ГО2 в правой периферической зоне от верхушки к основанию. Подтверждено гипоэхогенное поражение 2 см × 1,5 см (а) с кровотоком вокруг поражения и диффузным кровотоком в пределах поражения на ЦДУЗИ (б) (стрелка). На УЗИУК (в) более быстрое поглощение контраста в правой верхушке простаты и равномерное поглощение в остальной части простаты (стрелка).
В-mode – режим яркости; CDUS – цветное допплеровское ультразвуковое исследование; CEUS – ультрасонография с контрастным усилением; ГО- группа оценки; ПСА – простат-специфический антиген.
Традиционно сонографическая визуализация в B-режиме используется как часть первичного метода выявления РПЖ. Визуализация в B-режиме ТУЗИ была широко изучена для оценки ее диагностической способности в выявлении РПЖ. Его преимущества включают получение изображений в режиме реального времени и то, что он является наиболее доступным, экономичным и наименее вредным медицинским устройством для визуализации. 26 Однако, чувствительность и специфичность обычного УЗИ в В-режиме ТУЗИ ограничены и составляют от 40 до 50% при выявлении РПЖ по данным большинства исследований. 30 По данным Postema и соавт., 29 чувствительность стандартного УЗИ в В-режиме ТУЗИ в выявлении РПЖ составляет лишь от 11 до 35%, а положительный прогноз – от 17 до 57%. Однако полезность УЗИ в B-режиме, похоже, была подорвана, согласно данным Steinkohl и соавт., 31 которые показали, что визуализация предстательной железы в B-режиме ТУЗИ может выявить до 62% поражений, видимых при МРТ, что на сегодняшний день является самой точной методикой визуализации. Кроме того, B-режим считается недостаточно точным для выявления опухолей, что делает необходимым проведение систематических биопсий под контролем УЗИ. Систематическая биопсия является широко принятой практикой для выявления РПЖ, при которой образцы из заранее определенных анатомических зон простаты убираются бесцельным способом. 26 Однако, учитывая случайность такого подхода, он приводит к увеличению частоты ошибочноотрицательных результатов до 35%.31
Допплер -УЗИ
Цветное допплеровское ультразвуковое исследование (ЦДУЗИ) было предложено как инструмент для повышения точности ТУЗИ с использованием другого параметра, чем эхогенность на обычном УЗИ в В-режиме. 12 Сосудистость подозрительного гипоэхогенного участка на обычном УЗИ в серой шкале В-режиме может быть идентифицирована и охарактеризована с помощью ЦДУЗИ или мощной ультразвуковой допплерографии (МУД). 32 Хотя МУД является более чувствительной, чем КГУЗИ, в выявлении медленного кровотока, МУД не продемонстрировала лучшего выявления РПЖ, чем ЦДУЗИ. 32 К тому же, МУД не показывает направление движения кровотока. 22
Ангиогенез является одним из патологических признаков роста опухолей. Допплеровское смещение определяется как разница длин волн, вызванная движением объекта. Принцип допплерографии заключается в том, чтобы помочь идентифицировать изменения длины волны, отражающие движущиеся клетки в кровотоке. 33 Таким образом, увеличение количества смещений связано с неоваскуляризацией в этой ткани. 22, 17
Допплеровские паттерны потока между злокачественными и доброкачественными поражениями были оценены Ashi и соавт. 12 в этой серии исследований средняя скорость кровотока в поражениях РПЖ составляла 1,35 см/с по сравнению с медианой 0,36 см/с для их доброкачественных аналогов. Кроме того, поток был непрерывным и фазным для злокачественных образований и нерегулярным для доброкачественных. Характеристики кровотока, которые наблюдаются в участках РПЖ, возможно, связаны с большим количеством сосудов, увеличенным диаметром и пониженным сопротивлением кровотока. Отсутствие гладких мышц в неоваскуляризированных сосудах объясняет пониженное сопротивление потоку. Кроме того, увеличенный объем клеток в очаге поражения может сужать эти сосуды, увеличивая скорость кровотока. ЦДУЗИ может обнаруживать сосуды размером до 1 мм, однако микрососуды в злокачественных опухолях простаты имеют размер до 10 микрон, что представляет диагностическую проблему для этого инструмента. Тем не менее, МУД можно использовать для повышения чувствительности к меньшим сосудам (менее 2 мм). 17, 34
При оценке поражения РПЖ с помощью ЦДУЗИ были описаны различные картины течения: (1) очаговое в пределах поражения, (2) течение вокруг поражения и (3) диффузное течение в пределах поражения, причем последнее является наиболее распространенной картиной . 32
Кулиговская и соавт. 35 сообщили о диагностической эффективности ЦДУЗИ для выявления РПЖ у 544 пациентов с БП, которым была проведена секстантная биопсия и прицельная биопсия патологических образований УЗИ. Чувствительность/специфичность выявления РПЖ составляла 41%/85% при применении только ТУЗИ, 43%/66% при применении только ЦДУЗИ и 57%/61% при применении комбинации. Существует возможность для дальнейшего улучшения эффективности допплеровского УЗИ. Недавно Zeng и соавт. 36 исследовали диагностическую эффективность трехмерного (3D) силового допплеровского УЗИ (3D-МУД) для выявления КЗРП с помощью метода компьютерного анализа виртуального органа. В общем 99 участникам с подозрением на РПЖ проспективно выполнили ТУЗИ + МУД + 3D-МУД. Используя выявление КЗРП на БП как референтный стандарт, индекс васкуляризации, определенный с помощью 3D-МУД, достиг 86% чувствительности и 87% специфичности. Индекс васкуляризации рассчитывался по проценту цветно-кодированных вокселей в пределах суммы процентов. Выявление КЗРП с помощью индекса васкуляризации составило 82,1% и было статистически выше, чем ТУЗИ (69,5%) и МУД (63,4%).
Чувствительность для выявления РПЖ возрастает при использовании ЦДУЗИ, что улучшает диагностические показатели ТУЗИ. Специфичность, наоборот, снижается. Это можно объяснить тем, что простатит может быть интерпретирован как злокачественное поражение, а также преимущественной идентификацией более крупных по размеру и более высокой степени поражений с помощью допплерографии, в которых чаще происходит ангиогенез. .37,38 Поэтому воспалительные изменения или состояния в простате можно легко спутать со злокачественной опухолью без соответствующей клинической корреляции. ЦДУЗИ также можно использовать в других ситуациях, например, для сравнения повторных биопсий или как маркер нежизнеспособной ткани после местного лечения РПЖ путем измерения отсутствия допплеровских сигналов. 38 Основными ограничениями ЦДУЗИ являются зависимость от оператора и отсутствие стандартизации.
Сверхсовременная микрососудистая визуализация (СМВ) – это новая технология, которая визуализирует медленный микрососудистый кровоток. 33 В то время как обычная допплерография может отображать сигналы помех, вызванные движением тканей, СМВ подавляет помехи, чтобы целенаправленно обнаружить сигнал кровотока благодаря своему машинному алгоритму. 39 По сравнению с обычной допплерографией, СМВ может визуализировать медленный кровоток с высокой частотой кадров, высоким разрешением, высокой чувствительностью и меньшим количеством артефактов движения. Zhu и соавт. 33 обнаружили, что СМВ обнаружила кровеносные сосуды у 97,3% пациентов с РПЖ, а также положительную корреляцию между количеством микрососудов на СМВ и оценкой биопсии по шкале Глисона. Интересно, что Ohashi и соавт. 40 сообщили о случае, когда медленный кровоток в стромальной саркоме предстательной железы (ССП) был обнаружен с помощью СМВ. Следует отметить, что внутриопухолевый кровоток не был обнаружен с помощью обычного ЦДУЗИ. Они выполнили прицельную биопсию в направлении кровотока под руководством СМВ, и жизнеспособные опухолевые клетки были успешно отобраны. Они подчеркнули полезность СМВ для нацеливания на поражения с внутриопухолевым кровотоком, указывающим на жизнеспособные клетки, поскольку ССП часто включает большой некротический участок. Кроме того, некоторые исследователи выполняли СМВ до и после очаговой абляции при локализованном РПЖ. 39,41 Используя СМВ, они подтверждали наличие опухолевого кровотока до абляции, а затем подтверждали исчезновение кровотока после абляции для определения технического успеха абляции. 39,41 Хотя влияние СМВ на онкологические результаты еще не доказано, целевая БП и очаговая абляция под руководством СМВ представляется целесообразной.
HistoScanning
HistoScanning – это ультразвуковая система визуализации, которая используется для повышения точности обнаружения, локализации, объема опухоли и предполагаемых изменений РПЖ, состоящий из сканирования и последовательной оценки ткани предстательной железы с помощью ректального датчика. 13 Эта технология позволяет проводить программный анализ необработанных 3D-реконструированных данных УЗИ в сочетании с радиочастотами и их сравнение с базой данных, предварительно загруженной в систему. 13,42 Программное обеспечение HistoScanning предлагает три различных алгоритма, связанные с неоднородностью тканей, плотностью клеток и сосудов, для анализа сигналов перед выводом результатов на экран. 43
Технология HistoScanning выполняется в три этапа по порядку. Во-первых, датчик ТУЗИ, соединенный снаружи с двигателем (моторизованный ТУЗИ), генерирует полное 3D-сканирование предстательной железы. Во-вторых, оператор очерчивает зоны интереса (ЗИ) с помощью программной платформы HistoScanning. Наконец, компьютеризированный алгоритм анализа в режиме нереального времени показывает участки с красным кодом, подозрительные на РПЖ, и соответствующий объем опухоли. 44,45 Однако, в случаях, когда встречаются данные визуализации низкого качества, в анализе отображаются участки с фиолетовым кодом. 44,45
Подобно методам слияния МРТ-УЗИ, истинное таргетирование (true targeting) HistoScanning (HS-TT) позволяет преобразовать результаты HistoScanning в мишени ТУЗИ в режиме реального времени. 13 После анализа изображений и алгоритмов дополнительная программная система предоставляет оператору команды о том, как маневрировать зондом ТУЗИ, оснащенным направляющей иглой, чтобы отобрать образцы ядер из определенных, идентифицированных красным кодом участков. 7,44,45
Кроме того, так же, как метод промежностной БП приобрел популярность, метод промежностной биопсии HistoScanning также эволюционировал. Промежностная биопсия HistoScanning выполняется во время дорсальной литотомии пациента. Биопсия под контролем промежности выполняется с помощью трехплоскостного ультразвукового датчика, системы отчетов HistoScanning и шаблонной сетки для брахитерапии в качестве ориентира. Таким образом, прицельная биопсия с помощью шаблона HistoScanning может быть выполнена без дополнительных процедур. 7
В литературе существуют противоречивые данные относительно эффективности HistoScanning при выявлении РПЖ. 42,46 Некоторые предыдущие исследования показывают высокую точность HistoScanning при выявлении поражений РПЖ объемом ⩾0,5 см3 с чувствительностью и специфичностью до 100% и 80%, соответственно. 47 Несмотря на эти ранние обнадеживающие результаты, дальнейшие исследования дали противоречивые выводы с более низкой чувствительностью (37-70,3%) и специфичностью (14,7-73%).42,46,48,49 Аналогично, исследование, в котором был выявлен меньший объем поражения РПЖ ⩾ 0,1 см3, показало еще более низкие результаты (60% и 66% соответственно). 50 Более того, несколько исследований пришли к выводу, что точность HistoScanning определяется объективными факторами, такими как объем простаты, и субъективными факторами, включая опыт оператора в выполнении моторизованной ТУЗИ, что имеет важное значение для 3D-реконструкции данных сочетания радиочастот и УЗИ. 13 Таким образом, HistoScanning может быть ценным инструментом для опытных операторов.
УЗИУК
Joyner и соавт., 51 в 1967 году описали ультразвуковое контрастное исследование во время выполнения эхокардиограммы. Введение солевого раствора через внутрисердечный катетер образовывало мини-пузырьки, которые во время исследования воспринимались как облака эхосигналов. УЗИУК состоит из техники визуализации, предусматривающей внутривенное введение ультразвуковых контрастных веществ для улучшения визуализации структур, представляющих интерес. 52 В частности, для РПЖ эта стратегия помогает в выявлении, диагностике и наблюдении за подозрительными поражениями при выполнении прицельной БП с ТУЗИ.
Обычная серошкальная ТУЗИ ограничивается выявлением РПЖ или различением аблированной предстательной железы от нормальной с высокой точностью. Однако препараты, содержащие микропузырьки, которые улучшают визуализацию микрососудов предстательной железы, увеличивают шансы на выявление злокачественного поражения, поскольку аденокарцинома предстательной железы характеризуется ангиогенезом с увеличением плотности микрососудов(Рисунок 1(c)). 53 УЗИУК имеет несколько потенциальных преимуществ в ведении больных с РПЖ, включая диагностику, облегчение проведения таргетированной БП, оценку в реальном времени и подтверждение адекватной абляции тканей после очаговой терапии (ОТ), а также идентификацию рецидива заболевания в период постабляционного наблюдения с помощью лучшего разрешения сосудистых визуализаций. 52
Допплеровское ультразвуковое исследование может точно оценить макрососуды, но не сосуды менее 200 мкм, которые обычно наблюдаются при ангиогенезе. Ультразвуковой контраст, содержащий микропузырьки размером 2-6 мкм, является сугубо внутрисосудистым, поскольку они не проникают в интерстициальное пространство, они достаточно малы, чтобы пройти через легочный кровоток и попасть в системный кровоток, но достаточно велики, чтобы не выйти за пределы эндотелия, и прекрасно позволяют увидеть микрососуды, характерные для аденокарциномы предстательной железы. 54,55 Следующие препараты, усиливающие ультразвук (ПУУ), одобрены к использованию: Lumason® (микросферы из гексафторида серы липидного типа А), SonoVue®, Definity® или Luminity®.56 ПУУ не требуют лабораторных исследований перед процедурой и не имеют нефротоксичности, гепатотоксичности или кардиотоксичности. Многоинституциональное исследование с участием 5576 пациентов, которым проводили эхокардиографию с контрастированием, показало, что частота нежелательных явлений составляла 0,27%, причем все нежелательные явления были легкими и транзиторными. 57
С помощью УЗИУК можно оценить перфузию в мелких микрососудах (40 мкм), наблюдаемых при РПЖ, с положительным прогностическим значением до 91,7%, чувствительностью до 79,3% и точностью до 83,7%. Добавление прицельной БП под контролем УЗИУК может быть связано со значительным улучшением частоты обнаружения рака по сравнению с 12-контактной систематической биопсией. 14,58,59,60 Кроме того, она обеспечивает немедленную интраоперационную визуализацию абляционного участка с четкими и острыми краями, что подтверждает, что подозрительный участок действительно был обработан, как и планировалось. Следует отметить, что УЗИУК является убедительной стратегией для оценки и диагностики других урологических злокачественных новообразований, таких как рак почки и мочевого пузыря. 61,62
Собственное программное обеспечение может обрабатывать необработанные данные, полученные УЗИУК.63 Кривая временной интенсивности (КВИ) изображается программным обеспечением, которое откладывает среднее значение эхосигнала в дБ (ось X) против времени (ось Y). Из КВИ можно получить количественные параметры, такие как пиковая интенсивность (ПИ), наклон смыва (НС) и время до пика (ВДП). Сравнивая КВИ, выделенный из подозрительной на рак зоны интереса предстательной железы и контралатеральной нормальной ЗИ, РПЖ демонстрирует более высокую ПИ, более крутой НС и более ранний ВДП. 64,65 Удаленная ткань с помощью высокоинтенсивного сфокусированного ультразвука (ВИСУ) может быть подтверждена в виде плоской кривой с минимальным наклоном на КВИ (Рисунок 2). 52
Изображение 2. Репрезентативные изображения до/после ВИСУ с помощью УЗИУК. Мужчина 62 лет, ПСА 8,2 нг/мл. Мультипараметрическая МРТ перед биопсией выявила подозрительное поражение ПЖ в левой периферической зоне от основания до верхушки железы (5 баллов по шкале PIRADS). Систематическая биопсия из 12 пункций плюс 6 прицельных пункций выявили рак ГО2 с левой стороны простаты. Пациент пожелал пройти левую геми-ВИСУ как окончательное лечение РПЖ. Перед ВИСУ было проведено УЗИУК для оценки сосудистого русла двусторонних долей простаты (стрелкой показано контрастное усиление на раковом участке). Анализ кривых “время-интенсивность” показал более высокую пиковую интенсивность, более крутой наклон замывания и более раннее время до пика на левой стороне простаты (желтый круг и желтый график), чем на правой стороне (зеленый круг и зеленый график). Сразу после ВИСУ было проведено повторное исследование с помощью УЗИУК для подтверждения абляции (стрелка). В то время как обработанная боковая доля успешно потеряла сосудистую активность, контралатеральная сторона сохранила сосудистую активность. На этом этапе процедура была прекращена. После операции уровень ПСА снизился до 0,26 нг/мл, дальнейшие визуализационные исследования (мпМРТ, ТУЗИ в B-режиме, ЦДУЗИ и УЗИУК) не выявили рецидивирующего подозрительного поражения ПЖ. Через год после ВИСУ повторная систематическая биопсия подтвердила отсутствие рака как на пролеченной, так и на непролеченной стороне простаты.
В-mode – режим яркости; ЦДУЗИ- цветное допплеровское ультразвуковое исследование; CEUS с контрастным усилением – УЗИ с контрастированием; ГО – группа оценки; HIFU – высокоинтенсивный фокусированный ультразвук; мпМРТ- мультипараметрическая магнитно-резонансная томография; РПЖ – рак предстательной железы; PIRADS – система отчетности и данных о визуализации предстательной железы; ПСА – простат-специфический антиген; МРТ – магнитно-резонансная томография; КВИ – кривая “время-интенсивность”; ТУЗИ – трансректальное ультразвуковое исследование.
Эластография
Ультразвуковая эластография – метод визуализации, который выявляет и количественно оценивает жесткость тканей – помогает в диагностике РПЖ, поскольку злокачественная ткань имеет большую жесткость, чем доброкачественная. Два самых распространенных вида эластографии, применяемых для исследования простаты, – это компрессионная эластография (КЭ) и сдвиговолновая эластография (СВЭ). 66 КЭ измеряет деформацию, возникающую в ткани под воздействием механической нагрузки, вызванной трансректальным датчиком. Чтобы избежать риска чрезмерного сжатия и ложного увеличения жесткости тканей, для разделения зонда и прямой кишки можно использовать надутый баллон (например, с водой). 67 СВЭ измеряет распространение механических волн через ткань, которое может меняться в зависимости от ее жесткости. 68
КЭ простаты продемонстрировала лучшую точность, чем ТУЗИ, в выявлении РПЖ. Мета-анализ с участием 508 пациентов, в котором сравнивали КЭ с гистопатологией после радикальной простатэктомии (РП), показал чувствительность 72% и специфичность 76% для выявления РПЖ. 69 Систематический обзор, включавший 1840 пациентов, показал увеличение на 7-15% общего выявления РПЖ, когда прицельная биопсия с помощью ТУЗИ-эластографии комбинировалась с системной биопсией, по сравнению с одной только системной биопсией. 70 Schiffmann и соавт., 71 однако, не сообщают о подобных результатах. Результаты исследования с участием 679 мужчин и 4074 биоптатов простаты из 6 различных участков простаты продемонстрировали, что КЭ-таргетная биопсия имеет общее высокое значение специфичности (90%) и отрицательную прогностическую ценность (ОПЗ, 87%), а также низкое значение чувствительности (19%) и положительную прогностическую ценность (ППЗ, 25%). Низкие значения чувствительности и ППЗ свидетельствуют о том, что КЭ может не выявлять секстанты, которые действительно являются признаками РПЖ.
Систематический обзор, включавший 2227 пациентов из 16 исследований СВЭ, показал многообещающие результаты. 72 В девяти проанализированных исследованиях систематическая биопсия была референтным стандартом на уровне каждого образца (ядро, секстант). Объединенная чувствительность и специфичность составляла 85% и 85% соответственно. Когда гистопатология РП использовалась в качестве референтного стандарта, объединенная чувствительность и специфичность составляли 71% и 74% соответственно. Fu и соавт. 73 также продемонстрировали положительные результаты в своем проспективном исследовании 221 пациента, в котором сравнивали СВЭ с МРТ простаты. Чувствительность, специфичность, ППЗ, ОПЗ и точность составляли 78,97%, 90,67%, 71,30%, 93,66% и 88,03% соответственно. Между СВЭ и МРТ не было статистически значимой разницы в диагностике РПЖ (p = 0,259). Однако диагностическая способность СВЭ была несколько лучше, чем МРТ, для диагностики КЗРП (p = 0,013). Другие результаты были получены Xiang и соавт. 74 Было показано, что сама по себе СВЭ имеет более низкую диагностическую ценность, чем МРТ, но комбинация обоих методов визуализации продемонстрировала более высокую чувствительность, чем любой из методов в отдельности.
Несмотря на благоприятные результаты, эластография не лишена недостатков. Во-первых, ручное сжатие простаты оператором КЭ может изменить эластичность ткани, что ограничивает точность диагноза. 75, 76 Это снижает воспроизводимость результатов, поскольку они зависят от навыков и опыта врача. Кроме того, не существует метода равномерного сжатия простаты. Во-вторых, жесткие поражения не обязательно указывают на рак, а раковые поражения не всегда являются жесткими. 77 Сопутствующие факторы, такие как увеличение объема простаты, кальцинаты и фиброзная ткань, могут привести к ложноположительным результатам. Наконец, значительные ограничения включают малый размер окна, низкую частоту кадров и проблемы с проникновением при проведении СВЭ. 66
Эластография предстательной железы может рассматриваться как дополнительный метод для выявления РПЖ и направления биопсии. ТУЗИ-направленная биопсия с использованием эластографии представляется перспективной, но для подтверждения ее полезности необходимо провести проспективные многоцентровые исследования. Необходима стандартизация и валидация метода для дальнейшего сравнения исследований.
Микро-УЗИ
Обычное ТУЗИ в B-режиме, выполняемое на частоте 8-12 МГц, обеспечивает достаточную глубину проникновения в простату; однако пространственное разрешение может быть недостаточным для дифференциации физиологических железистых протоков, ацинусов простаты и злокачественных образований. 78–80 Для улучшения ограниченного разрешения обычной ТУЗИ была разработана микро-УЗИ с использованием датчика с частотой 29 МГц. 78, 81. По сравнению с обычной ТУЗИ, эта более высокочастотная система может визуализировать простату с втрое более высоким пространственным разрешением (70 мкм). 17 Однако существует баланс между пространственным разрешением и глубиной проникновения, поскольку ослабление пропорционально частоте. 82 Таким образом, глубина проникновения системы Микро-УЗИ уменьшена до 50 мм, что все еще охватывает всю простату стандартного размера. 81, 83 Современная система микро-УЗИ позволяет получить изображение только в сагиттальной плоскости, что является оптимальным для трансректальной БП. Отсутствие аксиальных изображений, однако, делает МРТ-управляемую БП недостижимой, хотя МРТ-управляемую БП все еще можно выполнить. 84
На основе ультрасонографического вида участков РПЖ на микро-УЗИ была создана 5-балльная система оценивания подозрительных поражений, позволяющая более последовательно интерпретировать изображения простаты. 81 Эта система оценивания называется PRI-MUS (Prostate Risk Identification using Micro-Ultrasound), которая является аналогом классификации PIRADS для мпМРТ. PRI-MUS 1 и 2, вероятно, являются доброкачественными. PRI-MUS 3 ассоциируется с промежуточным риском развития рака и может быть подтвержден прицельной или систематической биопсией. Поражения PRI-MUS 4 и 5 высоко коррелируют со значительным заболеванием, и показана прицельная биопсия. 81, 85 Используя эту систему классификации, Павлович и соавт. провели многоинституциональное рандомизированное контролируемое исследование, в котором сравнивали микро-УЗИ первого поколения с обычной трансректальной БП под контролем УЗИ. 86 В качестве референтного стандарта использовали результаты систематической 12-контактной трансректальной БП. Исследование было разделено на обучение до и после интерпретации изображений. PRI-MUS был разработан на основе данных группы до обучения, а затем использован группой после обучения. Было подтверждено улучшение чувствительности микро-US в группе после обучения по сравнению с группой до обучения (60,8% против 24,6%, p <0,01), и чувствительность была значительно выше, чем в обычном ТУЗИ (против 38,0%, p <0,001). Более того, обнаружение КЗРП на одного пациента, используя микро-US улучшилось на 7%, после обучения (32-39%, p <0,03). Однако обнаружение КЗРП при микро-US не было лучше, чем при обычном ТУЗИ (34,6% против 36,6 для всей когорты и 39,0% против 39,0% для когорты после тренинга).
После первого пилотного исследования точности микро-УЗИ, 78 несколько исследований сравнивали микро-УЗИ с обычными B-режимом ТУЗИ и мпМРТ. 16, 85–88 Zhang и соавт. 89 провели мета-анализ семи исследований, включавших 769 пациентов, чтобы проанализировать точность микро-УЗИ при БП. Они обнаружили, что микро-УЗИ имеет объединенную чувствительность, специфичность, диагностическое отношение шансов и площадь под кривой суммарной рабочей характеристики приемника (РХП) 0,91, 0,49, 10 и 0,82, соответственно. Sountoulides и соавт. 90 сравнили частоту обнаружения РПЖ между микро-УЗИ и БП управляемой мпМРТ (УБП) в своем мета-анализе 13 исследований, включавших 1125 пациентов. Коэффициент обнаружения (КО) оценивался как отношение частоты обнаружения микро-УЗИ УБП к частоте обнаружения мпМРТ-УБП. Объединенный КО для группы степеней (ГС) 1, ⩾1, ⩾2 и ⩾3 РПЖ составил 0,94, 0,99, 1,05 и 1,25 соответственно. Таким образом, Sountoulides и соавт. 90 пришли к выводу, что микро-УЗИ и мпМРТ УБП показали сходные показатели обнаружения для всех степеней РПЖ. Кроме того, в другом мета-анализе 15 исследований, включавших 2967 пациентов, Dariane и соавт. 91 оценили дополнительную ценность БП управляемой микро-УЗИ по сравнению с систематической биопсией (СБ). Они обнаружили, что микро-УЗИ УБП выявила больше КЗРП [КВ = 1,18, 95% доверительный интервал (ДИ) = 0,83-1,68] и значительно меньше РПЖ ГО1 (КВ = 0,55, 95% ДИ = 0,41-0,73), чем СБ. В первом многоцентровом проспективном исследовании, включавшем 1040 пациентов, сравнивали диагностическую эффективность микро-УЗИ и мпМРТ. Микро-УЗИ УБП и МРТ УБП были получены при поражении по шкале PRI-MUS >3 и PIRADS >3. По сравнению с мпМРТ УБП, микро-УЗИ УБП показал значительно более высокую чувствительность (94% против 90%, p = 0,03) и ОПЗ (85% против 77%, p = 0,04) со схожей специфичностью (22% против 22%, p = 0,45) и ППЗ (44% против 43%, p = 0,32) для выявления КЗРП. 92 Результаты исследования OPTIMUM (Optimization of prostate biopsy-Micro-Ultrasound versus MRI), которое продолжается с тремя участниками, определят, можно ли использовать микро-УЗИ как альтернативу сочетанию биопсии и МРТ/ТУЗИ. 93
Мультипараметрическое УЗИ
Как показано выше, новые методы УЗИ продемонстрировали многообещающие результаты. Однако неясно, может ли один новый метод УЗИ обеспечить удовлетворительную диагностическую эффективность при РПЖ. Эти методы визуализируют различные аспекты простаты. Концепция мпУЗИ подобна концепции мпМРТ. Поэтому мпУЗИ полезна для определения объема поражения, а также для направления для БП и ОТ. Как и динамическая контрастная визуализация на МРТ, допплерография и УЗИУК могут выявить сосудистую систему в тканях ПЖ. Эластография показывает жесткость ткани предстательной железы, которая может соответствовать плотности раковых клеток. Учитывая успех мпМРТ для диагностики РПЖ, сочетание нескольких методов УЗИ также имеет потенциал для достижения более достоверных результатов. Принимая во внимание несколько методов УЗИ, которые демонстрируют возможность направления при БП и ОТ, мпУЗИ также может быть полезным для наведения на БП и ОТ. 13, 39–41, 52
Несколько групп исследовали мпУЗИ, определенный как комбинация 3 или более способов УЗИ. 18–23 За последние 5 лет, однако, мпУЗИ приобрел популярность в урологии и радиологии. 30, 94–101
Zhang и соавт. 94 оценивали злокачественные признаки методов УЗИ с использованием 12-систематической БП у 40 пациентов с доброкачественной гистологией и 38 мужчин с локализованным РПЖ в качестве референтного стандарта. Они демонстрируют, что при сочетании режимов УЗИ (“⩾3 злокачественных признака” при ТУЗИ или “асимметричное распределение” при СВЭ или “несинхронное накопление/вымывание, неравномерное усиление и гетерогенное распределение” при УЗИУК) мпУЗИ достигает высоких показателей выявления РПЖ [чувствительность: 97,4%, специфичность: 77,5%, ППЗ: 80,4%, ОПЗ 96,9%, точность: 87,2%, площадь под рабочей характеристической кривой приемника (AUROC)]: 0,874], которая была совместима с МРТ (чувствительность: 94,7%, специфичность: 60,0%, ППЗ: 69,2%, ОПЗ 92,3%, точность: 76,9%, AUROC: 0,774). Прицельная биопсия, однако, не проводилась, и поэтому эффективность на одно поражение не оценивалась. СВЭ или УЗИУК обычно оцениваются в сочетании с результатами В-режима. Поскольку эффективность СВЭ или УЗИУК (AUROC: 0,860 и 0,859) была сходной с мпУЗИ (AUROC: 0,874), дополнительная ценность третьей методики УЗИ представляется ограниченной.
Mannaerts и соавт. 95 проспективно оценили диагностическую эффективность комбинации трех методов УЗИ (В-режим, СВЭ и УЗИУК) у 48 мужчин, которым выполняли РП в качестве референтного стандарта. Уникальным является использование автоматизированного метода гистопатологической корреляции РП для точной оценки локализации поражения КЗРП. Методику УЗИ оценивали трое читателей по 5-балльной шкале Лайкерта для определения 12 анатомических показателей ЗИ. При использовании шкалы Лайкерта ⩾3 в качестве порогового значения чувствительность, специфичность, ППЗ и ОПЗ для диагностики КЗРП помощью мпУЗИ составляли 74%, 59%, 65% и 70% соответственно. Чувствительность была значительно выше, чем у всех отдельных методик УЗИ (В-режим: 55%, СВЭ: 55% и УЗИУК: 59%). С другой стороны, специфичность достоверно не отличалась от всех отдельных методик УЗИ (В-режим: 61%, СВЭ: 61% и УЗИУК: 63%). В подгрупповом анализе эффективности мпУЗИ специфическая чувствительность ЗИ для поражения периферической зоны (ПЗ) была выше, чем для поражения транзитной зоны (ТЗ) (80% против 67%). В то время как чувствительность только СВЭ для выявления опухолей ПЗ была ниже, чем В-режима или только УЗИУК, В-режим или УЗИУК выявляют меньше опухолей ТЗ, чем СВЭ. Эти результаты могут оправдать концепцию мпУЗИ как комбинации этих методов УЗИ. Частота обнаружения индексного поражения (определяется как самая высокая степень поражения по Глисону на гистологии ПЖ) ЗИ1 и ЗИ2 была значительно выше при мпУЗИ, чем при всех отдельных методах УЗИ (мпУЗИ: 88% по сравнению с УЗИУК: 73%, B-режимом: 72% или СВЭ: 70%). Согласованность между наблюдателями, оцененная с помощью критерия Криппендорфа α, была невысокой [мпУЗИ (значение отсечения типа Лайкерта ⩾3): 0,33 и мпУЗИ (значение отсечения типа Лайкерта ⩾4): 0.48]. К сожалению, в этом исследовании не проводилось сравнение с результатами МРТ, а размер выборки был небольшим. Следует отметить, что все участники имели РПЖ, который в конечном итоге лечили с помощью РП; следовательно, вероятно, существовало популяционное смещение. По сравнению с отдельными методиками УЗИ, мпУЗИ выявил больше КЗРП как на ПЗ, так и на ТЗ. Это является очевидным преимуществом мпУЗИ.
Postema и др. 96 оценили диагностическую эффективность КЗРП (любой ГО⩾3 и ГО2 более 0,5 ml) B-режима, УЗИУК, контрастной ультразвуковой дисперсионной визуализации ( КУДВ) и мпУЗИ (комбинация этих трех методов УЗИ) у 133 мужчин, проходивших РП, в качестве референтного стандарта. КУДВ, компьютерная методика количественной оценки, была создана на основе записей УЗИУК. Достоверность обнаружения КЗРП для каждого метода визуализации (В-режим, УЗИУК и КУДВ) оценивали пять наблюдателей по шкале Лайкерта от 1 до 5 баллов. В многоцентровом исследовании чувствительность/специфичность/AUROC для диагностики КЗРП составляла 81%/64%/0,78 для УЗИУК, 83%/55%/0,79 для КУДВ и 83%/55%/0,78 для мпУЗИ. С помощью взвешенной статистики Флейса-Каппа в исследовании была продемонстрирована низкая согласованность между наблюдателями методов УЗИ (УЗИУК: 0,20, КУДВ: 0,18, комбинация: 0,18).
Недавно Grey и соавт. 102 провели многоцентровое проспективное парное когортное исследование для сравнения диагностической эффективности при КЗРП (любой участок с ГО ⩾3 или максимальной длиной ракового ядра ⩾6 мм) между мпУЗИ (B- режим + ЦДУЗИ + эластография + УЗИУК) по сравнению с мпМРТ. Оценка мпМРТ базировалась на системе Лайкерта вместо PIRADS, и каждое УЗИ оценивалось с помощью стандартизированного метода балльной оценки по Лайкерту. Общий балл поражения определялся на усмотрение докладчика. Используя БП управляемую трехъядерной мпУЗИ или мпМРТ как референтный стандарт, они обнаружили КЗРП только с помощью мпУЗИ, только мпМРТ и комбинации мпУЗИ и мпМРТ составляло 26%, 30% и 32% соответственно. В результате, 7% КЗРП были обнаружены исключительно с помощью только мпУЗИ, тогда как 20% КЗРП были обнаружены исключительно с помощью только мпМРТ. Авторы пришли к выводу, что мпУЗИ может быть альтернативой мпМРТ в качестве диагностического теста для пациентов с высоким риском развития РПЖ, особенно в случаях, когда мпМРТ не может быть выполнена.
Такая непоследовательная эффективность и ограниченная согласованность между наблюдателями мпУЗИ может быть связана с отсутствием хорошо структурированной или стандартизированной системы оценки. Wildeboer и соавт. 97 оценили эффективность радиометрических признаков РПЖ, полученных с помощью В-режима, СВЭ и УЗИУК, для локализации РПЖ, используя методы машинного обучения (алгоритм классификации случайного леса) в анализе 48 мужчин с биопсийно подтвержденным РПЖ. Образцы ПЗ этих 48 пациентов были использованы в качестве референтного стандарта. В то время как лучший отдельный радиомический признак, такой как скорость контрастирования, достиг регионального показателя AUROC 0,69 для любого РПЖ и 0,76 для КЗРП (определенного как РПЖ > ГО2), соответственно, мультипараметрическая комбинация радиомических признаков достигла более высокого показателя AUROC 0,75 для любого РПЖ и 0,90 для КЗРП, соответственно. Радиометрические признаки, связанные с перфузией, дисперсией и эластичностью, чаще всего выбирались как эффективные параметры для классификации РПЖ с помощью модели машинного обучения. Важно, что они также показали, что эффективные радиометрические параметры, полученные на основе В-режима, СВЭ и УЗИУК, не коррелируют между собой; следовательно, эти три модальности могут быть кумулятивными. Поскольку отобранные радиометрические параметры существенно отличались между ПЗ и ТЗ, они подчеркнули необходимость точной зональной сегментации для оценки УЗИ.
Моррис и соавт.98 оценили возможность использования В-режима, импульсной визуализации силы акустического излучения (ИСАИ), СВЭ и количественного ультразвукового (КУЗИ) подбора среднего диапазона (СД) для обеспечения наведения изображения для целевой БП. ИСАИ – это американский метод оценки эластичности с помощью силы акустического излучения. В то время как СВЭ обеспечивает количественную жесткость ткани, ИСАИ отражает относительную жесткость ткани. Вычисляя нормализованные спектры, спектральные методы КУЗИ количественно оценивают свойства рассеивания тканей. СД является самым распространенным параметром в КУЗИ-анализе, который генерируется с помощью линейной подгонки к нормализованным спектрам обратного рассеяния. У 35 мужчин с биопсийно подтвержденным РПЖ были получены показатели В-режима, ИСАИ, СВЭ и СД, которые были объединены с помощью метода линейных опорных векторов (МОВ). МОВ был обучен и валидирован на подмножестве данных 20 пациентов и протестирован на данных оставшихся 15 пациентов. Всем участникам после визуализации выполнили простатэктомию, гистологически проанализировали целостные препараты предстательной железы и определили поражение ПЖ на основе 27-зональной модели в качестве референтного стандарта. Они оценивали контраст и отношение контраст/шум (ОКШ) как метрики видимости поражения и обобщенное отношение контраст/шум (оОКШ) как метрику для оценки перекрытия в распределении двух ЗИ. мпУЗИ статистически достоверно превосходила В-режим и СВЭ в отношении контраста, ОКШ и оОКШ, СД – в отношении контраста и ОКШ, а ИСАИ – в отношении ОКШ. Они отметили, что как кальцификаты, так и расстояние от УЗИ ограничивали эффективность мпУЗИ.
Будущие направления деятельности
На сегодняшний день точная диагностика и соответствующая стратификация РПЖ имеет важное значение для индивидуального подхода к лечению РПЖ. 103 Недавние достижения в технологии визуализации РПЖ, включая мпМРТ, позволили более точно локализовать РПЖ. Улучшают ли эти новые методы визуализации клинические результаты, такие как общая выживаемость, еще не определено. 101 Точная визуализация, если она хорошо валидизирована, может уменьшить необходимость в БП и риск гипердиагностики и чрезмерного лечения. 104 Ожидается, что ОТ, основанная на точной визуализации в реальном времени, обеспечит лучшие онкологические/функциональные результаты. 52 Поэтому важное значение имеет установление более точной визуализации.
Обзор самой современной литературы, посвященной УЗИ для диагностики РПЖ, приведен в Таблице 2. Хотя размер выборки недавних исследований мпУЗИ все еще невелик и большинство исследований были одноцентровыми, совокупная эффективность нескольких методов УЗИ, вероятно, существует, когда отдельные методы комбинируются (т.е. В-режим + СВЭ + УЗИУК).94,95,97,98,102 Вариации комбинированных методов УЗИ на сегодняшний день ограничены. Включение современных методов УЗИ, таких как СМВ или микро-УЗИ, может еще больше улучшить эффективность мпУЗИ.
Таблица 2. Обзор самой современной литературы об исследовании.
| Главный автор, год | Структура исследования | Метод Визуализации | Количество пациентов | Референтный стандарт | Основные результаты | Ограничения |
| Lorusso, 2022105 | Ретроспективное одноцентровое исследование | B-mode | 64 | РП гистология | – Чувствительность, специфичность и точность выявления КЗРП с помощью анализа КАИНС-ТУЗИ составляли 69%, 77% и 75% соответственно. | – Одноцентровое ретроспективное исследование с небольшим размером выборки. – Гистология биопсийного материала выделенного при РП как референтный стандарт потенциально приводит к смещению отбора. |
| Steinkohl, 201831 | Ретроспективное одноцентровое исследование | B-mode | 142 | МРТ/ТУЗИ фюжин-прицельная биопсия | – 92 из 148 мпМРТ поражений (62,2%) были видимыми на В-режиме. – Значительное влияние на видимость на В-режиме: объем простаты (малые простаты более видимы). – Не имеют существенного влияния на видимость на В-режиме: локализация поражения, оценка по шкале PIRADS, размер поражения. |
– Только пациенты с хорошо задокументированной МРТ/ТУЗИ фюжин-управляемой биопсией были ретроспективно включены. – Результаты были получены опытным оператором на высококлассном ультразвуковом аппарате. |
| Garcia-Reyes, 2018106 | Ретроспективное одноцентровое исследование | B-mode | 178 | МРТ/ТУЗИ фюжин биопсия (14-контактная МБ + от 2 до 4-контактная ПБ) | – Анализ на каждую локацию состоит из 1331 секстанта. – Частота выявления КЗРП составляла 20,5% только с помощью В-режима и 19,7% только с помощью мпМРТ. – Комбинация B-режима и МРТ показала значительно более высокую AUC для выявления КЗРП (0,85), чем только B-режим (0,80, p = 0,001) или только МРТ (0,83, p = 0,04). – Чувствительность и специфичность -режима составляла 42,3% и 91,6%. – Чувствительность и специфичность МРТ составляла 62,2% и 84,1%. |
– Ретроспективно были включены только пациенты с по крайней мере одним видимым поражением на МРТ. |
| Zeng, 202236 | Проспективное одноцентровое исследование | 3D-МУД | 99 | ТУЗИ БП (12-контактная МБ + от 1 до 2-контактная ПБ на поражение) | – Площадь под кривой для выявления КЗРП по индексу васкуляризации и индексу васкуляризации/потока составляла 95% и 95%. – Чувствительность для индекса васкуляризации и индекса васкуляризации/потока составляла 86% и 94%. – Специфичность для индекса васкуляризации и индекса васкуляризации/потока составляла 87% и 76%. |
– Один специалист проводит допплерографию. – Отсутствие сравнения с гистологией целой железы. |
| Ashi, 202112 | Проспективное одноцентровое исследование | ЦДУЗИ | 16 | ТУЗИ БП 12-16 контактная | – Средняя скорость микрососудистого кровотока в злокачественных поражениях составляла 1,25 см/с по сравнению с 0,36 см/с в доброкачественных поражениях (p < 0,01). – Медиана индекса пульсации злокачественных образований составляла 1,55 против 6,38 для доброкачественных образований (p < 0,01). |
– Небольшой размер образцов. |
| Zhu, 201933 | Проспективное одноцентровое исследование | МУД Вand СМВ | 119 | ТУЗИ БП (10-контактная МБ + от 2 до 3-конткактная СМВ-управляемая ПБ) | – CМВ и КУДВ выявляли сосуды в пораженных раком ПЖ в 97,3% против 90,5% соответственно. – Большее количество сосудов, оцененное с помощью CМВ и КУДВ, достоверно коррелировало с более высоким показателем по шкале Глисона (коэффициент корреляции 0,373 против 0,286). – В биопсийном материале взятом с помощью CМВ-управляемой ПБ достоверно больше РПЖ, чем в биопсийном материале взятом с помощью МБ (28,3% против 6,4%, p < 0,001). |
– В исследование были включены только пациенты с по крайней мере одним видимым поражением НМВ. – Мишени СМВ были определены одним экспертом по СМВ. |
| Sarica, 201937 | Ретроспективное одноцентровое исследование | ЦДУЗИ | 78 | ТУЗИ Б | – Комбинация В-режима, CDUS и ППСА показала самую высокую специфичность выявления РПЖ (80%) по сравнению с каждым отдельным методом. – Чувствительность, положительная и отрицательная прогностическая ценность комбинации составляли 64%, 64% и 80% соответственно. |
– Субъективная оценка сосудистости. – Отсутствие отдельной записи ЦДУЗИ-изображений для каждого биопсийного участка. |
| Vezelis Alvydas, 202049 | Проспективное одноцентровое исследование | HistoScanning | 200 | 20-контактная ТПШК БП | – Чувствительность, специфичность и AUC для выявления КЗРП (ГО⩾3 или МДОО ⩾6 мм в одном месте или ОДОО ⩾10 мм во всех местах) с помощью HistoScanning ПЖ составляли 61,9%, 27,85% и 0,39. – Статистической разницы в результатах HistoScanning ПЖ между группами с объемом предстательной железы менее 60 см3 и более 60 см3 не выявлено. |
– Без слепых испытаний. |
| Glybochko, 201913 | Проспективное одноцентровое исследование | HistoScanning | 611 | ТУЗИ БП (12-контактная МБ + 1 HistoScanning ПБ на поражение) | – При подозрении на РПЖ частота выявления методом HistoScanning ПЖ на одного пациента составляла 87% при HistoScanning ПЖ-ИТ против 59% при МБ (p < 0,001). – При подозрении на РПЖ частота выявления методом HistoScanning ПЖ на одно поражение составляла 68% при HistoScanning ПЖ-ИТ по сравнению с 25% при МБ (p < 0,001). – При подозрении на РПЖ частота выявления шестой группы по Глисону на одного пациента с помощью HistoScanning ПЖ-ИТ была значительно ниже, чем при МБ (23,4% по сравнению с 32,4%, р = 0,002). |
– Выбор места расположения HistoScanning ПЖ-ИТ зависит от оператора. – Без слепых испытаний. – Не соответствует требованиям STARD. |
| Simmons, 201846 | Проспективное одноцентровое исследование | HistoScanning | 330 | ТПШК | – Чувствительность, специфичность и AUC для КЗРП (МДОО ⩾6 мм и оценка по Глисону ⩾4+3) при выявлении с помощью HistoScanning ПЖ составляли 70,3%, 14,7% и 0,43 соответственно. – Размер железы и объем поражения, оцененные между двумя временными точками с помощью одного и того же датчика, не были стабильными. – Плохая точность у мужчин, нуждающихся в дальнейшей биопсии. |
– После ТУЗИ БП набирали только мужчин с клиническим подозрением на пропущенный РПЖ или неправильную классификацию. – Технические сбои с устройством HistoScanning ПЖ и, как следствие, потеря данных для отчетности. – Техника таргетирования в режиме реального времени была недоступна. |
| Sharen and Zhang, 2022107 | Ретроспективное одноцентровое исследование | УЗИУК | 46 | 6-контактная МБ + от 2 до 4-контактная ПБ |
– Чувствительность, специфичность и точность выявления РПЖ составляли 66,7%, 60% и 65,2% для УЗИУК и 84,2%, 81,3% и 83,3% для СВЭ соответственно. | – Ретроспективная модель исследования с небольшим размером выборки. – Субоптимальный референтный стандарт. – Разница в количестве взятых биопсийных материалов между УЗИУК и СВЭ была статистически значимой. |
| Baur, 2018108 | Проспективное одноцентровое исследование | УЗИУК | 92 | 2-контактная МРТ/УЗИ фюжин ПБ | – Время до пика, измеренное во время УЗИУК, показало значительные различия между доброкачественным поражением и РПЖ в периферической зоне (AUC 0,65, чувствительность 69% и специфичность 63,3% при оптимальном значении отсечения). | – Все пациенты имели по крайней мере один отрицательный анамнез БП. – Субоптимальный референтный стандарт. |
| Wildeboer, 201714 | Ретроспективное исследование | УЗИУК | 19 | РП гистология | – Чувствительность, специфичность и точность для злокачественных пикселей составляли 79%, 80% и 81% для комбинации четырех различных параметров, связанных с перфузией и дисперсией. | – Ретроспективная модель исследования с небольшим размером выборки. – Гистология биопсийного материала выделенного при РП как референтный стандарт потенциально приводит к предвзятости отбора. |
| Eldred-Evans, 2021109 | Проспективное популяционное скрининговое исследование | Эластография (СВЭ) | 403 | 12-контактная МБ + B-mode/СВЭ ПБ + МРТ/ УЗИ ПБ |
– По сравнению со скринингом ПСА (⩾3 нг/мл), В-режим + СВЭ не показал лучшей скрининговой эффективности, чем скрининг только ПСА. | – Участникам без положительных результатов скрининга биопсию не проводили. |
| Liang, 2021110 | Одноцентровое ретроспективное исследование | Эластография (СВЭ) | 112 | 12-контактная МБ + 1-2 B-mode/СВЭ ПБ |
– AUC радиометрических признаков В-режима, СВЭ и комбинации В-режима и СВЭ составляли 0,74, 0,80 и 0,85 для выявления РПЖ соответственно. – Чувствительность и специфичность комбинации радиометрических признаков В-режима и СВЭ составили 77% и 80% соответственно. – При сочетании радиометрической модели с клинической (возраст и ППСА в качестве параметров) AUC возросла до 0,90. |
– Влияние зональной разницы (ПЗ против ТЗ) не учитывалось для оценки СВЭ. – Субоптимальный референтный стандарт. |
| Fu, 202073 | Одноцентровое проспективное исследование | Эластография (СВЭ) | 221 | 12-контактная МБ + ТУЗИ или СВЭ или МРТ/УЗИ-Управляемая ПБ | – Чувствительность и специфичность, определенные по максимальному индексу Юдена для выявления КЗРП (ГО⩾2 и % рака в биопсии >50%), составляли 66,2% и 96,1% соответственно. – Для выявления КЗРП, AUC СВЭ была значительно выше, чем МРТ (0,868 против 0,780, p = 0,013). |
– Переходная зона и центральная зона не были включены. – Субоптимальный эталон. |
| Ji, 2019111 | Одноцентровое проспективное исследование | Эластография (СВЭ) | 215 | 12-контактная МБ + ТУЗИ ПБ | – Модуль упругости Юнга (Emax, Emean и Emin) был значительно выше при злокачественном поражении, чем при доброкачественном. – Чувствительность Emax, Emean и Emin составляла 77,88%, 81,42% и 60,18% соответственно, а специфичность – 85,33%, 74,51% и 63,73% соответственно. – Как ШГ, так и ПСА продемонстрировали положительную корреляцию с Emax и Emean. |
– Вероятно, жесткость предстательной железы была недооценена методом. – Субоптимальный референтный стандарт. |
| Xiang, 201974 | Одноцентровое ретроспективное исследование | Эластография (СВЭ) | 356 | 8-20 контактная ТУЗИ – Б | – Чувствительность, специфичность и AUC составляли 78,3%, 62,4% и 0,7 соответственно для клинически значимого РПЖ. – СВЭ имеет более низкую диагностическую ценность, чем МРТ. |
– Клинически значимый РПЖ из центральной зоны не анализировали, поскольку СВЭ проводили только в периферической зоне. – Для биопсии и оценки СВЭ использовалось разное оборудование. |
| Ding, 2019112 | Одноцентровое ретроспективное исследование | Эластография | 125 | 12-контактная МБ + Эластография ПБ | – Когда точка отсечения при эластографическом Q-анализе составляла 1,95 для дифференциации злокачественных и доброкачественных поражений простаты, чувствительность, специфичность и AUC составляли 83,5%, 84,4% и 0,87, соответственно. | – Большая доля двусторонних или диффузных поражений РПЖ. – Отсутствует внутренняя/внешняя валидация. – Для достижения хорошей кривой оценки эластографического Q-анализа оператор должен быть должным образом обучен. |
| Lughezzani, 2021113 | Одноцентровое проспективное исследование | Микро-УЗИ | 320 | 6-8⩽ контактов МБ + 2⩽ контактов на одно поражение МРТ/УЗИ фюжин ПБ + 1⩽ контактов на одно поражение Микро-УЗИ ПБ | – Чувствительность и специфичность Микро-УЗИ для выявления КЗРП на одного пациента составила 89,7% и 26,0% соответственно. – 2,6% случаев КЗРП было выявлено только с помощью Микро-УЗИ ПБ, тогда как 2,6% случаев КЗРП было выявлено только с помощью мпМРТ ПБ. – Рост показателя PRI-MUS был независимым предиктором КЗРП. |
– Предвзятость наблюдателя ввиду того, что все пациенты имели подозрительное поражение на МРТ (PIRADS ⩾3). – Количество рандомизированных и управляемых биопсий не было стандартизировано. – Идеальный референтный стандарт, такой как трансперинеальная шаблонная картографическая биопсия, не использовался. |
| Wiemer, 202188 | Одноцентровое проспективное исследование | Микро-УЗИ | 159 | мпМРТ управляемая (2-3 контактная) и неуправляемая (8-9⩾ контактная) биопсии | – Чувствительность и специфичность Микро-УЗИ для выявления КЗРП составляла 95% и 15% соответственно. – Микро-УЗИ ПБ выявила более высокий уровень ГО, чем в неуправляемых биопсиях в 26%, по сравнению с неуправляемыми и МРТ-управляемыми биопсиями (16%). Микро-УЗИ таргетирование привело к большему повышению на 9,4% уровня ГО, чем мпМРТ таргетирование (p = 0,005). |
– Все участники имели положительные результаты мпМРТ. – Предвзятость обусловлена эффектом кривой обучения. – Большее количество мишеней и увеличение выявления рака благодаря включению всех пациентов с показаниями к биопсии простаты, даже тех, которые находятся на активном наблюдении. |
| Chessa, 2021114 | Одноцентровое проспективное исследование | Микро-УЗИ | 68 | 3-5 контактная мпМРТ-управляемая фюжин биопсия | – Чувствительность, специфичность и AUC Микро-УЗИ в выявлении КЗРП составляли 68%, 73% и 0,71 соответственно. – Чувствительность, специфичность и AUC Микро-УЗИ в выявлении КЗРП, расположенных в периферической зоне, составляли 74%, 75% и 0,75 соответственно. |
– В исследование были включены только пациенты с диагнозом РПЖ, установленным с помощью МРТ фюжин БП. – Отсутствие опыта работы с аппаратами Микро-УЗИ и протоколом PRI-MUS. – Неоптимальный референтный стандарт. |
| Avolio, 2021115 | Одноцентровое ретроспективное исследование | Микро-УЗИ | 111 | МРТ/УЗИ фюжин управляемая биопсия | – Чувствительность и специфичность Микро-УЗИ в выявлении КЗРП составляла 100% и 33,7% соответственно. – Оценка по шкале PRI-MUS ⩾3 была независимым предиктором КЗРП (OR = 4,22, p = 0,001). – Микро-УЗИ потенциально способна стратифицировать наличие РПЖ у пациентов с неоднозначным результатом МРТ. |
– Предвзятость операционного отбора, поскольку все пациенты имели по крайней мере одно поражение PIRADS3. – Неоптимальный референтный стандарт. |
| Klotz, 202092 | Проспективное многоцентровое исследование | Микро-УЗИ | 1040 | ТУЗИ БП (12- to 14-контактная МБ и 2- to 3-контактная с мпМРТ и Микро-УЗИ ПБ) | – Микро-УЗИ имеет сопоставимую или более высокую чувствительность (94% против 90%, p = 0,03) для КЗРП по сравнению с мпМРТ, с похожей специфичностью (22% против 22%, p = 0,45). | – Вариативность кривых обучения между центрами. – Между сайтами существовали значительные методологические различия. – 7 из 11 центров МРТ не были “ослеплены” во время проведения оценки УЗИ. |
| Claros, 202084 | Одноцентровое ретроспективное исследование | Микро-УЗИ | 47 | 12-контактная МБ + 3-контактная ПБ | В управляемых биопсиях при применении Микро-УЗИ было выявлено больше КЗРП, чем при применении роботизированной МРТ/УЗИ фюжины БП (38% против 23%, р = 0,02). – КЗРП было бы пропущено у 2% пациентов в группе Микро-УЗИ и 9% в группе роботизированной МРТ/УЗИ фюжины БП. |
– Ретроспективный характер и отсутствие рандомизации. – Включены только пациенты с подозрением на РПЖ на мпМРТ. – Субоптимальный референтный стандарт. |
| Rodriguez Socarrás, 2020116 | Одноцентровое ретроспективное исследование | Микро-УЗИ | 194 | Ginsburg МБ + 5-контактная Микро-УЗИ ПБ + 5-контактнаяМРТ/УЗИ фюжин ПБ (если PIRADS ⩾3) | – Микро-УЗИ выявила 12/108 (11%) раков предстательной железы, которые были пропущены всеми другими методами, из которых 11 (92%) были КЗРП. – Чувствительность, специфичность, ППЗ и ОПЗ Микро-УЗИ ПЖ для выявления КЗРП на одного пациента были равномерно выше, чем мпМРТ (99,7%, 23,1%, 46,0% и 99,2%). – PIRADS и PRI-MUS были сильными предикторами КЗРП в логистической регрессионной модели. |
– Нет предыдущего опыта применения микро-УЗИ. – Предвзятость из-за отсутствия рандомизации и контрольной группы. |
| Abouassaly, 2020117 | Одноцентровое исследование | Микро-УЗИ | 67 | 12-контактная МБ + 2- до 3-контактная мпМРТ ПБ + Микро-УЗИ ПБ | – Микро-УЗИ таргетирование значительно увеличило среднюю группу выявленного рака (p <0,01) по сравнению с обычным методом. | – Нет предыдущего опыта применения Микро-УЗИ. – Единственный центр с отсутствием “слепого исследования” и рандомизации. – Невозможность сравнить значение Микро-УЗИ и мпМРТ из-за малого размера выборки. |
| Grey, 2022102 | Многоцентровое проспективное парное когортное исследование | мпУЗИ (B-mode + КУДВ+ elastography + УЗИУК) | 306 | 3-контактная мпУЗИ ПБ + 3-контактная мпМРТ когнитивно фюжин ПБ на поражение | – Положительная согласованность тестов между мпУЗИ и мпМРТ составила 73,2% (κ = 0,06). – Выявление КЗРП только с помощью мпУЗИ, только мпМРТ и комбинации мпУЗИ и мпМРТ составило 26%, 30% и 32% соответственно. – 7% КЗРП были обнаружены исключительно с помощью только мпУЗИ, тогда как 20% КЗРП были обнаружены исключительно с помощью мпМРТ. |
– Оценка мпМРТ базировалась на системе Лайкерта вместо PIRADS. – Каждое УЗИ оценивалось по стандартизированной шкале Лайкерта, но общий балл поражения выставлялся на усмотрение докладчика. |
| Postema, 202096 | Многоцентровое проспективное исследование | мпУЗИ (B-mode + УЗИУК + КУДВ) | 133 | РП гистология | – Чувствительность, специфичность и AUC для выявления КЗРП составляли 81%, 64% и 0,78 для УЗИУК, 83%, 56% и 0,79 для КУДВ и 83%, 55% и 0,78 для комбинации соответственно. – Согласованность между наблюдателями для УЗИУК, КУДВ и комбинации показала взвешенные значения Fleiss’ kappa 0,20, 0,18 и 0,18 соответственно. |
– Наблюдатели, менее подготовленные к оценке УЗИУК или КУДВ. – Произвольно выбранная оценка по шкале Лайкерта. – Гистология биопсийного материала выделенного при РП в качестве референтного стандарта потенциально приводит к предвзятости выбора. |
| Wildeboer, 202097 | Ретроспектива одного центра | мпУЗИ (B-mode + СВЭ + УЗИУК) | 48 | РП гистология | – мпУЗИ классификатор для выявления КЗРП с использованием алгоритма случайного леса показал более высокую региональную AUC, чем лучший отдельный радиомический параметр УЗИ (0,90 против 0,76). – Эффективные радиометрические признаки УЗИ, полученные из В-режима, эластографии и УЗИУК, не коррелировали между собой, следовательно, могут быть кумулятивными. |
– Одноцентровое ретроспективное исследование с небольшим размером выборки. – Гистология биопсийного материала выделенного при РП как референтный стандарт потенциально приводит к предвзятости выбора. |
| Morris, 202098 | Ретроспективное исследование | мпУЗИ (B-mode + ИВСАИ + СВЭ + QUS) | 35 | РП гистология | – мпУЗИ, оцененная методом ЛОВ, достоверно превосходила В-режим и СВЭИ по показателям видимости поражения ПЖ (контраст, ВКШ и уВКШ), а также превосходил СД по показателям контраста и ВКШ и превосходил ИВСАИ по показателю ВКШ. | – Одноцентровое ретроспективное исследование с небольшим размером выборки. – Гистология биопсийного материала, полученного при РПЖ, как референтный стандарт, потенциально приводит к смещению отбора. |
| Drudi, 201999 | Проспективное исследование | мпУЗИ (B-mode + КУДВ+ УЗИУК + Эластография) | 82 | МРТ/УЗИ фюжин 12 контактная МБ + 2 контактная ПБ | – Чувствительность, специфичность и точность для выявления РПЖ составляли 56,5%, 61,1% и 58,5% для В-режима, 43,5%, 38,9% и 41,5% для ЦДУЗИ, 40,0%, 97. 2% и 63,4% для количественного анализа УЗИУК, 82,8%, 66,6% и 76,8% для эластографии и 95,6%, 88,9% и 92,7% для мпМРТ соответственно | – Об эффективности комбинации методов УЗИ не сообщалось. – Субоптимальный референтный стандарт (нет мпУЗИ ПБ). |
| Zhang, 201994 | Проспективное сравнительное исследование между мпУЗИ и мпМРТ | мпУЗИ (B-mode + КУДВ+ СВЭ + УЗИУК) | 78 | 12-контактная МБ | – Чувствительность, специфичность и AUC для выявления локализованного РПЖ составляли 97,4%, 77,5% и 0,87 для мпУЗИ, 83%, 56% и 0,79 для КУДВ и 94,7%, 60% и 0,77 для мпМРТ соответственно. | – Неоптимальный эталон (нет управляемой БП и шаблонной БП). |
| Mannaerts, 201995 | Одноцентровое проспективное исследование | мпУЗИ (B-mode + СВЭ + УЗИУК) | 48 | РП гистология | – мпУЗИ показала 74% СИ-специфическую чувствительность и 59% специфичность для выявления КЗРП. – Чувствительность мпУЗИ была значительно выше по сравнению с любым отдельным методом УЗИ (В-режим, СВЭ или УЗИУК). – Чувствительность мпУЗИ была выше для ПЗ, чем для ТЗ (80% против 67%). – Частота выявления индексного поражения для мпУЗИ составляла 88%, тогда как для В-режима, СВЭ и УЗИУК – 72%, 70% и 73% соответственно. – Коэффициент α Криппендорфа для мпУЗИ составлял 0,33 при пороговом балле по шкале Лайкерта ⩾3 и 0,46 при пороговом балле по шкале Лайкерта ⩾4. |
– Гистология биопсийного материала, полученного во время РП, как референтный стандарт потенциально приводит к погрешности отбора. |
КАИНС, компьютеризированный анализ искусственных нейронных сетей; ИВСАИ, импульсная визуализация силы акустического излучения; AUC, площадь под кривой; B-режим, режим яркости; ЦДУЗИ, цветная допплеровская ультрасонография; УЗИУК, ультрасонография с контрастным усилением; ОКШ, отношение контраст/шум; КЗРПЖ, клинически значимый рак предстательной железы; КУДВ, контрастная ультразвуковая дисперсионная визуализация; оОКШ, обобщенное отношение контраст/шум;ГО, группа оценки; ШГ, шкала Глисона; МДОО, максимальная длина опухолевого очага; СД, средний диапазон; мпМРТ, мультипараметрическая магнитно-резонансная томография; мпУЗИ, мультипараметрическая ультрасонография; МРТ, магнитно-резонансная томография; ОПЗ, отрицательное прогностическое значение; ОШ, отношение шансов; БП, биопсия простаты; РПЖ, рак предстательной железы; МУД, мощная ультразвуковая допплерография; HistoScanning ПЖ, гистосканирование простаты; PIRADS, система отчетности и данных о визуализации простаты; ППЗ, положительное прогностическое значение; PRI-MUS, идентификация риска простаты с помощью микроультразвука; ПСА, простат-специфический антиген; ППСА, плотность простат-специфического антигена; ПЗ, периферическая зона; ЗИ, зона интереса; РП, радикальная простатэктомия; МБ, мультифокальная биопсия; СМВ, Сверхсовременная микрососудистая визуализация; STARD, стандарты отчетности исследований диагностической точности; МОВ, машина опорных векторов; СВЭ, сдвиговолновая эластография; СВЭВ, сдвиговолновая эластичная визуализация; ПБ, прицельная биопсия; ООДО, общая длина опухолевого очага; ТУЗИ, трансректальное ультразвуковое исследование; ИТ, истинное таргетирование; ТПШК, шаблонное трансперинеальное картирование; ТЗ, транзитная зона; УЗИ, ультрасонография.
Неизвестно, превосходит ли мпУЗИ даже мпМРТ, поскольку до сих пор только несколько исследований непосредственно сравнивали эти методы.94,99,102 Все еще требуются многоцентровые и рандомизированные контролируемые исследования для их сравнения с большим размером выборки. Некоторые аспекты, такие как более низкая стоимость, визуализация в режиме реального времени, возможность применения для некоторых пациентов (например, с клаустрофобией или протезом бедра), которые не могут пройти мпМРТ, а также доступность в офисных условиях, являются очевидными преимуществами мпУЗИ по сравнению с мпМРТ.
Как интегрировать многофакторные результаты каждого метода УЗИ может сильно повлиять на эффективность мпУЗИ, поэтому это важно учитывать. Некоторые исследователи просто добавляли прицельную биопсию к подозрительному поражению ПЖ при любом методе УЗИ. 18,19 Эта стратегия повышает чувствительность и ОПЗ, в то время как она снижает специфичность и ППЗ. 22 Другие исследователи сначала сканировали простату с помощью напряженной эластографии для выявления ЗИ, а затем проверяли, является ли ЗИ подозрительным на рак на УЗИУК. 21 Эта стратегия приводит к повышению специфичности/ППЗ и снижению чувствительности/ОПЗ. 22 Для оптимизации производительности мпУЗИ некоторые исследователи использовали методы оценивания типа Лайкерта,95,96,99 а другие оценивали наличие некоторых особенностей изображения.94 Однако, даже когда использовались методы оценивания типа Лайкерта, относительно низкая согласованность между читателями мПУЗИ оставалась недостатком.95,96,118 Это может быть частично связано с нестандартизированным процессом считывания мпУЗИ и отсутствием хорошо проверенной и объективной системы оценивания. В настоящее время подход машинного обучения позволяет автоматизировать распознавание изображений и предоставлять количественные оценки большого количества сложных радиографических характеристик. 119 Глубокое обучение, подмножество машинного обучения, уже продемонстрировало диагностическую эффективность, эквивалентную эффективности медицинских работников. 120 Для достижения более точных и воспроизводимых ультразвуковых оценок, как показали Wildeboer и соавт. 97 and Morris и др. 98 в своих исследованиях, применение метода машинного обучения на многофакторных рентгенологических признаках мпУЗИ. 119, 121 Чтобы преодолеть ограничения метода машинного обучения, процесс обучения должен быть интерпретирован человеком, количество радиометрических признаков, подлежащих оценке, должно быть минимальным, а также необходима биологическая интерпретация/валидация радиометрических признаков. 122 Хотя 25% КРЗП могут быть пропущены мпМРТ, 123 мпУЗИ выявляет КРЗП, которые были пропущены мпМРТ.94 Интегрированная оценка результатов мпУЗИ и мпМРТ может стать захватывающей концепцией будущего (Рисунок 3).
Рисунок 3. Репрезентативное изображение отрицательного результата на мпМРТ, но положительного на мпУЗИ. 46-летний мужчина с ПСА 7,0 нг/мл на активном наблюдении по поводу рака ГО1. Хотя наблюдательная МРТ не выявила подозрительного поражения ПЖ, ТУЗИ в В-режиме, ЦДУЗИ и ПУД выявили подозрительное поражение ПЖ размером 1,3 см × 0,7 см в левой части основания простаты. Раннего усиления на УЗИУК не выявлено. Систематическая биопсия + прицельная биопсия подозрительного очага РПЖ выявила РПЖ ГО2 слева от основания до середины простаты. Пациенту было выбрано левостороннее геми-ВИСУ как окончательное лечение РПЖ. После операции уровень ПСА снизился до 3,6 нг/мл, повторная мпМРТ не выявила поражений, подозрительных на КЗРП (левые рисунки). Однако с помощью ТУЗИ в В-режиме, ЦДУЗИ и МУД обнаружено подозрительную HEL размером 1 см × 0,7 см в левой передне-верхушечной области предстательной железы (стрелка на правом рисунке). Прицельная биопсия HEL выявила рецидив РПЖ ГО2. Пациенту выполнили спасительную роботизированную РП. На гистологическом образце РП подтверждено поражение РПЖ ГО2 с экстрапростатическим распространением в левой передней области (зелеными точками показано картирование РПЖ).
ADC, коэффициент видимой диффузии; B-mode режим яркости; CDUS, цветное допплеровское ультразвуковое исследование; УЗИУК, ультразвуковое исследование с контрастным усилением; КЗРП, клинически значимый рак предстательной железы; DCE, динамическое контрастное изображение; DWI, диффузионно-взвешенное изображение; GG – группа оценки; ГП, гипоэхогенное поражение; ВИСУ, высокоинтенсивное сфокусированное ультразвуковое исследование; мпМРТ, мультипараметрическая магнитно-резонансная томография; мпУЗИ, мультипараметрическое ультразвуковое исследование; РП, рак предстательной железы; PDUS, силовое допплеровское ультразвуковое исследование; ПСА, простат-специфический антиген; RP, радикальная простатэктомия; T2WI, взвешенное изображение; ТУЗИ, трансректальное ультразвуковое исследование.
Заключение
За последние 5 лет мпУЗИ экспоненциально возросла популярность в урологии и радиологии. Несколько последних исследований показали, что мпУЗИ имеет потенциал для обеспечения более надежного выявления КЗРП и направления для БП и ОТ. Кроме того, некоторые аспекты, такие как более низкая стоимость, визуализация в реальном времени, применение для некоторых пациентов, имеющих противопоказания для мпМРТ, и доступность в офисных условиях, являются явными преимуществами мпУЗИ. Подход на основе машинного обучения и интеграция радиометрических особенностей могут улучшить диагностическую эффективность мпУЗИ. Необходимо провести многоцентровые рандомизированные контролируемые исследования для непосредственного сравнения диагностической эффективности мпУЗИ и мпМРТ.
ORCID iDs
Masatomo Kaneko https://orcid.org/0000-0002-1205-807X
Aref S. Sayegh https://orcid.org/0000-0001-9320-2987
Anibal La Riva Rincon https://orcid.org/0000-0003-2198-833X
Maria Lizana https://orcid.org/0000-0002-0648-6043
Andre Luis Abreu https://orcid.org/0000-0002-9167-2587
Примечания
|
Этическое одобрение и согласие на участие |
Не применяется. |
|
Согласие на публикацию |
От пациентов было получено письменное информированное согласие на публикацию. |
|
Вклад авторов |
Masatomo Kaneko: Концептуализация; Курация данных; Формальный анализ; Исследование; Методология; Ресурсы; Визуализация; Написание – оригинальный проект; Написание – рецензирование и редактирование. Maria Sarah L. Lenon: Курация данных; Формальный анализ; Исследование; Ресурсы; Визуализация; Написание – оригинальный проект; Написание – рецензирование и редактирование. Lorenzo Storino Ramacciotti: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Luis G. Medina: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Aref S. Sayegh: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Anibal La Riva Rincon: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Laura C. Perez: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Alireza Ghoreifi: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Maria Lizana: Курация данных; Формальный анализ; Исследование; Написание – оригинальный проект; Написание – рецензирование и редактирование. Donya S. Jadvar: Написание – рецензирование и редактирование. Amir H. Lebastchi: Концептуализация; исследования; методология; администрирование проекта; надзор; написание – рецензирование и редактирование. Giovanni E. Cacciamani: Концептуализация; исследования; методология; администрирование проекта; надзор; написание – рецензирование и редактирование. Andre Luis Abreu: Концептуализация; Курация данных; Формальный анализ; Исследование; Методология; Администрирование проекта; Ресурсы; Надзор; Визуализация; Написание – рецензирование и редактирование. |
|
Финансирование |
Авторы не получали никакой финансовой поддержки для проведения исследований, написания и/или публикации этой статьи. |
|
Конкурирующие интересы |
Авторы заявили о следующих потенциальных конфликтах интересов, связанных с исследованием, авторством и/или публикацией этой статьи: A.L.A. является врачом-консультантом Koelis. |
|
Доступность данных и материалов |
Не применяется. |
Список литературы
|
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021; 71: 209–249. |
|
|
Cooperberg MR, Lubeck DP, Meng MV, et al. The changing face of low-risk prostate cancer: trends in clinical presentation and primary management. J Clin Oncol 2004; 22: 2141–2149. |
|
|
Smeenge M, Barentsz J, Cosgrove D, et al. Role of transrectal ultrasonography (TRUS) in focal therapy of prostate cancer: report from a consensus panel. BJU Int 2012; 110: 942–948. |
|
|
Turkbey B, Pinto PA, Choyke PL. Imaging techniques for prostate cancer: implications for focal therapy. Nat Rev Urol 2009; 6: 191–203. |
|
|
Stabile A, Giganti F, Rosenkrantz AB, et al. Multiparametric MRI for prostate cancer diagnosis: current status and future directions. Nat Rev Urol 2020; 17: 41–61. |
|
|
Kaneko M, Sugano D, Lebastchi AH, et al. Techniques and outcomes of MRI-TRUS fusion prostate biopsy. Curr Urol Rep 2021; 22: 27. |
|
|
Sugano D, Kaneko M, Yip W, et al. Comparative effectiveness of techniques in targeted prostate biopsy. Cancers 2021; 13: 1449. |
|
|
Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2. Eur Urol 2019; 76: 340–351. |
|
|
Das CJ, Razik A, Netaji A, et al. Prostate MRI–TRUS fusion biopsy: a review of the state of the art procedure. Abdom Radiol 2020; 45: 2176–2183. |
|
|
Venderink W, de Rooij M, Sedelaar JPM, et al. Elastic versus rigid image registration in magnetic resonance imaging–transrectal ultrasound fusion prostate biopsy: a systematic review and meta-analysis. Eur Urol Focus 2018; 4: 219–227. |
|
|
Hale GR, Czarniecki M, Cheng A, et al. Comparison of elastic and rigid registration during magnetic resonance imaging/ultrasound fusion-guided prostate biopsy: a multi-operator phantom study. J Urol 2018; 200: 1114–1121. |
|
|
Ashi K, Kirkham B, Chauhan A, et al. Quantitative colour Doppler and greyscale ultrasound for evaluating prostate cancer. Ultrasound 2021; 29: 106–111. |
|
|
Glybochko PV, Alyaev YG, Amosov AV, et al. Evaluation of prostate HistoScanning as a method for targeted biopsy in routine practice. Eur Urol Focus 2019; 5: 179–185. |
|
|
Wildeboer RR, Postema AW, Demi L, et al. Multiparametric dynamic contrast-enhanced ultrasound imaging of prostate cancer. Eur Radiol 2017; 27: 3226–3234. |
|
|
Correas JM, Tissier AM, Khairoune A, et al. Prostate cancer: diagnostic performance of real-time shear-wave elastography. Radiology 2015; 275: 280–289. |
|
|
Lughezzani G, Saita A, Lazzeri M, et al. Comparison of the diagnostic accuracy of micro-ultrasound and magnetic resonance imaging/ultrasound fusion targeted biopsies for the diagnosis of clinically significant prostate cancer. Eur Urol Oncol 2019; 2: 329–332. |
|
|
Dias AB, O’Brien C, Correas J-M, et al. Multiparametric ultrasound and micro-ultrasound in prostate cancer: a comprehensive review. Br J Radiol 2022; 95: 20210633. |
|
|
Nelson ED, Slotoroff CB, Gomella LG, et al. Targeted biopsy of the prostate: the impact of color Doppler imaging and elastography on prostate cancer detection and Gleason score. Urology 2007; 70: 1136–1140. |
|
|
Xie SW, Li HL, Du J, et al. Contrast-enhanced ultrasonography with contrast-tuned imaging technology for the detection of prostate cancer: comparison with conventional ultrasonography. BJU Int 2012; 109: 1620–1626. |
|
|
Aigner F, Schäfer G, Steiner E, et al. Value of enhanced transrectal ultrasound targeted biopsy for prostate cancer diagnosis: a retrospective data analysis. World J Urol 2012; 30: 341–346. |
|
|
Brock M, EГОert T, Palisaar RJ, et al. Multiparametric ultrasound of the prostate: adding contrast enhanced ultrasound to real-time elastography to detect histopathologically confirmed cancer. J Urol 2013; 189: 93–98. |
|
|
Postema A, Mischi M, de la Rosette J, et al. Multiparametric ultrasound in the detection of prostate cancer: a systematic review. World J Urol 2015; 33: 1651–1659. |
|
|
Grey A, Ahmed HU. Multiparametric ultrasound in the diagnosis of prostate cancer. Curr Opin Urol 2016; 26: 114–119. |
|
|
Mottet N, Cornford P, van der Bergh R, et al. EAU-EANM-ESTRO-ESUR-SIOG guidelines on prostate cancer. European Association of Urology, 2022, https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP_SIOG-Guidelines-on-Prostate-Cancer-2022_2022-04-25-063938_yfos.pdf (accessed 19 October 2022). |
|
|
Azizi S, Mousavi P, Yan P, et al. Transfer learning from RF to B-mode temporal enhanced ultrasound features for prostate cancer detection. Int J Comput Assist Radiol Surg 2017; 12: 1111–1121. |
|
|
Moradi M, Mousavi P, Abolmaesumi P. Computer-aided diagnosis of prostate cancer with emphasis on ultrasound-based approaches: a review. Ultrasound Med Biol 2007; 33: 1010–1028. |
|
|
Porter CR, Wolff EM. Prostate ultrasound volume 22. New York, NY: Springer, 2015. |
|
|
Meiburger KM, Acharya UR, Molinari F. Automated localization and segmentation techniques for B-mode ultrasound images: a review. Comput Biol Med 2018; 92: 210–235. |
|
|
Postema AW, Scheltema MJV, Mannaerts CK, et al. The prostate cancer detection rates of УЗИУК-targeted versus MRI-targeted versus systematic TRUS-guided biopsies in biopsy-naïve men: a prospective, comparative clinical trial using the same patients. BMC Urol 2017; 17: 27. |
|
|
Correas JM, Halpern EJ, Barr RG, et al. Advanced ultrasound in the diagnosis of prostate cancer. World J Urol 2021; 39: 661–676. |
|
|
Steinkohl F, Luger AK, Pichler R, et al. Visibility of MRI prostate lesions on B-mode transrectal ultrasound. Med Ultrason 2018; 20: 441–445. |
|
|
Chen FK, de Castro Abreu AL, Palmer SL. Utility of ultrasound in the diagnosis, treatment, and follow-up of prostate cancer: state of the art. J Nucl Med 2016; 57(Suppl. 3): 13S–18S. |
|
|
Zhu YC, Shan J, Zhang Y, et al. Prostate cancer vascularity: Superb microvascular imaging ultrasonography with histopathology correlation. Med Sci Monit 2019; 25: 8571–8578. |
|
|
Westendarp M, Postema A, de la, Rosette JJ, et al. Advances in ultrasound techniques for the diagnosis and staging of prostate cancer. Elastography, Doppler ultrasound, ultrasound contrast media, ultrasound quantification media and MRI fusion. Arch Esp Urol 2015; 68: 307–315. |
|
|
Kuligowska E, Barish MA, Fenlon HM, et al. Predictors of prostate carcinoma: accuracy of gray-scale and color Doppler US and serum markers. Radiology 2001; 220: 757–764. |
|
|
Zeng S, Wu S, Chen C, et al. Performance characteristics of 3-D power Doppler ultrasound (3-D-PD) with the virtual organ computer-aided analysis (VOCAL) technique in the detection of prostate cancer. Ultrasound Med Biol 2022; 48: 91–97. |
|
|
Sarıca Ö. Contribution of color Doppler sonography in the diagnosis of prostatic pathologies. South Clin Istanbul Eurasia 2019; 30: 255–260. |
|
|
Ukimura O, de Castro Abreu AL, Gill IS, et al. Image visibility of cancer to enhance targeting precision and spatial mapping biopsy for focal therapy of prostate cancer. BJU Int 2013; 111: E354–E364. |
|
|
Matsugasumi T, Iwata T, Yamada Y, et al. Intraoperative ultrasound monitoring with superb microvascular imaging in focal cryotherapy for prostate cancer. J Med Ultrason 2022; 49: 497–498. |
|
|
Ohashi M, Shiraishi T, Fujihara A, et al. Detection of relatively poor but definitive blood supply in prostate stromal sarcoma using transrectal ultrasonography with superb microvascular imaging. Int Cancer Conf J 2022; 11: 215–218. |
|
|
Boku H, Kaneko M, Yamada Y, et al. Microwave focal therapy of prostate cancer: a non-clinical study and exploratory clinical trial. BJU Int. Epub ahead of ahead of print 26 May 2022. Crossref. |
|
|
Morozov A, Kozlov V, Rivas JG, et al. A systematic review and meta-analysis of Histoscanning™ in prostate cancer diagnostics. World J Urol 2021; 39: 3733–3740. |
|
|
Braeckman J, Autier P, Garbar C, et al. Computer-aided ultrasonography (HistoScanning): a novel technology for locating and characterizing prostate cancer. BJU Int 2008; 101: 293–298. |
|
|
Wysock JS, Xu A, Orczyk C, et al. HistoScanning™ to detect and characterize prostate cancer – a review of existing literature. Curr Urol Rep 2017; 18: 97. |
|
|
Scattoni V, Zlotta A, Montironi R, et al. Extended and saturation prostatic biopsy in the diagnosis and characterisation of prostate cancer: a critical analysis of the literature. Eur Urol 2007; 52: 1309–1322. |
|
|
Simmons LAM, Kanthabalan A, Arya M, et al. Prostate imaging compared to transperineal ultrasound-guided biopsy for significant prostate cancer risk evaluation (PICTURE): a prospective cohort validating study assessing prostate HistoScanning. Prostate Cancer Prostatic Dis 2019; 22: 261–267. |
|
|
Braeckman J, Autier P, Soviany C, et al. The accuracy of transrectal ultrasonography supplemented with computer-aided ultrasonography for detecting small prostate cancers. BJU Int 2008; 102: 1560–1565. |
|
|
Schiffmann J, Tennstedt P, Fischer J, et al. Does HistoScanning™ predict positive results in prostate biopsy? A retrospective analysis of 1,188 sextants of the prostate. World J Urol 2014; 32: 925–930. |
|
|
Vezelis Alvydas A, Platkevicius G, Kincius KM, et al. Prostate 3D ultrasound-guided imaging device (HistoScanning) performance detecting clinically significant prostate cancer. J BUON 2020; 25: 460–463. |
|
|
Macek P, Barret E, Sanchez-Salas R, et al. Prostate histoscanning in clinically localized biopsy proven prostate cancer: an accuracy study. J Endourol 2014; 28: 371–376. |
|
|
Joyner CRJr, Hey EBJr, Johnson J, et al. Reflected ultrasound in the diagnosis of tricuspid stenosis. Am J Cardiol 1967; 19: 66–73. |
|
|
de Castro Abreu AL, Ashrafi AN, Gill IS, et al. Contrast-enhanced transrectal ultrasound for follow-up after focal HIFU ablation for prostate cancer. J Ultrasound Med 2019; 38: 811–819. |
|
|
Kundavaram CR, Halpern EJ, Trabulsi EJ. Value of contrast-enhanced ultrasonography in prostate cancer. Curr Opin Urol 2012; 22: 303–309. |
|
|
Quaia E. Microbubble ultrasound contrast agents: an update. Eur Radiol 2007; 17: 1995–2008. |
|
|
Brannigan M, Burns PN, Wilson SR. Blood flow patterns in focal liver lesions at microbubble-enhanced US. Radiographics 2004; 24: 921–935. |
|
|
Porter TR, Mulvagh SL, Abdelmoneim SS, et al. Clinical applications of ultrasonic enhancing agents in echocardiography: 2018 American Society of Echocardiography guidelines update. J Am Soc Echocardiogr 2018; 31: 241–274. |
|
|
Platts DG, Luis SA, Roper D, et al. The safety profile of perflutren microsphere contrast echocardiography during rest and stress imaging: results from an Australian multicentre cohort. Heart Lung Circ 2013; 22: 996–1002. |
|
|
Seitz M, Gratzke C, Schlenker B, et al. Contrast-enhanced transrectal ultrasound (CE-TRUS) with cadence-contrast pulse sequence (CPS) technology for the identification of prostate cancer. Urol Oncol 2011; 29: 295–301. |
|
|
Aigner F, Pallwein L, Mitterberger M, et al. Contrast-enhanced ultrasonography using cadence-contrast pulse sequencing technology for targeted biopsy of the prostate. BJU Int 2009; 103: 458–463. |
|
|
Zhao HX, Xia CX, Yin HX, et al. The value and limitations of contrast-enhanced transrectal ultrasonography for the detection of prostate cancer. Eur J Radiol 2013; 82: e641–e647. |
|
|
O’Neal D, Cohen T, Peterson C, et al. Contrast-enhanced ultrasound-guided radiofrequency ablation of renal tumors. J Kidney Cancer VHL 2018; 5: 7–14. |
|
|
Guo S, Xu P, Zhou A, et al. Contrast-enhanced ultrasound differentiation between low- and high-grade bladder urothelial carcinomaand correlation with tumor microvessel density. J Ultrasound Med 2017; 36: 2287–2296. |
|
|
Ashrafi AN, Nassiri N, Gill IS, et al. Contrast-enhanced transrectal ultrasound in focal therapy for prostate cancer. Curr Urol Rep 2018; 19:87. |
|
|
Zhu Y, Chen Y, Jiang J, et al. Contrast-enhanced harmonic ultrasonography for the assessment of prostate cancer aГОressiveness: a preliminary study. Korean J Radiol 2010; 11: 75–83. |
|
|
Sano F, Uemura H. The utility and limitations of contrast-enhanced ultrasound for the diagnosis and treatment of prostate cancer. Sensors 2015; 15: 4947–4957. |
|
|
Barr RG, Cosgrove D, Brock M, et al. WFUMB guidelines and recommendations on the clinical use of ultrasound elastography: part 5. Ultrasound Med Biol 2017; 43: 27–48. |
|
|
Tsutsumi M, Miyagawa T, Matsumura T, et al. Real-time balloon inflation elastography for prostate cancer detection and initial evaluation of clinicopathologic analysis. AJR Am J Roentgenol 2010; 194: W471–W476. |
|
|
Gennisson JL, Deffieux T, Fink M, et al. Ultrasound elastography: principles and techniques. Diagn Interv Imaging 2013; 94: 487–495. |
|
|
Zhang B, Ma X, Zhan W, et al. Real-time elastography in the diagnosis of patients suspected of having prostate cancer: a meta-analysis. Ultrasound Med Biol 2014; 40: 1400–1407. |
|
|
van Hove A, Savoie PH, Maurin C, et al. Comparison of image-guided targeted biopsies versus systematic randomized biopsies in the detection of prostate cancer: a systematic literature review of well-designed studies. World J Urol 2014; 32: 847–858. |
|
|
Schiffmann J, Grindei M, Tian Z, et al. Limitations of elastography based prostate biopsy. J Urol 2016; 195: 1731–1736. |
|
|
Anbarasan T, Wei C, Bamber JC, et al. Characterisation of prostate lesions using transrectal shear wave elastography (СВЭ) ultrasound imaging: a systematic review. Cancers 2021; 13: 1–15. |
|
|
Fu S, Tang Y, Tan S, et al. Diagnostic value of transrectal shear wave elastography for prostate cancer detection in peripheral zone: comparison with magnetic resonance imaging. J Endourol 2020; 34: 558–566. |
|
|
Xiang LH, Fang Y, Wan J, et al. Shear-wave elastography: role in clinically significant prostate cancer with false-negative magnetic resonance imaging. Eur Radiol 2019; 29: 6682–6689. |
|
|
Miyagawa T, Tsutsumi M, Matsumura T, et al. Real-time elastography for the diagnosis of prostate cancer: evaluation of elastographic moving images. Jpn J Clin Oncol 2009; 39: 394–398. |
|
|
Kanagaraju V, Ashlyin PVK, Elango N, et al. Role of transrectal ultrasound elastography in the diagnosis of prostate carcinoma. J Med Ultrasound 2020; 28: 173–178. |
|
|
Correas JM, Tissier AM, Khairoune A, et al. Ultrasound elastography of the prostate: state of the art. Diagn Interv Imaging 2013; 94: 551–560. |
|
|
Pavlovich CP, Cornish TC, Mullins JK, et al. High-resolution transrectal ultrasound: pilot study of a novel technique for imaging clinically localized prostate cancer. Urol Oncol 2014; 32: 34.e27–34.e32. |
|
|
Harland N, Stenzl A. Micro-ultrasound: a way to bring imaging for prostate cancer back to urology. Prostate Int 2021; 9: 61–65. |
|
|
McNeal JE. Normal histology of the prostate. Am J Surg Pathol 1988; 12: 619–633. |
|
|
Ghai S, Eure G, Fradet V, et al. Assessing cancer risk on novel 29 MHz micro-ultrasound images of the prostate: creation of the micro-ultrasound protocol for prostate risk identification. J Urol 2016; 196: 562–569. |
|
|
Feleppa EJ. Basic physics of diagnostic ultrasound. In: Porter CR, Wolff EM (eds) Prostate ultrasound. New York: Springer, 2015, pp. 31–56. |
|
|
Terris MK, Stamey TA. Determination of prostate volume by transrectal ultrasound. J Urol 1991; 145: 984–987. |
|
|
Claros OR, Tourinho-Barbosa RR, Fregeville A, et al. Comparison of initial experience with transrectal magnetic resonance imaging cognitive guided micro-ultrasound biopsies versus established transperineal robotic ultrasound magnetic resonance imaging fusion biopsies for prostate cancer. J Urol 2020; 203: 918–925. |
|
|
Eure G, Fanney D, Lin J, et al. Comparison of conventional transrectal ultrasound, magnetic resonance imaging, and micro-ultrasound for visualizing prostate cancer in an active surveillance population: a feasibility study. Can Urol Assoc J 2019; 13: E70–E77. |
|
|
Pavlovich CP, Hyndman ME, Eure G, et al. A multi-institutional randomized controlled trial comparing first-generation transrectal high-resolution micro-ultrasound with conventional frequency transrectal ultrasound for prostate biopsy. BJUI Compass 2021; 2: 126–133. |
|
|
Cornud F, Lefevre A, Flam T, et al. MRI-directed high-frequency (29 MHz) TRUS-guided biopsies: initial results of a single-center study. Eur Radiol 2020; 30: 4838–4846. |
|
|
Wiemer L, Hollenbach M, Heckmann R, et al. Evolution of targeted prostate biopsy by adding micro-ultrasound to the magnetic resonance imaging pathway. Eur Urol Focus 2021; 7: 1292–1299. |
|
|
Zhang M, Wang R, Wu Y, et al. Micro-ultrasound imaging for accuracy of diagnosis in clinically significant prostate cancer: a meta-analysis. Front Oncol 2019; 9: 1368–1369. |
|
|
Sountoulides P, Pyrgidis N, Polyzos SA, et al. Micro-ultrasound-guided vs multiparametric magnetic resonance imaging-targeted biopsy in the detection of prostate cancer: a systematic review and meta-analysis. J Urol 2021; 205: 1254–1262. |
|
|
Dariane C, Ploussard G, Barret E, et al. Micro-ultrasound-guided biopsies versus systematic biopsies in the detection of prostate cancer: a systematic review and meta-analysis. World J Urol. Epub ahead of print 14 July 2022. Crossref. |
|
|
Klotz L, Lughezzani G, Maffei D, et al. Comparison of micro-ultrasound and multiparametric magnetic resonance imaging for prostate cancer: a multicenter, prospective analysis. Can Urol Assoc J 2020; 15: E11–E16. |
|
|
Klotz L, Andriole G, Cash H, et al. Optimization of prostate biopsy – micro-ultrasound versus MRI (OPTIMUM): a 3-arm randomized controlled trial evaluating the role of 29 MHz micro-ultrasound in guiding prostate biopsy in men with clinical suspicion of prostate cancer. Contemp Clin Trials 2022; 112: 106618. |
|
|
Zhang M, Tang J, Luo Y, et al. Diagnostic performance of multiparametric transrectal ultrasound in localized prostate cancer: a comparative study with magnetic resonance imaging. J Ultrasound Med 2019; 38: 1823–1830. |
|
|
Mannaerts CK, Wildeboer RR, Remmers S, et al. Multiparametric ultrasound for prostate cancer detection and localization: correlation of B-mode, shear wave elastography and contrast enhanced ultrasound with radical prostatectomy specimens. J Urol 2019; 202: 1166–1173. |
|
|
Postema AW, Gayet MCW, van Sloun RJG, et al. Contrast-enhanced ultrasound with dispersion analysis for the localization of prostate cancer: correlation with radical prostatectomy specimens. World J Urol 2020; 38: 2811–2818. |
|
|
Wildeboer RR, Mannaerts CK, van Sloun RJG, et al. Automated multiparametric localization of prostate cancer based on B-mode, shear-wave elastography, and contrast-enhanced ultrasound radiomics. Eur Radiol 2020; 30: 806–815. |
|
|
Morris DC, Chan DY, Lye TH, et al. Multiparametric ultrasound for targeting prostate cancer: combining ИВСАИ, СВЭВ, QUS and B-Mode. Ultrasound Med Biol 2020; 46: 3426–3439. |
|
|
Drudi FM, Cantisani V, Angelini F, et al. Multiparametric MRI versus multiparametric US in the detection of prostate cancer. Anticancer Res 2019; 39: 3101–3110. |
|
|
Pepe P, Pepe L, Panella P, et al. Can multiparametric ultrasound improve cognitive MRI/TRUS fusion prostate biopsy. Arch Ital Di Urol E Androl 2020; 92: 89–92. |
|
|
Fanti S, Minozzi S, Antoch G, et al. Consensus on molecular imaging and theranostics in prostate cancer. Lancet Oncol 2018; 19: e696–e708. |
|
|
Grey ADR, Scott R, Shah B, et al. Multiparametric ultrasound versus multiparametric MRI to diagnose prostate cancer (CADMUS): a prospective, multicentre, paired-cohort, confirmatory study. Lancet Oncol 2022; 23: 428–438. |
|
|
Shaeffer EM, Sriniva S, An Y, et al. NCCN guideline prostate cancer version 1.2023, https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (accessed 19 October 2022). |
|
|
Mehralivand S, Shih JH, Rais-Bahrami S, et al. A magnetic resonance imaging–based prediction model for prostate biopsy risk stratification. JAMA Oncol 2018; 4: 678–685. |
|
|
Lorusso V, Kabre B, Pignot G, et al. External validation of the computerized analysis of TRUS of the prostate with the КАИНС-TRUS system: a potential role of artificial intelligence for improving prostate cancer detection. World J Urol. Epub ahead of print 6 March 2022. Crossref |
|
|
Garcia-Reyes K, Nguyen HG, Zagoria RJ, et al. Impact of lesion visibility on transrectal ultrasound on the prediction of clinically significant prostate cancer (Gleason score 3 + 4 or greater) with transrectal ultrasound-magnetic resonance imaging fusion biopsy. J Urol 2018; 199: 699–705. |
|
|
Sharen GW, Zhang J. Application of shear wave elastography and contrast-enhanced ultrasound in transrectal prostate biopsy. Curr Med Sci 2022; 42: 447–452. |
|
|
Baur ADJ, Schwabe J, Rogasch J, et al. A direct comparison of contrast-enhanced ultrasound and dynamic contrast-enhanced magnetic resonance imaging for prostate cancer detection and prediction of aГОressiveness. Eur Radiol 2018; 28: 1949–1960. |
|
|
Eldred-Evans D, Burak P, Connor MJ, et al. Population-based prostate cancer screening with magnetic resonance imaging or ultrasonography: the IP1-PROSTAGRAM study. JAMA Oncol 2021; 7: 395–402. |
|
|
Liang L, Zhi X, Sun Y, et al. A nomogram based on a multiparametric ultrasound radiomics model for discrimination between malignant and benign prostate lesions. Front Oncol 2021; 11: 610785–610712. |
|
|
Ji Y, Ruan L, Ren W, et al. Stiffness of prostate gland measured by transrectal real-time shear wave elastography for detection of prostate cancer: a feasibility study. Br J Radiol 2019; 92: 20180970. |
|
|
Ding Z, Jiao Y, Wu H, et al. Clinical value of the elastographic Q-analysis score in assisting real-time elastography-guided prostate Biopsy: a retrospective study of 125 patients. J Ultrasound Med 2020; 39: 83–87. |
|
|
Lughezzani G, Maffei D, Saita A, et al. Diagnostic accuracy of microultrasound in patients with a suspicion of prostate cancer at magnetic resonance imaging: a single-institutional prospective study. Eur Urol Focus 2021; 7: 1019–1026. |
|
|
Chessa F, Schiavina R, Amelio E, et al. Diagnostic accuracy of the novel 29 MHz micro-ultrasound ‘ExactVuTM’ for the detection of clinically significant prostate cancer: a prospective single institutional study. A step forward in the diagnosis of prostate cancer. Arch Ital Di Urol E Androl 2021; 93: 132–138. |
|
|
Avolio PP, Lughezzani G, Paciotti M, et al. The use of 29 MHz transrectal micro-ultrasound to stratify the prostate cancer risk in patients with PI-RADS III lesions at multiparametric MRI: a single institutional analysis. Urol Oncol 2021; 39: 832e1–832.e7. |
|
|
Rodríguez Socarrás ME, Gomez Rivas J, Cuadros Rivera V, et al. Prostate mapping for cancer diagnosis: the Madrid protocol. Transperineal prostate biopsies using multiparametric magnetic resonance imaging fusion and micro-ultrasound guided biopsies. J Urol 2020; 204: 726–733. |
|
|
Abouassaly R, Klein EA, El-Shefai A, et al. Impact of using 29 MHz high-resolution micro-ultrasound in real-time targeting of transrectal prostate biopsies: initial experience. World J Urol 2020; 38: 1201–1206. |
|
|
Park KJ, Choi SH, Lee JS, et al. Interreader agreement with prostate imaging reporting and data system version 2 for prostate cancer detection: a systematic review and meta-analysis. J Urol 2020; 204: 661–670. |
|
|
Hosny A, Parmar C, Quackenbush J, et al. Artificial intelligence in radiology. Nat Rev Cancer 2018; 18: 500–510. |
|
|
Liu X, Faes L, Kale AU, et al. A comparison of deep learning performance against health-care professionals in detecting diseases from medical imaging: a systematic review and meta-analysis. Lancet Digit Health 2019; 1: e271–e297. |
|
|
Sugano D, Sanford D, Abreu A, et al. Impact of radiomics on prostate cancer detection: a systematic review of clinical applications. Curr Opin Urol 2020; 30: 754–781. |
|
|
Castiglioni I, Rundo L, Codari M, et al. AI applications to medical images: from machine learning to deep learning. Phys Med 2021; 83: 9–24. |
|
|
Ahmed HU, El-Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 2017; 389: 815–822. |