Резюме
Предусловия
Исследование для подтверждения концепции с целью оценки возможности и безопасности малоинвазивной ультразвуковой (УЗ) биопсии синовиальной ткани лучезапястного сустава (ЛЗ) с использованием анатомической табакерки как пути доступа.
Методы
Двадцати последовательным пациентам с активным хроническим артритом запястья выполнили малоинвазивную синовиальную биопсию ЛЗ сустава под контролем УЗ с использованием анатомической табакерки в качестве пути доступа. Образцы забирали из 3 предварительно определенных целевых участков синовии ЛЗ сустава (проксимальной, свода и дистального участка), с целью получения не менее 12 образцов. Целесообразность процедуры оценивали на основе количества и гистологического качества полученных фрагментов ткани, протестированных по предварительно определенным гистологическим параметрам. Безопасность и толерантность процедуры оценивались с помощью 1-недельных и 1-месячных клинических оценок.
Результаты
Для гистопатологического исследования было обработано в среднем 17 фрагментов (≥ 1 мм в диаметре при макроскопической оценке) за процедуру (диапазон 9-24), и посвящено изучению. При гистопатологической оценке ткань, поддающаяся классификации (видимый выстилающий слой и ≥ 4 фрагментов с НСТ), была распознана в 19/20 биоптатах (95%), а все предварительно определенные гистометрические параметры были признаны применимыми и успешно измерены в 19/19 биоптатах, подвергавшихся классификации. Все три целевые области биопсии были доступны для взятия образцов. Вся процедура в целом хорошо переносилась. Во время 1-месячного наблюдения ни у одного пациента не было выявлено инфекционных осложнений.
Заключения
Путь доступа через анатомическую табакерку в синовиальной биопсии ЛЗ сустава под контролем УЗ позволяет безопасно и целенаправленно собирать адекватные образцы тканей. Эта модификация традиционного пути доступа может позволить легче, многократно и безопаснее проводить забор образцов из анатомически отличных участков запястья при артрите.
Предусловия
В последние годы возросло количество клинических исследований, посвященных анализу синовиальной ткани у пациентов с хроническим артритом. Интерес в основном сосредоточен на изучении ранних стадий заболевания, не столько как на диагностическом инструменте [1], сколько на понимании патогенетических механизмов и получении дополнительных маркеров, полезных для руководства терапевтическими стратегиями [2,3,4,5,6,7].
Для того, чтобы способствовать широкому внедрению анализа синовиальной ткани в клиническую практику и научные исследования, образцы должны быть получены мини-инвазивно и из представительных суставов. Разработка и валидация методик под контролем ультразвука (УЗ) с использованием полуавтоматической иглы или портативного безыгольного инъектора и щипцов предложила альтернативный артроскопии инструмент с отличными результатами с точки зрения безопасности и доступа к суставам [8,9,10]. Тем не менее, забор образцов из мелких суставов кисти, которые являются наиболее частой и ранней мишенью воспалительного процесса при многих идиопатических артритах, включая ревматоидный артрит (РА), хотя и возможен [11, 12], но остается сложным из-за потенциально недостаточного выхода тканей. В этом контексте лучезапястный (ЛЗ) сустав является наиболее подходящей альтернативой, поскольку он больше и содержит большее количество синовии[8, 12]. Обычно доступ к ЛЗ сустава для выполнения внутрисуставных инъекций [13], артроскопии [14] или синовиальной биопсии [15] осуществляется между отделами сухожилий разгибателей III и IV, IV и V и V и VI на тыльной стороне. Однако, по нашему опыту, анатомические особенности ЛЗ сустава и ход различных околосуставных структур, в частности сухожилий, могут обусловливать путь и наклон хирургического инструмента в полости сустава, с возможностью того, что часть синовиальной поверхности остается недосягаемой.
Анатомическая табакерка – это треугольное углубление, которое образуется при разгибании и отведении большого пальца на лучевой стороне запястья на уровне костей запястья. Углубление ограничено медиально сухожилием длинного разгибателя большого пальца кисти, латерально – сухожилиями короткого разгибателя большого пальца кисти и длинной мышцей, отводящей большой палец кисти, дистально – основанием І пястной кости и проксимально – шиловидным отростком лучевой кости; дно определяют ладьевидная и трапециевидная кости и медиальная сторона ЛЗ сустава [16]. В этой области иглу можно ввести через капсулу сустава. Ее можно направить в лучелоктевом направлении, параллельно как хрящевой поверхности, выстилающей кости запястья (ладьевидную, полулунную и часть трехгранной кости), так и синовиальной выстилке верхней части капсулы сустава, простирающейся между тыльной границей лучевой кости и контуром мыщелка запястья, пока она не достигнет треугольной связки запястья.
Несмотря на этот потенциально благоприятный субстрат, в литературе пока отсутствуют данные о специфическом результате синовиальной биопсии запястья на основе вышеописанного анатомического подхода. В свете этих соображений мы разработали исследование для подтверждения концепции, чтобы оценить возможность и безопасность синовиальной биопсии с использованием анатомической табакерки в качестве пути доступа.
Методы
Вовлечение пациентов
Исследование, сбор данных и отчетность были выполнены в соответствии с пунктами EULAR, которые учитывают минимальные требования к отчетности при исследовании синовиальной ткани в ревматологии [17]. Было включено двадцать последовательных пациентов, которым проводили игольную синовиальную биопсию запястья под контролем УЗ в отделении ревматологии Фонда IRCCS Поликлиника Сан-Маттео в Павии в период с февраля 2021 года по декабрь 2022 года. Показаниями к проведению синовиальной биопсии были клинически неопределенный синовит или персистирующий необъяснимый артрит у пациентов с установленным диагнозом. Исследование проводилось в соответствии с Хельсинкской декларацией. Все пациенты подписали информированное согласие перед включением в исследование, а местный этический комитет одобрил протокол исследования.
Оценка с помощью УЗ и методика синовиальной биопсии под контролем УЗ
Ультразвуковое исследование (в серой шкале, СШ, и энергетическом допплере, ЭД) и синовиальную биопсию под контролем УЗ выполняли на аппарате Esaote MyLab™Seven с линейным датчиком (6/18 МГц). Утолщение синовиальной оболочки и степень ЭД-сигнала запястья оценивали полуколичественно (0-3)[18] непосредственно перед процедурой биопсии. У каждого пациента для биопсии выбирали ЛЗ сустав с самой высокой оценкой синовита по данным УЗ.
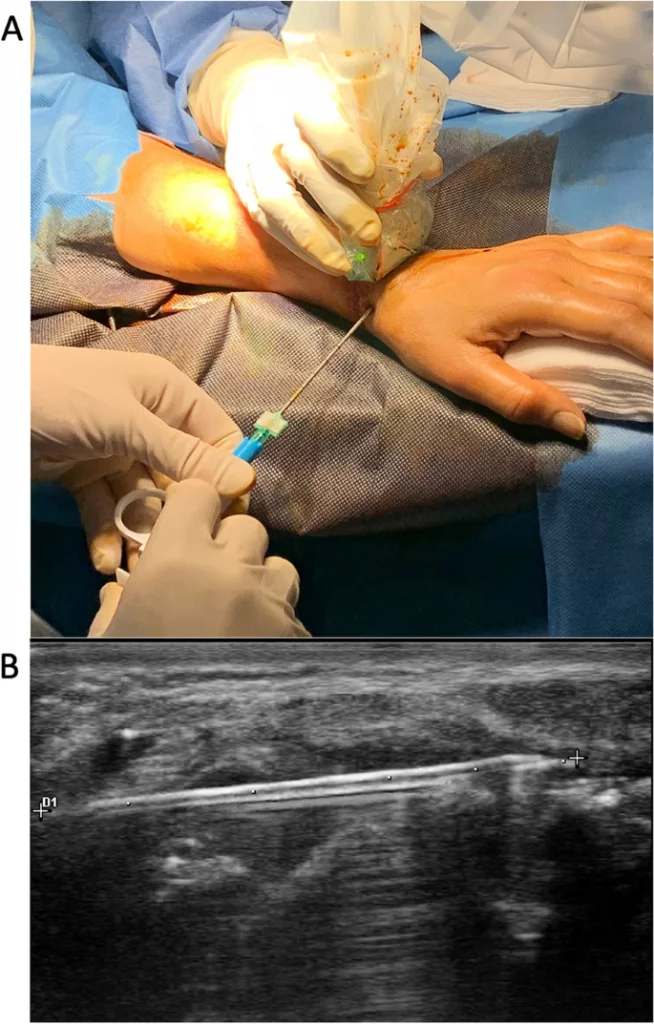
Все процедуры биопсии выполняли два обученных оператора (LDS [процедура] и SB [ассистент УЗ], с опытом проведения биопсии под контролем УЗ > 5 лет). Все процедуры биопсии проводились в амбулаторных условиях в стерильной среде. Доступ локализовали при пронации кисти, незначительном разгибании запястья и отведении большого пальца на дне анатомической табакерки, непосредственно под сухожилием длинного разгибателя кисти, выше латеральной связки ЛЗ и примерно на 5 мм ближе трапециевидной кости (Рис. 1А). Кожу и подкожную клетчатку анатомической табакерки над капсулой сустава инфильтрировали 5 мл местного анестетика (1% лидокаина) с помощью иглы 25-го калибра. Еще 5 мл местного анестетика (1% лидокаина) вводили в синовиальное пространство. Через 2 минуты в синовиальную полость под прямым контролем УЗ вводили биопсийную иглу Quick-Core (14Gx100 мм). Иглу можно было динамически визуализировать по всей длине в виде небольшой гиперэхогенной линии в синовиальной пролиферации над костями запястья (Рис. 1B).
Рис. 1
Биопсия синовиальной ткани лучезапястного (ЛЗ) сустава под контролем ультразвука (УЗ) с использованием анатомической табакерки в качестве пути доступа. A Репрезентативное изображение пациента, которому проводят синовиальную биопсию ЛЗ под контролем УЗ с использованием иглы Quick-Core (14Gx100 мм). Доступ расположен при пронации кисти, незначительном разгибании запястья и отведенном большом пальце кисти на дне анатомической табакерки, непосредственно под сухожилием длинного разгибателя большого пальца кисти, выше латеральной связки ЛЗ и примерно на 5 мм проксимальнее трапециевидной кости. B УЗ-наведение позволило игле проникнуть примерно на 3 см в ЛЗ сустав, пока она не достигла треугольной связки запястья. Иглу можно визуализировать на всей ее длине в виде небольшой гиперэхогенной линии в пределах синовиальной пролиферации над костями запястья
Под контролем УЗ игла проникла примерно на 3 см в ЛЗ сустав, пока не достигла треугольной связки запястья (Рис. 1Б). Игла, параллельно хрящевой поверхности запястья, оставалась на расстоянии примерно 3-4 мм от нее на протяжении всего пути. В противоположность этому, она непосредственно контактировала с синовиальной тканью, выстилающей тыльную сторону суставной капсулы. Иглу можно было ввести под углом около 20° дорсально, а также под углом около 30° латерально, запястно и лучезарно. Таким образом, кончиком иглы можно было достичь любой точки синовиальной ткани, выстилающей свод капсулы сустава, расположенной между тыльным краем суставной поверхности лучевой кости и тыльным краем запястного отростка, за исключением лишь наиболее проксимальных 5 мм лучезарно-ладьевидного сустава.
Заранее определенными целевыми участками для биопсии были (i) суставная поверхность лучевой кости (проксимальная область), (ii) суставные поверхности костей запястья (дистальная область) и (iii) свод суставной капсулы, особенно там, где синовиальная оболочка выглядела более толстой (область свода) (Рис. 2А). Старались получить максимально допустимое количество биопсий из каждого сустава, стремясь получить минимум 12 образцов (≥ 1 мм в диаметре при макроскопической оценке) из трех целевых участков и за целевое время процедуры 30 мин. [12].
Рис. 2
Целевые участки для синовиальной биопсии лучезапястного (ЛЗ) сустава и изъятые фрагменты тканей. А Репрезентативное ультразвуковое продольное сканирование лучезапястного сустава. Периметр лучезапястного синовита обозначен разными цветами для обозначения 3 целевых участков, которые используются для сбора биопсийных образцов. Красным цветом обозначен проксимальный участок, черным – участок свода, а синим – дистальный участок. B Репрезентативные изображения изъятых фрагментов синовиальной ткани для каждой целевой области. Макроскопические и гистологические изображения, окрашенные гематоксилином и эозином (при увеличении × 10 и детали лимфоцитарного инфильтрата при увеличении × 20) репрезентативных синовиальных тканей для каждого участка-мишени
Обработка синовиальной ткани
Биоптаты сохраняли влажными в физиологическом растворе в течение максимум 30 минут после завершения процедуры и нумеровали макроскопически (изъятые фрагменты ткани). Переменное количество фрагментов (в зависимости от общего количества и сопутствующих процедур) было случайным образом отобрано для гистопатологии и зафиксировано в 4% формалине до 24 часов. После заливки в парафин, с помощью стандартного микротома вырезали серийные срезы толщиной 5 мкм, устанавливали на предметные стекла и окрашивали гематоксилином и эозином (ГЭ) в соответствии со стандартными протоколами.
Таблица 1 Ультразвуковые и гистологические данные
| Биопсийный код, n° | Оценка СШ | Оценка ЭД | Фрагменты ГЭ, n всего/НСТ(ККТ) | Биопсия с возможностью градацииa | Оценка по шкале Krenn (степень синовита) | Оценка сосудистого русла | Клеточная агрегация G2/G3 (ИАЛ) |
| 1 | 3 | 2 | 12/9 (75%) | + | 6.5 (высокий) | 1 | + / + (0.89) |
| 2 | 2 | 2 | 16/0 (0%) | − | но (не оценивается) | но | но (не оценивается) |
| 3 | 2 | 2 | 21/14 (67%) | + | 3 (низкий) | 0.5 | + / + (0.14) |
| 4 | 2 | 3 | 14/14 (100%) | + | 6 (высокий) | 1.5 | + / + (0.86) |
| 5 | 2 | 1 | 23/22 (96%) | + | 5.5 (высокий) | 0 | + / − (0.14) |
| 6 | 1 | 2 | 16/5 (31%) | + | 4 (низкий) | 0.5 | − / − (0.00) |
| 7 | 3 | 3 | 13/12 (92%) | + | 4.5 (низкий) | 1 | + / − (0.33) |
| 8 | 2 | 3 | 19/9 (47%) | + | 4.5 (низкий) | 0.5 | + / − (0.22) |
| 9 | 3 | 2 | 12/12 (100%) | + | 7.5 (высокий) | 2 | + / + (0.50) |
| 10 | 3 | 3 | 20/9 (45%) | + | 4.5 (низкий) | 1 | − / − (0.00) |
| 11 | 1 | 3 | 9/7 (78%) | + | 5 (высокий) | 0.5 | + / − (0.37) |
| 12 | 2 | 2 | 10/8 (80%) | + | 5 (высокий) | 1.5 | + / + (0.62) |
| 13 | 2 | 1 | 17/6 (35%) | + | 3.5 (низкий) | 0.5 | − / − (0.00) |
| 14 | 2 | 2 | 24/18 (75%) | + | 5.5 (высокий) | 2 | + / − (0.18) |
| 15 | 3 | 2 | 19/10 (53%) | + | 4 (низкий) | 0 | − / − (0.00) |
| 16 | 2 | 3 | 20/20 (100%) | + | 6 (высокий) | 1.5 | + / + (0.87) |
| 17 | 2 | 3 | 18/16 (89%) | + | 4.5 (низкий) | 1 | + / + (0.59) |
| 18 | 3 | 3 | 18/18 (100%) | + | 6.5 (высокий) | 2.5 | + / + (0.52) |
| 19 | 3 | 2 | 16/12 (75%) | + | 5.5 (высокий) | 1.5 | + / − (0.23) |
| 20 | 2 | 1 | 18/13 (72%) | + | 4.5 (низкий) | 0.5 | + / − (0.16) |
-
- СШ серая шкала биоптата запястья, ЭД энергетическая допплерография биоптата запястья, Фрагменты ГЭ фрагменты отобраны для гистопатологии, НСТ неповрежденная синовиальная ткань, ККТ коэффициент качества ткани, G2/G3 клеточные агрегаты 2-го/ 3-го класса, ИАЛ индекс агрегации лимфоцитов, не подлежит оценке
- a Характеризуется видимым слоем выстилки и ≥ 4 фрагментами, демонстрирующими НСТ
Результаты исследования
Были рассмотрены следующие основные результаты.
Целесообразность
Процедурная целесообразность была определена как получение гистологически оцениваемой ткани. Каждую биопсию оценивали на гистологических слайдах на одном уровне среза для выявления фрагментов, характеризующихся неповрежденной синовиальной тканью (НСТ, что определяется микроскопически по наличию характерных сосудов и стромы при отсутствии артефактных изменений)[5]. Биоптаты определялись как градационные, если они содержали видимый слой выстилки и количество фрагментов, демонстрирующих НСТ ≥ 4 [8]. Для описательных целей каждому биоптату присваивали коэффициент качества ткани (ККТ) в соответствии с соотношением фрагментов, содержащих НСТ, к общему количеству фрагментов в срезе.
Применимость различных гистометрических анализов к градуированным биоптатам была проверена непосредственно с помощью количественной оценки по шкале Krenn [19], васкуляризации подстилки (полуколичественно, 0-3)[20], и клеточной агрегации (измеряли дихотомически с точки зрения наличия/отсутствия агрегатов лимфоцитов класса (G) 2/G3[21] и в виде индекса [индекс агрегации лимфоцитов, ИАЛ], выражающий соотношение между общим количеством агрегатов G2 и -G3/общим количеством фрагментов, демонстрирующих НСТ).
Все оценки тканей были выполнены вслепую двумя независимыми экспертами с опытом анализа синовиальной ткани более 5 лет (TL и AM). Разногласия решали по взаимному согласию или путем вычисления среднего балла (полуколичественные баллы Krenn’s и васкуляризации).
Безопасность и переносимость
После синовиальной биопсии каждого пациента наблюдали в течение 7 и 30 дней путем непосредственного клинического обследования для оценки количества и типа нежелательных явлений и/или локального ухудшения боли. Боль в суставах измеряли до биопсии, сразу после биопсии, через 1 неделю и 1 месяц по визуальной аналоговой шкале (ВАШ) в диапазоне от 0 до 100 мм. Любое ухудшение на ≥ 20 мм по сравнению с оценкой до биопсии может быть связано с процедурой биопсии. Краткосрочную безопасность и переносимость определяли как отсутствие побочных явлений и ухудшение боли в течение выбранных временных точек по сравнению с показателями до биопсии.
Результаты
Десять пациентов имели ранний артрит (продолжительность симптомов до 12 месяцев), 8 – установленный РА (продолжительность симптомов > 5 лет), а 2 – артрит в ходе иммунотерапии рака ингибиторами контрольных точек. Тринадцать из 20 пациентов были женщинами, средний возраст составлял 45 лет (СО ± 7,9), среди них не было пациентов с ожирением (среднее значение ИМТ 24, СО ± 4,2). Ни один из пациентов не получал инъекций глюкокортикоидов в биоптат запястья в течение предыдущих 4 недель. Все пациенты имели клинические признаки воспаления сустава в биоптате запястья (отек и болезненность) и по крайней мере синовит ЛЗ сустава 2 степени при УЗ [18, 22].Средний показатель (диапазон) активности заболевания 28 суставов (ПАЗ28) в исследуемой популяции составил 3,99 (2,77-5,07).
Среднее количество фрагментов (≥ 1 мм в диаметре при макроскопической оценке) за процедуру было обработано для гистопатологии (диапазон 9-24) и посвящено исследованию (Таблица 1). При гистопатологическом исследовании ткань, поддающаяся классификации (видимый выстилающий слой и ≥ 4 фрагмента с НСТ), была распознана в 19/20 биоптатах (95%) с медианой ККТ 75% (диапазон 31-100) (Таблица 1). Все три предварительно определенные гистометрические параметры были признаны применимыми и успешно измерены двумя экспертами в 19/19 градуированных биопсиях (Таблица 1). У первых пяти набранных пациентов с ранним артритом (отобранных до биопсии и до УЗ) было отслежено анатомическое происхождение полученного фрагмента для изучения доступности и качества ткани в 3 целевых участках запястья.
Все три подотдела (проксимальный, дистальный и свод) показали доступность для взятия образцов с помощью биопсийной иглы 14-G. Гистологические анализы продемонстрировали возможность получить ткань, поддающуюся классификации, и выявить патологические изменения во всех исследуемых участках запястья (Рис. 2B и Табл. 2).
Таблица 2 Гистологический анализ подотделов запястья
| Биопсийный код, n | Место взятия биопсии | Оценка по шкале Krenn (степень синовита) | Оценка сосудистого русла | Агрегация клеток G2/G3 (ИАЛ) |
| 1 | Дa | но (не оценивается) | но | но (не оценивается) |
| С | 6.5 (высокий) | 1 | − / + (0.50) | |
| П | 7 (высокий) | 1.5 | + / − (1.50) | |
| 4 | Д | 6 (высокий) | 1.5 | + / + (1.50) |
| С | 4 (низкий) | 1 | − / − (0.00) | |
| П | 6 (высокий) | 2 | + / + (1.20) | |
| 5 | Д | 5.5 (высокий) | 1 | + / − (0.11) |
| С | 4 (низкий) | 0.5 | + / − (0.15) | |
| Пb | но (не оценивается) | но | но (не оценивается) | |
| 8 | Д | 5 (высокий) | 1 | + / − (0.39) |
| С | 4 (низкий) | 0 | − / − (0.00) | |
| П | 4.5 (низкий) | 0.5 | + / − (0.38) | |
| 12 | Д | 6.5 (высокий) | 2.5 | + / + (0.89) |
| С | 4 (низкий) | 0.5 | + / − (0.25) | |
| П | 5.5 (высокий) | 1.5 | + / + (0.73) |
- Д суставная поверхность костей запястья (дистальный участок), С свод суставной капсулы (участок свода), П суставная поверхность лучевой кости (проксимальный участок), G2/G3 клеточные агрегаты 2-го/ 3-го класса, ИАЛ индекс агрегации лимфоцитов, но не оценивается.
- aНе подлежит оценке (< 4 фрагментов с интактной синовиальной тканью на уровне среза)
- bНе выполняется из-за дискомфорта пациента
Процедура в целом переносилась хорошо. Все пациенты сообщали о легком дискомфорте только во время анестезии кожи, подкожной клетчатки и капсулы сустава. Показатели боли показали незначительные изменения со средним значением (СО) ΔВАШ – 4 (7) сразу после биопсии, 2,3 (12) через 1 неделю и – 3,3 (3,9) через 1 месяц (Рис. 3). Ухудшение боли в суставах (ΔВАШ ≥ 20) наблюдалось у 2/20 (10%) пациентов сразу после биопсии и ни у одного через 1 неделю и через 1 месяц. Во всех случаях боль лечили анальгетиками и/или нестероидными противовоспалительными препаратами. У одного пациента наблюдались экхимозные проявления на уровне анатомической табакерки: экхимозные кожные проявления исчезли в течение следующих 2 недель. Во время 1-месячного наблюдения ни один пациент не жаловался на гипестезию или дизестезию, в частности на онемение и жжение. Ни у одного пациента не было выявлено инфекционных осложнений.
Рис. 3
Боль в суставах как показатель безопасности и переносимости процедуры биопсии. Боль в месте биопсии измеряли до биопсии (до), сразу после биопсии (после), через 1 неделю (1 нед) и 1 месяц (1 мес) с помощью визуальной аналоговой шкалы (ВАШ) в диапазоне от 0 до 100 мм. Любое ухудшение на ≥ 20 мм по сравнению с оценкой до биопсии интерпретировалось как вторичное относительно процедуры. Как видно на изображении, показатели боли продемонстрировали незначительные изменения со средним (СО) ΔВАШ – 4 (7) сразу после биопсии, 2,3 (12) через 1 неделю и – 3,3 (3,9) через 1 месяц после процедуры.
Обсуждение
Наш опыт демонстрирует, что достаточное количество и качество образцов синовиальной биопсии можно безопасно получить с помощью полуавтоматической иглы, введенной внутрь ЛЗ сустава с использованием анатомической табакерки в качестве пути доступа. Согласно первичным результатам исследования, показатель успешности процедуры составил 95%.
Мы смогли получить заранее определенное количество 12 образцов в 90% процедур и получить ткань, которая поддается оценке, для гистопатологического анализа в 19/20 биопсий, включая случаи с минимальной синовиальной гипертрофией при локальном УЗ. Кроме того, за исключением нескольких миллиметров синовии, выстилающей капсулу, растянутую между лучевой и ладьевидной костями, мы смогли достичь и выполнить прицельный забор образцов со всей синовиальной поверхности, с постоянным осознанием того, что благодаря УЗ также можно взять образец синовии, расположенной близко к хрящево-панусовому соединению, как с лучевой, так и с запястной стороны. Этот вопрос является актуальным и может иметь влияние на исследование синовиальной ткани как у пациентов с клинически активным, так и субклиническим заболеванием (ремиссия и доклинические фазы). Действительно, одним из аспектов, который следует учитывать при микроскопическом исследовании образцов синовиальной биопсии, является внутрисуставное разнообразие, поскольку синовиальное воспаление может быть по-разному выражено в разных участках одного и того же сустава. В частности, образцы ткани из участков, близких к хрящево-запястному соединению, могут иметь различные воспалительные биомаркеры, которые могут быть недооценены/переоценены при анализе образцов из более поверхностных участков сустава [23,24,25]. Сравнение степени и качества синовиального воспалительного процесса в различных участках одного и того же сустава может также предоставить пространственную информацию о специфических патогенетических механизмах, раскрывая те, что имеют местное происхождение, которые могут быть более тесно связаны со сложными остеитическими или энтезитными процессами [26].
Введение биопсийного инструмента через анатомическую табакерку дает достаточные гарантии от возможного ятрогенного повреждения тканей сустава, особенно хрящевых и внесуставных. Игла остается на достаточном расстоянии от хрящевого дна запястья на протяжении всего своего пути, что затрудняет, при отсутствии методических ошибок, соприкосновение кончика иглы с хрящевой поверхностью. Связочные структуры не укрепляют капсулярный участок, соответствующий анатомической табакерке, поскольку лучевая коллатеральная связка, которая проходит от шиловидного отростка лучевой кости до бугорка ладьевидной кости, прикрыта сухожилием длинной мышцы отводящей большой палец кисти. Поэтому вход через эту область не способен повредить структуры связок и не должен вызвать нестабильность сустава, обеспечивая более широкую зону комфорта для внутрисуставных движений.
С другой стороны, существуют также специфические ятрогенные риски, которые следует учитывать, сосредотачиваясь на области анатомической табакерки: (i) путь лучевой артерии и (ii) две поверхностные чувствительные ветви лучевого нерва, поверхностная ветвь и боковой кожный нерв предплечья, которые отвечают за чувствительность тыльной поверхности первого пальца. Однако лучевая артерия пересекает табакерку возле трапециевидной кости на среднем расстоянии 7,5 мм от лучевого шиловидного отростка, и ее пульсация легко ощутима.
Аналогично, пересечение чувствительных нервных стволов с сухожилиями, ограничивающими анатомическую табакерку, происходит дистально. Поэтому наиболее проксимальный участок анатомической табакерки, на расстоянии не более 5 мм от лучевого шиловидного отростка и близко к длинной мышце-разгибателю большого пальца, является самым безопасным путем входа, который защищает как лучевую артерию, так и сенсорные ветви.
В 1995 году Steinberg и соавт [27] определили небольшую, но значительную безопасную зону площадью примерно 0,682 см2 в пределах анатомической табакерки возле лучевого шиловидного отростка для чрескожной фиксации проводов Киршнера. Однако Korcek и Wongworawat [28]поставили под сомнение эту гипотезу, показав, что непредсказуемость хода двух сенсорных ветвей делает невозможным определение надлежащей безопасной зоны в анатомической табакерке. В нашем опыте, основанном на идентификации дна анатомической табакерки непосредственно под сухожилием длинной мышцы-разгибателя большого пальца и непосредственно проксимальнее трапециевидной мышцы как ворот, неврологических повреждений (таких как гипестезия или дизестезия на тыльной стороне большого пальца кисти) или повреждений лучевой артерии (в виде значительных геморрагических осложнений или аневризматической дилатации) не возникало ни у одного из пациентов. Поэтому мы считаем, что тщательной пальпации анатомической табакерки и определения лучевого пульса (вместе с предварительным УЗ) достаточно, чтобы очертить фактическую зону безопасности для каждого пациента и предотвратить ятрогенное сосудисто-нервное повреждение.
Хотя необходимы специальные исследования, безопасный широкий диапазон движений, позволяющий введение через анатомическую табакерку, вероятно, имеет потенциальные преимущества над наиболее используемыми дорсальными входными портами [13,14,15]. Они располагаются в мягкотканной вогнутости между сухожилиями длинного разгибателя большого пальца кисти и длинного разгибателя пальцев, или между длинным разгибателем большого пальца кисти и длинным лучевым разгибателем запястья, или между разгибателем пальцев и локтевым разгибателем запястья, приблизительно на 1 см дистальнее бугорка Листера. Через эти доступы игла входит в ЛЗ сустав в вертикальном направлении или с наклоном, обусловленным сухожилиями разгибателей, в любом случае не менее 45° в лучезапястном или локтево-запястном направлении. Таким образом, независимо от того, используются ли щипцы или полуавтоматическая игла, инструмент проникает в сустав менее чем на 2 см под углом, который достигает лишь части синовиальной поверхности, пропуская синовиальную мембрану, выстилающую дорсальный свод суставной капсулы и крайние медиальную и латеральную части сустава.
Наконец, несмотря на то, что наше исследование позволило подтвердить высокий уровень успешности процедуры, важно подчеркнуть ограничение анализа, которое заключается в отсутствии теста на межоператорскую вариабельность. Текущие результаты следует интерпретировать в контексте процедур, выполняемых одним оператором, который имеет > 5 лет опыта работы с методикой биопсии под контролем УЗ.
Заключения
Таким образом, наши результаты свидетельствуют о том, что использование анатомической табакерки в качестве ворот для выполнения синовиальной биопсии ЛЗ сустава в малоинвазивных процедурах под контролем УЗ позволяет не только получить адекватную синовиальную ткань для гистологической оценки, но также может предложить безопасный дополнительный инструмент для улучшенного отбора образцов и целенаправленного анализа во время единичных и серийных процедур.
Аббревиатуры
УЗ:
Ультразвук
ЛЗ:
Лучезапястный
РА:
Ревматоидный артрит
СШ:
Серая шкала
ЭД:
Энергетический допплер
ГЭ:
Гематоксилин и эозин
НСТ:
Неповрежденная синовиальная ткань
ККТ:
Коэффициент качества ткани
ВАШ:
Визуальная аналоговая шкала
ПАЗ28:
Показатель активности заболевания 28 суставов
Δ:
Дельта
СО:
Стандартное отклонение
ИАЛ:
Индекс агрегации лимфоцитов
но:
Не оценивается
Ссылки на источники
- Manzo A, Bugatti S, Rossi S. Clinical applications of synovial biopsy. Front Med (Lausanne). 2019;6:102. https://doi.org/10.3389/fmed.2019.00102. [published Online First: 20190510].
- Orr C, Vieira-Sousa E, Boyle DL, et al. Synovial tissue research: a state-of-the-art review. Nat Rev Rheumatol. 2017;13(8):463–75. https://doi.org/10.1038/nrrheum.2017.115. [published Online First: 20170713].
- Bugatti S, Manzo A, Bombardieri M, et al. Synovial tissue heterogeneity and peripheral blood biomarkers. Curr Rheumatol Rep. 2011;13(5):440–8. https://doi.org/10.1007/s11926-011-0201-y.
- Bugatti S, BozzallaCassione E, De Stefano L, et al. Established rheumatoid arthritis. The pathogenic aspects. Best Pract Res Clin Rheumatol. 2019;33(5):101478. https://doi.org/10.1016/j.berh.2019.101478. [published Online First: 20200127].
- Rivellese F, Humby F, Bugatti S, et al. B cell synovitis and clinical phenotypes in rheumatoid arthritis: relationship to disease stages and drug exposure. Arthritis Rheumatol. 2020;72(5):714–25. https://doi.org/10.1002/art.41184. [published Online First: 20200317].
- Humby F, Durez P, Buch MH, et al. Rituximab versus tocilizumab in anti-TNF inadequate responder patients with rheumatoid arthritis (R4RA): 16-week outcomes of a stratified, biopsy-driven, multicentre, open-label, phase 4 randomised controlled trial. Lancet. 2021;397(10271):305–17. https://doi.org/10.1016/s0140-6736(20)32341-2.
- Rivellese F, Surace AEA, Goldmann K, et al. Rituximab versus tocilizumab in rheumatoid arthritis: synovial biopsy-based biomarker analysis of the phase 4 R4RA randomized trial. Nat Med. 2022;28(6):1256–68. https://doi.org/10.1038/s41591-022-01789-0. [published Online First: 20220519].
- Humby F, Kelly S, Hands R, et al. Use of ultrasound-guided small joint biopsy to evaluate the histopathologic response to rheumatoid arthritis therapy: recommendations for application to clinical trials. Arthritis Rheumatol. 2015;67(10):2601–10. https://doi.org/10.1002/art.39235.
- Humby F, Kelly S, Bugatti S, et al. Evaluation of minimally invasive, ultrasound-guided synovial biopsy techniques by the OMERACT Filter–determining validation requirements. J Rheumatol. 2016;43(1):208–13. https://doi.org/10.3899/jrheum.141199. [published Online First: 20150601].
- Humby F, Romão VC, Manzo A, et al. A multicenter retrospective analysis evaluating performance of synovial biopsy techniques in patients with inflammatory arthritis: arthroscopic versus ultrasound-guided versus blind needle biopsy. Arthritis Rheumatol. 2018;70(5):702–10. https://doi.org/10.1002/art.40433. [published Online First: 20180402].
- Scirè CA, Epis O, Codullo V, et al. Immunohistological assessment of the synovial tissue in small joints in rheumatoid arthritis: validation of a minimally invasive ultrasound-guided synovial biopsy procedure. Arthritis Res Ther. 2007;9(5):R101. https://doi.org/10.1186/ar2302.
- Kelly S, Humby F, Filer A, et al. Ultrasound-guided synovial biopsy: a safe, well-tolerated and reliable technique for obtaining high-quality synovial tissue from both large and small joints in early arthritis patients. Ann Rheum Dis. 2015;74(3):611–7. https://doi.org/10.1136/annrheumdis-2013-204603. [published Online First: 20131213].
- Tortora S, Messina C, Albano D, et al. Ultrasound-guided musculoskeletal interventional procedures around the elbow, hand and wrist excluding carpal tunnel procedures. J Ultrason. 2021;21(85):e169–76. https://doi.org/10.15557/JoU.2021.0027. [published Online First: 20210618].
- Michelotti BF, Chung KC. Diagnostic wrist arthroscopy. Hand Clin. 2017;33(4):571–83. https://doi.org/10.1016/j.hcl.2017.06.004.
- Lazarou I, Kelly SG, Meric de Bellefon L. Ultrasound-guided synovial biopsies of wrists, metacarpophalangeal, metatarsophalangeal, interphalangeal joints, and tendon sheaths. Front Med (Lausanne). 2019;6:2. https://doi.org/10.3389/fmed.2019.00002. [published Online First: 20190121].
- Lampe EW. Surgical anatomy of the hand. With special reference to infections and trauma. Clin Symp. 1988;40(3):1–36.
- Najm A, Costantino F, Alivernini S, et al. EULAR points to consider for minimal reporting requirements in synovial tissue research in rheumatology. Ann Rheum Dis. 2022;81(12):1640–6. https://doi.org/10.1136/annrheumdis-2021-221875. [published OnlineFirst: 20220224].
- Bruyn GA, Iagnocco A, Naredo E, et al. OMERACT definitions for ultrasonographic pathologies and elementary lesions of rheumatic disorders 15 years on. J Rheumatol. 2019;46(10):1388–93. https://doi.org/10.3899/jrheum.181095. [published Online First: 20190201].
- Krenn V, Morawietz L, Burmester GR, et al. Synovitis score: discrimination between chronic low-grade and high-grade synovitis. Histopathology. 2006;49(4):358–64. https://doi.org/10.1111/j.1365-2559.2006.02508.x.
- Baeten D, Kruithof E, De Rycke L, et al. Diagnostic classification of spondylarthropathy and rheumatoid arthritis by synovial histopathology: a prospective study in 154 consecutive patients. Arthritis Rheum. 2004;50(9):2931–41. https://doi.org/10.1002/art.20476.
- Manzo A, Paoletti S, Carulli M, et al. Systematic microanatomical analysis of CXCL13 and CCL21 in situ production and progressive lymphoid organization in rheumatoid synovitis. Eur J Immunol. 2005;35(5):1347–59. https://doi.org/10.1002/eji.200425830.
- Terslev L, Naredo E, Aegerter P, et al. Scoring ultrasound synovitis in rheumatoid arthritis: a EULAR-OMERACT ultrasound taskforce-Part 2: reliability and application to multiple joints of a standardised consensus-based scoring system. RMD Open. 2017;3(1):e000427. https://doi.org/10.1136/rmdopen-2016-000427. [published Online First: 20170711].
- Kraan MC, Reece RJ, Smeets TJ, et al. Comparison of synovial tissues from the knee joints and the small joints of rheumatoid arthritis patients: implications for pathogenesis and evaluation of treatment. Arthritis Rheum. 2002;46(8):2034–8. https://doi.org/10.1002/art.10556.
- Kirkham B, Portek I, Lee CS, et al. Intraarticular variability of synovial membrane histology, immunohistology, and cytokine mRNA expression in patients with rheumatoid arthritis. J Rheumatol. 1999;26(4):777–84.
- Najm A, Costantino F, Weill C, et al. Impact of synovial biopsy procedures and disease-specific aspects on synovial tissue outcome: a systematic literature review informing the EULAR points to consider for the minimal reporting requirements in synovial tissue research in rheumatology. RMD Open 2022;8(1). https://doi.org/10.1136/rmdopen-2021-002116.
- Rhodes LA, Tan AL, Tanner SF, et al. Regional variation and differential response to therapy for knee synovitis adjacent to the cartilage-pannus junction and suprapatellar pouch in inflammatory arthritis: implications for pathogenesis and treatment. Arthritis Rheum. 2004;50(8):2428–32. https://doi.org/10.1002/art.20444.
- Steinberg BD, Plancher KD, Idler RS. Percutaneous Kirschner wire fixation through the snuff box: an anatomic study. J Hand Surg Am. 1995;20(1):57–62. https://doi.org/10.1016/s0363-5023(05)80059-0.
- Korcek L, Wongworawat M. Evaluation of the safe zone for percutaneous Kirschner-wire placement in the distal radius: cadaveric study. Clin Anat. 2011;24(8):1005–9.