Резюме
Потеря беременности может быть определена как потеря до 20 или 24 недель беременности (по первому дню последней менструации) или потеря эмбриона или плода весом менее 400 г, если срок беременности неизвестен. Ежегодно в мире происходит примерно 23 миллиона потерь беременности, что составляет 15-20% от всех клинически установленных беременностей. Потеря беременности обычно связана с физическими последствиями, такими как кровотечение на ранних сроках беременности, которое варьируется по степени тяжести от кровянистых выделений до геморрагии. Однако это также может быть связано с глубоким психологическим расстройством, которое могут испытывать оба партнера и которое может включать чувство отрицания, шок, тревогу, депрессию, посттравматическое стрессовое расстройство и суицид. Прогестерон играет ключевую роль в сохранении беременности, и прием прогестерона был оценен как профилактическая мера у пациенток с повышенным риском потери беременности. Основная цель этой статьи – оценить доказательства применения различных форм прогестагенов в лечении угрожающей и рецидивирующей потери беременности, исходя из предположения, что оптимальный план лечения должен преимущественно включать валидированный метод психологической поддержки в качестве дополнения к соответствующему фармакологическому лечению.
Ключевые слова: дидрогестерон; потеря беременности; прогестерон; прогестаген; психологическая поддержка;
1. Вступление
Потеря беременности (ПБ) определяется как потеря беременности до 20 или 24 недель беременности (по первому дню последней менструации) или потеря эмбриона или плода весом менее 400 г, если срок беременности неизвестен [1,2,3,4]. Вагинальное кровотечение в течение первых 20 недель беременности, с болью или без нее, с жизнеспособным плодом, находящимся внутри матки, без расширения или сглаживания шейки матки, известное как угрожающее ПБ [2,3,5,6]. Рецидивирующая ПБ определяется как прерывание двух или более беременностей, или трех и более беременностей до достижения плодом жизнеспособности [2,7,8,9,10,11]. Примерно 23 миллиона потерь беременности случаются в мире ежегодно, что составляет 15-20% от всех клинически признанных беременностей, причем 1-2% женщин, которые пытаются забеременеть, испытывают повторные потери, хотя реальная частота может быть гораздо выше [1,2,3,12,13].
С ПБ связаны как физические, так и психологические последствия. Кровотечение на ранних сроках беременности является типичным и может варьировать по степени тяжести от кровянистых выделений до геморрагии [1,2,3,5,13]. Психологическое воздействие может ощущаться обоими партнерами и включать чувство отрицания, шок, тревогу, депрессию, посттравматическое стрессовое расстройство и суицид [2,13,14,15,16,17]. Последствия ПБ являются более масштабными, если учесть повышенный риск акушерских осложнений, таких как мертворождение во время последующих беременностей, потенциальные долгосрочные проблемы со здоровьем, такие как сердечно-сосудистые заболевания и венозная тромбоэмболия, а также экономические затраты для систем здравоохранения и общества: Только в Соединенном Королевстве экономические затраты на ПБ составляют около 471 миллиона фунтов стерлингов в год [13].
Важность прогестерона на ранних сроках беременности и вероятность того, что дефицит прогестерона может привести к ПБ, уже давно теоретически обоснована [18,19,20]. Как следствие, экзогенные прогестагены широко используются для борьбы с дефицитом, который может привести к бесплодию и ПБ.
В этой статье мы обсуждаем лечение прогестагенами при ПБ и важность его сочетания с психологической поддержкой.
2. Стратегия поиска и критерии отбора
Мы провели комплексный поиск литературы в PubMed и Кокрановской библиотеке (с момента создания базы данных до марта 2022 г. ) относительно соответствующих рандомизированных клинических исследований (РКИ), систематических обзоров и мета-анализов, используя комбинацию свободных текстовых поисковых терминов и терминов и названий MeSH, связанных с темой “Аборты, угроза прерывания беременности”, ‘Угроза преждевременной беременности’, ‘Угроза выкидыша’, ‘Угроза преждевременных родов’, ‘Осложнения беременности’, ‘Спонтанный аборт’, ‘аборт’, ‘выкидыш’, ‘прогестерон’, ’17-OHPC, ’17α-гидроксипрогестерона капроат’, ’17p’, ’17-альфагидроксипрогестерон’ и ‘прогестагены’. Кроме того, мы вручную провели поиск в списках литературы всех соответствующих статей. Были отобраны только англоязычные публикации.
3. Прогестагены во время беременности
Прогестерон – это женский половой гормон с мультимодальным действием, который необходим для успешной имплантации и сохранения беременности [1,2,5,21,22,23,24]. Дефицит желтого тела вместе с соответствующим дефицитом прогестерона был постулирован как потенциальный этиологический фактор ПБ [2,3]. Как следствие, для лечения ПБ было оценено несколько фармакологических вмешательств, включая прогестагены, с рекомендациями, отраженными в большинстве клинических руководств (табл.1).
Таблица 1. Краткое изложение рекомендаций по лечению невынашивания беременности.
| Руководство для угрожающих ПБ | |
| Международные и региональные рекомендации/цитирование | Рекомендации/заявления |
| EPC guideline (2015 [5]) | У женщин с клиническим диагнозом угрозы ПБ наблюдается снижение частоты спонтанных ПБ при применении дидрогестерона |
| Australia and New Zealand, RANZCOG guidelines [25] | Прием прогестагенов до второго триместра у женщин с клиническим диагнозом угрозы прерывания беременности может снизить частоту самопроизвольных выкидышей и может быть рассмотрен |
| Национальное руководство/цитата | Рекомендации/заявления |
| UK, NICE guidelines [26] | Предложить вагинальный микронизированный прогестерон 400 мг 2 р/д женщинам с внутриматочной беременностью, подтвержденной сканированием, если у них есть вагинальное кровотечение и ранее был выкидыш. |
| Saudi Arabian guidelines [27] | Пероральные прогестагены, а именно дидрогестерон, хорошо переносятся и эффективно уменьшают количество выкидышей у женщин с риском угрозы прерывания беременности |
| Имеющихся доказательств недостаточно, чтобы рекомендовать использование вагинальных прогестагенов для лечения угрозы прерывания беременности | |
| Malaysian guidelines [29] | Женщинам можно назначать:
Пероральным дидрогестероном (10 мг 2 р/д) от начала кровотечения до 1 недели после его остановки Пероральным дидрогестероном (10 мг р/д от начала кровотечения до 16-й недели беременности) или микронизированным прогестероном (400 мг р/д вагинально/ректально), если в анамнезе женщины был ≥1 предыдущий выкидыш |
| FOGSI guidelines [30] | Женщины могут лечиться МВП (400 мг/сут до остановки кровотечения) или пероральным дидрогестероном (начальная доза 40 мг, затем 20-30 мг/сут до 7 дней после остановки кровотечения). |
| Chinese guidelines [31] | Пероральный дидрогестерон – первый выбор – 40 мг сразу, затем по 10 мг каждые 8 ч до исчезновения симптомов; затем продолжать прием перорального дидрогестерона в течение 1 – 2 недель |
| Vietnamese guidelines [32] | Эндокринные препараты, такие как прогестерон 25 мг × 2 ампулы (внутримышечная инъекция)/день, если есть признаки эндокринной недостаточности или для расслабления мышц матки |
| Vietnamese Hung Vuong Hospital guidelines [33] | Лечить симптомы после исключения инфекционной угрозы прерывания беременности:
Прогестерон 25 мг/ампула (внутримышечная инъекция); 1-4 ампулы/день Полусинтетический (дидрогестерон), максимальная доза 40 мг/сут; Пероральный прогестерон, максимальная доза 600 мг/день |
| Taiwanese guidelines, Taiwan Society of Perinatology 2022 [34] | Единственным рекомендуемым лекарственным средством является пероральный дидрогестерон: 40 мг сразу, затем 10 мг 2 раза в день до полной ремиссии симптомов; затем продолжать прием дидрогестерона по 10 мг 2 р/д в течение 1-2 недель |
| Indonesian guidelines [35] | Естественные прогестагены можно использовать как терапию при угрозе выкидыша
Рекомендации по лечению включают Дидрогестерон начальная доза 40 мг перорально, затем 3 × 10 мг до остановки кровотечения. Затем уменьшить дозу до 2 × 10 мг до 16 недель беременности Прогестерон 2 × 400 мг перорально до 12 недель беременности Пессарий прогестерона 2 × 400 мг ректально Прогестерон гель 8%, 90 мг, 1-2 раза/день вагинально Дидроксипрогестерон 250 мг/неделю, внутримышечно |
| Mexican guidelines [36] | Существующих доказательств недостаточно для назначения прогестерона; однако использование прогестерона рекомендуется для избежания экстренной и ненужной медицинской процедуры, а также для успокоения пациентки. |
| Philippines [37] | Данные ограничены и требуют дальнейших исследований, однако есть определенные доказательства того, что лечение прогестероном может снизить риск ПБ даже у женщин без рецидивов ПБ в анамнезе.
Прогестерон доступен для применения в трех формах: пероральной, внутримышечной и интравагинальной. Среди этих препаратов пероральный прогестерон является более эффективным для лечения женщин с угрозой возникновения ПБ Прогестерон, особенно пероральный дидрогестерон, может назначаться для лечения угрозы ПБ у женщин с рецидивами ПБ в анамнезе |
| Рекомендации относительно рецидивирующей ПБ | |
| Международные и региональные рекомендации/цитирование | Рекомендации/заявления |
| EPC guideline [5] | У женщин с клиническим диагнозом повторного выкидыша (три или более) наблюдается снижение частоты выкидышей при применении дидрогестерона |
| ESHRE guideline [7] | Вагинальный прогестерон на ранних сроках беременности не имеет положительного эффекта у женщин с необъяснимой рецидивирующией ПБ. Существуют некоторые доказательства того, что дидрогестерон, который начинают применять, когда можно подтвердить работу сердца плода, может быть эффективным, но требуются дополнительные исследования. |
| German (DGGG), Austrian (OEGGG), and Swiss (SGGG) Societies of Gynecology and Obstetrics guideline [10] | Синтетические прогестагены b можно назначать женщинам с идиопатическим рецидивирующим невынашиванием в первом триместре беременности для предотвращения выкидышей |
| Лечение натуральным микронизированным прогестероном в первом триместре беременности для предотвращения невынашивания не рекомендуется женщинам с идиопатическим рецидивирующим невынашиванием | |
| Национальное руководство/цитата | Рекомендации/заявления |
| UK, Royal College of Obstetricians and Gynaecologists guidelines [11] | Существует недостаточно доказательств для оценки влияния добавок прогестерона во время беременности для предотвращения выкидыша у женщин с повторным невынашиванием беременности |
| American Society for Reproductive Medicine [8] | У пациенток с тремя или более выкидышами подряд, непосредственно предшествовавших текущей беременности, эмпирическое назначение прогестагена может иметь определенную пользу |
| Saudi Arabian guidelines [27] | Пероральные прогестагены, а именно дидрогестерон, хорошо переносятся и эффективно уменьшают количество выкидышей у женщин с риском идиопатического рецидивирующего невынашивания беременности |
| Имеющихся доказательств недостаточно, чтобы рекомендовать использование вагинальных прогестагенов для лечения повторных выкидышей | |
| Israeli guidelines [38] | Установлено, что поддержка прогестероном имеет преимущество у женщин с рецидивирующими ПБ. Мета-анализы и систематические обзоры выявили преимущество определенных препаратов, таких как дидрогестерон |
| Malaysian guidelines [29] | Может рассмотреть терапию прогестероном у женщин с непонятными повторными выкидышами: Существуют определенные доказательства того, что пероральный прием дидрогестерона является эффективным, если его начать, когда подтверждена сердечная активность плода. |
| FOGSI guidelines [30] | Женщины могут лечиться пероральным дидрогестероном (10 мг 2 р/д до 20 недель беременности) или МВП (400 мг/сутки до 20 недель беременности) |
| Chinese guidelines [31] | Пероральный дидрогестерон – первый выбор: 30 мг/день |
| Taiwanese guidelines, Taiwan Society of Perinatology 2022 [34] |
Пероральный дидрогестерон 10 мг 2 р/д или МВП 400 мг 2 р/д назначают при подтверждении беременности. Лечение следует продолжать до 20-й недели беременности |
| Indonesian guidelines [41] |
Применение дидрогестерона значительно уменьшает риск повторного выкидыша и увеличивает частоту наступления беременности (Рекомендация А)
Применение дидрогестерона является более эффективным и полезным, если его начинать, как только подтверждена сердечная деятельность плода/с лютеиновой фазы, поскольку доказано, что он снижает риск выкидыша (Рекомендация А). |
| Vietnamese guidelines [32] | Вариант лечения зависит от причины повторного выкидыша; в случае эндокринной недостаточности: эндокринные добавки, такие как прогестерон 25 мг × 2 ампулы
(глубокая внутримышечная инъекция)/день, эстроген 2 мг/день |
| Philippines [37] | Существует польза от применения прогестагенов перорально (медроксипрогестерона ацетат 10 мг/сут или дидрогестерон 20-30 мг/сут до ≥12 недель) или внутримышечно (гидроксипрогестерона капроат 500 мг/неделю до 36 недель) для предотвращения ПБ у женщин, которые имели в анамнезе рецидивирующие ПБ.
Существует недостаточно доказательств, чтобы показать любой желаемый путь, дозировку или продолжительность лечения |
a Капсулы, суппозитории, микронизированные или гели; b вспомогательный набор данных включает дидрогестерон в группе синтетических прогестагенов [42]. 2 р/д – дважды в день; EКП – Европейский клуб прогестинов; ESHRE – Европейское общество репродукции человека и эмбриологии; FOGSI – Федерация акушерских и гинекологических обществ Индии; МВП – микронизированный вагинальный прогестерон; NICE – Национальный институт усовершенствования здравоохранения и медицинской помощи; ПБ – потеря беременности; RANZCOG – Королевский австралийский и новозеландский колледж акушеров-гинекологов; Великобритания – Соединенное Королевство.
Прогестагены – это стероидные гормоны, которые связываются с рецепторами прогестерона и активируют их [3,43,44,45]. Различия в химической структуре прогестагенов, приводящие к различной селективности связывания с рецепторами (андрогены, глюкокортикоиды, эстрогены и минералокортикоиды), эффективности и биодоступности, могут приводить к различным побочным эффектам, включая потенциально вредное воздействие на развивающийся плод, а это означает, что не все прогестагены пригодны для использования во время беременности [44,45,46]. Из-за перекрестной реактивности с другими рецепторами единственными прогестагенами, разрешенными для применения во время беременности, являются прогестерон, дидрогестерон и 17α-гидроксипрогестерона капроат [44,47,48]. Они доступны в различных формах для клинического применения, включая пероральные, вагинальные и внутримышечные препараты [44,49,50]. Исследования показали, что для профилактики ПБ вагинальный прогестерон может быть более эффективным, чем внутримышечные инъекции [51,52], а недавние мета-анализы пришли к выводу, что пероральные прогестагены могут быть столь же эффективными, как и прогестагены, вводимые внутримышечно или вагинально [1,2,3].
4. Использование прогестагенов при потере беременности
Применение прогестерона оценивали у женщин с угрозой ПБ или у женщин с рецидивами ПБ.
4.1. Угроза прерывания беременности
Многие исследования изучали способность прогестагенов лечить угрозу ПБ. Wahabi и соавт. провели попарный мета-анализ семи исследований (с участием 696 участниц) для изучения эффективности прогестагенов в лечении угрозы ПБ и обнаружили, что применение прогестагенов по сравнению с плацебо или отсутствием лечения снижает риск ПБ (отношение рисков [ОР] 0,64, 95% доверительный интервал [ДИ] 0,47-0,87) [3]. Аналогично, Wang и соавт. и Li и соавт. оценили РКИ, в которых сравнивали прогестаген с плацебо, без лечения или любым другим лечением, и сообщили об относительных рисках 0,64 (95% ДИ 0,48-0,85) [53] и 0,73 (95% ДИ 0,59-0,92) [54] соответственно. Вывод последнего исследования Li и соавт. о том, что польза наблюдалась только при применении пероральных прогестагенов, а не вагинального прогестерона [54], был подвергнут критике Devall и соавт., которые пришли к выводу, что использованные вспомогательные исследования имели высокий риск предвзятости, и что для дальнейшей оценки эффективности и безопасности пероральных прогестагенов необходимы более качественные рандомизированные исследования [55]. Li и соавт. впоследствии согласились с этой оценкой и подтвердили, что именно по этой причине их оригинальную публикацию, которая подчеркивает их выводы относительно пероральных прогестагенов, следует интерпретировать с осторожностью [56]. Недавно в сетевом мета-анализе оценивали эффективность и безопасность различных прогестагенов в лечении угрозы ПБ и подтвердили, что прогестагены эффективны в снижении риска ПБ [57].
4.2. Повторная потеря беременности
Ряд исследований, включая РКИ, оценивали эффективность прогестагенов при рецидивирующих ПБ. Haas и соавт. провели попарный мета-анализ 10 исследований (с общим количеством участниц 1684) для изучения эффективности прогестагенов в лечении рецидивирующих ПБ. Они сравнивали прогестаген с плацебо или отсутствием лечения и обнаружили, что применение прогестагенов снижает риск рецидива ПБ (ОР 0,73, 95% ДИ 0,54-1,00) [2].
4.3. Какой прогестаген следует использовать при потере беременности?
Много внимания уделяется способности микронизированного вагинального прогестерона (МВП) снижать риск будущих ПБ у женщин, страдающих рецидивирующей ПБ. В исследовании PROMISE – двойном слепом плацебо-контролируемом исследовании, в котором 836 женщин с необъяснимыми рецидивирующими ПБ были распределены случайным образом на прием суппозиториев МВП дважды в день (n = 404) или соответствующего плацебо (n = 432) с момента получения положительного результата теста на беременность до 12 недели беременности – лечение МВП достоверно (p = 0. 45) улучшить показатель живорождаемости (ПЖР) (65,8% МВП против 63,3% плацебо [ОР 1,04, 95% ДИ 0,94-1,15]) [58]. Аналогично, исследование PRISM (еще одно двойное слепое, плацебо-контролируемое, рандомизированное исследование по оценке МВП по сравнению с плацебо у 4153 женщин с вагинальными кровотечениями на ранних сроках беременности) не выявило статистически значимой разницы в показателях ПЖР (первичная конечная точка) между группами лечения: Из 2079 женщин, получавших МВП, и 2074 женщин, получавших плацебо, ПЖР составил 75% в группе МВП по сравнению с 72% в группе плацебо (ОР 1,03, 95% ДИ 1,00-1,07; p = 0,08) [59]. Предварительно определенный анализ данных в подгруппах выявил значительный подгрупповой эффект у женщин, перенесших ≥3 предыдущих ПБ (ПЖР 72% в группе МВП по сравнению с 57% в группе плацебо: ОР 1,28, 95% ДИ 1,08-1,51; р = 0,007) [59]. Дальнейший post hoc анализ подгрупп показал, что МВП был эффективным у женщин, перенесших ≥ 1 предыдущей ПБ (ОР 75% с МВП против 70% с плацебо; ОР 1,09, 95% ДИ 1,03-1,15; p = 0,003) [60].
Результаты подгруппы PRISM подтверждают данные мета-анализов, которые пришли к выводу, что прогестагены могут предотвращать ПБ у женщин с рецидивирующими ПБ [2,42,61], что заставило Национальный институт здравоохранения и качества медицинской помощи пересмотреть свои руководства и рекомендовать использование МВП вне показаний [26]. Однако преимущество МВП над другими формами прогестерона не является очевидным. Двойное слепое, рандомизированное, плацебо-контролируемое исследование прогестагена дидрогестерона продемонстрировало его эффективность у женщин с рецидивирующими ПБ [62], но подобных надежных исследований для других прогестагенов нет.
5. Пути введения прогестагенов и предпочтения пациенток и врачей
Прогестагены отличаются по своей эффективности, селективности связывания с рецепторами, биодоступности и способу введения, и эти факторы должны определять выбор наиболее подходящего лечения [44,46]. Несмотря на микронизацию, пероральному применению прогестерона все еще препятствует низкая биодоступность [44], а это означает, что требуются высокие дозы, что приводит к побочным эффектам, таким как сонливость, тошнота и головная боль [46,63,64,65]. Вагинальное введение микронизированного прогестерона улучшает концентрацию в матке, но может вызвать раздражение, вагинальные выделения и кровотечение; часто является неприятным; или может привести к вымыванию препарата, если кровотечение сильное [64,66,67,68]. Оптимальный уровень прогестерона в крови достигается при внутримышечном введении, но может вызвать образование абсцессов и быть чрезвычайно болезненным [67].
Вагинальные и пероральные препараты являются наиболее широко изученными при ПБ, и очень вероятно, что пациентки будут отдавать предпочтение той или иной форме на основе удобства и переносимости. Хотя можно предположить, что удобство и отсутствие вагинальных побочных эффектов могут привести к предпочтению перорального приема, исследования в этом отношении не проводились в условиях рецидивирующего ПБ. Однако исследования других гинекологических заболеваний показали, что как пациентки, так и медицинские работники в целом предпочитают пероральное применение перед вагинальным [69,70,71,72], а пероральный дидрогестерон стал широко применяться во время беременности.
6. Дидрогестерон
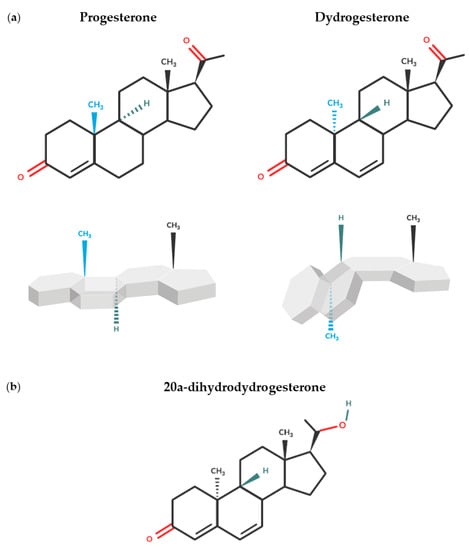
Дидрогестерон является ретропрогестероном и мощным и селективным пероральным агонистом рецепторов прогестерона [44,73]. Изменение пространственной ориентации метильной группы при 10-м углероде и двойная связь между карбонами 6 и 7 отличают дидрогестерон от прогестерона и придают ему “изогнутую” форму (рис. 1а) [46,64,73]. Эта уникальная структура обусловливает высокую пероральную биодоступность, а высокая селективность дидрогестерона к прогестероновому рецептору означает, что его можно применять в дозах, в 10-20 раз ниже, чем у микронизированного прогестерона для перорального применения [44,64,74]. Кроме того, в отличие от других форм прогестерона, основной метаболит дидрогестерона, 20α-дигидрогестерон (рис. 1б), проявляет подобную прогестагенную селективность к исходной молекуле, что сводит к минимуму нежелательные побочные эффекты (ПЭ) [44].
Рисунок 1. Химические структуры (а) прогестерона и дидрогестерона и связанная с этим разница в пространственной конформации и (б) основного метаболита дидрогестерона, 20α-дигидрогестерона.
6.1. Эффективность дидрогестерона при потере беременности
Существуют публикации, которые не являются релевантными для обсуждения из-за их возраста, качества и дизайна [75]; однако в последнее время появилось большое количество доказательств (включая РКИ, обзоры и мета-анализы), подтверждающих эффективность дидрогестерона как при угрожающем (табл. 2), так и при рецидивирующем (табл. 3) ПБ.
Таблица 2. Дидрогестерон при угрозе прерывания беременности.
| Показатель ПБ | ||||||
|---|---|---|---|---|---|---|
| РКИ | Лечение дидрогестероном | Контрольное лечение | Дидрогестерон | Контрольная или нелеченная группа | ОР/ОШ
(95% ДИ) |
p Value |
| [76] | Дидрогестерон 40 мг, затем 10 мг в/в (n = 74) до остановки кровотечения или консервативная терапия с постельным режимом и фолиевой кислотой | Все женщины получали постельный режим и фолиевую кислоту (n = 80) | 4.1% | 13.8% | – | p = 0.037 |
| [77] | Стандартная поддерживающая терапия и дидрогестерон 10 мг 2 р/д (n = 86) до 1 недели после остановки кровотечения | Все женщины получали стандартную поддерживающую терапию a (n = 60) | 17.5% | 25.0% | – | p < 0.05 |
| [78] | Дидрогестерон 40 мг (стандартная доза), затем 10 мг 2 р/д (n = 96) до 16-й недели | Консервативное лечение с постельным режимом (n = 95) | 12.5% | 28.4% | – | p < 0.05 |
| [79] | Дидрогестерон 10 мг 2 р/д (n = 71) в течение 2 недель | Пероральный микронизированный прогестерон 200 мг 2 р/д (n = 70) в течение 2 недель | 15.2% | 10.2% | – | p = 0.581 |
| [80] | Дидрогестерон 40 мг (статическая доза), затем 10 мг 3 р/д (n = 203) до 12-й недели или через 1 неделю после прекращения кровотечения | Плацебо (n = 203) | 12.8% | 14.3% | ОР: 0.897 (0.548–1.467) |
p = 0.772 |
| Показатель ПБ | ||||||
| Мета-анализ | Набор данных | Основной результат | Дидрогестерон | Контроль | ОР/ОШ
(95% ДИ) |
p Value |
| [67] | Дидрогестерон против плацебо или консервативного лечения
Пять исследований (n = 660) |
Значительное b снижение частоты выкидышей при применении дидрогестерона | 13.0% | 24.0% | ОШ: 0.47 (0.31–0.70) |
не применяетсяb |
| [6] | Дидрогестерон против контроля
(консервативное лечение) Три исследования (n = 491) |
Значительное снижение частоты выкидышей при применении дидрогестерона | 11.7% | 22.6% | ОШ: 0.43 (0.26–0.71) |
p = 0.001 |
| Вагинальный прогестерон по сравнению с контролем (плацебо или консервативное лечение)
Четыре исследования (n = 286) |
Снижение частоты выкидышей при применении вагинального прогестерона (незначительное) | 15.4% | 20.3% | ОШ: 0.72 (0.39–1.34) |
p = 0.3 | |
| [3] | Пероральный прогестаген против отсутствия лечения
Три исследования (n = 408); дидрогестерон два исследования (n = 337) |
Значительное снижение частоты выкидышей при применении пероральных прогестагенов (включая дидрогестерон) | не применяется | не применяется | ОР: 0.57 (0.38–0.85) |
p = 0.0059 |
| Вагинальный прогестерон против плацебо
Четыре исследования (n = 288) |
Незначительный или отсутствует эффект лечения вагинальным прогестероном | не применяется | не применяется | ОР: 0.75 (0.47–1.21) |
p = 0.24 | |
| [54] | Прогестагены по сравнению с плацебо или без лечения
Десять исследований (n = 5104); дидрогестерон по сравнению с плацебо или без лечения, четыре исследования (n = 563) |
Пероральные прогестагены могут оказывать положительное влияние на частоту ПБ: положительное влияние наблюдается только при использовании пероральных прогестагенов, но не вагинального прогестерона | 18.5% | 21.9% | ОР: 0.73 (0.59–0.92) |
p = 0.01 |
| [57] | Прогестагены против других препаратов прогестерона или плацебо
59 исследований (n = 10 424); дидрогестерон по сравнению с другими препаратами прогестерона или плацебо, 49 исследований (n = 2793) |
Дидрогестерон достоверно снижал риск выкидыша по сравнению с вагинальным, в/м и пероральным микронизированным прогестероном или плацебо | не применяется | не применяется | Вагинальный
ОШ: 0.50 (0.34-0.74) |
p = 0.002 |
| В/м
ОШ: 0.41 (0.32-0.54) |
p = 0.006 | |||||
| Пероральный
ОШ: 0.37 (0.28-0.48) |
p < 0.001 | |||||
| Плацебо
ОШ: 0.42 (0.29-0.61) |
p < 0.001 | |||||
a Железо, фолиевая кислота, поливитаминные добавки и рекомендованный постельный режим; b P value не указано. 2 р/д – дважды в день; ДИ – доверительный интервал; в/м – внутримышечно; НП – не применяется; ОШ – отношение шансов; ПБ – потеря беременности; РКИ – рандомизированное клиническое исследование; ОР – отношение рисков; 3 р/д – трижды в день.
Таблица 3. Дидрогестерон при повторной потере беременности.
| Показатель ПБ | ||||||
|---|---|---|---|---|---|---|
| РКИ | Лечение дидрогестероном | Контрольное лечение | Дидрогестерон | Контрольная или нелеченная группа | ОР/ОШ
(95% ДИ) |
p Value |
| [81] | Дидрогестерон 10 мг 2 р/д (n = 82) до 12-й недели беременности | Без дополнительного лечения (n = 48) | 13.4% | 29.0% | – | p = 0.028 |
| [62] | Дидрогестерон 20 мг/сут (n = 175) до 20-й недели беременности | Плацебо (n = 173) | 6.9% | 16.8% | – | p = 0.004 |
| Показатель ПБ | ||||||
| Мета-анализ | Набор данных | Основной результат | Прогестаген | Контроль | ОР/ОШ
(95% ДИ) |
p Value |
| [82] | Дидрогестерон по сравнению с плацебо или консервативным лечением (стандартное лечение)
Три исследования (n = 509) |
Значительное снижение частоты выкидышей при применении дидрогестерона | 10.5% | 23.5% | ОШ: 0.29 (0.13–0.65) |
не применяется a |
| [42] | Прогестагены против плацебо или отсутствия лечения
Десять исследований (n = 1586); дидрогестерон по сравнению с плацебо или без лечения, три исследования (n = 277) |
Более низкий риск выкидыша при лечении прогестагенами | – | – | ОР: 0.72 (0.53–0.97) |
p = 0.03 |
| [2] | Прогестагены против плацебо или
без лечения Десять исследований (n = 1684); дидрогестерон по сравнению с плацебо или без лечения, три исследования (n = 518) |
Численное снижение частоты выкидышей при лечении прогестагенами (несущественное) | 20.1% | 27.5% | ОР: 0.73 (0.54–1.00) b |
p = 0.10 |
a p value не указано; b два из трех исследований с использованием дидрогестерона показали четкое снижение риска ПБ при лечении прогестагеном [62,81]. 2 р/д – дважды в день; ДИ – доверительный интервал; НП – не применяется; ОШ – отношение шансов; ПБ – потеря беременности; РКИ – рандомизированное клиническое исследование; ОР – отношение рисков.
Три РКИ показали, что женщины с угрозой ПБ, получавшие дидрогестерон, имели достоверно (p <0,05) более низкую частоту ПБ по сравнению с женщинами, получавшими постельный режим с поддерживающей терапией или без нее [76,77,78]. Это подтверждается различными мета-анализами, которые демонстрируют достоверное (p = 0,001) снижение частоты ПБ при применении пероральных прогестагенов, включая дидрогестерон [3,6]. В каждом случае препараты сравнения имели незначительный или вообще не имели лечебного эффекта и существенно не снижали частоту ПБ (табл. 2). В более позднем мета-анализе Zhao и соавт. оценили эффективность и безопасность различных прогестагенов в 59 РКИ, в которых участвовали 10 424 женщины, и также пришли к выводу, что пероральный дидрогестерон был более эффективным в лечении угрозы ПБ, чем вагинальный прогестерон [57].
Основные данные об эффективности дидрогестерона при рецидивирующих ПБ приведены в таблице 3. Два РКИ продемонстрировали, что женщины с рецидивирующими ПБ, получавшие дидрогестерон, имели достоверно (p <0,05) более низкие показатели ПБ, чем те, которые получали плацебо или не получали дополнительного лечения. [62,81]. Два мета-анализа сообщили о подобных положительных эффектах дидрогестерона у женщин с рецидивирующими ПБ. Один из них оценивал три исследования (n = 509) и пришел к выводу, что дидрогестерон вызывает существенное снижение частоты ПБ по сравнению с плацебо или консервативным лечением [82]. В другом исследовании, которое оценивало всего 10 исследований (n = 1684), изучавших прогестагены по сравнению с плацебо или отсутствием лечения [2], был сделан вывод о численном снижении частоты ПБ при лечении прогестагенами, в том числе и в исследованиях с использованием дидрогестерона. Примечательно, что в этом последнем мета-анализе два исследования, которые показали четкое снижение риска ПБ при лечении прогестагенами, были двумя из трех, в которых использовался дидрогестерон [2,62,81]. Эти результаты подтверждаются еще одним РКИ, в котором сравнивали дидрогестерон с вагинальным прогестероном у женщин с рецидивирующей ПБ, в котором было обнаружено, что для полной остановки кровотечения требуется меньше времени у пациенток, получавших дидрогестерон, по сравнению с пациентками, получавшими вагинальный прогестерон (53,90 ± 9,09 против 94,60 ± 7,29 ч, р <9,09 ч, р < 0,0001) [83].
Недавно Devall и соавт. провели сетевой мета-анализ (который объединил прямые и косвенные доказательства относительных эффектов лечения для достижения единого согласованного анализа) для оценки прогестагенов с целью профилактики ПБ и пришли к выводу, что прогестагены, вероятно, имеют незначительную или нулевую разницу в ПЖР у женщин с угрожающей или рецидивирующей ПБ; однако, МВП могут увеличивать ПЖР у женщин с ≥ 1 предыдущей ПБ в анамнезе и кровотечением на ранних сроках беременности [1]. Они также пришли к выводу, что все еще существует неопределенность относительно эффективности и безопасности альтернативных методов лечения прогестагенами при угрозе и рецидиве ПБ [1].
Интересно отметить, что сетевой мета-анализ, проведенный Devall и соавт., включал семь РКИ, только одна из которых была посвящена исследованию дидрогестерона [1]. В противоположность этому, Zhao и соавт. включили значительно большее количество РКИ, с большой долей тех, что исследовали дидрогестерон [57]. Фактически, современные руководства отражают совокупность доказательств и поддерживают применение дидрогестерона как при угрожающем, так и при рецидивирующем ПБ, что свидетельствует о хорошем профиле эффективности и безопасности, с низкой частотой осложнений у матери и плода (табл. 1). Субъективный характер решения об исключении или включении исследований в сетевые мета-анализы еще раз подчеркивает ценность и важность постоянного учета первичных данных и проведения систематических обзоров с мета-анализом.
6.2. Безопасность применения дидрогестерона во время беременности
Дидрогестерон продается и используется с 1960-х годов для лечения ряда состояний, связанных с недостаточностью прогестерона, и показан для лечения как угрожающей, так и рецидивирующей ПБ во многих странах мира [47,84]. На основе данных о кумулятивной экспозиции дидрогестерона с апреля 1960 года по апрель 2021 года оценивается, что постмаркетинговая экспозиция пациенток составляет 137,5 млн лет лечения. В 2014 году, исходя из данных о продажах, сообщалось, что с апреля 1960 года по апрель 2014 года дидрогестерон внутриутробно влиял на более 20 миллионов беременностей [85]. В период с 1977 по 2005 год данные фармаконадзора выявили лишь 28 случаев врожденных пороков развития, которые потенциально могут быть связаны с влиянием дидрогестерона на плод [86]. Это может быть связано с уникальной структурой дидрогестерона, которая обеспечивает эффективность при пероральном применении в низких терапевтических дозах, избегая проблем переносимости, связанных с вагинальным введением прогестерона. Кроме того, высокая селективность дидрогестерона к рецепторам прогестерона может помочь ограничить риск побочных эффектов [44], что подтверждается хорошо изученным профилем безопасности дидрогестерона, который не вызывает значительных опасений относительно безопасности для матери или развивающегося плода при применении во время беременности [87].
6.2.1. Материнская безопасность
Доказано, что дидрогестерон имеет хороший профиль безопасности с низкой частотой материнских осложнений. Кроме того, он так же хорошо переносится, как и вагинальный прогестерон, по результатам анализа безопасности, проведенного в исследованиях по оценке применения дидрогестерона для поддержания лютеиновой фазы во время экстракорпорального оплодотворения (ЭКО), а также в исследованиях по изучению применения дидрогестерона при угрожающем и рецидивирующем ПБ [74].
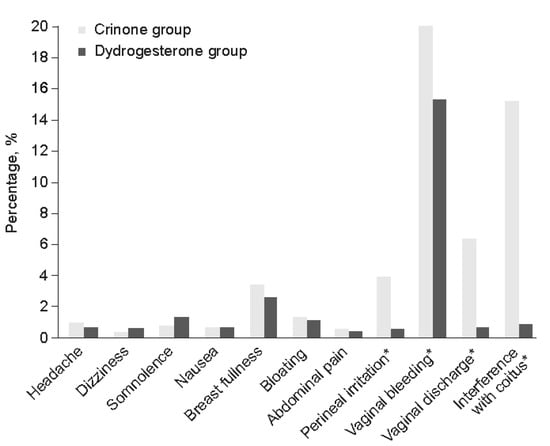
РКИ, в котором сравнивали дидрогестерон и вагинальный прогестероновый гель для поддержки лютеиновой фазы, подтвердило, что пациентки, получавшие прогестероновый гель, имели более высокую частоту вагинального раздражения и выделений, вагинальных кровотечений и препятствий для половой активности по сравнению с пациентками, получавшими дидрогестерон (рис. 2) [68]. Мета-анализ индивидуальных данных участниц исследований поддержки лютеиновой фазы Lotus I и II подтвердил, что частота материнских ПЭ была подобной между группами лечения дидрогестероном и МВП, причем самым распространенным ПЭ было вагинальное кровотечение [88,89,90]. Эти результаты подтверждаются недавним ретроспективным когортным исследованием, которое изучало, влияет ли применение дидрогестерона по сравнению с МВП на результаты беременности при переносе замороженных эмбрионов, и показало, что материнские осложнения были подобными в обеих группах пациенток [91].
Рисунок 2. Переносимость дидрогестерона по сравнению с вагинальным гелем прогестерона (8%) для поддержания лютеиновой фазы [68]. * p < 0,05 по критерию хи-квадрат в пользу группы Кринон. Перепечатка из Eur J Obstet Gynecol Reprod Bio, Vol 186, Tomic V, Tomic J, Klaic DZ и др. Пероральный дидрогестерон по сравнению с вагинальным гелем прогестерона в поддержании лютеиновой фазы: рандомизированное контролируемое исследование, стр. 49-53, Copyright 2015, с разрешения Elsevier.
Этот благоприятный профиль материнской безопасности был имитирован в исследованиях, изучавших применение дидрогестерона как при угрозе, так и при рецидиве ПБ, которые не выявили существенных различий в общем уровне материнских осложнений при применении дидрогестерона по сравнению с пероральным применением микронизированного прогестерона или плацебо [79,80].
6.2.2. Безопасность плода
Благоприятный профиль безопасности дидрогестерона также был отмечен при рассмотрении осложнений для плода, таких как низкий вес при рождении, неонатальная смертность и врожденные аномалии [2,74].
В исследованиях Lotus I и II, а также в дальнейших мета – и субпопуляционных анализах частота врожденных, семейных и генетических нарушений была низкой и подобной между пероральным дидрогестероном и гелем МВП [74,84,88,89,90,92]. Эти результаты были подтверждены более поздними ретроспективными когортными исследованиями. В одном из таких исследований оценивали 3556 младенцев в Китае после ЭКО с использованием протокола дидрогестерон + человеческий менопаузальный гонадотропин (n = 1429) или короткого протокола агониста гонадотропин-рилизинг-гормона (n = 2127) и обнаружили, что эти два протокола не имели различий в характеристиках массы тела при рождении и имели схожую частоту врожденных пороков развития после воздействия дидрогестерона [93]. В другом, более позднем, ретроспективном когортном исследовании изучали, влияет ли применение дидрогестерона по сравнению с МВП на результаты беременности при экстракорпоральном оплодотворении замороженными эмбрионами, и обнаружили, что аномалий развития плода не наблюдалось ни в одной из групп лечения [91]. Аналогично, исследования угрожающего и рецидивирующего ПБ также не выявили существенных различий в плодовых/неонатальных осложнениях при применении дидрогестерона по сравнению с плацебо или МВП [74].
Появились публикации, в которых утверждается, что дидрогестерон обладает тератогенным действием. Из-за плохого дизайна и несоблюдения основных принципов эпидемиологических исследований (различия в материнской популяции, приводящие к путанице, отсутствие подтвержденного влияния дидрогестерона, объединение различных пороков сердца во время оценки, игнорирование сопутствующих заболеваний и социально-экономического статуса), причинно-следственная связь между дидрогестероном и пороками сердца не может и не должна базироваться на исследовании, проведенном Zaqout et al. и соавт. [94]. Аналогично, в другом исследовании, опубликованном в 2020 году, утверждалось, что дидрогестерон имеет тератогенные эффекты после воздействия рекомендованных доз у беременных женщин [95]; однако существенные опасения относительно дизайна исследования, статистического анализа, непоследовательности и неточности представления данных и достоверности выводов побудили журнал отозвать эту статью.
Учитывая широкое применение, значительный тератогенный риск дидрогестерона без проблем с безопасностью представляется очень маловероятным [96]. Достоверность и дальнейшее использование отозванных и некачественных данных недавно поставили под сомнение Katalinic и соавт., которые провели мета-анализ шести РКИ и пришли к выводу, что применение дидрогестерона во время первого триместра беременности не связано со значительным повышением риска врожденных аномалий (ОР 0,96, 95% ДИ 0,57-1,62). Более того, они поддерживают использование дидрогестерона, при наличии показаний, в лечении угрожающего или рецидивирующего ПБ [87].
7. Дополнение фармакологического лечения психологической поддержкой
7.1. Психологическое влияние рискованных беременностей на женщин и результаты беременности
Беременность является рискованной, когда существует повышенная вероятность неблагоприятного исхода для матери или плода, что может произойти по разным причинам, таким как: развитие гипертензивных расстройств беременности, гестационный сахарный диабет, изменения шейки матки и отслойка плаценты, и/или серьезные аномалии, возникающие у ребенка [97,98,99].
Хорошо задокументировано, что беременность с высоким риском может оказать негативное влияние как на психологическое, так и на физическое состояние женщины, вызывая негативные эмоции, такие как страх, шок, горе, вину и дистресс [97,100,101]. Появляется все больше доказательств того, что психологическое благополучие может влиять на течение беременности. Например, повышенный уровень дистресса во время беременности с высоким риском может быть связан с вредными последствиями для ребенка, такими как низкий вес при рождении и преждевременные роды, а недавние публикации в целом свидетельствуют о том, что психологические консультации, которые могут повысить чувство контроля, могут помочь улучшить результаты беременности [97,99,101].
Хотя сейчас все больше внимания уделяется необходимости изучения эмоциональных и психологических проблем, а также медицинских аспектов во время беременности с высоким риском, целью этой статьи является сосредоточиться на тех исследованиях, которые оценивали психологическое благополучие женщин с высоким риском ПБ.
7.2. Психологические последствия потери беременности
Глубокий эмоциональный дистресс и психологическую заболеваемость обычно испытывают женщины с кровотечением при угрозе ПБ, а также женщины с рецидивирующими ПБ [1,2,3,102,103]. Однако сообщалось о разнице между психологическим воздействием однократной потери и многократных ПБ, когда было обнаружено, что депрессивные симптомы или риск психологического дистресса возрастают с увеличением количества предыдущих потерь беременности [104]. Действительно, многочисленные исследования сообщают о высоком уровне тревоги и депрессии у женщин, переживших повторную потерю беременности, причем повторяющийся характер этой потери усиливает эмоциональное воздействие, а ранние этапы новой беременности являются особенно сложным периодом для женщин из-за беспокойства относительно возможности повторной потери беременности [9,14,15,17,102,103,105]. Об этом свидетельствуют результаты фокус-группового исследования, в котором сообщалось, что женщины, пережившие повторные потери беременности, не могли уверенно чувствовать надежду или радость во время периода ожидания и часто использовали “подготовку к худшему” как стратегию преодоления в это время [106].
Вместо того, чтобы снова и снова переживать этот период неопределенности, при отсутствии адекватной эмоциональной поддержки и/или навыков преодоления, некоторые женщины, пережившие рецидивы ПБ, решают больше не пытаться забеременеть [16,107], что подчеркивает необходимость сочетания фармакологического лечения угрожающего и рецидивирующего ПБ с определенной формой психологической поддержки или консультирования как для женщин, так и для их партнеров в этот решающий период [108,109,110].
7.3. Как психологическое состояние женщины влияет на риск потери беременности?
Влияние стресса на риск ПБ изучалось в многочисленных исследованиях. В большом проспективном исследовании стресса, связанного с работой, у почти 4000 беременных женщин было обнаружено, что стресс ассоциируется с более высоким риском ПБ у женщин старше 32 лет (p = 0,04), курящих женщин (p = 0,02), и во время первых беременностей (p = 0,06) [111]. Аналогично, в когортном исследовании 1098 беременных женщин сообщалось, что более высокий уровень воспринимаемого стресса был связан со следующими ПБ (p = 0,024) [112]. В поддержку этих данных мета-анализ восьми исследований “случай-контроль” и когортных исследований показал, что психологический стресс ассоциируется с повышенным риском ПБ (соотношение шансов 1,42) [113], а недавно эти результаты были подтверждены проспективным когортным исследованием 293 женщин, посещавших отделение ранней диагностики беременности, в котором сообщалось, что отсутствие эмоционального благополучия связано с повышенным риском ПБ [114].
7.4. Может ли психологическая поддержка помочь улучшить благополучие пациента и его партнеров?
Ранее было высказано предположение, что существует недостаточно доказательств в поддержку консультирования после ранней ПБ [115]. Тем не менее, недавно появились сообщения о том, что женщины и их партнеры выразили неудовлетворенную потребность в психологических консультациях, которые обеспечат эмоциональную поддержку и стратегии, которые помогут им справиться с ситуацией во время и после ПБ, во время следующей беременности, а также при принятии решения о том, стоит ли пытаться забеременеть снова [105,116,117]. Несмотря на известные психологические и эмоциональные последствия ПБ и потенциальное влияние стресса на результаты беременности, на ранних стадиях новой беременности доступна ограниченная поддержка и консультирование [9]; однако, что обнадеживает, в последние годы эта сфера начала медленно развиваться, чтобы сосредоточиться на опыте пациентки, и все больше исследований теперь сообщают о мыслях и чувствах не только женщин, но и их партнеров, и подтверждают, что как женщины, так и их партнеры подвержены риску развития тревоги и депрессии [118,119,120,121,122].
Хотя психологическая и поддерживающая помощь после ПБ не была широко изучена, ряд психологических вмешательств, таких как консультирование, психотерапия на основе осознанности, когнитивно-поведенческая терапия и мероприятия по позитивной переоценке (МПП), были исследованы в контексте рецидивирующих ПБ и дали многообещающие результаты; получены предварительные доказательства преимуществ в отношении стресса, депрессии и тревоги, причем МПП получила положительные отзывы от пациентов относительно простоты применения и влияния на мышление [9,107,123,124,125,126]. Подтверждением эффективности этих вмешательств стало недавнее исследование с участием 294 женщин, в котором 72,7% (n = 176) родили живых детей, и в котором, как сообщалось, поддерживающая терапия была, вероятно, единственным наиболее эффективным методом лечения [127]. Другое исследование, проведенное среди женщин, перенесших повторные ПБ, подтвердило, что пациент-ориентированная помощь может иметь значительное влияние на вероятность рождения живого ребенка во время следующей беременности; в общем, ПЖР для этих пар составляла около 80% [103]. Более поздние исследования подтвердили, что медицинские работники также признают необходимость лучшего ухода после ПБ и осознают, что необходимо принять срочные меры для улучшения возможностей, которые они предоставляют, включая увеличение информации о ПБ, более эмоционально чувствительный уход во время ПБ и больше вариантов психологической поддержки [108,109,110,128]. Важно, что независимо от вмешательства, большинство установок подчеркивают эту неудовлетворенную потребность и важную роль поддерживающей помощи [7,8,11].
8. Будущие исследования и выводы
Мы подчеркнули, что прогестагены, такие как дидрогестерон, могут быть полезными в лечении угрожающего и рецидивирующего ПБ. Продолжаются исследования для углубления нашего понимания факторов, связанных с пациентками, таких как разнообразие репродуктивного микробиома и его связь с последствиями беременности [129,130,131], а также факторов, связанных с лечением, таких как: комбинированное лечение внутриутробных патологий, иммунного статуса и функции щитовидной железы – так называемая стратегия лечения “OPTIMUM” (OPtimization of Thyroid function, IMmunity, and Uterine Milieu) – может потенциально улучшить результаты беременности [132]; оптимальная продолжительность лечения прогестагенами; влияние начала лечения прогестагенами до зачатия и продолжения во время беременности (практика, которая уже используется в России и рекомендована в национальных клинических руководствах) [39]; генетическое разнообразие рецепторов прогестерона и конкретных популяций пациенток, которые могут получить наибольшую пользу от приема прогестагенов во время беременности [133,134,135]. Другим фактором является потенциальная связь экзогенных прогестагенов с побочными эффектами, связанными с настроением, например, тревожными и депрессивными симптомами. Исследования использования гормональной контрацепции признали, что существует подгруппа женщин, страдающих от побочных эффектов, связанных с настроением, несмотря на внедрение таблеток с меньшей дозой и альтернативных методов введения [136,137]. Совсем недавно использование гормональных контрацептивов было связано с усилением депрессии и ухудшением распознавания эмоций, с предположением, что прогестаген, который содержится в гормональных контрацептивах, вызывает проблемы с настроением [138,139]. В сочетании с некоторыми данными, указывающими на связь между уровнем эндогенного прогестерона и тревожностью [140], а также на роль аллопрегнанолона (3-альфа-восстановленного метаболита прогестерона) в изменении настроения [139], это означает, что могут быть основания для беспокойства относительно использования прогестагенов при ПБ, особенно учитывая то, что пациентки и без того уязвимы к повышенному уровню тревожности и депрессии. Однако исследования этиологии гормонально индуцированных аффективных симптомов остаются неубедительными, и лишь некоторые из них могут напрямую связать уровень гормонов с психопатологией [137,139]; необходимо провести гораздо больше исследований, чтобы определить группы женщин, которые могут иметь больший риск возникновения аффективных побочных эффектов после лечения прогестагенами. Действительно, более глубокое понимание всех этих факторов может углубить наше понимание механизма действия прогестагенов и помочь оптимизировать и персонализировать лечение будущих пациентов.
Учитывая эмоциональную травму, которую многие женщины переживают после ПБ, мы также предположили, что структурированная психологическая поддержка имеет решающее значение для сохранения благополучия пациентки, чтобы заверить ее, что она делает все возможное для поддержания беременности, помочь ей и ее партнеру справиться с эмоциональным воздействием ПБ и поддержать их во время стрессового периода ожидания следующих беременностей. Необходимы дальнейшие исследования для определения наиболее эффективной формы психологической помощи таким пациенткам, а также рекомендации по ее внедрению. Поскольку мы пытаемся выяснить, как результаты новых исследований могут повлиять на результаты лечения, было бы разумно рассмотреть реконцептуализированный, целостный подход к лечению угрожающего и рецидивирующего ПБ, чтобы обеспечить оптимальный уход и поддержку для женщин и их партнеров. Хотя для подтверждения того, что комбинированное фармакологическое и психологическое лечение является более эффективным, чем каждый из этих подходов отдельно, необходимы новые исследования, желательно, чтобы переосмысленный план лечения сочетал валидированный инструмент психологической поддержки как дополнение к соответствующему фармакологическому лечению. Уделяя особое внимание пожеланиям пациентки, этот план также должен быть направлен на решение некоторых разнообразных аспектов, которые могут способствовать ПБ, таким образом, максимизируя будущие шансы на рождение живого ребенка.
Ссылки на источники
- Devall, A.J.; Papadopoulou, A.; Podesek, M.; Haas, D.M.; Price, M.J.; Coomarasamy, A.; Gallos, I.D. Progestogens for preventing miscarriage: A network meta-analysis. Cochrane Database Syst. Rev. 2021, 4, CD013792.
- Haas, D.M.; Hathaway, T.J.; Ramsey, P.S. Progestogen for preventing miscarriage in women with recurrent miscarriage of unclear etiology. Cochrane Database Syst. Rev. 2019, 2019, CD003511.
- Wahabi, H.A.; Fayed, A.A.; Esmaeil, S.A.; Bahkali, K.H. Progestogen for treating threatened miscarriage. Cochrane Database Syst. Rev. 2018, 8, CD005943.
- Zegers-Hochschild, F.; Adamson, G.D.; de Mouzon, J.; Ishihara, O.; Mansour, R.; Nygren, K.; Sullivan, E.; Vanderpoel, S.; International Committee for Monitoring Assisted Reproductive Technology (ICMART); World Health Organization (WHO). International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) revised glossary of ART terminology, 2009. Fertil. Steril. 2009, 92, 1520–1524.
- Schindler, A.E.; Carp, H.; Druckmann, R.; Genazzani, A.R.; Huber, J.; Pasqualini, J.; Schweppe, K.W.; Szekeres-Bartho, J. European Progestin Club Guidelines for prevention and treatment of threatened or recurrent (habitual) miscarriage with progestogens. Gynecol. Endocrinol. 2015, 31, 447–449.
- Lee, H.J.; Park, T.C.; Kim, J.H.; Norwitz, E.; Lee, B. The influence of oral dydrogesterone and vaginal progesterone on threatened abortion: A systematic review and meta-analysis. Biomed. Res. Int. 2017, 2017, 3616875.
- European Society of Human Reproduction and Embryology Early Pregnancy Guideline Development Group. Recurrent Pregnancy Loss. November 2017. Available online: https://www.eshre.eu/Guidelines-and-Legal/Guidelines/Recurrent-pregnancy-loss.aspx (accessed on 24 January 2023).
- Practice Committee of the American Society for Reproductive Medicine (ASRM). Evaluation and treatment of recurrent pregnancy loss: A committee opinion. Fertil. Steril. 2012, 98, 1103–1111.
- Bailey, S.; Boivin, J.; Cheong, Y.; Bailey, C.; Kitson-Reynolds, E.; Macklon, N. Effective support following recurrent pregnancy loss: A randomized controlled feasibility and acceptability study. Reprod. Biomed. Online 2020, 40, 729–742.
- Toth, B.; Würfel, W.; Bohlmann, M.; Zschocke, J.; Rudnik-Schöneborn, S.; Nawroth, F.; Schleussner, E.; Rogenhofer, N.; Wischmann, T.; von Wolff, M.; et al. Recurrent Miscarriage: Diagnostic and Therapeutic Procedures. Guideline of the DGGG, OEGGG and SGGG (S2k-Level, AWMF Registry Number 015/050). Geburtshilfe Frauenheilkd. 2018, 78, 364–381.
- Royal College of Obstetricians and Gynaecologists (RCOG). The Investigation and Treatment of Couples with Recurrent First-trimester and Second-Trimester Miscarriage. Green-Top Guideline No. 17. April 2011. Available online: https://www.rcog.org.uk/media/3cbgonl0/gtg_17.pdf (accessed on 24 January 2023).
- Cohain, J.S.; Buxbaum, R.E.; Mankuta, D. Spontaneous first trimester miscarriage rates per woman among parous women with 1 or more pregnancies of 24 weeks or more. BMC Pregnancy Childbirth 2017, 17, 437.
- Quenby, S.; Gallos, I.D.; Dhillon-Smith, R.K.; Podesek, M.; Stephenson, M.D.; Fisher, J.; Brosens, J.J.; Brewin, J.; Ramhorst, R.; Lucas, E.S.; et al. Miscarriage matters: The epidemiological, physical, psychological, and economic costs of early pregnancy loss. Lancet 2021, 397, 1658–1667.
- He, L.; Wang, T.; Xu, H.; Chen, C.; Liu, Z.; Kang, X.; Zhao, A. Prevalence of depression and anxiety in women with recurrent pregnancy loss and the associated risk factors. Arch. Gynecol. Obstet. 2019, 300, 1061–1066.
- Tavoli, Z.; Mohammadi, M.; Tavoli, A.; Moini, A.; Effatpanah, M.; Khedmat, L.; Montazeri, A. Quality of life and psychological distress in women with recurrent miscarriage: A comparative study. Health Qual. Life Outcomes 2018, 16, 150.
- Venema, V. ‘I Faced Miscarriage Alone—My Partner had to Wait in the Car Park’. Available online: https://www.bbc.co.uk/news/uk-53613348 (accessed on 24 January 2023).
- Kolte, A.M.; Olsen, L.R.; Mikkelsen, E.M.; Christiansen, O.B.; Nielsen, H.S. Depression and emotional stress is highly prevalent among women with recurrent pregnancy loss. Hum. Reprod. 2015, 30, 777–782.
- Csapo, A.I.; Pulkkinen, M.O.; Wiest, W.G. Effects of luteectomy and progesterone replacement therapy in early pregnant patients. Am. J. Obstet. Gynecol. 1973, 115, 759–765.
- Couzinet, B.; Le Strat, N.; Ulmann, A.; Baulieu, E.E.; Schaison, G. Termination of early pregnancy by the progesterone antagonist RU 486 (Mifepristone). N. Engl. J. Med. 1986, 315, 1565–1570.
- Silvestre, L.; Dubois, C.; Renault, M.; Rezvani, Y.; Baulieu, E.E.; Ulmann, A. Voluntary interruption of pregnancy with mifepristone (RU 486) and a prostaglandin analogue. A large-scale French experience. N. Engl. J. Med. 1990, 322, 645–648.
- Corner, G.W.; Csapo, A. Action of the ovarian hormones on uterine muscle. Br. Med. J. 1953, 1, 687–693.
- Okada, H.; Tsuzuki, T.; Murata, H. Decidualization of the human endometrium. Reprod. Med. Biol. 2018, 17, 220–227.
- Polikarpova, A.V.; Levina, I.S.; Sigai, N.V.; Zavarzin, I.V.; Morozov, I.A.; Rubtsov, P.M.; Guseva, A.A.; Smirnova, O.V.; Shchelkunova, T.A. Immunomodulatory effects of progesterone and selective ligands of membrane progesterone receptors. Steroids 2019, 145, 5–18.
- Maurya, V.K.; DeMayo, F.J.; Lydon, J.P. Illuminating the “black box” of progesterone-dependent embryo implantation using engineered mice. Front. Cell Dev. Biol. 2021, 9, 640907.
- Royal Australian and New Zealand College of Obstetricians and Gynaecologists (RANZCOG). Progesterone Support of the Luteal Phase and in the First Trimester. March 2018. Available online: https://ranzcog.edu.au/wp-content/uploads/2022/05/Progesterone-Support-of-the-Luteal-Phase-and-in-the-First-Trimester.pdf (accessed on 24 January 2023).
- National Institute for Health and Care Excellence (NICE). Ectopic Pregnancy and Miscarriage: Diagnosis and Initial Management. Guideline NG126 (Update). 24 November 2021. Available online: https://www.nice.org.uk/guidance/ng126 (accessed on 24 January 2023).
- Arab, H.; Alharbi, A.J.; Oraif, A.; Sagr, E.; Al Madani, H.; Abduljabbar, H.; Bajouh, O.S.; Faden, Y.; Sabr, Y. The role of progestogens in threatened and idiopathic recurrent miscarriage. Int. J. Womens Health 2019, 11, 589–596.
- Sinthamoney, E.; Hamdan, M.; Yan, V.H.; Bhaskaran, V.; Karalasingam, S.D.; Peraba, P.; Dass, S.G.S.; Daud, S.; Shen, V.C.B.; Aznal, S.S.S.; et al. Progestogens in the management of miscarriage and preterm labour. 12 May 2020. Available online: https://www.ogsm.org.my/docs/Clinical-Practice-Guidelines-on-Miscarriage-Management.pdf (accessed on 24 January 2023).
- Patki, A.; Pandit, S.N. FOGSI Position Statement on the Use of Progestogens. 2015. Available online: https://www.fogsi.org/wp-content/uploads/2015/11/Progesterone-position-paper-Oct-2015.pdf (accessed on 24 January 2023).
- Chinese Society of Reproductive Medicine and Chinese Medical Doctor Association. Clinical practice guidelines for progestogens in pregnancy maintenance and luteal phase support. Chin. J. Reprod. Contracep. 2021, 41, 95–105. (In Mandarin)
- Vietnam Ministry of Health. Vietnam Guideline for Obstetrics and Gynecology Disease Management. 2015. Chapter 1: Obstetrics. Threatened Miscarriage. Available online: https://thuvien.benhvienhungvuong.vn/index.php?language=vi&nv=laws&op=detail/Huong-dan-chan-doan-va-dieu-tri-cac-benh-san-phu-khoa-90 (accessed on 24 January 2023). (In Vietnamese)
- Hung Vuong Hospital. Hung Vuong Guideline of Obstetrics and Gynecology Disease Management. Miscarriage: Threatened Miscarriage; Hung Vuong Hospital: Ho Chi Minh City, Vietnam, 2016; pp. 48–53. (In Vietnamese)
- Lai, T.J.; Teng, S.W.; Chang, C.K.; Huang, C.Y. Evidence-Base Recommendation of Progesterone in Early Pregnancy. 2022. Available online: https://www.tsop.org.tw/upload/magazine/20220312150908_magazine_0.pdf (accessed on 24 January 2023). (In Taiwanese).
- Indonesian Society of Reproductive Endocrinology and Fertility (HIFERI). Indonesian National Guidelines for Health Services: Consensus of Threatened Miscarriage; HIFERI: Jakarta Pusat, Indonesia, 2015. (In Indonesian)
- CENETEC. Prevention, Diagnosis, Treatment, and Referral of Patients with Threatened Abortion in Primary and Secondary Levels of Care. Clinical Practice Guidelines: Evidence and Recommendations. Mexico. 2020. Available online: http://www.cenetec-difusion.com/CMGPC/GPC-SS-026-20/ER.pdf (accessed on 24 January 2023). (In Spanish)
- Philippine Obstetrical and Gynecological Society. Clinical Practice Guidelines on Abortion. 2017. Available online: https://pogsinc.org/clinical-practice-guidelines/ (accessed on 24 January 2023).
- Bashiri, A.; Orbito, R.; Carp, H.; Laufer, N.; Blickstein, D.; Vardimon, D.; Yaron, Y.; Solt, I.; Baris-Feldman, H.; Halevy, R.; et al. Recurrent Pregnancy Loss. Position Paper Number 215. 2021. Available online: https://ima-contentfiles.s3.amazonaws.com/Ne167_pregnencyLost.pdf (accessed on 24 January 2023).
- Indonesian Society of Reproductive Endocrinology and Fertility (HIFERI); Indonesian Society of Obstetrics and Gynecology (POGI). Consensus of Recurrent Miscarriage; HIFERI: Jakarta Pusat, Indonesia, 2018. (In Indonesian)
- Saccone, G.; Schoen, C.; Franasiak, J.M.; Scott, R.T., Jr.; Berghella, V. Supplementation with progestogens in the first trimester of pregnancy to prevent miscarriage in women with unexplained recurrent miscarriage: A systematic review and meta-analysis of randomized, controlled trials. Fertil. Steril. 2017, 107, 430–438.e433.
- Evans, R.M. The steroid and thyroid hormone receptor superfamily. Science 1988, 240, 889–895.
- Griesinger, G.; Tournaye, H.; Macklon, N.; Petraglia, F.; Arck, P.; Blockeel, C.; van Amsterdam, P.; Pexman-Fieth, C.; Fauser, B.C. Dydrogesterone: Pharmacological profile and mechanism of action as luteal phase support in assisted reproduction. Reprod. Biomed. Online 2019, 38, 249–259.
- Kuhl, H. Pharmacology of estrogens and progestogens: Influence of different routes of administration. Climacteric 2005, 8 (Suppl.. 1), 3–63.
- Stanczyk, F.Z.; Hapgood, J.P.; Winer, S.; Mishell, D.R., Jr. Progestogens used in postmenopausal hormone therapy: Differences in their pharmacological properties, intracellular actions, and clinical effects. Endocr. Rev. 2013, 34, 171–208.
- Abbott, B.V. Duphaston 10 mg Film-Coated Tablets, Summary of Product Characteristics; Abbott B.V.: Hoofddorp, The Netherlands, 2020.
- Besins Healthcare Ltd. Utrogestan Vaginal 200mg Capsules; Summary of Product Characteristics; Besins Healthcare (UK) Ltd.: London, UK, 2020.
- Sator, M.; Radicioni, M.; Cometti, B.; Loprete, L.; Leuratti, C.; Schmidl, D.; Garhofer, G. Pharmacokinetics and safety profile of a novel progesterone aqueous formulation administered by the s.c. route. Gynecol. Endocrinol. 2013, 29, 205–208.
- Vaisbuch, E.; Leong, M.; Shoham, Z. Progesterone support in IVF: Is evidence-based medicine translated to clinical practice? A worldwide web-based survey. Reprod. Biomed. Online 2012, 25, 139–145.
- Oler, E.; Eke, A.C.; Hesson, A. Meta-analysis of randomized controlled trials comparing 17alpha-hydroxyprogesterone caproate and vaginal progesterone for the prevention of recurrent spontaneous preterm delivery. Int. J. Gynaecol. Obstet. 2017, 138, 12–16.
- Saccone, G.; Khalifeh, A.; Elimian, A.; Bahrami, E.; Chaman-Ara, K.; Bahrami, M.A.; Berghella, V. Vaginal progesterone vs intramuscular 17alpha-hydroxyprogesterone caproate for prevention of recurrent spontaneous preterm birth in singleton gestations: Systematic review and meta-analysis of randomized controlled trials. Ultrasound Obstet. Gynecol. 2017, 49, 315–321.
- Wang, X.X.; Luo, Q.; Bai, W.P. Efficacy of progesterone on threatened miscarriage: Difference in drug types. J. Obstet. Gynaecol. Res. 2019, 45, 794–802.
- Li, L.; Zhang, Y.; Tan, H.; Bai, Y.; Fang, F.; Faramand, A.; Chong, W.; Hai, Y. Effect of progestogen for women with threatened miscarriage: A systematic review and meta-analysis. BJOG 2020, 127, 1055–1063.
- Devall, A.J.; Gallos, I.D.; Khalaf, Y.; Mol, B.W.; Ross, J.; Shennan, A.; Horne, A.W.; Small, R.; Goddijn, M.; van Wely, M.; et al. Re: Effect of progestogen for women with threatened miscarriage: A systematic review and meta-analysis. BJOG 2020, 127, 1303–1304.
- Li, L.; Zhang, Y.; Fang, F. Authors’ reply re: Effect of progestogen for women with threatened miscarriage: A systematic review and meta-analysis. BJOG 2020, 127, 1304.
- Zhao, H.; He, W.; Yang, Z. A pairwise and network meta-analysis comparing the efficacy and safety of progestogens in threatened abortion. Int. J. Gynaecol. Obstet. 2022, 156, 383–393.
- Coomarasamy, A.; Williams, H.; Truchanowicz, E.; Seed, P.T.; Small, R.; Quenby, S.; Gupta, P.; Dawood, F.; Koot, Y.E.; Bender Atik, R.; et al. A randomized trial of progesterone in women with recurrent miscarriages. N. Engl. J. Med. 2015, 373, 2141–2148.
- Coomarasamy, A.; Devall, A.J.; Cheed, V.; Harb, H.; Middleton, L.J.; Gallos, I.D.; Williams, H.; Eapen, A.K.; Roberts, T.; Ogwulu, C.C.; et al. A randomized trial of progesterone in women with bleeding in early pregnancy. N. Engl. J. Med. 2019, 380, 1815–1824.
- Coomarasamy, A.; Harb, H.M.; Devall, A.J.; Cheed, V.; Roberts, T.E.; Goranitis, I.; Ogwulu, C.B.; Williams, H.M.; Gallos, I.D.; Eapen, A.; et al. Progesterone to prevent miscarriage in women with early pregnancy bleeding: The PRISM RCT. Health Technol. Assess. 2020, 24, 1–70.
- Rasmark Roepke, E.; Hellgren, M.; Hjertberg, R.; Blomqvist, L.; Matthiesen, L.; Henic, E.; Lalitkumar, S.; Strandell, A. Treatment efficacy for idiopathic recurrent pregnancy loss—A systematic review and meta-analyses. Acta Obstet. Gynecol. Scand. 2018, 97, 921–941.
- Kumar, A.; Begum, N.; Prasad, S.; Aggarwal, S.; Sharma, S. Oral dydrogesterone treatment during early pregnancy to prevent recurrent pregnancy loss and its role in modulation of cytokine production: A double-blind, randomized, parallel, placebo-controlled trial. Fertil. Steril. 2014, 102, 1357–1363.e1353.
- Paulson, R.J.; Collins, M.G.; Yankov, V.I. Progesterone pharmacokinetics and pharmacodynamics with 3 dosages and 2 regimens of an effervescent micronized progesterone vaginal insert. J. Clin. Endocrinol. Metab. 2014, 99, 4241–4249.
- Mirza, F.G.; Patki, A.; Pexman-Fieth, C. Dydrogesterone use in early pregnancy. Gynecol. Endocrinol. 2016, 32, 97–106.
- Di Renzo, G.C.; Tosto, V.; Tsibizova, V.; Fonseca, E. Prevention of preterm birth with progesterone. J. Clin. Med. 2021, 10, 4511.
- Chakravarty, B.N.; Shirazee, H.H.; Dam, P.; Goswami, S.K.; Chatterjee, R.; Ghosh, S. Oral dydrogesterone versus intravaginal micronised progesterone as luteal phase support in assisted reproductive technology (ART) cycles: Results of a randomised study. J. Steroid Biochem. Mol. Biol. 2005, 97, 416–420.
- Carp, H. A systematic review of dydrogesterone for the treatment of threatened miscarriage. Gynecol. Endocrinol. 2012, 28, 983–990.
- Tomic, V.; Tomic, J.; Klaic, D.Z.; Kasum, M.; Kuna, K. Oral dydrogesterone versus vaginal progesterone gel in the luteal phase support: Randomized controlled trial. Eur. J. Obstet. Gynecol. Reprod. Biol. 2015, 186, 49–53.
- Ashok, P.W.; Hamoda, H.; Nathani, F.; Flett, G.M.; Templeton, A. Randomised controlled study comparing oral and vaginal misoprostol for cervical priming prior to surgical termination of pregnancy. BJOG 2003, 110, 1057–1061.
- Arvidsson, C.; Hellborg, M.; Gemzell-Danielsson, K. Preference and acceptability of oral versus vaginal administration of misoprostol in medical abortion with mifepristone. Eur. J. Obstet. Gynecol. Reprod. Biol. 2005, 123, 87–91.
- Saxena, P.; Sarda, N.; Salhan, S.; Nandan, D. A randomised comparison between sublingual, oral and vaginal route of misoprostol for pre-abortion cervical ripening in first-trimester pregnancy termination under local anaesthesia. Aust. N. Z. J. Obstet. Gynaecol. 2008, 48, 101–106.
- Song, T.; Kim, M.K.; Kim, M.L.; Jung, Y.W.; Yoon, B.S.; Seong, S.J. Effectiveness of different routes of misoprostol administration before operative hysteroscopy: A randomized, controlled trial. Fertil. Steril. 2014, 102, 519–524.
- Schindler, A.E. Progestational effects of dydrogesterone in vitro, in vivo and on the human endometrium. Maturitas 2009, 65 (Suppl.. 1), S3–S11.
- Ott, J.; Egarter, C.; Aguilera, A. Dydrogesterone after 60 years: A glance at the safety profile. Gynecol. Endocrinol. 2022, 38, 279–287.
- MacDonald, R.R.; Goulden, R.; Oakey, R.E. Cervical mucus, vaginal cytology and steroid excretion in recurrent abortion. Obstet. Gynecol. 1972, 40, 394–402.
- Omar, M.H.; Mashita, M.K.; Lim, P.S.; Jamil, M.A. Dydrogesterone in threatened abortion: Pregnancy outcome. J. Steroid Biochem. Mol. Biol. 2005, 97, 421–425.
- El-Zibdeh, M.Y.; Yousef, L.T. Dydrogesterone support in threatened miscarriage. Maturitas 2009, 65 (Suppl.. 1), S43–S46.
- Pandian, R.U. Dydrogesterone in threatened miscarriage: A Malaysian experience. Maturitas 2009, 65 (Suppl. 1), S47–S50.
- Siew, J.Y.S.; Allen, J.C.; Hui, C.Y.Y.; Ku, C.W.; Malhotra, R.; Ostbye, T.; Tan, T.C. The randomised controlled trial of micronised progesterone and dydrogesterone (TRoMaD) for threatened miscarriage. Eur. J. Obstet. Gynecol. Reprod. Biol. 2018, 228, 319–324.
- Chan, D.M.K.; Cheung, K.W.; Ko, J.K.Y.; Yung, S.S.F.; Lai, S.F.; Lam, M.T.; Ng, D.Y.T.; Lee, V.C.Y.; Li, R.H.W.; Ng, E.H.Y. Use of oral progestogen in women with threatened miscarriage in the first trimester: A randomized double-blind controlled trial. Hum. Reprod. 2021, 36, 587–595.
- El-Zibdeh, M.Y. Dydrogesterone in the reduction of recurrent spontaneous abortion. J. Steroid Biochem. Mol. Biol. 2005, 97, 431–434.
- Carp, H. A systematic review of dydrogesterone for the treatment of recurrent miscarriage. Gynecol. Endocrinol. 2015, 31, 422–430.
- Kale, A.R.; Kale, A.A.; Yelikar, K. A comparative, randomized control trial in patients of per vaginal bleeding comparing efficacy of oral dydrogesterone versus vaginal progesterone in successful pregnancy outcome for patients with recurrent pregnancy loss. J. Obstet. Gynaecol. India 2021, 71, 591–595.
- Griesinger, G.; Blockeel, C.; Tournaye, H. Oral dydrogesterone for luteal phase support in fresh in vitro fertilization cycles: A new standard? Fertil. Steril. 2018, 109, 756–762.
- Podzolkova, N.; Tatarchuk, T.; Doshchanova, A.; Eshimbetova, G.; Pexman-Fieth, C. Dydrogesterone treatment for menstrual-cycle regularization in routine clinical practice: A multicenter observational study. Gynecol. Endocrinol. 2016, 32, 246–249.
- Queisser-Luft, A. Dydrogesterone use during pregnancy: Overview of birth defects reported since 1977. Early Hum. Dev. 2009, 85, 375–377.
- Katalinic, A.; Shulman, L.P.; Strauss, J.F.; Garcia-Velasco, J.A.; Anker, J. A critical appraisal of safety data on dydrogesterone for the support of early pregnancy: A scoping review and meta-analysis. Reprod. Biomed. Online, 2022; online ahead of print.
- Tournaye, H.; Sukhikh, G.T.; Kahler, E.; Griesinger, G. A Phase III randomized controlled trial comparing the efficacy, safety and tolerability of oral dydrogesterone versus micronized vaginal progesterone for luteal support in in vitro fertilization. Hum. Reprod. 2017, 32, 2152.
- Griesinger, G.; Blockeel, C.; Sukhikh, G.T.; Patki, A.; Dhorepatil, B.; Yang, D.Z.; Chen, Z.J.; Kahler, E.; Pexman-Fieth, C.; Tournaye, H. Oral dydrogesterone versus intravaginal micronized progesterone gel for luteal phase support in IVF: A randomized clinical trial. Hum. Reprod. 2018, 33, 2212–2221.
- Griesinger, G.; Blockeel, C.; Kahler, E.; Pexman-Fieth, C.; Olofsson, J.I.; Driessen, S.; Tournaye, H. Dydrogesterone as an oral alternative to vaginal progesterone for IVF luteal phase support: A systematic review and individual participant data meta-analysis. PLoS ONE 2020, 15, e0241044.
- Atzmon, Y.; Aslih, N.; Estrada, D.; Bilgory, A.; Ellenbogen, A.; Shalom-Paz, E. Comparable outcomes using oral dydrogesterone vs. micronized vaginal progesterone in frozen embryo transfer: A retrospective cohort study. Reprod. Sci. 2021, 28, 1874–1881.
- Yang, D.Z.; Griesinger, G.; Wang, W.; Gong, F.; Liang, X.; Zhang, H.; Sun, Y.; Kahler, E.; Pexman-Fieth, C.; Olofsson, J.I.; et al. A Phase III randomized controlled trial of oral dydrogesterone versus intravaginal progesterone gel for luteal phase support in in vitro fertilization (Lotus II): Results from the Chinese mainland subpopulation. Gynecol. Endocrinol. 2020, 36, 175–183.
- Huang, J.; Xie, Q.; Lin, J.; Lu, X.; Wang, N.; Gao, H.; Cai, R.; Kuang, Y. Neonatal outcomes and congenital malformations in children born after dydrogesterone application in progestin-primed ovarian stimulation protocol for IVF: A retrospective cohort study. Drug Des. Devel. Ther. 2019, 13, 2553–2563. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Zaqout, M.; Aslem, E.; Abuqamar, M.; Abughazza, O.; Panzer, J.; De Wolf, D. The impact of oral intake of dydrogesterone on fetal heart development during early pregnancy. Pediatr. Cardiol. 2015, 36, 1483–1488.
- Koren, G.; Gilboa, D.; Katz, R. Expression of concern to: Fetal safety of dydrogesterone exposure in the first trimester of pregnancy. Clin. Drug Investig. 2020, 40, 681.
- Medicines and Healthcare Products Regulatory Agency (MHRA). Efficacy of Progestogens in the Maintenance of Early Pregnancy in Women with Threatened Miscarriage or Recurrent Miscarriage. February 2008. Available online: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/852391/Efficacy_of_progestogens_in_the_maintenance_of_early_pregnancy_in_women_with_threatened_miscarriage_or_recurrent_miscarriage.pdf (accessed on 24 January 2023).
- Williamson, S.P.; Moffitt, R.L.; Broadbent, J.; Neumann, D.L.; Hamblin, P.S. Coping, wellbeing, and psychopathology during high-risk pregnancy: A systematic review. Midwifery 2023, 116, 103556.
- Isaacs, N.Z.; Andipatin, M.G. A systematic review regarding women’s emotional and psychological experiences of high-risk pregnancies. BMC Psychol. 2020, 8, 45.
- Yu, X.; Liu, Y.; Huang, Y.; Zeng, T. The effect of nonpharmacological interventions on the mental health of high-risk pregnant women: A systematic review. Complement. Ther. Med. 2022, 64, 102799.
- Dawes, L.; Waugh, J.J.S.; Lee, A.; Groom, K.M. Psychological well-being of women at high risk of spontaneous preterm birth cared for in a specialised preterm birth clinic: A prospective longitudinal cohort study. BMJ Open 2022, 12, e056999.
- Aliabadi, S.; Shayan, A.; Refaei, M.; Tapak, L.; Moradveisi, L. The effect of individual counseling based on the GATHER principles on perceived stress and empowerment of the mothers with high-risk pregnancies: An experimental study. BMC Psychiatry 2022, 22, 396.
- Mevorach-Zussman, N.; Bolotin, A.; Shalev, H.; Bilenko, N.; Mazor, M.; Bashiri, A. Anxiety and deterioration of quality of life factors associated with recurrent miscarriage in an observational study. J. Perinat. Med. 2012, 40, 495–501.
- Lachmi-Epstein, A.; Mazor, M.; Bashiri, A. Psychological and mental aspects and “tender loving care” among women with recurrent pregnancy losses. Harefuah 2012, 151, 633–637, 654.
- Neugebauer, R. Depressive symptoms at two months after miscarriage: Interpreting study findings from an epidemiological versus clinical perspective. Depress. Anxiety 2003, 17, 152–161.
- Bailey, S.L.; Boivin, J.; Cheong, Y.C.; Kitson-Reynolds, E.; Bailey, C.; Macklon, N. Hope for the best …but expect the worst: A qualitative study to explore how women with recurrent miscarriage experience the early waiting period of a new pregnancy. BMJ Open 2019, 9, e029354.
- Ockhuijsen, H.D.; Boivin, J.; van den Hoogen, A.; Macklon, N.S. Coping after recurrent miscarriage: Uncertainty and bracing for the worst. J. Fam. Plann. Reprod. Health Care 2013, 39, 250–256.
- Bailey, S.; Bailey, C.; Boivin, J.; Cheong, Y.; Reading, I.; Macklon, N. A feasibility study for a randomised controlled trial of the Positive Reappraisal Coping Intervention, a novel supportive technique for recurrent miscarriage. BMJ Open 2015, 5, e007322.
- Dimitriadis, E.; Menkhorst, E.; Saito, S.; Kutteh, W.H.; Brosens, J.J. Recurrent pregnancy loss. Nat. Rev. Dis. Primers 2020, 6, 98.
- Chichester, M.; Harding, K.M. Early pregnancy loss: Invisible but real. Nursing 2021, 51, 28–32.
- Yang, J.; Dowell, A.; Filoche, S. Views of health professionals on the impact of early miscarriage on women’s mental health and the accessibility of services and support. N. Z. Med. J. 2022, 135, 54–64.
- Fenster, L.; Schaefer, C.; Mathur, A.; Hiatt, R.A.; Pieper, C.; Hubbard, A.E.; Von Behren, J.; Swan, S.H. Psychologic stress in the workplace and spontaneous abortion. Am. J. Epidemiol. 1995, 142, 1176–1183.
- Arck, P.C.; Rücke, M.; Rose, M.; Szekeres-Bartho, J.; Douglas, A.J.; Pritsch, M.; Blois, S.M.; Pincus, M.K.; Bärenstrauch, N.; Dudenhausen, J.W.; et al. Early risk factors for miscarriage: A prospective cohort study in pregnant women. Reprod. Biomed. Online 2008, 17, 101–113.
- Qu, F.; Wu, Y.; Zhu, Y.H.; Barry, J.; Ding, T.; Baio, G.; Muscat, R.; Todd, B.K.; Wang, F.F.; Hardiman, P.J. The association between psychological stress and miscarriage: A systematic review and meta-analysis. Sci. Rep. 2017, 7, 1731.
- San Lazaro Campillo, I.; Meaney, S.; Corcoran, P.; Spillane, N.; O’Donoghue, K. Risk factors for miscarriage among women attending an early pregnancy assessment unit (EPAU): A prospective cohort study. Ir. J. Med. Sci. 2019, 188, 903–912.
- Murphy, F.A.; Lipp, A.; Powles, D.L. Follow-up for improving psychological well being for women after a miscarriage. Cochrane Database Syst. Rev. 2012, 3, CD008679.
- van den Berg, M.M.J.; Dancet, E.A.F.; Erlikh, T.; van der Veen, F.; Goddijn, M.; Hajenius, P.J. Patient-centered early pregnancy care: A systematic review of quantitative and qualitative studies on the perspectives of women and their partners. Hum. Reprod. Update 2018, 24, 106–118
- Koert, E.; Malling, G.M.H.; Sylvest, R.; Krog, M.C.; Kolte, A.M.; Schmidt, L.; Nielsen, H.S. Recurrent pregnancy loss: Couples’ perspectives on their need for treatment, support and follow up. Hum. Reprod. 2019, 34, 291–296.
- Voss, P.; Schick, M.; Langer, L.; Ainsworth, A.; Ditzen, B.; Strowitzki, T.; Wischmann, T.; Kuon, R.J. Recurrent pregnancy loss: A shared stressor—couple-orientated psychological research findings. Fertil. Steril. 2020, 114, 1288–1296.
- Riggs, D.W.; Due, C.; Tape, N. Australian heterosexual men’s experiences of pregnancy loss: The relationships between grief, psychological distress, stigma, help-seeking, and support. Omega 2021, 82, 409–423.
- Harty, T.; Trench, M.; Keegan, O.; O’Donoghue, K.; Nuzum, D. The experiences of men following recurrent miscarriage in an Irish tertiary hospital: A qualitative analysis. Health Expect. 2022, 25, 1048–1057.
- Miller, E.J.; Temple-Smith, M.J.; Bilardi, J.E. ‘There was just no-one there to acknowledge that it happened to me as well’: A qualitative study of male partner’s experience of miscarriage. PLoS ONE 2019, 14, e0217395.
- Obst, K.L.; Due, C.; Oxlad, M.; Middleton, P. Men’s grief following pregnancy loss and neonatal loss: A systematic review and emerging theoretical model. BMC Pregnancy Childbirth 2020, 20, 11.
- Nakano, Y.; Akechi, T.; Furukawa, T.A.; Sugiura-Ogasawara, M. Cognitive behavior therapy for psychological distress in patients with recurrent miscarriage. Psychol. Res. Behav. Manag. 2013, 6, 37–43.
- Patel, A.; Dinesh, N.; Sharma, P.S.V.N.; Kumar, P.; Binu, V.S. Outcomes of structured psychotherapy for emotional adjustment in a childless couple diagnosed with recurrent pregnancy loss: A unique investigation. J. Hum. Reprod. Sci. 2018, 11, 202–207.
- Jensen, K.H.K.; Krog, M.C.; Koert, E.; Hedegaard, S.; Chonovitsch, M.; Schmidt, L.; Kolte, A.M.; Nielsen, H.S. Meditation and mindfulness reduce perceived stress in women with recurrent pregnancy loss: A randomized controlled trial. Reprod. Biomed. Online 2021, 43, 246–256.
- Elsharkawy, N.B.; Mohamed, S.M.; Awad, M.H.; Ouda, M.M.A. Effect of happiness counseling on depression, anxiety, and stress in women with recurrent miscarriage. Int. J. Womens Health 2021, 13, 287–295.
- Green, D.M.; O’Donoghue, K. A review of reproductive outcomes of women with two consecutive miscarriages and no living child. J. Obstet. Gynaecol. 2019, 39, 816–821
- Yu, A.Y.; Temple-Smith, M.J.; Bilardi, J.E. Health care support following miscarriage in Australia: A qualitative study. How can we do better? Aust. J. Prim. Health 2022, 28, 172–178.
- Kuon, R.J.; Togawa, R.; Vomstein, K.; Weber, M.; Goeggl, T.; Strowitzki, T.; Markert, U.R.; Zimmermann, S.; Daniel, V.; Dalpke, A.H.; et al. Higher prevalence of colonization with Gardnerella vaginalis and gram-negative anaerobes in patients with recurrent miscarriage and elevated peripheral natural killer cells. J. Reprod. Immunol. 2017, 120, 15–19.
- Sirota, I.; Zarek, S.M.; Segars, J.H. Potential influence of the microbiome on infertility and assisted reproductive technology. Semin. Reprod. Med. 2014, 32, 35–42.
- Zhang, F.; Zhang, T.; Ma, Y.; Huang, Z.; He, Y.; Pan, H.; Fang, M.; Ding, H. Alteration of vaginal microbiota in patients with unexplained recurrent miscarriage. Exp. Ther. Med. 2019, 17, 3307–3316.
- Kuroda, K.; Ikemoto, Y.; Horikawa, T.; Moriyama, A.; Ojiro, Y.; Takamizawa, S.; Uchida, T.; Nojiri, S.; Nakagawa, K.; Sugiyama, R. Novel approaches to the management of recurrent pregnancy loss: The OPTIMUM (OPtimization of Thyroid function, Thrombophilia, Immunity, and Uterine Milieu) treatment strategy. Reprod. Med. Biol. 2021, 20, 524–536.
- Li, J.; Hong, X.; Mesiano, S.; Muglia, L.J.; Wang, X.; Snyder, M.; Stevenson, D.K.; Shaw, G.M. Natural selection has differentiated the progesterone receptor among human populations. Am. J. Hum. Genet. 2018, 103, 45–57.
- Zeberg, H.; Kelso, J.; Pääbo, S. The neandertal progesterone receptor. Mol. Biol. Evol. 2020, 37, 2655–2660.
- Bahia, W.; Finan, R.R.; Al-Mutawa, M.; Haddad, A.; Soua, A.; Janhani, F.; Mahjoub, T.; Almawi, W.Y. Genetic variation in the progesterone receptor gene and susceptibility to recurrent pregnancy loss: A case-control study. BJOG 2018, 125, 729–735.
- Lewis, C.A.; Kimmig, A.S.; Zsido, R.G.; Jank, A.; Derntl, B.; Sacher, J. Effects of hormonal contraceptives on mood: A focus on emotion recognition and reactivity, reward processing, and stress response. Curr. Psychiatry Rep. 2019, 21, 115.
- Standeven, L.R.; McEvoy, K.O.; Osborne, L.M. Progesterone, reproduction, and psychiatric illness. Best Pract. Res. Clin. Obstet. Gynaecol. 2020, 69, 108–126.
- Shirazi, T.N.; Rosenfield, K.A.; Cardenas, R.A.; Breedlove, S.M.; Puts, D.A. No evidence that hormonal contraceptive use or circulating sex steroids predict complex emotion recognition. Horm. Behav. 2020, 119, 104647.
- Sundstrom-Poromaa, I.; Comasco, E.; Sumner, R.; Luders, E. Progesterone—Friend or foe? Front. Neuroendocrinol. 2020, 59, 100856.
- Reynolds, T.A.; Makhanova, A.; Marcinkowska, U.M.; Jasienska, G.; McNulty, J.K.; Eckel, L.A.; Nikonova, L.; Maner, J.K. Progesterone and women’s anxiety across the menstrual cycle. Horm. Behav. 2018, 102, 34–40.
- McEvoy, K.; Osborne, L.M. Allopregnanolone and reproductive psychiatry: An overview. Int. Rev. Psychiatry 2019, 31, 237–244.