Резюме
ПРЕДУСЛОВИЯ: Эффективность абемациклиба у пациенток высокого риска с ранними стадиями HR+/Her2- рака молочной железы была подтверждена исследованием MonarchE. Однако точное определение количества метастазов в подмышечных лимфатических узлах (ПЛУ) остается сложной задачей. Исследование Z0011 изменило стратегию лечения подмышечных лимфатических узлов, устранив потребность в диссекции подмышечных лимфатических узлов (ДПЛУ) у пациентов с 1-2 метастазами в сторожевых лимфатических узлах (СЛУ). Поэтому необходимы дальнейшие исследования для выявления пациентов, которые могут получить пользу от терапии абемациклибом.
МАТЕРИАЛЫ И МЕТОДЫ: Ретроспективное исследование включало пациентов с CT1-2N0M0 HR+/Her2- с 1-2 положительными СЛУ, которым была проведена ДПЛУ. Были собраны клинико-патологические данные, и с помощью логистического регрессионного анализа были определены независимые предикторы для ≥4 положительных ПЛУ. Разработана прогностическая номограмма, оценена дискриминация и калибровка с помощью С-индекса и калибровочной кривой. Клиническую эффективность оценивали с помощью кривой анализа принятия решений (КАР).
РЕЗУЛЬТАТЫ: Мы включили 444 пациентки, из которых 77 (17,3%) имели ≥4 положительных ПЛУ. Независимыми предикторами ≥4 положительных ПЛУ были аномальные ПЛУ на УЗИ, маммографические кальцинаты, Т-стадия и количество положительных СЛУ. Номограмма продемонстрировала AUC 0,777 (95% ДИ: 0,735-0,815, P<0,001), а внутренняя валидация показала хорошую калибровку и дискриминацию (С-индекс 0,802; 95% ДИ: 0,779-0,824). КАР выявил положительную чистую пользу для уровней риска от 5% до 54%.
ЗАКЛЮЧЕНИЯ:Эта номограмма является удобным и надежным инструментом для прогнозирования риска ≥4 положительных ПЛУ у HR+/Her2- пациентов. Она помогает в выборе протокола, определяя СЛУ-положительных пациентов, которые могут получить пользу от терапии абемациклибом без ДПЛУ.
КЛЮЧЕВЫЕ СЛОВА: Абемациклиб, Новообразования в молочной железе, номограммы
Предусловия
Рак молочной железы является самой частой злокачественной опухолью у женщин, а диссекция подмышечных лимфатических узлов (ПЛУ) была стандартным методом лечения положительных ПЛУ у пациенток. Исследование ACOSOG Z0011 [1] и AMAROS [2] доказали, что ДПЛУ не улучшает общую выживаемость у пациентов cT1-2 с клинически отрицательными подмышечными и 1-2 метастазами в СЛУ. Что касается рецидивирования локорегиональных лимфатических узлов, то исследование Z0011 показало, что в группе биопсии сторожевых лимфатических узлов (БСЛУ) кумулятивная частота рецидивирования подмышечной области составляла 1,5% по сравнению с 0,5% в группе ДПЛУ. Аналогично, у пациентов, получавших ДПЛУ, 5-летняя частота подмышечных рецидивов составляла 0,43% по сравнению с 1,19% у пациентов, получавших лучевую терапию в подмышечной области. Приведенные выше данные продемонстрировали, что ДПЛУ не имеет преимуществ в увеличении общей выживаемости и контроле локальных рецидивов. Таким образом, большинство пациенток на ранних стадиях рака молочной железы с отрицательными лимфатическими узлами избегают ДПЛУ. HR+/Her2- рак молочной железы является самым распространенным подтипом среди пациенток на ранних стадиях [3], на который приходится около 60% всех случаев рака молочной железы. Несмотря на более благоприятный прогноз, чем при Her2 и трижды негативном раке молочной железы, пациентки все еще имеют 40% риск развития отдаленных рецидивов, и этот риск возрастает вместе с повышенным анатомическим риском [4]. Пациентки с высоким риском рецидива должны получать лечение как можно раньше, чтобы предотвратить рецидив и метастазирование. MonarchE [5] – это глобальное, рандомизированное, III-этапное исследование, которое доказало, что стандартное эндокринное лечение + абемациклиб (ингибитор циклинзависимых киназ 4 и 6) может улучшить терапевтические результаты у пациенток на ранних стадиях рака молочной железы с высоким риском HR + / Her2-. Абсолютная 4-летняя выживаемость без инвазивных заболеваний (ВБИЗ) составила 6,4% (группа Абемациклиба (85,8% [95% ДИ 84,2-87,3] против 79,4% в группе стандартного эндокринного лечения [95% ДИ 77,5-81,1]). Риск возникновения события ВБИЗ был снижен на 33,6%. Пациентки, включенные в исследование MonarchE, имели положительные ПЛУ ≥4 или имели 1-3 положительные ПЛУ и по крайней мере 1 клинический признак высокого риска: опухоль ≥5 см или гистологический класс 3 или Ki-67 ≥20%. Начиная с исследования Z0011, отказ от ДПЛУ широко применяется у пациенток, сохраняющих молочную железу, с 1-2 положительными СЛУ. Это приводит к новой проблеме: как решить, нуждается ли пациентка в терапии абемациклибом при 1-2 положительных СЛУ без клинических признаков высокого риска? Является ли ДПЛУ необходимым для подтверждения метастатической нагрузки подмышечных узлов? Было показано, что 13,0-18,4% пациентов, которые соответствовали критериям Z0011, имели более 4 положительных ПЛУ [1,2,6]. Таким образом, мы должны определить риск метастазов ПЛУ ≥4 у пациенток с HR+/Her2- раком молочной железы с 1-2 положительными СЛУ и пропущенным ДПЛУ без признаков опухоли высокого риска. Эти пациентки, вероятно, могут получить пользу от терапии абемациклибом для усиления системной терапии и деэскалации местного хирургического лечения. Целью данного исследования было проанализировать ретроспективные данные одноцентрового исследования с помощью одномерного и многомерного регрессионного анализа и построить номограмму для отбора пациентов, которые подходят для терапии абемациклибом.
Материалы и методы
СТАТИСТИЧЕСКИЙ АНАЛИЗ:
Были собраны клинические данные пациенток, включая возраст, ИМТ, менопаузальный статус, унифокальные/мультифокальные опухоли, ультразвук ПЛУ (УЗИ-ПЛУ), маммографические кальцинаты, хирургический метод, патологический тип, гистологический класс, размер опухоли, лимфоваскулярную инвазию (ЛВИ), положительное и отрицательное число СЛУ, N классификацию, уровень экспрессии рецепторов прогестерона и Her2. Клинико-патологические факторы были проанализированы как категориальные переменные для изучения их корреляции с положительным числом ПЛУ ≥4. Категориальные переменные анализировали с помощью одномерного логистического регрессионного анализа, из которого полученные значимые переменные анализировали в многомерном логистическом регрессионном анализе для подтверждения независимых предикторов положительных ПЛУ ≥4. Номограмма была построена с помощью пакета “rms” программного обеспечения R. Для оценки эффективности номограммы использовали дискриминацию и калибровку. Внутренняя валидация была выполнена с помощью метода повторной выборки 1000 бутстрапов, с вычислением С-индекса и построением калибровочной кривой. Дискриминационную способность оценивали по площади под ROC-кривой и С-индексом. Для оценки клинической эффективности и чистой пользы номограммы использовали кривую анализа принятия решений (КАР). Все статистические анализы были проведены с использованием SPSS 25.0 (IBM Corporation, Армонк, Нью-Йорк, США) и R 4.1.1 (The R Foundation for Statistical Computing, Австрия, Вена). P<0,05 интерпретировался как статистически значимый.
Результаты
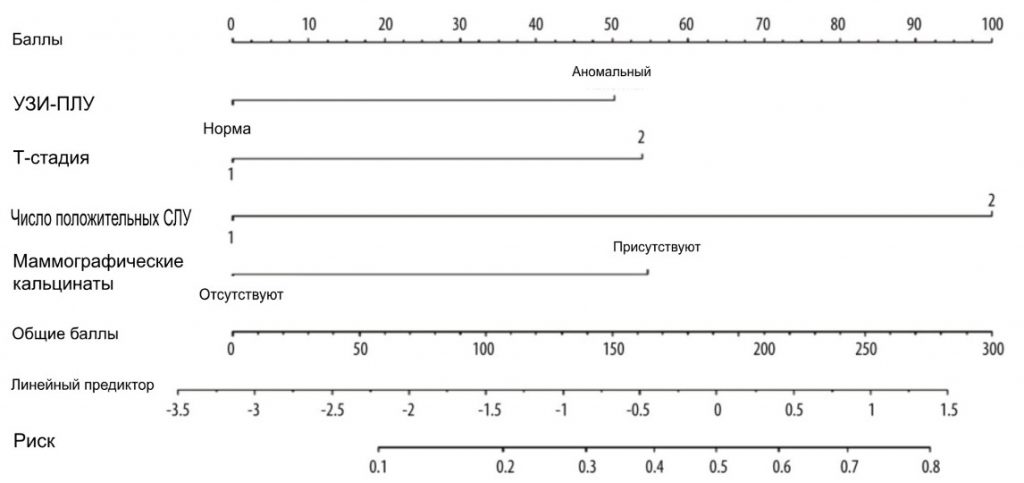
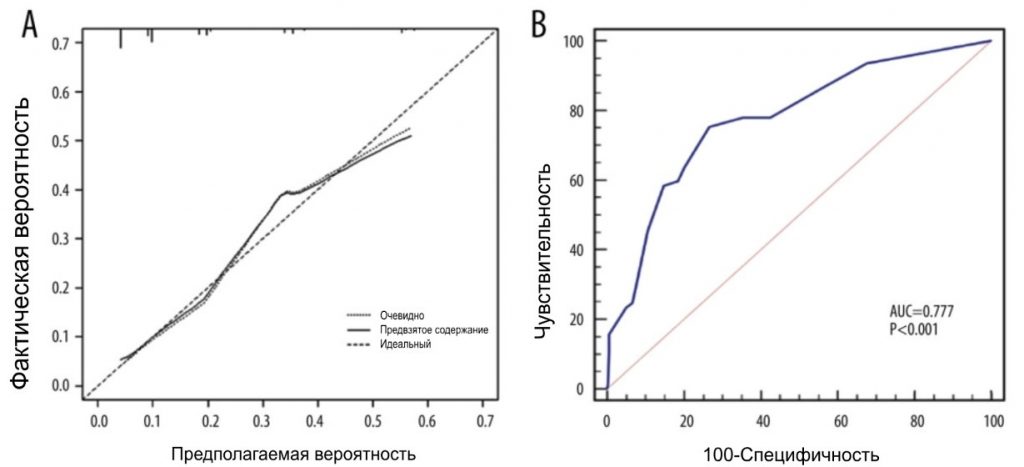
Мы набрали 444 пациентки с раком молочной железы, которые соответствовали критериям включения, с января 2015 года по июнь 2022 года. Исходные характеристики пациентов приведены в Таблице 1. Средний возраст составлял 50 лет. У 274 пациенток (61,7%) были опухоли cT1, у 318 пациенток (71,6%) – 1 положительный СЛУ и у 126 пациенток (28,4%) – 2 положительных СЛУ. Среди пациентов с 1 положительным СЛУ 9,43% имели положительные не-СЛУ ≥3, а среди пациентов с 2 положительными СЛУ 36,5% имели положительные не-СЛУ ≥2. В целом 367 (82,7%) пациентов имели 1-3 положительные СЛУ (pN1), а 77 (17,3%) пациентов имели положительные СЛУ ≥4 (pN2-3) (Табл. 2). Для выявления факторов положительного значения ПЛУ ≥4 был проведен одномерный и многомерный логистический регрессионный анализ. Факторы с P<0,05 в одномерном анализе были проанализированы в многомерном анализе. Независимыми предикторами положительных ПЛУ ≥4 были УЗИ-ПЛУ (ОШ= 2,289, 95% ДИ: 1,327-3,948, P = 0,003), маммографические кальцинаты (ОШ = 2,452, 95% ДИ: 1. 297-4,638, P = 0,006), Т-стадия (ОШ = 2,426, 95% ДИ: 1,414-4,161, P = 0,001) и положительное число СЛУ (ОШ = 5,175, 95% ДИ: 3,007-8,904, P <0,001). На основе данных многомерного логистического регрессионного анализа была построена номограмма для прогнозирования положительных ПЛУ ≥4 среди пациентов с cT1-2N0M0 HR+/Her2- с 1-2 положительными СЛУ (Рис. 1). Вероятность положительных СЛУ ≥4 рассчитывали путем сложения баллов по 4 факторам и отношением к общей сумме баллов и шкале минимального риска. Калибровочная кривая и ROC-кривая были использованы для оценки калибровки и дискриминации номограммы. Калибровочная кривая показала хорошее соответствие между прогнозируемыми и наблюдаемыми результатами для номограммы (Рис. 2А). ROC-кривая номограммы показана на Рис. 2B. Чувствительность составила 75,32%, специфичность – 73,30%, а AUC – 0,777 (95% ДИ: 0,735-0,815, P<0,001), что свидетельствует о том, что номограмма имеет хорошие прогностические характеристики. Номограмма продемонстрировала хорошую дискриминацию со значением С-индекса 0,802 (95% ДИ: 0,779-0,824). Анализ кривых принятия решений был использован для определения клинической применимости принятия решений на основе прогностической модели по сравнению со стандартной стратегией. По сравнению с лечением всех пациентов (наклонная линия) или не лечением ни одного пациента (горизонтальная линия), модель продемонстрировала высокие чистые преимущества. КАР (Рис. 3) продемонстрировала, что в диапазоне порогового риска от 5% до 54% решения о вмешательстве на основе номограммы были однозначно полезными.
Обсуждение
В этом исследовании была построена номограмма с использованием клинико-патологических факторов для оценки риска положительных ПЛУ ≥4 среди пациентов с cT1-2N0M0 HR+/Her2- с 1-2 положительными СЛУ. Номограмма включала УЗИ-ПЛУ, маммографические кальцинаты, Т-стадию и количество положительных СЛУ. Внутренняя валидация показала, что номограмма имеет хорошую дискриминацию, калибровку и клиническую эффективность.
Сейчас основными тенденциями в лечении рака молочной железы являются деэскалационная химиотерапия для пациенток с низким риском и интенсивная системная терапия для пациенток с высоким риском. Для разработки протоколов адъювантной химиотерапии больных раком молочной железы на ранних стадиях с HR+/Her2- (например, Oncotype DX [9,10] и MammaPrint [11]) были разработаны многочисленные методы выявления генов, ориентированные на рак молочной железы с HR+ и отрицательными лимфатическими узлами или 1-3 положительными лимфатическими узлами. Пациентки с клинико-патологическими характеристиками высокого риска (например, участницы исследования MonarchE) имели показатели смертности, подобные показателям смертности пациенток с тройным негативным раком груди (ТНРГ) [12]. Исследование MonarchE [5] показало, что 2-летнее применение абемациклиба может улучшить клинические результаты. Сейчас у большинства пациентов, которые соответствовали критериям Z0011, не выявлено ДПЛУ, что делает невозможным получение полных данных о метастазировании ПЛУ, поэтому частично пациенты не имеют оснований для интенсивного лечения. Индекс Ki-67 может отражать степень пролиферации клеток, и пациенты с высоким уровнем Ki-67 имели худшие прогнозы [13]. Пациентам, включенным в исследование MonarchE, было разрешено лечение абемациклибом при Ki-67 ≥20%, если были метастазы в лимфатические узлы, за исключением только ≥4 метастазов в лимфатические узлы, когда Ki-67 был <20%. Поэтому пациенты с Ki-67 ≥20% были исключены из этого исследования. В группе намерений на лечение и в первой когорте клинического опыта MonarchE отмечено, что лечение абемациклибом значительно улучшило ВБИЗ у пациентов с опухолями с высоким уровнем экспрессии Ki-67. В когорте 1 преимущество абемациклиба постоянно наблюдалось независимо от экспрессии Ki-67, что указывает на то, что Ki-67 не может предсказать терапевтическую пользу абемациклиба. Примечательно, что пациенты с высоким уровнем экспрессии Ki-67 имели более высокие показатели рецидивов, чем пациенты с низким уровнем экспрессии Ki-67. Таким образом, экспрессия Ki-67 является прогностическим показателем рецидива, но не может предсказать терапевтические преимущества абемациклиба [14]. Предварительное исследование показало, что 13,0-18,4% пациентов, которые соответствовали критериям Z0011, имели более 4 положительных ПЛУ [1,2,6]. Наше исследование показало, что вероятность положительных ПЛУ ≥4 среди пациентов cT1-2N0 HR+/Her2- с 1-2 положительными СЛУ составляла 17,1%, 9,43% для 1 положительного СЛУ и 38,1% для 2 положительных СЛУ.
Большинство прогностических исследований были сосредоточены на наличии метастазов не в СЛУ, тогда как исследований относительно точного количества метастазов в лимфатические узлы (например, положительные лимфатические узлы ≥4) немного. Кроме того, переменными, включенными в эти исследования, были прежде всего размер метастатического очага СЛУ, экстрамембранозная инфильтрация лимфатических узлов и ЛВИ [15], которые базировались на послеоперационных патогистологических исследованиях. Gilles и соавт.[16] создали предоперационную клиническую модель и послеоперационную патологическую модель для прогнозирования риска метастазов ПЛУ на основе 12572 случаев рака молочной железы на ранних стадиях, показав, что послеоперационная модель имеет лучшую дискриминацию (AUC=0,780), чем предоперационная модель (AUC=0,717). Интраоперационных моделей мало. Shimazu и соавт. [17] построили интраоперационную модель прогнозирования метастазирования не-СЛУ с помощью метода одношаговой амплификации нуклеиновых кислот. Модель включала общую опухолевую нагрузку и размер опухоли, с AUC 0,70. AUC модели в этом исследовании составляла 0,777, и она была такой же эффективной, как и приведенная выше послеоперационная модель. Считается, что размер опухоли, гистологический класс, ЛВИ, возраст на момент постановки диагноза, положительное СЛУ-число, экспрессия гормональных рецепторов, статус Her-2 и молекулярный подтип являются значимыми факторами риска метастазирования не-СЛУ [18]. Это исследование показало, что УЗИ-ПЛУ, маммографические кальцинаты, Т-стадия и положительное число СЛУ являются независимыми предикторами положительных ПЛУ ≥4.
В исследовании Z0011 [1], исследовании BCSG 23-01 [19] и исследовании AMAROS [2] клинически отрицательные лимфатические узлы определялись как отсутствие увеличенных лимфатических узлов при физикальном обследовании. Тем не менее, оценка статуса ПЛУ с помощью клинического обследования является неточной, а ультразвуковое исследование способствует выявлению пациентов с высокой нагрузкой на подмышечные лимфатические узлы [20,21]. В этом исследовании 146 пациентов имели аномалии ПЛУ на УЗИ, из них 39 пациентов (26,7%) имели ≥4 положительных лимфоузлов, 260 пациентов имели нормальное состояние ПЛУ на УЗИ, и 38 (14,6%) из них имели положительные лимфоузлы ≥4. Было показано, что пациенты с аномальными ПЛУ на УЗИ имели большую подмышечную нагрузку (ОШ=2,289, 95% ДИ: 1,327-3,948, P=0,003) по сравнению с пациентами с нормальными результатами УЗИ, что согласуется с исследованием Muneer и соавт. [21]. Lim и соавт. [22] сообщили, что ≥3 патологических лимфатических узлов на УЗИ является критическим предиктором высокой нагрузки на подмышечные лимфатические узлы у пациентов, которые соответствуют критериям Z0011. Кроме того, было показано, что предоперационная МРТ может точно выявить метастазы ПЛУ для оценки опухолевой нагрузки на подмышечные лимфатические узлы [23,24]. Радиоимические переменные могут быть включены в будущие прогностические модели для дальнейшего улучшения прогностической эффективности модели.
Связь между визуализационными проявлениями первичной опухоли и метастазами ПЛУ недостаточно изучена, особенно с помощью маммографии. Zheng и соавт. [25] обнаружили значительную связь между метастазированием ПЛУ и маммографическими кальцификатами среди 7317 пациенток. Yan и соавт. [26] сообщили, что маммографические кальцинаты существенно связаны с высокой нагрузкой метастазирования ПЛУ как независимый прогностический фактор для пациенток с раком молочной железы. Визуализационные проявления первичного локуса не были включены в исследования, подобные исследованию Z0011. Однако мы продемонстрировали значительную корреляцию между маммографическими кальцификатами и положительными ПЛУ ≥4 (ОШ=2,452, 95% ДИ: 1,297-4,638, P=0,006).
ЛВИ является независимым предиктором метастазирования в лимфатические узлы и неблагоприятных результатов [27,28]. Он требует рутинной окраски послеоперационных срезов гематоксилином и эозином (ГЭ), что не подходит для интраоперационных моделей. ЛВИ в значительной степени коррелирует с возрастом, Т-стадией, гистологическим классом и экспрессией гормональных рецепторов [29]. В этом исследовании было обнаружено, что ЛВИ не имеет отношения к метастазированию ПЛУ (P=0,420), что может быть связано с тем, что включенные пациенты имели положительные гормональные рецепторы, исключая вовлечение продвинутой стадии T/N и гистологической степени опухоли 3.
Экспрессия Her2 существенно коррелирует с метастатическим потенциалом клеток рака молочной железы. Ahmed и соавт. [30] сообщили, что экспрессия Her2 является независимым предиктором метастазирования ПЛУ. В настоящее время считается, что низкая экспрессия Her2 может быть новым молекулярным подтипом. Francesco [31] обнаружил, что пациенты с HR-положительными заболеваниями (65,4%) имели более высокую долю низкой экспрессии Her2, чем пациенты с ТНРГ (36,6%). Низкий уровень экспрессии Her2 не имел отношения к общей выживаемости пациенток с HR-положительным раком молочной железы. Немного исследований изучали взаимосвязь между экспрессией Her2 и метастазированием ПЛУ. Наше исследование показало, что доля низкой экспрессии Her2 (85,6%) была выше, чем Her2 0 (14,4%) среди HR + / Her2- пациентов, что согласуется с данными в исследовании Francesco. Однако не было выявлено достоверной корреляции между низкой экспрессией Her2 и статусом HER2 0 и количеством метастазов в лимфатических узлах (P = 0,151).
Номограмма в этом исследовании показала С-индекс 0,802 (95% ДИ: 0,779-0,824), что свидетельствует о хорошей дискриминации. Что касается оценки калибровки, то калибровочная кривая продемонстрировала сильное соответствие между кривой распределения прогнозируемых значений модели и кривой распределения, полученной после коррекции переобучения с помощью повторной выборки. Она тесно совпадала с оптимальной кривой (стандартной кривой), что свидетельствует о хорошей калибровке модели. Для оценки клинической эффективности была применена кривая анализа принятия решений (КАР) для расчета чистой пользы и построения КАР. КАР проиллюстрировала, что кривая принятия решения модели отклонилась от 2 крайних кривых сценариев, что свидетельствует о хорошей клинической эффективности.
Это исследование имеет определенные ограничения. Во-первых, это было одноцентровое ретроспективное исследование с потенциальными предубеждениями. Во-вторых, номограмма не прошла внешнюю валидацию. Таким образом, для оценки и валидации результатов необходимы проспективные многоцентровые исследования.
Заключения
Мы создали интраоперационную прогностическую номограмму для прогнозирования вероятности положительных ПЛУ ≥4 среди HR+/Her2- пациентов с положительными СЛУ и пропущенными ДПЛУ, чтобы помочь в принятии клинических решений. Прогностическая модель является точной и может помочь онкологам идентифицировать пациентов, нуждающихся в терапии абемациклибом. Таким образом, пациентам могут быть предложены лучшие стратегии лечения, включая деэскалационную хирургию и системную эскалационную терапию в эпоху БСЛУ и точной медицины.
Рисунок 1. Номограмма для прогнозирования пациентов с ≥4 положительными суммарными ПЛУ в популяции HR+/HER2- с 1-2 положительными СЛУ. Баллы по 4 факторам суммировались для расчета вероятности ≥4 положительных суммарных ПЛУ, а общие баллы и нижняя шкала риска были отнесены к шкале риска. Программное обеспечение R 4.1.1 (The R Foundation for Statistical Computing, Австрия, Вена).
Рисунок 2. (А) Калибровочная кривая показала удовлетворительное соответствие между прогнозом и фактическим наблюдением. (B) ROC-кривая номограммы. Программное обеспечение R 4.1.1 (The R Foundation for Statistical Computing, Австрия, Вена).
Рисунок 3. КАР демонстрирует клиническую эффективность номограммы. Красная линия – это номограмма, которая прогнозирует риск появления ≥4 положительных узлов у пациентов. Серая линия обозначает всех пациентов с ≥4 положительными узлами, тогда как черная линия не обозначает ни одного пациента с ≥4 положительными узлами. Эта КАР может обеспечить большую чистую выгоду в диапазоне от 5% до 54%. КАР – кривая анализа принятия решений. Программное обеспечение R 4.1.1 (The R Foundation for Statistical Computing, Австрия, Вена).
Таблицы
Таблица 1. Характеристика HR+/HER2- пациенток.
| Характеристики | Пациенты(n=444) |
| Возраст, медиана (мин, макс), годы | 50 (26-80) |
| 215 (48.4%) | |
| ≥50, нет. (%) | 229 (51.6%) |
| ИМТ | 244 (22.3-26.1) |
| Менопаузальный статус, количество- (%) | |
| Предменопаузальный период | 254 (57.2%) |
| Постменопаузальный период | 190 (42.8%) |
| Мультифокальность, количество (%) | |
| Отсутствие | 394 (88.7%) |
| Присутствие | 50 (11.3%) |
| Клиническая стадия опухоли, количество (%) | |
| 1 | 274 (61.7%) |
| 2 | 170 (38.3%) |
| Размер опухоли, медиана (мин, макс), см | 1.9 (0.2-5.0) |
| УЗИ-ПЛУ, количество (%) | |
| Норма | 298 (67.1%) |
| Аномальный | 146 (32.9%) |
| Маммографические кальцинаты, количество (%) | |
| Отсутствуют | 365 (82.2%) |
| Присутствуют | 79 (17.8%) |
| Хирургическое вмешательство, количество (%) | |
| Мастэктомия | 350 (78.8%) |
| Сохранение груди | 94 (21.2%) |
| Тип опухоли, количество (%) | |
| Проточный | 425 (95.7%) |
| Дольковый | 15 (3.4%) |
| Другие | 4 (0.9%) |
| Гистологическая степень, количество (%) | |
| I | 7 (1.6%) |
| II | 397 (89.4%) |
| Отсутствует | 40 (9.0%) |
| Удалено 1 положительный СЛУ, всего, количество (%) | 318 (71.6%) |
| 0 положительных не-СЛУ, нет | 166 |
| 1 положительных не-СЛУ, нет | 95 |
| 2 положительных не-СЛУ, нет | 27 |
| ≥3 положительных не-СЛУ, нет | 30 |
| Удалено 2 положительных СЛУ, всего, количество (%) | 126 (28.4%) |
| 0 положительных не-СЛУ, нет | 62 |
| 1 положительных не-СЛУ, нет | 18 |
| 2 положительных не-СЛУ, нет | 22 |
| ≥3 положительных не-СЛУ, нет | 24 |
| Стадия pN, количество (%) | |
| 1 | 367 (82.7%) |
| 2-3 | 77 (17.3%) |
| ЛВИ, количество (%) | |
| Отсутствует | 348 (78.4%) |
| Присутствует | 96 (21.6%) |
| Рецептор прогестерона, количество (%) | |
| Негативный | 33 (7.4%) |
| Положительный | 411 (92.6%) |
| Экспрессия HER2, количество (%) | |
| 0 | 64 (14.4%) |
| 1+ | 137 (30.9%) |
| 2+ | 243 (54.7%) |
ИМТ – индекс массы тела; УЗИ-ПЛУ – ультразвуковое исследование подмышечного лимфатического узла; СЛУ – сторожевой лимфатический узел; ЛВИ – лимфоваскулярная инвазия.
Таблица 2. Одномерный и многомерный анализ среди пациенток с HR+/HER2-.
| Характеристики | pN1 (n=367) | pN2-3 (n=77) | Неизменная P | Многомерная P |
| Возраст, количество (%) | 0.747 | |||
| 179 (48.8) | 36 (46.8) | |||
| ≥50, нет. (%) | 188 (51.2) | 41 (53.2) | ||
| Менопаузальный статус, количество (%) | 0.990 | |||
| Отсутствует | 210 (57.2) | 44 (57.1) | ||
| Присутствует | 157 (42.8) | 33 (42.9) | ||
| Мультифокальность, количество (%) | 0.356 | |||
| Отсутствует | 328 (89.4) | 66 (85.7) | ||
| Присутствует | 39 (10.6) | 11 (14.3) | ||
| Клиническая стадия опухоли, количество (%) | 0.001 | |||
| 1 | 241 (65.7) | 33 (42.9) | ||
| 2 | 126 (34.3) | 44 (57.1) | ||
| УЗИ-ПЛУ, количество (%) | 0.003 | |||
| Норма | 260 (70.8) | 38 (49.4) | ||
| Аномальный | 107 (29.2) | 39 (50.6) | ||
| Маммографические кальцинаты | 0.017 | 0.006 | ||
| Отсутствуют | 309 (84.2) | 56 (72.7) | ||
| Присутствуют | 58 (15.8) | 21 (27.3) | ||
| Хирургическое вмешательство, количество (%) | 0.602 | |||
| Мастэктомия | 291 (79.3) | 59 (76.6) | ||
| Сохранение груди | 76 (20.7) | 18 (23.4) | ||
| Тип опухоли, количество (%) | 0.571 | |||
| Проточный | 353 (96.1) | 72 (93.5) | ||
| Дольковый | 11 (3.0) | 4 (5.2) | ||
| Другие | 3 (0.9) | 1 (1.3) | ||
| Гистологическая степень, количество (%) | 0.880 | |||
| I | 6 (1.6) | 1 (1.3) | ||
| II | 329 (89.6) | 68 (88.3) | ||
| Отсутствует | 32 (8.8) | 8 (10.4 | ||
| Количество удаленных положительных СЛУ | ||||
| 1 | 287 (78.2) | 31 (40.2) | ||
| 2 | 80 (21.8) | 46 (59.8) | ||
| Количество удаленных негативных СЛУ | 0.004 | |||
| 0 | 18 (4.9) | 10 (13.0) | ||
| 1 | 66 (18.0) | 18 (23.4) | ||
| 2 | 79 (21.5) | 9 (11.7) | ||
| 3 | 65 (17.7) | 20 (26.0) | ||
| ≥4 | 139 (37.9) | 20 (26.0) | ||
| ЛВИ, количество (%) | 0.420 | |||
| Отсутствует | 285 (77.7) | 63 (81.8) | ||
| Присутствует | 82 (22.3) | 14 (18.2) | ||
| Рецептор прогестерона, количество (%) | 0.895 | |||
| Негативный | 27 (7.4) | 6 (7.8) | ||
| Положительный | 340 (92.6) | 71 (92.2) | ||
| Экспрессия HER2, количество (%) | 0.151 | |||
| 0 | 48 (13.1) | 16 (20.8) | ||
| 1 | 112 (30.5) | 25 (32.5) | ||
| 2 | 207 (56.4) | 36 (46.7) |
УЗИ-ПЛУ – ультразвуковое исследование подмышечного лимфатического узла; СЛУ – сторожевой лимфатический узел; ЛВИ – лимфоваскулярная инвазия.
Ссылки на источники
- Giuliano AE, Ballman KV, McCall L, Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: The ACOSOG Z0011 (Alliance) randomized clinical trial: JAMA, 2017; 318(10); 918
- Donker M, van Tienhoven G, Straver ME, Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial: Lancet Oncol, 2014; 15(12); 1303-10
- Howlader N, Altekruse SF, Li CI, US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status: J Natl Cancer Inst, 2014; 106(5); dju055
- Pan H, Gray R, Braybrooke J, 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years: N Engl J Med, 2017; 377(19); 1836-46
- Johnston SRD, Toi M, O’Shaughnessy J, Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): Results from a preplanned interim analysis of a randomised, open-label, phase 3 trial: Lancet Oncol, 2022; 24(1); 77-90
- Katz A, Smith BL, Golshan M, Nomogram for the prediction of having four or more involved nodes for sentinel lymph node-positive breast cancer: J Clin Oncol, 2008; 26(13); 2093-98
- Wolff AC, Hammond MEH, Allison KH, Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update: Arch Pathol Lab Med, 2018; 142(11); 1364-82
- Hammond MEH, Hayes DF, Dowsett M, American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Immunohistochemical Testing of Estrogen and Progesterone Receptors in Breast Cancer (Unabridged Version): Arch Pathol Lab Med, 2010; 134; 25
- Sparano JA, Gray RJ, Makower DF, Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer: N Engl J Med, 2018; 379(2); 111-21
- Kalinsky K, Barlow WE, Gralow JR, 21-gene assay to inform chemotherapy benefit in node-positive breast cancer: N Engl J Med, 2021; 385(25); 2336-47
- Cardoso F, van’t Veer LJ, Bogaerts J, 70-gene signature as an aid to treatment decisions in early-stage breast cancer: N Engl J Med, 2016; 375(8); 717-29
- Nelson DR, Brown J, Morikawa A, Method M, Breast cancer-specific mortality in early breast cancer as defined by high-risk clinical and pathologic characteristics: PLoS One, 2022; 17(2); e0264637
- Yerushalmi R, Woods R, Ravdin PM, Ki67 in breast cancer: Prognostic and predictive potential: Lancet Oncol, 2010; 11(2); 174-83
- Harbeck N, Rastogi P, Martin M, Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: Updated efficacy and Ki-67 analysis from the monarchE study: Ann Oncol, 2021; 32(12); 1571-81
- Kim I, Ryu JM, Kim JM, Development of a nomogram to predict N2 or N3 stage in T1-2 invasive breast cancer patients with no palpable lymphadenopathy: J Breast Cancer, 2017; 20(3); 270
- Houvenaeghel G, Lambaudie E, Classe JM, Lymph node positivity in different early breast carcinoma phenotypes: A predictive model: BMC Cancer, 2019; 19(1); 45
- Shimazu K, Sato N, Ogiya A, Intraoperative nomograms, based on one-step nucleic acid amplification, for prediction of non-sentinel node metastasis and four or more axillary node metastases in breast cancer patients with sentinel node metastasis: Ann Surg Oncol, 2018; 25(9); 2603-11
- van la Parra RFD, Peer PGM, Ernst MF, Bosscha K, Meta-analysis of predictive factors for non-sentinel lymph node metastases in breast cancer patients with a positive SLN: Eur J Surg Oncol, 2011; 37(4); 290-99
- Galimberti V, Cole BF, Zurrida S, Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23–01): A phase 3 randomised controlled trial: Lancet Oncol, 2013; 14(4); 297-305
- Farrell TPJ, Adams NC, Stenson M, The Z0011 Trial: Is this the end of axillary ultrasound in the pre-operative assessment of breast cancer patients?: Eur Radiol, 2015; 25(9); 2682-87
- Ahmed M, Jozsa F, Baker R, Meta-analysis of tumour burden in pre-operative axillary ultrasound positive and negative breast cancer patients: Breast Cancer Res Treat, 2017; 166(2); 329-36
- Lim GH, Upadhyaya VS, Acosta HA, Preoperative predictors of high and low axillary nodal burden in Z0011 eligible breast cancer patients with a positive lymph node needle biopsy result: Eur J Surg Oncol, 2018; 44(7); 945-50
- Kuijs VJL, Moossdorff M, Schipper RJ, The role of MRI in axillary lymph node imaging in breast cancer patients: A systematic review: Insights Imaging, 2015; 6(2); 203-15
- Schacht DV, Drukker K, Pak I, Using quantitative image analysis to classify axillary lymph nodes on breast MRI: A new application for the Z 0011 Era: Eur J Radiol, 2015; 84(3); 392-97
- Zheng K, Tan JX, Li F, Relationship between mammographic calcifications and the clinicopathologic characteristics of breast cancer in Western China: A retrospective multi-center study of 7317 female patients: Breast Cancer Res Treat, 2017; 166(2); 569-82
- Li Y, Cao J, Zhou Y, Mammographic casting-type calcification is an independent prognostic factor in invasive breast cancer: Sci Rep, 2019; 9(1); 10544
- Houvenaeghel G, Lymphovascular invasion has a significant prognostic impact in patients with early breast cancer, results from a large, national, multicenter, retrospective cohort study: ESMO Open, 2021; 6(6); 10
- Rakha EA, Martin S, Lee AH, The prognostic significance of lymphovascular invasion in invasive breast carcinoma: Cancer, 2012; 118(15); 3670-80
- Aleskandarany MA, Sonbul SN, Mukherjee A, Rakha EA, Molecular mechanisms underlying lymphovascular invasion in invasive breast cancer: Pathobiology, 2015; 82(3–4); 113-23
- Ahmed ARH, HER2 expression is a strong independent predictor of nodal metastasis in breast cancer: J Egypt Natl Cancer Inst, 2016; 28(4); 219-27
- Schettini F, Chic N, Brasó-Maristany F, Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer: NPJ Breast Cancer, 2021; 7(1); 1