Резюме
ПЕРЕДУМОВИ: Ефективність абемациклібу у пацієнток високого ризику з ранніми стадіями HR+/Her2- раку молочної залози була підтверджена дослідженням MonarchE. Однак точне визначення кількості метастазів у пахвових лімфатичних вузлах (ПЛВ) залишається складним завданням. Дослідження Z0011 змінило стратегію лікування пахвових лімфатичних вузлів, усунувши потребу в дисекції пахвових лімфатичних вузлів (ДПЛВ) у пацієнтів з 1-2 метастазами в сторожових лімфатичних вузлах (СЛВ). Тому необхідні подальші дослідження для виявлення пацієнтів, які можуть отримати користь від терапії абемациклібом.
МАТЕРІАЛИ ТА МЕТОДИ: Ретроспективне дослідження включало пацієнтів з CT1-2N0M0 HR+/Her2- з 1-2 позитивними СЛВ, яким була проведена ДПЛВ. Були зібрані клініко-патологічні дані, і за допомогою логістичного регресійного аналізу були визначені незалежні предиктори для ≥4 позитивних ПЛВ. Розроблено прогностичну номограму, оцінено дискримінацію та калібрування за допомогою С-індексу та калібрувальної кривої. Клінічну ефективність оцінювали за допомогою кривої аналізу прийняття рішень (КАР).
РЕЗУЛЬТАТИ: Ми включили 444 пацієнтки, з яких 77 (17,3%) мали ≥4 позитивних ПЛВ. Незалежними предикторами ≥4 позитивних ПЛВ були аномальні ПЛВ на УЗД, мамографічні кальцинати, Т-стадія та кількість позитивних СЛВ. Номограма продемонструвала AUC 0,777 (95% ДІ: 0,735-0,815, P<0,001), а внутрішня валідація показала хороше калібрування і дискримінацію (С-індекс 0,802; 95% ДІ: 0,779-0,824). КАР виявив позитивну чисту користь для рівнів ризику від 5% до 54%.
ВИСНОВКИ: Ця номограма є зручним і надійним інструментом для прогнозування ризику ≥4 позитивних ПЛВ у HR+/Her2- пацієнтів. Вона допомагає у виборі протоколу, визначаючи СЛВ-позитивних пацієнтів, які можуть отримати користь від терапії абемациклібом без ДПЛВ.
КЛЮЧОВІ СЛОВА: Абемацикліб, Новоутворення в молочній залозі, номограми
Передумови
Рак молочної залози є найчастішою злоякісною пухлиною у жінок, а дисекція пахвових лімфатичних вузлів (ПЛВ) була стандартним методом лікування позитивних ПЛВ у пацієнток. Дослідження ACOSOG Z0011 [1] та AMAROS [2] довели, що ДПЛВ не покращує загальну виживаність у пацієнтів cT1-2 з клінічно негативними пахвовими та 1-2 метастазами в СЛВ. Що стосується рецидивування локорегіональних лімфатичних вузлів, то дослідження Z0011 показало, що в групі біопсії сторожових лімфатичних вузлів (БСЛВ) кумулятивна частота рецидивування пахвової ділянки становила 1,5% порівняно з 0,5% в групі ДПЛВ. Аналогічно, у пацієнтів, які отримували ДПЛВ, 5-річна частота пахвових рецидивів становила 0,43% порівняно з 1,19% у пацієнтів, які отримували променеву терапію в пахвовій ділянці. Наведені вище дані продемонстрували, що ДПЛВ не має переваг у збільшенні загальної виживаності та контролі локальних рецидивів. Таким чином, більшість пацієнток на ранніх стадіях раку молочної залози з негативними лімфатичними вузлами уникають ДПЛВ. HR+/Her2- рак молочної залози є найпоширенішим підтипом серед пацієнток на ранніх стадіях [3], на який припадає близько 60% усіх випадків раку молочної залози. Незважаючи на більш сприятливий прогноз, ніж при Her2 та потрійному негативному раку грудей, пацієнтки все ще мають 40% ризик розвитку віддалених рецидивів, і цей ризик зростає разом з підвищеним анатомічним ризиком [4]. Пацієнтки з високим ризиком рецидиву повинні отримувати лікування якомога раніше, щоб запобігти рецидиву та метастазуванню. MonarchE [5] – це глобальне, рандомізоване, ІІІ-етапне дослідження, яке довело, що стандартне ендокринне лікування + абемацикліб (інгібітор циклінзалежних кіназ 4 і 6) може покращити терапевтичні результати у пацієнток на ранніх стадіях раку молочної залози з високим ризиком HR+/Her2-. Абсолютна 4-річна виживаність без інвазивних захворювань (ВБІЗ) становила 6,4% (група Абемациклібу (85,8% [95% ДІ 84,2-87,3] проти 79,4% у групі стандартного ендокринного лікування [95% ДІ 77,5-81,1]). Ризик виникнення події ВБІЗ був знижений на 33,6%. Пацієнтки, включені в дослідження MonarchE, мали позитивні ПЛВ ≥4 або мали 1-3 позитивні ПЛВ і принаймні 1 клінічну ознаку високого ризику: пухлина ≥5 см або гістологічний клас 3 або Ki-67 ≥20%. Починаючи з дослідження Z0011, відмова від ДПЛВ широко застосовується у пацієнток, які зберігають молочну залозу, з 1-2 позитивними СЛВ. Це призводить до нової проблеми: як вирішити, чи потребує пацієнтка терапії абемациклібом при 1-2 позитивних СЛВ без клінічних ознак високого ризику? Чи є ДПЛВ необхідним для підтвердження метастатичного навантаження пахвових вузлів? Було показано, що 13,0-18,4% пацієнтів, які відповідали критеріям Z0011, мали більше 4 позитивних ПЛВ [1,2,6]. Таким чином, ми повинні визначити ризик метастазів ПЛВ ≥4 у пацієнток з HR+/Her2- раком молочної залози з 1-2 позитивними СЛВ і пропущеним ДПЛВ без ознак пухлини високого ризику. Ці пацієнтки, ймовірно, можуть отримати користь від терапії абемациклібом для посилення системної терапії та деескалації місцевого хірургічного лікування. Метою даного дослідження було проаналізувати ретроспективні дані одноцентрового дослідження за допомогою одновимірного та багатовимірного регресійного аналізу та побудувати номограму для відбору пацієнтів, які підходять для терапії абемациклібом.
Матеріали та методи
СТАТИСТИЧНИЙ АНАЛІЗ:
Були зібрані клінічні дані пацієнток, включаючи вік, ІМТ, менопаузальний статус, уніфокальні/мультифокальні пухлини, ультразвук ПЛВ (УЗД-ПВЛ), мамографічні кальцинати, хірургічний метод, патологічний тип, гістологічний клас, розмір пухлини, лімфоваскулярну інвазію (ЛВІ), позитивне та негативне число СЛВ, N класифікацію, рівень експресії рецепторів прогестерону та Her2. Клініко-патологічні фактори були проаналізовані як категоріальні змінні для вивчення їх кореляції з позитивним числом ПЛВ ≥4. Категоріальні змінні аналізували за допомогою одновимірного логістичного регресійного аналізу, з якого отримані значущі змінні аналізували в багатовимірному логістичному регресійному аналізі для підтвердження незалежних предикторів позитивних ПЛВ ≥4. Номограму було побудовано за допомогою пакету “rms” програмного забезпечення R. Для оцінки ефективності номограми використовували дискримінацію та калібрування. Внутрішня валідація була виконана за допомогою методу повторної вибірки 1000 бутстрапів, з обчисленням С-індексу та побудовою калібрувальної кривої. Дискримінаційну здатність оцінювали за площею під ROC-кривою та С-індексом. Для оцінки клінічної ефективності та чистої користі номограми використовували криву аналізу прийняття рішень (КАР). Всі статистичні аналізи були проведені з використанням SPSS 25.0 (IBM Corporation, Армонк, Нью-Йорк, США) та R 4.1.1 (The R Foundation for Statistical Computing, Австрія, Відень). P<0,05 інтерпретувався як статистично значущий.
Результати
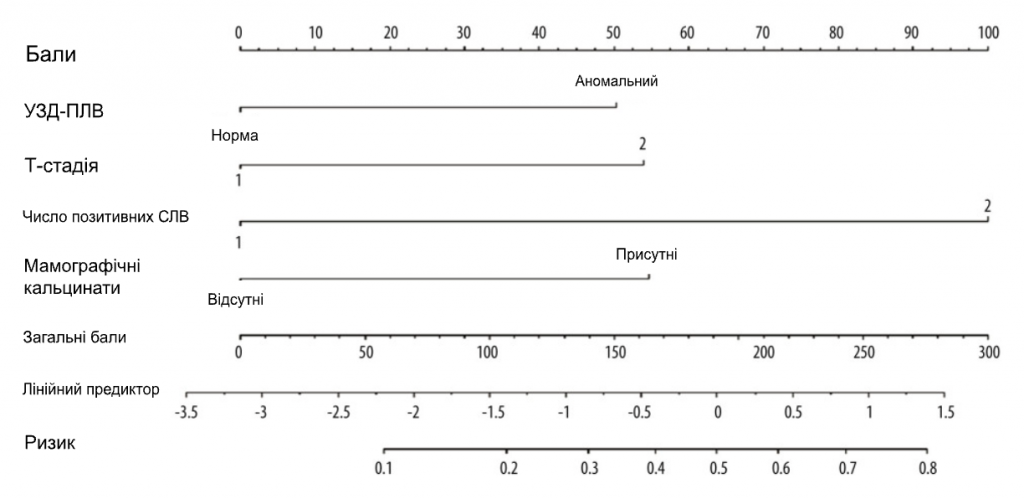
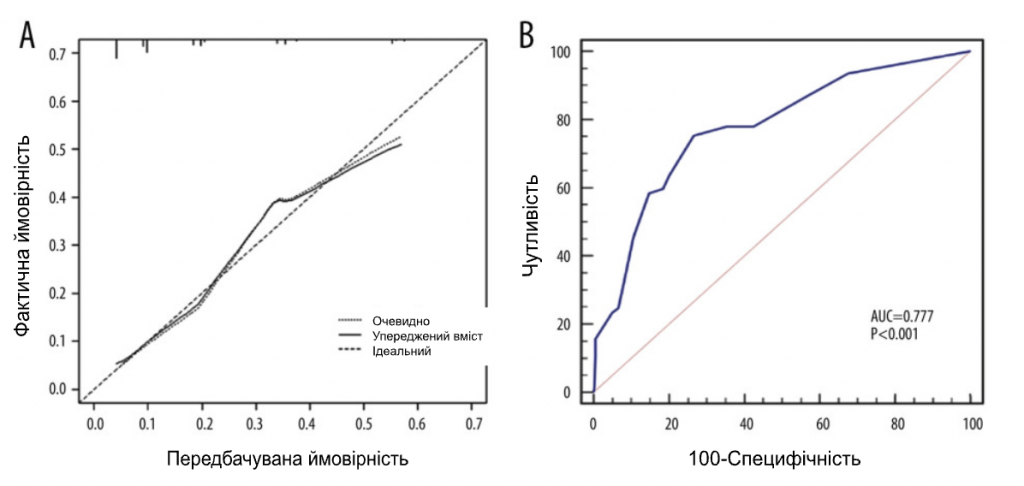
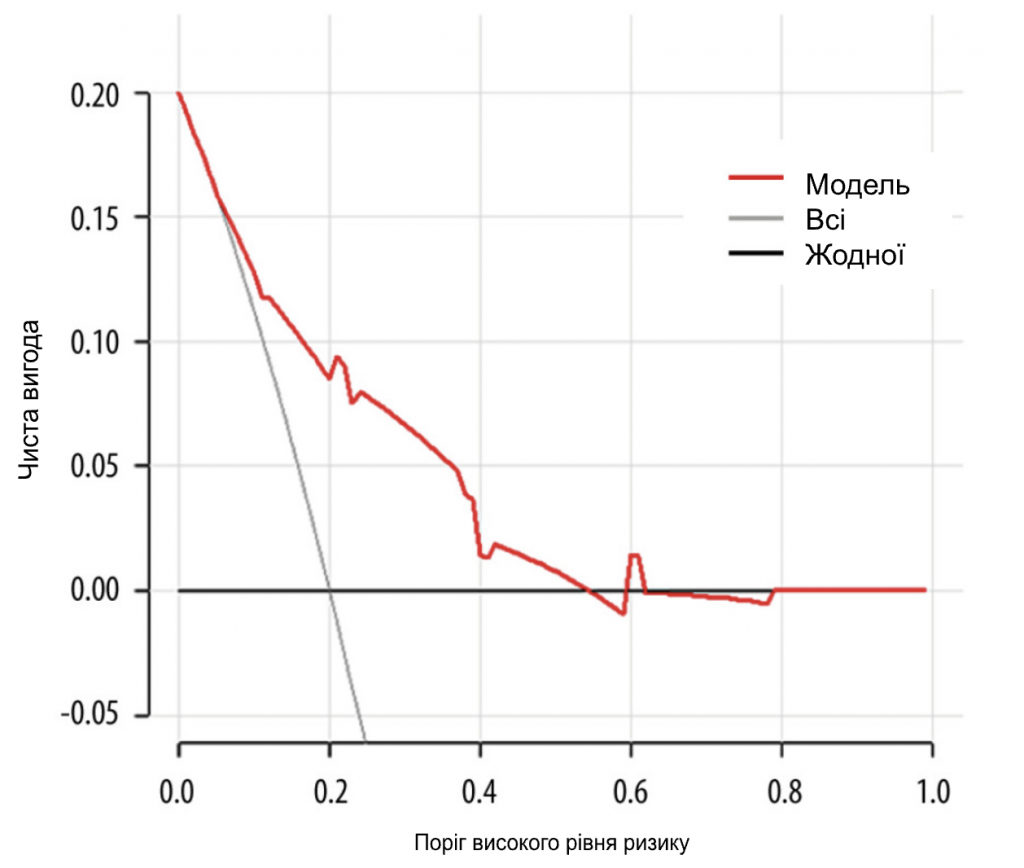
Ми набрали 444 пацієнтки з раком молочної залози, які відповідали критеріям включення, з січня 2015 року по червень 2022 року. Вихідні характеристики пацієнтів наведені в Таблиці 1. Середній вік становив 50 років. У 274 пацієнток (61,7%) були пухлини cT1, у 318 пацієнток (71,6%) – 1 позитивний СЛВ і у 126 пацієнток (28,4%) – 2 позитивних СЛВ. Серед пацієнтів з 1 позитивним СЛВ 9,43% мали позитивні не-СЛВ ≥3, а серед пацієнтів з 2 позитивними СЛВ 36,5% мали позитивні не-СЛВ ≥2. Загалом 367 (82,7%) пацієнтів мали 1-3 позитивні ПЛВ (pN1), а 77 (17,3%) пацієнтів мали позитивні ПЛВ ≥4 (pN2-3) (Табл. 2). Для виявлення факторів позитивного значення ПЛВ ≥4 було проведено одновимірний та багатовимірний логістичний регресійний аналіз. Фактори з P<0,05 в одновимірному аналізі були проаналізовані в багатовимірному аналізі. Незалежними предикторами позитивних ПЛВ ≥4 були УЗД-ПЛВ (ВШ=2,289, 95% ДІ: 1,327-3,948, P=0,003), мамографічні кальцинати (ВШ=2,452, 95% ДІ: 1. 297-4,638, P=0,006), Т-стадія (ВШ=2,426, 95% ДІ: 1,414-4,161, P=0,001) та позитивне число СЛВ (ВШ=5,175, 95% ДІ: 3,007-8,904, P<0,001). На основі даних багатовимірного логістичного регресійного аналізу була побудована номограма для прогнозування позитивних ПЛВ ≥4 серед пацієнтів з cT1-2N0M0 HR+/Her2- з 1-2 позитивними СЛВ (Зобр. 1). Ймовірність позитивних СЛВ ≥4 розраховували шляхом додавання балів за 4 факторами та відношенням до загальної суми балів і шкали мінімального ризику. Калібрувальна крива та ROC-крива були використані для оцінки калібрування та дискримінації номограми. Калібрувальна крива показала добру відповідність між прогнозованими та спостережуваними результатами для номограми (Зобр. 2А). ROC-крива номограми показана на Зобр. 2B. Чутливість становила 75,32%, специфічність – 73,30%, а AUC – 0,777 (95% ДІ: 0,735-0,815, P<0,001), що свідчить про те, що номограма має хороші прогностичні характеристики. Номограма продемонструвала хорошу дискримінацію зі значенням С-індексу 0,802 (95% ДІ: 0,779-0,824). Аналіз кривих прийняття рішень був використаний для визначення клінічної застосовності прийняття рішень на основі прогностичної моделі порівняно зі стандартною стратегією. Порівняно з лікуванням усіх пацієнтів (похила лінія) або нелікуванням жодного пацієнта (горизонтальна лінія), модель продемонструвала високі чисті переваги. КАР (Зобр. 3) продемонструвала, що в діапазоні порогового ризику від 5% до 54% рішення про втручання на основі номограми були однозначно корисними.
Обговорення
У цьому дослідженні була побудована номограма з використанням клініко-патологічних факторів для оцінки ризику позитивних ПЛВ ≥4 серед пацієнтів з cT1-2N0M0 HR+/Her2- з 1-2 позитивними СЛВ. Номограма включала УЗД-ПЛВ, мамографічні кальцинати, Т-стадію та кількість позитивних СЛВ. Внутрішня валідація показала, що номограма має добру дискримінацію, калібрування та клінічну ефективність.
Наразі основними тенденціями в лікуванні раку молочної залози є деескалаційна хіміотерапія для пацієнток з низьким ризиком та інтенсивна системна терапія для пацієнток з високим ризиком. Для розробки протоколів ад’ювантної хіміотерапії хворих на рак молочної залози на ранніх стадіях з HR+/Her2- (наприклад, Oncotype DX [9,10] та MammaPrint [11]) були розроблені численні методи виявлення генів, орієнтовані на рак молочної залози з HR+ і негативними лімфатичними вузлами або 1-3 позитивними лімфатичними вузлами. Пацієнтки з клініко-патологічними характеристиками високого ризику (наприклад, учасниці дослідження MonarchE) мали показники смертності, подібні до показників смертності пацієнток з потрійним негативним раком грудей (ПНРГ) [12]. Дослідження MonarchE [5] показало, що 2-річне застосування абемациклібу може покращити клінічні результати. Наразі у більшості пацієнтів, які відповідали критеріям Z0011, не виявлено ДПЛВ, що унеможливлює отримання повних даних про метастазування ПЛВ, тому частково пацієнти не мають підстав для інтенсивного лікування. Індекс Ki-67 може відображати ступінь проліферації клітин, і пацієнти з високим рівнем Ki-67 мали гірші прогнози [13]. Пацієнтам, включеним у дослідження MonarchE, було дозволено лікування абемациклібом при Ki-67 ≥20%, якщо були метастази в лімфатичні вузли, за винятком лише ≥4 метастазів у лімфатичні вузли, коли Ki-67 був <20%. Тому пацієнти з Ki-67 ≥20% були виключені з цього дослідження. У групі намірів на лікування та в першій когорті клінічного досліду MonarchE відзначено, що лікування абемациклібом значно покращило ВБІЗ у пацієнтів з пухлинами з високим рівнем експресії Ki-67. У когорті 1 перевага абемациклібу постійно спостерігалася незалежно від експресії Ki-67, що вказує на те, що Ki-67 не може передбачити терапевтичну користь абемациклібу. Примітно, що пацієнти з високим рівнем експресії Ki-67 мали вищі показники рецидивів, ніж пацієнти з низьким рівнем експресії Ki-67. Таким чином, експресія Ki-67 є прогностичним показником рецидиву, але не може передбачити терапевтичні переваги абемациклібу [14]. Попереднє дослідження показало, що 13,0-18,4% пацієнтів, які відповідали критеріям Z0011, мали більше 4 позитивних ПЛВ [1,2,6]. Наше дослідження показало, що ймовірність позитивних ПЛВ ≥4 серед пацієнтів cT1-2N0 HR+/Her2- з 1-2 позитивними CЛВ становила 17,1%, 9,43% для 1 позитивного CЛВ і 38,1% для 2 позитивних CЛВ.
Більшість прогностичних досліджень були зосереджені на наявності метастазів не в СЛВ, тоді як досліджень щодо точної кількості метастазів у лімфатичні вузли (наприклад, позитивні лімфатичні вузли ≥4) небагато. Крім того, змінними, включеними в ці дослідження, були насамперед розмір метастатичного вогнища СЛВ, екстрамембранозна інфільтрація лімфатичних вузлів і ЛВІ [15], які базувалися на післяопераційних патогістологічних обстеженнях. Gilles та співавт. [16] створили передопераційну клінічну модель і післяопераційну патологічну модель для прогнозування ризику метастазів ПЛВ на основі 12572 випадків раку молочної залози на ранніх стадіях, показавши, що післяопераційна модель має кращу дискримінацію (AUC=0,780), ніж передопераційна модель (AUC=0,717). Інтраопераційних моделей мало. Shimazu та співавт. [17] побудували інтраопераційну модель прогнозування метастазування не-СЛВ за допомогою методу однокрокової ампліфікації нуклеїнових кислот. Модель включала загальне пухлинне навантаження і розмір пухлини, з AUC 0,70. AUC моделі в цьому дослідженні становила 0,777, і вона була такою ж ефективною, як і наведена вище післяопераційна модель. Вважається, що розмір пухлини, гістологічний клас, ЛВІ, вік на момент встановлення діагнозу, позитивне СЛВ-число, експресія гормональних рецепторів, статус Her-2 та молекулярний підтип є значущими факторами ризику метастазування не-СЛВ [18]. Це дослідження показало, що УЗД-ПЛВ, мамографічні кальцинати, Т-стадія та позитивне число СЛВ є незалежними предикторами позитивних ПЛВ ≥4.
У дослідженні Z0011 [1], дослідженні IBCSG 23-01 [19] та дослідженні AMAROS [2] клінічно негативні лімфатичні вузли визначалися як відсутність збільшених лімфатичних вузлів при фізикальному обстеженні. Тим не менш, оцінка статусу ПЛВ за допомогою клінічного обстеження є неточною, а ультразвукове дослідження сприяє виявленню пацієнтів з високим навантаженням на пахвові лімфатичні вузли [20,21]. У цьому дослідженні 146 пацієнтів мали аномалії ПЛВ на УЗД, з них 39 пацієнтів (26,7%) мали ≥4 позитивних лімфовузлів, 260 пацієнтів мали нормальний стан ПЛВ на УЗД, і 38 (14,6%) з них мали позитивні лімфовузли ≥4. Було показано, що пацієнти з аномальними ПЛВ на УЗД мали більше пахвове навантаження (ВШ=2,289, 95% ДІ: 1,327-3,948, P=0,003) порівняно з пацієнтами з нормальними результатами УЗД, що узгоджується з дослідженням Muneer та співавт. [21]. Lim та співавт. [22] повідомили, що ≥3 патологічних лімфатичних вузлів на УЗД є критичним предиктором високого навантаження на пахвові лімфатичні вузли у пацієнтів, які відповідають критеріям Z0011. Крім того, було показано, що передопераційна МРТ може точно виявити метастази ПЛВ для оцінки пухлинного навантаження на пахвові лімфатичні вузли [23,24]. Радіоімічні змінні можуть бути включені в майбутні прогностичні моделі для подальшого покращення прогностичної ефективності моделі.
Зв’язок між візуалізаційними проявами первинної пухлини та метастазами ПЛВ недостатньо вивчений, особливо за допомогою мамографії. Zheng та співавт. [25] виявили значний зв’язок між метастазуванням ПЛВ і мамографічними кальцифікатами серед 7317 пацієнток. Yan та співавт. [26] повідомили, що мамографічні кальцинати суттєво пов’язані з високим навантаженням метастазування ПЛВ як незалежний прогностичний фактор для пацієнток з раком молочної залози. Візуалізаційні прояви первинного локусу не були включені в дослідження, подібні до дослідження Z0011. Однак ми продемонстрували значну кореляцію між мамографічними кальцифікатами і позитивними ПЛВ ≥4 (ВШ=2,452, 95% ДІ: 1,297-4,638, P=0,006).
ЛВІ є незалежним предиктором метастазування в лімфатичні вузли та несприятливих результатів [27,28]. Він вимагає рутинного забарвлення післяопераційних зрізів гематоксиліном та еозином (ГЕ), що не підходить для інтраопераційних моделей. ЛВІ значною мірою корелює з віком, Т-стадією, гістологічним класом та експресією гормональних рецепторів [29]. У цьому дослідженні було виявлено, що ЛВІ не має відношення до метастазування ПЛВ (P=0,420), що може бути пов’язано з тим, що включені пацієнти мали позитивні гормональні рецептори, виключаючи залучення просунутої стадії T/N і гістологічного ступеня пухлини 3.
Експресія Her2 суттєво корелює з метастатичним потенціалом клітин раку молочної залози. Ahmed та співавт. [30] повідомили, що експресія Her2 є незалежним предиктором метастазування ПЛВ. В даний час вважається, що низька експресія Her2 може бути новим молекулярним підтипом. Francesco [31] виявив, що пацієнти з HR-позитивними захворюваннями (65,4%) мали вищу частку низької експресії Her2, ніж пацієнти з ПНРГ (36,6%). Низький рівень експресії Her2 не мав відношення до загальної виживаності пацієнток з HR-позитивним раком молочної залози. Небагато досліджень вивчали взаємозв’язок між експресією Her2 та метастазуванням ПЛВ. Наше дослідження показало, що частка низької експресії Her2 (85,6%) була вищою, ніж Her2 0 (14,4%) серед HR+/Her2- пацієнтів, що узгоджується з даними у дослідженні Francesco. Однак не було виявлено достовірної кореляції між низькою експресією Her2 і статусом HER2 0 та кількістю метастазів у лімфатичних вузлах (P=0,151).
Номограма в цьому дослідженні показала С-індекс 0,802 (95% ДІ: 0,779-0,824), що свідчить про хорошу дискримінацію. Щодо оцінки калібрування, то калібрувальна крива продемонструвала сильну відповідність між кривою розподілу прогнозованих значень моделі та кривою розподілу, отриманою після корекції перенавчання за допомогою повторної вибірки. Вона тісно збігалася з оптимальною кривою (стандартною кривою), що свідчить про хороше калібрування моделі. Для оцінки клінічної ефективності була застосована крива аналізу прийняття рішень (КАР) для розрахунку чистої користі та побудови КАР. КАР проілюструвала, що крива прийняття рішення моделі відхилилася від 2 крайніх кривих сценаріїв, що свідчить про добру клінічну ефективність.
Це дослідження має певні обмеження. По-перше, це було одноцентрове ретроспективне дослідження з потенційними упередженнями. По-друге, номограма не пройшла зовнішню валідацію. Таким чином, для оцінки та валідації результатів необхідні проспективні багатоцентрові дослідження.
Висновки
Ми створили інтраопераційну прогностичну номограму для прогнозування ймовірності позитивних ПЛВ ≥4 серед HR+/Her2- пацієнтів з позитивними СЛВ і пропущеними ДПЛВ, щоб допомогти в прийнятті клінічних рішень. Прогностична модель є точною і може допомогти онкологам ідентифікувати пацієнтів, які потребують терапії абемациклібом. Таким чином, пацієнтам можуть бути запропоновані кращі стратегії лікування, включаючи деескалаційну хірургію та системну ескалаційну терапію в епоху БСЛВ та точної медицини.
Зображення 1. Номограма для прогнозування пацієнтів з ≥4 позитивними сумарними ПЛВ у популяції HR+/HER2- з 1-2 позитивними СЛВ. Бали за 4 факторами підсумовувалися для розрахунку ймовірності ≥4 позитивних сумарних ПЛВ, а загальні бали та нижня шкала ризику були віднесені до шкали ризику. Програмне забезпечення R 4.1.1 (The R Foundation for Statistical Computing, Австрія, Відень).
Зображення 2. (А) Калібрувальна крива показала задовільну відповідність між прогнозом і фактичним спостереженням. (B) ROC-крива номограми. Програмне забезпечення R 4.1.1 (The R Foundation for Statistical Computing, Австрія, Відень).
Зображення 3. КАР демонструє клінічну ефективність номограми. Червона лінія – це номограма, яка прогнозує ризик появи ≥4 позитивних вузлів у пацієнтів. Сіра лінія позначає всіх пацієнтів з ≥4 позитивними вузлами, тоді як чорна лінія не позначає жодного пацієнта з ≥4 позитивними вузлами. Ця КАР може забезпечити більшу чисту вигоду в діапазоні від 5% до 54%. КАР – крива аналізу прийняття рішень. Програмне забезпечення R 4.1.1 (The R Foundation for Statistical Computing, Австрія, Відень).
Таблиці
Таблиця 1. Характеристика HR+/HER2- пацієнток.
| Характеристики | Пацієнти (n=444) |
| Вік, медіана (мін., макс.), роки | 50 (26-80) |
| 215 (48.4%) | |
| ≥50, кількість (%) | 229 (51.6%) |
| ІМТ | 244 (22.3-26.1) |
| Менопаузальний статус, кількість (%) | |
| Передменопаузальний період | 254 (57.2%) |
| Постменопаузальний період | 190 (42.8%) |
| Мультифокальність, кількість (%) | |
| Відсутність | 394 (88.7%) |
| Присутність | 50 (11.3%) |
| Клінічна стадія пухлини, кількість (%) | |
| 1 | 274 (61.7%) |
| 2 | 170 (38.3%) |
| Розмір пухлини, медіана (min, max), см | 1.9 (0.2-5.0) |
| УЗД-ПЛВ, кількість (%) | |
| Норма | 298 (67.1%) |
| Аномальний | 146 (32.9%) |
| Мамографічні кальцинати, кількість (%) | |
| Відсутні | 365 (82.2%) |
| Присутні | 79 (17.8%) |
| Хірургічне втручання, кількість (%) | |
| Мастектомія | 350 (78.8%) |
| Збереження грудей | 94 (21.2%) |
| Тип пухлини, кількість (%) | |
| Протоковий | 425 (95.7%) |
| Дольковий | 15 (3.4%) |
| Інші | 4 (0.9%) |
| Гістологічний ступінь, кількість (%) | |
| I | 7 (1.6%) |
| II | 397 (89.4%) |
| Відсутній | 40 (9.0%) |
| Видалено 1 позитивний СЛВ , всього, кількість (%) | 318 (71.6%) |
| 0 позитивних не-СЛВ, немає | 166 |
| 1 позитивних не-СЛВ, немає | 95 |
| 2 позитивних не-СЛВ, немає | 27 |
| ≥3 позитивних не-СЛВ, немає | 30 |
| Видалено 2 позитивних СЛВ , всього, кількість (%) | 126 (28.4%) |
| 0 позитивних не-СЛВ, немає | 62 |
| 1 позитивних не-СЛВ, немає | 18 |
| 2 позитивних не-СЛВ, немає | 22 |
| ≥3 позитивних не-СЛВ, немає | 24 |
| Стадія pN, кількість (%) | |
| 1 | 367 (82.7%) |
| 2-3 | 77 (17.3%) |
| ЛВІ, кількість (%) | |
| Відсутній | 348 (78.4%) |
| Присутній | 96 (21.6%) |
| Рецептор прогестерону, кількість (%) | |
| Негативний | 33 (7.4%) |
| Позитивний | 411 (92.6%) |
| Експресія HER2, кількість (%) | |
| 0 | 64 (14.4%) |
| 1+ | 137 (30.9%) |
| 2+ | 243 (54.7%) |
ІМТ – індекс маси тіла; УЗД-ПЛВ – ультразвукове виявлення пахвового лімфовузла; СЛВ – сторожовий лімфатичний вузол; ЛВІ – лімфоваскулярна інвазія.
Таблиця 2. Одновимірний та багатовимірний аналіз серед пацієнток з HR+/HER2-.
| Характеристики | pN1 (n=367) | pN2-3 (n=77) | Незмінна P | Багатовимірна P |
| Вік, кількість (%) | 0.747 | |||
| 179 (48.8) | 36 (46.8) | |||
| ≥50, кількість (%) | 188 (51.2) | 41 (53.2) | ||
| Менопаузальний статус, кількість (%) | 0.990 | |||
| Відсутній | 210 (57.2) | 44 (57.1) | ||
| Присутній | 157 (42.8) | 33 (42.9) | ||
| Мультифокальність, кількість (%) | 0.356 | |||
| Відсутність | 328 (89.4) | 66 (85.7) | ||
| Присутність | 39 (10.6) | 11 (14.3) | ||
| Клінічна стадія пухлини, кількість (%) | 0.001 | |||
| 1 | 241 (65.7) | 33 (42.9) | ||
| 2 | 126 (34.3) | 44 (57.1) | ||
| УЗД-ПЛВ, кількість (%) | 0.003 | |||
| Норма | 260 (70.8) | 38 (49.4) | ||
| Аномальний | 107 (29.2) | 39 (50.6) | ||
| Мамографічні кальцинати | 0.017 | 0.006 | ||
| Відсутні | 309 (84.2) | 56 (72.7) | ||
| Присутні | 58 (15.8) | 21 (27.3) | ||
| Хірургічне втручання, кількість (%) | 0.602 | |||
| Мастектомія | 291 (79.3) | 59 (76.6) | ||
| Збереження грудей | 76 (20.7) | 18 (23.4) | ||
| Тип пухлини, кількість (%) | 0.571 | |||
| Протоковий | 353 (96.1) | 72 (93.5) | ||
| Дольковий | 11 (3.0) | 4 (5.2) | ||
| Інші | 3 (0.9) | 1 (1.3) | ||
| Гістологічний ступінь, кількість (%) | 0.880 | |||
| I | 6 (1.6) | 1 (1.3) | ||
| II | 329 (89.6) | 68 (88.3) | ||
| Відсутній | 32 (8.8) | 8 (10.4 | ||
| Кількість видалених позитивних СЛВ | ||||
| 1 | 287 (78.2) | 31 (40.2) | ||
| 2 | 80 (21.8) | 46 (59.8) | ||
| Кількість видалених негативних СЛВ | 0.004 | |||
| 0 | 18 (4.9) | 10 (13.0) | ||
| 1 | 66 (18.0) | 18 (23.4) | ||
| 2 | 79 (21.5) | 9 (11.7) | ||
| 3 | 65 (17.7) | 20 (26.0) | ||
| ≥4 | 139 (37.9) | 20 (26.0) | ||
| ЛВІ, кількість (%) | 0.420 | |||
| Відсутній | 285 (77.7) | 63 (81.8) | ||
| Присутній | 82 (22.3) | 14 (18.2) | ||
| Рецептор прогестерону, кількість (%) | 0.895 | |||
| Негативний | 27 (7.4) | 6 (7.8) | ||
| Позитивний | 340 (92.6) | 71 (92.2) | ||
| Експресія HER2, кількість (%) | 0.151 | |||
| 0 | 48 (13.1) | 16 (20.8) | ||
| 1 | 112 (30.5) | 25 (32.5) | ||
| 2 | 207 (56.4) | 36 (46.7) |
УЗД-ПЛВ; СЛВ – сторожовий лімфатичний вузол; ЛВІ – лімфоваскулярна інвазія.
Посилання на джерела
- Giuliano AE, Ballman KV, McCall L, Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: The ACOSOG Z0011 (Alliance) randomized clinical trial: JAMA, 2017; 318(10); 918
- Donker M, van Tienhoven G, Straver ME, Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial: Lancet Oncol, 2014; 15(12); 1303-10
- Howlader N, Altekruse SF, Li CI, US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status: J Natl Cancer Inst, 2014; 106(5); dju055
- Pan H, Gray R, Braybrooke J, 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years: N Engl J Med, 2017; 377(19); 1836-46
- Johnston SRD, Toi M, O’Shaughnessy J, Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): Results from a preplanned interim analysis of a randomised, open-label, phase 3 trial: Lancet Oncol, 2022; 24(1); 77-90
- Katz A, Smith BL, Golshan M, Nomogram for the prediction of having four or more involved nodes for sentinel lymph node-positive breast cancer: J Clin Oncol, 2008; 26(13); 2093-98
- Wolff AC, Hammond MEH, Allison KH, Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update: Arch Pathol Lab Med, 2018; 142(11); 1364-82
- Hammond MEH, Hayes DF, Dowsett M, American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Immunohistochemical Testing of Estrogen and Progesterone Receptors in Breast Cancer (Unabridged Version): Arch Pathol Lab Med, 2010; 134; 25
- Sparano JA, Gray RJ, Makower DF, Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer: N Engl J Med, 2018; 379(2); 111-21
- Kalinsky K, Barlow WE, Gralow JR, 21-gene assay to inform chemotherapy benefit in node-positive breast cancer: N Engl J Med, 2021; 385(25); 2336-47
- Cardoso F, van’t Veer LJ, Bogaerts J, 70-gene signature as an aid to treatment decisions in early-stage breast cancer: N Engl J Med, 2016; 375(8); 717-29
- Nelson DR, Brown J, Morikawa A, Method M, Breast cancer-specific mortality in early breast cancer as defined by high-risk clinical and pathologic characteristics: PLoS One, 2022; 17(2); e0264637
- Yerushalmi R, Woods R, Ravdin PM, Ki67 in breast cancer: Prognostic and predictive potential: Lancet Oncol, 2010; 11(2); 174-83
- Harbeck N, Rastogi P, Martin M, Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: Updated efficacy and Ki-67 analysis from the monarchE study: Ann Oncol, 2021; 32(12); 1571-81
- Kim I, Ryu JM, Kim JM, Development of a nomogram to predict N2 or N3 stage in T1-2 invasive breast cancer patients with no palpable lymphadenopathy: J Breast Cancer, 2017; 20(3); 270
- Houvenaeghel G, Lambaudie E, Classe JM, Lymph node positivity in different early breast carcinoma phenotypes: A predictive model: BMC Cancer, 2019; 19(1); 45
- Shimazu K, Sato N, Ogiya A, Intraoperative nomograms, based on one-step nucleic acid amplification, for prediction of non-sentinel node metastasis and four or more axillary node metastases in breast cancer patients with sentinel node metastasis: Ann Surg Oncol, 2018; 25(9); 2603-11
- van la Parra RFD, Peer PGM, Ernst MF, Bosscha K, Meta-analysis of predictive factors for non-sentinel lymph node metastases in breast cancer patients with a positive SLN: Eur J Surg Oncol, 2011; 37(4); 290-99
- Galimberti V, Cole BF, Zurrida S, Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23–01): A phase 3 randomised controlled trial: Lancet Oncol, 2013; 14(4); 297-305
- Farrell TPJ, Adams NC, Stenson M, The Z0011 Trial: Is this the end of axillary ultrasound in the pre-operative assessment of breast cancer patients?: Eur Radiol, 2015; 25(9); 2682-87
- Ahmed M, Jozsa F, Baker R, Meta-analysis of tumour burden in pre-operative axillary ultrasound positive and negative breast cancer patients: Breast Cancer Res Treat, 2017; 166(2); 329-36
- Lim GH, Upadhyaya VS, Acosta HA, Preoperative predictors of high and low axillary nodal burden in Z0011 eligible breast cancer patients with a positive lymph node needle biopsy result: Eur J Surg Oncol, 2018; 44(7); 945-50
- Kuijs VJL, Moossdorff M, Schipper RJ, The role of MRI in axillary lymph node imaging in breast cancer patients: A systematic review: Insights Imaging, 2015; 6(2); 203-15
- Schacht DV, Drukker K, Pak I, Using quantitative image analysis to classify axillary lymph nodes on breast MRI: A new application for the Z 0011 Era: Eur J Radiol, 2015; 84(3); 392-97
- Zheng K, Tan JX, Li F, Relationship between mammographic calcifications and the clinicopathologic characteristics of breast cancer in Western China: A retrospective multi-center study of 7317 female patients: Breast Cancer Res Treat, 2017; 166(2); 569-82
- Li Y, Cao J, Zhou Y, Mammographic casting-type calcification is an independent prognostic factor in invasive breast cancer: Sci Rep, 2019; 9(1); 10544
- Houvenaeghel G, Lymphovascular invasion has a significant prognostic impact in patients with early breast cancer, results from a large, national, multicenter, retrospective cohort study: ESMO Open, 2021; 6(6); 10
- Rakha EA, Martin S, Lee AH, The prognostic significance of lymphovascular invasion in invasive breast carcinoma: Cancer, 2012; 118(15); 3670-80
- Aleskandarany MA, Sonbul SN, Mukherjee A, Rakha EA, Molecular mechanisms underlying lymphovascular invasion in invasive breast cancer: Pathobiology, 2015; 82(3–4); 113-23
- Ahmed ARH, HER2 expression is a strong independent predictor of nodal metastasis in breast cancer: J Egypt Natl Cancer Inst, 2016; 28(4); 219-27
- Schettini F, Chic N, Brasó-Maristany F, Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer: NPJ Breast Cancer, 2021; 7(1); 1