Резюме
Передумови
Дослідити, чи можна використовувати коефіцієнт поглинання (КП) як неінвазивний показник для оцінки ураження печінки у дітей та підлітків з хворобою Вільсона (ХВ).
Методи
Діти та підлітки з діагнозом ХВ були ретроспективно відібрані в Першій афілійованій лікарні Університету традиційної китайської медицини провінції Аньхой в період з травня 2022 року по серпень 2022 року. Були отримані результати КП, Зсувнохвильової еластографії (ЗХЕ), Індекс співвідношення АсАТ до тромбоцитів (APRI), та індекс фіброзу 4 (FIB-4). Ураження печінки при ХВ було поділено на 3 групи на основі сироваткових рівнів колагену IV типу (КIV), гіалуронової кислоти (ГК), ламініну (ЛН), N-кінцевого пептиду преколагену типу III (PIIINP): (1) Група 1 (n = 25), немає змін в КIV, ГК, ЛН та PIIINP; (2) Група 2 (n = 19), підвищення 1 або 2 показників в КIV, ГК, ЛН, та PIIINP; Група 3 (n = 18), підвищення 3 або 4 індикаторів в КIV, ГК, ЛН, та PIIINP. Рівні КП, ЗХЕ, APRI та FIB-4 порівнювали між 3 групами; та кореляцію КП з ЗХЕ та тригліцеридами (ТГ) проводили за допомогою кореляційного аналізу Спірмена. Для аналізу діагностичної ефективності КП та її комбінації з ЗХЕ, APRI та FIB-4 у дітей та підлітків з ХВ використовували криву робочої характеристики приймача (ROC-крива).
Результати
Загалом було ретроспективно відібрано 62 дітей та підлітків з ХВ. При міжгрупових порівняннях рівні КП значно відрізнялися (P < 0,001). ROC-крива показала, що площа під кривою (AUC) для діагностики стеатозу печінки за допомогою КП становила 0,714, 0,712 та 0,867 у групі 1 порівняно з групою 2, групою 2 порівняно з групою 3 та групою 1 порівняно з групою 3 відповідно; чутливість для діагностики стеатозу печінки в групі 1 порівняно з групою 2 становила 89,47% при пороговому значенні КП 0,73 дБ/см/МГц. Не було виявлено значної кореляції між КП і ТГ (ρ = 0,154, P = 0,231). У порівнянні лише КП, комбінація КП з APRI та FIB-4 або комбінацію КП з ЗХЕ, APRI та FIB-4 показала кращу діагностичну ефективність у групі 1 порівняно з групою 2 (обидва випадки P = 0,038).
Висновок
КП може бути використаний як неінвазивний індекс для оцінки стеатозу печінки у дітей та підлітків з ХВ, що має хороше клінічне застосування. Окрім того, КП у поєднанні з APRI, FIB-4 та ЗХЕ може мати кращу діагностичну ефективність, ніж тільки КП.
Передумови
Хвороба Вільсона (ХВ), також відома як гепато-лентикулярна дегенерація, є аутосомно-рецесивним генетичним захворюванням, зумовленим мутацією гена ATP7B, що призводить до порушення виведення міді з печінки та накопичення її в тканинах [1]. Печінка є основним органом метаболізму міді [2], а патогенез ХВ є прямим наслідком накопичення міді в гепатоцитах, що починається з жирового гепатозу та супроводжується хронічним запаленням, фіброзом печінки та цирозом печінки [3]. Біопсія печінки визнана золотим стандартом для оцінки патологічних змін у печінці. Однак у більшості пацієнтів з ХВ спостерігається цілий спектр неврологічних проявів, таких як тремор, брадикінезія, ригідність, дистонія, хорея, дизартрія та дисфагія [4], що ускладнює виконання інвазивної біопсії печінки. Тому актуальним є дослідження неінвазивних методів для оцінки патологічних змін у пацієнтів з ХВ.
Попередні дослідження показали, що різні ультразвукові методи, включаючи двовимірне (2D) ультразвукове дослідження [5], транзиторну еластографію (ТЕ) та двовимірну зсувнохвильову еластографію (2D-ЗХЕ), можуть бути використані для оцінки фіброзу печінки та процесу цирозу печінки у пацієнтів з ХВ [5,6,7]. У пацієнтів з цирозом печінки, пов’язаними з ХВ, 2D-УЗД може виявити шорстку капсулу печінки, а також порушення внутрішньої ехогенності печінки. Коли захворювання прогресує до фіброзу печінки або навіть цирозу печінки, ТЕ і 2D-ЗХЕ часто вказують на подальше збільшення показників жорсткості печінки. Як повідомлялося, у педіатричних пацієнтів з ХВ оптимальний поріг жорсткості печінки для фіброзу печінки становить 8,30 КПа за даними TE [8] та 8,50 КПа за даними 2D-ЗХЕ [7]. Однак попередні дослідження були зосереджені переважно на стадіях фіброзу та цирозу печінки у пацієнтів з ХВ і рідко приділяли увагу неінвазивному оцінюванню жирового гепатозу, який є найпоширенішою ранньою патологічною зміною при ХВ у дітей та підлітків [9, 10].
Метою дослідження було з’ясувати, чи існує неінвазивне обстеження, яке дозволяє оцінити ступінь жирової інфільтрації в тканинах печінки у хворих на ХВ, особливо у дітей та підлітків, щоб у подальшому кількісно проаналізувати ступінь стеатозу гепатоцитів у цих пацієнтів.
Нещодавно був розроблений новий ультразвуковий метод, в якому вимірювання коефіцієнта поглинання (КП) отримують за допомогою ультразвукових методів для кількісного вимірювання жиру в печінці, і він поступово починає застосовуватись у клінічній практиці [11]. Попередні дослідження продемонстрували, що КП може бути використаний для кількісної оцінки вмісту жиру в печінці у пацієнтів з неалкогольною жировою хворобою печінки (НАЖХП) та хронічними захворюваннями печінки, а також тісно пов’язана з періодом початку та прогресування ураження печінки [12]. У клінічній практиці у дітей та підлітків з ХВ перевагу надають КП завдяки її неінвазивності, високій відтворюваності та високій точності локалізації за допомогою 2D-УЗД.
Таким чином, у цьому ретроспективному дослідженні нашою метою було вивчити діагностичну цінність неінвазивного показника КП в оцінці ураження печінки та кількісному визначенні ступеня стеатозу печінки у дітей та підлітків з ХВ.
Методи
Пацієнти
Це ретроспективне обсерваційне дослідження. Діти та підлітки з діагнозом ХВ були ретроспективно відібрані в Першій афілійованій лікарні Університету китайської медицини провінції Аньхой в період з травня 2022 року по серпень 2022 року. Критеріями включення були: (1) пацієнти з діагнозом ХВ відповідно до Лейпцизьких діагностичних критеріїв, запропонованими Європейською асоціацією з вивчення печінки (ЄАВП) [13]; (2) пацієнти віком ≤ 18 років. Критеріями виключення були: (1) пацієнти з тяжкими неврологічними порушеннями та утрудненим контролем дихання або рухів кінцівки під час проведення УЗД, що призводить до неможливості проведення КП та/або ЗХЕ; (2) пацієнти з відсутніми або частково відсутніми результатами серологічних показників під час діагностики та лікування ХВ.
Відповідно до критеріїв включення та виключення, загалом було відібрано 62 дітей та підлітків із ХВ. Ми розпитували та реєстрували тривалість ХВ від моменту встановлення діагнозу. Паралельно ми реєстрували класифікацію пацієнтів з ХВ відповідно до ураження органів.
Всі процедури, виконані в цьому дослідженні, були схвалені етичним комітетом університету традиційної китайської медицини провінції Аньхой (№ 2018AH-08).
Обчислення лабораторних показників
Були зібрані рівні показників загального аналізу крові, включаючи кількість тромбоцитів (PLT), аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ), тригліцеридів (ТГ) та церулоплазміну (ЦП). Також були розраховані серологічні індекси для неінвазивної оцінки фіброзу печінки, включаючи показник фіброзу 4 (FIB-4) [14] та індекс співвідношення АсАТ до тромбоцитів (APRI) [15]. Значення APRI розраховували за формулою (АсАТ/верхня межа норми) × 100/кількість тромбоцитів (109/л). Верхня межа норми для АсАТ становила 40 Од/л. Значення FIB-4 розраховували за формулою вік (роки) × АсАТ (Од/л)/(тромбоцити [109/л] × [АлАТ (Од/л)]1/2). У той же час, екскреція міді з сечею у пацієнтів із ХВ визначалася і реєструвалася до і після лікування.
Обстеження стандартним ультразвуком
Стандартне ультразвукове дослідження проводили за допомогою ультразвукового апарату Arietta 850 (Hitachi Medical, Токіо, Японія) з використанням масивного випуклого датчика C715 (частота: 1-5 МГц). У день проведення УЗД органів черевної порожнини пацієнт був у стабільному положенні протягом 8 годин для визначення розмірів печінки та внутрішніх ехосигналів. Внутрішній діаметр ворітної вени та швидкість кровотоку ворітної вени вимірювали в стандартному розрізі при спокійному диханні пацієнта.
Вимірювання КП та ЗХЕ
Вимірювання КП і ЗХЕ проводили одразу після звичайного ультразвукового дослідження черевної порожнини тим же апаратом. Вимірювання КП та ЗХЕ проводили досвідчені лікарі-рентгенологи (5-річний досвід проведення УЗД органів черевної порожнини), які виконали щонайменше 50 вимірювань КП та ЗХЕ печінки за останні шість місяців. Пацієнт знаходився в положенні лежачи на спині (або лежачи на лівій стороні, якщо якість зображення була поганою), оператор розміщував датчик перпендикулярно до печінкової капсули в правому міжреберному просторі, уникаючи великих внутрішньопечінкових судин, і вибирав праву частку печінки (перевага надавалася 5 сегменту, а потім 7 або 8) для вимірювань, при цьому рамка вибірки розташовувалася на 1-2 см нижче капсули печінки. Пацієнтові сказали затримати дихання на 3-5 с після спокійного вдиху. Під час вимірювання рука оператора повинна залишатися нерухомою, щоб зображення було стабільним протягом більше ніж 3 с. Після цього активувалася клавіша оновлення, і апарат автоматично вимірював, аналізував і зберігав зображення протягом 2 с, а також автоматично записував єдиний показник КП (дБ/см/МГц) і ЗХЕ (м/с). Вимірювання КП і ЗХЕ повторювалися 5 разів, і для кожного пацієнта визначалось середнє значення.
Контроль якості
При вимірюванні КП та ЗХЕ для контролю якості використовували 2 показники. (1) VsN: як показник контролю якості одиниці вимірювання, VsN ≥ 50% свідчить про достовірний результат; (2) інтерквартильний розмах (ІКР)/медіана: Вимірювання повторюється 5 разів для кожного пацієнта, і співвідношення ІКР до медіани ≤ 30% свідчить про достовірний результат.
Клінічна стратифікація уражень печінки
Венозна кров пацієнтів була зібрана для вимірювання показників, пов’язаних з фіброзом печінки, включаючи колаген IV типу (КIV, нормальний діапазон: ≤ 95 нг/мл), гіалуронову кислоту (ГК, нормальний діапазон: < 120 нг/мл), ламінін (ЛН, нормальний діапазон: < 130 нг/мл) та N-кінцевий пептид III типу преколагену (PIIINP, нормальний діапазон: < 15 нг/мл). Ураження печінки при ХВ було поділено на 3 групи на основі лабораторних даних: Група 1 – без змін в КIV, ГК, ЛН та PIIIN; Група 2 – підвищення 1 або 2 показників за показниками КIV, ГК, ЛН та PIIINP; Група 3 – підвищення 3 або 4 індикаторів в КIV, ГК, ЛН та PIIINP.
Лікування та відповідь на неї
Усі пацієнти із ХВ отримували лікування для виведення міді. Пацієнти отримували натрію димеркаптопропансульфат (ДМПС) внутрішньовенно в дозі 10-20 мг/кг/добу, один раз на добу. Курс лікування становив 6 днів, інтервалом у 2 дні можна проводити багаторазові курси лікування під час госпіталізації. Реакцію на лікування оцінювали за показниками екскреції міді з сечею впродовж 24 годин.
Статистична оцінка
Статистичний аналіз проводили за допомогою SPSS (версія 25.0) та MedCalc (версія 12.7.0). Дані з нормальним розподілом були виражені як середнє ± стандартне відхилення (СВ); відмінності всередині груп порівнювали за допомогою дисперсійного аналізу (ДА), а відмінності між групами – за допомогою незалежного тесту. Дані зі зміщеним розподілом виражалися як медіана (інтерквартильний розмах [ІНК]); відмінності між групами порівнювалися за допомогою критерія Краскела-Уолліса, а відмінності між групами – за допомогою U-теста Манна-Уїтні з поправкою Бонферроні. Категоріальні дані були виражені у вигляді чисел (відсотків), а для порівняння між групами використовувався критерій Хі-квадрат. Для пацієнтів з ХВ були побудовані бокс-діаграми для значень КП по трьом групах. Для оцінки кореляційного зв’язку КП з ЗХЕ та ТГ проводили кореляційний аналіз за Спірменом. Для відображення діагностичної ефективності КП розраховували площу під ROC-кривою (AUROC), порогове значення (визначене за індексом Йодена), чутливість та специфічність. Для оцінки діагностичної ефективності КП у поєднанні з ЗХЕ, APRI та FIB-4 використовували ROC-криву. Відмінності в діагностичній ефективності між лише КП і комбінованими показниками порівнювали за допомогою тесту Делонга. Статистично значущою вважали різницю при P < 0,05.
Результати
Кінцеві характеристики пацієнтів з ХВ
Усього в це дослідження було включено 62 пацієнти, середній вік яких становив 14,0 років (мін.-макс.: 5-18 років), тривалість ХВ з моменту поставлення діагнозу варіювала від 4 місяців до 16 років. Було 54 пацієнтів з ураженням печінки (85,5%, 53/62), 8 пацієнтів з неврологічними ураженнями (11,3%, 7/62) та 3 пацієнта з печінковими та неврологічними ураженнями (3,2%, 2/62). Кінцеві характеристики пацієнтів з ХВ наведені в Таблиці 1. Залежно від категорії ураження печінки пацієнти були розподілені на 3 групи відповідно до показників КIV, ГК, ЛН та PIIINP: група 1 (n = 25), група 2 (n = 19) та група 2 (n = 18).
Таблиця 1 Кінцеві характеристики пацієнтів з ХВ
| Показник | Всі | Група 1 | Група 2 | Група 3 | P* |
|---|---|---|---|---|---|
| Число (N) | 62 | 25 | 19 | 18 | – |
| Вік (Роки) | 14.00 (5.00) | 15.00 (4.50) | 12.00 (6.00) | 12.50 (5.25) | 0.035 |
| Чоловік (N) | 37 | 17 | 12 | 8 | 0.279 |
| ЦП (г/л) | 0.019 (0.022) | 0.018 (0.026) | 0.017 (0.018) | 0.024 (0.024) | 0.915 |
| За 24 години до аналізу сечі на вміст міді (µg/24 h) | 738.63 (513.47) | 758.67 (480.58) | 708.98 (460.43) | 714.88 (715.17) | 0.917 |
| За 24 години після аналізу сечі на вміст міді (µg/24 h) | 807.53 (503.56) | 839.79 (426.14) | 788.26 (1053.55) | 777.24 (599.79) | 0.198 |
| КIV (нг/мл) | 62.98 (31.29) | 49.31 (32.18) | 68.07 (21.01) | 78.10 (68.90) | 0.002 |
| ГК (нг/мл) | 87.63 (63.30) | 63.04 (24.04) | 90.34 (41.77) | 156.04 (91.67) | < 0.001 |
| ЛН (нг/мл) | 132.02 (95.84) | 89.68 (49.80) | 165.26 (59.20) | 213.10 (92.36) | < 0.001 |
| PIIINP (нг/мл) | 34.40 (23.01) | 30.82 (20.16) | 30.01 (17.13) | 45.91 (35.69) | 0.008 |
| PLT (×109) | 243.46 (119.00) | 229.00 (81.00) | 284.00 (111.00) | 218.50 (155.00) | 0.360 |
| АлАТ (Од/л) | 49.90 (35.15) | 49.30 (26.05) | 68.60 (59.60) | 36.40 (28.38) | 0.008 |
| АсАТ (Од/л) | 34.35 (19.17) | 28.00 (20.15) | 37.60 (15.40) | 33.35 (19.85) | 0.036 |
| ТГ (ммоль/л) | 1.32 (1.06) | 1.26 (0.76) | 1.46 (1.35) | 1.51 (1.31) | 0.648 |
| Внутрішній діаметр ворітної вени (мм) | 10.00 (2.10) | 10.00 (3.00) | 9.70 (2.50) | 9.75 (1.50) | 0.383 |
| Швидкість кровотоку у ворітній вені (см/с) | 19.90 (6.10) | 20.70 (5.15) | 20.10 (6.40) | 18.50 (5.40) | 0.383 |
- Кількісні дані були виражені з медіаною (ІКР)
- *Критерії Краскела–Уолліса або критерій xi-квадрат
Порівняння серологічних та ультразвукових показників
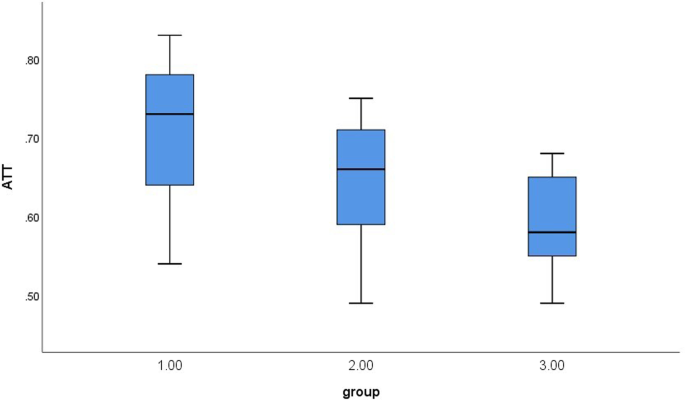
Рівень КП значно відрізнявся між трьома групами (P < 0,001). Порівняно один з одним, рівні FIB-4, APRI та ЗХЕ суттєво не відрізнялися у трьох групах (P > 0,05) (Таблиця 2). Зображення вимірювань КП для кожної групи показано на Зобр. 1, та для кожної групи побудовано діаграми рівню КП (Зобр. 2). Істотні відмінності були виявлені при міжгруповому порівнянні рівнів КП (Таблиця 3).
Таблиця 2 Результати серологічних та ультразвукових показників у пацієнтів з ХВ
| Показник | Всі | Група 1 | Група 2 | Група 3 | P* |
|---|---|---|---|---|---|
| Число (N) | 62 | 25 | 19 | 18 | – |
| APRI | 0.37 (0.32) | 0.33 (0.36) | 0.42 (0.25) | 0.37 (0.48) | 0.608 |
| FIB-4 | 0.28 (0.26) | 0.31 (0.25) | 0.25 (0.14) | 0.28 (0.43) | 0.476 |
| ЗХЕ (м/с) | 1.48 (0.55) | 1.47 (0.45) | 1.50 (0.56) | 1.57 (0.82) | 0.279 |
| КП (дБ/см/МГц) | 0.66 (0.14) | 0.73 (0.15) | 0.66 (0.13) | 0.58 (0.10) | < 0.001 |
- Кількісні дані були виражені з медіаною (ІКР)
- *Критерії Краскела–Уолліса або критерій xi-квадрат
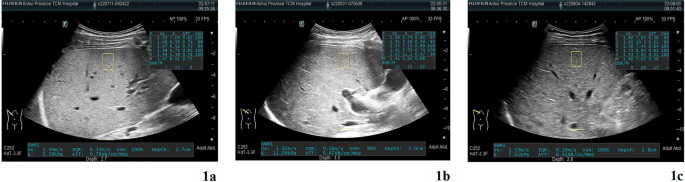
Зобр. 1
УЗД-зображення рівнів КП для 3 груп пацієнтів із ХВ (а Група 1, середнє значення КП становить 0,75; b Група 1, середнє значення КП становить 0,68, c Група 1, середнє значення КП 0,56)
Зобр. 2
Бокс-діаграми рівнів КП для трьох груп хворих з ХВ
Таблиця 3 Міжгрупове порівняння рівнів КП в пацієнтів з ХВ
| КП | Z | P* |
|---|---|---|
| Група 1 порівняно з Групою 2 | − 2.408 | 0.016 |
| Група 1 порівняно з Групою 3 | − 4.069 | 0.000 |
| Група 2 порівняно з Групою 3 | − 2.206 | 0.026 |
- * U-тест Манна-Уїтні з поправкою Бонферроні
Кореляція КП з показниками ЗХЕ та ТГ
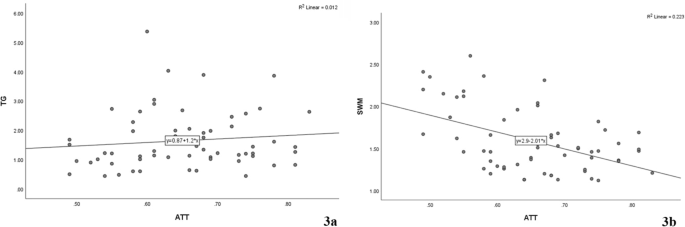
Не було виявлено значної кореляції між рівнями КП і ТГ (ρ = 0,154, P = 0,231, Зобр. 3a) та було виявлено слабку негативну кореляцію між КП і ЗХЕ (ρ = – 0,374, P = 0,003, Зобр. 3b).
Зобр. 3
Кореляційний аналіз КП з ЗХЕ та ТГ (a кореляція КП та ТГ за Спірменом; b кореляція КП та ЗХЕ за Спірменом)
Оцінка діагностичної ефективності КП
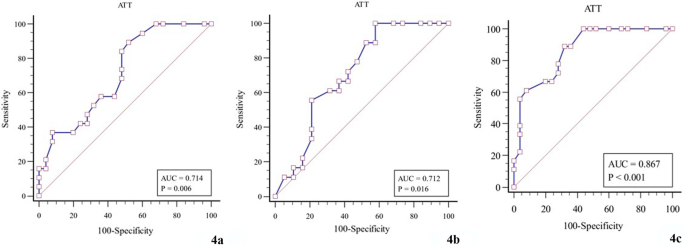
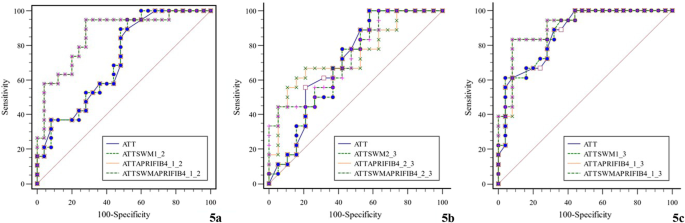
Для оцінки діагностичної ефективності КП у трьох групах хворих на ХВ були побудовані ROC-криві. Розраховано порогове значення AUROC, чутливість та специфічність відповідно (Таблиця. 4, Зобр. 4).
Таблиця 4 Оцінка діагностичної ефективності КП
| Група | AUC | Порогове значення | Чутливість (%) | Специфічність (%) | P |
|---|---|---|---|---|---|
| Група 1 порівняно з Групою 2 | 0.714 | 0.73 | 89.47 | 48.00 | 0.006 |
| Група 2 порівняно з Групою 3 | 0.712 | 0.68 | 100.00 | 42.11 | 0.016 |
| Група 1 порівняно з Групою 3 | 0.867 | 0.66 | 88.89 | 68.00 | < 0.001 |
Зобр. 4
Діагностична ефективність КП (a Група 1 порівняно з Групою 2; b Група 2 порівняно з Групою 3; c Група 1 порівняно з Групою 3)
Оцінка діагностичної ефективності КП у поєднанні з ЗХЕ, APRI та FIB-4
Діагностична ефективність КП у поєднанні з APRI та FIB-4, а також КП у поєднанні з ЗХЕ, APRI та FIB-4 була вищою порівняно з одним лише КП у групі 1 порівняно з групою 2 (обидва показники P = 0,038). Діагностична ефективність КП у поєднанні з іншими індексами статистично не відрізнялася порівняно з одним лише КП (Таблиця 5, Зобр. 5).
Таблиця 5 Оцінка діагностичної ефективності всіх показників окремо
| Група | Показник | AUC | 95%CI | P* |
|---|---|---|---|---|
| Група 1 порівняно з Групою 2 | КП + ЗХЕ | 0.718 | 0.562–0.843 | 0.480 |
| КП + APRI + FIB-4 | 0.863 | 0.726–0.948 | 0.038 | |
| КП + ЗХЕ + APRI + FIB-4 | 0.863 | 0.726–0.948 | 0.038 | |
| Група 2 порівняно з Групою 3 | КП + ЗХЕ | 0.696 | 0.523–0.836 | 0.393 |
| КП + APRI + FIB-4 | 0.743 | 0.573–0.872 | 0.643 | |
| КП + ЗХЕ + APRI + FIB-4 | 0.737 | 0.566–0.867 | 0.724 | |
| Група 1 порівняно з Групою 3 | КП + ЗХЕ | 0.871 | 0.734–0.954 | 0.507 |
| КП + APRI + FIB-4 | 0.909 | 0.781–0.975 | 0.231 | |
| КП + ЗХЕ + APRI + FIB-4 | 0.911 | 0.784–0.976 | 0.215 |
- * Тест Делонга
Зобр. 5
Оцінка діагностичної ефективності КП у поєднанні з іншими показниками (a Група 1 порівняно з Групою 2; b Група 2 порівняно з Групою 3; c Група 1 порівняно з Групою 3)
Обговорення
У цьому дослідженні ми проаналізували цінність методики КП в оцінці ураження печінки у дітей та підлітків з ХВ. Наскільки нам відомо, методика КП вперше була застосована у пацієнтів з ХВ, і результати показали, що КП має кращу діагностичну ефективність порівняно з APRI, FIB-4 та ЗХЕ в оцінці раннього ураження печінки у дітей та підлітків з ХВ, а її діагностична ефективність покращується при поєднанні з іншими індексами.
Рівень ЗХЕ можна було отримати одночасно при вимірюванні КП, і результати показали, що відмінності в рівні ВЗК не були статистично суттєвими в трьох групах пацієнтів з ХВ (P = 0,270). Hwang та співавт. [16] також згрупували ступінь ураження печінки у хворих на ХВ на основі клінічних критеріїв. Однак вони дійшли висновку, що 2D-ЗХЕ може мати більш порівнянну цінність в клініці, ніж APRI і FIB-4. Суперечливі результати можуть бути пов’язані з різним віком пацієнтів з ХВ, включених у дослідження. Пацієнти з ХВ у дослідженні Jisum Hwang були віком від 3 до 35 років, що свідчить про включення певної кількості дорослих пацієнтів у дослідження; тоді як пацієнти в нашому дослідженні були віком від 5 до 18 років, без включення дорослих хворих. Крім того, було відмічено, що вимірювання жорсткості печінки може впливати на результати, якщо включені пацієнти мають помірний або тяжкий жировий гепатоз. Більшість таких змін були у дітей із ХВ, що також може вплинути на низьку ефективність ЗХЕ в даному дослідженні [17]. Оскільки Jisum Hwang зі співавторами не використовували методику КП, порівняння діагностичної цінності між КП і 2D-ЗХЕ у пацієнтів з ХВ у його дослідженні було відсутнім. У нашому дослідженні ROC-крива показала, що AUC для діагностики стеатозу печінки за допомогою КП становила 0,714, 0,712 і 0,867 у групі 1 порівняно з групою 2, у групі 2 порівняно з групою 3 та у групі 1 порівняно з групою 3 відповідно; чутливість для діагностики стеатозу печінки в групі 1 порівняно з групою 2 досягла 89,47% при пороговому значення КП 0,73 дБ/см/МГц. Ці результати узгоджувалися з результатами попереднього дослідження, в якому розраховували середнє значення (95% довірчий інтервал) значень КП для кожного ступеня стеатозу (визначеного гістологічним дослідженням біоптату печінки та оціненого за шкалою активності НАЖХП): S0, < 5%; S1, 5-33%; S2, 33-66%; і S3, > 66%), і повідомили, що значення S2 становило 0,72 (0,56-0,76), а чутливість для діагностики S ≥ 2 становила 77,8% при відсіканні КП 0,72 дБ/см/МГц [18]. Крім того, Nobuharu Tamaki зі співавторами також використовували КП для класифікації ступеня стеатозу печінки у 285 пацієнтів з ГХБ і НАЖХП, підтвердили цінність КП в оцінці стеатозу печінки [19]. Однак, враховуючи рідкісність захворювання та неможливість проведення біопсії печінки, в попередні дослідження пацієнти з ХВ ніколи не залучалися. У цьому дослідженні, враховуючи, що ХВ є спадковим захворюванням з раннім жировим гепатозом у дитячому та підлітковому віці, ми включили пацієнтів з ХВ віком до 18 років. Проаналізували їхні патологічні зміни в печінці та продемонстрували, що КП є кращим неінвазивним інструментом для оцінки ураження печінки. Обмеженням є те, що ХВ все частіше діагностують у дітей віком до 3 років [10], мінімальний вік суб’єктів у цьому дослідженні становив 5 років, і молодші діти не були включені в дослідження. Можливо, саме через це існувала значна різниця у віці між трьома групами в нашому дослідженні. Різний віковий діапазон та різний ступінь ураження печінки визначається багатьма факторами, що в майбутньому може потребувати проведення досліджень з більшою вибіркою обстежених. У клінічній практиці ступінь стеатозу печінки у хворих на ХВ часто оцінюють за допомогою декількох показників. Таким чином, ми поєднали КП з трьома неінвазивними показниками, які зазвичай використовуються для оцінки фіброзу печінки (ЗХЕ, APRI та FIB-4), і довели, що ефективність діагностики на ранніх стадій ураження печінки покращилася порівнюючи з використанням лише КП (S1 у порівнянні з S2), що узгоджується з висновком, запропонованим у попередньому дослідженні [20], де площа під кривою (AUROC) для діагностики фіброзу печінки з використанням ТЕ, 2D-ЗХЕ, APRI та FIB-4 становила 0,955, 0. 842 і 0,897, 0,856, відповідно; проте всі AUROC були підвищені при різних комбінаціях показників (0,961 для ТЕ + APRI, 0,911 для 2D-ЗХЕ + APRI, 0,969 для ТЕ + FIB-4 і 0,931 для 2D-ЗХЕ + FIB-4). Виходячи з наведених вище результатів, КП необхідно поєднувати з ЗХЕ, APRI та FIB-4 для підвищення діагностичної ефективності, особливо в оцінці раннього жирового гепатозу у пацієнтів з ХВ.
У цьому дослідженні не було виявлено кореляції між КП і ТГ, яке свідчить про те, що в клінічній практиці ТГ не може замінити КП при ранньому стеатозі печінки у пацієнтів з ХВ. У методичних рекомендаціях з діагностики та лікування НАЖХП, ХВ визнано вторинною причиною стеатозу печінки [21]. Таким чином, моніторинг змін КП у пацієнтів зі стеатозом печінки при подальшому спостереженні є корисним для розуміння прогресування захворювання [22]. На даний момент лише декілька досліджень присвячено взаємозв’язку між КП і ТГ. У нашому дослідженні рівень ТГ не відрізнявся в різних групах пацієнтів з ХВ. Однак Chalasani N. вказав, що може існувати достовірний зв’язок між рівнем ТГ і ступенем стеатозу печінки в тканинах печінки [23], що не узгоджується з отриманими результатами, і основною причиною може бути наявність пацієнтів з НАЖХП в дослідженні, який провів Chalasani N. Тому необхідно проаналізувати клінічні дослідження з великою вибіркою.
Крім того, ми виявили слабкий негативний кореляційний зв’язок між КП і ЗХЕ, що вказує на те, що рівень ЗХЕ не підвищується, коли КП знаходиться на високому рівні, що узгоджується з тим, що стеатоз печінки у пацієнтів з ХВ виникає раніше, ніж фіброз печінки. Тому це не є основною патологічною зміною на стадіях фіброзу і цирозу печінки, що робить ЗХЕ неінвазійним показником для оцінки фіброзу печінки у пацієнтів з ХВ [24]. Однак залишається нез’ясованим, чи можна використовувати ЗХЕ як чутливий показник для оцінки раннього стеатозу печінки.
У цьому дослідженні були певні обмеження. По-перше, клінічна стратифікація уражень печінки базувалася на рівнях серологічних показників фіброзу печінки, а не на результатах біопсії печінки, через неможливість її проведення у хворих на ХВ з неврологічними порушеннями. По-друге, пацієнти з ХВ, включені в це дослідження, були віком від 5 до 18 років і перебували на стадії швидкого росту та розвитку. Через обмежений розмір вибірки аналіз підгруп за віком у цьому дослідженні не проводився. Однак ми продовжимо досліджувати це питання в майбутньому.
Висновки
Таким чином, метод КП може бути використаний для неінвазивної оцінки раннього стеатозу печінки у дітей та підлітків з ХВ і має високу діагностичну ефективність. Крім того, комбінація КП з APRI, FIB-4 та ЗХЕ може мати потенціал для покращення клінічної ефективності оцінки порівняно з використанням тільки КП.
Доступність даних і матеріалів
Набори даних, що підтверджують висновки цієї статті, можна отримати у відповідного автора за обґрунтованим запитом.
Скорочення та абревіатури
КП:
Коефіцієнт поглинання
ХВ:
Хвороба Вільсона
ЗХЕ:
Зсувнохвильова еластографія
APRI:
Індекс співвідношення АсАТ до тромбоцитів
FIB-4:
Індекс фіброзу 4
КIV:
Колаген IV типу
ГК:
Гіалуронова кислота
ЛН:
Ламінін
PIIINP:
N-кінцевий пептид III типу преколагену
ТГ:
Тригліцерид
ЦП:
Церулоплазмін
ROC:
Робоча характеристика приймача
AUC:
Площа під кривою
2D:
Двовимірний
TE:
Транзиторна еластографія
2D-ЗХЕ:
Двовимірна зсувнохвильова еластографія
НАЖХП:
Неалкогольна жирова хвороба печінки
ЄАВП:
Європейська асоціація з вивчення печінки
PLT:
Кількість тромбоцитів
АлАТ:
Аланінамінотрансфераза
АсАТ:
Аспартатамінотрансфераза
Посилання
- Ferenci P, Czlonkowska A, Stremmel W, Houwen R, Rosenberg W, Schilsky M, Jansen P, Moradpour D, Gitlin J. EASL clinical practice guidelines: Wilson’s disease. J Hepatol Eur Assoc Study Liver. 2012;56(3):671–85.
- Zhong HJ, Sun HH, Xue LF, McGowan EM, Chen Y. Differential hepatic features presenting in Wilson disease-associated cirrhosis and hepatitis B-associated cirrhosis. World J Gastroenterol. 2019;25(3):378–87.
- Ferenci P. Pathophysiology and clinical features of Wilson disease. Metab Brain Disease. 2004;19(3–4):229–39.
- Członkowska A, Litwin T, Chabik G. Wilson disease: neurologic features. Handb Clin Neurol. 2017;142:101–19.
- Akhan O, Akpinar E, Karcaaltincaba M, Haliloglu M, Akata D, Karaosmanoglu AD, Ozmen M. Imaging findings of liver involvement of Wilson’s disease. Eur J Radiol. 2009;69(1):147–55.
- Karlas T, Hempel M, Tröltzsch M, Huster D, Günther P, Tenckhoff H, Mössner J, Berg T, Keim V, Wiegand J. Non-invasive evaluation of hepatic manifestation in Wilson disease with transient elastography, ARFI, and different fibrosis scores. Scand J Gastroenterol. 2012;47(11):1353–61.
- Przybyłkowski A, Szeligowska J, Januszewicz M, Raszeja-Wyszomirska J, Szczepankiewicz B, Nehring P, Górnicka B, Litwin T, Członkowska A. Evaluation of liver fibrosis in patients with Wilson’s disease. Eur J Gastroenterol Hepatol. 2021;33(4):535–40.
- Behairy BES, Sira MM, Zalata KR, Salama ESE, Abd-Allah MA. Transient elastography compared to liver biopsy and morphometry for predicting fibrosis in pediatric chronic liver disease: Does etiology matter? World J Gastroenterol. 2016;22(16):4238–49.
- Roberts EA, Socha P. Wilson disease in children. Handb Clin Neurol. 2017;142:141–56.
- Schilsky ML, Roberts EA, Bronstein JM, Dhawan A, Hamilton JP, Rivard AM, Washington MK, Weiss KH, Zimbrean PC. A multidisciplinary approach to the diagnosis and management of Wilson disease: 2022 practice guidance on Wilson disease from the American Association for the Study of Liver Diseases. Hepatology. 2022 (September); 1–49.
- Ferraioli G, Monteiro LBS. Ultrasound-based techniques for the diagnosis of liver steatosis. World J Gastroenterol. 2019;25(40):6053–62.
- Tamaki N, Kurosaki M, Yasui Y, Tsuchiya K, Izumi N. Attenuation coefficient (ATT) measurement for liver fat quantification in chronic liver disease. J Med Ultrason. 2021;48(4):481–7.
- Ferenci P, Caca K, Loudianos G, Mieli-Vergani G, Tanner S, Sternlieb I, Schilsky M, Cox D, Berr F. Diagnosis and phenotypic classification of Wilson disease. Liver Int. 2003;23(3):139–42.
- Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, Lok ASF. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology. 2003;38(2):518–26.
- Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, Sulkowski MS, Torriani FJ, Dieterich DT, Thomas DL, Messinger D. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology. 2006;43:1317–25.
- Hwang J, Yoon HM, Jung AY, Lee JS, Kim KM, Oh SH, Cho YA. Diagnostic performance of ultrasound elastography and serologic fibrosis indices for evaluation of hepatic involvement in Wilson disease. J Ultrasound Med. 2020;39(11):2231–42.
- Huang Z, Zhou J, Lu X, Zhang T, Xu S, Jin J, Zheng R, Chen S. How does liver steatosis affect diagnostic performance of 2D-SWE.SSI: assessment from aspects of steatosis degree and pathological types. Eur Radiol. 2021;31(5):3207–15.
- Koizumi Y, Hirooka M, Tamaki N, Yada N, Nakashima O, Izumi N, Kudo M, Hiasa Y. New diagnostic technique to evaluate hepatic steatosis using the attenuation coefficient on ultrasound B mode. PLOS ONE. 2019;14(8):1–12.
- Tamaki N, Koizumi Y, Hirooka M, Yada N, Takada H, Nakashima O, Kudo M, Hiasa Y, Izumi N. Novel quantitative assessment system of liver steatosis using a newly developed attenuation measurement method. Hepatol Res. 2018;48(10):821–8.
- Hwang J, Yoon HM, Kim KM, Oh SH, Namgoong JM, Kim DY, Cho YA. Assessment of native liver fibrosis using ultrasound elastography and serological fibrosis indices in children with biliary atresia after the Kasai procedure. Acta Radiol. 2021;62(8):1088–96.
- Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, Charlton M, Sanyal AJ. The diagnosis and management of non-alcoholic fatty liver disease: practice guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Am J Gastroenterol Nat Publ Group. 2012;107(6):811–26.
- Yoon H, Kim J, Lim HJ, Kamiyama N, Oguri T, Koh H, Lee MJ. Attenuation coefficient measurement using a high-frequency (2–9 MHz) convex transducer for children including fatty liver. Ultrasound Med Biol. 2022;48(6):1070–7.
- Chalasani N. Relationship among histologic radiologic and Biochemical Assessments of Hepatic Steatosis. J Clin Gastroenterol. 2007;41(2):206–10.
- Chen K, Wan Y, Mao J, Lai Y, Zhuo-Ma G, Hong P. Liver cirrhosis prediction for patients with Wilson disease based on machine learning: a case-control study from southwest China. Eur J Gastroenterol Hepatol. 2022;34(10):1067–73.