Резюме
Предусловия
Исследовать, можно ли использовать коэффициент поглощения (КП) как неинвазивный показатель для оценки поражения печени у детей и подростков с болезнью Вильсона (БВ).
Методы
Дети и подростки с диагнозом БВ были ретроспективно отобраны в Первой аффилированной больнице Университета традиционной китайской медицины провинции Аньхой в период с мая 2022 года по август 2022 года. Были получены результаты КП, сдвиговолновой эластографии (СВЭ), Индекс соотношения АсАТ к тромбоцитам (APRI), и индекс фиброза 4 (FIB-4). Поражение печени при БВ было разделено на 3 группы на основе сывороточных уровней коллагена IV типа (КIV), гиалуроновой кислоты (ГК), ламинина (ЛН), N-концевого пептида преколагена типа III (PIIINP): (1) Группа 1 (n = 25), нет изменений в КIV, ГК, ЛН и PIIINP; (2) Группа 2 (n = 19), повышение 1 или 2 показателей в КIV, ГК, ЛН, и PIIINP; Группа 3 (n = 18), повышение 3 или 4 индикаторов в КIV, ГК, ЛН, и PIIINP. Уровни КП, СВЭ, APRI и FIB-4 сравнивали между 3 группами; и корреляцию КП с СВЭ и триглицеридами (ТГ) проводили с помощью корреляционного анализа Спирмена. Для анализа диагностической эффективности КП и ее комбинации с СВЭ, APRI и FIB-4 у детей и подростков с БВ использовали кривую рабочей характеристики приемника (ROC-кривая).
Результаты
Всего было ретроспективно отобрано 62 детей и подростков с БВ. При межгрупповых сравнениях уровни КП значительно отличались (P <0,001). ROC-кривая показала, что площадь под кривой (AUC) для диагностики стеатоза печени с помощью КП составляла 0,714, 0,712 и 0,867 в группе 1 по сравнению с группой 2, группой 2 по сравнению с группой 3 и группой 1 по сравнению с группой 3 соответственно; чувствительность для диагностики стеатоза печени в группе 1 по сравнению с группой 2 составила 89,47% при пороговом значении КП 0,73 дБ/см/МГц. Не было выявлено значительной корреляции между КП и ТГ (ρ = 0,154, P = 0,231). По сравнению только КП, комбинация КП с APRI и FIB-4 или комбинацию КП с СВЭ, APRI и FIB-4 показала лучшую диагностическую эффективность в группе 1 по сравнению с группой 2 (оба случая P = 0,038).
Выводы
КП может быть использован как неинвазивный индекс для оценки стеатоза печени у детей и подростков с БВ, что имеет хорошее клиническое применение. Кроме того, КП в сочетании с APRI, FIB-4 и СВЭ может иметь лучшую диагностическую эффективность, чем только КП.
Предусловия
Болезнь Вильсона (БВ), также известная как гепато-лентикулярная дегенерация, является аутосомно-рецессивным генетическим заболеванием, обусловленным мутацией гена ATP7B, что приводит к нарушению выведения меди из печени и накоплению ее в тканях [1]. Печень является основным органом метаболизма меди [2], а патогенез БВ является прямым следствием накопления меди в гепатоцитах, что начинается с жирового гепатоза и сопровождается хроническим воспалением, фиброзом печени и циррозом печени [3]. Биопсия печени признана золотым стандартом для оценки патологических изменений в печени. Однако у большинства пациентов с БВ наблюдается целый спектр неврологических проявлений, таких как тремор, брадикинезия, ригидность, дистония, хорея, дизартрия и дисфагия [4], что затрудняет выполнение инвазивной биопсии печени. Поэтому актуальным является исследование неинвазивных методов для оценки патологических изменений у пациентов с БВ.
Предыдущие исследования показали, что различные ультразвуковые методы, включая двумерное (2D) ультразвуковое исследование [5], транзиторную эластографию (ТЭ) и двумерную сдвиговолновую эластографию ( 2D-СВЭ), могут быть использованы для оценки фиброза печени и процесса цирроза печени у пациентов с БВ [5,6,7]. У пациентов с циррозом печени, связанным с БВ, 2D-УЗИ может выявить шероховатую капсулу печени, а также нарушение внутренней эхогенности печени. Когда заболевание прогрессирует до фиброза печени или даже цирроза печени, ТЭ и 2D-СВЭ часто указывают на дальнейшее увеличение показателей жесткости печени. Как сообщалось, у педиатрических пациентов с БВ оптимальный порог жесткости печени для фиброза печени составляет 8,30 КПа по данным ТЭ [8] и 8,50 КПа по данным 2D-СВЭ [7]. Однако предыдущие исследования были сосредоточены преимущественно на стадиях фиброза и цирроза печени у пациентов с БВ и редко уделяли внимание неинвазивной оценке жирового гепатоза, который является самым распространенным ранним патологическим изменением при БВ у детей и подростков [9, 10].
Целью исследования было выяснить, существует ли неинвазивное обследование, которое позволяет оценить степень жировой инфильтрации в тканях печени у больных БВ, особенно у детей и подростков, чтобы в дальнейшем количественно проанализировать степень стеатоза гепатоцитов у этих пациентов.
Недавно был разработан новый ультразвуковой метод, в котором измерение коэффициента поглощения (КП) получают с помощью ультразвуковых методов для количественного измерения жира в печени, и он постепенно начинает применяться в клинической практике [11]. Предыдущие исследования показали, что КП может быть использован для количественной оценки содержания жира в печени у пациентов с неалкогольной жировой болезнью печени (НАЖБП) и хроническими заболеваниями печени, а также тесно связана с периодом начала и прогрессирования поражения печени [12]. В клинической практике у детей и подростков с БВ предпочтение отдается КП благодаря ее неинвазивности, высокой воспроизводимости и высокой точности локализации с помощью 2D-УЗИ.
Таким образом, в этом ретроспективном исследовании нашей целью было изучить диагностическую ценность неинвазивного показателя КП в оценке поражения печени и количественном определении степени стеатоза печени у детей и подростков с БВ.
Методы
Пациенты
Это ретроспективное обсервационное исследование. Дети и подростки с диагнозом БВ были ретроспективно отобраны в Первой аффилированной больнице Университета китайской медицины провинции Аньхой в период с мая 2022 года по август 2022 года. Критериями включения были: (1) пациенты с диагнозом БВ в соответствии с Лейпцигскими диагностическими критериями, предложенными Европейской ассоциацией по изучению печени (ЕАИП) [13]; (2) пациенты в возрасте ≤ 18 лет. Критериями исключения были: (1) пациенты с тяжелыми неврологическими нарушениями и затрудненным контролем дыхания или движений конечности во время проведения УЗИ, что приводит к невозможности проведения КП и/или СВЭ; (2) пациенты с отсутствующими или частично отсутствующими результатами серологических показателей во время диагностики и лечения БВ.
В соответствии с критериями включения и исключения, всего было отобрано 62 детей и подростков с БВ. Мы расспрашивали и регистрировали продолжительность БВ с момента установления диагноза. Параллельно мы регистрировали классификацию пациентов с БВ в соответствии с поражением органов.
Все процедуры, выполненные в этом исследовании, были одобрены этическим комитетом университета традиционной китайской медицины провинции Аньхой (№ 2018AH-08).
Вычисления лабораторных показателей
Были собраны уровни показателей общего анализа крови, включая количество тромбоцитов (PLT), аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), триглицеридов (ТГ) и церулоплазмина (ЦП). Также были рассчитаны серологические индексы для неинвазивной оценки фиброза печени, включая показатель фиброза 4 (FIB-4) [14] и индекс соотношения АсАТ к тромбоцитам (APRI) [15]. Значение APRI рассчитывали по формуле (АсАТ/верхняя граница нормы) × 100/количество тромбоцитов (109/л). Верхняя граница нормы для АсАТ составляла 40 Ед/л. Значение FIB-4 рассчитывали по формуле возраст (годы) × АсАТ (Ед/л)/(тромбоциты [109/л] × [АлАТ (Ед/л)]1/2). В то же время, экскреция меди с мочой у пациентов с БВ определялась и регистрировалась до и после лечения.
Обследование стандартным ультразвуком
Стандартное ультразвуковое исследование проводили с помощью ультразвукового аппарата Arietta 850 (Hitachi Medical, Токио, Япония) с использованием массивного выпуклого датчика C715 (частота: 1-5 МГц). В день проведения УЗИ органов брюшной полости пациент был в стабильном положении в течение 8 часов для определения размеров печени и внутренних эхосигналов. Внутренний диаметр воротной вены и скорость кровотока воротной вены измеряли в стандартном разрезе при спокойном дыхании пациента.
Измерение КП и СВЭ
Измерение КП и СВЭ проводили сразу после обычного ультразвукового исследования брюшной полости тем же аппаратом. Измерение КП и СВЭ проводили опытные врачи-рентгенологи (5-летний опыт проведения УЗИ органов брюшной полости), которые выполнили не менее 50 измерений КП и СВЭ печени за последние шесть месяцев. Пациент находился в положении лежа на спине (или лежа на левой стороне, если качество изображения было плохим), оператор размещал датчик перпендикулярно к печеночной капсуле в правом межреберном пространстве, избегая крупных внутрипеченочных сосудов, и выбирал правую долю печени (предпочтение отдавалось 5 сегменту, а затем 7 или 8) для измерений, при этом рамка выборки располагалась на 1-2 см ниже капсулы печени. Пациенту сказали задержать дыхание на 3-5 с после спокойного вдоха. Во время измерения рука оператора должна оставаться неподвижной, чтобы изображение было стабильным в течение более чем 3 с. После этого активировалась клавиша обновления, и аппарат автоматически измерял, анализировал и сохранял изображение в течение 2 с, а также автоматически записывал единый показатель КП (дБ/см/МГц) и СВЭ (м/с). Измерения КП и СВЭ повторялись 5 раз, и для каждого пациента определялось среднее значение.
Контроль качества
При измерении КП и СВЭ для контроля качества использовали 2 показателя. (1) VsN: как показатель контроля качества единицы измерения, VsN ≥ 50% свидетельствует о достоверном результате; (2) интерквартильный размах (ИКР)/медиана: Измерение повторяется 5 раз для каждого пациента, и соотношение ИКР к медиане ≤ 30% свидетельствует о достоверном результате.
Клиническая стратификация поражений печени
Венозная кровь пациентов была собрана для измерения показателей, связанных с фиброзом печени, включая коллаген IV типа (КIV, нормальный диапазон: ≤ 95 нг/мл), гиалуроновую кислоту (ГК, нормальный диапазон: < 120 нг/мл), ламинин (ЛН, нормальный диапазон: < 130 нг/мл) и N-концевой пептид III типа преколагена (PIIINP, нормальный диапазон: < 15 нг/мл). Поражение печени при БВ было разделено на 3 группы на основе лабораторных данных: Группа 1 – без изменений в КIV, ГК, ЛН и PIIIN; Группа 2 – повышение 1 или 2 показателей по показателям КIV, ГК, ЛН и PIIINP; Группа 3 – повышение 3 или 4 индикаторов в КIV, ГК, ЛН и PIIINP.
Лечение и ответ на него
Все пациенты с БВ получали лечение для выведения меди. Пациенты получали димеркаптопропансульфат натрия (ДМПС) внутривенно в дозе 10-20 мг/кг/сутки, один раз в сутки. Курс лечения составлял 6 дней, интервалом в 2 дня можно проводить многократные курсы лечения во время госпитализации. Реакцию на лечение оценивали по показателям экскреции меди с мочой в течение 24 часов.
Статистическая оценка
Статистический анализ проводили с помощью SPSS (версия 25.0) и MedCalc (версия 12.7.0). Данные с нормальным распределением были выражены как среднее ± стандартное отклонение (СО); различия внутри групп сравнивали с помощью дисперсионного анализа (ДА), а различия между группами – с помощью независимого теста. Данные со смещенным распределением выражались как медиана (интерквартильный размах [ИКР]); различия между группами сравнивались с помощью критерия Краскела-Уоллиса, а различия между группами – с помощью U-теста Манна-Уитни с поправкой Бонферрони. Категориальные данные были выражены в виде чисел (процентов), а для сравнения между группами использовался критерий Хи-квадрат. Для пациентов с БВ были построены бокс-диаграммы для значений КП по трем группам. Для оценки корреляционной связи КП с СВЭ и ТГ проводили корреляционный анализ по Спирмену. Для отображения диагностической эффективности КП рассчитывали площадь под ROC-кривой (AUROC), пороговое значение (определенное по индексу Йодена), чувствительность и специфичность. Для оценки диагностической эффективности КП в сочетании с СВЭ, APRI и FIB-4 использовали ROC-кривую. Различия в диагностической эффективности между только КП и комбинированными показателями сравнивали с помощью теста Делонга. Статистически значимой считалась разница при P < 0,05.
Результаты
Конечные характеристики пациентов с БВ
Всего в это исследование было включено 62 пациента, средний возраст которых составил 14,0 лет (мин.-макс.: 5-18 лет), продолжительность БВ с момента постановки диагноза варьировала от 4 месяцев до 16 лет. Было 54 пациента с поражением печени (85,5%, 53/62), 8 пациентов с неврологическими поражениями (11,3%, 7/62) и 3 пациента с печеночными и неврологическими поражениями (3,2%, 2/62). Конечные характеристики пациентов с БВ приведены в Таблице 1. В зависимости от категории поражения печени пациенты были разделены на 3 группы в соответствии с показателями КIV, ГК, ЛН и PIIINP: группа 1 (n = 25), группа 2 (n = 19) и группа 2 (n = 18).
Таблица 1 Конечные характеристики пациентов с БВ
| Показатель | Все | Группа 1 | Группа 2 | Группа 3 | P* |
|---|---|---|---|---|---|
| Число (N) | 62 | 25 | 19 | 18 | – |
| Возраст (Годы) | 14.00 (5.00) | 15.00 (4.50) | 12.00 (6.00) | 12.50 (5.25) | 0.035 |
| Мужчина (N) | 37 | 17 | 12 | 8 | 0.279 |
| ЦП (г/л) | 0.019 (0.022) | 0.018 (0.026) | 0.017 (0.018) | 0.024 (0.024) | 0.915 |
| За 24 часа до анализа мочи на содержание меди (µg/24 h) | 738.63 (513.47) | 758.67 (480.58) | 708.98 (460.43) | 714.88 (715.17) | 0.917 |
| Через 24 часа после анализа мочи на содержание меди (µg/24 h) | 807.53 (503.56) | 839.79 (426.14) | 788.26 (1053.55) | 777.24 (599.79) | 0.198 |
| КIV (нг/мл) | 62.98 (31.29) | 49.31 (32.18) | 68.07 (21.01) | 78.10 (68.90) | 0.002 |
| ГК (нг/мл) | 87.63 (63.30) | 63.04 (24.04) | 90.34 (41.77) | 156.04 (91.67) | < 0.001 |
| ЛН (нг/мл) | 132.02 (95.84) | 89.68 (49.80) | 165.26 (59.20) | 213.10 (92.36) | < 0.001 |
| PIIINP (нг/мл) | 34.40 (23.01) | 30.82 (20.16) | 30.01 (17.13) | 45.91 (35.69) | 0.008 |
| PLT (×109) | 243.46 (119.00) | 229.00 (81.00) | 284.00 (111.00) | 218.50 (155.00) | 0.360 |
| АлАТ (Од/л) | 49.90 (35.15) | 49.30 (26.05) | 68.60 (59.60) | 36.40 (28.38) | 0.008 |
| АсАТ (Од/л) | 34.35 (19.17) | 28.00 (20.15) | 37.60 (15.40) | 33.35 (19.85) | 0.036 |
| ТГ (ммоль/л) | 1.32 (1.06) | 1.26 (0.76) | 1.46 (1.35) | 1.51 (1.31) | 0.648 |
| Внутренний диаметр воротной вены (мм) | 10.00 (2.10) | 10.00 (3.00) | 9.70 (2.50) | 9.75 (1.50) | 0.383 |
| Скорость кровотока в воротной вене (см/с) | 19.90 (6.10) | 20.70 (5.15) | 20.10 (6.40) | 18.50 (5.40) | 0.383 |
- Количественные данные были выражены с медианой (ИНК)
- *Критерии Краскела-Уоллиса или критерий xi-квадрат
Сравнение серологических и ультразвуковых показателей
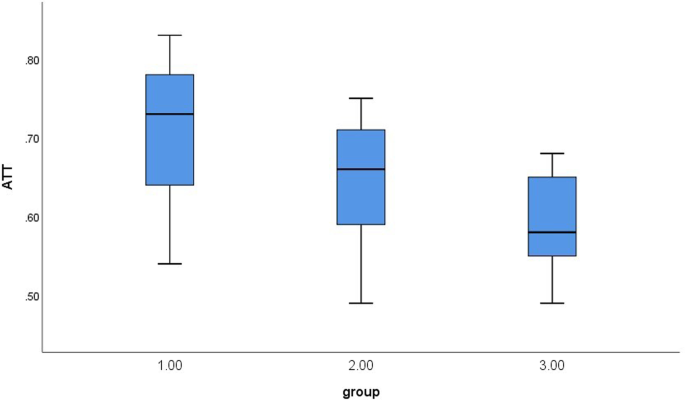
Уровень КП значительно отличался между тремя группами (P < 0,001). По сравнению друг с другом, уровни FIB-4, APRI и СВЭ существенно не отличались в трех группах (P > 0,05) (Таблица 2). Рисунок измерений КП для каждой группы показан на Рис.1, и для каждой группы построены диаграммы уровня КП (Рис. 2). Существенные различия были выявлены при межгрупповом сравнении уровней КП (Таблица 3).
Таблица 2 Результаты серологических и ультразвуковых показателей у пациентов с БВ
| Показатель | Все | Группа 1 | Группа 2 | Группа 3 | P* |
|---|---|---|---|---|---|
| Число (N) | 62 | 25 | 19 | 18 | – |
| APRI | 0.37 (0.32) | 0.33 (0.36) | 0.42 (0.25) | 0.37 (0.48) | 0.608 |
| FIB-4 | 0.28 (0.26) | 0.31 (0.25) | 0.25 (0.14) | 0.28 (0.43) | 0.476 |
| СВЭ (м/с) | 1.48 (0.55) | 1.47 (0.45) | 1.50 (0.56) | 1.57 (0.82) | 0.279 |
| КП (дБ/см/МГц) | 0.66 (0.14) | 0.73 (0.15) | 0.66 (0.13) | 0.58 (0.10) | < 0.001 |
- Количественные данные были выражены с медианой (ИКР)
- *Критерии Краскела-Уоллиса или критерий хи-квадрат
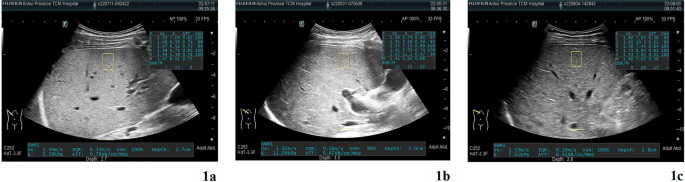
Рис. 1
УЗИ-изображения уровней КП для 3 групп пациентов с БВ (а Группа 1, среднее значение КП составляет 0,75; b Группа 1, среднее значение КП составляет 0,68, c Группа 1, среднее значение КП 0,56)
Рис. 2
Бокс-диаграммы уровней КП для трех групп больных с БВ
Таблица 3 Межгрупповое сравнение уровней КП у пациентов с БВ
| КП | Z | P* |
|---|---|---|
| Группа 1 по сравнению с Группой 2 | − 2.408 | 0.016 |
| Группа 1 по сравнению с Группой 3 | − 4.069 | 0.000 |
| Группа 2 по сравнению с Группой 3 | − 2.206 | 0.026 |
- * U-тест Манна-Уитни с поправкой Бонферрони
Корреляция КП с показателями СВЭ и ТГ
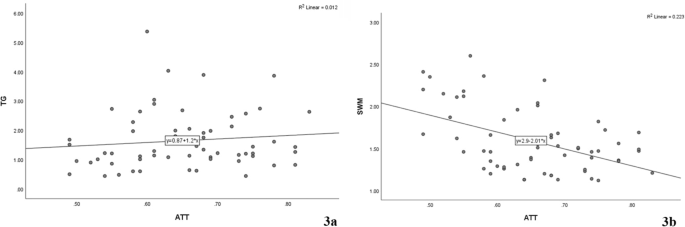
Не было выявлено значительной корреляции между уровнями КП и ТГ (ρ = 0,154, P = 0,231, Рис.3a) и была выявлена слабая отрицательная корреляция между КП и СВЭ (ρ = – 0,374, P = 0,003, Рис. 3b).
Рис. 3
Корреляционный анализ КП с СВЭ и ТГ (a корреляция КП и ТГ по Спирмену; b корреляция КП и СВЭ по Спирмену)
Оценка диагностической эффективности КП
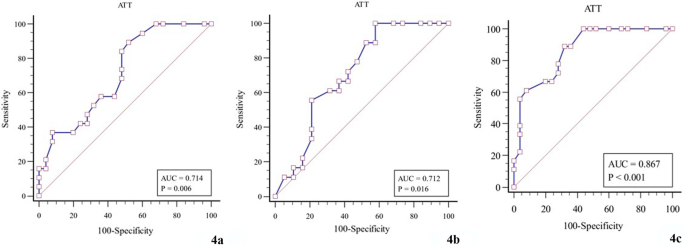
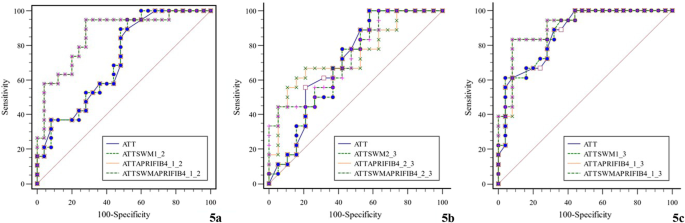
Для оценки диагностической эффективности КП в трех группах больных БВ были построены ROC-кривые. Рассчитано пороговое значение AUROC, чувствительность и специфичность соответственно (Таблица.4, Рис. 4).
Таблица 4 Оценка диагностической эффективности КП
| Группа | AUC | Пороговое значение | Чувствительность (%) | Специфичность (%) | P |
|---|---|---|---|---|---|
| Группа 1 по сравнению с Группой 2 | 0.714 | 0.73 | 89.47 | 48.00 | 0.006 |
| Группа 2 по сравнению с Группой 3 | 0.712 | 0.68 | 100.00 | 42.11 | 0.016 |
| Группа 1 по сравнению с Группой 3 | 0.867 | 0.66 | 88.89 | 68.00 | < 0.001 |
Рис. 4
Диагностическая эффективность КП (a Группа 1 по сравнению с Группой 2; b Группа 2 по сравнению с Группой 3; c Группа 1 по сравнению с Группой 3)
Оценка диагностической эффективности КП в сочетании с СВЭ, APRI и FIB-4
Диагностическая эффективность КП в сочетании с APRI и FIB-4, а также КП в сочетании с СВЭ, APRI и FIB-4 была выше по сравнению с одним только КП в группе 1 по сравнению с группой 2 (оба показателя P = 0,038). Диагностическая эффективность КП в сочетании с другими индексами статистически не отличалась по сравнению с одним только КП (Таблица 5, Рис. 5).
Таблица 5 Оценка диагностической эффективности всех показателей по отдельности
| Группа | Показатель | AUC | 95%CI | P* |
|---|---|---|---|---|
| Группа 1 по сравнению с Группой 2 | КП + СВЭ | 0.718 | 0.562–0.843 | 0.480 |
| КП + APRI + FIB-4 | 0.863 | 0.726–0.948 | 0.038 | |
| КП + СВЭ + APRI + FIB-4 | 0.863 | 0.726–0.948 | 0.038 | |
| Группа 2 по сравнению с Группой 3 | КП + СВЭ | 0.696 | 0.523–0.836 | 0.393 |
| КП + APRI + FIB-4 | 0.743 | 0.573–0.872 | 0.643 | |
| КП + СВЭ + APRI + FIB-4 | 0.737 | 0.566–0.867 | 0.724 | |
| Группа 1 по сравнению с Группой 3 | КП + СВЭ | 0.871 | 0.734–0.954 | 0.507 |
| КП + APRI + FIB-4 | 0.909 | 0.781–0.975 | 0.231 | |
| КП + СВЭ + APRI + FIB-4 | 0.911 | 0.784–0.976 | 0.215 |
- * Тест Делонга
Рис. 5
Оценка диагностической эффективности КП в сочетании с другими показателями (a Группа 1 по сравнению с Группой 2; b Группа 2 по сравнению с Группой 3; c Группа 1 по сравнению с Группой 3)
Обсуждение
В этом исследовании мы проанализировали ценность методики КП в оценке поражения печени у детей и подростков с БВ. Насколько нам известно, методика КП впервые была применена у пациентов с БВ, и результаты показали, что КП имеет лучшую диагностическую эффективность по сравнению с APRI, FIB-4 и СВЭ в оценке раннего поражения печени у детей и подростков с БВ, а ее диагностическая эффективность улучшается при сочетании с другими индексами.
Уровень СВЭ можно было получить одновременно при измерении КП, и результаты показали, что различия в уровне СВЭ не были статистически существенными в трех группах пациентов с БВ (P = 0,270). Hwang и соавт. [16] также сгруппировали степень поражения печени у больных БВ на основе клинических критериев. Однако они пришли к выводу, что 2D-СВЭ может иметь более сопоставимую ценность в клинике, чем APRI и FIB-4. Противоречивые результаты могут быть связаны с различным возрастом пациентов с БВ, включенных в исследование. Пациенты с БВ в исследовании Jisum Hwang были в возрасте от 3 до 35 лет, что свидетельствует о включении определенного количества взрослых пациентов в исследование; тогда как пациенты в нашем исследовании были в возрасте от 5 до 18 лет, без включения взрослых больных. Кроме того, было отмечено, что измерение жесткости печени может влиять на результаты, если включенные пациенты имеют умеренный или тяжелый жировой гепатоз. Большинство таких изменений были у детей с БВ, что также может повлиять на низкую эффективность СВЭ в данном исследовании [17]. Поскольку Jisum Hwang с соавторами не использовали методику КП, сравнение диагностической ценности между КП и 2D-СВЭ у пациентов с БВ в его исследовании отсутствовало. В нашем исследовании ROC-кривая показала, что AUC для диагностики стеатоза печени с помощью КП составляла 0,714, 0,712 и 0,867 в группе 1 по сравнению с группой 2, в группе 2 по сравнению с группой 3 и в группе 1 по сравнению с группой 3 соответственно; чувствительность для диагностики стеатоза печени в группе 1 по сравнению с группой 2 достигла 89,47% при пороговом значении КП 0,73 дБ/см/МГц. Эти результаты согласовывались с результатами предыдущего исследования, в котором рассчитывали среднее значение (95% доверительный интервал) значений КП для каждой степени стеатоза (определенного гистологическим исследованием биоптата печени и оцененного по шкале активности НАЖБП): S0, <5%; S1, 5-33%; S2, 33-66%; и S3, > 66%), и сообщили, что значение S2 составило 0,72 (0,56-0,76), а чувствительность для диагностики S ≥ 2 составляла 77,8% при отсечении КП 0,72 дБ/см/МГц [18]. Кроме того, Nobuharu Tamaki с соавторами также использовали КП для классификации степени стеатоза печени у 285 пациентов с ГХБ и НАЖБП, подтвердили ценность КП в оценке стеатоза печени [19]. Однако, учитывая редкость заболевания и невозможность проведения биопсии печени, в предыдущие исследования пациенты с БВ никогда не привлекались. В этом исследовании, учитывая, что БВ является наследственным заболеванием с ранним жировым гепатозом в детском и подростковом возрасте, мы включили пациентов с БВ в возрасте до 18 лет. Проанализировали их патологические изменения в печени и продемонстрировали, что КП является лучшим неинвазивным инструментом для оценки поражения печени. Ограничением является то, что БВ все чаще диагностируют у детей в возрасте до 3 лет [10], минимальный возраст субъектов в этом исследовании составлял 5 лет, и младшие дети не были включены в исследование. Возможно, именно поэтому существовала значительная разница в возрасте между тремя группами в нашем исследовании. Разный возрастной диапазон и разная степень поражения печени определяется многими факторами, что в будущем может потребовать проведения исследований с большей выборкой обследованных. В клинической практике степень стеатоза печени у больных БВ часто оценивают с помощью нескольких показателей. Таким образом, мы объединили КП с тремя неинвазивными показателями, которые обычно используются для оценки фиброза печени (СВЭ, APRI и FIB-4), и доказали, что эффективность диагностики на ранних стадиях поражения печени улучшилась по сравнению с использованием только КП (S1 по сравнению с S2), что согласуется с выводом, предложенным в предыдущем исследовании [20 где площадь под кривой (AUROC) для диагностики фиброза печени с использованием ТЕ, 2D-СВЭ, APRI и FIB-4 составляла 0,955, 0.842 и 0,897, 0,856, соответственно; однако все AUROC были повышены при различных комбинациях показателей (0,961 для ТЭ + APRI, 0,911 для 2D-СВЭ + APRI, 0,969 для ТЕ + FIB-4 и 0,931 для 2D-СВЭ + FIB-4). Исходя из приведенных выше результатов, КП необходимо сочетать с СВЭ, APRI и FIB-4 для повышения диагностической эффективности, особенно в оценке раннего жирового гепатоза у пациентов с БВ.
В этом исследовании не было выявлено корреляции между КП и ТГ, которое свидетельствует о том, что в клинической практике ТГ не может заменить КП при раннем стеатозе печени у пациентов с БВ. В методических рекомендациях по диагностике и лечению НАЖБП, БВ признано вторичной причиной стеатоза печени [21]. Таким образом, мониторинг изменений КП у пациентов со стеатозом печени при дальнейшем наблюдении является полезным для понимания прогрессирования заболевания [22]. На данный момент лишь несколько исследований посвящено взаимосвязи между КП и ТГ. В нашем исследовании уровень ТГ не отличался в разных группах пациентов с БВ. Однако Chalasani N. указал, что может существовать достоверная связь между уровнем ТГ и степенью стеатоза печени в тканях печени [23], что не согласуется с полученными результатами, и основной причиной может быть наличие пациентов с НАЖБП в исследовании, которое провел Chalasani N. Поэтому необходимо проанализировать клинические исследования с большой выборкой.
Кроме того, мы обнаружили слабую отрицательную корреляционную связь между КП и СВЭ, что указывает на то, что уровень СВЭ не повышается, когда КП находится на высоком уровне, что согласуется с тем, что стеатоз печени у пациентов с БВ возникает раньше, чем фиброз печени. Поэтому это не является основным патологическим изменением на стадиях фиброза и цирроза печени, что делает СВЭ неинвазивным показателем для оценки фиброза печени у пациентов с БВ [24]. Однако остается невыясненным, можно ли использовать СВЭ как чувствительный показатель для оценки раннего стеатоза печени.
В этом исследовании были определенные ограничения. Во-первых, клиническая стратификация поражений печени базировалась на уровнях серологических показателей фиброза печени, а не на результатах биопсии печени, из-за невозможности ее проведения у больных БВ с неврологическими нарушениями. Во-вторых, пациенты с БВ, включенные в это исследование, были в возрасте от 5 до 18 лет и находились на стадии быстрого роста и развития. Из-за ограниченного размера выборки анализ подгрупп по возрасту в этом исследовании не проводился. Однако мы продолжим исследовать этот вопрос в будущем.
Заключение
Таким образом, метод КП может быть использован для неинвазивной оценки раннего стеатоза печени у детей и подростков с БВ и имеет высокую диагностическую эффективность. Кроме того, комбинация КП с APRI, FIB-4 и СВЭ может иметь потенциал для улучшения клинической эффективности оценки по сравнению с использованием только КП.
Доступность данных и материалов
Наборы данных, подтверждающие выводы этой статьи, можно получить у соответствующего автора по обоснованному запросу.
Сокращения и аббревиатуры
КП:
Коэффициент поглощения
БВ:
Болезнь Вильсона
СВЭ:
Сдвиговолновая эластография
APRI:
Индекс соотношения АсАТ к тромбоцитам
FIB-4:
Индекс фиброза 4
КIV:
Коллаген IV типа
ГК:
Гиалуроновая кислота
ЛН:
Ламинин
PIIINP:
N-концевой пептид III типа преколагена
ТГ:
Триглицерид
ЦП:
Церулоплазмин
ROC:
Рабочая характеристика приемника
AUC:
Площадь под кривой
2D:
Двумерный
TЭ:
Транзиторная эластография
2D-СВЭ:
Двумерная сдвиговолновая эластография
НАЖБП:
Неалкогольная жировая болезнь печени
ЕАИП:
Европейская ассоциация по изучению печени
PLT:
Количество тромбоцитов
АлАТ:
Аланинаминотрансфераза
АсАТ:
Аспартатаминотрансфераза
Ссылки
- Ferenci P, Czlonkowska A, Stremmel W, Houwen R, Rosenberg W, Schilsky M, Jansen P, Moradpour D, Gitlin J. EASL clinical practice guidelines: Wilson’s disease. J Hepatol Eur Assoc Study Liver. 2012;56(3):671–85.
- Zhong HJ, Sun HH, Xue LF, McGowan EM, Chen Y. Differential hepatic features presenting in Wilson disease-associated cirrhosis and hepatitis B-associated cirrhosis. World J Gastroenterol. 2019;25(3):378–87.
- Ferenci P. Pathophysiology and clinical features of Wilson disease. Metab Brain Disease. 2004;19(3–4):229–39.
- Członkowska A, Litwin T, Chabik G. Wilson disease: neurologic features. Handb Clin Neurol. 2017;142:101–19.
- Akhan O, Akpinar E, Karcaaltincaba M, Haliloglu M, Akata D, Karaosmanoglu AD, Ozmen M. Imaging findings of liver involvement of Wilson’s disease. Eur J Radiol. 2009;69(1):147–55.
- Karlas T, Hempel M, Tröltzsch M, Huster D, Günther P, Tenckhoff H, Mössner J, Berg T, Keim V, Wiegand J. Non-invasive evaluation of hepatic manifestation in Wilson disease with transient elastography, ARFI, and different fibrosis scores. Scand J Gastroenterol. 2012;47(11):1353–61.
- Przybyłkowski A, Szeligowska J, Januszewicz M, Raszeja-Wyszomirska J, Szczepankiewicz B, Nehring P, Górnicka B, Litwin T, Członkowska A. Evaluation of liver fibrosis in patients with Wilson’s disease. Eur J Gastroenterol Hepatol. 2021;33(4):535–40.
- Behairy BES, Sira MM, Zalata KR, Salama ESE, Abd-Allah MA. Transient elastography compared to liver biopsy and morphometry for predicting fibrosis in pediatric chronic liver disease: Does etiology matter? World J Gastroenterol. 2016;22(16):4238–49.
- Roberts EA, Socha P. Wilson disease in children. Handb Clin Neurol. 2017;142:141–56.
- Schilsky ML, Roberts EA, Bronstein JM, Dhawan A, Hamilton JP, Rivard AM, Washington MK, Weiss KH, Zimbrean PC. A multidisciplinary approach to the diagnosis and management of Wilson disease: 2022 practice guidance on Wilson disease from the American Association for the Study of Liver Diseases. Hepatology. 2022 (September); 1–49.
- Ferraioli G, Monteiro LBS. Ultrasound-based techniques for the diagnosis of liver steatosis. World J Gastroenterol. 2019;25(40):6053–62.
- Tamaki N, Kurosaki M, Yasui Y, Tsuchiya K, Izumi N. Attenuation coefficient (ATT) measurement for liver fat quantification in chronic liver disease. J Med Ultrason. 2021;48(4):481–7.
- Ferenci P, Caca K, Loudianos G, Mieli-Vergani G, Tanner S, Sternlieb I, Schilsky M, Cox D, Berr F. Diagnosis and phenotypic classification of Wilson disease. Liver Int. 2003;23(3):139–42.
- Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, Lok ASF. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology. 2003;38(2):518–26.
- Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, Sulkowski MS, Torriani FJ, Dieterich DT, Thomas DL, Messinger D. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology. 2006;43:1317–25.
- Hwang J, Yoon HM, Jung AY, Lee JS, Kim KM, Oh SH, Cho YA. Diagnostic performance of ultrasound elastography and serologic fibrosis indices for evaluation of hepatic involvement in Wilson disease. J Ultrasound Med. 2020;39(11):2231–42.
- Huang Z, Zhou J, Lu X, Zhang T, Xu S, Jin J, Zheng R, Chen S. How does liver steatosis affect diagnostic performance of 2D-SWE.SSI: assessment from aspects of steatosis degree and pathological types. Eur Radiol. 2021;31(5):3207–15.
- Koizumi Y, Hirooka M, Tamaki N, Yada N, Nakashima O, Izumi N, Kudo M, Hiasa Y. New diagnostic technique to evaluate hepatic steatosis using the attenuation coefficient on ultrasound B mode. PLOS ONE. 2019;14(8):1–12.
- Tamaki N, Koizumi Y, Hirooka M, Yada N, Takada H, Nakashima O, Kudo M, Hiasa Y, Izumi N. Novel quantitative assessment system of liver steatosis using a newly developed attenuation measurement method. Hepatol Res. 2018;48(10):821–8.
- Hwang J, Yoon HM, Kim KM, Oh SH, Namgoong JM, Kim DY, Cho YA. Assessment of native liver fibrosis using ultrasound elastography and serological fibrosis indices in children with biliary atresia after the Kasai procedure. Acta Radiol. 2021;62(8):1088–96.
- Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, Charlton M, Sanyal AJ. The diagnosis and management of non-alcoholic fatty liver disease: practice guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Am J Gastroenterol Nat Publ Group. 2012;107(6):811–26.
- Yoon H, Kim J, Lim HJ, Kamiyama N, Oguri T, Koh H, Lee MJ. Attenuation coefficient measurement using a high-frequency (2–9 MHz) convex transducer for children including fatty liver. Ultrasound Med Biol. 2022;48(6):1070–7.
- Chalasani N. Relationship among histologic radiologic and Biochemical Assessments of Hepatic Steatosis. J Clin Gastroenterol. 2007;41(2):206–10.
- Chen K, Wan Y, Mao J, Lai Y, Zhuo-Ma G, Hong P. Liver cirrhosis prediction for patients with Wilson disease based on machine learning: a case-control study from southwest China. Eur J Gastroenterol Hepatol. 2022;34(10):1067–73.