Резюме
Передумови
Частота рецидивів поліпів ендометрія (ПЕ) після гістероскопічної поліпектомії сильно варіює, а фактори, що впливають на рецидив ПЕ, все ще залишаються суперечливими. Крім того, відомі нам певні незалежні фактори ризику майже не змінюються, такі як кількість ПЕ та попередня поліпектомія в анамнезі. Метою цього дослідження було оцінити вплив хронічного ендометриту (ХЕ) на рецидив ПЕ у жінок в пременопаузі, які перенесли гістероскопічну поліпектомію.
Методи
Ретроспективне дослідження було проведено в університетській клініці. Були включені жінки в пременопаузі, які перенесли гістероскопічну поліпектомію, і були виключені жінки з певними факторами ризику рецидиву поліпів, включаючи ендометріоз і попередню поліпектомію в анамнезі. Усього в дослідження було включено 233 жінки, з них 64 (27,5%) – з ХЕ і 169 (72,5%) – без ХЕ. Діагноз ХЕ ставили за допомогою імуногістохімічного виявлення CD138 у зразку ендометрія. Порівняння частоти рецидивів ПЕ проводили у жінок з ХЕ та без ХЕ на кожному етапі спостереження (тобто через 3, 6, 9 та 12 місяців) після гістероскопічної поліпектомії.
Результати
Частота рецидивів ПЕ протягом одного року у пацієнтів з ХЕ та без ХЕ становила 26,6% (95% довірчий інтервал [ДІ] 15,8-37,4%) та 9,5% (95% ДІ 5,0-14,0%) відповідно, а загальна частота рецидивів становила 14,2% (95% ДІ 9,7-18,7%). Відносний ризик (ВР) для рецидиву ПЕ у групі пацієнтів з ХЕ порівняно з групою пацієнтів без ХЕ становило 3,08 (95% ДІ 1,56-6,09) (Р = 0,001). Аналогічно, частота рецидивів ПЕ була значно вищою у жінок з ХЕ, ніж у жінок без ХЕ на кожному етапі спостереження (тобто через 3, 6 і 9 місяців). Факторами ризику рецидиву ПЕ були ХЕ та множинні ПЕ. ВР для рецидиву ПЕ у когорті жінок з ХЕ порівняно з когортою жінок без ХЕ становило 3,06 після поправки кількості ПЕ.
Висновки
ХЕ був шкідливим фактором для рецидиву ПЕ у жінок у пременопаузі після гістероскопічної поліпектомії. Таким чином, були необхідні рутині скринінги на ХЕ під час гістероскопічної поліпектомії. Частий моніторинг був необхідний для множинних ПЕ, оскільки кількість ПЕ також сприяла рецидиву поліпа.
Передумови
Поліпи ендометрія (ПЕ) є поширеним доброякісним гінекологічним захворюванням, яке проявляється надмірною локальною гіперплазією інтерстиціальних та ендометріальних залоз. Поширеність поліпів матки коливається від 7,8 до 34,9% у різних популяціях [1]. Хоча патогенез і точна причина виникнення ПЕ невідомі, хронічне запалення ендометрію може призводити до формування ПЕ [2]. Гіалінове потовщення судин було загальною морфологічною зміною судин при хронічному ендометриті (ХЕ), яка була дуже схожа на товстостінні судини при ПЕ [3]. Підвищена експресія трансформуючого фактора росту-бета 1 (TGF-β1), фактора росту ендотелію судин (VEGF), пухлинного білка P73 (TP73), пухлинного білка P63 (TP63) та транскрипту альфа-варіанту білка BAX (BCL-2 associated X protein) свідчить про домінування проліферативної та антиапоптозної активності при ХЕ. Це ймовірно може сприяти розвитку та рецидивуванню ПЕ [4].
ХЕ – це персистуюче локальне запалення ендометрію, що характеризується наявністю плазматичних клітин, які інфільтрують інтерстицій [5, 6]. ХЕ зазвичай протікає безсимптомно або супроводжується лише легкими симптомами, такими як аномальні маткові кровотечі (АМК), тазовий біль, диспареунія і лейкорея, а також безпліддя і викидні, всі вони дуже схожі на симптоми ПЕ [7]. Імуногістохімія на плазмоцитарний маркер CD138 наразі є надійнішим методом діагностики ХЕ, який перевершує фарбуванням гематоксиліном та еозином (H&E) і гістероскопічну діагностику [8,9,10,11]. Однак, за даними рандомізованого клінічного дослідження, частота спонтанного одужання від ХЕ становила лише 12,7% [12]. Оптимальним методом лікування ХЕ на сьогодні є пероральний прийом антибіотиків [13, 14].
ПЕ асоціюються з АМК, безпліддям та рецидивуючими репродуктивними порушеннями [1, 2, 15]. Гістероскопічна поліпектомія вважається золотим стандартом лікування ПЕ [15, 16]. У багатьох дослідженнях повідомляється, що частота рецидивів ПЕ через 12 місяців після гістероскопічної поліпектомії коливається в широкому діапазоні від 5,6 до 31,4% [17,18,19]. Встановлено, що велика кількість ПЕ, ендометріоз і попередня поліпектомія в анамнезі є незалежними факторами ризику рецидиву ПЕ [18, 19]. Крім того, пізня менопауза та ожиріння підвищують частоту виникнення ПЕ [20]. Однак фактори, що впливають на ймовірність рецидивування ПЕ після гістероскопічної поліпектомії, залишаються досить суперечливими. Крім того, відомі нам певні незалежні фактори ризику є майже незмінними, такі як кількість ПЕ і попередня поліпектомія в анамнезі, а отже, необхідно дослідити приховані мінливі фактори. ХЕ був залучений до формування ПЕ. Чи причетний ХЕ також до рецидивування ПЕ після гістероскопічної поліпектомії?
У ретроспективному дослідженні ми вивчали, чи підвищується ризик рецидиву ХЕ у жінок в пременопаузі після гістероскопічної поліпектомії.
Методи
План дослідження
У період з січня 2019 по січень 2020 року в афілійованій лікарні Медичного коледжу Північного Сичуану (Китай) було проведено ретроспективне дослідження жінок, які перенесли гістероскопічну поліпектомію. 35 пацієнток без регулярного спостереження протягом 12 місяців були виключені. Загалом у дослідження було включено 233 жінки в пременопаузі після гістероскопічної поліпектомії, серед них 64 (27,5%) випадки з ХЕ і 169 (72,5%) випадків без ХЕ. Експресію CD138 в ендометрії аналізували за допомогою імуногістохімії для виявлення ХЕ. Порівняння частоти рецидивів ПЕ проводили у жінок з ХЕ та без ХЕ на кожному етапі спостереження (тобто через 3, 6, 9 та 12 місяців).
Пацієнтки були включеними в дослідження, якщо вони мали достатньо зразків ендометрія для імуногістохімічного аналізу CD138 для виявлення ХЕ, це були жінки в пременопаузі (18-50 років) і які не мали тяжких системних захворювань. Критеріями виключення були запальні захворювання органів малого тазу (ЗЗОМТ), що виникли протягом 12 місяців після гістероскопічної поліпектомії, попередня поліпектомія ендометрія в анамнезі, ендометріоз, гіперплазія ендометрія та використання гормональної терапії або антибіотиків. Це дослідження було проведено відповідно до принципів Гельсінської декларації.
Гістероскопічна резекція та біопсія ендометрію
Гістероскопічну поліпектомію проводили у фолікулярній фазі за допомогою системи біполярної плазмакінетичної резекції під внутрішньовенною анестезією з використанням 3-мм жорсткого гістероскопа з внутрішнім кутом нахилу 15° і зовнішньою оболонкою 8,5 мм (Olympus, Токіо, Японія). Всі операції виконував один і той же лікар (DC Qu). Зразки ендометрію отримували візуально за допомогою неелектризованого кільця для розтину плазми з верхнього відділу порожнини матки, тоді як гістероскопічну поліпектомію проводили для видалення локальних поліпів. Зразки поліпів та ендометрію відбирали для рутиного гістологічного аналізу після гістероскопічної поліпектомії не тільки для підтвердження діагнозу ПЕ, але й для того, щоб показати, чи мала місце злоякісна трансформація або ураження ендометрію.
Імуногістохімія
Діагноз ХЕ слід ставити насамперед на основі морфогенетичного поля та наявності плазматичних клітин з лімфоїдними фолікулами або без них. Якщо морфологія була суперечливою, необхідно було провести імуногістохімічне дослідження на маркер плазмоцитів CD138. Консультант з гістопатології проводив імуногістохімічне виявлення CD138 на зрізах зразків ендометрію, як описано раніше [11, 21]. З парафінових блоків вирізали п’ятиміліметрові зрізи. Депарафінізація, виділення антигену, забарвлення антитілами, контрастування гематоксиліном та хромогеном 3,3′-діамінобензидину (ДАБ) були повністю автоматизовані в автостейнері Leica BondMax (Leica BioSystems). Клон моноклональних анти-CD138 антитіл, що використовувався в нашому дослідженні, був MI15 Cell Marque (Fuzhou Maixin Biotechnology Co., Ltd., Фучжоу, Китай). Для діагностики ХЕ підраховували CD138-позитивні клітини в стромі ендометрія під світловим мікроскопом (збільшення 400 ×) (Olympus, Токіо, Японія). Експресія CD138 вважалася позитивною, якщо спостерігалося жовте або коричневе забарвлення специфічної клітинної мембрани/цитоплазми. Хоча в даний час не існує конкретних рекомендацій щодо необхідної кількості плазматичних клітин, необхідних для постановки діагнозу, в цьому дослідженні ХЕ діагностували принаймні за наявності 1 CD138-позитивної клітини на 10 високопотужних полів, як це широко використовується в інших дослідженнях. Для кожного зразка досліджували щонайменше 50 полів високої потужності [11, 21].
Подальша робота
Жінки, які перенесли гістероскопічну поліпектомію в нашому гістероскопічному центрі, перебували під рутинним спостереженням. Для оцінки стану порожнини матки через 3, 6, 9 і 12 місяців після гістероскопічної поліпектомії проводили тривимірну кольорову доплерівську трансвагінальну ультрасонографію. Усі ультразвукові дослідження виконували за допомогою ультразвукової системи Voluson E8 та внутрішньопорожнинного датчика з частотою від 5 до 9 МГц (GE Healthcare, Kretz, Zipf, Австрія).
Статистична оцінка
Для всіх статистичних аналізів ми використовували SPSS версії 22.0 (SPSS, Inc, Чикаго, Іллінойс, США), а значення P < 0,05 вважалося статистично суттєвими. Проаналізувавши розподіл даних і підтвердивши, що вік та індекс маси тіла (ІМТ) популяції не були нормально розподіленими, ми застосували U-тест Манна-Уїтні для аналізу віку та ІМТ, виражених як медіана (міжквартильний розмах). Категоріальні змінні порівнювали за допомогою критерію Хі-квадрат. Критерій Хі-квадрат використовували для порівняння повторюваності ПЕ між кожною групою на кожному етапі. Для оцінки безрецидивного виживання та порівняння частоти рецидивів між двома групами використовували метод Каплана-Мейєра з логранговим критерієм. Для оцінки факторів, пов’язаних з рецидивами ПЕ, використовували одновимірні та багатовимірні регресійні моделі Кокса. Фактори, для яких P < 0,2 в одновимірному аналізі, були включені в подальшу багатовимірну модель.
Результати
Порівняння загальних та клінічних особливостей пацієнтів з ПЕ з ХЕ та без ХЕ
Поширеність ХЕ в популяції становила 27,5% (64/233). Демографічні дані та клінічні особливості двох груп пацієнтів наведені в Таблиці 1. Статистично суттєвих відмінностей у демографічних даних та клінічних характеристиках між двома групами пацієнтів не виявлено (всі P > 0,05).
Таблиця 1 Базові демографічні дані пацієнтів, які брали участь у дослідженні
| Характеристики | ПЕ з ХЕ (n = 64) | ПЕ без ХЕ (n = 169) | Значення P |
|---|---|---|---|
| Вік, рік (медіана (Q3–Q1)) | 33 (9) | 34 (8) | 0.092 |
| ІМТ, кг/м2 (медіана (Q3–Q1)) | 21.7 (3.9) | 22.4 (4.0) | 0.120 |
| Кількість поліпів, n (%) | 0.713 | ||
| Поодинокі | 17 (26.6%) | 49 (29.0%) | |
| Множинні | 47 (73.4%) | 120 (71.0%) | |
| Розмір поліпа (см), n (%) | 0.314 | ||
| ≤ 1 | 12 (18.8%) | 20 (11.8%) | |
| > 1, ≤ 2 | 49 (76.6%) | 136 (80.5%) | |
| > 2 | 3 (4.7%) | 13 (7.7%) |
- ПЕ поліпи ендометрія, ХЕ хронічний ендометрит, ІМТ індекс маси тіла
Порівняння частоти рецидивів ПЕ між пацієнтами з ХЕ та без ХЕ
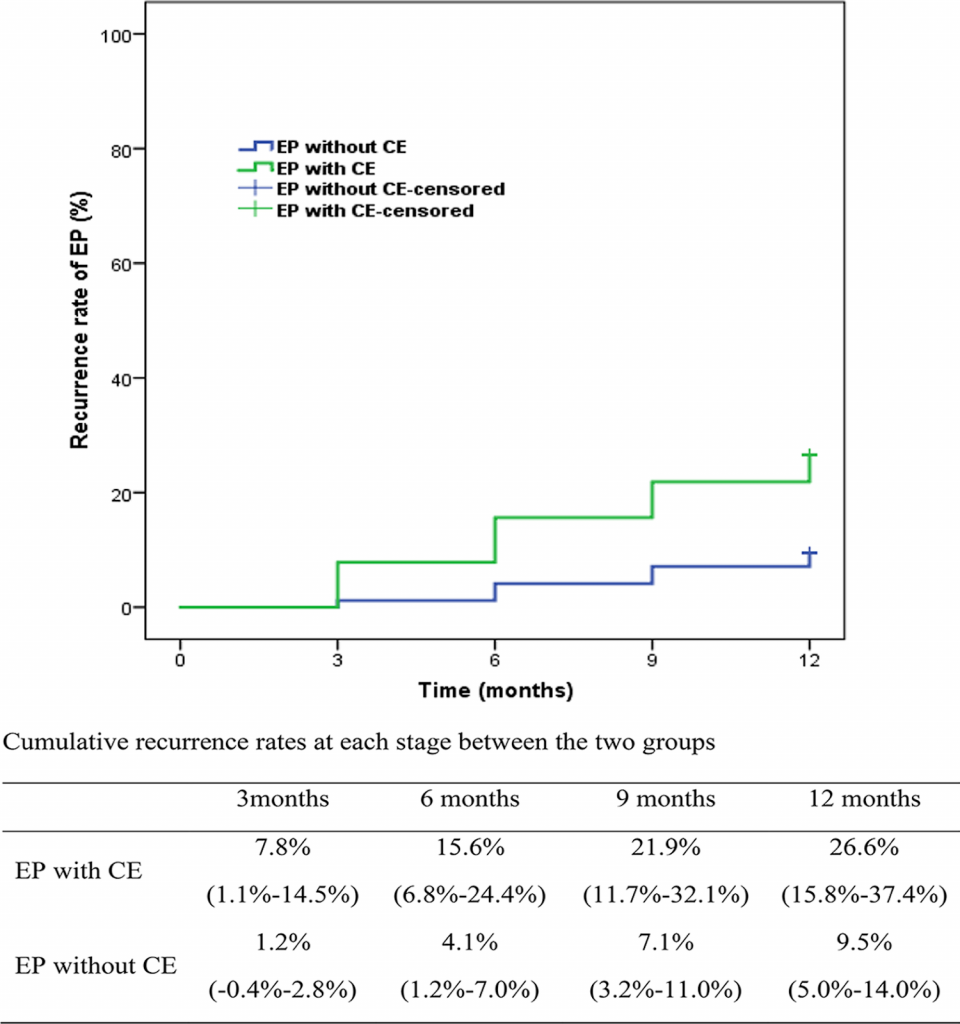
Протягом 1 року спостереження у 33 жінок спостерігався рецидив ПЕ, у тому числі 17 випадків з ХЕ і 16 випадків без ХЕ. Частота рецидивів ПЕ з ХЕ і без ХЕ становила 26,6% (95% довірчий інтервал [ДІ] 15,8-37,4%) і 9,5% (95% ДІ 5,0-14,0%), відповідно, із загальним відсотком виліковування 14,2% (95% ДІ 9,7-18,7%) (Зобр. 1). Частота рецидивів ПЕ була вищою у пацієнтів з ХЕ (P = 0,001). ВР для рецидиву ПЕ у когорті ПЕ з ХЕ порівняно з когортою ПЕ без ХЕ становив 3,08 (95% ДІ 1,56-6,09, P < 0,01; Таблиця 2).
Порівняння частоти рецидивів ПЕ між групами пацієнтів з ХЕ та без ХЕ на кожному етапі моніторингу протягом 12-місячного спостереження (всі P < 0,05 через 3, 6, 9 та 12 місяців). Значення є частотою (95% довірчий інтервал). ПЕ – поліпи ендометрія; ХЕ – хронічний ендометрит
Таблиця 2 Фактори ризику рецидиву ПЕ за даними одновимірного та багатовимірного регресійного аналізу Кокса
| Характеристики | ВР (95% ДІ) | Значення P |
|---|---|---|
| Одновимірний аналіз | ||
| Вік | 1.00 (0.95–1.06) | 0.996 |
| ІМТ | 0.93 (0.81–1.05) | 0.245 |
| Розмір поліпа (см) (порівняно з ≤ 1) | ||
| > 1, ≤ 2 | 1.54 (0.16–14.80) | 0.709 |
| > 2 | 2.57 (0.35–18.89) | 0.353 |
| Множинні ПЕ порівняно з поодинокими | 3.02 (1.06–8.60) | 0.038 |
| ХЕ | 3.08 (1.56–6.09) | 0.001 |
| Багатофакторний аналіз | ||
| ХЕ | 3.06 (1.54–6.05) | 0.001 |
| Множинні ПЕ порівняно з поодинокими | 2.99 (1.05–8.91) | 0.040 |
- ПЕ поліпи ендометрія, ХЕ хронічний ендометрит, ІМТ індекс маси тіла
Аналогічно, у групі з ХЕ було 5 випадків рецидиву ПЕ через 3 місяці, 10 випадків через 6 місяців і 14 випадків через 9 місяців. У групі без ХЕ було 2 випадки рецидиву ПЕ через 3 місяці, 7 випадків через 6 місяців і 12 випадків через 9 місяців. Частота рецидивів ПЕ була значно вищою у жінок з ХЕ, ніж у жінок без ХЕ на кожному етапі спостереження, а саме: 7,8% (95% ДІ 1,1-14,5%) порівняно з 1,2% (95% ДІ – 0,4-2,8%, Р = 0,018) через 3 місяці, 15,6% (95% ДІ 6,8-24,4%) порівняно з 4,1% (95% ДІ 1,2-7,0%, Р = 0,003) через 6 місяців, і 21,9% (95% ДІ 11.7-32,1%) порівняно з 7,1% (95% ДІ 3,2-11,0%, Р = 0,001) через 9 місяців (Зобр. 1).
Фактори які пов’язані з рецидивами ПЕ
Для оцінки факторів, пов’язаних з рецидивами ПЕ, використовували одновимірні та багатовимірні регресійні моделі Кокса. Одновимірний аналіз показав, що вік, ІМТ або розмір поліпів не впливають на рецидиви ПЕ, але значно вищі показники рецидивів ПЕ спостерігаються у жінок з множинними ПЕ та з ХЕ порівняно з показниками у пацієнток без відповідних захворювань (Таблиця 2, P < 0,05 і P < 0,05 відповідно). Багатовимірний аналіз підтвердив, що ХЕ є шкідливим фактором для рецидивування ПЕ (ВР 3,06, 95% ДІ 1,54-6,05, Р = 0,001). Крім того, як згадувалося раніше [18, 19], наявність множинних ПЕ також сприяла рецидиву ПЕ (ВР 2,99, 95% ДІ 1,05-8,91, P = 0,040).
Обговорення
У цьому ретроспективному когортному дослідженні 233 учасниць, які перенесли гістероскопічну поліпектомію для лікування ПЕ, частота рецидивів ПЕ була значно вищою у жінок з ХЕ, ніж у жінок без ХЕ на кожному етапі спостереження, тобто через 3, 6, 9 і 12 місяців. Ці дані вказують на шкідливу роль ХЕ в рецидивах ПЕ у жінок в пременопаузі після гістероскопічної поліпектомії. ВР для рецидиву ПЕ у групі ПЕ з ХЕ порівняно з групою ПЕ без ХЕ становило 3,06 після поправки на кількість ПЕ.
Приховані мінливі фактори рецидивування ПЕ потребують вивчення, оскільки відомі нам незалежні фактори ризику майже не змінюються, такі як кількість ПЕ та попередня поліпектомія в анамнезі [18]. У цьому дослідженні загальна частота рецидивів ПЕ у жінок в пременопаузі становила 14,2% через 12 місяців після гістероскопічної поліпектомії, що узгоджується з показниками, отриманими в попередніх дослідженнях [17, 22,23,24]. Хоча після підгрупового аналізу за ХЕ частота рецидивів ПЕ у жінок в пременопаузі зросла до 26,6%, а ХЕ відігравала шкідливу роль у рецидивах ПЕ. Наскільки нам відомо, наше дослідження є першим, в якому повідомляється про вплив ХЕ. Аналогічно, частота рецидивів ПЕ була значно вищою у жінок з ХЕ, ніж у жінок без ХЕ на кожному етапі спостереження, тобто 7,8% порівняно з 1,2% через 3 місяці, 15,6% порівняно з 4,1% через 6 місяців і 21,9% порівняно з 7,1% через 9 місяців. Це може бути одним з можливих пояснень широкого діапазону частоти рецидивів ПЕ (5,6-31,4%) протягом 1 року спостереження, про який повідомлялося раніше [17,18,19]. ХЕ може бути прихованим фактором рецидивування ПЕ. Механізм, що лежить в основі шкідливого впливу ХЕ, наразі невідомий. Одне з можливих пояснень полягає в тому, що судинна вісь ПЕ може насправді походити від еволюції судинних змін, пов’язаних з ендометритом [3]. По-друге, домінування проліферативної та антиапоптозної активності при ХЕ може призводити до формування та рецидивування ПЕ [4]. TGF-β1, VEGF, TP73 і TP63 були надмірно виражені при ХЕ. Нарешті, порівняно з неполіпозним ендометрієм, ендометрій ПЕ та ХЕ мав нижчу щільність NK-клітин [25]. Це ймовірно може призвести до росту in situ та рецидивування ПЕ після гістероскопічної поліпектомії.
ХЕ – це захворювання, що полягає в порушенні гомеостазу між мікроорганізмами ендометрію та імунною системою організму. Найбільш поширеними бактеріальними патогенами, що викликають ХЕ, є Enterobacteriaceae, Enterococcus, Streptococcus, Staphylococcus, Mycoplasma, та Ureaplasma [26]. Аналогічно, в іншому дослідженні було виявлено, що найпоширенішим родом у мікробіоті ендометрію з ХЕ є не-Lactobacillus [27]. Антибіотики ефективні для лікування ХЕ [8, 21, 28, 29, 30], оскільки він викликається бактеріальними патогенами. Хоча ХЕ є незалежним фактором ризику рецидиву поліпів, на відміну від незмінних факторів, ХЕ можна легко змінити за допомогою лікування антибіотиками. Частота виліковування ХЕ за один курс становила 72,6% при прийомі доксицикліну 200 мг на добу протягом 14 днів і 89,8% при прийомі левофлоксацину 500 мг і тинідазолу 1000 мг на добу протягом 14 днів [8, 21].
У цьому дослідженні, щоб краще оцінити вплив ХЕ на рецидив поліпів, пацієнтки з певними зовнішніми несприятливими факторами для рецидиву поліпів, включаючи ендометріоз і попередню поліпектомію в анамнезі, були виключені. Для визначення зв’язку між рецидивом ПЕ та його ймовірними факторами ризику, включаючи вік, ІМТ, розмір поліпа, кількість ПЕ та ХЕ, використовували одновимірний аналіз. Згідно з попередніми дослідженнями [17, 18], синдром полікістозу яєчників, безпліддя, тяжкість і паритет не були включені в аналіз. Множинні ПЕ і ХЕ були пов’язані з ймовірним рецидивом ПЕ (P < 0,05). ВР рецидиву ПЕ у групі з множинними ПЕ порівняно з групою з поодинокими ПЕ становило 3,02, що узгоджується з даними попередніх досліджень, які показали, що при великій кількості ПЕ, ВР становило 3,45 [18]. Після адаптації на ХЕ, ВР кількості ПЕ становило 2,99, що може справді впливати на кількість ПЕ. Таким чином, при множинних поліпах після гістероскопічної поліпектомії потрібен частий моніторинг. Водночас, на рецидив ПЕ не впливав вік, ІМТ або розмір поліпів, що збігається з даними попередніх досліджень [18, 19].
Це дослідження має певні обмеження. Наприклад, оскільки це було ретроспективне дослідження, ми не змогли врахувати достатню кількість факторів, що впливають на рецидиви ПЕ, та інші приховані фактори потребують вивчення. Крім того, в наше дослідження не була включена когорта хворих на ХЕ, які отримували антибіотики, тому ми не знаємо, чи можна усунути вплив ХЕ на рецидиви ПЕ при лікуванні антибіотиками.
Висновки
Отже, це дослідження продемонструвало, що ХЕ є шкідливим фактором рецидивування ПЕ у жінок в пременопаузі після гістероскопічної поліпектомії. Таким чином, під час гістероскопічної поліпектомії необхідно проводити рутинний скринінг на наявність ХЕ. При множинних ПЕ потрібен частий моніторинг, оскільки кількість ПЕ також сприяє рецидивуванню поліпів. Роль ХЕ в рецидивах ПЕ і те, чи може вилікуваний ХЕ забезпечити профілактику для усунення шкідливого ефекту, потребують подальшого підтвердження в проспективних дослідженнях з більшими розмірами вибірки.
Доступність даних і матеріалів
Набори даних, використані та/або проаналізовані в цьому дослідженні, можна отримати у відповідного автора за обґрунтованим запитом.
Скорочення та абревіатури
ПЕ:
Поліпи ендометрія
ХЕ:
Хронічний ендометрит
Посилання на джерела
- Clark TJ, Stevenson H. Endometrial polyps and abnormal uterine bleeding (AUB-P): what is the relationship, how are they diagnosed and how are they treated? Best Pract Res Clin Obstet Gynaecol. 2017;40:89–104.
- Nijkang NP, Anderson L, Markham R, Manconi F. Endometrial polyps: pathogenesis, sequelae and treatment. SAGE Open Med. 2019;7:2050312119848247.
- Carvalho FM, Aguiar FN, Tomioka R, de Oliveira RM, Frantz N, Ueno J. Functional endometrial polyps in infertile asymptomatic patients: a possible evolution of vascular changes secondary to endometritis. Eur J Obstet Gynecol Reprod Biol. 2013;170:152–6.
- Cicinelli E, Vitagliano A, Loizzi V, De Ziegler D, Fanelli M, Bettocchi S, et al. Altered gene expression encoding cytochines, grow factors and cell cycle regulators in the endometrium of women with chronic endometritis. Diagnostics (Basel). 2021;11(3):471.
- Kitaya K, Takeuchi T, Mizuta S, Matsubayashi H, Ishikawa T. Endometritis: new time, new concepts. Fertil Steril. 2018;110:344–50.
- Puente E, Alonso L, Laganà AS, Ghezzi F, Casarin J, Carugno J. Chronic endometritis: old problem, novel insights and future challenges. Int J Fertil Steril. 2020;13:250–6.
- Kasius JC, Fatemi HM, Bourgain C, Sie-Go DM, Eijkemans RJ, Fauser BC, et al. The impact of chronic endometritis on reproductive outcome. Fertil Steril. 2011;96:1451–6.
- Cicinelli E, Haimovich S, De Ziegler D, Raz N, Ben-Tzur D, Andrisani A, et al. MUM-1 immunohistochemistry has high accuracy and reliability in the diagnosis of chronic endometritis: a multi-centre comparative study with CD-138 immunostaining. J Assist Reprod Genet. 2022;39:219–26.
- Chen YQ, Fang RL, Luo YN, Luo CQ. Analysis of the diagnostic value of CD138 for chronic endometritis, the risk factors for the pathogenesis of chronic endometritis and the effect of chronic endometritis on pregnancy: a cohort study. BMC Womens Health. 2016;16:60.
- Li Y, Xu S, Yu S, Huang C, Lin S, Chen W, et al. Diagnosis of chronic endometritis: How many CD138(+) cells/HPF in endometrial stroma affect pregnancy outcome of infertile women? Am J Reprod Immunol. 2021;85:e13369.
- Song D, Li TC, Zhang Y, Feng X, Xia E, Huang X, et al. Correlation between hysteroscopy findings and chronic endometritis. Fertil Steril. 2019;111:772–9.
- Song D, He Y, Wang Y, Liu Z, Xia E, Huang X, et al. Impact of antibiotic therapy on the rate of negative test results for chronic endometritis: a prospective randomized control trial. Fertil Steril. 2021;115:1549–56.
- Cicinelli E, Matteo M, Tinelli R, Lepera A, Alfonso R, Indraccolo U, et al. Prevalence of chronic endometritis in repeated unexplained implantation failure and the IVF success rate after antibiotic therapy. Hum Reprod. 2015;30:323–30.
- Cicinelli E, Matteo M, Trojano G, Mitola PC, Tinelli R, Vitagliano A. Chronic endometritis in patients with unexplained infertility: Prevalence and effects of antibiotic treatment on spontaneous conception. Am J Reprod Immunol. 2018;79(1):e12782.
- Sheng KK, Lyons SD. To treat or not to treat? An evidence-based practice guide for the management of endometrial polyps. Climacteric. 2020;23:336–42.
- American Association of Gynecologic Laparoscopists. AAGL practice report: practice guidelines for the diagnosis and management of endometrial polyps. J Minim Invasive Gynecol. 2012;19:3–10.
- Ciscato A, Zare SY, Fadare O. The significance of recurrence in endometrial polyps: a clinicopathologic analysis. Hum Pathol. 2020;100:38–44.
- Gu F, Zhang H, Ruan S, Li J, Liu X, Xu Y, et al. High number of endometrial polyps is a strong predictor of recurrence: findings of a prospective cohort study in reproductive-age women. Fertil Steril. 2018;109:493–500.
- Yang JH, Chen CD, Chen SU, Yang YS, Chen MJ. Factors Influencing the Recurrence Potential of Benign Endometrial Polyps after Hysteroscopic Polypectomy. PLoS ONE. 2015;10:e0144857.
- Oguz S, Sargin A, Kelekci S, Aytan H, Tapisiz OL, Mollamahmutoglu L. The role of hormone replacement therapy in endometrial polyp formation. Maturitas. 2005;50:231–6.
- Qu D, Yang M, Tong L, Yu X, Jing Q, Yang Y, et al. Combination of dydrogesterone and antibiotic versus antibiotic alone for chronic endometritis: a randomized controlled trial study. Reprod Sci. 2021;28(11):3073–80.
- Wang Y, Yang M, Huang X, Li X, Lin E, Feng Y. Prevention of benign endometrial polyp recurrence using a Levonorgestrel-releasing intrauterine system in premenopausal patients: a retrospective cohort study. J Minim Invasive Gynecol. 2020;27:1281–6.
- Ceci O, Franchini M, Cardinale S, Cannone R, Giarrè G, Fascilla FD, et al. Comparison of endometrial polyp recurrence in fertile women after office hysteroscopic endometrial polypectomy using two widely spread techniques. J Obstet Gynaecol Res. 2020;46:2084–91.
- Li F, Wei S, Yang S, Liu Z, Nan F. Post hysteroscopic progesterone hormone therapy in the treatment of endometrial polyps. Pak J Med Sci. 2018;34:1267–71.
- Kitaya K, Tada Y, Taguchi S, Funabiki M, Hayashi T, Nakamura Y. Local mononuclear cell infiltrates in infertile patients with endometrial macropolyps versus micropolyps. Hum Reprod. 2012;27:3474–80.
- Moreno I, Cicinelli E, Garcia-Grau I, Gonzalez-Monfort M, Bau D, Vilella F, et al. The diagnosis of chronic endometritis in infertile asymptomatic women: a comparative study of histology, microbial cultures, hysteroscopy, and molecular microbiology. Am J Obstet Gynecol. 2018;218:602.e1-.e16.
- Liu Y, Ko EY, Wong KK, Chen X, Cheung WC, Law TS, et al. Endometrial microbiota in infertile women with and without chronic endometritis as diagnosed using a quantitative and reference range-based method. Fertil Steril. 2019;112:707-17.e1.
- Johnston-MacAnanny EB, Hartnett J, Engmann LL, Nulsen JC, Sanders MM, Benadiva CA. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilization. Fertil Steril. 2010;93:437–41.
- McQueen DB, Bernardi LA, Stephenson MD. Chronic endometritis in women with recurrent early pregnancy loss and/or fetal demise. Fertil Steril. 2014;101:1026–30.
- Kitaya K, Matsubayashi H, Takaya Y, Nishiyama R, Yamaguchi K, Takeuchi T, et al. Live birth rate following oral antibiotic treatment for chronic endometritis in infertile women with repeated implantation failure. Am J Reprod Immunol. 2017;78(5):e12719.