Автори: Yi Dong, Wen-Ping Wang, Adrian Lim, Won Jae Lee, Dirk-Andre Clevert, Michael Höpfner, Andrea Tannapfel, Christoph Frank Dietrich
Зміст:
- Вступ
- Матеріали та методи
-
-
- Дотримання етичних стандартів
- Пацієнти
- Техніка ультразвукового дослідження
- Аналіз зображень
- Гістопатологічний діагноз
-
- Отримані результати
-
- BMUS Особливості
- Особливості CEUS
- Остаточний діагноз
- Обговорення
Вступ
Пеліоз печінки (ПП) – рідкісне доброякісне захворювання, що гістологічно характеризується кістозними порожнинами, заповненими кров’ю, різних розмірів та неправильної форми. Ці порожнини поєднуються з синусоїдами печінки та пов’язані з розривом ретикулярного каркасу. З розвитком сучасних технологій медичної візуалізації ПП дедалі частіше зустрічається у клінічній практиці.
ПП часто протікає безсимптомно; однак це може бути пов’язано з рідкісними, але серйозними ускладненнями, які включають печінкову недостатність, портальну гіпертензію та розрив печінки, що призводять до гемоперитонеуму та гемодинамічної нестабільності.
У клінічній практиці точний передопераційний діагноз ПП може вплинути на негайне ведення пацієнтів та допомогти уникнути непотрібного хірургічного втручання або біопсії, тим самим знижуючи захворюваність. Найчастіше ПП виявляється випадково і немає симптомів.
Результати візуалізації ПП часто неспецифічні та варіюються залежно від різних патологічних патернів захворювання та наявності стеатозу печінки.
Характеристики ПП на УЗД черевної порожнини, комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ), ангіографії та позитронно-емісійної томографії/КТ із флюдезоксиглюкозою описувалися лише спорадично у клінічних випадках. Неспецифічні візуальні характеристики ПП мають широкий спектр і часто вводять в оману.
Як правило, важко чітко відрізнити ПП від інших гіперваскулярних уражень лише за допомогою візуалізаційних досліджень, тому потрібна гістопатологічна оцінка. Однак існує підвищений ризик кровотечі при пункційній біопсії судинних уражень, і тому розуміння особливостей візуалізації ПП може бути корисним для встановлення правильного діагнозу, іноді без необхідності відбору проб.
Згідно з діючими керівництвами Європейської федерації товариств ультразвуку в медицині та біології (EFSUMB) та Всесвітній федерації товариств ультразвуку в медицині та біології (WFUMB), ультразвукове дослідження з контрастним посиленням (CEUS) як неінвазивний метод візуалізації дозволяє диференціювати найбільш доброякісні. Лише у кількох звітах про клінічні випадки описані випадкові знахідки та особливості осередкового ПП за шкалою CEUS. Наскільки нам відомо, у цьому дослідженні ми наводимо найбільшу серію на сьогоднішній день. Наша мета полягала в тому, щоб вивчити особливості ультразвукового дослідження та CEUS гістопатологічно підтвердженого осередкового ПП.
Матеріали та методи
Дотримання етичних стандартів
Наглядова рада лікарні Чжуншань схвалила це ретроспективне дослідження (ID: B2020-309R). Інформована згода була скасована до ультразвукового дослідження. Процедура була проведена відповідно до Гельсінської декларації.
Пацієнти
У період із січня 2012 року до травня 2020 року було проведено багатоцентрове ретроспективне дослідження п’яти установ. Було проаналізовано 24 пацієнти з гістопатологічно підтвердженим ПП (11 чоловіків, 13 жінок; середній вік 32,4±7,1 роки; діапазон від 28 до 41 року).
Всі ураження були підтверджені гістологічно за допомогою голкової біопсії калібру 18 або 20 (n = 10) або хірургічним втручанням печінки (n = 14). Усі пацієнти були обстежені за допомогою CEUS за 2-3 дні до біопсії або резекції печінки під ультразвуковим контролем. Критерії виключення не визначено.
Техніка ультразвукового дослідження
Звичайне УЗД у B-режимі (BMUS) та CEUS виконувались у всіх пацієнтів сонологами з більш ніж 10-річним досвідом CEUS печінки. Усі ультразвукові дослідження проводилися з використанням однієї з чотирьох ультразвукових систем преміум-класу:
- Siemens Acuson Sequoia (датчики з опуклою матрицею 5C1, 3,5 МГц, n = 3, Siemens Healthineers, Маунтін-В’ю, Каліфорнія, США)
- Siemens S2000 HELX (датчики з опуклою матрицею 6C1, 3,5 МГц. n = 8, Siemens Medical Solution USA Inc., Mountain View, CA, USA)
- Philips EPIQ 7 (датчики з опуклою решіткою C2-9, 2-9 МГц, n=6, Philips, Bothell, WA, США)
- GE LOGIQ E9 (Датчики з опуклою матрицею C1-5, 1-5 МГц, n = 7, GE Healthcare, Мілуокі, Вісконсін, США)
SonoVue (гексафторид сірки, Bracco, Мілан, Італія) використовувався з дозами від 1,5 до 2,4 мл залежно від розміру пацієнта та місцевої практики. Його вводили внутрішньовенно через канюлю, поміщену у вену антекубітальної ямки, та негайно промивали 5 мл фізіологічного розчину. Нерухомі зображення та відеокліпи, записані протягом 3 хвилин після ін’єкції контрастної речовини, зберігалися для аналізу.
Аналіз зображень
Два незалежні лікарі (з великим досвідом CEUS більше 10 років), які не знали клінічних та патологічних даних, переглянули всі збережені анонімні ультразвукові дослідження. Всі функції CEUS були інтерпретовані відповідно до чинних рекомендацій WFUMB-EFSUMB.
Рецензенти задокументували такі особливості BMUS:
- максимальний діаметр осередкового ураження печінки
- ехогенність (гомогенна або гетерогенна; гіперехогенна, гіпоехогенна або ізоехогенна)
- форма (регулярна чи нерегулярна)
- край (чіткий чи нечіткий)
- наявність сигналу колірного потоку
Огляд зображень CEUS був сфокусований на паттерні контрастного посилення ураження (гіпопосилений, гіперпосилений, ізопосилений, гетерогенний і гомогенний) під час артеріальної (10-45 секунд), ворітної вени (30-120 секунд) та пізньої (> 120 секунд) фази.
Гістопатологічний діагноз
Семеро патологів, які мають досвід роботи з гепатобіліарною системою, переглянули всі патологічні слайди. Остаточний гістопатологічний діагноз був заснований на забарвлених гематоксиліном та еозином зрізах та результатах імуногістохімічного фарбування.
Отримані результати
Показаннями для візуалізаційних досліджень у пацієнтів були регулярне післяопераційне спостереження за 5 пацієнтами, передопераційна стадія раку шлунково-кишкового тракту у 3 пацієнтів, скринінг гепатоцелюлярної карциноми (ГЦК) у 4 пацієнтів з хронічним гепатитом В та регулярні медичні огляди у 12 пацієнтів.
Серологічні пухлинні маркери, включаючи альфа-фетопротеїн, вуглеводний антиген 19-9 та карциноембріональний антиген, були в межах норми. Пеліоз спостерігався у трьох пацієнтів із супутньою гепатоцелюлярною аденомою, у двох пацієнтів із ГЦК та у 19 пацієнтів без синхронного осередкового ураження печінки.
BMUS Особливості
Поодинокі ураження були виявлені у 17 пацієнтів, а численні – у 7 пацієнтів. Більшість уражень (83,3%, 20/24) були неоднорідно гіпоехогенними на BMUS, з чітко окресленими краями, але неправильної форми.
Жодного ефекту новоутворень у цій групі не спостерігалося. Два вогнища мали змішану ехогенність, але були переважно гіпоехогенними. Середній розмір всіх уражень ПП становив 36,8 ± 12,4 мм (діапазон від 10 до 80 мм), а кольорові сигнали доплерівських потоків були виявлені в 41,7% (10/24) уражень. Розрахунки спектральної доплерівської кривої показали, що середній індекс опору всередині осередку ураження становить 0,45±0,13.
Особливості CEUS
CEUS була проведена всім 24 пацієнтам з діагнозом ПП. Під час артеріальної фази ураження демонстрували або помірне гетерогенне гіперпосиленя (83,3%, 20/24), або ізопосиленя (16,7%, 4/24) порівняно з навколишньою паренхімою печінки (зобр. 1, 2).
У трьох випадках спостерігалася прогресивна картина відцентрового посилення. Через 1 хвилину у фазі ворітної вени 21 осередок ураження став злегка гіпопосиленим і змився в пізній фазі. У нашій серії було 3 пацієнти з флебетаксичним ПП, у яких була виявлена область, що сильно збільшується, в центральній частині в артеріальній фазі, яка потім поширилася на периферію в прогресивно відцентровому напрямку під час портальної венозної та пізньої фаз (зобр. 3).
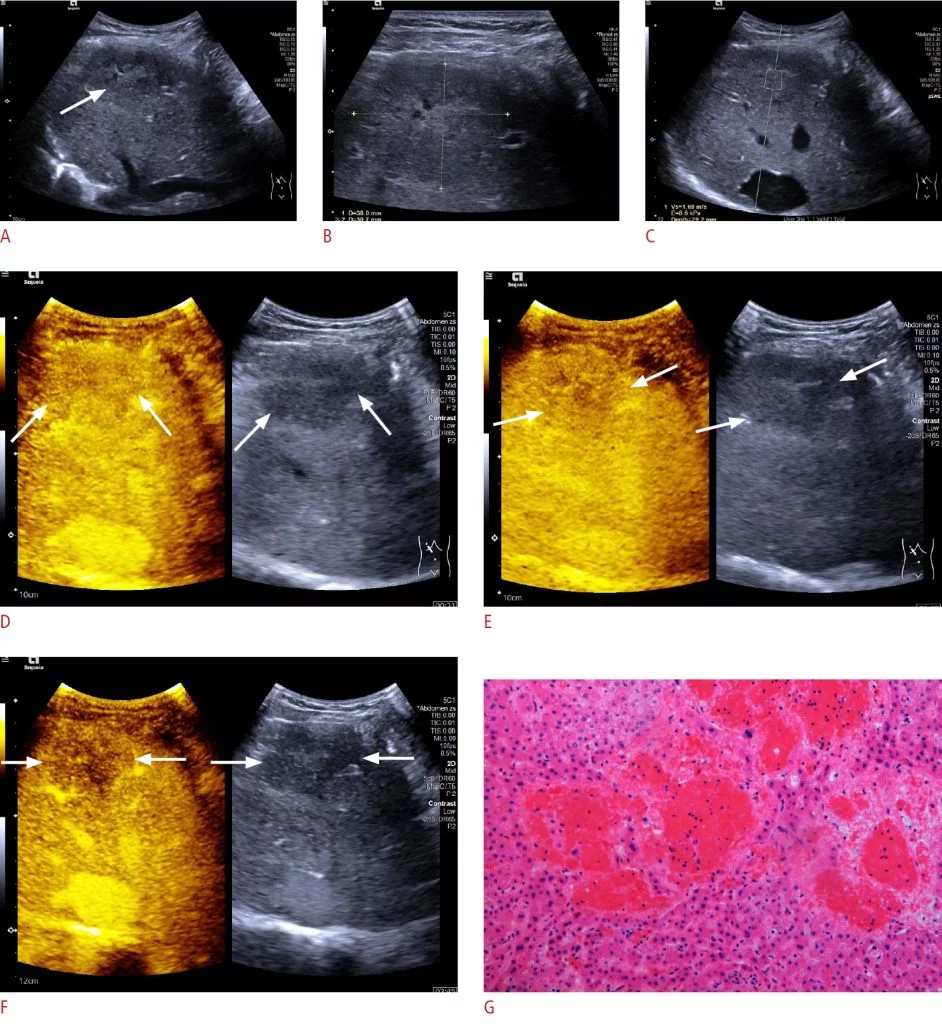
Зображення 1: CEUS ознаки осередкового пеліозу печінки.
Ультрасонографія у B-режимі (BMUS) показує змішане ехогенне та переважно гіпоехогенне ураження (стрілка) у правій частині печінки. B. Утворення мало максимальний діаметр 38 мм BMUS, виміряному за допомогою лінійного датчика. C. Ультразвукова еластографія зсувної хвилі показує, що ураження було відносно м’яким порівняно з навколишньою паренхімою печінки (Vs = 1,69 м/с). Д-F. На ультрасонографії з контрастним посиленням ураження показує гетерогенне ізопосилення (стрілки) в артеріальній фазі (D) та гіпопідсилення (стрілки) у пізній фазі ворітної вени (E), так і в пізній фазі (F). G. Помітна синусоїдальна дилатація з утворенням неправильних просторів та витончення тяжів печінкових клітин спостерігається на зразку після хірургічної резекції (H&E, × 20).
Зображення 2: Мультилокулярний пеліоз печінки.
Ультрасонографія у B-режимі показує злегка гіпоехогенне ураження (стрілка) у правій частині печінки. B. Пунктирні кольорові сигнали потоку можуть бути виявлені всередині ураження. C-E. Після ін’єкції контрастних речовин множинні вогнища ураження можуть бути виявлені як злегка гіперпосилені вогнища ураження під час артеріальної фази (C), гіпопідсилені під час фази ворітної вени (D) та пізньої фази (E) ультразвукового дослідження з контрастним посиленням.
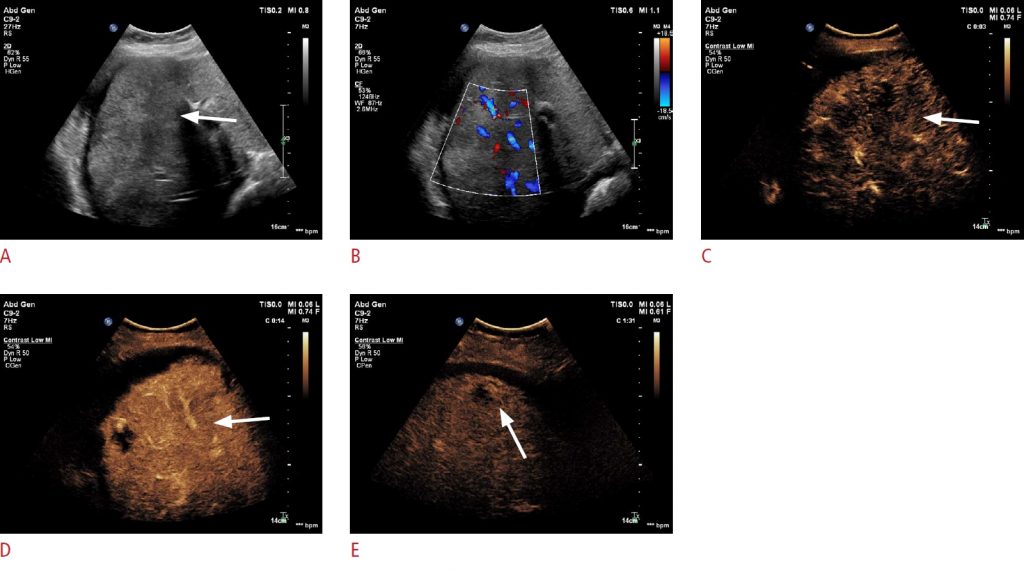
Зображення 3: Чоловік 35 років із пеліозом печінки флебектатичного типу.
A – D. Показані ультразвукові зображення з контрастним посиленням (CEUS), отримані до введення контрастної речовини (A) та під час артеріальної (B), портальної (C) та рівноважної (D) фаз. Зображення CEUS показують область, що сильно збільшується, в центральній частині гіпоехогенного ураження в артеріальній фазі, яка поступово поширюється на периферію в відцентровому напрямку під час портальної фази і фази пізнього наповнення. E-G. Трифазні КТ-зображення, отримані під час артеріальної (E), портальної (F) і наповнювальної (G) фаз, показують те саме гіпоатенуюче ураження з тим же патерном прогресивного відцентрового посилення в сегменті VIII. H, I. Попередньо контрастні T1-зважені (H) і T2-зважені (I) зображення МРТ показують те саме ураження, яке є гіпоінтенсивним на T1-зважених зображеннях і гіперінтенсивним на T2-зважених зображеннях. J-M. Постконтрастні Т1-зважені МРТ-зображення, отримані під час артеріальної (J), портальної (K), наповнювальної (L) і гепатобіліарної (M) фаз, показують те саме гіпоінтенсивне ураження з одним і тим же патерном прогресивного відцентрового посилення.
Остаточний діагноз
Гістопатологічні дослідження зразків з фарбуванням гематоксиліном та еозином виявили типові особливості паренхіматозного ПП у 21 пацієнта, включаючи наявність локалізованої нерегулярної дилатації синусоїдів, що утворюють заповнені кров’ю простори в паренхімі печінки, та стоншення канатиків печінкових клітин та мережі клітин ректикулину. Наявність пухлинних клітин виключено (зобр. 1, 2).
У трьох пацієнтів з флебетактичним ПП спостерігалася наявність ендотеліальної вистилки вздовж заповнених кров’ю просторів, спричинена аневризматичною дилатацією центральної вени.
Обговорення
У цьому дослідженні ми проаналізували особливості візуалізації гістологічно підтвердженого ПП. Патогенез та етіологія ПП залишаються неясними і часто не виявляються у 20-50% пацієнтів. Повідомлялося, що він пов’язаний з хронічними виснажливими станами (наприклад, амілоїдозом, хронічними захворюваннями нирок, інфекціями та імунодефіцитним статусом) та різними ліками (наприклад, стероїдами, оральними контрацептивами та тамоксифеном).
У наших результатах не було значної різниці у розподілі пацієнтів із ПП за статтю.
ПП може бути обмеженим або бути частиною осередкового ураження печінки, але він також може проявлятися як широко поширена, дифузна ознака по всій печінці.
Клінічні прояви ПП можуть змінюватись від безсимптомного до прогресуючого холестазу, печінкової недостатності та потенційно спонтанного розриву, який може бути фатальним. У нашому дослідженні лише п’ять пацієнтів мали в анамнезі хронічне захворювання печінки.
Результати візуалізації осередкового ПП можуть змінюватись в залежності від розміру, патологічної картини та стадії ураження. Він має неспецифічні особливості при звичайному УЗД черевної порожнини і може проявлятися як гомогенне гіпоехогенне ураження у пацієнтів з жировою дистрофією печінки, гіперехогенне ураження у пацієнтів з нормальною печінкою або гетерогенне ураження, якщо воно ускладнене кровотечею.
У цьому дослідженні первинні ураження не виявляли помітного ефекту новоутворень через їх дифузні характеристики, і більшість з них являли собою гіпоехогенні осередкові ураження печінки (80,9%). Вважається, що це відповідає венозним озерам, які зазвичай описуються гістологічно.
Два ураження були зі змішаною ехогенністю, але переважно гіпоехогенними; це може бути пов’язане з кістозними порожнинами, тромбозом або крововиливом у судинних порожнинах цих уражень. За допомогою кольорового доплера можна виявити інтра-осередковий кровообіг з типовими показниками низького опору за допомогою спектрального доплера.
Осередковий ПП слід підозрювати, коли випадково виявлене осередкове ураження печінки не показує специфічних результатів УЗД, які явно підтверджують діагноз поширеного пухлинного ураження печінки.
Найбільш частим патерном посилення CEUS, описаним у наших випадках, було помірне гетерогенне гіперпосилення в артеріальній фазі з вимиванням як найважливішою характеристикою CEUS у пізній фазі ворітної вени та пізній фазі. Ці особливості CEUS вимивання на більш пізніх етапах передбачають наявність непечінкової тканини і, таким чином, потребують подальшого діагностичного обстеження, включаючи біопсію. Слід враховувати, що гіпопідсилення у пізній фазі дуже рідко спостерігається при CEUS-дослідженнях доброякісних осередкових уражень печінки.
Динамічні патерни посилення осередкового ПП CEUS можуть також відрізнятися залежно від основного захворювання та різних стадій компонентів крові.
У нашій серії було 3 пацієнти з флебетактичним ПП. Характеристики динамічної візуалізації CEUS цих уражень показали патогномонічний патерн посилення з прогресуючим відцентровим посиленням від артеріальної до пізньої фази (зобр. 3). Патологічно основною ознакою підтипу флебектатичного ПП від підтипу тромботичним ПП є наявність ендотеліальної вистилки вздовж наповнених кров’ю просторів, оскільки відомо, що вона заснована на аневризматичній дилатації центральної вени. Ця різниця в кровопостачанні допомагає зрозуміти гемодинаміку та «зворотний» патерн відхилення ПП від гемангіоми печінки, що дозволяє чітко розрізняти ці дві сутності.
Відсутність якогось вузлового периферичного гіперпосилення в артеріальній фазі CEUS, що спостерігається в наших випадках, також була б атиповою для гемангіоми.
Результати візуалізації ПП у нашому дослідженні певною мірою аналогічні до описаних при пухлинах печінки різної етіології. Таким чином, ПП завжди слід враховувати при диференціальній діагностиці осередкових уражень печінки.
Розмір уражень ПП становить від кількох міліметрів до понад 4 см, і ПП, мабуть, є безперервним процесом від дифузної інфільтрації до переважаючої осередкової інфільтрації.
Хоча ПП є доброякісним, безсимптомним і є випадковою знахідкою, його слід завжди пам’ятати як диференціальний діагноз атипового гіперваскулярного ураження печінки. Інші диференціальні діагнози включатимуть:
- аденоми печінки
- фокальну вузлову гіперплазію
- хвороба Каролі
- множинні абсцеси
Відповідно до діючих посібників, всі осередкові ураження печінки з вимиванням на CEUS вимагають біопсії або висічення для гістологічного підтвердження, якщо не протипоказані.