Резюме
Передумови
Ендоскопічна резекція (ЕР) є доведеним методом лікування шлунково-кишкових стромальних пухлин (ШКСП). Ми мали на меті оцінити криву навчання (КН), пов’язану з ЕР при ШКСП, та визначити її детермінанти.
Методи
Ми провели аналіз 289 пацієнтів, яким було виконано ЕР ШКСП досвідченим ендоскопістом. Для характеристики КН ми використовували кумулятивний сумарний аналіз тривалості хірургічного втручання. Пацієнтів було розподілено на ранню фазу (випадки 1-50) та пізню фазу (випадки 51-289), які порівнювали. Крім того, ми визначили фактори ризику переходу від ендоскопічної до лапароскопічної резекції (ЛР).
Результати
Тривалість операції та госпіталізації була коротшою, а на пізній фазі було менше ускладнень і днів голодування. Частота переходу на ЛР становила 6,0% та 2,5% на ранній та пізній фазах відповідно. Діаметр пухлини (≥3,0 см) та інвазія за межі власної мускулатури були значущими факторами ризику переходу в ЛР (співвідношення шансів 17,92, 95% довірчий інтервал 2,66-120,87; і 58,03, 6,40-525,84 відповідно).
Висновки
КН при ЕР ШКСП продовжується приблизно у 50 випадках. Крім того, пухлини діаметром ≥3,0 см і ті, що проростають за межі власної мускулатури, частіше потребують переходу на ЛР.
Вступ
Ендоскопічна резекція (ЕР) є широко застосовуваним методом лікування ранніх стадій раку шлунка (РРШ) та підслизових пухлин шлунка (ППШ).1,2 Шлунково-кишкові стромальні пухлини (ШКСП) є найбільш поширеним типом ППШ у верхніх відділах травного тракту.3 ЕР виявилася ефективним і безпечним методом лікування ШКСП, пропонуючи такі переваги, як швидке післяопераційне відновлення, коротший термін перебування в стаціонарі та менші витрати.4,5 Однак, через злоякісний потенціал ШКСП, регулярне спостереження необхідне при ураженнях <2 см, що може накласти психологічний тягар на пацієнтів. Як наслідок, протягом останніх років спостерігається поступове збільшення кількості процедур ЕР, що виконуються для лікування ШКСП.6
Виконання ЕР при ШКСП вимагає високих ендоскопічних навичок, тому недосвідченим ендоскопістам може знадобитися допомога. Ця процедура пов’язана з певними ризиками, в тому числі з тяжкою інтраопераційною кровотечею, перфорацією та необхідністю переходу до лапароскопічної резекції (ЛР). Пацієнти старшого віку, особливо з супутніми захворюваннями, мають вищий ризик ускладнень, включаючи перфорацію, під час ендоскопічних процедур. Крім того, коли у пацієнтів зі стромальними пухлинами шлунково-кишкового тракту спостерігається гостра шлунково-кишкова кровотеча, проблеми, пов’язані з ендоскопічним лікуванням, стають ще більшими, а ризик значної кровотечі під час процедури – вищим.7 Тому розробка настанов для ендоскопістів для досягнення майстерності у виконанні ЕР при ШКСП є необхідною для підвищення безпеки пацієнтів, враховуючи складність процедури та пов’язані з нею потенційні ускладнення.
Дослідження, проведене Sun та співавт.8 , показало, що ендоскопіст повинен виконати приблизно 32 процедури, щоб отримати КН з ЕР шлункових ППШ. Аналогічно, Yoshida та співавт.9 виявили, що ендоскопісти-початківці досягають стабільного стану після виконання приблизно 30 процедур ЕР при ураженнях шлунка. Однак важливо зазначити, що розміри вибірок у цих дослідженнях були відносно невеликими. Крім того, не вивчався КН при ЕР при ШКСП, що виконується одним ендоскопістом у центрі з великим обсягом роботи. Для усунення цих обмежень ми мали на меті вивчити більшу кількість випадків і всебічно оцінити КН для ЕР ШКСП, що дасть змогу отримати більш достовірну та надійну інформацію про цю ЛР і покращити розуміння оптимального способу виконання цієї процедури в медичному закладі.
Матеріали та методи
Пацієнти
Ми провели ретроспективне дослідження пацієнтів, які пройшли передопераційні комп’ютерну томографію (КТ) та ендоскопічну ультрасонографію (ЕУС) для оцінки локалізації, розміру, глибини інвазії та наявності метастазів пухлини. Крім того, було проведено комплексне передопераційне обстеження, включаючи загальний аналіз крові, коагуляційний профіль та електрокардіографію. Критеріями включення в дослідження були: пухлина <5,0 см в діаметрі, без ураження лімфатичних вузлів або віддалених метастазів. Досліджувалися послідовні пацієнти, яким було виконано ЕР шлунково-кишкових стромальних пухлин (ШКСП) одним ендоскопістом у період з серпня 2012 р. по грудень 2022 р. Усі процедури виконував єдиний лікар-ендоскопіст (ЄЛЕ), який до виконання своєї першої процедури ЕР з приводу ШКСП виконав приблизно 500 ендоскопічних підслизових дисекцій товстої кишки і 100 ендоскопічних підслизових дисекцій шлунка. Демографічні, інтраопераційні та післяопераційні дані були зібрані ретроспективно для кожного учасника. Протокол дослідження був схвалений етичним комітетом Першої афілійованої лікарні Університету Сучжоу, і всі учасники надали письмову інформовану згоду на проведення процедури та участь у дослідженні. Звітність цього дослідження відповідає керівним принципам STROBE.10
Методики та обладнання для ендоскопічної резекції
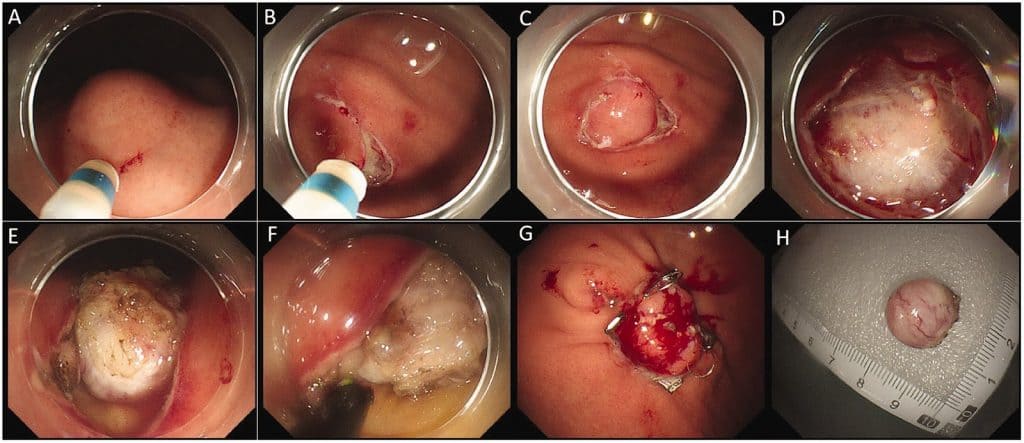
Усім учасникам було введено загальний наркоз і проведено ендотрахеальну інтубацію. Ми використовували дві методики ЕР: ЕПД та ендоскопічну резекцію на всю товщину (ЕРВТ). ЕПД застосовували для лікування ШКСП, які походили зі м’язової пластинки слизової оболонки (МП) або власної м’язової оболонки (МО) і виступали в просвіт, тоді як ШКСП, що походили з глибини МО, мали позапросвітний ріст, а також ті, які не могли бути відокремлені від серозного шару під час ЕПД, лікували за допомогою ЕРВТ. Процедури ЕР виконували, як описано раніше.11,12 Зображення 1 ілюструє процес ЕРВТ для ШКСП. Ми використовували одноканальний ендоскоп (GIF-Q260J, Olympus, Токіо, Японія) з прозорим ковпачком, прикріпленим до кінчика ендоскопа. Інше обладнання включало подвійні ножі (KD-650L; Olympus, Японія), ножі з ізольованими кінчиками (KD-611L; Olympus), високочастотний генератор (ERBE VIO 200D, Erbe Elektromedizin, Тюбінген, Німеччина), інсуфлятор вуглекислого газу, гарячі біопсійні пінцети, ін’єкційні голки, металеві затискачі, затискачі для виходу за межі ендоскопа (OTSC) і нейлонові петлі.
Зображення 1. Ілюстрація етапів ЕРВТ для лікування ШКСП. (а) Пухлина, розташована на дні шлунка; (б) Розріз слизового шару за допомогою подвійного ножа; (в) Периферійний розріз слизового шару; (г) Оголення тіла пухлини; (д) Розріз на всю товщину стінки шлунка; (е) Повне висічення пухлини за допомогою ІН-ножа; (ж) Закриття раневої поверхні за допомогою OTSC-кліпс і (з) Резекція ШКСП.
ЕРВТ – ендоскопічна резекція на всю товщину; ШКСП- шлунково-кишкова стромальна пухлина; ІТ – ізольований наконечник.
Визначення
Тривалість операції визначали як час від початку підслизової ін’єкції до повного закриття дефекту. Походження пухлини визначали за допомогою передопераційної ЕУС, а її розмір і розташування оцінювали за допомогою передопераційної КТ черевної порожнини з підсиленням або ЕУС. Найпоширенішим інтраопераційним ускладненням була тяжка інтраопераційна кровотеча, визначена як повторний ендоскопічний гемостаз з післяопераційним зниженням концентрації циркулюючого гемоглобіну >2 г/дл.13 Післяопераційні ускладнення включали відстрочену кровотечу, відстрочену перфорацію і післяопераційну інфекцію. Діагноз відстроченої кровотечі підтверджували за допомогою екстреної ендоскопії, а діагноз відстроченої перфорації – за допомогою рентгенографії або комп’ютерної томографії. Післяопераційна інфекція визначалася як післяопераційна температура тіла >37,5°C, що супроводжувалася показниками запалення при лабораторних дослідженнях (загальний аналіз крові, висока концентрація С-реактивного білка або висока концентрація кальцитоніну.14 Резекція R0 визначалася на основі гістологічного дослідження бічних і вертикальних країв, яке не виявило залишкових пухлин.15
Післяопераційне ведення
Видалені під час операції тканини фіксували в 10% розчині формаліну і піддавали імуногістохімічному фарбуванню на маркери, включаючи CD117, CD34 і Dog-1, для підтвердження діагнозу. Після операції учасникам, як правило, проводили назогастральну декомпресію для запобігання післяопераційним ускладненням і проінструктували постити протягом 2 днів. Для тих, хто пройшов ЕРВТ, період голодування був продовжений до 3 днів або більше, відповідно до їхнього післяопераційного стану. Після операції проводили рутинні аналізи крові, вимірювання концентрації циркулюючого С-реактивного білка та/або кальцитоніну, а також усім учасникам призначали інгібітор протонної помпи, засоби для захисту слизової оболонки шлунка, нутритивну підтримку та відшкодування рідини. Коли учасник відчував біль у животі або м’язову напругу, йому проводили КТ або ортостатичну рентгенографію, щоб виключити післяопераційну перфорацію. Проводилася антибіотикотерапія або подальше хірургічне втручання залежно від стану учасника. Якщо в учасників виникала інтраопераційна перфорація або післяопераційна інфекція, призначалися антибіотики.
Подальші дії
Для оцінки загоєння ран учасники проходили ендоскопічні обстеження через 1, 3, 6 і 12 місяців після операції, а рецидив або залишкові пухлини виявляли за допомогою ендоскопічної ультрасонографії. Згодом щороку проводили повторні обстеження, під час яких виконували КТ черевної порожнини з контрастним підсиленням та КТ грудної клітки для виявлення лімфатичних вузлів та віддалених метастазів.
Аналіз кривої навчання
Аналіз кумулятивної суми (КУСУМ) раніше використовувався для кількісної оцінки КН для ряду ендоскопічних процедур.16,17 У цьому дослідженні ми оцінили зв’язок між досвідом ендоскопіста і тривалістю операції, а метод КУСУМ був використаний для аналізу КН для ЕР ШКСП. Формула, яка використовується для розрахунку КУСУМ, наведена нижче, де Xi – тривалість операції для кожного учасника, u – середня тривалість операції для всіх учасників, а n – порядковий номер учасника.
КУСУМ=
∑
i=1
n
(Xi−u)
Статистичний аналіз
Категоріальні набори даних виражені у вигляді частот і відсотків і порівнювалися за допомогою критерію хі-квадрат або точного критерію Фішера. Нормально розподілені безперервні масиви даних виражені як середнє ± стандартне відхилення і порівнювалися за допомогою t-критерію Стьюдента. Ненормально розподілені безперервні масиви даних виражені як медіана та інтерквартильний розмах (ІКР) і порівнювалися за допомогою U-критерію Манна-Уітні. Одномірний аналіз проводився для груп конверсії та неконверсії (до ЛР), а змінні з P < 0,1 при одномірному аналізі були включені в багатовимірний регресійний аналіз. p < 0,05 вважався статистично значущим, і всі аналізи були виконані з використанням SPSS версії 26 (IBM Corp., Армонк, Нью-Йорк, США).
Результати
Демографічні дані пацієнтів
За період дослідження 297 пацієнтам з 300 ураженнями шлунка була проведена ЕР. Ми виключили п’ятьох пацієнтів, які мали одночасні ураження в інших місцях, і трьох, які мали множинні ураження в шлунку. Після цього для аналізу залишилися дані 289 учасників з 289 ураженнями. У таблиці 1 наведено демографічні дані учасників, яким було виконано ЕР з приводу ШКСП. Серед них було 149 чоловіків (51,6%) і 140 жінок (48,4%), середній вік становив 59,8 ± 9,4 року. Медіана (ІКР) діаметра пухлини становила 1,5 (1,0, 2,0) см, а діаметр варіював від 0,3 до 5,0 см. Більшість уражень знаходилися в межах МО (87,5%). Демографічні показники учасників двох фаз були подібними (табл. 1).
Таблиця 1. Демографічні дані учасників протягом двох етапів.
| Всього (n = 289) | Рання стадія (n = 50) | Пізня стадія (n = 239) | P-value | |
| Вік, років, середнє ± СВ | 59.8 ± 9.4 | 60.1 ± 9.3 | 59.7 ± 9.5 | 0.780# |
| Стать, n (%) | 0.104& | |||
| Чоловіки | 149 (51.6) | 31 (62.0) | 118 (49.4) | |
| Жінки | 140 (48.4) | 19 (38.0) | 121 (50.6) | |
| Розмір пухлини, см, медіана (ІКР) | 1.5 (1.0, 2.0) | 1.5 (1.1, 3.0) | 1.5 (1.0, 2.0) | 0.132$ |
| ІМТ, кг/м², середнє ± СВ | 22.3 ± 3.2 | 22.3 ± 3.8 | 22.4 ± 3.1 | 0.892# |
| Гіпертонія, n(%) | 0.819& | |||
| Так | 100 (34.6) | 18 (36.0) | 82 (34.3) | |
| Ні | 189 (65.4) | 32 (64.0) | 157 (65.7) | |
| Діабет, n(%) | 0.770& | |||
| Так | 80 (27.7) | 13 (26.0) | 67 (28.0) | |
| Ні | 209 (72.3) | 37 (74.0) | 172 (72.0) | |
| Ішемічна хвороба серця, n(%) | 0.812& | |||
| Так | 60 (20.8) | 11 (22.0) | 49 (20.5) | |
| Ні | 229 (79.2) | 39 (78.0) | 190 (79.5) | |
| Місцезнаходження, n (%) | 0.063& | |||
| Верхня частина | 203 (70.2) | 42 (84.0) | 161 (67.4) | |
| Середина | 61 (21.1) | 6 (12.0) | 55 (23.0) | |
| Нижня частина | 25 (8.7) | 2 (4.0) | 23 (9.6) | |
| Шкала АТА, n (%) | 0.747* | |||
| I | 56 (19.4) | 11 (22.0) | 45 (18.8) | |
| II | 232 (80.3) | 39 (78.0) | 193 (80.8) | |
| III | 1 (0.3) | 0 | 1 (0.4) | |
| Глибина інвазії, n (%) | 0.563& | |||
| У межах МО | 253 (87.5) | 45 (90.0) | 208 (87.0) | |
| Поза межами МО | 36 (12.5) | 5 (10.0) | 31 (13.0) | |
| Модифікований бал за критеріями ризику НІЗ, n (%) | 0.842* | |||
| Дуже низький | 216 (74.7) | 36 (72.0) | 180 (75.3) | |
| Низький | 56 (19.4) | 11 (22.0) | 45 (18.8) | |
| Середній | 16 (5.5) | 3 (6.0) | 13 (5.4) | |
| Високий | 1 (0.3) | 0 | 1 (0.4) | |
| Оцінка ризику за Флетчером, n (%) | 0.842* | |||
| Дуже низька | 216 (74.7) | 36 (72.0) | 180 (75.3) | |
| Низька | 56 (19.4) | 11 (22.0) | 45 (18.8) | |
| Середня | 16 (5.5) | 3 (6.0) | 13 (5.4) | |
| Висока | 1 (0.3) | 0 | 1 (0.4) | |
| Стадія TNM, n (%) | ||||
| Ia | 289 (100) | 50 (100) | 239 (100) | Н/Д |
СВ: стандартне відхилення; ІКР: інтерквартильний розмах; ІМТ: індекс маси тіла; МО: м’язова оболонка; НІЗ: Національна організація охорони здоров’я; АТА : Американське товариство анестезіологів: Н/Д: немає даних. Дані аналізували за допомогою #критерію Стьюдента; $критерію Манна-Уітні; &критерію хі-квадрат або *точного критерію Фішера.
Процедури та результати ЕР ШКСП
Медіана (ІКР) тривалості операції становила 59,0 (47,5, 75,0) хвилин, а конверсія в ЛР знадобилася дев’ятьом пацієнтам (3,1%). Частота інтраопераційних та післяопераційних ускладнень становила 2,4% та 9,0% відповідно. Загалом 273 учасникам (94,5%) було виконано резекцію R0. Медіана (ІКР) тривалості післяопераційного голодування і госпіталізації становила 3,0 (2,0, 3,0) і 5,0 (5,0, 6,0) днів відповідно. Двадцять шість учасників зазнали післяопераційних ускладнень, включаючи два випадки післяопераційної кровотечі, 25 випадків післяопераційної інфекції та один випадок післяопераційної перфорації. Двом учасникам, у яких виникла післяопераційна кровотеча, було успішно проведено екстрене ендоскопічне лікування шляхом гемостазу гарячими щипцями для біопсії. З 25 учасників, які зазнали післяопераційної інфекції, у 14 була лихоманка, але без підвищення концентрації маркерів запалення, і вони не отримували антибіотиків, а у 11 були високі концентрації маркерів запалення і лихоманка, але вони одужали після лікування антибіотиками. Учасник, у якого сталася післяопераційна перфорація, був успішно вилікуваний за допомогою підтримуючої дієтотерапії та назогастральної декомпресії. Протягом періоду спостереження не було виявлено жодних лімфатичних вузлів або віддалених метастазів.
Подальший аналіз
Загалом 242 учасники були успішно проліковані, середня тривалість спостереження становила 45,0 місяців (ІКР від 18,0 до 82,0 місяців). Сімнадцять учасників були віднесені до групи проміжного або високого ризику відповідно до модифікованих критеріїв Національного інституту охорони здоров’я (НІЗ)18 , і всі вони проходили післяопераційне лікування іматинібом. Лише в одного учасника, який після операції мав проміжний ступінь ризику, виник рецидив. Цей пацієнт припинив лікування іматинібом через 6 місяців, але після виявлення рецидиву переніс лапароскопічну операцію. Протягом подальшого періоду спостереження не було виявлено жодного рецидиву.
Аналіз кривої навчання
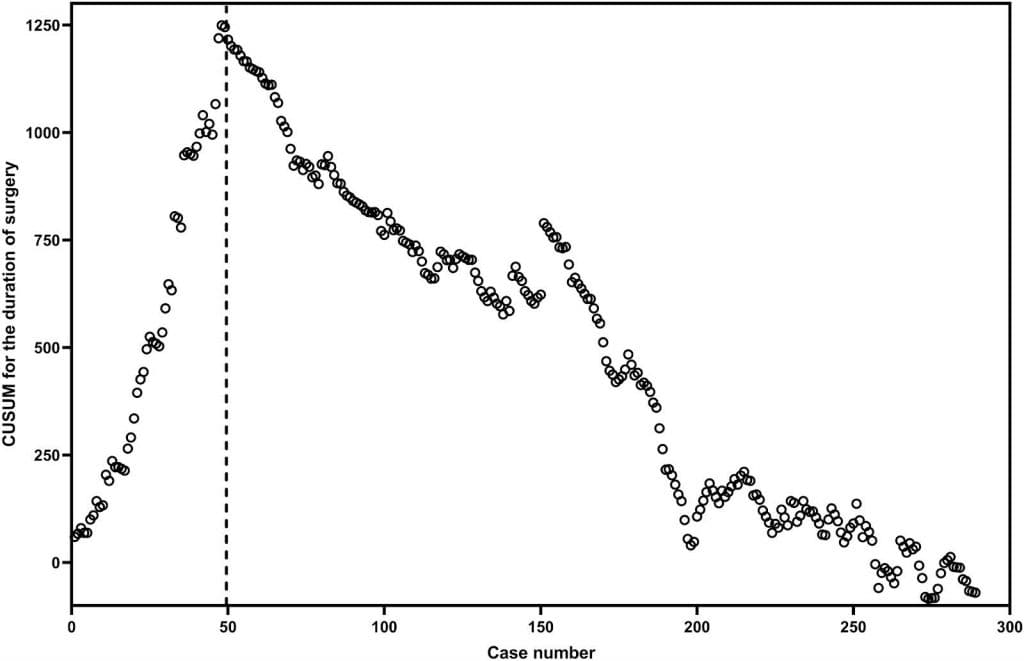
Максимальна тривалість операції за КУСУМ спостерігалася приблизно на 50-му випадку. Після цього КУСУМ зменшувався, за винятком випадків, коли шість учасників потребували переходу на ЛР (зобр. 2). На основі діаграми КУСУМ учасники були розподілені на ранню (випадки з 1 по 50) і пізню (випадки з 51 по 289) фази КН. Тривалість операції, післяопераційної госпіталізації та післяопераційного голодування, а також частота інтраопераційних та післяопераційних ускладнень під час ранньої фази були значно меншими, ніж під час пізньої фази (P < 0,05) (Таблиця 2).
Зображення 2. Кумулятивна сума (КУСУМ) тривалості хірургічного втручання проти номера випадку.
Таблиця 2. Інтраопераційні та післяопераційні дані для двох фаз.
| Всього (n = 289) | Рання стадія (n = 50) | Пізня стадія (n = 239) | P-value | |
| Методика ендоскопії, n (%) | 0.064& | |||
| ЕПД | 150 (51.9) | 20 (40.0) | 130 (54.4) | |
| ЕРВТ | 139 (48.1) | 30 (60.0) | 109 (45.6) | |
| Метод закриття дефекту, n (%) | 0.862& | |||
| Металеві кліпси | 212 (73.3) | 38 (76.0) | 174 (72.8) | |
| Нейлонові петлі | 55 (19.0) | 9 (18.0) | 46 (19.2) | |
| Інші | 22 (7.6) | 3 (6.0) | 19 (7.9) | |
| Тривалість операції, хвилини, медіана (ІКР) | 59.0 (47.5, 75.0) | 79.0 (60.0, 108.5) | 55.0 (45.0, 68.0) | <0.001$ |
| Інтраопераційні ускладнення, n (%) | 7 (2.4) | 4 (8.0) | 3 (1.3) | 0.019* |
| Післяопераційні ускладнення, n (%) | 26 (9.0) | 10 (20.0) | 16 (6.7) | 0.003& |
| Конверсія, n (%) | 9 (3.1) | 3 (6.0) | 6 (2.5) | 0.191* |
| R0 Резекція, n (%) | 273 (94.5) | 45 (90.0) | 228 (95.4) | 0.129& |
| Тривалість післяопераційної госпіталізації, дні, медіана (ІКР) | 5.0 (5.0, 6.0) | 7.0 (5.0, 8.3) | 5.0 (5.0, 6.0) | <0.001$ |
| Тривалість післяопераційного голодування, днів, медіана (ІКР) | 3.0 (2.0, 3.0) | 4.0 (3.0, 5.0) | 3.0 (2.0, 3.0) | <0.001$ |
ЕПД: ендоскопічна підслизова дисекція; ЕРВТ: ендоскопічна резекція на всю товщину; U-критерій Манна-Уітні, &критерій хі-квадрат, *точний критерій Фішера.
Фактори ризику переходу до лапароскопічної резекції
Поширеність конверсії в ЛР на ранній та пізній фазах становила 6,0% та 2,5% відповідно (P > 0,05) (табл. 2). Причинами конверсії в ЛР були: тяжка інтраопераційна кровотеча, яку неможливо було контролювати ендоскопічно (n = 6), неможливість закриття перфорації (n = 2) і випадіння пухлини в черевну порожнину (n = 1). Багатофакторний аналіз показав, що факторами ризику, пов’язаними з конверсією в ЛР, були розмір пухлини (діаметр ≥3,0 см, відношення шансів [ВШ] 17,92, 95% довірчий інтервал [ДІ] 2,65, 120,87, P = 0,003) та інвазія за межі МО (ВШ 58,03, 95% ДІ 6,40, 525,84, P < 0,001) (табл. 3).
Таблиця 3. Фактори ризику конверсії до лапароскопічної резекції.
| Одновимірний аналіз | Багатовимірний аналіз | ||||
| Операція з конверсією (n = 9) |
Неконверсійна (n = 280) | P-value* | ВШ (95% ДІ) | P-value | |
| Вік ≥60 років, n (%) | 5 (55.6) | 143 (51.1) | 1.000 | ||
| Чоловіча стать, n (%) | 5 (55.6) | 144 (51.4) | 1.000 | ||
| ІМТ ≥24,0 (кг/м²), n (%) | 2 (22.2) | 88 (31.4) | 0.725 | ||
| Діаметр пухлини ≥3,0 см, n (%) | 7 (77.8) | 37 (13.2) | <0.001 | 17.92 (2.66–120.87) | 0.003 |
| Верхня третина, n (%) | 8 (88.9) | 196 (70.0) | 0.291 | ||
| Інвазія за межі МО, n (%) | 8 (88.9) | 28 (10.0) | <0.001 | 58.03 (6.40–525.84) | <0.001 |
| Оцінка за модифікованими критеріями ризику НІЗ Середній або високий, n (%) | 2 (22.2) | 15 (5.4) | 0.092 | 1.021 (0.099–10.57) | 0.986 |
| Оцінка за шкалою АТА ≥II, n (%) | 7 (77.8) | 226 (80.7) | 0.687 | ||
| Артеріальна гіпертензія, n (%) | 2 (22.2) | 98 (35.0) | 0.724 | ||
| Діабет, n (%) | 1 (11.1) | 79 (28.2) | 0.452 | ||
| Ішемічна хвороба серця, n (%) | 1 (11.1) | 59 (21.1) | 0.691 | ||
| Ендоскопічна техніка (ЕРВТ), n (%) | 6 (66.7) | 133 (47.5) | 0.321 | ||
ІМТ: індекс маси тіла; МО: м’язова оболонка; НІЗ: Національний інститут здоров’я; АТА : Американське товариство анестезіологів; ЕРВТ: ендоскопічна резекція на всю товщину. Для аналізу даних використовували точний критерій Фішера.
Обговорення
Хоча раніше ЕР при ШКСП виконувалася невеликою кількістю спеціалістів у центрах з великим навантаженням, нещодавно ця методика була впроваджена у багатьох менш завантажених лікарнях. Через складність техніки та ризик інтраопераційних ускладнень може бути важливим розподіл пацієнтів відповідно до особливостей хірургічної процедури та рівня кваліфікації кожного ендоскопіста, щоб забезпечити безпеку процедури. Тому в даному дослідженні ми мали на меті об’єктивно оцінити технічну спроможність ендоскопіста шляхом вивчення КН для ЕР ШКСП.
У нашому попередньому дослідженні ми оцінили КН для ЕР ШКСП у когорті зі 100 пацієнтів і виявили, що лікування приблизно 30 пацієнтів було достатнім для того, щоб ендоскопіст набув навичок, необхідних для мінімізації ризиків ускладнень і конверсії, пов’язаних з процедурою ЕР. Ми підрахували, що для завершення КН з ЕР ШКСП необхідно пролікувати 60 пацієнтів.19 Однак важливо зазначити, що це дослідження включало відносно невелику кількість пацієнтів з діаметром пухлини >3,0 см, які, можливо, відносно легко піддаються хірургічному лікуванню. Крім того, невеликий розмір вибірки міг вплинути на точність результатів. Щоб усунути ці обмеження, в дане дослідження ми включили 289 пацієнтів, з яких лише 14,9% (43/289) мали пухлини діаметром >3,0 см. Отримані дані вказують на те, що приблизно у 50 випадках ендоскопіст повинен пролікувати пацієнта до того, як досягне відповідного рівня кваліфікації, необхідного для успішного виконання ЕР ШКСП.
Sun та співавт.8 повідомили, що приблизно 32 пацієнти повинні бути проліковані ендоскопістами, які володіють базовими навичками ендоскопічних втручань, щоб набути навичок, необхідних для успішного виконання ЕР ППШ. Однак це було невелике дослідження, а тому існував високий ризик упередженості. Крім того, ППШ включають багато типів уражень, включаючи ШКСП, лейоміоми, ектопічну підшлункову залозу, шванноми, гемангіоми та запальні фіброзні поліпи.2,3,20 ППШ відрізняються за місцем розвитку, формою, типом росту та межами з оточуючими тканинами. Тому складність ЕР різних ППШ відрізняється, а отже, відрізняється і КН для ЕР конкретних ППШ. Численні попередні дослідження послідовно показали, що КН для ЕР уражень шлунка становить приблизно 30 випадків,9,21–23 , що є коротшою, ніж КН, розрахований в даному дослідженні для ЕР ШКСП. Ми вважаємо, що довша КН при ШКСП, ніж при інших ураженнях шлунка, може бути пов’язана з наступними факторами. (1) ШКСП розташовані глибше в стінці шлунка, ніж інші ураження шлунка, і ближче до м’язового або серозного шару. Це зумовлює необхідність глибших розрізів і додає складності резекції при ШКСП. (2) ШКСП можуть мати неправильну форму і можуть бути пов’язані зі спайками з навколишніми тканинами, тоді як інші ППШ, такі як лейоміоми, як правило, мають більш правильну форму. Ця складніша морфологія ШКСП створює труднощі під час резекції. (3) ШКСП мають багате кровопостачання, що робить їх схильними до інтраопераційних кровотеч. Для порівняння, інші ураження шлунка, такі як лейоміоми, мають меншу тенденцію до кровотечі. Отже, потрібен ретельний підхід для контролю кровотечі та забезпечення хірургічної безпеки під час резекції ШКСП.
Середня тривалість операції була значно коротшою на пізній фазі, ніж на ранній (55,0 проти 79,0 хв, P < 0,001), головним чином завдяки підвищенню кваліфікації ендоскопіста. Зі збільшенням кількості виконуваних процедур удосконалювалася техніка боротьби з інтраопераційною кровотечею, що дозволило скоротити тривалість операції. Крім того, накопичення досвіду призвело до зниження частоти післяопераційних ускладнень, а тривалість післяопераційного голодування і госпіталізації на пізній стадії також була коротшою.
Під час цього дослідження дев’ять учасників були переведені на ЛР. Оскільки це пов’язано з більшою тривалістю операції, ми також мали на меті визначити фактори ризику такої конверсії. Наскільки нам відомо, труднощі, пов’язані з виконанням ЕР при ураженнях шлунка, значною мірою пов’язані з розміром, локалізацією та глибиною інвазії пухлини.24–27 Тому ми вирішили дослідити ці змінні як потенційні фактори ризику і виявили, що діаметр пухлини >3,0 см і інвазія за межі МО асоціювалися з конверсією. Ми також виявили, що учасники з більшими ШКСП частіше зазнавали тяжкої інтраопераційної кровотечі, ніж пацієнти з пухлинами <3 см (14,0% проти 0,4%, P < 0,001), так само як і пацієнти з ШКСП, у яких спостерігалася інвазія за межі МО (1,6% проти 8,3%, P = 0,044). Якщо тяжка інтраопераційна кровотеча не піддавалася ендоскопічному контролю, був необхідна конверсія в ЛР.
Проведене дослідження мало певні обмеження. По-перше, це було одноцентрове ретроспективне дослідження, і вивчалася КН одного ендоскопіста. Тому для підтвердження наших результатів необхідно провести проспективне багатоцентрове дослідження із залученням кількох ендоскопістів. По-друге, кількість учасників, які потребували конверсії, була низькою (n = 9; 3,1%), що могло вплинути на точність результатів. Однак попередні дослідження показали, що частота конверсій при ЕР ШКСП є низькою.5,13 З покращенням технічної кваліфікації ендоскопіста частота конверсій поступово зменшувалася. Тому збільшення розміру вибірки не обов’язково призведе до збільшення кількості пацієнтів, які потребують конверсії. По-третє, враховуючи відмінності в процедурах, ймовірно, що складність і КН, пов’язані з ЕПД і ЕРВТ, відрізняються. У цьому дослідженні ми вивчали КН для обох методик ЕР разом. Однак у майбутньому буде важливо провести подальші дослідження щодо КН, специфічних для кожної ендоскопічної методики.
У висновку ми показали, що КН для ЕР ШКСП продовжується протягом приблизно 50 випадків, а пухлини >3,0 см в діаметрі і ті, що проростають за межі МО, асоціюються з вищим ризиком конверсії в ЛР. Таким чином, ендоскопісти-початківці повинні прагнути накопичувати хірургічний досвід і відбирати випадки, які відповідають їхнім технічним навичкам, перш ніж приступати до виконання хірургічних втручань.
Декларація про конфлікт інтересів
Автори заявляють про відсутність конфлікту інтересів.
Фінансування
Автори отримали наступну фінансову підтримку для проведення досліджень, написання та/або публікації цієї статті: грант від Проекту підготовки медичних кадрів м. Сучжоу (номер GSWS2020109) та грант від Науково-технічного проекту м. Чаншу (номер CS202116).
Посилання на джерела
- Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer (second edition). Dig Endosc 2021; 33: 4–20.
- Chen H, Li B, Li L, et al. Current Status of endoscopic resection of gastric subepithelial tumors. Am J Gastroenterol 2019; 114: 718–725.
- Nishida T, Kawai N, Yamaguchi S, et al. Submucosal tumors: comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors. Dig Endosc 2013; 25: 479–489.
- Wang C, Gao Z, Shen K, et al. Safety and efficiency of endoscopic resection versus laparoscopic resection in gastric gastrointestinal stromal tumours: a systematic review and meta-analysis. Eur J Surg Oncol 2020; 46: 667–674.
- Chen L, Zhang Q, Li FY, et al. Comparison of treatment outcomes between laparoscopic and endoscopic surgeries for relatively small gastric gastrointestinal stromal tumors. Surg Oncol 2018; 27: 737–742.
- von Mehren M, Kane JM, Bui MM, et al. NCCN guidelines insights: soft tissue sarcoma, version 1.2021. J Natl Compr Canc Netw 2020; 18: 1604–1612.
- Marano L, Arru GM, Piras M, et al. Surgical management of acutely presenting gastrointestinal stromal tumors of the stomach among elderly: experience of an emergency surgery department. Int J Surg 2014; 12: S145–S147.
- Sun C, Zheng Z, Wang B. Learning curve for endoscopic submucosal dissection of gastric submucosal tumors: is it more difficult than it may seem? J Laparoendosc Adv Surg Tech A 2014; 24: 623–627.
- Yoshida M, Kakushima N, Mori K, et al. Learning curve and clinical outcome of gastric endoscopic submucosal dissection performed by trainee operators. Surg Endosc 2017; 31: 3614–3622.
- von Elm E, Altman DG, Egger M, et al. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. Ann Intern Med 2007; 147: 573–577.
- Huberty V, Verset L, Deviere J. Endoscopic full-thickness resection of a gastric GI stromal tumor. VideoGIE 2019; 4: 120–122.
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2015; 47:829–854.
- Su W, Wang M, Zhang D, et al. Predictors of the difficulty for endoscopic resection of gastric gastrointestinal stromal tumor and follow-up data. J Gastroenterol Hepatol 2022; 37: 48–55.
- Muro T, Higuchi N, Imamura M, et al. Post-operative infection of endoscopic submucosal dissection of early colorectal neoplasms: a case-controlled study using a Japanese database. J Clin Pharm Ther 2015; 40: 573–577.
- Draganov PV, Aihara H, Karasik MS, et al. Endoscopic submucosal dissection in North America: a large prospective multicenter study. Gastroenterology 2021; 160: 2317–2327.e2.
- Song X, Wang D, Sun X, et al. Cumulative sum analysis of the learning curve for endoscopic resection of juvenile nasopharyngeal angiofibroma. Surg Endosc 2018; 32: 3181–3191.
- Ozeki Y, Hirasawa K, Sawada A, et al. Learning curve analysis for duodenal endoscopic submucosal dissection: a single-operator experience. J Gastroenterol Hepatol 2022; 37: 2131–2137.
- Jang SH, Kwon JE, Kim JH, et al. Prediction of tumor recurrence in patients with non-gastric gastrointestinal stromal tumors following resection according to the Modified National Institutes of Health Criteria. Intest Res. 2014; 12: 229–235.
- Liu L, Xu X, You W, et al. Learning curve for endoscopic resection of gastric gastrointestinal stromal tumors: a single-center experience. Rev Esp Enferm Dig. 2023 May 12. Epub ahead of print.
- Shichijo S, Abe N, Takeuchi H, et al. Endoscopic resection for gastric submucosal tumors: Japanese multicenter retrospective study. Dig Endosc 2023; 35: 206–215.
- Oda I, Odagaki T, Suzuki H, et al. Learning curve for endoscopic submucosal dissection of early gastric cancer based on trainee experience. Dig Endosc 2012; 24: 129–132.
- Kakushima N, Fujishiro M, Kodashima S, et al. A learning curve for endoscopic submucosal dissection of gastric epithelial neoplasms. Endoscopy 2006; 38: 991–995.
- Kato M, Gromski M, Jung Y, et al. The learning curve for endoscopic submucosal dissection in an established experimental setting. Surg Endosc 2013; 27: 154–161.
- Jian G, Tan L, Wang H, et al. Factors that predict the technical difficulty during endoscopic full-thickness resection of a gastric submucosal tumor. Rev Esp Enferm Dig 2021; 113: 35–40.
- Yang F, Wang S, Sun S, et al. Factors associated with endoscopic full-thickness resection of gastric submucosal tumors. Surg Endosc 2015; 29: 3588–3593.
- Kim JH, Nam HS, Choi CW, et al. Risk factors associated with difficult gastric endoscopic submucosal dissection: predicting difficult ESD. Surg Endosc 2017; 31: 1617–1626.
- Yoon JY, Shim CN, Chung SH, et al. Impact of tumor location on clinical outcomes of gastric endoscopic submucosal dissection. World J Gastroenterol 2014; 20: 8631–8637.