Резюме
Предусловия
Эндоскопическая резекция (ЭР) является доказанным методом лечения желудочно-кишечных стромальных опухолей (ЖКСО). Мы имели целью оценить кривую обучения (КО), связанную с ЭР при ЖКСО, и определить ее детерминанты.
Методы
Мы провели анализ 289 пациентов, которым было выполнено ЭР ЖКСО опытным эндоскопистом. Для характеристики КО мы использовали кумулятивный суммарный анализ продолжительности хирургического вмешательства. Пациенты были разделены на раннюю фазу (случаи 1-50) и позднюю фазу (случаи 51-289), которые сравнивали. Кроме того, мы определили факторы риска перехода от эндоскопической к лапароскопической резекции (ЛР).
Результаты
Продолжительность операции и госпитализации была короче, а на поздней фазе было меньше осложнений и дней голодания. Частота перехода на ЛР составляла 6,0% и 2,5% на ранней и поздней фазах соответственно. Диаметр опухоли (≥3,0 см) и инвазия за пределы собственной мускулатуры были значимыми факторами риска перехода в ЛР (соотношение шансов 17,92, 95% доверительный интервал 2,66-120,87; и 58,03, 6,40-525,84 соответственно).
Заключения
КО при ЭР ЖКСО продолжается примерно в 50 случаях. Кроме того, опухоли диаметром ≥3,0 см и прорастающие за пределы собственной мускулатуры чаще требуют перехода на ЛР.
Вступление
Эндоскопическая резекция (ЭР) является широко применяемым методом лечения ранних стадий рака желудка (РРЖ) и подслизистых опухолей желудка (ПОЖ).1,2 Желудочно-кишечные стромальные опухоли (ЖКСО) являются наиболее распространенным типом ПОЖ в верхних отделах пищеварительного тракта.3 ЭР оказалась эффективным и безопасным методом лечения ЖКСО, предлагая такие преимущества, как быстрое послеоперационное восстановление, более короткий срок пребывания в стационаре и меньшие затраты.4,5 Однако, из-за злокачественного потенциала ЖКСО, регулярное наблюдение необходимо при поражениях <2 см, что может наложить психологическое бремя на пациентов. Как следствие, в последние годы наблюдается постепенное увеличение количества процедур ЭР, выполняемых для лечения ЖКСО.6
Выполнение ЭР при ЖКСО требует высоких эндоскопических навыков, поэтому неопытным эндоскопистам может потребоваться помощь. Эта процедура связана с определенными рисками, в том числе с тяжелым интраоперационным кровотечением, перфорацией и необходимостью перехода к лапароскопической резекции (ЛР). Пациенты старшего возраста, особенно с сопутствующими заболеваниями, имеют более высокий риск осложнений, включая перфорацию, во время эндоскопических процедур. Кроме того, когда у пациентов со стромальными опухолями желудочно-кишечного тракта наблюдается острое желудочно-кишечное кровотечение, проблемы, связанные с эндоскопическим лечением, становятся еще большими, а риск значительного кровотечения во время процедуры – выше.7 Поэтому разработка руководств для эндоскопистов для достижения мастерства в выполнении ЭР при ЖКСО является необходимой для повышения безопасности пациентов, учитывая сложность процедуры и связанные с ней потенциальные осложнения.
Исследование, проведенное Sun и соавт. 8 , показало, что эндоскопист должен выполнить примерно 32 процедуры, чтобы получить КО с ЭР желудочных ПОЖ. Аналогично, Yoshida и соавт. 9 обнаружили, что начинающие эндоскописты достигают стабильного состояния после выполнения примерно 30 процедур ЭР при поражениях желудка. Однако важно отметить, что размеры выборок в этих исследованиях были относительно небольшими. Кроме того, не изучался КО при ЭР при ЖКСО, выполняемой одним эндоскопистом в центре с большим объемом работы. Для устранения этих ограничений мы ставили целью изучить большее количество случаев и всесторонне оценить КО для ЭР ЖКСО, что позволит получить более достоверную и надежную информацию об этой ЛР и улучшить понимание оптимального способа выполнения этой процедуры в медицинском учреждении.
Материалы и методы
Пациенты
Мы провели ретроспективное исследование пациентов, которые прошли предоперационную компьютерную томографию (КТ) и эндоскопическую ультрасонографию (ЭУС) для оценки локализации, размера, глубины инвазии и наличия метастазов опухоли. Кроме того, было проведено комплексное предоперационное обследование, включая общий анализ крови, коагуляционный профиль и электрокардиографию. Критериями включения в исследование были: опухоль <5,0 см в диаметре, без поражения лимфатических узлов или отдаленных метастазов. Исследовались последовательные пациенты, которым было выполнено ЭР желудочно-кишечных стромальных опухолей (ЖКСО) одним эндоскопистом в период с августа 2012 г. по декабрь 2022 г. Все процедуры выполнял единственный врач-эндоскопист (ЕВЭ), который до выполнения своей первой процедуры ЭР по поводу ЖКСО выполнил примерно 500 эндоскопических подслизистых диссекций толстой кишки и 100 эндоскопических подслизистых диссекций желудка. Демографические, интраоперационные и послеоперационные данные были собраны ретроспективно для каждого участника. Протокол исследования был одобрен этическим комитетом Первой аффилированной больницы Университета Сучжоу, и все участники предоставили письменное информированное согласие на проведение процедуры и участие в исследовании. Отчетность этого исследования соответствует руководящим принципам STROBE.10
Методики и оборудование для эндоскопической резекции
Всем участникам был введен общий наркоз и проведена эндотрахеальная интубация. Мы использовали две методики ЭР: ЭПД и эндоскопическую резекцию на всю толщину (ЭРВТ). ЭПД применяли для лечения ЖКСО, которые происходили из мышечной пластинки слизистой оболочки (МП) или собственной мышечной оболочки (МО) и выступали в просвет, тогда как ЖКСО, происходившие из глубины МО, имели внепросветный рост, а также те, которые не могли быть отделены от серозного слоя во время ЭПД, лечили с помощью ЭРВТ. Процедуры ЭР выполняли, как описано ранее.11,12 Рисунок 1 иллюстрирует процесс ЭРВТ для ЖКСО. Мы использовали одноканальный эндоскоп (GIF-Q260J, Olympus, Токио, Япония) с прозрачным колпачком, прикрепленным к кончику эндоскопа. Другое оборудование включало двойные ножи (KD-650L; Olympus, Япония), ножи с изолированными кончиками (KD-611L; Olympus), высокочастотный генератор (ERBE VIO 200D, Erbe Elektromedizin, Тюбинген, Германия), инсуфлятор углекислого газа, горячие биопсийные пинцеты, инъекционные иглы, металлические зажимы, зажимы для выхода за пределы эндоскопа (OTSC) и нейлоновые петли.
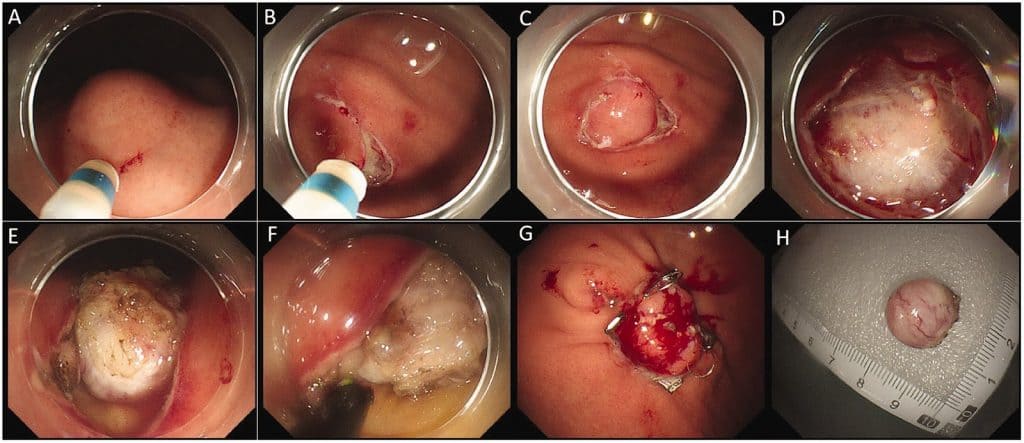
Рисунок 1. Иллюстрация этапов ЭРВТ для лечения ЖКСО. (а) Опухоль, расположенная на дне желудка; (б) Разрез слизистого слоя с помощью двойного ножа; (в) Периферийный разрез слизистого слоя; (г) Обнажение тела опухоли; (д) Разрез на всю толщину стенки желудка; (е) Полное иссечение опухоли с помощью ИТ-ножа; (ж) Закрытие раневой поверхности с помощью OTSC-клипс и (з) Резекция ЖКСО.
ЭРВТ – эндоскопическая резекция на всю толщину; ЖКСО- желудочно-кишечная стромальная опухоль; ИН – изолированный наконечник.
Определение
Продолжительность операции определяли как время от начала подслизистой инъекции до полного закрытия дефекта. Происхождение опухоли определяли с помощью предоперационной ЭУС, а ее размер и расположение оценивали с помощью предоперационной КТ брюшной полости с усилением или ЭУС. Самым распространенным интраоперационным осложнением было тяжелое интраоперационное кровотечение, определенное как повторный эндоскопический гемостаз с послеоперационным снижением концентрации циркулирующего гемоглобина >2 г/дл.13 Послеоперационные осложнения включали отсроченное кровотечение, отсроченную перфорацию и послеоперационную инфекцию. Диагноз отсроченного кровотечения подтверждали с помощью экстренной эндоскопии, а диагноз отсроченной перфорации – с помощью рентгенографии или компьютерной томографии. Послеоперационная инфекция определялась как послеоперационная температура тела >37,5°C, сопровождавшаяся показателями воспаления при лабораторных исследованиях (общий анализ крови, высокая концентрация С-реактивного белка или высокая концентрация кальцитонина.14 Резекция R0 определялась на основе гистологического исследования боковых и вертикальных краев, которое не выявило остаточных опухолей.15
Послеоперационное ведение
Удаленные во время операции ткани фиксировали в 10% растворе формалина и подвергали иммуногистохимическому окрашиванию на маркеры, включая CD117, CD34 и Dog-1, для подтверждения диагноза. После операции участникам, как правило, проводили назогастральную декомпрессию для предотвращения послеоперационных осложнений и проинструктировали поститься в течение 2 дней. Для тех, кто прошел ЭРВТ, период голодания был продлен до 3 дней или более, в соответствии с их послеоперационным состоянием. После операции проводили рутинные анализы крови, измерение концентрации циркулирующего С-реактивного белка и/или кальцитонина, а также всем участникам назначали ингибитор протонной помпы, средства для защиты слизистой оболочки желудка, нутритивную поддержку и возмещение жидкости. Когда участник чувствовал боль в животе или мышечное напряжение, ему проводили КТ или ортостатическую рентгенографию, чтобы исключить послеоперационную перфорацию. Проводилась антибиотикотерапия или дальнейшее хирургическое вмешательство в зависимости от состояния участника. Если у участников возникала интраоперационная перфорация или послеоперационная инфекция, назначались антибиотики.
Дальнейшие действия
Для оценки заживления ран участники проходили эндоскопические обследования через 1, 3, 6 и 12 месяцев после операции, а рецидив или остаточные опухоли выявляли с помощью эндоскопической ультрасонографии. Впоследствии ежегодно проводили повторные обследования, во время которых выполняли КТ брюшной полости с контрастным усилением и КТ грудной клетки для выявления лимфатических узлов и отдаленных метастазов.
Анализ кривой обучения
Анализ кумулятивной суммы (КУСУМ) ранее использовался для количественной оценки КО для ряда эндоскопических процедур.16,17 В этом исследовании мы оценили связь между опытом эндоскописта и продолжительностью операции, а метод КУСУМ был использован для анализа КО для ЭР ЖКСО. Формула, используемая для расчета КУСУМ, приведена ниже, где Xi – продолжительность операции для каждого участника, u – средняя продолжительность операции для всех участников, а n – порядковый номер участника.
КУСУМ=
∑
i=1
n
(Xi−u)
Статистический анализ
Категориальные наборы данных выражены в виде частот и процентов и сравнивались с помощью критерия хи-квадрат или точного критерия Фишера. Нормально распределенные непрерывные массивы данных выражены как среднее ± стандартное отклонение и сравнивались с помощью t-критерия Стьюдента. Ненормально распределенные непрерывные массивы данных выражены как медиана и интерквартильный размах (ИКР) и сравнивались с помощью U-критерия Манна-Уитни. Одномерный анализ проводился для групп конверсии и неконверсии (до ЛР), а переменные с P < 0,1 при одномерном анализе были включены в многомерный регрессионный анализ. p < 0,05 считался статистически значимым, и все анализы были выполнены с использованием SPSS версии 26 (IBM Corp., Армонк, Нью-Йорк, США).
Результаты
Демографические данные пациентов
За период исследования 297 пациентам с 300 поражениями желудка была проведена ЭР. Мы исключили пятерых пациентов, которые имели одновременные поражения в других местах, и трех, которые имели множественные поражения в желудке. После этого для анализа остались данные 289 участников с 289 поражениями. В таблице 1 приведены демографические данные участников, которым была выполнена ЭР по поводу ЖКСО. Среди них было 149 мужчин (51,6%) и 140 женщин (48,4%), средний возраст составил 59,8 ± 9,4 года. Медиана (ИКР) диаметра опухоли составляла 1,5 (1,0, 2,0) см, а диаметр варьировал от 0,3 до 5,0 см. Большинство поражений находились в пределах МО (87,5%). Демографические показатели участников двух фаз были сходными (табл. 1).
Таблица 1. Демографические данные участников в течение двух этапов.
| Всего
(n = 289) |
Ранняя стадия (n = 50) | Поздняя стадия (n = 239) | P-value | |
| Возраст, лет, среднее ± СО | 59.8 ± 9.4 | 60.1 ± 9.3 | 59.7 ± 9.5 | 0.780# |
| Пол, n (%) | 0.104& | |||
| Мужчины | 149 (51.6) | 31 (62.0) | 118 (49.4) | |
| Женщины | 140 (48.4) | 19 (38.0) | 121 (50.6) | |
| Размер опухоли, см, медиана (ИКР) | 1.5 (1.0, 2.0) | 1.5 (1.1, 3.0) | 1.5 (1.0, 2.0) | 0.132$ |
| ИМТ, кг/м², среднее ± СО | 22.3 ± 3.2 | 22.3 ± 3.8 | 22.4 ± 3.1 | 0.892# |
| Гипертония, n(%) | 0.819& | |||
| Да | 100 (34.6) | 18 (36.0) | 82 (34.3) | |
| Нет | 189 (65.4) | 32 (64.0) | 157 (65.7) | |
| Диабет, n(%) | 0.770& | |||
| Да | 80 (27.7) | 13 (26.0) | 67 (28.0) | |
| Нет | 209 (72.3) | 37 (74.0) | 172 (72.0) | |
| Ишемическая болезнь сердца, n(%) | 0.812& | |||
| Да | 60 (20.8) | 11 (22.0) | 49 (20.5) | |
| Нет | 229 (79.2) | 39 (78.0) | 190 (79.5) | |
| Местонахождение, n (%) | 0.063& | |||
| Верхняя часть | 203 (70.2) | 42 (84.0) | 161 (67.4) | |
| Середина | 61 (21.1) | 6 (12.0) | 55 (23.0) | |
| Нижняя часть | 25 (8.7) | 2 (4.0) | 23 (9.6) | |
| Шкала АСА, n (%) | 0.747* | |||
| I | 56 (19.4) | 11 (22.0) | 45 (18.8) | |
| II | 232 (80.3) | 39 (78.0) | 193 (80.8) | |
| III | 1 (0.3) | 0 | 1 (0.4) | |
| Глубина инвазии, n (%) | 0.563& | |||
| В пределах МО | 253 (87.5) | 45 (90.0) | 208 (87.0) | |
| За пределами МО | 36 (12.5) | 5 (10.0) | 31 (13.0) | |
| Модифицированный балл по критериям риска НИЗ, n (%) | 0.842* | |||
| Очень низкий | 216 (74.7) | 36 (72.0) | 180 (75.3) | |
| Низкий | 56 (19.4) | 11 (22.0) | 45 (18.8) | |
| Средний | 16 (5.5) | 3 (6.0) | 13 (5.4) | |
| Высокий | 1 (0.3) | 0 | 1 (0.4) | |
| Оценка риска по Флетчеру, n (%) | 0.842* | |||
| Очень низкая | 216 (74.7) | 36 (72.0) | 180 (75.3) | |
| Низкая | 56 (19.4) | 11 (22.0) | 45 (18.8) | |
| Средняя | 16 (5.5) | 3 (6.0) | 13 (5.4) | |
| Высокая | 1 (0.3) | 0 | 1 (0.4) | |
| Стадия TNM, n (%) | ||||
| Ia | 289 (100) | 50 (100) | 239 (100) | Н/Д |
СО: стандартное отклонение; ИКР: интерквартильный размах; ИМТ: индекс массы тела; МО: мышечная оболочка; НИЗ: Национальный инсититут здравоохранения; ASA: Американская ассоциация по здравоохранению: Н/Д: нет данных. Данные анализировали с помощью #критерия Стьюдента; $критерия Манна-Уитни; &критерия хи-квадрат или *точного критерия Фишера.
Процедуры и результаты ЭР ЖКСО
Медиана (ИКР) продолжительности операции составила 59,0 (47,5, 75,0) минут, а конверсия в ЛР понадобилась девяти пациентам (3,1%). Частота интраоперационных и послеоперационных осложнений составила 2,4% и 9,0% соответственно. В целом 273 участникам (94,5%) была выполнена резекция R0. Медиана (ИКР) продолжительности послеоперационного голодания и госпитализации составила 3,0 (2,0, 3,0) и 5,0 (5,0, 6,0) дней соответственно. Двадцать шесть участников испытали послеоперационных осложнений, включая два случая послеоперационного кровотечения, 25 случаев послеоперационной инфекции и один случай послеоперационной перфорации. Двум участникам, у которых возникло послеоперационное кровотечение, было успешно проведено экстренное эндоскопическое лечение путем гемостаза горячими щипцами для биопсии. Из 25 участников, подвергшихся послеоперационной инфекции, у 14 была лихорадка, но без повышения концентрации маркеров воспаления, и они не получали антибиотиков, а у 11 были высокие концентрации маркеров воспаления и лихорадка, но они выздоровели после лечения антибиотиками. Участник, у которого произошла послеоперационная перфорация, был успешно вылечен с помощью поддерживающей диетотерапии и назогастральной декомпрессии. В течении периода наблюдения не было выявлено никаких лимфатических узлов или отдаленных метастазов.
Дальнейший анализ
В целом 242 участника были успешно пролечены, средняя продолжительность наблюдения составила 45,0 месяцев (ИКР от 18,0 до 82,0 месяцев). Семнадцать участников были отнесены к группе промежуточного или высокого риска в соответствии с модифицированными критериями Национального института здравоохранения (НИЗ) 18 , и все они проходили послеоперационное лечение иматинибом. Только у одного участника, который после операции имел промежуточную степень риска, возник рецидив. Этот пациент прекратил лечение иматинибом через 6 месяцев, но после обнаружения рецидива перенес лапароскопическую операцию. В течение дальнейшего периода наблюдения не было выявлено ни одного рецидива.
Анализ кривой обучения
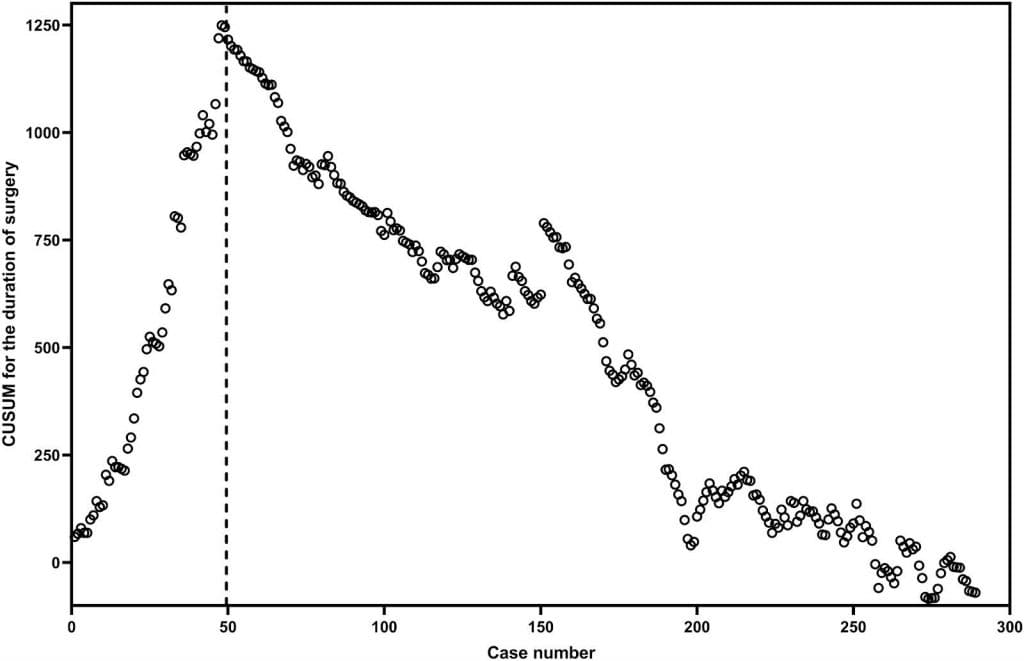
Максимальная продолжительность операции по КУСУМ наблюдалась примерно на 50-м случае. После этого КУСУМ уменьшался, за исключением случаев, когда шесть участников нуждались в переходе на ЛР (рис. 2). На основе диаграммы КУСУМ участники были распределены на раннюю (случаи с 1 по 50) и позднюю (случаи с 51 по 289) фазы КО. Продолжительность операции, послеоперационной госпитализации и послеоперационного голодания, а также частота интраоперационных и послеоперационных осложнений во время ранней фазы были значительно меньше, чем во время поздней фазы (P <0,05) (Таблица 2).
Рисунок 2. Кумулятивная сумма (КУСУМ) продолжительности хирургического вмешательства против номера случая.
Таблица 2. Интраоперационные и послеоперационные данные для двух фаз.
| Всего
(n = 289) |
Ранняя стадия (n = 50) | Поздняя стадия (n = 239) | P-value | |
| Методика эндоскопии, n (%) | 0.064& | |||
| ЭПД | 150 (51.9) | 20 (40.0) | 130 (54.4) | |
| ЭРВТ | 139 (48.1) | 30 (60.0) | 109 (45.6) | |
| Метод закрытия дефекта, n (%) | 0.862& | |||
| Металлические клипсы | 212 (73.3) | 38 (76.0) | 174 (72.8) | |
| Нейлоновые петли | 55 (19.0) | 9 (18.0) | 46 (19.2) | |
| Другие | 22 (7.6) | 3 (6.0) | 19 (7.9) | |
| Продолжительность операции, минуты, медиана (ИКР) | 59.0 (47.5, 75.0) | 79.0 (60.0, 108.5) | 55.0 (45.0, 68.0) | <0.001$ |
| Интраоперационные осложнения, n (%) | 7 (2.4) | 4 (8.0) | 3 (1.3) | 0.019* |
| Послеоперационные осложнения, n (%) | 26 (9.0) | 10 (20.0) | 16 (6.7) | 0.003& |
| Конверсия, n (%) | 9 (3.1) | 3 (6.0) | 6 (2.5) | 0.191* |
| R0 Резекция, n (%) | 273 (94.5) | 45 (90.0) | 228 (95.4) | 0.129& |
| Продолжительность послеоперационной госпитализации, дни, медиана (ИКР) | 5.0 (5.0, 6.0) | 7.0 (5.0, 8.3) | 5.0 (5.0, 6.0) | <0.001$ |
| Продолжительность послеоперационного голодания, дней, медиана (ИКР) | 3.0 (2.0, 3.0) | 4.0 (3.0, 5.0) | 3.0 (2.0, 3.0) | <0.001$ |
ЭПД: эндоскопическая подслизистая диссекция; ЭРВТ: эндоскопическая резекция на всю толщину; U-критерий Манна-Уитни, &критерий хи-квадрат, *точный критерий Фишера.
Факторы риска перехода к лапароскопической резекции
Распространенность конверсии в ЛР на ранней и поздней фазах составляла 6,0% и 2,5% соответственно (P > 0,05)(табл. 2). Причинами конверсии в ЛР были: тяжелое интраоперационное кровотечение, которое невозможно было контролировать эндоскопически (n = 6), невозможность закрытия перфорации (n = 2) и выпадение опухоли в брюшную полость (n = 1). Многофакторный анализ показал, что факторами риска, связанными с конверсией в ЛР, были размер опухоли (диаметр ≥3,0 см, отношение шансов [ОШ] 17,92, 95% доверительный интервал [ДИ] 2,65, 120,87, P = 0,003) и инвазия за пределы МО (ОШ 58,03, 95% ДИ 6,40, 525,84, P < 0,001) (табл. 3).
Таблица 3. Факторы риска конверсии к лапароскопической резекции.
| Одномерный анализ | Многомерный анализ | ||||
| Операция с конверсией
(n = 9) |
Неконверсионная (n = 280) | P-value* | ОШ (95% ДИ) | P-value | |
| Возраст ≥60 лет, n (%) | 5 (55.6) | 143 (51.1) | 1.000 | ||
| Мужской пол, n (%) | 5 (55.6) | 144 (51.4) | 1.000 | ||
| ИМТ ≥24,0 (кг/м²), n (%) | 2 (22.2) | 88 (31.4) | 0.725 | ||
| Диаметр опухоли ≥3,0 см, n (%) | 7 (77.8) | 37 (13.2) | <0.001 | 17.92 (2.66–120.87) | 0.003 |
| Верхняя треть, n (%) | 8 (88.9) | 196 (70.0) | 0.291 | ||
| Инвазия за пределы МО, n (%) | 8 (88.9) | 28 (10.0) | <0.001 | 58.03 (6.40–525.84) | <0.001 |
| Оценка по модифицированным критериям риска НИЗ Средний или высокий, n (%) | 2 (22.2) | 15 (5.4) | 0.092 | 1.021 (0.099–10.57) | 0.986 |
| Оценка по шкале АОА ≥II, n (%) | 7 (77.8) | 226 (80.7) | 0.687 | ||
| Артериальная гипертензия, n (%) | 2 (22.2) | 98 (35.0) | 0.724 | ||
| Диабет, n (%) | 1 (11.1) | 79 (28.2) | 0.452 | ||
| Ишемическая болезнь сердца, n (%) | 1 (11.1) | 59 (21.1) | 0.691 | ||
| Эндоскопическая техника (ЭРВТ), n (%) | 6 (66.7) | 133 (47.5) | 0.321 | ||
ИМТ: индекс массы тела; МО: мышечная оболочка; НИЗ: Национальный институт здоровья; ASA: Американское общество анестезиологов; ЭРВТ: эндоскопическая резекция на всю толщину. Для анализа данных использовали точный критерий Фишера.
Обсуждение
Хотя раньше ЭР при ЖКСО выполнялась небольшим количеством специалистов в центрах с большой нагрузкой, недавно эта методика была внедрена во многих менее загруженных больницах. Из-за сложности техники и риска интраоперационных осложнений может быть важным распределение пациентов в соответствии с особенностями хирургической процедуры и уровня квалификации каждого эндоскописта, чтобы обеспечить безопасность процедуры. Поэтому в данном исследовании мы имели целью объективно оценить техническую способность эндоскописта путем изучения КО для ЭР ЖКСО.
В нашем предыдущем исследовании мы оценили КО для ЭР ЖКСО в когорте из 100 пациентов и обнаружили, что лечение примерно 30 пациентов было достаточным для того, чтобы эндоскопист приобрел навыки, необходимые для минимизации рисков осложнений и конверсии, связанных с процедурой ЭР. Мы подсчитали, что для завершения КО с ЭР ЖКСО необходимо пролечить 60 пациентов.19 Однако важно отметить, что это исследование включало относительно небольшое количество пациентов с диаметром опухоли >3,0 см, которые, возможно, относительно легко поддаются хирургическому лечению. Кроме того, небольшой размер выборки мог повлиять на точность результатов. Чтобы устранить эти ограничения, в данное исследование мы включили 289 пациентов, из которых только 14,9% (43/289) имели опухоли диаметром >3,0 см. Полученные данные указывают на то, что примерно в 50 случаях эндоскопист должен пролечить пациента до того, как достигнет соответствующего уровня квалификации, необходимого для успешного выполнения ЭР ЖКСО.
Sun и соавт. 8 сообщили, что примерно 32 пациента должны быть пролечены эндоскопистами, владеющими базовыми навыками эндоскопических вмешательств, чтобы приобрести навыки, необходимые для успешного выполнения ЭР ПОЖ. Однако это было небольшое исследование, а потому существовал высокий риск предвзятости. Кроме того, ПОЖ включают много типов поражений, включая ЖКСО, лейомиомы, эктопическую поджелудочную железу, шванномы, гемангиомы и воспалительные фиброзные полипы.2,3,20 ПОЖ отличаются по месту развития, форме, типу роста и границам с окружающими тканями. Поэтому сложность ЭР различных ПОЖ отличается, а следовательно, отличается и КО для ЭР конкретных ПОЖ. Многочисленные предыдущие исследования последовательно показали, что КО для ЭР поражений желудка составляет примерно 30 случаев,9,21–23 , что является более короткой, чем КО, рассчитанный в данном исследовании для ЭР ЖКСО. Мы считаем, что более длинная КО при ЖКСО, чем при других поражениях желудка, может быть связана со следующими факторами. (1) ЖКСО расположены глубже в стенке желудка, чем другие поражения желудка, и ближе к мышечному или серозному слою. Это предопределяет необходимость более глубоких разрезов и добавляет сложности резекции при ЖКСО. (2) ЖКСО могут иметь неправильную форму и могут быть связаны со спайками с окружающими тканями, тогда как другие ПОЖ, такие как лейомиомы, как правило, имеют более правильную форму. Эта более сложная морфология ЖКСО создает трудности во время резекции. (3) ЖКСО имеют богатое кровоснабжение, что делает их склонными к интраоперационным кровотечениям. Для сравнения, другие поражения желудка, такие как лейомиомы, имеют меньшую тенденцию к кровотечению. Следовательно, нужен тщательный подход для контроля кровотечения и обеспечения хирургической безопасности во время резекции ЖКСО.
Средняя продолжительность операции была значительно короче на поздней фазе, чем на ранней (55,0 против 79,0 мин, P < 0,001), главным образом благодаря повышению квалификации эндоскописта. С увеличением количества выполняемых процедур совершенствовалась техника борьбы с интраоперационным кровотечением, что позволило сократить продолжительность операции. Кроме того, накопление опыта привело к снижению частоты послеоперационных осложнений, а продолжительность послеоперационного голодания и госпитализации на поздней стадии также была короче.
Во время этого исследования девять участников были переведены на ЛР. Поскольку это связано с большей продолжительностью операции, мы также имели целью определить факторы риска такой конверсии. Насколько нам известно, трудности, связанные с выполнением ЭР при поражениях желудка, в значительной степени связаны с размером, локализацией и глубиной инвазии опухоли.24–27 Поэтому мы решили исследовать эти переменные как потенциальные факторы риска и обнаружили, что диаметр опухоли >3,0 см и инвазия за пределы МО ассоциировались с конверсией. Мы также обнаружили, что участники с большими ЖКСО чаще испытывали тяжелое интраоперационное кровотечение, чем пациенты с опухолями <3 см (14,0% против 0,4%, P <0,001), так же как и пациенты с ЖКСО, у которых наблюдалась инвазия за пределы МО (1,6% против 8,3%, P = 0,044). Если тяжелое интраоперационное кровотечение не поддавалось эндоскопическому контролю, была необходима конверсия в ЛР.
Проведенное исследование имело определенные ограничения. Во-первых, это было одноцентровое ретроспективное исследование, и изучалась КО одного эндоскописта. Поэтому для подтверждения наших результатов необходимо провести проспективное многоцентровое исследование с привлечением нескольких эндоскопистов. Во-вторых, количество участников, нуждавшихся в конверсии, было низким (n = 9; 3,1%), что могло повлиять на точность результатов. Однако предыдущие исследования показали, что частота конверсий при ЭР ЖКСО является низкой.5,13 С улучшением технической квалификации эндоскописта частота конверсий постепенно уменьшалась. Поэтому увеличение размера выборки не обязательно приведет к увеличению количества пациентов, нуждающихся в конверсии. В-третьих, учитывая различия в процедурах, вероятно, что сложность и КО, связанные с ЭПД и ЭРВТ, отличаются. В этом исследовании мы изучали КО для обеих методик ЭР вместе. Однако в будущем будет важно провести дальнейшие исследования относительно КО, специфичных для каждой эндоскопической методики.
В заключении мы показали, что КО для ЭР ЖКСО продолжается в течение примерно 50 случаев, а опухоли >3,0 см в диаметре и те, что прорастают за пределы МО, ассоциируются с более высоким риском конверсии в ЛР. Таким образом, начинающие эндоскописты должны стремиться накапливать хирургический опыт и отбирать случаи, которые соответствуют их техническим навыкам, прежде чем приступать к выполнению хирургических вмешательств.
Декларация о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Финансирование
Авторы получили следующую финансовую поддержку для проведения исследований, написания и/или публикации этой статьи: грант от Проекта подготовки медицинских кадров г. Сучжоу (номер GSWS2020109) и грант от Научно-технического проекта г. Чаншу (номер CS202116).
Ссылки на источники
- Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer (second edition). Dig Endosc 2021; 33: 4–20.
- Chen H, Li B, Li L, et al. Current Status of endoscopic resection of gastric subepithelial tumors. Am J Gastroenterol 2019; 114: 718–725.
- Nishida T, Kawai N, Yamaguchi S, et al. Submucosal tumors: comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors. Dig Endosc 2013; 25: 479–489.
- Wang C, Gao Z, Shen K, et al. Safety and efficiency of endoscopic resection versus laparoscopic resection in gastric gastrointestinal stromal tumours: a systematic review and meta-analysis. Eur J Surg Oncol 2020; 46: 667–674.
- Chen L, Zhang Q, Li FY, et al. Comparison of treatment outcomes between laparoscopic and endoscopic surgeries for relatively small gastric gastrointestinal stromal tumors. Surg Oncol 2018; 27: 737–742.
- von Mehren M, Kane JM, Bui MM, et al. NCCN guidelines insights: soft tissue sarcoma, version 1.2021. J Natl Compr Canc Netw 2020; 18: 1604–1612.
- Marano L, Arru GM, Piras M, et al. Surgical management of acutely presenting gastrointestinal stromal tumors of the stomach among elderly: experience of an emergency surgery department. Int J Surg 2014; 12: S145–S147.
- Sun C, Zheng Z, Wang B. Learning curve for endoscopic submucosal dissection of gastric submucosal tumors: is it more difficult than it may seem? J Laparoendosc Adv Surg Tech A 2014; 24: 623–627.
- Yoshida M, Kakushima N, Mori K, et al. Learning curve and clinical outcome of gastric endoscopic submucosal dissection performed by trainee operators. Surg Endosc 2017; 31: 3614–3622.
- von Elm E, Altman DG, Egger M, et al. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. Ann Intern Med 2007; 147: 573–577.
- Huberty V, Verset L, Deviere J. Endoscopic full-thickness resection of a gastric GI stromal tumor. VideoGIE 2019; 4: 120–122.
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2015; 47:829–854.
- Su W, Wang M, Zhang D, et al. Predictors of the difficulty for endoscopic resection of gastric gastrointestinal stromal tumor and follow-up data. J Gastroenterol Hepatol 2022; 37: 48–55.
- Muro T, Higuchi N, Imamura M, et al. Post-operative infection of endoscopic submucosal dissection of early colorectal neoplasms: a case-controlled study using a Japanese database. J Clin Pharm Ther 2015; 40: 573–577.
- Draganov PV, Aihara H, Karasik MS, et al. Endoscopic submucosal dissection in North America: a large prospective multicenter study. Gastroenterology 2021; 160: 2317–2327.e2.
- Song X, Wang D, Sun X, et al. Cumulative sum analysis of the learning curve for endoscopic resection of juvenile nasopharyngeal angiofibroma. Surg Endosc 2018; 32: 3181–3191.
- Ozeki Y, Hirasawa K, Sawada A, et al. Learning curve analysis for duodenal endoscopic submucosal dissection: a single-operator experience. J Gastroenterol Hepatol 2022; 37: 2131–2137.
- Jang SH, Kwon JE, Kim JH, et al. Prediction of tumor recurrence in patients with non-gastric gastrointestinal stromal tumors following resection according to the Modified National Institutes of Health Criteria. Intest Res. 2014; 12: 229–235.
- Liu L, Xu X, You W, et al. Learning curve for endoscopic resection of gastric gastrointestinal stromal tumors: a single-center experience. Rev Esp Enferm Dig. 2023 May 12. Epub ahead of print.
- Shichijo S, Abe N, Takeuchi H, et al. Endoscopic resection for gastric submucosal tumors: Japanese multicenter retrospective study. Dig Endosc 2023; 35: 206–215.
- Oda I, Odagaki T, Suzuki H, et al. Learning curve for endoscopic submucosal dissection of early gastric cancer based on trainee experience. Dig Endosc 2012; 24: 129–132.
- Kakushima N, Fujishiro M, Kodashima S, et al. A learning curve for endoscopic submucosal dissection of gastric epithelial neoplasms. Endoscopy 2006; 38: 991–995.
- Kato M, Gromski M, Jung Y, et al. The learning curve for endoscopic submucosal dissection in an established experimental setting. Surg Endosc 2013; 27: 154–161.
- Jian G, Tan L, Wang H, et al. Factors that predict the technical difficulty during endoscopic full-thickness resection of a gastric submucosal tumor. Rev Esp Enferm Dig 2021; 113: 35–40.
- Yang F, Wang S, Sun S, et al. Factors associated with endoscopic full-thickness resection of gastric submucosal tumors. Surg Endosc 2015; 29: 3588–3593.
- Kim JH, Nam HS, Choi CW, et al. Risk factors associated with difficult gastric endoscopic submucosal dissection: predicting difficult ESD. Surg Endosc 2017; 31: 1617–1626.
- Yoon JY, Shim CN, Chung SH, et al. Impact of tumor location on clinical outcomes of gastric endoscopic submucosal dissection. World J Gastroenterol 2014; 20: 8631–8637.