Резюме
Передумови
Неінвазивне визначення міокардіальної роботи правого шлуночка (МРПШ), визначена за допомогою ехокардіографії, є новим показником, який використовується для оцінки систолічної функції ПШ. На сьогоднішній день доцільність визначення МРПШ для оцінки функції правого шлуночка у пацієнтів з дефектом міжпередсердної перегородки (ДМПП) не була перевірена.
Методи
Неінвазивне визначення МРПШ була проаналізована у 29 пацієнтів з ДМПП (середній вік 49 років; 21% чоловіків) і 29 осіб без серцево-судинних захворювань, які відповідали за віком і статтю. Пацієнтам з ДМПП проводили ехокардіографію та катетеризацію правих відділів серця (КПВС) протягом 24 годин.
Результати
Глобальний індекс роботи ПШ (ГІРПШ), глобальна конструктивна робота ПШ (ГКРПШ) і глобальна марна робота ПШ (ГМРПШ) були достовірно вищими у пацієнтів з ДМПП, ніж у контрольній групі, тоді як не було достовірної різниці в глобальній ефективності роботи ПШ (ГЕРПШ). Глобальна поздовжня деформація ПШ (ГПД ПШ), ГІРПШ, ГКРПШ і ГМРПШ продемонстрували значні кореляції з ударним об’ємом (УО) та індексом УО, визначеними за допомогою КПВС. ГІРПШ (площа під робочою характеристичною кривою ресивера [AUC] = 0,895), ГКРПШ (AUC = 0,922) і ГМРПШ (AUC = 0,870) можна вважати добрими предикторами ДМПП і вони були кращими, ніж ГПД ПШ (AUC = 0,656).
Висновок
ГІРПШ, ГКРПШ і ГМРПШ можуть бути використані для оцінки систолічної функції ЛШ і корелюють з показниками УО та індексом УО у пацієнтів з ДМПП.
Графічне резюме
Передумови
Дефект міжпередсердної перегородки (ДМПП) є поширеною формою вродженої вади серця з оціночною частотою 1 на 1000 живонароджених [1, 2]. У пацієнтів з нелікованою ДМПП підвищується частота розвитку дисфункції правого шлуночка (ПШ).
Ехокардіографія відіграє вирішальну роль в оцінці функції ПШ [3]. Систолічна екскурсія трикуспідального кільця (TAPSE), фракційна зміна площі ПШ (ФЗП ПШ), систолічна швидкість латерального трикуспідального кільця, отримана за допомогою тканинної доплерографії (Sʹ ПШ), та тривимірна фракція викиду ПШ (3D ФВ ПШ) є загальновживаними параметрами для оцінки систолічної функції ПШ [3, 4]. Однак ці параметри залежать від навантаження. Глобальна поздовжня деформація ПШ (ГПД ПШ) як надійний і кращий показник залишається залежним від навантаження параметром через низьку еластичність шлуночків і тонку стінку правого шлуночка [5, 6].
Неінвазивне визначення міокардіальної роботи ПШ (МРПШ) за допомогою ехокардіографії, нещодавно була продемонстрована як новий і надійний показник для оцінки систолічної функції ПШ [7, 8]. МРПШ інтегрує ГПД ПШ, тиск у легеневій артерії та події серцевого циклу, які надають більш точну інформацію, ніж традиційні параметри систолічної функції ПШ. Дотепер неінвазивне визначення МРПШ не застосовувалася для оцінки систолічної функції ПШ у пацієнтів з ДМПП. Тому дане дослідження було спрямоване на досягнення наступних цілей: (i) порівняти МРПШ між пацієнтами з ДМПП та здоровими особами; (ii) дослідити кореляції між неінвазивним визначенням МРПШ і ударним об’ємом (УО) ПШ та індексом УО, виміряним за допомогою катетеризації правих відділів серця (КПВС), у пацієнтів з ДМПП; (iii) вивчити можливість використання показників МРПШ для оцінки ефективності роботи міокарда у пацієнтів з ДМПП.
Методи
Досліджувана когорта
Загалом 57 пацієнтів з ДМПП (> 17 років) були проспективно набрані в Сяменьській лікарні серцево-судинних захворювань у період з травня по серпень 2022 року. Схема дослідження представлена на зображенні 1. Критерії виключення були наступними: КПВС, не проведена протягом 24 годин після ехокардіографії, ішемічна хвороба серця, серцеві аритмії під час ехокардіографії, інші вроджені вади серця, дисфункція лівого шлуночка (ЛШ) або серцева недостатність, виражена трикуспідальна регургітація (ТР) [9], доплерівське огинання ТР низької якості, неякісні ехокардіографічні зображення та тиск заклинювання в легеневих капілярах> 15 мм рт.ст. [10]. Після виключення, 29 пацієнтів були остаточно включені в дослідження. Ще 29 осіб без серцево-судинних захворювань, які відповідали за віком і статтю, були включені в контрольну групу. Дослідження було схвалено Комітетом з питань етики та отримано форми інформованої згоди.
Зображення 1
Хід дослідження. ДМПП – дефект міжпередсердної перегородки; КПВС – катетеризація правих відділів серця; МРПШ – Міокардіальноа робота правого шлуночка
Ехокардіографічне дослідження
Трансторакальні ехокардіографічні зображення отримували за допомогою ультразвукової системи Vivid E95 (GE Vingmed Ultrasound) згідно з рекомендованими протоколами [11, 12]. Двовимірні та тривимірні (3D) ехокардіографічні зображення отримували за допомогою датчиків M5S та 4 V відповідно. Всі ехокардіографічні зображення зберігали протягом 3-4 послідовних кардіоциклів з підключеною електрокардіограмою. Набори даних аналізували в автономному режимі за допомогою програми EchoPAC (версія 204).
Ехокардіографічні вимірювання
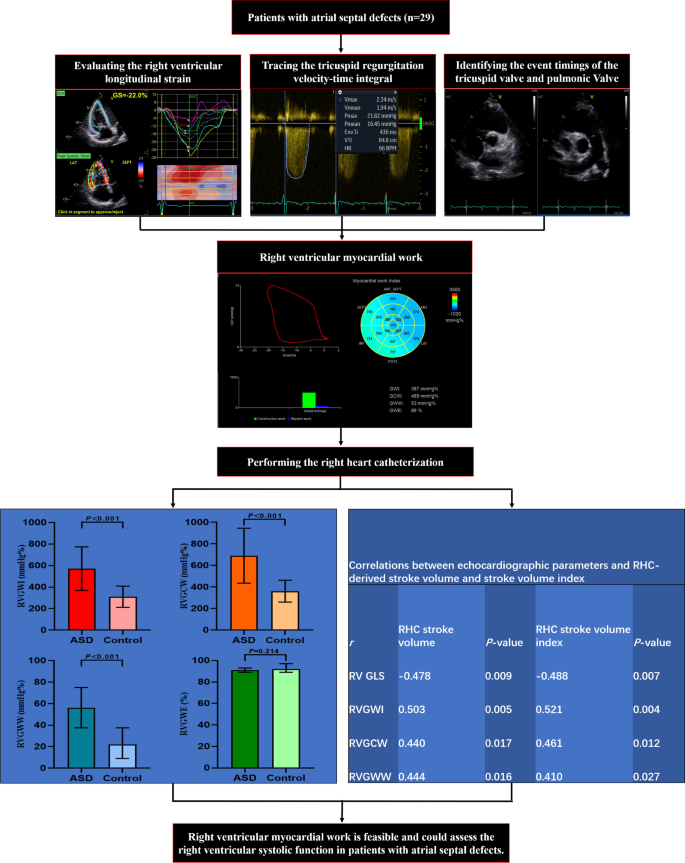
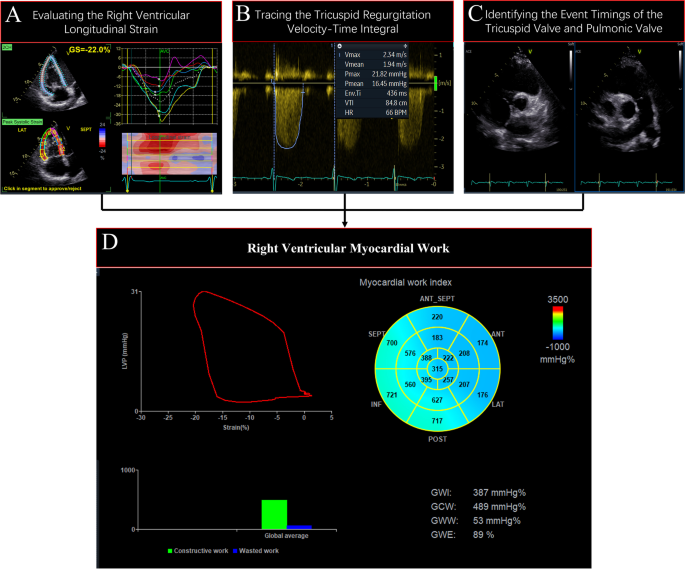
Фракцію викиду ЛШ, TAPSE, ФЗП ПШ, Sʹ ПШ, базальний діаметр ПШ та діаметр трикуспідального кільця вимірювали відповідно до чинних рекомендацій [3, 4, 13]. 3D об’єм ПШ та об’єм ПШ отримували за допомогою програмних пакетів 4D Auto RVQ та 4D Auto LAQ відповідно. ГПД ПШ та поздовжню деформацію вільної стінки ПШ (ПДВС ПШ) оцінювали шляхом відстеження ендокардіальної межі міжшлуночкової перегородки та вільної стінки ПШ (зображення 2А) [12].
Зображення 2
Процес розрахунку роботи міокарда правого шлуночка. A Оцінка поздовжньої деформації правого шлуночка. B Відстеження інтегралу швидкості-часу TR для оцінки середнього градієнта тиску між правим шлуночком і передсердям. C Визначення часу відкриття трикуспідального і легеневого клапанів. D Отримання роботи міокарда правого шлуночка за допомогою петлі “тиск-деформація правого шлуночка”.
Систолічний тиск у легеневій артерії (СТЛА) оцінювали за такою формулою: СТЛА= 4 × (пікова швидкість ТР)2 + тиск ПП (оцінений за нижньою порожнистою веною) [3, 14]. Середній градієнтний тиск ПШ-ПП отримували шляхом відстеження інтегралу швидкості-часу ТР (зображення 2В) [15]. Медіана тиску у легеневій артерії (МТЛА) дорівнює тиску в ПП плюс середній градієнтний тиск ПШ-ПП. Діастолічний тиск у легеневій артерії (ДТЛА) розраховували наступним чином: ДТЛА = 1,5 × МТЛА- 0,5 × СТЛА [3]. МРПШ аналізували за допомогою (AFI) програмного пакету оцінки (МРЛШ) міокардіальної роботи ЛШ . Прогностична валідація МРЛШ була виконана в кількох дослідженнях [16,17,18]. Часи подій трикуспідального і легеневого клапанів отримували з візуалізації в короткоосьовій парастернальній проекції (зображення 2C). Потім ГПД ПШ, СТЛА і ДТЛА синхронізували за хронометражем клапанних подій для створення неінвазивної петлі тиску-деформації ПШ (ПТД ПШ) (зображення 2A-D). МРПШ розраховували шляхом інтегрування добутку миттєвого тиску ПШ з часом і швидкості сегментарного скорочення для отримання роботи міокарда як функції часу протягом серцевого циклу.
Чотири індекси МРПШ були отримані наступним чином:
- (i)
- Глобальний індекс роботи ПШ (ГІРПШ): загальна робота, площа ПШ ЛШ від закриття до відкриття тристулкового клапана.
- (ii)
- Глобальна конструктивна робота ПШ (ГКРПШ): позитивна робота, розтягнення міокарда під час ізоволюмічного розслаблення і вкорочення під час систоли.
- (iii)
- ПШ глобальна марна робота (ГМРПШ): негативна робота, вкорочення міокарда під час ізоволюмічного розслаблення і розтягування під час систоли.
- (iv)
- ПШ глобальної ефективності роботи (ПШГЕР): відношення ГКРПШ до суми ГКРПШ і ГМРПШ.
КПВС
КПВС виконували досвідчені інтервенційні кардіологи. Катетер Swan Ganz 6 F вводився через стегнову або внутрішню яремну вену під контролем рентгеноскопії. Систолічний та діастолічний тиск у легеневій артерії, тиск у легеневій артерії та тиск заклинювання в легеневих капілярах вимірювали в кінці видиху. Співвідношення легеневого та системного кровотоку, а також ЛШ та ПШ серцевий викид розраховували за формулою Фіка. УО ПШ розраховували як відношення ПШ серцевого викиду до частоти серцевих скорочень. Індекс УО ПШ та серцеві індекси ЛШ і ПШ розраховували як відношення УО ПШ та серцевого викиду ЛШ і ПШ до площі поверхні тіла відповідно.
Статистика
Категоріальні змінні були виражені у вигляді чисел (відсотків). Нормальність безперервних змінних була перевірена за допомогою тесту Колмогорова-Смірнова. Виходячи з нормальності даних, безперервні змінні були виражені як середнє значення (СВ) або медіана (інтерквартильний розмах), відповідно. Відмінності між ДМПП та контрольною групою порівнювали за допомогою критерію χ2 , t-критерію Стьюдента та U-критерію Манна-Уітні відповідно. Взаємозв’язки між параметрами систолічної функції ПШ та інвазивно-визначеними УО та індексом УО досліджували за допомогою кореляції Пірсона або Спірмена відповідно. Для визначення оптимальних значень відсікання для прогнозування ДМПП та розрахунку площі під ROC-кривою (AUC), чутливості та специфічності було проаналізовано криві операційної характеристики приймача (ROC). П’ятнадцять випадкових пацієнтів з ДМПП були відібрані для розрахунку внутрішньоспостережної та міжспостережної варіабельності за допомогою аналізу Бланда-Альтмана та коефіцієнтів внутрішньокласової кореляції. Всі дані були оброблені за допомогою SPSS (версія 26.0). Двостороннє значення P < 0,05 вважалося показником статистичної значущості.
Результати
Характеристики учасників
П’ятдесят сім пацієнтів з ДМПП були включені в це дослідження (зображення 1). Сорока семи пацієнтам за клінічними показаннями було виконано КПВС. Двадцять дев’ять пацієнтів були включені в остаточний аналіз, а решта пацієнтів були виключені на основі критеріїв виключення. Ще 29 осіб без серцево-судинних і легеневих захворювань склали контрольну групу. Клінічні характеристики наведені в таблиці 1.
Таблиця 1 Клінічні характеристики пацієнтів з ДМПП та здорових осіб
| Змінні | ДМПП (n = 29) | Контроль (n = 29) | P-value |
| Чоловік, n (%) | 6 (21%) | 6 (21%) | 1.000 |
| Вік (років) | 49.0 (32.0–58.0) | 49.0 (34.5–51.0) | 0.688 |
| Зріст (см) | 160.4 ± 7.4 | 161.6 ± 6.1 | 0.488 |
| Вага (кг) | 57.0 (53.5–62.5) | 58.0 (52.5–62.0) | 0.651 |
| ІМТ (м/кг2) | 23.1 (20.9–25.1) | 22.0 (20.1–23.6) | 0.240 |
| ППТ (м2) | 1.56 (1.53–1.68) | 1.61 (1.52–1.67) | 0.779 |
| САТ (мм рт.ст.) | 125 (116–142) | 126 (107–133) | 0.259 |
| ДТЛА (мм рт.ст.) | 78 ± 11 | 74 ± 10 | 0.134 |
| Гіпертензія, n (%) | 6 (21%) | ||
| Гіперліпідемія, n (%) | 11 (42%) | ||
| Діабет, n (%) | 4 (15%) | ||
| III або IV клас за NYHA, n (%) | 5 (19%) | ||
| NT-proBNP (пг/мл) | 60.3 (34.8–128.0) |
- Дані представлені як середнє значення ± СВ або медіана (інтерквартильний розмах), або як кількість (відсоток). ДМПП Дефект міжпередсердної перегородки, ІМТ Індекс маси тіла, ППТ Площа поверхні тіла, ДТЛА Діастолічний легеневої артерії, NT-proBNP мозковий натрійуретичний пептид , NYHA Нью-Йоркська асоціація серця, САТ Систолічний артеріальний тиск
Дані ехокардіографічного дослідження
Усі пацієнти мали кольорові доплерівські шунти зліва направо, а медіана розміру ДМПП становила 11,0 (8,0-18,5) мм. У таблиці 2 наведено ехокардіографічні параметри пацієнтів з ДМПП та контрольної групи. TAPSE, ПШ Sʹ, 3D кінцево-діастолічний об’єм ПШ, 3D кінцево-систолічний об’єм ПШ, 3D УО ПШ, базальний діаметр ПШ, діаметр трикуспідального кільця, 3D об’єм ПП, тиск у легеневій артерії та ГПД ПШ були вищими в групі ДМПП 3D УО ПШ. ФВ ЛШ, ФЗП ПШ, 3D ФВ ПШ і ГПД ПШ достовірно не відрізнялися між двома групами. Пацієнти з ДМПП мали вищі показники ГІРПШ, КДРПШ та ГМРПШ порівняно з контрольною групою (ГІРПШ: 571,7 ± 203,2 мм рт.ст. проти 311,2 ± 98,7 мм рт.ст., P < 0,001; ДГРПШ: 690,8 ± 254,8 мм рт.ст. проти 361,5 ± 101,3 мм рт.ст., P < 0,001; ГМРПШ: 56,0 [37,5-75,0] мм рт.ст. проти 22,0 [9,0-37,5] мм рт.ст., P < 0,001), тоді як ГЕРПШ не виявила достовірної різниці між пацієнтами з ДМПП та контролем.
Таблиця 2 Порівняння ехокардіографічних параметрів між пацієнтами з ДМПП та контрольною групою
| Змінні | ДМПП (n = 29) | Контроль (n = 29) | P-value |
| ФВЛШ (%) | 63.6 ± 3.4 | 64.7 ± 2.9 | 0.173 |
| TAPSE (mm) | 25.4 ± 3.6 | 20.2 ± 3.6 | <0.001 |
| ФЗП ПШ (%) | 46.6 ± 3.7 | 47.1 ± 4.4 | 0.689 |
| ПШ Sʹ (cm/s) | 15.0 ± 3.0 | 13.1 ± 1.8 | 0.004 |
| 3D ПШ кінцевий діастолічний об’єм (мл) | 153 (117–193) | 91 (79–98) | <0.001 |
| 3D ПШ кінцевий систолічний об’єм (мл) | 67 (44–80) | 37 (34–40) | <0.001 |
| 3D Ударний об’єм ПШ (мл) | 89 ± 25 | 53 ± 7 | <0.001 |
| 3D ФВ ПШ (%) | 57.6 ± 3.3 | 58.6 ± 1.9 | 0.140 |
| Базальний діаметр ПШ (мм) | 44.7 ± 7.8 | 34.4 ± 3.7 | <0.001 |
| Діаметр ТК (мм) | 36.8 ± 6.2 | 26.9 ± 3.7 | <0.001 |
| 3D максимальний об’єм ПШ (мл) | 50 (43–64) | 36 (34–39) | <0.001 |
| СТЛА (мм рт.ст.) | 35.4 (29.1–48.4) | 21.9 (18.6–25.6) | <0.001 |
| ДТЛА (мм рт.ст.) | 21.1 (18.0-27.3) | 16.3 (13.6–18.6) | <0.001 |
| МТЛА (мм рт.ст.) | 25.9 (22.2–34.2) | 13.6 (11.2–15.7) | <0.001 |
| ПШ ФВЛШ(%) | -25.2 ± 3.8 | -24.4 ± 3.5 | 0.401 |
| ГПД ПШ (%) | -22.3 ± 3.0 | -20.7 ± 2.6 | 0.030 |
| ГІРПШ (мм рт.ст.%) | 571.7 ± 203.2 | 311.2 ± 98.7 | <0.001 |
| ГКРПШ (мм рт.ст.%) | 690.8 ± 254.8 | 361.5 ± 101.3 | <0.001 |
| ГМРПШ (мм рт.ст.%) | 56.0 (37.5–75.0) | 22.0 (9.0-37.5) | <0.001 |
| ГЕРПШ (%) | 91.0 (89.0–93.0) | 92.0 (89.0–97.0) | 0.214 |
- Дані представлені як середнє значення ± СВ або медіана (інтерквартильний розмах). 3D Тривимірний, ДМПП Дефект міжпередсердної перегородки, ДАТ Діастолічний тиск в легеневій артерії, ФВ Фракція викиду, ФЗП Фракційна зміна площі, ГПД Глобальна поздовжня деформація, ФВЛШ Фракція викиду лівого шлуночка, МТЛА Медіана тиску в легеневій артерії, ПП Праве передсердя, ПШ Правий шлуночок, ГКРПШ глобальна конструктивна робота, ГЕРПШ глобальна ефективність роботи, ГІРПШ глобальний індекс роботи, ГМРПШ глобальна марна робота, Sʹ, систолічна швидкість бічного кільця трикуспідального кільця, отримана за допомогою тканинної доплерографії, СТЛА систолічний тиск у легеневій артерії, ТК трикуспідальне кільце, TAPSE TК систолічна екскурсія у площині трикуспідального кільця
Характеристики КПВС
Дані КПВС пацієнтів з ДМПП узагальнені в таблиці 3. У пацієнтів з ДМПП були збільшені УО ПШ (114,7 ± 37,9 мл), індекс УО ПШ (71,2 ± 24,0 мл/м2), ПШ серцевий викид (8,9 ± 3,7 л/хв), ПШ серцевий індекс (5,5 ± 2,4 л/хв/м2). СТЛА, розрахований за допомогою КПВС, не мав вірогідних відмінностей від СТЛА, визначеного за допомогою ехокардіографії (38,0 [29,0-48,5] мм рт.ст. проти 35,4 [29,1-48,4] мм рт.ст., P = 0,320). Середнє співвідношення Qp/Qs становило 1,9 ± 0,8 у пацієнтів з ДМПП.
Таблиця 3 Характеристика КПВС пацієнтів з ДМПП
| Змінні | n = 29 |
| СТЛА, отриманий за допомогою КПВС (мм рт.ст.) | 38.0 (29.0-48.5) |
| ДТЛА, отриманий за допомогою КПВС (мм рт.ст.) | 7.0 (6.0-13.5) |
| МТЛА, отримана за допомогою КПВС (мм рт.ст.) | 19.0 (15.0–25.0) |
| Ударний об’єм ПШ (мл) | 114.7 ± 37.9 |
| Індекс ударного об’єму ПШ (мл/м2) | 71.2 ± 24.0 |
| Серцевий викид ПШ (л/хв) | 8.9 ± 3.7 |
| Серцевий індекс ПШ (Л/хв/м2) | 5.5 ± 2.4 |
| Серцевий викид ЛШ (л/хв) | 4.9 ± 1.6 |
| Серцевий індекс ЛШ (Л/хв/м2) | 3.0 ± 1.0 |
| ТЗЛК (мм рт.ст.) | 8.6 ± 2.9 |
| Qp/Qs | 1.9 ± 0.8 |
- Дані представлені як середнє значення ± СВ або медіана (інтерквартильний розмах). ДМПП Дефект міжпередсердної перегородки, ДТЛА Діастолічний тиск у легеневій артерії, ЛШ Лівий шлуночок, МТЛА Медіана тиску у легеневій артерії, ТЗЛК Тиск заклинювання в легеневих капілярах, Qp/Qs Відношення легеневого до системного кровотоку, КПВС Катетеризація правих відділів серця, ПШ Правий шлуночок, СТЛА Систолічний тиск в легеневій артерії
Взаємозв’язок між показниками систолічної функції ПШ та параметрами КПВС
У групі ДМПП були розраховані кореляційні зв’язки між визначеними за допомогою КПВС УО та індексом УО і ехокардіографічними параметрами систолічної функції ПШ (табл. 4). За винятком ГПД ПШ, яка достовірно корелювала з УО ПШ та індексом УО ПШ (r = -0,478, P = 0,009 та r = -0,488, P = 0. 007 відповідно), жоден зі стандартних ехокардіографічних параметрів систолічної функції ПШ не мав значущої кореляції з УО ПШ або індексом УО ПШ. Однак ГІРПШ продемонструвала помірні кореляції з УО ПШ та індексом УО (r = 0,503, P = 0,005 та r = 0,521, P = 0,004 відповідно), ГКРПШ – слабкі кореляції з УО ПШ та індексом УО (r = 0. 440, P = 0,017 та r = 0,461, P = 0,012 відповідно), а ГМРПШ – слабкі кореляційні зв’язки з УО ПШ а індексом УО (r = 0,444, P = 0,016 та r = 0,410, P = 0,027 відповідно).
Таблиця 4 Кореляції між ехокардіографічними параметрами систолічної функції ПШ та інвазивним ударним об’ємом та індексом ударного об’єму
| r | КПВС stroke volume | P-value | КПВС stroke volume index | P-value |
| TAPSE | 0.321 | 0.089 | 0.226 | 0.238 |
| ФЗМ ПШ | 0.326 | 0.084 | 0.290 | 0.127 |
| ПШ Sʹ’ | 0.360 | 0.055 | 0.319 | 0.092 |
| 3D ФВ ПШ | 0.032 | 0.870 | 0.002 | 0.991 |
| ПШ ФВЛШ | -0.313 | 0.098 | -0.339 | 0.072 |
| ГПД ПШ | -0.478 | 0.009 | -0.488 | 0.007 |
| ГІРПШ | 0.503 | 0.005 | 0.521 | 0.004 |
| ГКРПШ | 0.440 | 0.017 | 0.461 | 0.012 |
| ГМРПШ | 0.444 | 0.016 | 0.410 | 0.027 |
| ГЕРПШ | 0.106 | 0.586 | 0.114 | 0.557 |
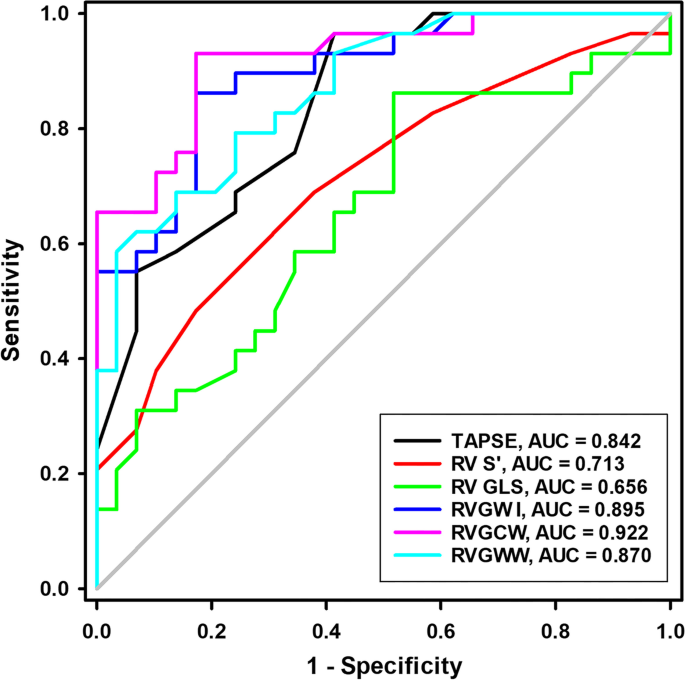
ROC-аналіз
Було проведено ROC-аналіз, щоб визначити, чи можуть стандартні ехокардіографічні параметри та показники МРПШ ідентифікувати пацієнтів з ДМПП (табл. 5; зображення 3). ROC-аналіз показав, що оптимальними точками відсікання TAPSE, ПШ Sʹ, ГПД ПШ, ГКРПШ, ГІРПШ та ГМРПШ були 20,2 мм (AUC = 0. 842), 13,5 см/с (AUC = 0,713), -19,8% (AUC = 0,656), 376,5 мм рт.ст. (AUC = 0,895), 430,0 мм рт.ст. (AUC = 0,922) та 45,5 мм рт.ст. (AUC = 0,870) відповідно.
Таблиця 5 ROC-аналіз ехокардіографічних параметрів для виявлення дефекту міжпередсердної перегородки
| Зміннні | AUC (СП) | P-value | AUC (95% ДІ ) | Значення відсікання | Чутливість | Специфічність |
| TAPSE (мм) | 0.842 (0.050) | <0.001 | 0.744–0.940 | 20.2 | 96.6% | 58.6% |
| ПШ-ФЗП (%) | 0.499 (0.080) | 0.994 | 0.342–0.656 | 43.9 | 86.2% | 37.9% |
| ПШ Sʹ (см/с) | 0.713 (0.068) | 0.005 | 0.580–0.846 | 13.5 | 69.0% | 62.1% |
| 3D ФВ ПШ (%) | 0.365 (0.077) | 0.078 | 0.215–0.516 | 61.6 | 20.7% | 96.6% |
| ПДВС ПШ (%) | 0.553 (0.077) | 0.489 | 0.403–0.703 | -25.4 | 48.3% | 69.0% |
| ГПД ПШ (%) | 0.656 (0.073) | 0.042 | 0.514–0.798 | -19.8 | 86.2% | 48.3% |
| ГІРПШ (мм рт.ст.%) | 0.895 (0.040) | <0.001 | 0.816–0.974 | 376.5 | 86.2% | 82.8% |
| ГКРПШ (мм рт.ст.%) | 0.922 (0.034) | <0.001 | 0.855–0.989 | 430.0 | 93.1% | 82.8% |
| ГМРПШ (мм рт.ст.%) | 0.870 (0.045) | <0.001 | 0.782–0.957 | 45.5 | 69.0% | 86.2% |
| ГЕРПШ (%) | 0.405 (0.077) | 0.216 | 0.255–0.556 | 87.5 | 86.2% | 17.2% |
- 3D Тривимірний, AUC Площа під кривою робочої характеристики приймача, ДІ Довірчий інтервал, ФВ Фракція викиду, ФЗП Фракційна зміна площі, ПДВС Поздовжня деформація вільної стінки, ГПД Глобальна поздовжня деформація. ROC Робоча характеристика приймача, ПШ Правий шлуночок, ГКРПШ глобальна конструктивна робота, ГЕРПШ глобальна ефективність роботи, ГІРПШ глобальний індекс роботи, ГМРПШ Глобальні марна робота, ПШ S’ Систолічна швидкість трикуспідального бічного кільця, визначена за допомогою тканинної доплерографії, СП Стандартна похибка, TAPSE Систолічна екскурсія трикуспідального кільця
Зображення 3
Аналіз робочих характеристик приймачів TAPSE, ПШ Sʹ, ГПД ПШ, ГІРПШ, ГМРПШ та ГЕРПШ для прогнозування дефекту міжпередсердної перегородки. ГПД – глобальна поздовжня деформація; ПШ – правий шлуночок; ГКРПШ – глобальна конструктивна робота ПШ; ГЕРПШ – глобальна ефективність роботи ПШ; ГІРПШ – глобальний індекс роботи ПШ; ГМРПШ, глобальна марна робота ПШ; ПШ Sʹ, Систолічна швидкість трикуспідального бічного кільця, визначена за допомогою тканинної доплерографії; TAPSE, Систолічна екскурсія трикуспідального кільця
Внутрішньоспостережна та міжспостережна варіабельність індексів МРПШ
Внутрішньоспостережна та міжспостережна варіабельність ГІРПШ, ГКРПШ, ГМРПШ та ПШГВЕ представлена в таблиці 6, що свідчить про добру відтворюваність.
Таблиця 6 Внутрішньо- та міжспостережна варіабельність неінвазивних показників роботи міокарда ПШ
| Внутрішньоспостережна варіабельність (n = 15) | Варіабельність між спостерігачами (n = 15) | |||||
| Bias | 95% CI | ICC | Bias | 95% CI | ICC | |
| ГІРПШ (мм рт.ст.%) | 1.5 | -54.0 to 57.1 | 0.971 | -7.2 | -51.8 to 37.4 | 0.982 |
| ГКРПШ (мм рт.ст.%) | 3.5 | -44.7 to 51.7 | 0.986 | -0.7 | -41.9 to 40.6 | 0.990 |
| ГМРПШ (мм рт.ст.%) | -0.1 | -23.0 to 22.8 | 0.850 | 1.4 | -20.4 to 23.2 | 0.849 |
| ГЕРПШ (%) | 0.1 | -2.5 to 2.7 | 0.849 | -0.1 | -2.9 to 2.6 | 0.830 |
- ДІ Довірчий інтервал, ВККК Внутрішньокласовий коефіцієнт кореляції, ПШ Правошлуночковий, ГКРПШ глобальна конструктивна робота, ГЕРПШ глобальна ефективність роботи, ГІРПШ глобальний індекс роботи, ГМРПШ глобальна марна робота ПШ
Обговорення
Це дослідження є доказовим дослідженням для визначення доцільності використання неінвазивного визначення МРПШ у пацієнтів з ДМПП. Оцінка МРПШ може покращити розуміння патофізіології систолічної функції міокарда ПШ у пацієнтів з ДМПП.
Зміни параметрів систолічної функції ПШ при ДМПП
У нашому дослідженні ФЗП ПШ не виявила достовірної різниці між пацієнтами з ДМПП та контрольною групою, що узгоджується з даними попередніх досліджень [19]. TAPSE та ПШ Sʹ були вищими у пацієнтів з ДМПП, ніж у контрольній групі, що узгоджується з даними попередніх досліджень [20, 21].
У пацієнтів з ДМПП спостерігалося підвищене об’ємне навантаження на правий шлуночок, що в подальшому призводило до розширення порожнини ПШ [22, 23]. Однак 3D ФВ ПШ у пацієнтів з ДМПП достовірно не відрізнялася від такої в контролі, що може бути пов’язано зі збереженою скоротливістю ПШ при об’ємному перевантаженні ПШ протягом тривалого часу [24]. Крім того, ГПД ПШ не виявив достовірної різниці між пацієнтами з ДМПП і контролем, і цей результат узгоджується з дослідженням Dragulescu та співавт. [21]. Однак ГПД ПШ була гіршою у пацієнтів з ДМПП, ніж у контрольній групі, можливо, тому, що дилатація ПШ при підвищеному переднавантаженні призводила до посилення напруження міжшлуночкової перегородки.
Підвищене переднавантаження ПШ у пацієнтів з ДМПП призводить до збільшення об’єму крові в легеневому кровообігу і, в кінцевому рахунку, збільшує постнавантаження [25]. ГІРПШ і КДРПШ відображають позитивну роботу міокарда і збільшуються зі збільшенням постнавантаження. Більше того, збільшення ГМРПШ може бути пов’язане з ремоделюванням кардіоміоцитів при тривалому навантаженні та міокардіальною дисинхронією в стані підвищеного післянавантаження ПШ [26]. Однак не було виявлено достовірної різниці в ГЕРПШ між пацієнтами з ДМПП та контрольною групою. Це свідчить про те, що глобальна систолічна продуктивність міокарда ПШ може бути добре збережена при довготривалих навантаженнях потужності, а також при навантаженнях тиску у пацієнтів з ДМПП.
Перевага визначення МРПШ в оцінці систолічної функції ПШ
Порівняно з TAPSE, ФЗП ПШ, ПШ Sʹ і поздовжньою деформацією ПШ, МРПШ інтегрує систолічну функцію міокарда, тиск ПШ і серцевий цикл в ПТД ПШ. Функція правого шлуночка є більш чутливою до післянавантаження, ніж функція лівого шлуночка [6]. Крім того, суттєвий вплив на функцію ПШ має дисинхронія ПШ [27, 28]. Теоретично, комплексна оцінка систолічної функції ПШ може бути отримана на основі чотирьох індексів МРПШ.
За винятком ГПД ПШ, жоден зі стандартних ехокардіографічних параметрів не мав достовірної кореляції з УО або індексом УО, визначеними за допомогою КПВС. І навпаки, ГІРПШ, ГКРПШ і ПШГВЕ показали позитивні кореляції з УО та індексом УО, визначеними за допомогою КПВС. Згідно з ROC-аналізом, ГІРПШ, ГКРПШ і ПШГВЕ можна вважати добрими предикторами ДМПП і кращими за залежну від навантаження ГПД ПШ. Хоча кореляції між трьома індексами МРПШ і зумовленими КПВС УО ПШ та УО є слабкими та помірними, визначення МРПШ є найкращим неінвазивним методом оцінки систолічної функції ПШ у пацієнтів з ДМПП порівняно зі стандартними індексами систолічної функції ПШ.
Клінічні застосування
Для дослідження скоротливої здатності міокарда ПШ у пацієнтів з ДМПП використовували традиційні ехокардіографічні параметри систолічної функції ПШ, але жоден з цих параметрів не враховував вплив перед- або післянавантаження на правий шлуночок [19, 21, 29,30,31]. Оскільки післянавантаження ПШ відображається в МРПШ, останнє може розширити ехокардіографічну оцінку функції ПШ у пацієнтів з нелікованою ДМПП.
Обмеження
Це одноцентрове дослідження, і розмір вибірки пацієнтів з ДМПП був невеликим. Неінвазивне визначення МРПШ не було підтверджене радіонуклідною вентрикулографією або серцево-судинним магнітним резонансом. Крім того, визначення МРПШ проводили за допомогою платформи одного постачальника, спеціально розробленої для визначення МРЛШ. ГПД ПШ розраховували шляхом вимірювання деформації міжшлуночкової перегородки та вільної стінки ПШ через нерегулярну та складну анатомію ПШ [32]. Тому МРЛШ, отримана за допомогою ПТД ПШ, не є такою ж точною, як МРЛШ, визначена за допомогою петлі “тиск – деформація ЛШ” [16]. Більше того, неінвазивне визначення МРПШ повинне бути валідизоване інвазивною ПТД ПШ в майбутньому.
Висновки
ГІРПШ, ГКРПШ і ГМРПШ є можливими показниками, які оцінюють систолічну функцію ПШ і корелюють з УО та індексом УО, зумовленими КПВС, у пацієнтів з ДМПП. Неінвазивне визначення МРПШ може прогнозувати систолічну функцію ПШ і корелювати з УО та індексом УО, зумовленими КПВС, у пацієнтів з ДМПП, з можливими прогностичними наслідками. Для підтвердження клінічної ролі неінвазивного визначення МРПШ необхідні подальші дослідження.
Абревіатури
ДМПП:
Дефект міжпередсердної перегородки
ПШ:
Правий шлуночок
TAPSE:
Систолічна екскурсія трикуспідального кільця
ФЗП ПШ:
Фракційна зміна площі ПШ
ПШ Sʹ:
Систолічна швидкість бічного кільця трикуспідального кільця, отримана за допомогою тканинної доплерографії
3D:
Тривимірний
ФВ ПШ:
Фракція викиду ПШ
ГПД ПШ:
Глобальна поздовжня деформація ПШ
МРПШ:
Міокардіальна робота правого шлуночка
КПВС:
Катетеризація правих відділів серця
ЛШ:
Лівий шлуночок
ТР:
Трикуспідальна регургітація
ПП:
Праве передсердя
СТЛА:
Систолічний тиск у легеневій артерії
МТЛА:
Медіана тиску у легеневій артерії
ДТЛА:
Діастолічний тиск легеневої артерії
МРЛШ:
Міокардіальна робота ЛШ
ПТД ПШ:
Петля тиску і деформації ПШ
ГІРПШ:
Глобальний індекс роботи ПШ
ГКРПШ:
Глобальна конструктивна робота ПШ
ГМРПШ:
Глобальна марна робота ПШ
ГЕРПШ:
Глобальна ефективність роботи ПШ
УО:
Ударний об’єм
ROC:
Робоча характеристика приймача
Посилання на джерела
- Geva T, Martins JD, Wald RM. Atrial septal defects. Lancet. 2014;383:1921–32.
- Botto LD, Correa A, Erickson JD. Racial and temporal variations in the prevalence of heart defects. Pediatrics. 2001;107:E32.
- Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the canadian society of Echocardiography. J Am Soc Echocardiogr. 2010;23:685–713. quiz 86 – 8.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28:1–39. e14.
- Houard L, Benaets MB, de Meester de Ravenstein C, Rousseau MF, Ahn SA, Amzulescu MS, et al. Additional prognostic value of 2D right ventricular speckle-tracking strain for prediction of Survival in Heart failure and reduced ejection fraction: a comparative study with Cardiac magnetic resonance. JACC Cardiovasc Imaging. 2019;12:2373–85.
- Walker LA, Buttrick PM. The right ventricle: biologic insights and response to disease: updated. Curr Cardiol Rev. 2013;9:73–81.
- Butcher SC, Fortuni F, Montero-Cabezas JM, Abou R, El Mahdiui M, van der Bijl P, et al. Right ventricular myocardial work: proof-of-concept for non-invasive assessment of right ventricular function. Eur Heart J Cardiovasc Imaging. 2021;22:142–52.
- Wu J, Huang X, Huang K, Gao Q, Tian Y, Lin B, et al. Correlations among noninvasive right ventricular myocardial work indices and the main parameters of systolic and diastolic functions. J Clin Ultrasound. 2022;50:873–84.
- Hahn RT, Zamorano JL. The need for a new tricuspid regurgitation grading scheme. Eur Heart J Cardiovasc Imaging. 2017;18:1342–3.
- Mandras SA, Mehta HS, Vaidya A. Pulmonary Hypertension: A Brief Guide for Clinicians. Mayo Clin Proc. 2020;95:1978–88.
- Mitchell C, Rahko PS, Blauwet LA, Canaday B, Finstuen JA, Foster MC, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2019;32:1–64.
- Badano LP, Kolias TJ, Muraru D, Abraham TP, Aurigemma G, Edvardsen T, et al. Standardization of left atrial, right ventricular, and right atrial deformation imaging using two-dimensional speckle tracking echocardiography: a consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging. 2018;19:591–600.
- Zaidi A, Oxborough D, Augustine DX, Bedair R, Harkness A, Rana B, et al. Echocardiographic assessment of the tricuspid and pulmonary valves: a practical guideline from the british Society of Echocardiography. Echo Res Pract. 2020;7:G95–G122.
- Vazquez de Prada JA, Ruano J, Martin-Duran R, Larman M, Zueco J, Ortiz de Murua JA, et al. Noninvasive determination of pulmonary arterial systolic pressure by continuous wave Doppler. Int J Cardiol. 1987;16:177–84.
- Aduen JF, Castello R, Lozano MM, Hepler GN, Keller CA, Alvarez F, et al. An alternative echocardiographic method to estimate mean pulmonary artery pressure: diagnostic and clinical implications. J Am Soc Echocardiogr. 2009;22:814–9.
- Russell K, Eriksen M, Aaberge L, Wilhelmsen N, Skulstad H, Remme EW, et al. A novel clinical method for quantification of regional left ventricular pressure-strain loop area: a non-invasive index of myocardial work. Eur Heart J. 2012;33:724–33.
- Hubert A, Le Rolle V, Leclercq C, Galli E, Samset E, Casset C, et al. Estimation of myocardial work from pressure-strain loops analysis: an experimental evaluation. Eur Heart J Cardiovasc Imaging. 2018;19:1372–9.
- Edwards NFA, Scalia GM, Shiino K, Sabapathy S, Anderson B, Chamberlain R, et al. Global myocardial work is Superior to Global Longitudinal strain to predict significant coronary artery disease in patients with normal left ventricular function and Wall Motion. J Am Soc Echocardiogr. 2019;32:947–57.
- Kowalik E, Kowalski M, Hoffman P. Is right ventricular myocardial deformation affected by degree of interatrial shunt in adults? Eur J Echocardiogr. 2011;12:400–5.
- Schroh AM, Laghezza LB, Dominguez PJ, Brandan V, Nento DE, Alvarez E, et al. Pattern of pulmonary venous flow in patients with ostium secundum atrial septal defect. Eur J Echocardiogr. 2009;10:244–9.
- Dragulescu A, Grosse-Wortmann L, Redington A, Friedberg MK, Mertens L. Differential effect of right ventricular dilatation on myocardial deformation in patients with atrial septal defects and patients after tetralogy of Fallot repair. Int J Cardiol. 2013;168:803–10.
- Vitarelli A, Sardella G, Roma AD, Capotosto L, De Curtis G, D’Orazio S, et al. Assessment of right ventricular function by three-dimensional echocardiography and myocardial strain imaging in adult atrial septal defect before and after percutaneous closure. Int J Cardiovasc Imaging. 2012;28:1905–16.
- Redington AN, Rigby ML, Shinebourne EA, Oldershaw PJ. Changes in the pressure-volume relation of the right ventricle when its loading conditions are modified. Br Heart J. 1990;63:45–9.
- Szabo G, Soos P, Bahrle S, Radovits T, Weigang E, Kekesi V, et al. Adaptation of the right ventricle to an increased afterload in the chronically volume overloaded heart. Ann Thorac Surg. 2006;82:989–95.
- Konstam MA, Kiernan MS, Bernstein D, Bozkurt B, Jacob M, Kapur NK, et al. Evaluation and management of right-sided heart failure: a Scientific Statement from the American Heart Association. Circulation. 2018;137:e578–e622.
- Sanz J, Sanchez-Quintana D, Bossone E, Bogaard HJ, Naeije R. Anatomy, function, and dysfunction of the right ventricle: JACC state-of-the-art review. J Am Coll Cardiol. 2019;73:1463–82.
- Badagliacca R, Poscia R, Pezzuto B, Papa S, Gambardella C, Francone M, et al. Right ventricular dyssynchrony in idiopathic pulmonary arterial hypertension: determinants and impact on pump function. J Heart Lung Transplant. 2015;34:381–9.
- Marcus JT, Gan CT, Zwanenburg JJ, Boonstra A, Allaart CP, Gotte MJ, et al. Interventricular mechanical asynchrony in pulmonary arterial hypertension: left-to-right delay in peak shortening is related to right ventricular overload and left ventricular underfilling. J Am Coll Cardiol. 2008;51:750–7.
- Pauliks LB, Chan KC, Chang D, Kirby SK, Logan L, DeGroff CG, et al. Regional myocardial velocities and isovolumic contraction acceleration before and after device closure of atrial septal defects: a color tissue Doppler study. Am Heart J. 2005;150:294–301.
- Van De Bruaene A, Buys R, Vanhees L, Delcroix M, Voigt JU, Budts W. Regional right ventricular deformation in patients with open and closed atrial septal defect. Eur J Echocardiogr. 2011;12:206–13.
- Moceri P, Duchateau N, Gillon S, Jaunay L, Baudouy D, Squara F, et al. Three-dimensional right ventricular shape and strain in congenital heart disease patients with right ventricular chronic volume loading. Eur Heart J Cardiovasc Imaging. 2021;22:1174–81.
- Sheehan F, Redington A. The right ventricle: anatomy, physiology and clinical imaging. Heart. 2008;94:1510–5.