Резюме
Предусловия
Лапароскопическая операция (ЛО) все чаще применяется при перихилярной холангиокарциноме (ПХХК). В этом исследовании мы намерены сравнить краткосрочные результаты ЛО и Открытых хирургических операций (ОО) при ПХХК в многоцентровой практике в Китае.
Методы
Этот реальный анализ включал 645 пациентов с ПХХК, которым проводили лапароскопические и открытые операции в 11 центрах-участниках в Китае в период с января 2013 года по январь 2019 года. Сравнительный анализ проводился до и после согласования оценки склонности (СОС) в группах ЛО и ОО, а также в подгруппах висмута. Для выявления значимых прогностических факторов неблагоприятных хирургических результатов и послеоперационной продолжительности пребывания в стационаре (ППС) были использованы одномерные и многомерные модели.
Результаты
Среди 645 пациентов с ПХХК, 256 выполнили ЛО и 389 – OО. В группе ЛО наблюдали меньшее количество гепатикоеюностомий (30,89% против 51,40%, P = 0,006), меньшую потребность в билиарной пластике (19,51% против 40,16%, P = 0,001), более короткий ППС (в среднем 14,32 против 17,95 д, P < 0,001) и меньшее количество тяжелых осложнений (CD ≥ III) (12,11% против 22,88%, P = 0,006) по сравнению с группой ОО. Основные послеоперационные осложнения, такие как кровотечение, желчный свищ, абсцесс брюшной полости и печеночная недостаточность, были сходными между ЛО и ОО (P > 0,05 для всех). После СОС краткосрочные результаты двух хирургических методов были подобными, за исключением более короткого ППС при ЛО по сравнению с ОО (в среднем 15,19 против 18,48 д, P = 0,0007). Серийный анализ подгрупп продемонстрировал, что ЛО является безопасным и имеет преимущества в сокращении ППС.
Заключение
Несмотря на сложные хирургические процедуры, ЛО кажется безопасной и выполнимой для опытных хирургов.
Предусловия
Перихилярная холангиокарцинома (ПХХК) является разрушительным заболеванием, ежегодная заболеваемость которым составляет один-два случая на 100 000 человек [1]. Радикальное хирургическое вмешательство является важнейшим потенциально излечимым методом лечения ПХХК. В то же время, радикальная хирургия, несомненно, является одним из самых сложных и самых совершенных навыков для хирургов [2]. Последние достижения в хирургической технике и периоперационном менеджменте позволили повысить резектабельность и улучшить результаты хирургического вмешательства, однако послеоперационная заболеваемость и смертность остаются проблемой [3].
Лапароскопические операции (ЛО) все чаще применяются при всех видах гепато-панкреато-билиарных резекций, включая панкреатэктомию и гепатэктомию [4,5,6]. В хирургии печени ЛО демонстрирует лучшие послеоперационные результаты по сравнению с открытым доступом [7]. В последнее время растет интерес к выполнению лапароскопической панкреатодуоденэктомии (ПДЭ), которая, как было продемонстрировано, является целесообразной и безопасной, а ее результаты сопоставимы с результатами открытой ПДЭ [8]. Хирургические процедуры при ПХХК предусматривают резекцию перихилярного отдела общего желчного протока с расширенной гепатэктомией, что требует сопутствующей резекции и восстановления сосудов или даже комбинированной гепато-панкреато-дуодентэктомии. Основной проблемой является сложное анатомическое расположение поражения, которое находится в непосредственной близости к воротной вене (ВВ), печеночным артериям и паренхиме печени [9, 10]. Таким образом, сообщений о лапароскопической резекции по поводу ПХХК немного из-за сложности хирургического вмешательства. До сих пор считалось, что лапароскопическая резекция при ПХХК находится в зачаточном состоянии [11]. Однако имеющиеся доказательства по применению лапароскопического доступа при ПХХК ограничены; лапароскопический доступ не может рассматриваться как догматическое противопоказание при ПХХК. Таким образом, крайне важно провести масштабные многоцентровые исследования для изучения технической возможности и безопасности ЛО при ПХХК [12].
В этой работе мы сравнили периоперационные результаты ЛО и открытых операций (ОО) у 654 пациентов с ПХХК в Китае до и после анализа на основе оценки склонности. Насколько нам известно, это самая большая на сегодняшний день серия операций с использованием ЛО по сравнению с ОО при ПХХК, которую исследовали.
Методы
Пациенты и сбор данных
Ретроспективный анализ институциональных баз данных 11 больниц Китая выявил 645 пациентов с ПХХК, перенесших радикальную операцию в период с января 2013 года по январь 2019 года, в том числе 256 пациентов перенесли операции с использованием ЛО и 389 – ОО. Во всех случаях была гистологически подтверждена ПХХК. Критерии исключения были следующими: (1) пациенты с перитонеальным метастазированием или метастазами в печень, парааортальные лимфатические узлы или отдаленные участки; (2) пациенты с гистологией, не похожей на аденокарциному; и (3) пациенты с неполными клиническими данными. Детальный ход исследования показан на рис. 1. Исследование было одобрено этическим комитетом / Институциональным наблюдательным советом этического комитета больницы Тонджи (номер одобрения: TJ-IRB20220531). Необходимость получения информированного согласия была отменена комитетом по вопросам этики / Институциональным наблюдательным советом Комитета по вопросам этики больницы Тунцзи (номер одобрения: TJ-IRB20220531) из-за ретроспективного характера исследования. Это исследование также было зарегистрировано на сайте ClinicalTrials.gov (идентификатор: NCT05402618; дата первой регистрации: 02/06/2022). Вся работа проводилась в соответствии с “Руководством по гендерному и половому равенству в исследованиях – SAGER” и была оформлена в соответствии с критериями STROCSS [13].
Рисунок 1
Ход исследования
Техника проведения операций
ЛО определялась как тотальная лапароскопическая операция (ТЛО), когда и резекция, и реконструкция пищеварительного тракта выполнялись лапароскопически. Гепатэктомия с блочной резекцией хвостовой доли и внепеченочного желчного протока и диссекцией регионарных лимфатических узлов применялась как в лапароскопических, так и в открытых операциях. Расширенные резекции (левая/правая трехсекционная эктомия), артериальное окаймление, резекция/реконструкция сосудов, билиарное стентирование были необходимы пациентам в зависимости от стадии Bismuth.
Переменные и определения
Сбор данных включал демографические, клинические и онкологические данные. Пациенты были распределены по стадиям в соответствии с системой клинического стадирования метастазов в узлы опухоли (TNM) Национальной всеобъемлющей онкологической сети (НВОС), версия 2.2019 г., для ПХХК [14]. Местное распространение заболевания выражалось преимущественно по классификации Bismuth-Corlette [15]. Продолжительность операции определяли как время от разреза кожи или установки троакара до полного зашивания кожи. Интраоперационную кровопотерю (ИКП) тщательно регистрировал анестезиолог с помощью вакуумной системы. Реконструкцию сосудов определяли как любое восстановление или замену магистральных сосудов во время операции. Основным краткосрочным результатом в этом исследовании была послеоперационная продолжительность пребывания в стационаре (ППС), которая определялась как время от операции до выписки. Пациенты, которые находились в стационаре более 30 дней или менее трех дней, будут считаться исключенными из исследования. Другие краткосрочные оценки включали заболеваемость и смертность, которые определялись как любое осложнение или смерть, соответственно, которые произошли во время госпитализации или в течение 90 дней после выписки. Регистрировали повторные операции в течение 30 дней, а послеоперационную заболеваемость оценивали в соответствии с классификацией Clavien-Dindo (CD) [16]. Основные послеоперационные осложнения, такие как вытекание желчи, послеоперационное кровотечение и печеночная недостаточность, классифицировали, как сообщалось ранее [17,18,19]. Хирургическая неудача определялась как тяжелое осложнение (CD ≥ III), или повторная операция во время госпитализации, или смерть в течение 30 дней после операции.
Статистический анализ
Пациенты, перенесшие ЛО, были сопоставлены с пациентами, перенесшими ОО, в соотношении 1:1 на основе модели оценки склонности [20], где в качестве ковариантов были выбраны возраст, ИМТ, пол, физический статус по ASA, CA 19-9, предоперационный Общий билирубин, АСТ, АЛТ, альбумин, класс по Bismuth-Corlette, гепатэктомия, время операции, реконструкция пищеварительного тракта, ИКП, резекция и реконструкция сосудов, положительный край, количество лимфатических узлов и стадия TNM. Сравнение с ближайшим соседним регионом без замены проводилось с шириной штангенциркуля, установленной на уровне 0,2.
Непрерывные данные представлены как средние значения со стандартными отклонениями (СО) или медианы с интерквартильным размахом (ИКР) и сравниваются с помощью t-критерия для независимых выборок или U-критерия Манна-Уитни. Категориальные данные представлены в виде чисел и процентов и сравнивались с помощью критерия хи-квадрат или точного критерия Фишера, соответственно. Логистический регрессионный анализ использовали для определения факторов риска неблагоприятных послеоперационных осложнений (стадия CD ≥ III). Для оценки факторов риска, связанных с послеоперационной летальностью, использовали регрессионную модель Кокса, при этом предположение о пропорциональном риске проверяли методом взвешенных невязок. Кроме того, учитывая, что послеоперационные осложнения увеличивают продолжительность госпитализации, для изучения прогностических факторов продолжительности пребывания в стационаре была использована модель Файн-Грея, в которой неблагоприятные послеоперационные осложнения и смерть в течение 30 дней были конкурирующими событиями риска. Во время регрессионного анализа непрерывные переменные будут преобразованы в две или несколько категорий фиктивных переменных в соответствии с нормальным диапазоном. Все статистические процедуры были проведены с использованием программного обеспечения SAS версии 9.40 (SAS Institute, Inc., Cary, NC). Статистически значимой считалась двусторонняя проверка гипотез с заранее определенным уровнем P < 0,05.
Результаты
Участники и исходные характеристики
Исходные демографические характеристики и предоперационная сопутствующая патология включенных 645 резекций гистологически подтвержденного ПХХК приведены в таблице 1. В исходной когорте большинство начальных характеристик были сопоставимыми в группах ЛО и ОО, за исключением большего количества пациентов женского пола (49,61% против 40,36%; P = 0,021), лучшего показателя печеночной функции (более низкие уровни общего билирубина, АСТ и АЛТ) и более низкой стадии по шкале TNM, наблюдавшихся в группе ЛО по сравнению с группой ОО. Для преодоления предвзятости ретроспективного исследования был проведен анализ сопоставления баллов склонности, в котором 141 пациент с ПХХК, перенесший ЛО, был сопоставлен с 141 пациентом, перенесшим ОО. Все исходные характеристики были сбалансированы после СОС.
Таблица 1 Исходные характеристики до и после СОС
| Показатели | Необработанная когорта (N = 645) | Согласованная по оценке склонности когорта (N = 282) | |||||
| ЛО (n = 256) | ОО (n = 389) | P-value | ЛО (N = 141) | ОО (N = 141) | P-value | MSD | |
| Пол, Количество (%) | 1.000 | < 0.01 | |||||
| Мужчина | 129(50.39) | 232(59.64) | 0.021 | 86(60.99) | 86(60.99) | ||
| Женщина | 127(49.61) | 157(40.36) | 55(39.01) | 55(39.01) | |||
| Возраст (лет), среднее (СО) | 62.83(9.70) | 62.10(9.17) | 0.333 | 62.55(9.15) | 63.09(9.03) | 0.624 | 0.06 |
| ИМТ (кг/см2), среднее (СО) | 23.12(3.09) | 22.75(2.80) | 0.112 | 22.92(3.09) | 22.66(2.81) | 0.459 | 0.09 |
| Оценка АОА, количество (%) | 0.872 | 0.471 | 0.05 | ||||
| I | 57(22.27) | 82(21.08) | 39(27.66) | 34(24.11) | |||
| II | 156(60.94) | 245(62.98) | 77(54.61) | 87(61.70) | |||
| III | 43(16.80) | 62(15.94) | 25(17.73) | 20(14.18) | |||
| CA199 (Ед/мл), медиана (ИКР) | 204.40(69.50 ~ 814.70) | 256.00(98.50 ~ 455.00) | 0.791 | 202.30(100.10 ~ 545.80) | 187.60(72.70 ~ 369.80) | 0.843 | 0.02 |
| ОбщБилируб (мкмоль/л), медиана (ИКР) | 47.85(44.10 ~ 53.65) | 131.00(73.10 ~ 230.30) | < 0.001 | 49.70(44.70 ~ 57.30) | 60.50(28.90 ~ 108.80) | 0.798 | 0.03 |
| ЩФ (мкмоль/л), медиана (ИКР) | 362.65(216.40 ~ 451.15) | 327.00(225.00 ~ 462.00) | 0.168 | 345.00(210.00 ~ 440.00) | 269.00(189.30 ~ 424.80) | 0.856 | 0.02 |
| АСТ (мкмоль/л), медиана (ИКР) | 43.00(33.20 ~ 87.60) | 89.00(54.00 ~ 156.30) | < 0.001 | 60.60(35.50 ~ 132.00) | 74.00(46.00 ~ 119.30) | 0.909 | 0.01 |
| АЛТ (мкмоль/л), медиана (ИКР) | 59.10(30.90 ~ 133.65) | 115.30(60.00 ~ 183.90) | < 0.001 | 78.50(36.60 ~ 154.60) | 92.90(56.70 ~ 143.40) | 0.874 | 0.02 |
| Альбумин (мкмоль/л), медиана (ИКР) | 35.60(33.35 ~ 38.45) | 35.90(33.40 ~ 39.20) | 0.639 | 35.60(33.00 ~ 38.20) | 35.60(32.50 ~ 39.60) | 0.928 | 0.01 |
| Количество лимфоузлов, медиана (ИКР) | 12.00(8.00 ~ 16.00) | 14.00(5.00 ~ 21.00) | 0.760 | 12.00(6.00 ~ 18.00) | 13.00(7.00 ~ 17.00) | 0.701 | 0.05 |
| Максимальный размер опухоли (мм), среднее значение (СО) | 3.03(1.35) | 2.89(1.26) | 0.167 | 2.73(1.18) | 2.83(1.29) | 0.492 | 0.08 |
| Предоперационное дренирование желчных путей, количество (%) | 193(75.39) | 268(69.25) | 0.091 | 105(74.47) | 90(64.29) | 0.064 | 0.19 |
| Bismuth-Corlette Тип, Количество (%) | 0.895 | 0.95 | 0.01 | ||||
| I | 72(28.13) | 108(27.76) | 44(31.21) | 39(27.66) | |||
| II | 63(24.61) | 85(21.85) | 24(17.02) | 23(16.31) | |||
| IIIa | 24(9.38) | 35(9.00) | 9(6.38) | 10(7.09) | |||
| IIIb | 33(12.89) | 52(13.37) | 23(16.31) | 27(19.15) | |||
| IV | 64(25.00) | 109(28.02) | 41(29.08) | 42(29.79) | |||
| TNM стадия, Количество (%) | < 0.001 | 0.725 | 0.11 | ||||
| – | 8(3.13) | 9(2.31) | 4(2.84) | 7(4.96) | |||
| I(T1N0M0) | 25(9.77) | 66(16.97) | 22(15.60) | 23(16.31) | |||
| II(T2a/2bN0M0) | 108(42.19) | 148(38.05) | 60(42.55) | 56(39.72) | |||
| IIIA(T3N0M0) | 38(14.84) | 31(7.97) | 8(5.67) | 12(8.51) | |||
| IIIB(T4N0M0) | 30(11.72) | 25(6.43) | 7(4.96) | 11(7.80) | |||
| IVA(T, N2M0) | 34(13.28) | 80(20.57) | 30(21.28) | 23(16.31) | |||
| IVB(T,N,M1) | 13(5.08) | 30(7.71) | 10(7.09) | 9(6.38) | |||
СОС Согласованность оценки склонности, ЛО Лапароскопическая операция, ОО Открытая операция, ИМТ Индекс массы тела, ОбщБилируб Общий билирубин, ЩФ Щелочная фосфатаза, АСТ Аспартатаминотрансфераза, АЛТ Аланинаминотрансфераза
Периоперационные результаты
Перед СОС 19 пациентам (7,42%) была выполнена лапаротомия. Среднее операционное время в группе ЛО было подобным группе ОО (353,4 против 342,1 мин, P = 0,176). Больше пациентов получили гепатэктомию в ЛО по сравнению с ОО (63,67% против 55,53%, P = 0,013), особенно больше левую гемигепатэктомию в ЛО (47,66% против 36,76%). В группе ЛО было выполнено меньше гепатикоеюностомий (39,06% против 61,44%, P < 0,0001), билиарной пластики (28,91% против 48,84%, P < 0,001), сосудистой резекции (8,59% против 23,39%, P < 0,0001) и меньше гепатикоеюностомии (43,48% против 65,48%, P < 0,0001) по сравнению с группой ОО. Показатели R0, ИКП, частота и объем трансфузий, а также каудальная лобэктомия были сходными между группами (табл. 2).
Таблица 2 Интраоперационные результаты до и после СОС
| Показатели | Необработанная когорта (N = 645) | Согласованная по оценке склонности когорта (N = 282) | |||||
| ЛО
(N = 256) |
ОО
(N = 389) |
P-value | ЛО (N = 141) | ОО (N = 141) | P-value | MSD | |
| Конверсия на лапаротомию, количество (%) | 19(7.42) | 0(0.00) | < 0.001* | 11(7.80) | 0(0.00) | < 0.001* | 4.86 |
| Гепатэктомия, количество (%) 0.001* | 0.076* | 0.38 | |||||
| Только желчный проток | 93(36.33) | 173(44.47) | 66(46.81) | 57(40.43) | |||
| Левая гемигепатэктомия | 122(47.66) | 143(36.76) | 47(33.33) | 52(36.88) | |||
| Правая гемигепатэктомия | 19(7.42) | 57(14.65) | 12(8.51) | 25(17.73) | |||
| Левая сегментэктомия | 4(1.56) | 3(0.77) | 2(1.42) | 1(0.71) | |||
| Правая сегментэктомия | 6(2.34) | 2(0.51) | 5(3.55) | 1(0.71) | |||
| Желчный проток и часть гепатэктомии | 12(4.69) | 11(2.83) | 9(6.38) | 5(3.55) | |||
| Продолжительность операции (мин), среднее значение (СО) | 353.39(113.71) | 342.10(96.52) | 0.176 | 359.45(105.47) | 342.43(92.42) | 0.151 | 0.09 |
| Количество лимфатических узлов, среднее значение (СО) | 12(4.06) | 10(3.24) | 0.213 | 12(5.12) | 11(4.31) | 0.542 | 0.08 |
| Резекция сосудов, количество (%) | < 0.001* | < 0.001* | 0.53 | ||||
| Ни одной | 234(91.41) | 298(76.61) | 126(89.36) | 110(78.01) | |||
| Печеночная артерия | 13(5.08) | 23(5.91) | 11(7.80) | 8(5.67) | |||
| Воротная вена | 8(3.13) | 14(3.60) | 3(2.13) | 3(2.13) | |||
| Печеночная артерия и воротная вена | 1(0.39) | 54(13.88) | 1(0.71) | 20(14.18) | |||
| Билиарная пластика, количество (%) | 74(28.91) | 190(48.84) | < 0.001 | 61 (43.3) | 74 (52.5) | 0.153 | 0.11 |
| Реконструкция желчевыводящих путей, количество (%) | < 0.001 | < 0.001 | 0.41 | ||||
| Холедохоеюностомия | 130(56.52) | 126(34.52) | 68(52.71) | 40(30.77) | |||
| Гепатикоеюностомия | 100(43.48) | 239(65.48) | 61(47.29) | 90(69.23) | |||
| Каудальная лобэктомия, количество (%) | 138(54.12) | 220(56.70) | 0.519 | 85(60.71) | 82(58.57) | 0.715 | 0.05 |
| ИКП (мл), медиана (ИКР) | 200.00(100.00 ~ 500.00) | 300.00(200.00 ~ 500.00) | 0.685 | 300.00(150.00 ~ 500.00) | 300.00(150.00 ~ 500.00) | 0.573 | 0.07 |
| Переливание крови во время операции, количество (%) | 80(31.25) | 150(38.56) | 0.0579 | 47(33.33) | 52(36.88) | 0.533 | 0.07 |
| Объем перелитой крови (мл), медиана (ИКР) | 0.00(0.00 ~ 600.00) | 0.00(0.00 ~ 750.00) | 0.9535 | 0.00(0.00 ~ 600.00) | 0.00(0.00 ~ 600.00) | 0.680 | 0.07 |
| R0, No. (%) | 218(85.16) | 341(87.66) | 0.360 | 115(81.56) | 119(84.40) | 0.526 | 0.08 |
СОС Согласованность оценки склонности, ЛО Лапароскопическая операция, ОО Открытая операция, ИКП Интраоперационная кровопотеря
*Точный тест Фишера
Не было достоверных различий по общим послеоперационным осложнениям между двумя группами, за исключением сердечной недостаточности (0,78% против 3,60%, P = 0,0244) и тяжелых осложнений в группе ЛО (12,11% против 22,88%, P = 0,0006). Пациенты в группе ЛО нуждались в более короткой послеоперационной продолжительности удержания дренажной трубки (ППУД) (медиана [ИКР], 8.00 [5.00 ~ 11.00] против 9.00 [6.00 ~ 14.00], P <0.0001) и послеоперационного ППС (медиана [ИКР], 13.00 [10.00 ~ 18.00] против 15.00 [12.00 ~ 23.00], P <0.0001), чем пациенты в группе ОО. Не было достоверной разницы в отношении частоты повторных операций или смерти в течение 30 или 90 дней. Подобная частота некоторых наиболее распространенных послеоперационных осложнений между двумя хирургическими группами все еще была сравнимой в сопоставленной когорте (Таблица 3).
Таблица 3 Послеоперационные результаты в соответствии с разным уровнем ИМТ до и после СОС
| Показатели | Необработанная когорта (N = 645) | Согласованная по оценке склонности когорта (N = 282) | |||||
| ЛО (n = 256) | ОО (n = 389) | P-value * | ЛО (N = 141) | ОО (N = 141) | P-value * | ||
| Серьезные осложнения, количество (%) | |||||||
| Кровотечение | 17(6.64) | 19(4.88) | 0.342 | 10(7.09) | 5(3.55) | 0.185 | |
| Желчный свищ | 19(7.42) | 29(7.46) | 0.988 | 14(9.93) | 7(4.96) | 0.112 | |
| Абсцесс брюшной полости | 20(7.81) | 47(12.08) | 0.082 | 17(12.06) | 17(12.06) | > 0.999* | |
| Печеночная недостаточность | 3(1.17) | 9(2.31) | 0.294 | 2(1.42) | 4(2.84) | 0.684* | |
| Желудочно-кишечный свищ | 1(0.39) | 4(1.03) | 0.653 | 1(0.71) | 4(2.84) | 0.371* | |
| Инфекция разреза | 4(1.56) | 16(4.11) | 0.068 | 3(2.13) | 8(5.67) | 0.124 | |
| Пневмония | 16(6.25) | 28(7.20) | 0.640 | 12(8.51) | 9(6.38) | 0.496 | |
| Почечная недостаточность | 3(1.17) | 10(2.57) | 0.216 | 3(2.13) | 5(3.55) | 0.723* | |
| Сердечная недостаточность | 2(0.78) | 14(3.60) | 0.024 | 2(1.42) | 3(2.13) | > 0.99* | |
| ОРДС | 3(1.17) | 9(2.31) | 0.294 | 3(2.13) | 3(2.13) | > 0.99* | |
| CD стадия ≥ III, количество (%) | 31(12.11) | 89(22.88) | 0.001 | 26(18.44) | 32(22.70) | 0.377 | |
| Повторные операции, количество (%) | 5(1.95) | 7(1.80) | 0.888 | 4(2.84) | 4(2.84) | > 0.99* | |
| Смерть (30 дней), количество (%) | 8(3.13) | 24(6.17) | 0.082 | 7(4.96) | 12(8.51) | 0.235 | |
| Смерть (90д), количество (%) | 12(4.69) | 34(8.74) | 0.050 | 9(6.38) | 15(10.64) | 0.200 | |
| Время внекроватной активности (d), медиана (ИКР) | 4.00(3.00 ~ 7.00) | 5.00(3.00 ~ 7.00) | 0.406 | 4.00(3.00 ~ 7.00) | 4.00(3.00 ~ 6.00) | 0.649 | |
| ППУД (d), медиана (ИКР) | 8.00(5.00 ~ 11.00) | 9.00(6.00 ~ 14.00) | < 0.001 | 8.00(5.00 ~ 12.00) | 9.00(5.00 ~ 13.00) | 0.225 | |
| Время пребывания в отделении интенсивной терапии (d), медиана (ИКР) | 0.00(0.00 ~ 2.00) | 0.00(0.00 ~ 1.00) | 0.137 | 0.00(0.00 ~ 1.00) | 0.00(0.00 ~ 1.00) | 0.762 | |
| ППС (d), медиана (ИКР) | 13.00(10.00 ~ 18.00) | 15.00(12.00 ~ 21.00) | < 0.001 | 14.00(11.00 ~ 19.00) | 15.00(12.00 ~ 23.00) | 0.001 | |
СОС Согласованность оценки склонности, ЛО Лапароскопическая операция, ОО Открытая операция, ОРДС Острый респираторный дистресс-синдром, CD Clavien-Dindo, ППУД Послеоперационная продолжительность удержания дренажной трубки, ППС Послеоперационная продолжительность пребывания в стационаре
*Точный тест Фишера
Послеоперационные результаты в зависимости от класса по Bismuth
В этом исследовании 328 пациентов с ПХХК имели низкий тип по (Bismuth I/II) и 317 – высокий тип по Bismuth (Bismuth III/V), с существенно различными хирургическими характеристиками и послеоперационными краткосрочными результатами. Медиана ППС была значительно короче при низком типе по Bismuth (15 дней; 95% ДИ, 14 ~ 16), чем при высоком типе по Bismuth (18 дней; 95% ДИ, 17 ~ 20, P < 0,0001). Кроме того, у пациентов с I-II типами по Bismuth наблюдались более короткие ППС и ППУД, а также меньшее количество трансфузий во время операции у пациентов, перенесших ЛО, по сравнению с теми, которые перенесли ОО, при этом другие послеоперационные осложнения были сопоставимыми в обеих группах. Среди пациентов с III-V типом по Bismuth, которым было выполнено ЛО, показали сопоставимые или лучшие краткосрочные результаты, чем группа ОО, такие как меньшее общее количество послеоперационных осложнений (39(32,23)86(43,88), P = 0,0393), меньшая продолжительность пребывания в стационаре (среднее количество дней, 14 против 17 дней) и более низкая частота тяжелых осложнений (10,74% против 26,02%), что демонстрирует гарантированную безопасность лапароскопической резекции при высших типах ПХХК по Bismuth. Кроме того, в группе ЛО наблюдали достоверно меньшее количество сосудистых резекций и билиарной пластики.
Анализ подгрупп по неудачам хирургического вмешательства и ППС
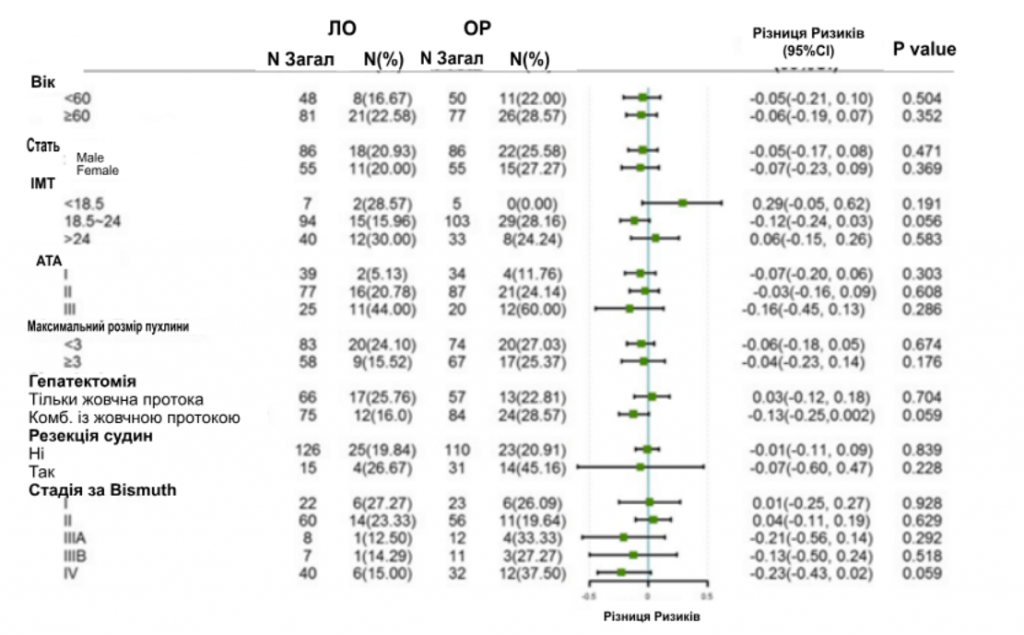
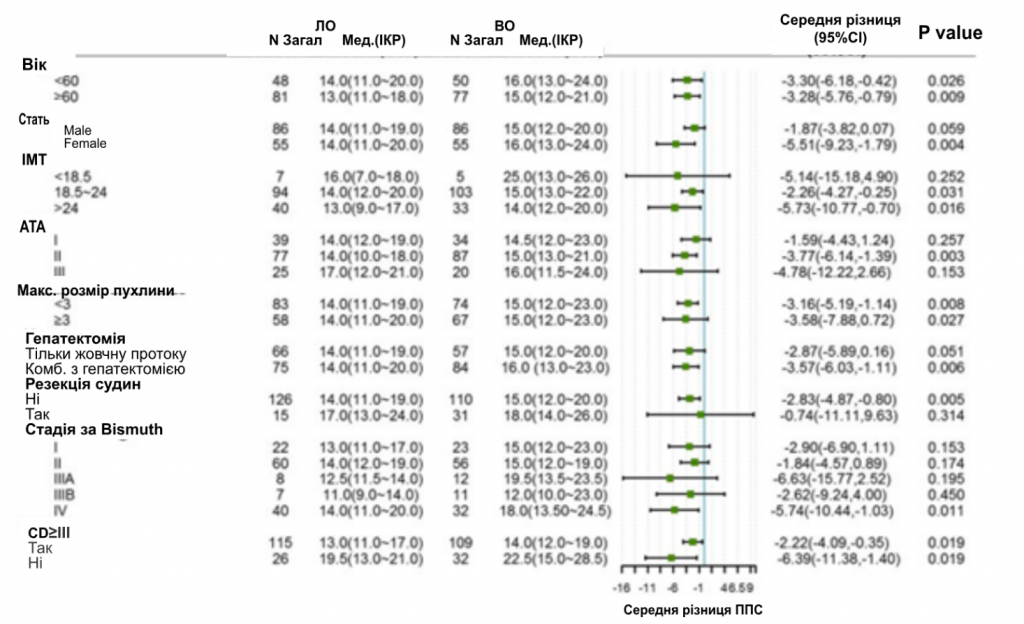
Анализ подгрупп по неудачам хирургического вмешательства и ППС проводили по возрасту, полу, уровню ИМТ, показателю Американского Общества Анестезиологов (АОА), размеру опухоли, гепатэктомии, сосудистой резекции и стадии по Bismuth. После СОС частота хирургических неудач была сходной в группе ЛО по сравнению с группой ОО в целом (4,30% против 7,20%, P = 0,131) и во всех подгруппах (рис. 2). Однако анализ подгрупп по ППС показал, что для быстрого выздоровления пациентам, независимо от возраста, размера опухоли и тяжелых послеоперационных осложнений, будет эффективной ЛО для быстрого выздоровления. Другие пациенты, такие как те, что имели недостаточный вес, I или III степень по шкале АОА или перенесли резекцию сосудов, имели сопоставимые показатели ППС в группе ЛО и ОО (рис. 3).
Рисунок 2
Лесная диаграмма анализа подгрупп по хирургической неудаче. Хирургическая неудача определялась как тяжелое осложнение (CD ≥ III), или повторная операция во время госпитализации, или смерть в течение 30 дней после операции.
Рисунок 3
Лесная диаграмма анализа подгрупп по продолжительности пребывания в стационаре
Анализ риска неблагоприятного хирургического результата и продолжительности пребывания в стационаре
Анализ риска показал, чем выше балл АОА, большая интраоперационная кровопотеря и большее количество сосудистых реконструкций были обнаружены независимыми факторами риска послеоперационных осложнений как среди сопоставленных, так и среди несопоставленных выборок (скорректированное отношение шансов (СОШ) > 1, P < 0,05 для всех) (Таблица 4). Кроме того, мы обнаружили, что ОО, высокий уровень CA19-9, а также некоторые распространенные послеоперационные осложнения и повторная операция были связаны с большей продолжительностью ППС после корректировки других ковариатов в сопоставленной когорте (табл. 5).
Таблица 4 Анализ факторов риска послеоперационных неблагоприятных последствий по данным одномерного и многомерного анализа с использованием необработанной и сопоставленной когорты
| Факторы риска | Необработанная когорта | Согласованная по оценке склонности когорта | ||||||
| Однофакторный анализ | Многофакторный анализ | Однофакторный анализ | Многофакторный анализ | |||||
| ОР
(95%ДИ) |
P value | ОР
(95%ДИ) |
P value | ОР
(95%ДИ) |
P value | ОР
(95%ДИ) |
P value | |
| Вид доступа | ||||||||
| ЛО | Референс | Референс | ||||||
| ОО | 1.68(1.20,2.35) | 0.002 | 0.97(0.60,1.56) | 0.904 | ||||
| Женщина | 0.79(0.57,1.08) | 0.141 | 1.07(0.66,1.75) | 0.776 | ||||
| Возраст ≥ 60 г. | 0.95(0.68,1.34) | 0.780 | 0.77(0.47,1.27) | 0.305 | ||||
| ИМТ, кг/см2 | ||||||||
| 18.5 | Референс | Референс | ||||||
| 18.5 ~ 24 | 0.72(0.32,1.64) | 0.436 | 2.09(0.64,6.82) | 0.221 | ||||
| > 24 | 0.79(0.55,1.13) | 0.195 | 0.98(0.57,1.70) | 0.955 | ||||
| АОА | ||||||||
| I | Референс | Референс | Референс | Референс | ||||
| II | 1.88(1.22,2.89) | 0.004 | 1.938(1.203,3.121) | 0.007 | 1.75(0.97,3.18) | 0.064 | 2.36(1.23,4.53) | 0.010 |
| III | 2.41(1.40,4.13) | 0.001 | 2.578(1.388,4.788) | 0.003 | 3.39(1.56,7.38) | 0.002 | 5.11(2.15,12.17) | < 0.001 |
| Размер опухоли > 3 см | 0.67(0.48,0.95) | 0.025 | 0.88(0.51,1.49) | 0.624 | ||||
| Положительные лимфоузлы≥ 1 | 1.20(0.85,1.70) | 0.295 | 1.25(0.74,2.10) | 0.402 | ||||
| Лимфоузлы > 8 | 1.56(1.09,2.23) | 0.016 | 1.16(0.68,1.98) | 0.584 | ||||
| Послеоперационный ОбщБилируб > 85,5 мкмоль/л | 1.58(1.146,2.18) | 0.005 | 1.68(0.99,2.85) | 0.053 | ||||
| Предоперационный уровень АСТ > 40 мкмоль/л | 2.20(1.50,3.23) | < .0001 | 1.97(1.10, 3.54) | 0.023 | ||||
| Предоперационная АЛТ > 40 мкмоль/л | 2.12(1.42,3.18) | 0.0003 | 1.75(0.96,3.20) | 0.068 | ||||
| CA199, Од/мл | ||||||||
| ≤ 50 | Референс | Референс | ||||||
| 50 ~ 400 | 1.38(0.88,2.19) | 0.164 | 0.98(0.49,1.94) | 0.944 | ||||
| ≥ 400 | 1.45(0.89,2.36) | 0.137 | 1.11(0.51,2.41) | 0.788 | ||||
| Продолжительность операции, мин | ||||||||
| ≤ 200 | Референс | Референс | ||||||
| 200 ~ 400 | 1.35(0.75,2.42) | 0.315 | 2.22(0.90,5.47) | 0.082 | ||||
| ≥ 400 | 2.11(1.13,3.96) | 0.020 | 2.66(1.01,7.01) | 0.048 | ||||
| ИКП, мл | ||||||||
| ≤ 100 | Референс | Референс | Референс | Референс | ||||
| 100 ~ 500 | 2.45(1.58,3.80) | < .0001 | 2.23(1.40,3.55) | < 0.001 | 2.45(1.27,4.72) | 0.008 | 2.28(1.14,4.54) | 0.019 |
| ≥ 500 | 3.41(2.15,5.42) | < .0001 | 2.75(1.64,4.62) | < 0.001 | 2.33(1.17,4.62) | 0.016 | 1.54(0.74,3.21) | 0.254 |
| Переливание крови во время операции | 2.00(1.44,2.78) | < .0001 | 1.43(0.87,2.35) | 0.154 | ||||
| Гепатэктомия | ||||||||
| Только желчный проток | Референс | Референс | ||||||
| Левая гемигепатэктомия | 0.80(0.56,1.14 | 0.212 | 0.49(0.32,0.74) | < 0.001 | 1.06(0.617,1.82) | 0.835 | ||
| Правая гемигепатэктомия | 2.36(1.40,3.96) | 0.001 | 1.02(0.54,1.92) | 0.955 | 1.33(0.633,2.79) | 0.453 | ||
| Левая сегментэктомия | 4.29(0.82,22.51) | 0.086 | 4.06(0.66,25.02) | 0.131 | 3.13(0.28,35.41) | 0.358 | ||
| Правая сегментэктомия | 1.71(0.42,7.01) | 0.453 | 1.46(0.34,6.22) | 0.613 | 1.56(0.30,8.06) | 0.594 | ||
| Желчный проток и частично гепатэктомия | 0.91(0.37,2.23) | 0.844 | 1.37(0.47,4.11) | 0.576 | 0.87(0.27,2.75) | 0.810 | ||
| Переход к лапаротомии | 1.21(0.48,3.05) | 0.686 | 1.78(0.53,5.99) | 0.349 | ||||
| Резекция сосудов | ||||||||
| Ни одной | Референс | Референс | ||||||
| Печеночная артерия | 1.30(0.65,2.60) | 0.461 | 1.35(0.65,2.82) | 0.419 | 1.00(0.38,2.63) | 0.999 | ||
| Воротная вена | 2.95(1.24,7.03) | 0.015 | 1.97(0.71,5.49) | 0.196 | 8.56(0.98,74.49) | 0.052 | ||
| Печеночная артерия и воротная вена | 5.97(3.17,11.25) | < .0001 | 3.47(1.70,7.07) | < 0.001 | 5.48(1.94,15.48) | 0.003 | ||
| Реконструкция сосудов | 3.28(1.44,7.49) | 0.005 | 12.41(1.53,100.65) | 0.013 | 13.18(1.53,113.89) | 0.019 | ||
| Реконструкция пищеварительной системы | ||||||||
| Холедохоеюностомия | Референс | Референс | Референс | |||||
| Гепатикоеюностомия | 2.01(1.43,2.82) | < .0001 | 1.81(1.22,2.70) | 0.004 | 1.80(1.08,2.99) | 0.024 | 2.13(1.21,3.75) | 0.009 |
| Пластика желчевыводящих путей | 1.33(0.96,1.84) | 0.082 | 0.84(0.52,1.35) | 0.459 | ||||
| TNM стадия | ||||||||
| I(T1N0M0) | Референс | Референс | ||||||
| II(T2a/2bN0M0) | 0.78(0.48,1.28) | 0.325 | 0.84(0.42,1.69) | 0.617 | ||||
| IIIA(T3N0M0) | 0.84(0.44,1.60) | 0.602 | 1.67(0.58,4.83) | 0.342 | ||||
| IIIB(T4N0M0) | 0.62(0.31,1.27) | 0.191 | 1.10(0.36,3.30) | 0.872 | ||||
| IVA(T, N2M0) | 1.01(0.58,1.77) | 0.960 | 1.05(0.47,2.34) | 0.907 | ||||
| IVB(T,N,M1) | 0.91(0.44,1.91) | 0.807 | 0.80(0.27,2.41) | 0.689 | ||||
СОС Согласованность оценки склонности, ЛО Лапароскопическая операция, ОО Открытая операция, ИМТ Индекс массы тела, ОбщБилируб Общий билирубин, ЩФ Щелочная фосфатаза, АСТ Аспартатаминотрансфераза, АЛТ Аланинаминотрансфераза, ИКП интраоперационная кровопотеря, ОРДС острый респираторный дистресс-синдром.
Таблица 5 Анализ модели пропорционального риска Кокса относительно продолжительности пребывания с использованием необработанной когорты и сопоставленной когорт
| Факторы риска | Необработанная когорта | Согласованная по оценке склонности когорта | ||||||
| Однофакторный анализ | Мультифакторный анализ | Однофакторный анализ | Мультифакторный анализ | |||||
| ОР(95%ДИ) | P value | ОР(95%ДИ) | P value | ОР(95%ДИ) | P value | ОР(95%ДИ) | P value | |
| Вид доступа | ||||||||
| ЛО | Референс | Референс | Референс | Референс | ||||
| ОО | 0.67(0.57,0.80) | < .0001 | 0.74(0.61,0.90) | 0.002 | 0.66(0.51,0.85) | 0.001 | 0.58(0.45,0.75) | < .0001 |
| Женщина | 1.08(0.91,1.27) | 0.378 | 0.83(0.64,1.07) | 0.147 | ||||
| Возраст ≥ 60 лет | 1.11(0.94,1.32) | 0.228 | 1.10(0.85,1.43) | 0.465 | ||||
| ИМТ | ||||||||
| 18.5 | Референс | Референс | ||||||
| 18.5 ~ 24 | 1.39(0.93,2.06) | 0.108 | 0.84(0.44,1.59) | 0.584 | ||||
| > 24 | 1.07(0.89,1.29) | 0.480 | 1.14(0.86,1.52) | 0.360 | ||||
| АОА | ||||||||
| I | Референс | Референс | ||||||
| II | 0.91(0.74,1.11) | 0.347 | 0.91(0.68,1.20) | 0.494 | ||||
| III | 0.81(0.62,1.06) | 0.131 | 0.73(0.49,1.09) | 0.120 | ||||
| CA199, ОД/мл | ||||||||
| ≤ 50 | Референс | Референс | Референс | Референс | ||||
| 50 ~ 400 | 0.57(0.46,0.72) | < .0001 | 0.60(0.47,0.76) | < .0001 | 0.67(0.48,0.95) | 0.025 | 0.455(0.315,0.658) | < .0001 |
| ≥ 400 | 0.64(0.50,0.81) | 0.001 | 0.59(0.450,0.77) | < .0001 | 0.75(0.50,1.11) | 0.144 | 0.424(0.279,0.645) | < .0001 |
| Размер опухоли > 3 см | 1.12(0.94,1.33) | 0.214 | 1.01(0.76,1.33) | 0.963 | ||||
| Лимфоузлы> 8 | 0.91(0.75,1.09) | 0.292 | 1.03(0.78,1.36) | 0.855 | ||||
| Предоперационный ОбщБилируб > 85,5 мкмоль/л | 0.85(0.73,1.01) | 0.057 | 0.77(0.58,1.02) | 0.064 | ||||
| Предоперационный уровень АСТ > 40 мкмоль/л | 0.69(0.58,0.83) | < .0001 | 0.83(0.62,1.11) | 0.208 | ||||
| Предоперационная АЛТ > 40 мкмоль/л | 0.59(0.48,0.71) | < .0001 | 0.74(0.59,0.91) | 0.005 | 0.62(0.46,0.84) | 0.002 | ||
| CA199, ОД/мл | ||||||||
| ≤ 50 | Референс | Референс | Референс | Референс | ||||
| 50 ~ 400 | 0.57(0.46,0.72) | < .0001 | 0.60(0.47,0.76) | < .0001 | 0.67(0.48,0.95) | 0.025 | 0.46(0.32,0.66) | < .0001 |
| ≥ 400 | 0.64(0.50,0.81) | < .0001 | 0.59(0.45,0.77) | < .0001 | 0.75(0.50,1.11) | 0.144 | 0.42(0.28,0.65) | < .0001 |
| Длительность операции, мин | ||||||||
| ≤ 200 | Референс | Референс | ||||||
| 200 ~ 400 | 1.13(0.84,1.51) | 0.428 | 1.23(0.79,1.91) | 0.353 | ||||
| ≥ 400 | 0.94(0.68,1.29) | 0.683 | 1.20(0.75,1.93) | 0.446 | ||||
| ИКП, мл | ||||||||
| ≤ 100 | Референс | Референс | ||||||
| 100 ~ 500 | 0.75(0.62,0.92) | 0.004 | 0.95(0.77,1.17) | 0.625 | 0.90(0.66,1.23) | 0.523 | ||
| ≥ 500 | 0.49(0.39,0.61) | < .0001 | 0.54(0.42,0.69) | < .0001 | 0.66(0.47,0.91) | 0.013 | ||
| Переливание крови во время операции | ||||||||
| Гепатэктомия | ||||||||
| Только желчный проток | Референс | Референс | ||||||
| Левая гемигепатэктомия | 1.16(0.97,1.39) | 0.100 | 1.26(1.02,1.55) | 0.029 | 1.02(0.77,1.35) | 0.909 | ||
| Правая гемигепатэктомия | 0.57(0.43,0.75) | < .0001 | 0.78(0.57,1.05) | 0.104 | 0.72(0.49,1.07) | 0.102 | ||
| Левая сегментэктомия | 0.73(0.32,1.64) | 0.444 | 1.06(0.45,2.47) | 0.895 | 0.81(0.25,2.55) | 0.712 | ||
| Правая сегментэктомия | 0.73(0.34,1.54) | 0.403 | 0.88(0.38,2.02) | 0.761 | 0.64(0.26,1.58) | 0.336 | ||
| Желчный проток и часть гепатэктомии | 0.67(0.41,1.08) | 0.098 | 0.78(0.45,1.37) | 0.390 | 0.86(0.47,1.56) | 0.618 | ||
| Переход к лапаротомии | 0.80(0.50,1.28) | 0.351 | 0.79(0.43,1.44) | 0.440 | ||||
| Резекция сосудов | ||||||||
| Ни одной | Референс | Референс | ||||||
| Печеночная артерия | 0.74(0.52,1.06) | 0.101 | 0.79(0.48,1.29) | 0.342 | ||||
| Воротная вена | 0.71(0.46,1.10) | 0.127 | 0.54(0.24,1.22) | 0.138 | ||||
| Печеночная артерия и воротная вена | 0.44(0.32,0.61) | < .0001 | 0.49(0.29,0.81) | 0.006 | ||||
| Реконструкция сосудов | 0.74(0.50,1.11) | 0.141 | 0.58(0.30,1.12) | 0.105 | ||||
| Реконструкция пищеварительной системы | ||||||||
| Холедохоеюностомия | Референс | Референс | ||||||
| Гепатикоеюностомия | 0.69(0.58,0.82) | < .0001 | 0.808(0.662,0.986) | 0.035 | 0.75(0.58,0.98) | 0.034 | ||
| Пластика желчевыводящих путей | 0.93(0.79,1.10) | 0.377 | 1.02(0.80,1.308) | 0.868 | ||||
| TNM | ||||||||
| I(T1N0M0) | Референс | Референс | Референс | |||||
| II(T2a/2bN0M0) | 0.94(0.73,1.21) | 0.636 | 1.04(0.80,1.36) | 0.777 | 0.97(0.67,1.39) | 0.851 | ||
| IIIA(T3N0M0) | 0.82(0.59,1.14) | 0.238 | 0.95(0.66,1.36) | 0.761 | 0.88(0.511,1.53) | 0.655 | ||
| IIIB(T4N0M0) | 1.43(1.01,2.03) | 0.047 | 2.40(1.62,3.55) | < .0001 | 1.29(0.72,2.31) | 0.388 | ||
| IVA(T, N2M0) | 0.80(0.60,1.06) | 0.119 | 1.13(0.83,1.54) | 0.444 | 0.82(0.53,1.24) | 0.343 | ||
| IVB(T,N,M1) | 0.95(0.65,1.38) | 0.788 | 1.09(0.74,1.62) | 0.665 | 0.83(0.47,1.48) | 0.534 | ||
| Абсцесс брюшной полости | 0.44(0.33,0.59) | < .0001 | 0.46(0.34,0.62) | < .0001 | 0.47(0.31,0.70) | 0.0002 | 0.41(0.27,0.63) | < .0001 |
| Кровотечение | 0.44(0.29,0.67) | < .0001 | 0.39(0.26,0.61) | < .0001 | 0.50(0.28,0.92) | 0.027 | 0.33(0.18,0.63) | 0.0007 |
| Желчный свищ | 0.49(0.35,0.68) | < .0001 | 0.50(0.36,0.71) | < .0001 | 0.64(0.39,1.04) | 0.074 | 0.54(0.33,0.89) | 0.016 |
| Сердечная недостаточность | 0.46(0.25,0.86) | 0.016 | 0.26(0.13,0.51) | < .0001 | 0.39(0.14,1.05) | 0.061 | 0.18(0.07,0.50) | 0.001 |
| Инфекция разреза | 0.31(0.17,0.54) | < .0001 | 0.37(0.21,0.66) | 0.001 | 0.39(0.19,0.80) | 0.009 | ||
| Пневмония | 0.49(0.35,0.69) | < .0001 | 0.49(0.34,0.71) | < .0001 | 0.67(0.41,1.09) | 0.105 | ||
| ОРДС | 0.36(0.17,0.75) | 0.007 | 0.45(0.17,1.20) | 0.109 | ||||
| Печеночная недостаточность | 0.37(0.18,0.79) | 0.010 | 0.38(0.12,1.17) | 0.092 | ||||
| Повторная операция | 0.25(0.10,0.61) | 0.002 | 0.21(0.07,0.65) | 0.007 | 0.308(0.10,0.98) | 0.046 | ||
| Почечная недостаточность | 0.28(0.12,0.69) | 0.005 | 0.29(0.09,0.90) | 0.032 | ||||
СОС Согласованность оценки склонности, ЛО Лапароскопическая операция, ОО Открытая операция, ИМТ Индекс массы тела, ОбщБилируб Общий билирубин, ЩФ Щелочная фосфатаза, АСТ Аспартатаминотрансфераза, АЛТ Аланинаминотрансфераза, ИКП интраоперационная кровопотеря, ОРДС острый респираторный дистресс-синдром.
Кроме того, для дальнейшего исследования связи между хирургическими методами и ППС была применена модель Fine Gray, где послеоперационные осложнения, повторные операции во время госпитализации или смерть в течение 30 дней после операции были определены как конкурирующие события при анализе ППС. После корректировки конкурирующих рисков было обнаружено, что открытое хирургическое вмешательство является независимым фактором риска увеличения продолжительности ППС как в несопоставленном, так и в сопоставленном анализе.
Обсуждение
Краткосрочные результаты этого ретроспективного исследования показали, что ЛО имеет преимущество в показателях ППС и восстановления функций, таких как послеоперационная продолжительность удержания дренажной трубки, по сравнению с ОО у пациентов с ПХХК. Более того, показатели смертности, частоты послеоперационных осложнений и онкологических результатов существенно не отличались между двумя хирургическими методами. Это самое большое на сегодняшний день исследование реальных данных по сравнению ЛО и ОО при ПХХК. Они показали, что ЛО, хотя и является сложным, но выполнимым и безопасным методом для пациентов с ПХХК. Мы также провели СОС, чтобы устранить потенциальные предубеждения, и обнаружили, что группа ЛО была благоприятной для послеоперационного функционального восстановления, без различий в осложнениях и смертности по сравнению с группой ОО. Многофакторный анализ также подтвердил, что ЛО является безопасной в отношении периоперационных осложнений и может значительно сократить послеоперационный ППС.
Хотя несколько кумулятивных доказательств с мета-анализом показали применение ЛО при ПХХК [21,22,23,24], эта методика все еще ограничена меньшинством высококвалифицированных хирургов и специализированных учреждений, а также отсутствием крупных выборочных многоцентровых доказательств. ЛО применяется для всех типов опухолей по Bismuth-Corlette, хотя преимущественно используется у пациентов с опухолями с низкими стадиями [25,26,27]. Bismuth III-IV составляли 47,26% в этом исследовании, и в группе ЛО по сравнению с группой ВО в этой выборке также было выявлено одинаковую безопасность и лучшее послеоперационное восстановление, что отражается более короткими ППС и ППУД. Кроме того, целесообразность лапароскопического подхода подтверждается частотой конверсии (19/256 случаев, 7,4% до СОС; и 11/141 случай, 7,8% после СОС), которая была значительно ниже, чем в целом сообщалось об операциях по поводу ПХХК [28], а также ниже при больших гепатэктомиях [29, 30]. На самом деле, хотя хирургическое лечение ПХБК предполагает технические сложности связанные с портальной инфильтрацией, артериальным обволакиванием или инфильтрацией желчных протоков, потребности в ургентной конверсии выявляют относительно редко. Поскольку операционное поле легко доступно для осмотра оператору, а следовательно, некоторые оперативные процедуры с высокой степенью технической сложности были более контролируемыми при лапароскопии.
На сегодняшний день только ретроспективные исследования с небольшим размером выборки сообщают о периоперационных результатах ЛО и ОО при ПХХК. Эффективность и безопасность ЛО при ПХХК является в значительной степени противоречивой [11, 12, 31, 32]. Единственное сравнительное исследование, проведенное Xu с соавторами, показало, что роботизированная резекция неблагоприятно сравнивалась с традиционной открытой резекцией по продолжительности времени операции. Не было выявлено существенной разницы в показателях кровопотери, смертности или продолжительности послеоперационного пребывания в стационаре. В то время как расходы на госпитализацию были намного выше в роботизированных группах, выживаемость без рецидива опухоли была ниже [33]. Исследование, обобщающее серию лапароскопических операций, показало, что в группе ЛО была значительно меньшая кровопотеря, меньше интраоперационных и послеоперационных переливаний крови и более короткий ППС. Как общая заболеваемость, так и заболеваемость, связанная с лимфаденэктомией, была ниже в группе ЛО [34]. В этом исследовании не было достоверных различий в продолжительности операции, ИКП, послеоперационных осложнениях или смертности между двумя группами, но в группе ЛО наблюдалась меньшая продолжительность ППС. Кроме того, хирургические методы, независимо от того, открытые они или лапароскопические, не были связаны с неблагоприятными послеоперационными осложнениями как в сравниваемых, так и в несравнимых выборках. Кроме того, в однофакторном анализе ЛО была более протективным фактором в отношении неблагоприятных послеоперационных осложнений, чем ОО. Эти данные продемонстрировали, что ЛО является безопасным и целесообразным для пациентов с ПХХК.
Важнейшим потенциальным преимуществом ЛО является более широкое применение послеоперационных путей функционального восстановления и сокращение срока пребывания в больнице [35]. Методика ЛО может обеспечить функциональное восстановление не только после простых операций, таких как ЛХЭ герниорафия, но и после сложных операций, таких как ЛПДЭ, лапароскопическая гепатэктомия или лапароскопическая гастрэктомия [36,37,38,39]. В нашем исследовании наблюдался протективный эффект ЛО в отношении сокращения ППС с учетом или без учета послеоперационных осложнений, которые являются конкурирующими факторами риска. Периоперационные осложнения потенциально могут влиять на оценку краткосрочного результата при наличии событий, угрожающих жизни, и, таким образом, на оценку чистого кумулятивного эффекта ЛО в сокращении ППС. Пренебрежение существованием этих конкурирующих событий риска приведет к неточным расчетам кумулятивной частоты выписки при использовании классических методов анализа выживаемости [40, 41]. До сих пор лишь в немногих исследованиях рассматривалось использование модели Файн-Грея для изучения послеоперационных преимуществ ЛО. СОС был еще одним статистическим методом для контроля предвзятости в этом исследовании. Он был предложен как метод преодоления предвзятости отбора и повышения уровня доказательности в обсервационных и рандомизированных исследованиях [42, 43]. В этом исследовании мы продемонстрировали, что в группе ЛО меньше гепатикоеюностомии, меньше сосудистых резекций, короче ППС и тенденция к меньшему количеству тяжелых осложнений (стадия CD ≥ III) по сравнению с группой ОО до и после СОС. Результаты показали, что ЛО может достоверно сократить срок пребывания в стационаре и обеспечить преимущества в отношении послеоперационного функционального восстановления у пациентов с ПХХК.
Кроме того, мы обнаружили, что высокий балл по шкале АОА, большая интраоперационная кровопотеря и гепатикоеюностомия являются постоянными факторами риска неблагоприятного хирургического исхода. Кроме того, большая интраоперационная кровопотеря была определена как фактор риска для увеличения ППС как в модели общего риска, так и в модели конкурирующего риска. Эти результаты указывают на то, что лучшее предоперационное состояние и меньшая интраоперационная кровопотеря ассоциируются с лучшим краткосрочным прогнозом у пациентов с ПХХК. Во время хирургического лечения ПХХК большинство технических сложностей связаны с лечением портальной инфильтрации, или обволакиванием артерии опухолевой тканью, или инфильтрации вдоль желчных протоков. Вместе с тем, эти состояния и связанные с ними риски повреждения сосудов, как правило, лучше поддаются лечению при лапароскопии, поскольку операционное поле является легкодоступным и находится в поле зрения оператора, а кровотечение может быть остановлено с помощью временного зажима, если возникла экстренная ситуация. Таким образом, ЛО лучше подходит для остановки интраоперационных кровотечений, что потенциально может принести пользу для краткосрочного результата, как недавно сообщалось [28, 44]. Предоперационное состояние пациента является наиболее важным вопросом при назначении хирургического вмешательства. Отбор пациентов является распространенным явлением в клинической практике, а также ключевым вызовом, который до сих пор озадачивает большинство хирургических экспертов. В нашем исследовании мы обнаружили, что частота резекции сосудов, послеоперационных желчных свищей и печеночной недостаточности очень низкая, что свидетельствует об очевидном отборе пациентов перед хирургическим лечением. В повседневной практике пациентам с ПХХК перед операцией предлагается пройти тест с индоцианином зеленым, тестирование функции печени и 3D визуализацию, чтобы помочь хирургам рассчитать объем печени, оценить функцию печени и определить точную анатомическую структуру поражения. Некоторые хирурги относительно консервативно относятся к радикальному хирургическому вмешательству по поводу ПХХК, когда сталкиваются со сложной резекцией и реконструкцией, особенно при лапароскопической операции. Несмотря на трудности, среди хирургов растет энтузиазм в отношении лапароскопической радикальной хирургии перихилярной холангиокарциномы. Отбор подходящих пациентов для лапароскопического радикального лечения перихилярной холангиокарциномы, чтобы помочь хирургам ориентироваться в кривой обучения, будет в центре внимания наших будущих исследований.
Насколько нам известно, это самая большая серия клинических случаев ПХХК, в которой сравниваются ЛО и ОО. Однако следует отметить некоторые ограничения. Во-первых, ретроспективный характер исследования подвергает риску предвзятости отбора, и нельзя полностью исключить неожиданную предвзятость. Во-вторых, мультицентрический характер исследования создает риск различных критериев отбора, применяемых в учреждениях, участвующих в исследовании. В то время как из-за сложности процедуры лапароскопическая резекция сейчас выполняется очень редко, этот анализ на большой выборке может предоставить несколько важных сведений о лапароскопической хирургии ПХХК. В-третьих, все лапароскопические резекции, выполненные опытными специалистами, все еще находятся на ранних и исследовательских стадиях и выполняются лишь в отдельных случаях. Кроме того, все центры, включенные в это исследование, были центрами с большим объемом направлений в Китае. Полученный опыт может быть трудно обобщить для хирургов с менее интенсивной подготовкой. Тем не менее, учитывая продолжающиеся дебаты по этой сложной процедуре и текущий переход к моделям возмещения расходов на здравоохранение, основанных на ценности, наши выводы являются актуальными и своевременными.
Заключение
Таким образом, это масштабное многоцентровое исследование продемонстрировало, что Ло не увеличивает интраоперационные и послеоперационные риски при ПХХК. Таким образом, этот отчет служит основой для национальных протоколов, направленных на безопасное выполнение ЛО у пациентов с ПХХК. Для дальнейшего изучения этой темы необходимы большие проспективные когортные серии и проспективные рандомизированные исследования в разных странах.
Аббревиатуры
ЛО:
Лапароскопическая операция
ПХХК:
Перихилярная холангиокарцинома
ОО:
Открытая операция
СОС:
Согласование оценки склонности
ППС:
Послеоперационная продолжительность пребывания в стационаре
ВВ:
Воротная вена
ТЛО:
Тотальная лапароскопическая операция
TNM:
Tumor, nodus, metastasis
НВОС:
Национальная всеобъемлющая онкологическая сеть
ЛПДЭ:
Лапароскопическая панкреатодуоденэктомия
ИКП:
Интраоперационная кровопотеря
CD:
Clavien-Dindo
ИКР:
Интерквартирный ромах
СО:
Стандартное отклонение
ИМТ:
Индекс массы тела
ОбщБилируб:
Общий билирубин
АЛТ:
Аланинаминотрансфераза
АСТ:
Аспартатаминотрансфераза
ОРДС:
Острый респираторный дистресс-синдром
ППУД:
Послеоперационная продолжительность удержания дренажной трубки
Ссылки на источники
-
- Groot Koerkamp B, Wiggers JK, Allen PJ, Busch OR, D’Angelica MI, DeMatteo RP, et al. American Joint Committee on Cancer staging for resected perihilar cholangiocarcinoma: a comparison of the 6th and 7th editions. HPB (Oxford). 2014;16(12):1074–82.
- Kimura N, Young AL, Toyoki Y, Wyatt JI, Toogood GJ, Hidalgo E, et al. Radical operation for hilar cholangiocarcinoma in comparable Eastern and Western centers: Outcome analysis and prognostic factors. Surgery. 2017;162(3):500–14.
- Tang Z, Yang Y, Zhao Z, Wei K, Meng W, Li X. The clinicopathological factors associated with prognosis of patients with resectable perihilar cholangiocarcinoma: A systematic review and meta-analysis. Medicine. 2018;97(34):e11999.
- Wang Y, Ma K, Zhong A, Xiong Q, Chen J. Hepatopulmonary syndrome after radiofrequency ablation of recurrent intrahepatic cholangiocarcinoma: a case report. Onco Targets Ther. 2019;12:2431–8.
- de Rooij T, van Hilst J, van Santvoort H, Boerma D, van den Boezem P, Daams F, et al. Minimally Invasive Versus Open Distal Pancreatectomy (LEOPARD): A Multicenter Patient-blinded Randomized Controlled Trial. Ann Surg. 2019;269(1):2–9.
- Wang M, Peng B, Liu J, Yin X, Tan Z, Liu R, et al. Practice Patterns and Perioperative Outcomes of Laparoscopic Pancreaticoduodenectomy in China: A Retrospective Multicenter Analysis of 1029 Patients. Ann Surg. 2021;273(1):145–53.
- Jin B, Chen MT, Fei YT, Du SD, Mao YL. Safety and efficacy for laparoscopic versus open hepatectomy: A meta-analysis. Surg Oncol. 2018;27(2):a26–34.
- Nickel F, Haney CM, Kowalewski KF, Probst P, Limen EF, Kalkum E, et al. Laparoscopic Versus Open Pancreaticoduodenectomy: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Ann Surg. 2020;271(1):54–66.
- Hosokawa I, Shimizu H, Yoshidome H, Ohtsuka M, Kato A, Yoshitomi H, et al. Surgical strategy for hilar cholangiocarcinoma of the left-side predominance: current role of left trisectionectomy. Ann Surg. 2014;259(6):1178–85.
- Gumbs AA, Jarufe N, Gayet B. Minimally invasive approaches to extrapancreatic cholangiocarcinoma. Surg Endosc. 2013;27(2):406–14.
- Franken LC, van der Poel MJ, Latenstein AEJ, Zwart MJ, Roos E, Busch OR, et al. Minimally invasive surgery for perihilar cholangiocarcinoma: a systematic review. J Robot Surg. 2019;13(6):717–27.
- Hu HJ, Wu ZR, Jin YW, Ma WJ, Yang Q, Wang JK, et al. Minimally invasive surgery for hilar cholangiocarcinoma: state of art and future perspectives. ANZ J Surg. 2019;89(5):476–80.
- Agha R, Abdall-Razak A, Crossley E, Dowlut N, Iosifidis C, Mathew G; the STROCSS Group. The STROCSS. Guideline: Strengthening the Reporting of Cohort Studies in Surgery. Int J Surg. 2019;2019(72):156–65.
- Edge SBBD, Compton CC, Fritz AG, Greene FL, Trotti A. American Joint Committee on cancer. Cancer staging manual: Springer, New York; 2020.
- Bismuth H, Nakache R, Diamond T. Management strategies in resection for hilar cholangiocarcinoma. Ann Surg. 1992;215(1):31–8.
- Clavien PA, Barkun J, de Oliveira ML, Vauthey JN, Dindo D, Schulick RD, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009;250(2):187–96.
- Koch M, Garden OJ, Padbury R, Rahbari NN, Adam R, Capussotti L, et al. Bile leakage after hepatobiliary and pancreatic surgery: a definition and grading of severity by the International Study Group of Liver Surgery. Surgery. 2011;149(5):680–8.
- Rahbari NN, Garden OJ, Padbury R, Maddern G, Koch M, Hugh TJ, et al. Post-hepatectomy haemorrhage: a definition and grading by the International Study Group of Liver Surgery (ISGLS). HPB (Oxford). 2011;13(8):528–35.
- Rahbari NN, Garden OJ, Padbury R, Brooke-Smith M, Crawford M, Adam R, et al. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery. 2011;149(5):713–24.
- Brookhart MA, Schneeweiss S, Rothman KJ, Glynn RJ, Avorn J, Stürmer T. Variable selection for propensity score models. Am J Epidemiol. 2006;163(12):1149–56.
- Cipriani F, Ratti F, Fiorentini G, Reineke R, Aldrighetti L. Systematic review of perioperative and oncologic outcomes of minimally-invasive surgery for hilar cholangiocarcinoma. Updates Surg. 2021;73(2):359–77.
- Rahnemai-Azar AA, Abbasi A, Tsilimigras DI, Weber SM, Pawlik TM. Current Advances in Minimally Invasive Surgical Management of Perihilar Cholangiocarcinoma. J Gastrointest Surg. 2020;24(9):2143–9.
- Wang W, Fei Y, Liu J, Yu T, Tang J, Wei F. Laparoscopic surgery and robotic surgery for hilar cholangiocarcinoma: an updated systematic review. ANZ J Surg. 2021;91(1–2):42–8.
- Lin E, Sarmiento JM. Laparoscopic extended right hepatectomy, portal lymphadenectomy, and hepaticojejunostomy for hilar cholangiocarcinoma. J Laparoendosc Adv Surg Tech A. 2014;24(6):411–6.
- Yu H, Wu SD, Chen DX, Zhu G. Laparoscopic resection of Bismuth type I and II hilar cholangiocarcinoma: an audit of 14 cases from two institutions. Dig Surg. 2011;28(1):44–9.
- Zhang CW, Liu J, Hong DF, Wang ZF, Hu ZM, Huang DS, et al. Pure laparoscopic radical resection for type IIIa hilar cholangiocarcinoma. Surg Endosc. 2018;32(3):1581–2.
- Yu H, Wu SD, Tian Y, Su Y, Li YN. Single-incision laparoscopic resection of Bismuth I hilar cholangiocarcinoma. Surgical innovation. 2013;20(3):209–13.
- Ratti F, Fiorentini G, Cipriani F, Catena M, Paganelli M, Aldrighetti L. Perihilar cholangiocarcinoma: are we ready to step towards minimally invasiveness? Updates Surg. 2020;72(2):423–33.
- Cipriani F, Alzoubi M, Fuks D, Ratti F, Kawai T, Berardi G, et al. Pure laparoscopic versus open hemihepatectomy: a critical assessment and realistic expectations – a propensity score-based analysis of right and left hemihepatectomies from nine European tertiary referral centers. J Hepatobiliary Pancreat Sci. 2020;27(1):3–15.
- Cipriani F, Ratti F, Cardella A, Catena M, Paganelli M, Aldrighetti L. Laparoscopic Versus Open Major Hepatectomy: Analysis of Clinical Outcomes and Cost Effectiveness in a High-Volume Center. J Gastrointest Surg. 2019;23(11):2163–73.
- Li J, Zhao L, Zhang J, Li Z, Li A, Wei Y, et al. Application of the laparoscopic technique in perihilar cholangiocarcinoma surgery. Int J Surg. 2017;44:104–9.
- Ebata T, Nagino M, Kamiya J, Uesaka K, Nagasaka T, Nimura Y, et al. Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases. Ann Surg. 2003;238(5):720–7.
- Xu Y, Wang H, Ji W, Tang M, Li H, Leng J, et al. Robotic radical resection for hilar cholangiocarcinoma: perioperative and long-term outcomes of an initial series. Surg Endosc. 2016;30(7):3060–70.
- Ratti F, Fiorentini G, Cipriani F, Paganelli M, Catena M, Aldrighetti L. Perioperative and Long-Term Outcomes of Laparoscopic Versus Open Lymphadenectomy for Biliary Tumors: A Propensity-Score-Based. Case-Matched Analysis Ann Surg Oncol. 2019;26(2):564–75.
- Slim K. Laparoscopy within fast-track or within enhanced recovery after surgery? Ann Surg. 2014;259(2):e24.
- Ni X, Jia D, Chen Y, Wang L, Suo J. Is the Enhanced Recovery After Surgery (ERAS) Program Effective and Safe in Laparoscopic Colorectal Cancer Surgery? A Meta-Analysis of Randomized Controlled Trials. J Gastrointest Surg. 2019;23(7):1502–12.
- Morgan KA, Lancaster WP, Walters ML, Owczarski SM, Clark CA, McSwain JR, et al. Enhanced Recovery After Surgery Protocols Are Valuable in Pancreas Surgery Patients. J Am Coll Surg. 2016;222(4):658–64.
- Wong-Lun-Hing EM, van Dam RM, van Breukelen GJ, Tanis PJ, Ratti F, van Hillegersberg R, et al. Randomized clinical trial of open versus laparoscopic left lateral hepatic sectionectomy within an enhanced recovery after surgery programme (ORANGE II study). Br J Surg. 2017;104(5):525–35.
- Bednarski BK, Nickerson TP, You YN, Messick CA, Speer B, Gottumukkala V, et al. Randomized clinical trial of accelerated enhanced recovery after minimally invasive colorectal cancer surgery (RecoverMI trial). Br J Surg. 2019;106(10):1311–8.
- Varadhan R, Weiss CO, Segal JB, Wu AW, Scharfstein D, Boyd C. Evaluating health outcomes in the presence of competing risks: a review of statistical methods and clinical applications. Med Care. 2010;48(6 Suppl):S96-105.
- Koller MT, Raatz H, Steyerberg EW, Wolbers M. Competing risks and the clinical community: irrelevance or ignorance? Stat Med. 2012;31(11–12):1089–97.
- Willms AG, Schaaf S, Zimmermann N, Schwab R, Güsgen C, Vilz TO, et al. The Significance of Visceral Protection in Preventing Enteroatmospheric Fistulae During Open Abdomen Treatment in Patients With Secondary Peritonitis: A Propensity Score-matched Case-control Analysis. Ann Surg. 2021;273(6):1182–8.
- Bonnot PE, Piessen G, Kepenekian V, Decullier E, Pocard M, Meunier B, et al. Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis. J Clin Oncol. 2019;37(23):2028–40.
- Jingdong L, Yongfu X, Yang G, Jian X, Xujian H, Jianhua L, et al. Minimally invasive surgery for hilar cholangiocarcinoma: a multicenter retrospective analysis of 158 patients. Surg Endosc. 2021;35(12):6612–22.