У пацієнтів зі значними вадами серцевих клапанів втручання, пов’язане з відновленням або заміною клапана, може бути неминучим. Хоча відновлення клапана виконується часто, особливо при мітральній та трикуспідальній регургітації, заміна клапана залишається поширеним втручанням, особливо у дорослих. Для оцінки функції протеза часто потрібні діагностичні методи. Ехокардіографія є методом першої лінії для неінвазивної оцінки функції протезованого клапана. Трансторакальний підхід доповнюється двовимірною і тривимірною черезстравохідною ехокардіографією для подальшого уточнення морфології і функції клапана, коли це необхідно. Зовсім недавно досягнення в галузі комп’ютерної томографії та магнітно-резонансної томографії серця посилили їхню роль в оцінці клапанних вад серця. У цьому документі представлено огляд використовуваних ехокардіографічних методів, а також рекомендації та загальні настанови щодо оцінки функції протезованого клапана на основі даних наукової літератури та консенсусу групи експертів. У цій настанові обговорюється роль сучасних методів візуалізації за допомогою черезстравохідної ехокардіографії, комп’ютерної томографії серця та магнітно-резонансної томографії серця в оцінці структури, функції та регургітації протезного клапана. Вона замінює настанову Американського товариства ехокардіографії 2009 року щодо протезованих клапанів і доповнює настанову 2019 року щодо оцінки клапанної регургітації після черезшкірного ремонту або заміни клапана. (J Am Soc Echocardiogr 2024;37:2-63).
Абревіатури:
2D = двовимірний
3D = тривимірний
4D = Чотиривимірний
AР = Аортальна регургітація
ASE = Американське товариство Ехокардіографії
ВВС = Вроджена вада серця
СМР = Серцевий магнітний резонанс
КТ = Комп’ютерна томографія
БХ = Безперервна хвиля
ДІШ = Допплерівський індекс швидкості
ЕПО = Ефективна площа отвору
ЕПР = Ефективна площа регургітації
FDA = Управління з контролю за продуктами та ліками США
ВСЕ = Внутрішньосерцева ехокардіографія
ЛШ = Лівий шлуночок
ВТЛШ = вихідний тракт лівого шлуночка
МР = Мітральна регургітація
ЛА = Легенева артерія
ПЕТ = Позитронно-емісійна томографія
НПТ = Напівперіод тиску
ПКС = Протезований клапан серця
НПП = Невідповідність між протезом і пацієнтом
ЛР = Легенева регургітація
ПВВ = Паравальвулярний витік
ЗЛК = Заміна легеневого клапана
ІХ = Імпульсно-хвильовий
ПП = Праве передсердя
ПШ = Правий шлуночок
RVOT = вихідний тракт правого шлуночка
SAVR = Хірургічна заміна аортального клапана
ЗСП = збалансована стійка прецесія
СДК = Структурна дисфункція клапана
ТІАК = Транскатетерна імплантація аортального клапана
TEE = Трансезофагеальна ехокардіографія
ТТЕ = Трансторакальна ехокардіографія
ТР = Трикуспідальна регургітація
ТК = Тристулковий клапан
ЗТК = Заміна трикуспідального клапана
ВК = Вена контракта
Квк = Клапан в клапан
ІШЧ = Інтеграл швидкості-часу
ІШЧ ПрМК = інтеграл швидкості-часу протезованого мітрального клапана
Ключові слова: Ехокардіографія, допплерівська ехокардіографія, штучні клапани, серцеві клапани, магнітно-резонансна томографія, комп’ютерна томографія
Часто потрібна заміна. Незважаючи на прогрес у відновленні клапанів, заміна клапанів залишається поширеною, особливо у дорослих. Перша настанова Американського товариства ехокардіографії (ASE) щодо оцінки протезованих клапанів серця (ПКС) була опублікована у 2009 році.1 Згодом з’явилася настанова Європейської асоціації серцево-судинної візуалізації щодо протезованих клапанів у 2016 році2 та настанова ASE у 2019 році щодо оцінки клапанної регургітації після черезшкірного ремонту або заміни клапана.3 Хоча багато принципів і рекомендацій, викладених у настанові ASE 2009 року, все ще залишаються актуальними і дійсними, в ній не вистачає кількох важливих нововведень: функції черезшкірних клапанів, використання тривимірної (3D) ехокардіографії та ролі комп’ютерної томографії (КТ) і магнітно-резонансної томографії серця (МРТ) в оцінці ПМК. З розвитком структурних втручань на серці та візуалізації клапанних вад серця необхідне всебічне оновлення настанови. Цей документ замінює настанову ASE 2009 року і доповнює настанову 2019 року щодо клапанної регургітації після черезшкірного відновлення або заміни клапана.1,3
I. ЗАГАЛЬНІ МІРКУВАННЯ ЩОДО ПРОТЕЗУВАННЯ КЛАПАНІВ
A. Типи штучних клапанів
Існує широкий вибір типів і розмірів протезованих клапанів серця (ПКС), вибір яких залежить від місця імплантації, основної клапанної патології, техніки встановлення та індивідуальних особливостей пацієнта. Хоча перкутантні клапани є біопротезами, хірургічно імплантовані протезовані клапани можуть бути як біопротезними, так і механічними, причому останні асоціюються з більшою довговічністю4 , але потребують хронічної антикоагуляції. Спільне прийняття рішень щодо вибору клапана та техніки імплантації повинно враховувати анатомію пацієнта, ризик процедури, очікувану тривалість життя пацієнта, очікувану довговічність ПКС, а також уподобання та спосіб життя пацієнта.5
Поширеність імплантації механічних клапанів зменшилася за останні 10 років з кількох причин, в тому числі через вподобання пацієнтів. Транскатетерний ремонт і заміна клапанів змінили демографічні та клінічні характеристики пацієнтів, яким проводять хірургічну заміну клапанів.6,7 Потреба в одночасних процедурах, таких як модифікація кореня аорти і висхідної аорти, а також модифікація вихідного тракту лівого шлуночка (ВТЛШ) або вихідного тракту правого шлуночка (ВТПШ), також може вплинути на вибір ПКС. Найпоширенішим типом механічного клапана є двостулковий перекидний клапан (наприклад, St. Jude Medical, Carbomedics, On-X), який забезпечує найкращу гемодинаміку серед наявних на сьогоднішній день механічних клапанів.8 Поодинокі перекидні дискові клапани з низькою тромбогенністю (наприклад, Medtronic-Hall) в сучасній практиці застосовуються нечасто. Нарешті, клапан Старра-Едвардса з кулькою в сепараторі більше не імплантується; однак, зважаючи на його довговічність, деякі з цих клапанів продовжують задовільно функціонувати і можуть зустрічатися в клінічній практиці.
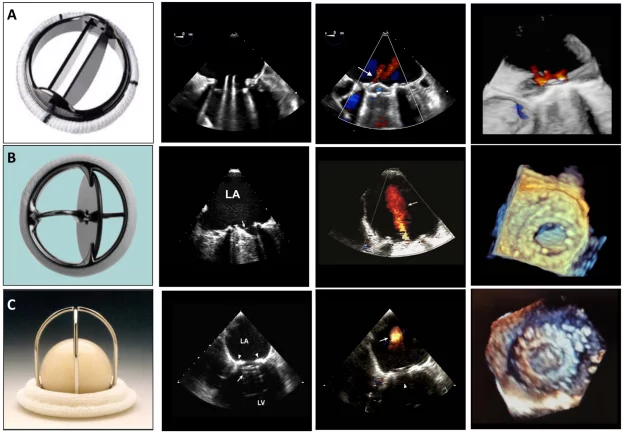
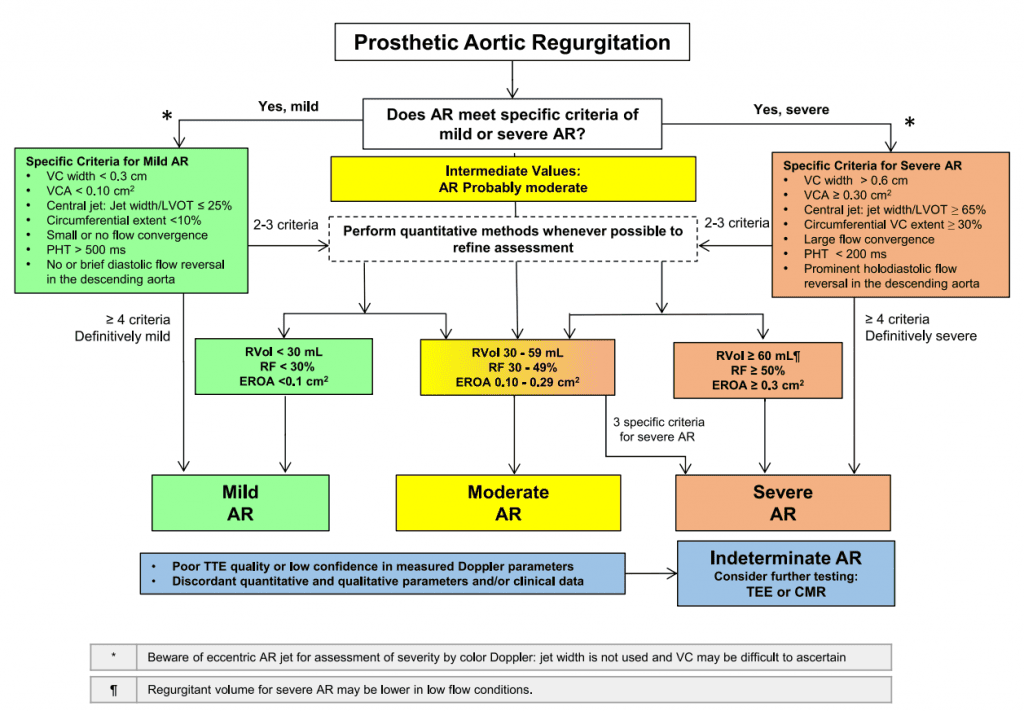
Рисунок 1 Механічні клапани: (А) двостулковий, (В) одностулковий і (С) тристулковий та їхні 2D і 3D черезстравохідні ехокардіографічні показники, отримані в мітральній позиції в діастолу і систолу (друга і третя панелі зліва). Стрілки в діастолу вказують на відкритий оклюдерний механізм клапана, а в систолу – на характерну фізіологічну регургітацію, що спостерігається з кожним клапаном. Зображення тривимірної черезстравохідної ехокардіографії (четверта панель) з черезстравохідного вікна показані з вигляду лівого передсердя. LA – ліве передсердя; LV – лівий шлуночок.
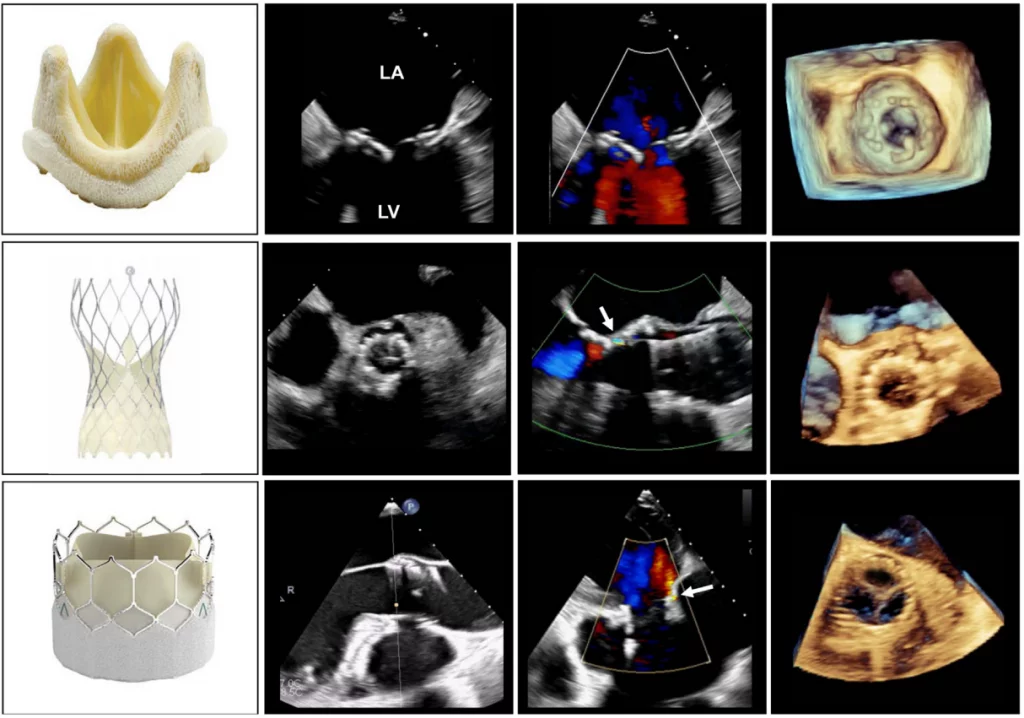
Приклади механічних протезів клапанів зображені на рисунку 1, а приклади стентованих і черезшкірних біопротезних клапанів – на рисунку 2.
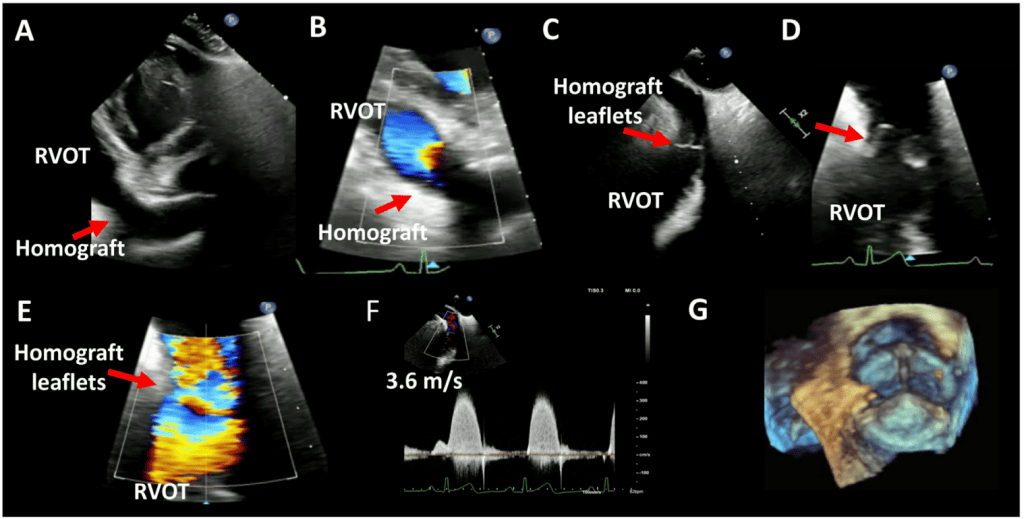
Хірургічні біопротези клапанів можуть бути ксенотрансплантатами, що складаються з перикардіальної тканини свині або великої рогатої худоби, гомотрансплантатами від трупних донорів або аутотрансплантатами (як, наприклад, у процедурі Росса). Найчастіше використовуються стентовані ксенотрансплантати; перикардіальні листки встановлюються на внутрішній або зовнішній стороні стентового каркасу. Зовнішні стулки і безстентові біопротези мають перевагу у вигляді більшої площі стулок і меншого трансклапанного градієнту, але нещодавні дослідження показують високий рівень ранньої структурної дисфункції клапана (СДК), особливо у молодих пацієнтів.9 У випадку СДК транскатетерні процедури “клапан в клапані” (КвК) пропонують пацієнтам альтернативу хірургічній реоперації.10 Хоча ризик розвитку коронарної обструкції з зовнішньо встановленими стулками, а також безстентовими клапанами після процедури КвК вищий, ніж з внутрішньо встановленими біопротезними клапанами, процедури черезшкірного розриву стулок можуть зменшити цей ризик. Різні біопротезні клапани часто можна ідентифікувати за рентгенологічним і комп’ютерно-томографічним виглядом конфігурації стентових стовбурів і зшивного кільця.
Технологія транскатетерної імплантації серцевих клапанів продовжує розвиватися з розширенням показань до застосування.5 Протези для транскатетерної імплантації аортального клапана (ТІАК), що використовуються в комерційних цілях, включають внутрішньоанулярні пристрої, що розширюються балоном (наприклад, клапани SAPIEN; Edwards Lifesciences), супраанулярні клапани, що саморозширюються (наприклад, клапани Evolut; Medtronic), та внутрішньоанулярні клапани (клапани Navitor; Abbott Structural Heart). Інші протези ТІАК знаходяться на стадії випробувань або раннього використання у людей. З іншого боку, кілька мітральних і трикуспідальних транскатетерних клапанів наразі перебувають на стадії клінічних досліджень. Вони мають широкий спектр конструкцій і механізмів кріплення, включаючи радіальну силу, захоплення стулок, кільцеве зачеплення і апікальне прив’язування. Крім того, можлива транскатетерна імплантація мітрального клапана КвК з балонним розширюваним протезом ТІАК, яка має схвалення Управління з контролю за продуктами і ліками США (FDA). Клапан SAPIEN також схвалений для імплантації в легеневій позиції. Нарешті, саморозширювальний клапан Harmony (Medtronic) нещодавно отримав звання проривного пристрою від FDA і також доступний для лікування дітей та дорослих пацієнтів з тяжкою легеневою регургітацією (ЛР).
З точки зору візуалізації, тип, положення і розмір протезованого клапана впливають на його гемодинамічний профіль і частоту ускладнень. Нормальні трансклапанні швидкості та градієнти залежать від потоку, але можуть змінюватися залежно від конкретного розміру та типу клапана.11,12 Тип клапана також впливає на кількість артефактів, які виявляються при ехокардіографії, КТ та СМР, що може вплинути на оцінку функції ПМК. Нормальні ехокардіографічні параметри функції клапана для різних типів і розмірів протезів в аортальній, мітральній, легеневій і трикуспідальній позиціях.
B. Дисфункція ПКС
Дисфункцію протезованого клапана можна розділити на наступні категорії: СДК, неструктурна дисфункція клапана, ендокардит і тромб.13 Незалежно від етіології, гемодинамічні наслідки дисфункції повинні бути кількісно оцінені. Наступні визначення отримані від Академічного дослідницького консорціуму з вивчення клапанів 3 13:
Зображення 2 Біологічні клапани: стентований (верхній ряд) і черезшкірний клапани з їхніми ехокардіографічними характеристиками та 3D-трансезофагеальні ехокардіографічні зображення. Черезшкірний клапан, що саморозширюється, знаходиться в середньому ряду, а клапан, що розширюється балоном, – в нижньому ряду. Стрілками на середніх панелях позначено легку паравальвулярну регургітацію. LA – ліве передсердя; LV – лівий шлуночок.
- СДК: внутрішні постійні зміни протезованого клапана. Приклади включають зношування, розрив стулки, фіброз або кальцифікацію стулки, а також перелом або деформацію стента або стрижня. Структурна поломка частіше зустрічається у біопротезах, ніж у механічних протезах. Кальцифікація клапана є найпоширенішою причиною дегенерації біопротеза, яка спостерігається у 50% свинячих клапанів у віці 5 років і у 75% у віці 8 років.14 Частота відмов у віці від 10 до 15 років становить від 10% до 20% для гомотрансплантатів і 30% для гетеротрансплантатів.15 Стулки і стенти є основними місцями, де відбувається кальцифікація і розрив стулки або розрив стента.
- Неструктурна дисфункція клапана: будь-яка аномалія протеза, не пов’язана з самим клапаном, але яка призводить до його дисфункції.
- Невідповідність між протезом і пацієнтом (НПП) виникає, коли нормально функціонуючий протез є малим відносно розміру пацієнта, що спричиняє високий градієнт і функціональний стеноз. Результати пов’язані з тяжкістю НПП.
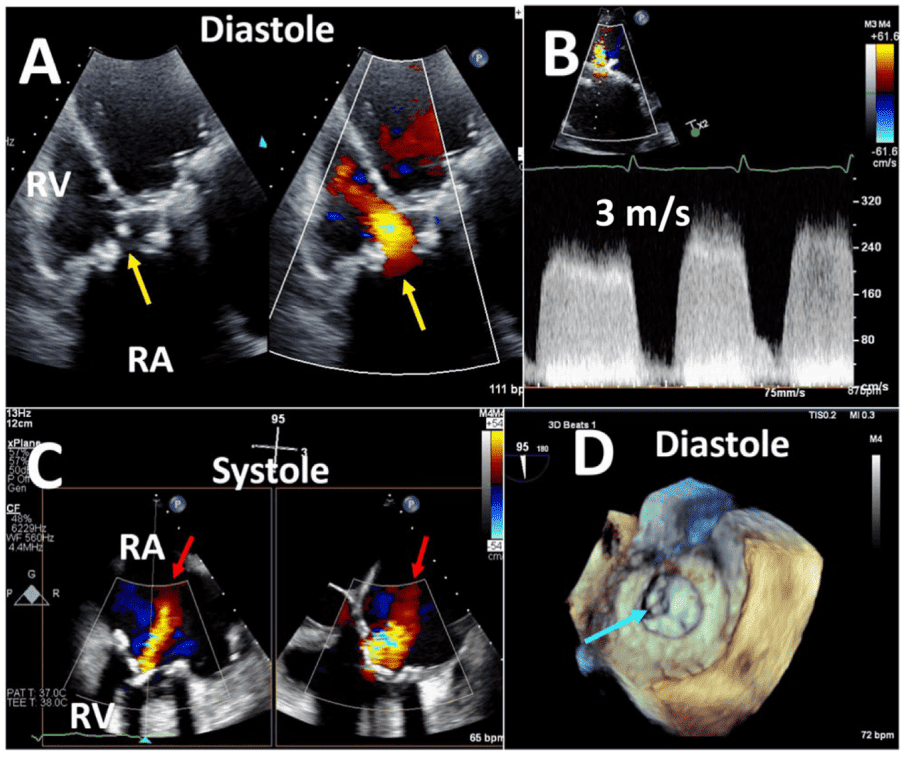
- Паравальвулярний витік (ПВВ) може виникати в хірургічних клапанах через дегісценцію зшивного кільця, а в транскатетерних клапанах – через неправильне розташування каркасу стента з нативною тканиною. Дегісценція є серйозним ускладненням, яке у 4,9% випадків аортальних ПКС вимагає повторної операції або катетерного втручання, порівняно з 2,0% мітральних ПКС. Факторами ризику дегідратації є бактеріальний ендокардит, хірургічна техніка, аневризма висхідного відділу аорти, дегенеративна регургітація та виражена кальцифікація нативного клапана. Транскатетерна ПВВ пов’язана з багатьма факторами, включаючи неправильний розмір пристрою, об’ємну кальцифікацію стулки або кільця, недостатнє розгортання транскатетерного клапана або неправильну глибину імплантації.13
- Інші неструктурні причини дисфункції: Інші причини дисфункції включають защемлення стулки або дисфункцію через паннус, невідповідне положення або розмір, дилатацію камер серця після імплантації (наприклад, дилатація кореня аорти, дилатація мітрального кільця або лівого передсердя) та емболізацію клапана. Паннус – це фіброзна тканина, яка розростається в періаннулярній ділянці і може спричинити дисфункцію ПКС.16 Паннус має поширеність від 0,2% до 4,5% і зустрічається однаково в механічних і біопротезних клапанах, з втричі вищим ризиком у мітральній позиції.17 Паннус може співіснувати з тромбоутворенням в МКК.
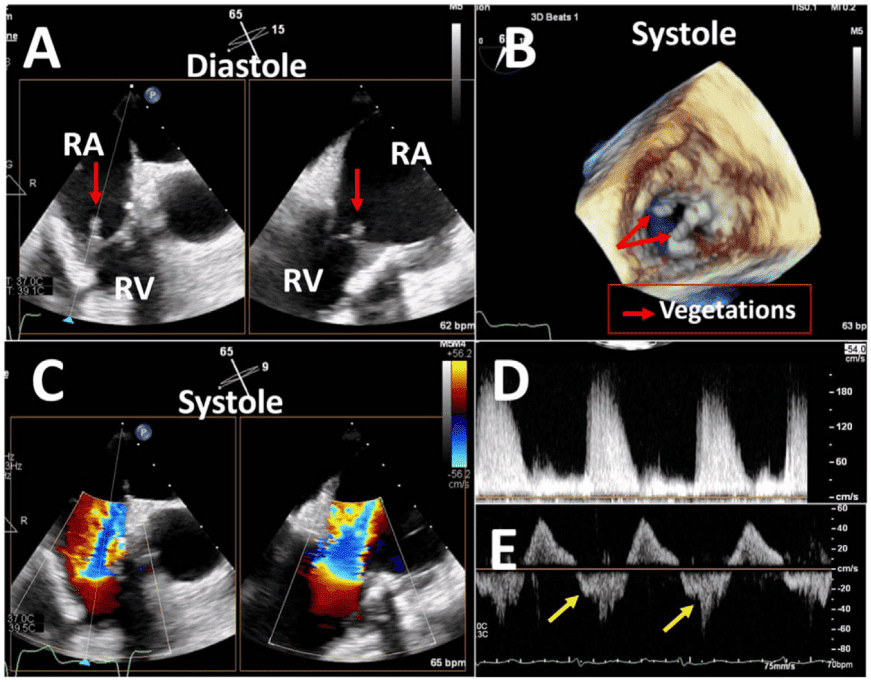
iii. Ендокардит має поширеність від 1% до 6% і може виникнути в будь-який час після операції. У механічних клапанах інфекція майже завжди поширюється від зшивального кільця і призводить до таких ускладнень, як ПВВ, абсцес і поширення на сусідні структури. Інфекції біопротезних клапанів виникають на стулках і можуть поширюватися на шовне кільце або паравальвулярну ділянку. Паравальвулярний абсцес частіше зустрічається у ПКС (56%-100%), ніж у нативних клапанах (10%-40%), особливо в аортальній позиції.18,19 Псевдоаневризми часто спостерігаються в аортальній позиції і становлять від 7% до 25% випадків ендокардиту протезованого клапана.18-20 Інфікована псевдоаневризма у зв’язку з ПКС означає дренування паравальвулярного абсцесу в сусідню камеру серця. Між двома сусідніми порожнинами може виникнути аномальне сполучення, наприклад, фістула, через перфорацію, спричинену інфекцією, яка виходить за межі клапана.18,19 Нарешті, ендокардит після ТІАК стає все більш важливим фактором у відповідній клінічній ситуації, зважаючи на збільшення кількості імплантованих протезів ТІАК.21
- Тромб спостерігається у 0,3%-8% протезів.2 Механічні клапани є більш тромбогенними, ніж біопротези, хоча ризик тромбоутворення для механічного клапана при відповідній антикоагуляційній терапії подібний до ризику тромбоутворення для біопротеза. Правосторонні клапани більш вразливі до тромбозу, ніж лівосторонні, причому трикуспідальний клапан (ТК) уражається в 12-20 разів частіше, ніж лівосторонні клапани.22 Тромб на ехокардіографії виглядає як утворення на клапані з м’якою ехощільністю, що може бути пов’язано з внутрішньосерцевим тромбом16; у біопротезованих клапанах він може виглядати як потовщення клапана.23 На КТ тромб на біопротезованих клапанах може виглядати як гіпоатенуйоване потовщення стулок, що характеризується потовщеними і гіпоатенуйованими стулками ПКС і зниженою рухливістю клапана (гіпоатенуація, що впливає на рух). За повідомленнями, поширеність цього явища становить від 3,6% до 40%.24
| Клінічна інформація | Параметри |
| Дата заміни клапана | Відкривання та закривання стулок або оклюдера |
| Клінічна інформація | Параметри |
| Тип і розмір протезованого клапана | Наявність потовщення листків, кальцифікатів або аномальної ехо-щільності на різних компонентах протеза або поруч з протезом |
| Зріст/вага/площа поверхні тіла | Цілісність та стабільність кільця для зшивання клапана або стента |
| Симптоми та пов’язані з ними клінічні дані | Положення зшивного кільця або каркаса стента |
| Артеріальний тиск і частота серцевих скорочень | |
| Ехокардіографія | Контур сигналу швидкості струменя |
| Пікова швидкість і градієнт | |
| Середній градієнт тиску | |
| ІШЧ струменя | |
| ДІШ | |
| Час розгону, час розгону/викидання для AV | |
| НПТ в МК та ТК | |
| ЕПО* | |
| Наявність, локалізація та тяжкість регургітації†. | |
| Допплер-ехокардіографія клапана | Інші ехокардіографічні дані |
| Розмір, функція та гіпертрофія LV та RV | |
| Розмір і функція лівого передсердя та RA | |
| Супутнє захворювання клапанів | |
| Оцінка тиску ЛА | |
| Патерн венозного притоку | |
| Попередні післяопераційні дослідження, за наявності | |
| Порівняння вищезазначених параметрів є особливо корисним при підозрі на дисфункцію протезованого клапана |
C. Оцінка протезованих клапанів
- Клінічна інформація: Показання до дослідження, симптоми пацієнта, розмір і тип заміни клапана, а також дата операції повинні бути включені у звіт, якщо вони доступні. Це дозволить порівняти результати дослідження з очікуваною нормальною гемодинамікою ПКС. Аналогічно слід включити показники артеріального тиску, частоти серцевих скорочень, зросту, ваги та площі поверхні тіла. Частота серцевих скорочень впливає на тривалість діастолічного наповнення і, отже, на середні градієнти в мітральному клапані і ТК ; площа поверхні тіла допомагає оцінити наявність НПП і розмір камери.
- Ехокардіографічне дослідження: Пацієнтам з ПКС рекомендується проведення стандартизованих вимірювань камер серця, систолічної та діастолічної функції, кореня аорти та висхідної аорти згідно з настановами ASE. Для оцінки всіх компонентів протезованого клапана слід використовувати зум-візуалізацію з декількома видами (таблиця 1). Через акустичну реверберацію від протезного матеріалу візуалізація центрального оклюдера або стулок може потребувати позаосьової візуалізації. Біпланарна візуалізація дозволяє одночасно оцінити структуру клапана в реальному часі і локалізувати паравальвулярну регургітацію за допомогою кольорового доплера. Помірне потовщення часто є першою ознакою первинної неспроможності біологічного клапана і сигналом до скорочення інтервалу між наступними дослідженнями. Самостійні або гойдаючі рухи замінного клапана є ознакою дегідратації і можуть бути більш діагностичними для клапанів в аортальній позиції.25 У мітральній позиції нормальна підвищена рухливість клапана може бути зумовлена кільцевим рухом, передсердною або кільцевою реконструкцією або розташуванням зшивного кільця (тобто в межах лівого передсердя); її потрібно диференціювати з дегідратацією за відсутністю ПВВ. Потовщення кореня аорти внаслідок гематоми та набряку після встановлення безстентового клапана зазвичай зникає через 3-6 місяців, але може бути помилково прийняте за абсцес кореня аорти. Перегляд післяопераційного або інтраопераційного дослідження корисний для підтвердження цього висновку. Зауважте, що ретельна увага до можливості утворення абсцесу необхідна на рівні кільця або зшивного кільця.25 При використанні 3D-ехокардіографії протез слід оцінювати за допомогою об’ємних 3D-даних, з кольоровим допплером і без нього, з того ракурсу зображення, який найкраще візуалізує клапанну або параклапанну структуру. Вигляд протезованих клапанів спереду дозволяє легше локалізувати ПВВ і керувати черезшкірними втручаннями. При отриманні наборів 3D-даних слід використовувати двовимірні (2D) мультипланарні зображення для оптимізації щільності ліній і частоти кадрів, що дозволяє точно оцінити просторові і часові зміни. Цього можна досягти за допомогою однотактних вузьких об’ємів з використанням режимів 3D в реальному часі або багатотактного збору з використанням режимів 3D в реальному часі, масштабування або повного об’єму, бажано з частотами об’єму, що перевищують 20 Гц. Якщо вимірювання проводяться з використанням 3D-об’ємів, перевага надається одноканальному скануванню з високою об’ємною швидкістю. Однак, якщо 3D кольоровий доплер необхідний для кількісної оцінки площі Вена контракта (ВК), то для покращення щільності ліній та об’ємної швидкості може знадобитися багатоканальне сканування. Оптимальні 3D-зображення включатимуть навколишні тканини та клапанні орієнтири, щоб можна було визначити та відобразити локалізацію ураження відповідно до рекомендацій ASE та Європейської асоціації ехокардіографії.26
iii. Допплерівська ехокардіографія: Принципи дослідження та реєстрації швидкості потоку через протезовані клапани з використанням імпульсно-хвильового (ІХ), безперервно-хвильового (БХ) та кольорового доплера подібні до тих, що використовуються при оцінці функції нативного клапана.
- Визначення градієнтів через протезовані клапани: Швидкість через протезований клапан залежить від потоку, розміру та типу клапана. Спрощене рівняння Бернуллі (DP = 4V2 ) є ключовим для неінвазивного розрахунку градієнтів тиску. У пацієнтів з аортальними протезами і високим серцевим викидом або вузьким ВТЛШ, у яких проксимальна швидкість (V1) становить >1,5 м/с, проксимальну швидкість більше не можна ігнорувати, і оцінка градієнта тиску становить DP = 4(V2 2 V1 2 ). Однак, у протезах жовчного міхура та кулькових клапанах може відбуватися переоцінка градієнта більше, ніж у біопротезах, особливо при меншому розмірі клапанів та високому серцевому викиді (див. “Відновлення тиску”: Гемодинамічні умови та клінічні наслідки”; Рис. 3).27,28
- Ефективна площа отвору (ЕПО): Ефективна площа отвору протезного клапана, отримана за допомогою рівняння безперервності, є кращим показником функції клапана, ніж просто градієнт, оскільки вона менше залежить від потоку через клапан:
EOA = ударний об’єм/інтеграл швидкості-часу протезованого клапана (ІШЧ).
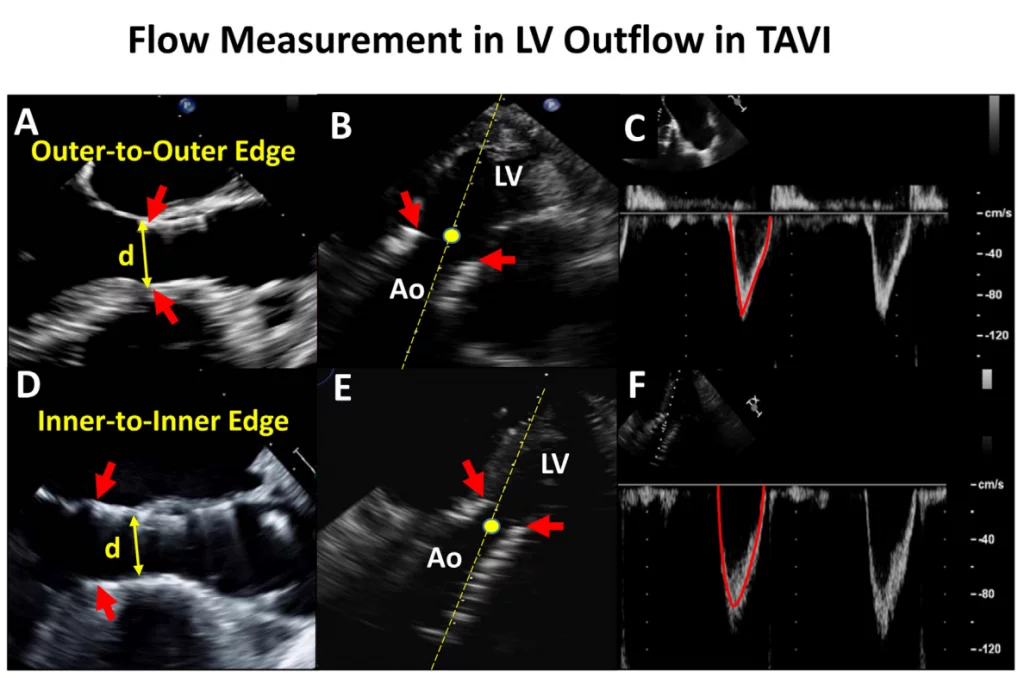
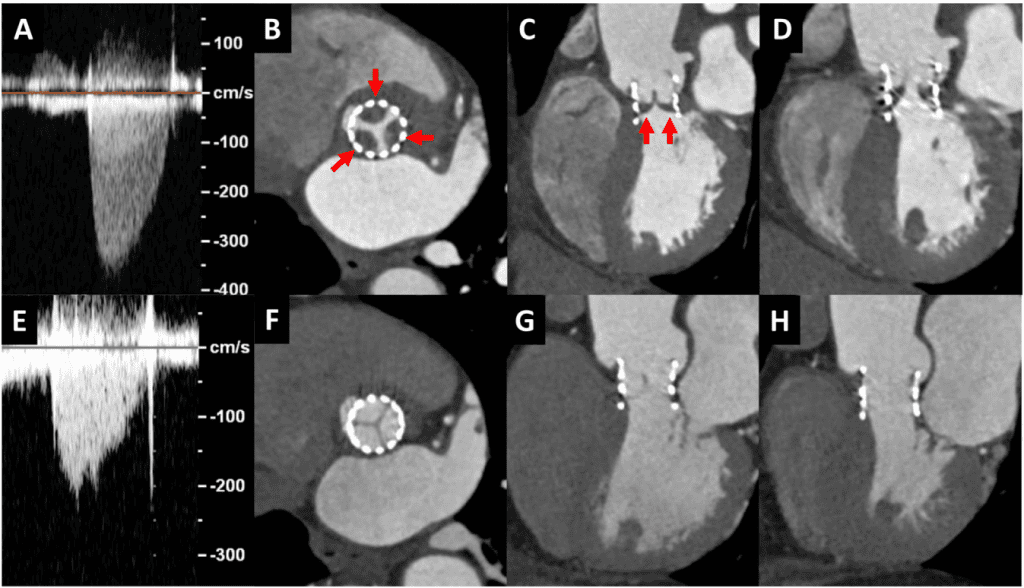
Для розрахунку ударного об’єму з використанням ВТЛШ вимірювання діаметра ВТЛШ і відповідне положення об’єму ІХ допплерівської проби вносять найбільші похибки в оцінку ЕПО.1,2 Діаметр, що використовується, завжди повинен бути найбільшим діаметром, виміряним перпендикулярно до напрямку ВТЛШ, а не середнім значенням, оскільки похибка полягає в недооцінці діаметру ВТЛШ. При хірургічній заміні аортального клапана (ХЗАК) діаметр вимірюють трохи нижче площини клапана. При ТІАК діаметр ВТЛШ переважно визначається як зовнішній діаметр стентованого клапана.3,11 Об’єм ІХ допплерівського зразка також повинен бути розміщений апікально до каркасу стента на піку систоли. Можна використовувати внутрішній діаметр стента, але відповідний об’єм ІХ допплерівської проби всередині стента може реєструвати прискорення потоку, завищуючи ударний об’єм (рис. 4). Використання розміру етикетки протезованого клапана для розрахунку площі поперечного перерізу кільця не рекомендується.29 Метод біпланарних дисків для розрахунку об’єму лівого шлуночка (ЛШ) (модифікований метод Сімпсона) і 3D-об’ємів ЛШ є альтернативними методами для розрахунку загального ударного об’єму ЛШ і ЕПО, особливо за наявності прискорення потоку в ВТЛШ. Однак, для запобігання недооцінки ударного об’єму ЛШ, яка, як відомо, трапляється при ехокардіографії порівняно з СМРТ, наполегливо рекомендується уникати форшорингу ЛШ та використовувати ультразвукові підсилювачі.30,31 При протезованих мітральних клапанах можна використовувати ударний об’єм, розрахований на рівні кільця аорти або легеневого кільця, за умови відсутності значного мітрального, аортального або ЛР.
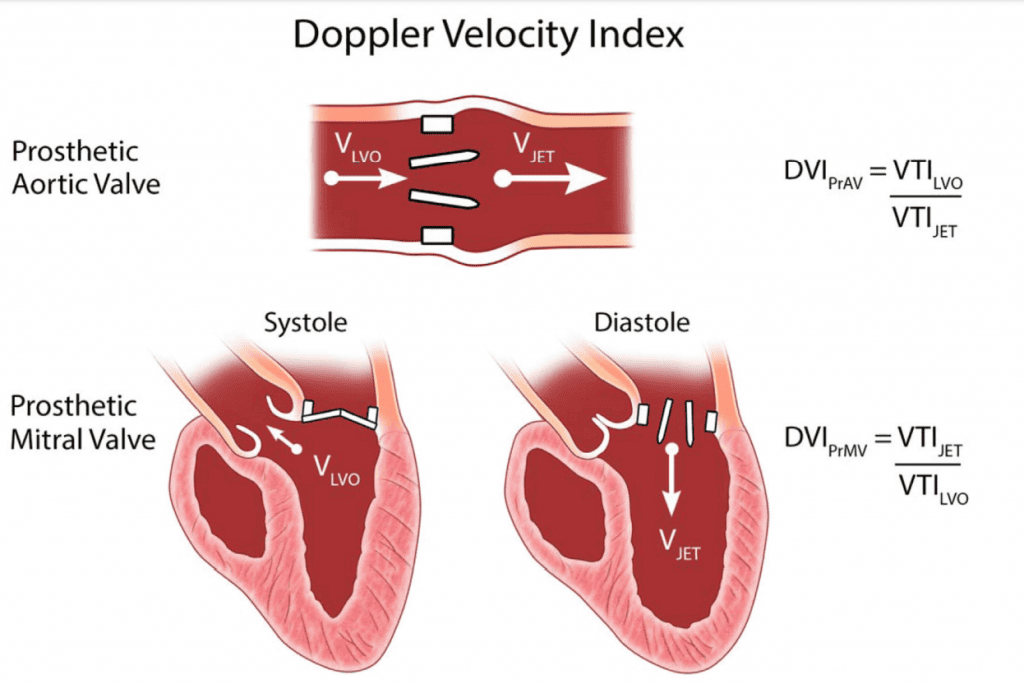
- Допплерівський індекс швидкості (ДІШ): У протезованих аортальних клапанах ДІШ – відношення ІШЧ проксимально до клапана до ІШЧ через клапан – можна використовувати для оцінки функції аортального клапана.29,32 ДІШ 0,35 асоціюється з несприятливими наслідками для ХЗАК, але не для ТІАК.32 Обернене значення цього показника використовується для протезування мітральних клапанів (Рис. 5).33 Для мітральних клапанів цей показник також допомагає виявити значну мітральну регургітацію (МР), оскільки швидкість потоку збільшується через мітральний клапан і зменшується в ЛШ при значній МР. Параметр ДІШ також може застосовуватися до протезованих легеневих клапанів і ТК , але потрібна додаткова валідація.
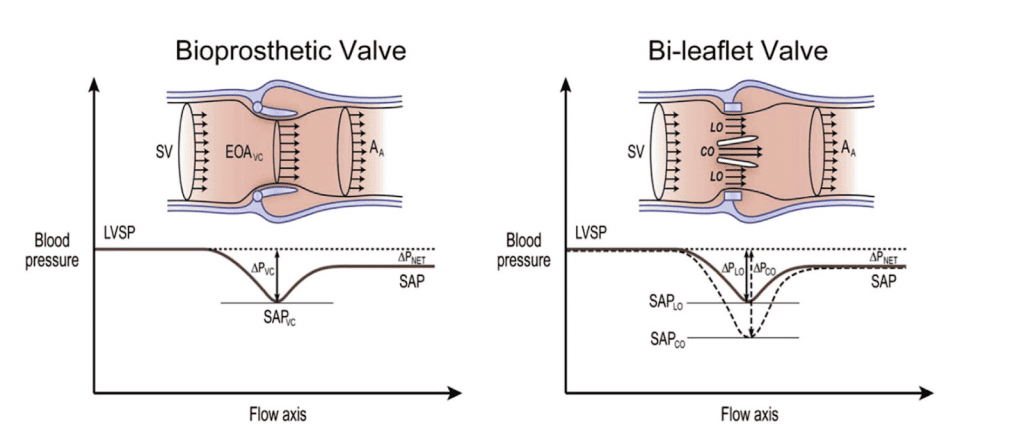
Рисунок 3 Відновлення тиску в протезованих клапанах. Схеми зміни швидкості і тиску в протезованих аортальних клапанах. Швидкість нижча, а систолічний артеріальний тиск (SAT) вищий на дистальному відділі аорти, ніж на рівні ВК. На лівому рисунку показано зміни швидкості і тиску від відтоку крові з лівого шлуночка LV до висхідної аорти (AA) в стентованому біопротезному клапані. Коли потік розширюється в ширший просвіт за клапаном, швидкість і кінетична енергія зменшуються, а тиск відновлюється. Величина цього явища невелика, за винятком пацієнтів з аортами діаметром <3 см. Справа, в механічних протезах жовчної протоки швидкість вища в центральному отворі (CO) порівняно з бічними отворами (LO); отже, падіння тиску на цьому рівні є вищим. Цього не спостерігається в жодному тарілчастому або біопротезному клапані. Менший об’єм CO створює струмінь з більшою швидкістю, що відповідає локальному падінню тиску, який потім відновлюється, як тільки центральний потік возз’єднується з потоками з двох бічних отворів. Допплерівська оцінка швидкості і градієнтів зазвичай не може розрізнити мінімальну і максимальну швидкість, що призводить до завищеної оцінки порівняно з інвазивним стандартом. LVSP, систолічний тиск у лівому шлуночку; SV, ударний об’єм у вихідному тракті ЛШ.
Рисунок 4 Розрахунок потоку у вихідному тракті лівого шлуночка в транскатетерних аортальних клапанах. Підхід за замовчуванням полягає у вимірюванні діаметру ВТЛШ, використовуючи зовнішній діаметр від краю до краю на нижньому (шлуночковому) кінці стента клапана (А, стрілка). ІХ об’єм зразка з апікальної проекції розміщується безпосередньо проксимальніше місця прискорення потоку на вході в стент (В). Потім розраховують ударний об’єм, як зазвичай, припускаючи кругову геометрію ВТЛШ як 0,785 d2 ІШЧ. У випадках, коли саморозширювальний клапан розміщений низько у вихідному тракті лівого шлуночка, особливо якщо нижній кінець стента не знаходиться в безпосередній близькості до передньої мітральної стулки і міжшлуночкової перегородки, альтернативним підходом є вимірювання внутрішнього діаметра стента клапана від краю до краю безпосередньо проксимальніше від стулок (D). Потім об’єм допплерівського зразка слід розмістити безпосередньо всередині стента, але проксимальніше від місця прискорення потоку на стулках клапана (E). Швидкість і ІШЧ будуть більшими, якщо ІХ допплерівський об’єм буде розміщений безпосередньо всередині стента (F проти C). Зверніть увагу, що при використанні транскатетерних клапанів спостерігається прискорення потоку на вході в стент і знову на стулках клапана. Червоні стрілки вказують на нижній кінець стента. Ао – аорта; LV- лівий шлуночок.
Рисунок 5 DVI доплерівський індекс швидкості, індекс ефективності роботи клапана, отриманий для протезованого аортального клапана (ПрАК) (PrAV) і для протезованого мітрального клапана (ПрМК) (PrMV).Інтеграл швидкості-часу ІШЧ (VTI) у вихідному тракті ЛШ (ВТ) (LVOT) визначається за допомогою ІХ допплерографії, а у струменевому відділі – за допомогою БХ допплерографії. Таку ж концепцію можна застосувати до легеневого клапана і ТК . Використання DVI в протезах мітрального, трикуспідального і легеневого клапанів допустиме за відсутності значної АР .
D. Відновлення тиску: Гемодинамічні умови та клінічні наслідки
У протезованих клапанах явище відновлення тиску може відбуватися у двох ділянках (Рис. 3): (1) нижче за течією від протезного клапана і (2) всередині деяких протезних клапанів, як правило, стулкових або кулькових.27,34-36
У першому сценарії (рис. 3, ліворуч), коли потік розширюється в ширший просвіт за клапаном, швидкість і кінетична енергія зменшуються, а тиск відновлюється. На величину відновлення тиску і точність допплерівських градієнтів впливають декілька факторів, включаючи профіль потоку, швидкість потоку, розмір камери за клапаном і спрощення рівняння Бернуллі, що може призвести до вищих градієнтів при допплерографії порівняно з інвазивними вимірюваннями.37 Величина цієї розбіжності, як правило, невелика, за винятком пацієнтів з аортами діаметром <3 см.
У другому сценарії (рис. 3, праворуч) конструкція механічних двостулкових і кулькових протезованих клапанів створює окреме відновлення тиску на рівні клапана, чого не спостерігається в моностулкових або біопротезних клапанах.38 У двостулкових клапанах менший центральний отвір створює високошвидкісний струмінь, який відповідає локальному падінню тиску, що нормалізується, як тільки центральний потік возз’єднується з потоками, що виходять з двох більших бокових отворів.34,38 БХ допплерівський запис часто включає цей високошвидкісний струмінь, що призводить до переоцінки градієнтів і недооцінки ЕПО порівняно з інвазивними гемодинамічними заходами, особливо при невеликих протезах і високошвидкісних станах. Диференціація струменів з центрального і бічного отворів можлива при протезованих мітральних клапанах за допомогою трансезофагальна ехокардіографії (ТЕЕ; у ближньому полі), але не за допомогою трансторакальної ехокардіографії (ТТЕ). Ефект відновлення тиску зазвичай не заважає оцінці функції ПКС, оскільки він вже закладений в нормальних значеннях допплерівських швидкостей, градієнтів і ДІШ різних клапанів (Додаток, таблиці А1-А9). Однак у пацієнтів з невеликими стулками аортального клапана (наприклад, 19 мм), що супроводжуються високим потоком, диференціація аномальної функції може вимагати подальшої оцінки руху і структури клапана за допомогою рентгеноскопії, КТ або ТТЕ. Останнє і найважливіше: коли клапан (біопротезний або механічний) стає стенозованим, ехокардіографічні та інвазивні методи дослідження клапанної гемодинаміки стають узгодженими і асоціюються з результатами.27,28,37
E. Невідповідність протеза пацієнту
НПП виникає, коли ЕПО протезованого клапана занадто мала відносно розміру тіла і потреб кровотоку в стані спокою пацієнта.39 ЕПО, а також морфологія і рухливість стулок є нормальними; однак, індексований ЕПО є малим для розміру тіла.40 Хоча НПП може бути однією з причин високих трансклапанних градієнтів, градієнти можуть бути нормальними при НПП з низьким кровотоком, що асоціюється з поганими наслідками.41
Діагностика аортальної НПП ґрунтується на вимірюванні ЕПО з використанням рівняння безперервності, індексованого на площу поверхні тіла пацієнта. КТ може надати додаткову діагностичну інформацію, включаючи підтвердження нормальної рухливості стулок, розміру протеза та площі входу стента. Вона також дозволяє виявити обструкцію клапана (знижену рухливість через тромб, кальцифікати або паннус).2 Було показано, що градієнти збільшуються експоненціально, коли індексована ЕПО становить <0,8-0,9 см2 /м2 . 39,42 Важливо, що індексована ЕПО може переоцінювати тяжкість НПП на тлі ожиріння (індекс маси тіла > 30 кг/м2 ), і тому для таких пацієнтів запропоновано різні пороги НПП.
Вплив аортальної НПП на клінічні наслідки зростає зі збільшенням ступеня тяжкості.43,44 Повідомляється, що частота помірної аортальної НПП при ХЗАК варіює від 20% до 70%, тоді як частота тяжкої НПП – від 2% до 20%.40 Частота тяжкої НПП при ТІАК є нижчою, ніж при ХЗАК.45,46 Слід підкреслити, що індексований ЕПО (а не розмір або геометричні характеристики протеза) є єдиним параметром, який послідовно пов’язаний з післяопераційними градієнтами та/або несприятливими клінічними наслідками. ХЗАК НПП асоціюється зі зниженням здатності до фізичного навантаження та нижчим функціональним класом. Основним несприятливим клінічним наслідком НПП є зниження короткострокового і довгострокового виживання, але також повідомлялося про вищі показники серцевої недостатності і госпіталізації, меншу регресію гіпертрофії ЛШ і швидший розвиток СДК.40 Гірші результати також були описані у певних підгрупах пацієнтів, таких як особи віком від 65 до 70 років та особи з супутньою дисфункцією ЛШ, значною гіпертрофією, низькоградієнтним аортальним стенозом та МР.47,48 Аортальної НПП зазвичай можна уникнути47,49,50 за допомогою розрахунку прогнозованої індексованої ЕПО протеза перед імплантацією. Якщо передбачається НПП, рекомендується вибрати альтернативний протез, зробити вибір на користь ТІАК або розглянути можливість операції з розширення кореня аорти.40
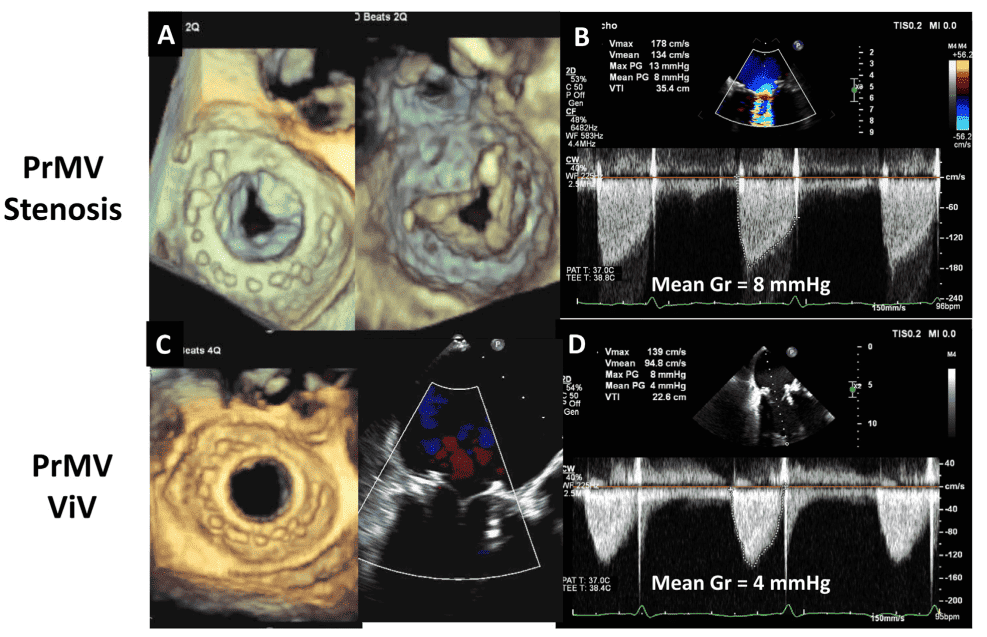
НПП також може виникати при використанні мітральних протезів, але кореляція між індексованим ЕПО і трансклапанними градієнтами не така сильна, як при використанні аортальних протезів.51 Розрахунок індексованої ЕПО для мітральних протезів найкраще проводити за допомогою рівняння безперервності; слід підкреслити, що розрахунок ЕПО за методом напівперіоду тиску (НПТ) часто є неточним і призводить до завищення ЕПО, особливо в нормальних клапанах.52,53 Порогові значення для мітральної НПП вищі, ніж для аортальних клапанів, з ідеальною індексованою ЕПО >1,2 см2 /м2 , щоб уникнути аномально високих післяопераційних градієнтів.53 Помірна мітральна НПП визначається як <1,2 см2 /м2 , а тяжка мітральна НПП визначається як 0,9 см2 /м2 . 2,54 Поширеність мітральної НПП варіює від 39% до 71%. Він асоціюється зі стійкою легеневою гіпертензією та зниженим періопераційним і довгостроковим виживанням.55,56 Мітральний НПП можна запобігти або мінімізувати шляхом імплантації протеза з більшим прогнозованим ЕПО, коли це можливо.54
F. Фізіологічна регургітація
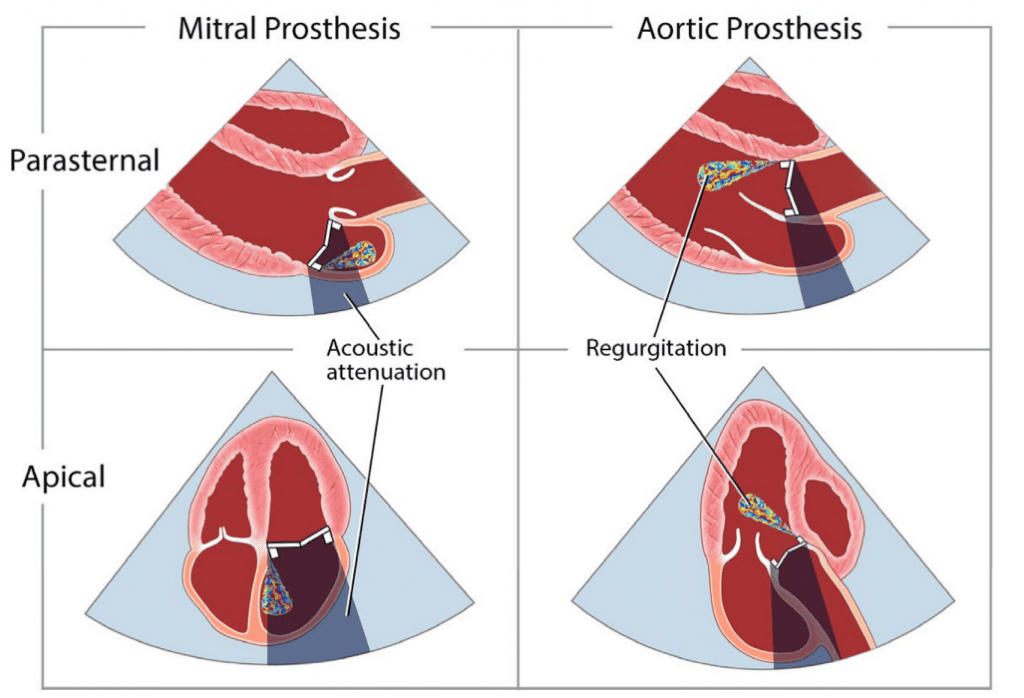
Механічні клапани зазвичай мають незначні регургітаційні струмені. Можна спостерігати два типи “фізіологічної” регургітації: об’єм закриття (ретроградне витіснення крові, спричинене рухом оклюдера) і справжню тривіальну або легку регургітацію на шарнірах оклюдера. Для клапана StarrEdwards зазвичай характерний малий об’єм закриття і незначна або відсутня справжня трансклапанна регургітація (рис. 1). Клапани з одним нахиленим диском мають обидва типи регургітації, але схема може відрізнятися: клапан BjorkShiley має невеликі струмені, розташовані безпосередньо всередині зшивного кільця, де закритий диск стикається з корпусом, тоді як клапан Medtronic-Hall має ті ж самі струмені плюс один великий струмінь через центральний отвір у диску, де він повертається (Рис. 1). Двостулкові клапани, які зараз широко використовуються, зазвичай мають кілька струменів, розташованих безпосередньо всередині зшивного кільця, де закриті стулки стикаються з корпусом, і по центру, де закриті стулки стикаються одна з одною (рис. 1). Вважається, що ці “промивні струмені” запобігають утворенню тромбів у місцях застою всередині зшивного кільця. Фракція регургітації зазвичай не перевищує 10-15%; відповідний кольоровий струмінь може виглядати великим, до 5 см завдовжки (особливо в клапанах Medtronic-Hall), але вузьким на початку. У випадку двостулкових клапанів промивні струмені, як правило, розташовуються у формі, по два з кожної точки повороту; іноді ці поодинокі поворотні промивні струмені розділяються на два або три окремі “шлейфи” (Рис. 1). Струмені завжди мають низький імпульс, тому вони однорідні за кольором, а аліасинг приурочений переважно до основи струменя. Все частіше повідомляється про регургітацію в нормальних біологічних клапанах, головним чином через покращену доплерівську чутливість сучасних ультразвукових апаратів. Нестентовані клапани, включаючи гомографти та аутографти, частіше, ніж стентовані клапани, мають незначні регургітаційні струмені. Черезшкірні аортальні клапани рідко мають невелику центральну регургітацію. Частіше регургітація є паравальвулярною в місці прилягання стента до кальцинованого нативного клапана (Рис. 2).3 Частота паравальвулярної регургітації значно зменшилася з удосконаленням конструкції стулок клапана.
G. Патологічна регургітація при протезуванні
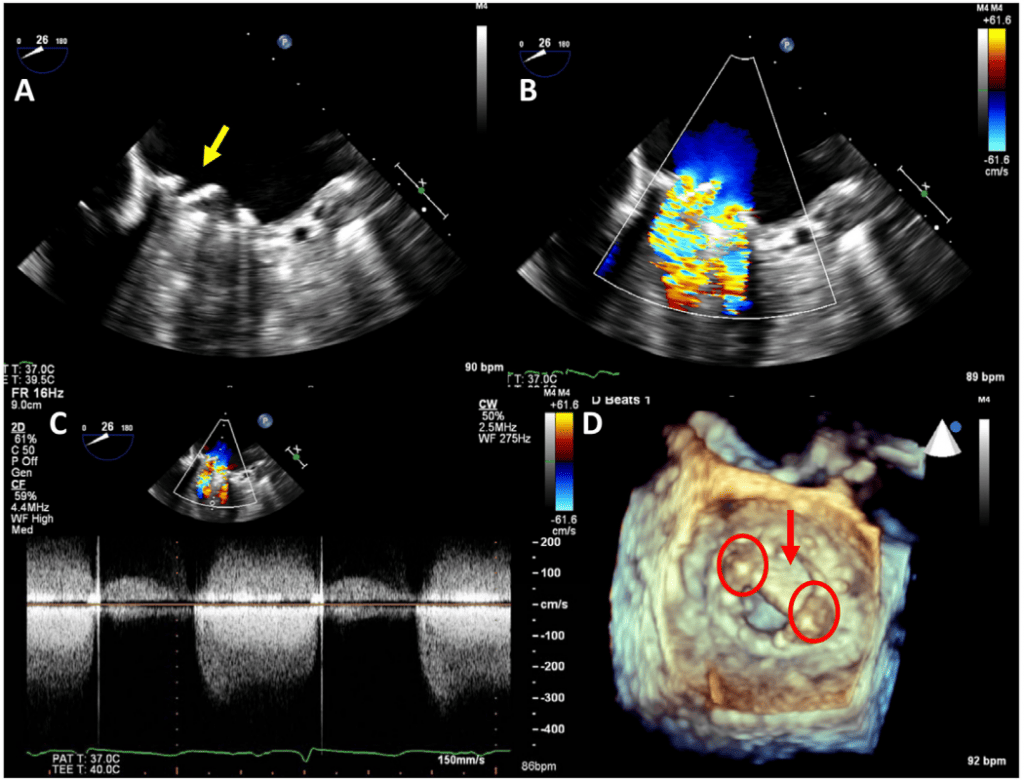
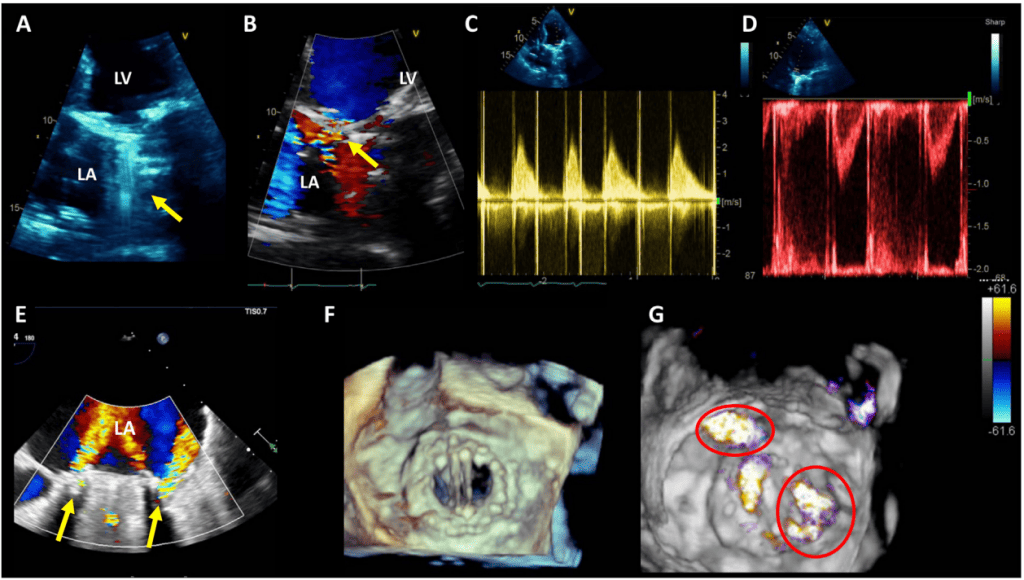
Патологічна регургітація може бути центральною або параклапанною. Патологічна центральна клапанна регургітація найчастіше спостерігається при використанні біологічних клапанів, тоді як параклапанна регургітація може спостерігатися при будь-якому типі клапанів, але частіше при механічних та черезшкірних клапанах (Рис. 2). Локалізація паравертебральної регургітації може бути складною, але можливою, якщо можна візуалізувати струмінь, який виходить з-під зшивного кільця і рухається за його межами. Для цього може знадобитися використання декількох положень датчика і позаосьових зображень.3 Мультипланарна і/або 3D-ТЕЕ може бути корисною, особливо при дослідженні мітрального клапана і ТК. Хоча паравальвулярна регургітація є патологією, невеликі струмені не є рідкістю, особливо під час періопераційного обстеження на ранній стадії після хірургічного втручання. Відразу після імплантації поширеність паравальвулярної регургітації коливається від 5% до 20%57; більшість цих витоків, однак, є клінічно і гемодинамічно незначущими і, за відсутності ендокардиту, мають доброякісний перебіг. Загалом, ті ж самі методи, що використовуються для кількісної оцінки нативної клапанної регургітації58 , можуть бути використані для протезованих клапанів, але застосування цих методів може бути більш складним. Через акустичну реверберацію та затінення від протеза виявлення регургітації за допомогою TTE є складнішим для клапанів у мітральній та трикуспідальній позиціях, особливо для механічних клапанів (рис. 6). Непрямі ознаки з різних допплерівських параметрів можуть вказувати на наявність значної регургітації. Однак для діагностики МР часто потрібне проведення ТЕЕ. Часта ексцентриситетність регургітаційних струменів, особливо в механічних клапанах, ускладнює або обмежує кількісну оцінку регургітації в цілому. Множинні невеликі нормальні транспротезні струмені не піддаються точному кількісному визначенню, але вони, як правило, не мають клінічної значущості. Для паравальвулярних струменів частка окружності зшивного кільця, яку займає струмінь, дає приблизне уявлення про тяжкість.3 Порівняльні вимірювання потоку для визначення об’єму або фракції регургітації, які часто ґрунтуються на визначенні ударного об’єму в кільцевих ділянках, можуть бути використані для протезування аортальної регургітації (АР) і ЛР, але не для протезування МР, оскільки мітральний приплив не може бути виміряний за допомогою допплерографії через наявність мітрального протезу. Використання 3D-ТЕЕ з допплерографією покращує оцінку та кількісну оцінку протезованої регургітації.59
Зображення 6 Вплив положення механічного протезу клапана і виду ехокардіографічного зображення на ослаблення ультразвуку і маскування кольорового допплерівського струменя потоку регургітації. Вищий ефект від трансторакальної візуалізації спостерігається на протезах в мітральній позиції порівняно з аортальною позицією.
H. Зміни під час стресу
Стрес-ехокардіографія може бути корисною для оцінки симптомів у пацієнтів з протезованими клапанами,60 особливо коли є невідповідність між гемодинамікою клапана у стані спокою та симптомами пацієнта. Нормально та аномально функціонуючі протезовані клапани можуть мати подібні трансклапанні градієнти у стані спокою.61 Симптоми можуть розвиватися внаслідок протезного стенозу або регургітації, НПП, коронарних стенозів або легеневих захворювань, і їх можна оцінити під час стрес-ехокардіографії. Оскільки гемодинаміка може швидко повернутися до вихідного рівня після навантажень на біговій доріжці, кращими методами є велоергометрія в положенні лежачи і фармакологічний стрес з добутаміном; обидва дозволяють оцінити клапанну гемодинаміку під час стресу і на піку стресу. Вправи, як правило, є кращими за фармакологічний стрес через їх фізіологічну реакцію, що є важливим у цих клінічних обставинах. Загалом, оцінка обструкції клапана повинна бути подібною до оцінки стенозу нативного клапана, а деталі щодо протоколів стресових тестів були описані раніше.60
I. Міркування щодо інтраопераційного та інтрапроцесуального керівництва
ТЕЕ з використанням як 2D, так і 3D візуалізації залишається основою для інтраопераційного та інтрапроцедурного керівництва при встановленні ПКС. Крім того, внутрішньосерцева ехокардіографія (ВСЕ), включаючи 3D ВСЕ і злиття зображень, стає все більш важливою для візуалізації під час структурних процедур. Інші підходи, такі як епікардіальна та епіаортальна ехокардіографія, використовуються в операційній нечасто, згідно з місцевим досвідом.62 i. Інтраопераційна ехокардіографія під час встановлення протезованого клапана: Окрім оцінки дисфункціональних протезованих клапанів або нещодавно встановлених протезів, ТЕЕ може виявити раніше невиявлену патологію для відповідного хірургічного планування і спрямовувати розміщення канюль для полегшення серцево-легеневого шунтування, особливо при малоінвазивних і роботизованих операціях на клапанах. Фундаментальною метою інтраопераційної оцінки нових клапанів є діагностика будь-якої патології, яка вимагає відновлення штучного кровообігу і негайної хірургічної корекції. До них відносяться значна параклапанна регургітація, розшарування протезів і ускладнення в сусідніх структурах, такі як коронарна остіальна обструкція або застрягання стулок протезного клапана. Тривимірна ТЕЕ має значний вплив на оцінку ПКС при мітральній позиції порівняно з іншими позиціями через близькість мітрального клапана до лівого передсердя і візуалізацію всього мітрального клапана “анфас”. Тривимірна ТЕЕ особливо корисна для виявлення та характеристики параклапанної регургітації. Більш комплексний підхід до інтраопераційної візуалізації протезованих клапанів обговорюється в настановах ASE щодо використання ТЕЕ для допомоги в прийнятті хірургічних рішень.62
- Орієнтування по зображенню під час черезшкірної заміни протезованого клапана
- Двовимірна та тривимірна ТЕЕ: TEE є важливим інструментом для наведення зображення при черезшкірній заміні ПКС, особливо для протезування мітрального клапана, а також для усунення паравальвулярної регургітації.63 TEE для ТІАК також була широко розглянута. Заміна легеневого клапана (ЗЛК) часто виконується під керівництвом ІСЕ. Телевізійне втручання все ще є експериментальним, але проводиться за допомогою ТЕЕ, доповненої, за необхідності, ІХЕ.
- ТІАК: Керування зображенням під час ТІАК виконується з використанням як трансторакального, так і черезстравохідного ехокардіографічних підходів.3,64 Основна увага приділяється виявленню паравальвулярної регургітації з урахуванням основних ускладнень, які можуть виникнути після ТІАК, таких як розрив кільця аорти, дефект міжшлуночкової перегородки, періаортальна гематома, обструкція ВТЛШ і втручання в роботу мітрального клапана.64,65. Більшість лабораторій застосовують напівкількісний підхід, використовуючи кольорову допплерографію лише в цьому випадку, а за потреби підтверджують діагноз інвазивною гемодинамікою та аортографією.
- Ремонт або заміна мітрального клапана. Тривимірна TEE була революційною щодо керівництва транскатетерним ремонтом мітрального клапана від краю до краю і розгортання пристрою.66,67 Тривимірна TEE також важлива для розміщення КвК в мітральній позиції при дегенеративному біопротезуванні клапана, невдалому відновленні мітрального клапана хірургічним кільцем або при процедурі кальцифікації кільцевого клапана в мітральному відділі.63
- Ремонт або заміна трикуспідального клапана при вродженій трикуспідальній регургітації (ТР): Ремонт або заміна ТК , як правило, проводиться за допомогою 2D і 3D TEE. У цій більш складній і відносно новій процедурі рекомендується додаткова візуалізація з глибокої стравохідної позиції, щоб уникнути акустичного шуму з боку лівих відділів серця. З цього рівня найбільш корисними є зображення притоку-витоку з ортогональними 140 та 40-60 видами з глибокого стравоходу.68 Вид 140 ТЕЕ корисний через відсутність прилеглих структур, які перешкоджають проходженню ультразвукового променя.68-70.
Таблиця 2 Мультимодальна візуалізація протезованих клапанів після первинної трансторакальної ехокардіографічної оцінки: переваги та обмеження
| Методи діагностики | Переваги | Недоліки |
| TEE | – Висока просторова та часова роздільна здатність у реальному часі структури та функції клапанів – Доплерівська кількісна гемодинамічна оцінка функції клапанів – Найкраща візуалізація та оцінка мітрального клапана (анфас), а також аортального, трикуспідального та легеневого клапанів: Рух стулок та оклюдера/стулок, етіологія дисфункції, градієнт; оцінка локалізації та тяжкості регургітації (транс- або параклапанна) – 3D TEE, з використанням прямих зображень та/або МПР, може запропонувати більш точну оцінку структури клапана, руху стулок/оклюдера, локалізації ПВВ та оцінку вихідного рівня перед структурним втручанням. – Виявлення клапанних вегетацій (малих, рухомих) – Виявлення параклапанних ускладнень (дегісценція, абсцес, псевдоаневризма) – Портативність, можливість використання у відділеннях інтенсивної терапії/відділеннях невідкладної допомоги та в інтубованих пацієнтів – Відсутність протипоказань при нирковій дисфункції | – Оптимальна візуалізація та оцінка клапана залежить від положення клапана та датчика – реверберація/затінення від протезованих клапанних структур ближнього поля перешкоджають візуалізації структур дальнього поля; зміна акустичних вікон може дозволити візуалізувати раніше затінені структури. – Менша можливість оцінити структуру та функцію легеневого клапана; потрібні спеціальні види |
| ВСЕ | – Найкраща модальність для оцінки легеневого клапана і стулок та передніх структур серця – 3D ВАІТ може показувати пряму проекцію легеневого клапана і стулок, а також мітрального клапана (при виконанні з лівого передсердя) – Одночасна двоплощинна візуалізація з використанням 3D ВАІТ має вищу часову і просторову роздільну здатність у порівнянні з 3D об’ємними зображеннями. | – Вузька ширина сектора об’ємних зображень 3D ВСЕ з обмеженою часовою та просторовою роздільною здатністю – Кольоровий доплер у 3D ВСЕ має низьку просторову та часову роздільну здатність у сучасних системах |
| КТ | – Відмінна просторова роздільна здатність – Хороша візуалізація руху оклюдера/стулки, паннуса та кальцифікації/потовщення стулки незалежно від положення клапана – Виявлення параклапанних ускладнень (дегідратація, абсцес, псевдоаневризма) – Корисно в контексті декількох протезованих клапанів, де артефакт може впливати на якість ТЕЕ | – Відсутність гемодинамічної оцінки – тяжкість регургітації клапана визначається на основі анатомічного дефекту; легка регургітація або шунт можуть бути не виявлені. – Артефакт зміцнення променя, особливо в механічних клапанах, може перешкоджати виявленню вегетацій, тромбу, паннуса, невеликої дегідратації – Нефротоксичні контрастні речовини, необхідні для ангіографії (неконтрастна КТ може бути використана для механічного руху клапана) – Повні R-R зйомки сприяють збільшенню дози опромінення – Тимчасова роздільна здатність може бути обмеженою. |
| СМРТ | – Кількісне визначення пікової швидкості та градієнтів (у біопротезованих клапанах), незалежно від положення клапана – Кількісне визначення об’єму та фракції регургітації у регургітаційних клапанах – Визначення анатомічної площі клапана та патологій стулок у біопротезованих клапанах (потовщення, стулки) – Виявлення великих параклапанних ускладнень (наприклад, дегісценція, псевдоаневризма) | – Обмежена просторова і часова роздільна здатність – Артефакт від протезу заважає оцінці механічних клапанів і деяких біопротезних клапанів – Неможливість виявлення дрібних, високорухомих рослин – Нерегулярний ритм і фібриляція передсердь впливають на візуалізацію клапанів (потенціал для подолання за допомогою кінескопів в реальному часі) і кількісне визначення потоку крові |
ВАІТ, Відділення інтенсивної терапії; МПР, мультипланарна реконструкція.
J. Інші методи оцінки ПКС
- Кіно-флюороскопія: Кіно-флюороскопія була початковою неінвазивною методикою оцінки механічних клапанів.71 Завдяки рентгеноконтрастній основі та дисковому оклюдеру можна оцінити аномальний нахил кільця основи та порушення рухливості дискового оклюдера. Аномальний нахил опорного кільця свідчить про значну дегідратацію клапана та параклапанну регургітацію. Порушення рухливості тарілчастого оклюдера можна оцінити шляхом розрахунку кутів відкриття і закриття, що свідчить про дисфункцію протезованого клапана.71 Кінефлюороскопія має обмежену цінність при біопротезуванні клапанів. Кальцифікати на стулках біопротеза можуть свідчити про дегенерацію клапана, хоча її гемодинамічний вплив неможливо оцінити. З появою ТЕЕ та все ширшим застосуванням КТ серця кіно-флюороскопія тепер є насамперед додатковим інструментом для оцінки механічної рухливості клапанів.
- Катетеризація серця: Широка доступність ехокардіографії обмежує потребу в інвазивній гемодинамічній оцінці при дисфункції протезованого клапана. Для інвазивного розрахунку ЕПО клапана використовується формула Горліна.72 В ідеалі слід використовувати підхід з двома катетерами для одночасного вимірювання тиску перед і після клапана. Слід уникати перетину катетером механічного клапана для вимірювання градієнта тиску через потенційні ускладнення.73 При протезованому мітральному стенозі тиск в легеневій артерії (ЛА) для вимірювання трансмітрального градієнта тиску часто призводить до переоцінки істинного градієнта, що призводить до недооцінки площі клапана; пряме вимірювання тиску в лівому передсерді за допомогою транссептальної техніки рекомендується в обставинах, коли необхідна інвазивна оцінка мітрального стенозу.74,75 Ін’єкція контрасту може бути використана для оцінки протезованої трансклапанної або параклапанної регургітації та інших ускладнень, включаючи нориці та псевдоаневризму.
iii. КТ: КТ з електрокардіографічним гейтингом забезпечує об’ємну візуалізацію протезованого клапана і камер серця з високою просторовою роздільною здатністю, яку можна комбінувати з візуалізацією повного серцевого циклу для забезпечення функціональної та анатомічної оцінки. У пацієнтів з аритміями часто корисною є ретроспективна стробілізація, якій сприяє використання реконструкцій з абсолютною затримкою (в мілісекундах), а не відносною затримкою (у відсотках).76 КТ є найбільш корисною, коли дисфункція клапана виявлена на ТТЕ, але її етіологія не з’ясована або планується структурне втручання. Переваги та обмеження сучасних методів візуалізації після первинного трансторакального ехокардіографічного дослідження протезованих клапанів детально описані в таблиці 2. Відносні переваги TTE, TEE, КТ і CМР в оцінці структури, функції та ускладнень протезованих клапанів показані в таблиці 3. КТ має обмежену роль у рутинному спостереженні або кількісній оцінці тяжкості гемодинамічних порушень. Неконтрастні зображення можна використовувати для оцінки механічної рухливості клапана, коли можна точно виміряти ступінь відкриття стулки. Додавання внутрішньовенного контрасту дозволяє виявити і потенційно диференціювати тромб і паннус як основну причину будь-якого обмеження руху (Рис. 7).77 Точність КТ з контрастом знаходиться на рівні 3D TEE для ПКС і може бути вищою для механічних клапанів аорти і легеневих клапанів.77 При біопротезуванні клапанів рутинне використання внутрішньовенного контрасту є корисним, оскільки дозволяє оцінити потовщення стулок і обмеження руху, а також виявити і локалізувати значні ПВВ.78,79 Слід зазначити, що фетр або застави можуть мати дещо вищі або подібні одиниці Хаунсфілда в якості контрасту, і тому можуть бути помилково сприйняті за невеликі ПВВ. Порівняння неконтрастних зображень і кореляція з ехокардіографією є важливими для точної ідентифікації ПВВ. З іншого боку, невеликі ПВВ можуть бути приховані металевими артефактами від протезного кільця або дискових оклюдерів. Кальцифікація стулок біопротезного клапана є маркером дегенерації, однак наразі не існує кількісної або бальної стратегії, яка б дозволила використовувати його в діагностичних цілях.80 КТ також може відігравати додаткову роль в діагностиці ендокардиту протезного клапана, при цьому ТЕЕ забезпечує більш точну оцінку вегетацій стулок і перфорацій, тоді як КТ забезпечує більш точну оцінку наявності абсцесу кореня клапана.81
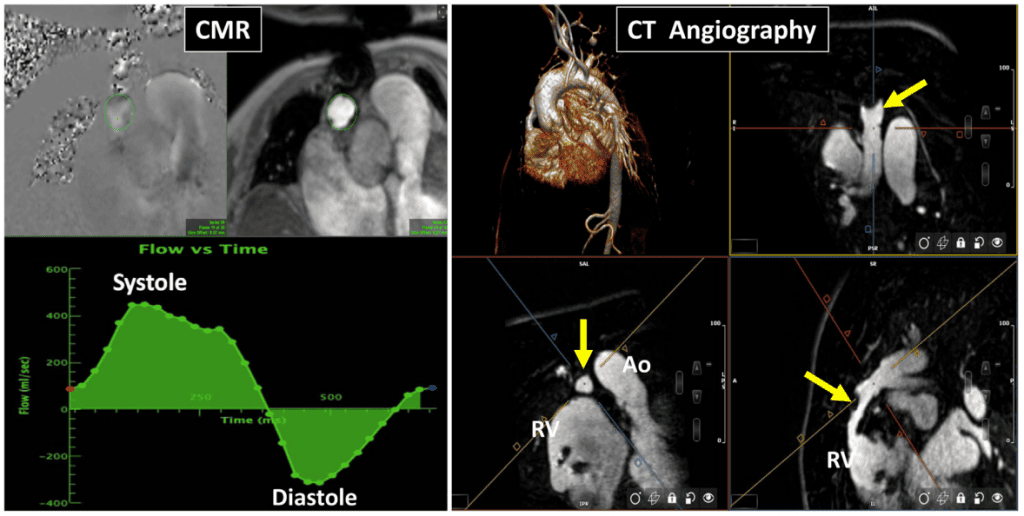
- КТ: КТ відіграєдопоміжну роль в оцінці функції ПКС (табл. 2). ПКС можна безпечно візуалізувати за допомогою 1,5- і 3-Тл магнітів, які є найбільш поширеними напруженістю поля, що використовуються в клінічній практиці.82- 84 Різні методики, що використовуються в CМР і їх застосування для оцінки протезованих клапанів, детально описані на рисунку 8. Наявність стенозу або регургітації протезованого клапана можна спочатку розпізнати на кіно-зображеннях. Однак кадри зі забалансованою стійкою прецесією (ЗСП) чутливі до артефактів і менш чутливі до потоку. Послідовності швидко-градієнтної ехо-сигналу можуть допомогти зменшити артефакти, пов’язані з потоком,85,86 а послідовності спін-ехо-сигналу можна використовувати для зменшення артефактів протезованого клапана.83 Ступінь артефакту пов’язаний з типом клапана (наприклад, механічний vs біопротез, двостулковий vs одностулковий, стентований vs нестентований) і може бути незначним або значним, причому останній випадок унеможливлює діагностичну оцінку. За наявності мінімальних артефактів кіно-зображення можуть допомогти візуалізувати екскурсію стулок біопротеза або механічних оклюдерів ПКС, дозволити провести планіметрію області біопротезного клапана,85,86 та ідентифікувати перебільшений рух протеза в контексті дедисценції клапана. Фазово-контрастні зйомки з використанням площинного фазового кодування можуть допомогти покращити візуалізацію турбулентності потоку через стенозовані протезовані клапани або як клапанну, так і параклапанну регургітацію. Для оцінки стенозу ПКС фазово-контрастні зображення з використанням наскрізного фазового кодування дають можливість прямої кількісної оцінки пікових швидкостей/градієнтів через ПКС.87 Однак це зазвичай неможливо для механічних протезів у мітральній і трикуспідальній позиціях через артефакт і часто є складним завданням для біопротезованих клапанів через кільцеву трансляцію. Для оцінки клапанної або параклапанної регургітації наскрізні фазово-контрастні зображення можуть забезпечити кількісну оцінку загального ударного об’єму, об’єму регургітації та фракції регургітації для ПКС в аортальній та легеневій позиціях (рис. 9, табл. 2).58,88 Для мітрального клапана та ТК необхідний непрямий підхід з використанням комбінації ударного об’єму шлуночків та наскрізних фазово-контрастних зображень в аортальній або легеневій позиціях.58,88 Конкретні методи описані у відповідних розділах щодо клапанів нижче та в попередніх настановах ASE.3,58
- Позитронно-емісійна томографія серця (ПЕТ): Основна роль ПЕТ серця полягає в обстеженні при підозрі на ендокардит протезованого клапана. ПЕТ з фтордезоксиглюкозою покаже інтенсивне збільшення поглинання в прилеглій кільцевій тканині при наявності ендокардиту протезованого клапана (рис. 10),89 хоча це слід інтерпретувати з обережністю, оскільки низьке або проміжне паравальвулярне поглинання є нормальною знахідкою навіть через 1 рік після операції.90,91 Фтор-18 може бути корисним для виявлення клапанів з ризиком структурної дегенерації; однак результати в цій галузі обмежені, і необхідна подальша робота.80
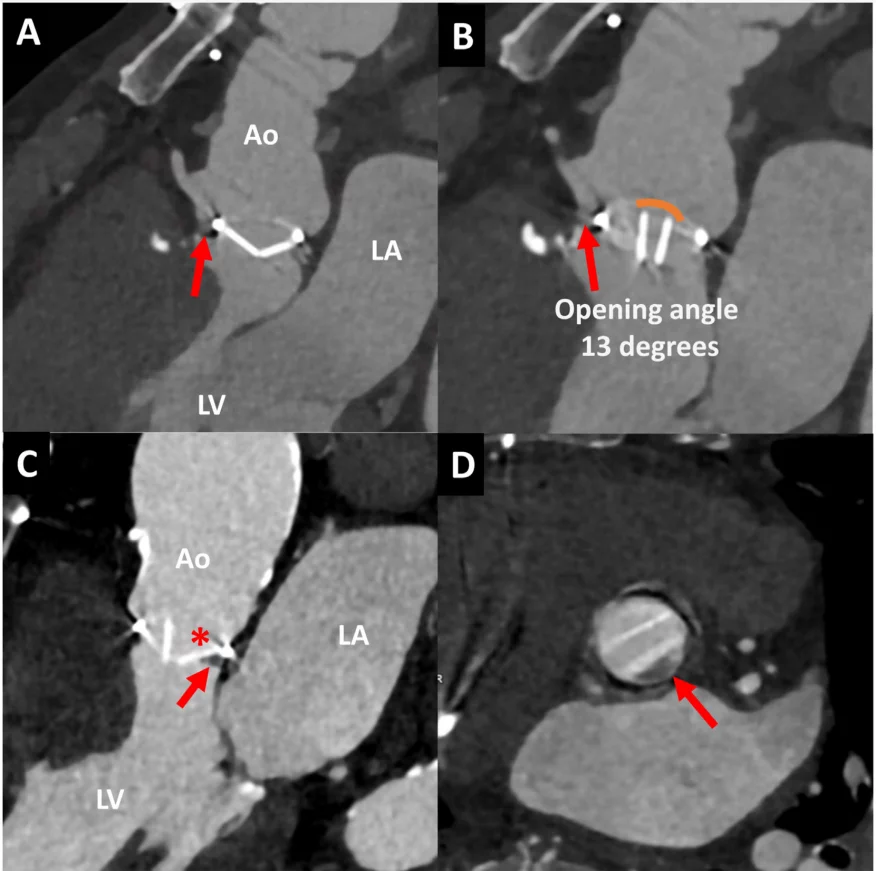
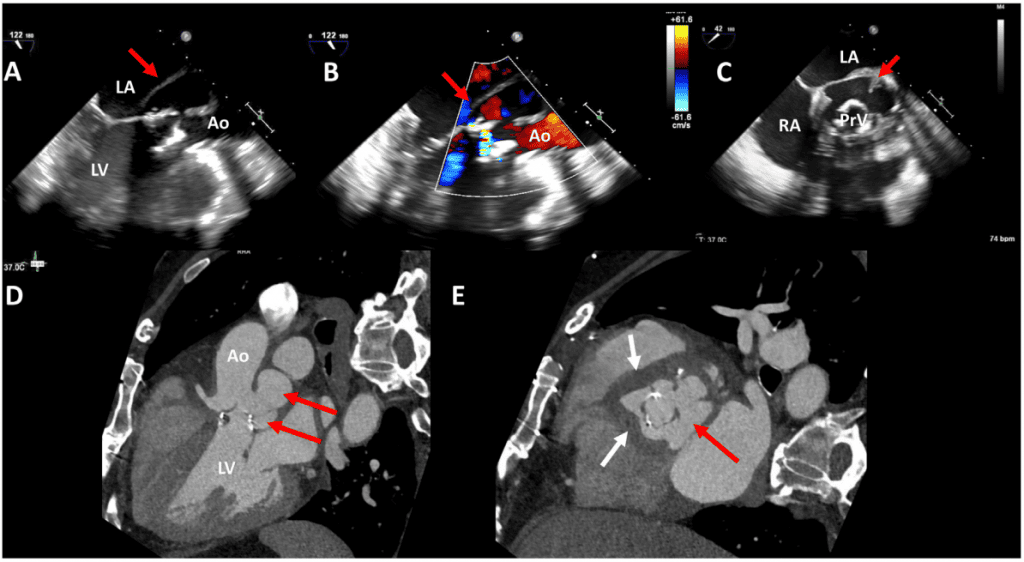
Рисунок 7 Два випадки двостулкових механічних аортальних клапанів, зображених за допомогою комп’ютерної томографічної ангіографії серця. У випадку 1 пацієнта після процедури Bentall (верхні панелі) показано аортальний клапан в діастолу (А) і систолу (В) з нормальними кутами закриття і відкриття. Однак є передня паравальвулярна дедисцензія (червоні стрілки). У випадку 2 (нижні панелі) на трикамерних і короткоосьових зображеннях видно застиглий диск механічного аортального клапана (зірочка), зображений у систолу (С). Паннус видно над лівим коронарним кінцем (стрілка) на поздовжніх (С) і коротких (D) зображеннях, одиниці Хаунсфілда 150. Ао – аорта; LA – ліве передсердя; LV – лівий шлуночок.
Ключові моменти для оцінки ПКС 1.
Перед оцінкою гемодинаміки функції МКК необхідно розуміти різні типи МКК. Важливим є знання типу та розміру клапана у конкретного пацієнта. 2. Дисфункцію біопротезного клапана можна розділити на наступні категорії: СДК, неструктурна дисфункція клапана, тромбоз і ендокардит. 3. Комплексна оцінка функції протезованого клапана включає ехокардіографічну візуалізацію (2D і 3D), допплерографічну оцінку та відповідну клінічну інформацію. 4. Стрес-ехокардіографія може бути корисною для оцінки симптомів у пацієнтів з протезованими клапанами. 5. Двовимірна ТЕЕ та 3D ТЕЕ залишаються основою для інтраопераційного та інтрапроцедурного керівництва при встановленні ПКС. 6. КТ і CМР надають додаткову і цінну інформацію до трансторакальної ехокардіографічної оцінки МКП. КТ особливо корисна для оцінки анатомії клапанів, в той час як CМР може забезпечити оцінку гемодинаміки.
Серцевий магнітний резонанс протезованих клапанів, Гомотрансплантати та кондуїти 1,5Т і 3Т підходять
| Анатомія та візуалізація потоку | Кількісний потік/швидкість | 3D Анатомія | Фіброїди |
| ЗСП – Стандартне кіно – Кілька площин – Шлуночки і клапани – Кількісна оцінка об’ємів камер – Оцінка руху стулок/потовщення в біопротезних клапанах і каналах – Клапанна планіметрія – Проблеми з великою сигнальною порожнечею ПКС | 2D фазовий контраст – вимірюйте потік і швидкість – розміщуйте на 0,25-0,44 мм нижче за течією від ПКС – може бути складним при МК/ТК через наскрізну площину; непряма оцінка за допомогою шлуночкового УО та аортального/легеневого потоку може покращити оцінку в цих ситуаціях – 3D фазовий контраст може більше характеризувати ексцентричні стенозуючі струмені. | 3D МРА – Оцінка аорти та легеневих артерій – Оцінка розміру та стенозу кондуїту | Характеристика тканин – Оцінка фіброзу міокарда – Оцінка фіброзу/запалення судин |
| Градієнтне ехо – Зменшує ефект потоку – Кілька площин – Проблеми з великою пустотою сигналу ПКС | 4D фазовий контраст – Вимірювання потоку і швидкості в 3 площинах одночасно по всьому серцю і судинах – Візуалізація потоку, кількісна оцінка потоку і поліпшення гемодинаміки – Здійсненно в ПКС з низьким рівнем сигналу | ||
| Спін-ехо – Лише повні зображення – Кілька площин – Не залежить від пустого сигналу ПКС |
Рисунок 8 Методологія магнітного резонансу серця та відповідні застосування в оцінці протезів аортальних клапанів, гомографтів і кондуїтів. МРА, магнітно-резонансна ангіографія; МК, мітральний клапан; ЗСП, збалансована стійка прецесія; УО, ударний об’єм.
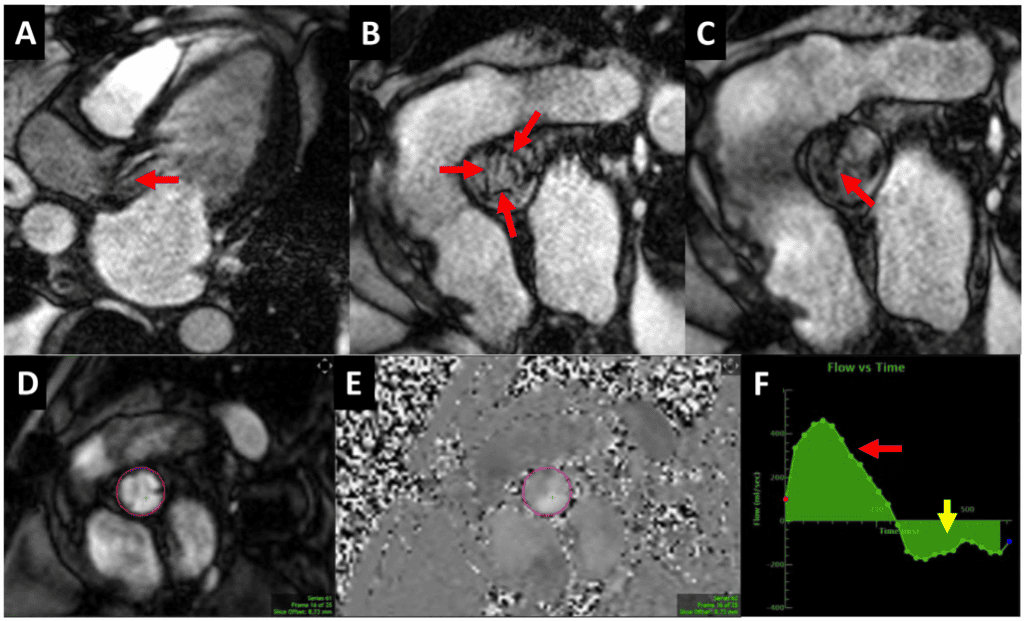
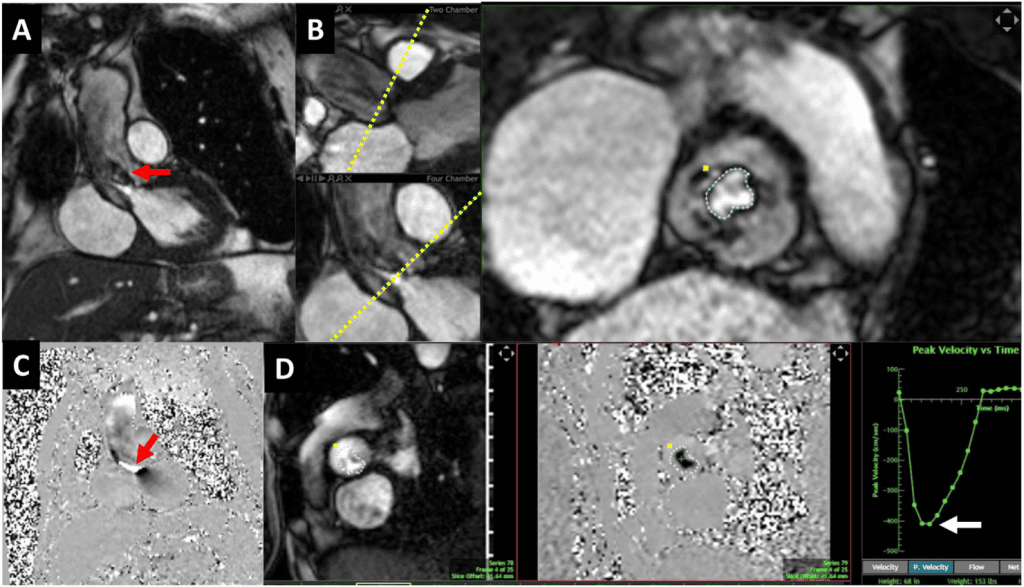
Зображення 9 Магнітно-резонансна томографія серця пацієнта з тяжким біопротезним АР . (А) Трикамерне поздовжнє зображення на збалансованій вільній прецесійній кіно-СМРТ, що демонструє дефазифікацію спіну в діастолу через клапан, що свідчить про турбулентність внаслідок АР (червона стрілка). (B, C) Короткоосьові зображення біопротезного клапана в систолу, що демонструють нормальну систолічну екскурсію (B, три стрілки) і деформацію стулки в діастолу (C, стрілка). (D-F) Магнітно- та фазово-контрастна послідовність CМР з областю інтересу на рівні синотубулярного з’єднання. Крива “потік проти часу” (F) показує прямий (червона стрілка) і зворотній (жовта стрілка) потік для прямої оцінки АР (об’єм регургітації = 55 мл).
Зображення 10 Приклад ендокардиту з ураженням механічного аортального клапана та висхідного аортального трансплантата (G), виявленого при ПЕТ з фтордезоксиглюкозою (ФДГ). Пацієнт звернувся зі скаргами на нездужання та задишку. За допомогою ТТЕ було виявлено пролабування тристулкового клапана та виражену АР. ФДГ ПЕТ, виконана після тривалого голодування, показала інтенсивне поглинання навколо аортального клапана в ділянці передбачуваного абсцесу (А, стрілки) і, що важливо, також в аортальному трансплантаті (В, верхня стрілка). Комп’ютерна томографічна ангіографія підтвердила можливий абсцес перед аортальним клапаном (С, стрілка) і розшарування протеза аортального клапана (PrAV) (ПрАК) з 10-мм ПВВ (D, стрілки).
ІІ. ОЦІНКА ПРОТЕЗІВ АОРТАЛЬНИХ КЛАПАНІВ
A. Ехокардіографічна та допплерографічна оцінка функції протезованого аортального клапана
- Ехокардіографічне та допплерографічне дослідження Застосування інструментів візуалізації для оцінки функції протезованого аортального клапана слід починати з визначення розміру та типу імплантованого протезованого клапана з подальшим проведенням комплексного ехокардіографічного дослідження (табл. 4). Хоча хірургічні типи клапанів і методики залишаються стабільними протягом багатьох років, впровадження безшовних клапанів, а також ТІАК у нативних клапанах і в дегенерованих біопротезах збільшило обсяг і складність оцінки протезованих клапанів. Оцінка функції протезованого аортального клапана
- TTE: TTE є початковим методом візуалізації, який використовується для оцінки пацієнтів з ХЗАК або ТІАК. Параметри для оцінки ПКС в аортальній позиції детально описані в таблиці 4. Стандартні види, необхідні для оцінки функції клапана, були узагальнені раніше (Рис. 11).1,3 Хоча оцінка біопротезів ХЗАК і ТІАК за допомогою TTE є подібною, особливу увагу слід приділяти черезшкірним клапанам. Повна оцінка черезшкірних клапанів повинна включати позицію клапана в корені аорти, короткоосьову форму клапана, прилягання стента клапана до рідної тканини аорти та наявність пошкодження кільця аорти або дефектів міжшлуночкової перегородки. Крім того, для виявлення регургітації клапана необхідно провести площину візуалізації через клапан, оскільки струмені регургітації не можуть бути адекватно виявлені в одній площині клапана (див. нещодавню настанову для більш детальної інформації3 ). Низьке розгортання ТІАК-протеза може обмежити анкерування і призвести до випинання нативних стулок клапана над аортальним краєм каркаса. Це підвищує ризик затримки міграції клапана у ВТЛШ або лівий шлуночок. На додаток до регургітації клапана, низьке розгортання може впливати на функцію мітрального клапана, викликаючи МР. Неповне розкриття клапана ТІАК через кальцій може призвести до параклапанної і клапанної регургітації та вищого градієнта клапана.3
- TEE: ТЕЕ відіграє важливу роль в оцінці функції протезованого аортального клапана.3,92 Одним з обмежень трансторакальної ехокардіографічної оцінки протезованого аортального клапана є реверберація та затінення, пов’язані з аортальним протезом, що унеможливлює повне дослідження заднього кільця та кореня (Зображення 12). І навпаки, хоча ТЕЕ дозволяє чудово візуалізувати задній корінь аорти, оцінка переднього кореня може бути обмеженою через той самий артефакт. Цю проблему можна вирішити шляхом регулювання кута візуалізації або глибини введення черезстравохідного датчика, щоб “змістити” артефакт і дозволити часткову візуалізацію інших сегментів протезованого клапана. Наявність механічного мітрального клапана також впливає на оцінку ВТЛШ за допомогою TEЕ. Таким чином, трансгастральні зображення відіграють цінну роль у пацієнтів з протезованими аортальними клапанами, дозволяючи оцінити рух стулок протезованого клапана, градієнт і регургітацію. Однак слід пам’ятати, що допплерівська ангуляція при трансгастральному доступі може бути неоптимальною. Тривимірна трансстравохідна візуалізація стулок протезованого аортального клапана або механічного оклюдера може бути складною. Орієнтація протезованого аортального клапана коаксіально до променя інсоляції може призвести до випадіння стулок тканинних протезів, особливо якщо стулки тонкі і некальциновані. І навпаки, механічні та тканинні клапани, які сильно кальциновані, також становлять проблему через артефакти, спричинені затуханням та/або реверберацією від кальцію стулок, дисків, стійок клапана або кільцевого отвору. З цих причин точний рух та екскурсія металевих стулок може бути нечітко окресленим; якщо це клінічно необхідно, наприклад, при обструкції клапана або НПП, рекомендується проводити рентгенологічне дослідження (КТ або рентгеноскопію; табл. 2 і 3). Деталі щодо отримання та представлення 3D-візуалізації аортального клапана наведені в попередніх рекомендаціях Європейської асоціації ехокардіографії та ASE.26
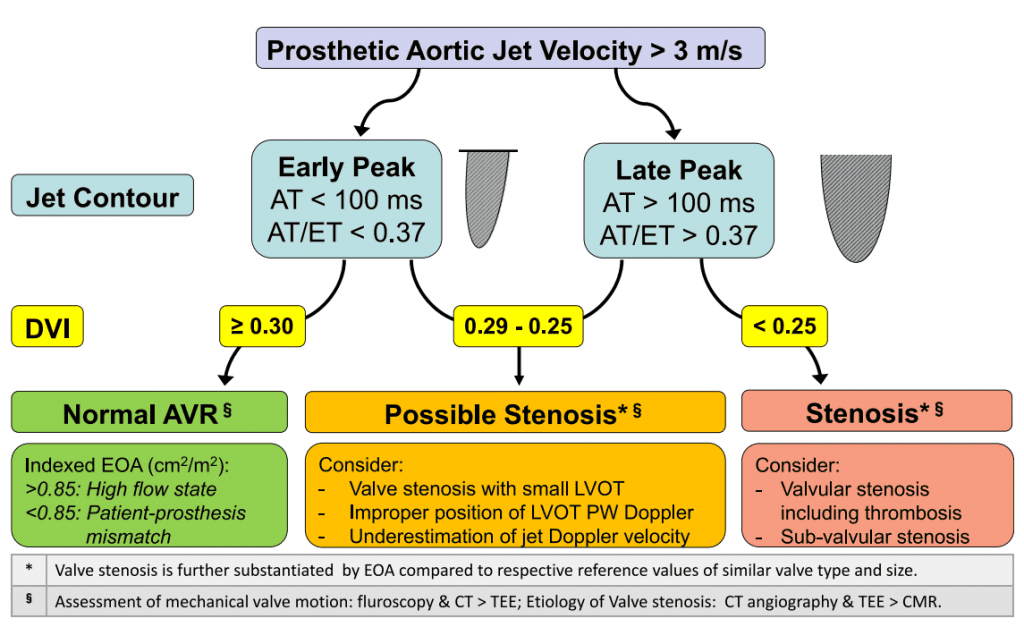
iii. Допплерівська ехокардіографія: Оцінка функції протезованого аортального клапана включає пікову швидкість через клапан, середній градієнт і ЕПО, на додаток до інших критеріїв, таких як ДІШ, контур струменя і час прискорення (таблиці 4 і 5, рисунки 11 і 12). Допплерівський алгоритм, який допомагає полегшити оцінку функції протезованого аортального клапана у пацієнтів з підвищеною максимальною швидкістю через протез, показаний на рисунку 13. Як і при захворюванні нативного аортального клапана, допплерівська інсонація повинна бути отримана з усіх можливих вікон. Також слід використовувати невеликий невізуалізаційний датчик для кращого доступу між реберними проміжками і для оптимальної кута нахилу надпередсердної вирізки. Рекомендовані критерії оцінки можливого або значного стенозу, СДК і НПП наведені в таблицях 5-7 відповідно. Рекомендації щодо СДК дещо відрізняються від інших опублікованих критеріїв.13,94,95 Діагноз стенозу протезованого клапана не повинен ґрунтуватися на вимірюванні одного параметра, оскільки коливання кровотоку можуть впливати на допплерівські вимірювання.13 Діагноз повинен включати оцінки двох або більше серійних ехокардіограм, якщо вони доступні. Базові постпроцедурні ехокардіограми мають вирішальне значення для встановлення наявності НПП після імплантації та для порівняння роботи клапана з плином часу. Слід виключити інші причини підвищених допплерівських градієнтів, такі як стани високого потоку, надклапанну обструкцію та відновлення тиску. Інтеграція даних допплерівської гемодинаміки зі спеціальною візуалізацією для візуалізації стулок протеза, часто за допомогою ТЕЕ або КТ (особливо у механічних клапанах [Таблиця 3], як описано нижче), є важливою, оскільки це покращує діагностичні показники і часто визначає конкретну етіологію підвищеного трансклапанного градієнта.96 Зауважте, що у пацієнтів з поганою функцією ЛШ або підвищеним системним артеріальним тиском високі градієнти можуть бути відсутніми, незважаючи на значний стулковий стеноз клапанів.
- Міркування щодо ТІАК і КвК: При ТІАК у нативних клапанах прискорення потоку всередині стента відбувається у двох місцях: під клапаном і на рівні стулок.97 Таким чином, вимірювання діаметру і потоку ВТЛШ слід проводити безпосередньо проксимальніше від стента, щоб запобігти переоцінці ЕПО через прискорення потоку всередині стента (рис. 4). Рекомендується використовувати одне високозалежне від потоку вимірювання (наприклад, пікова швидкість, середній градієнт) і одне менш залежне від потоку вимірювання (наприклад, ЕПО) для оцінки стенозу протезованого аортального клапана.13 Дослідження продемонстрували, що порівняно з пацієнтами з ХЗАК пацієнти з ТІАК мають подібні або нижчі градієнти клапана, вищий індекс ЕПО та нижчі показники НПП.98,99 Однак, хоча відсоток пацієнтів з помірною або тяжкою АР був подібним між клапанами ХЗАК і ТІАК третього покоління, поширеність постпроцедурної легкої АР є вищою у пацієнтів з ТІАК.99 У випадку ТІАК КвК на ехокардіографічні параметри впливають тип і розмір як первинно імплантованого хірургічного або ТІАК клапана, так і другого імплантованого клапана.100,101 У таблиці А3 Додатку узагальнено результати ехокардіографічних досліджень після КвК через 1 рік після операції. Ехокардіографічні результати на основі первинного імплантованого клапана і вторинного ТІАК-клапана в літературі обмежені. Загалом, надкільцеві клапани порівняно з внутрішньокільцевими мають більшу ЕПО, нижчий середній градієнт і меншу частоту помірної або більшої АР. Підвищені ехокардіографічні градієнти КвК (середній градієнт > 20 мм рт.ст.) виявляють у 28% пацієнтів після КТК. Клінічно значущі підвищені градієнти повинні бути підтверджені катетеризацією серця, оскільки ехокардіографічні градієнти можуть бути вищими порівняно з інвазивними вимірюваннями через явище відновлення тиску та обмеження спрощеного рівняння Бернуллі.102-104 Ступінь дискордантності вищий при використанні саморозширювальних клапанів, ніж при використанні балонних клапанів.104-106 Значна НПП також спостерігалася після КвК, з помірною або більшою НПП у 60% пацієнтів і тяжкою НПП у 25%.102 Однак наявність помірної або більшої НПП не впливає на 1- або 3-річну смертність або клінічні результати.102,107,108 Нарешті, довгострокові дослідження показали, що ехокардіографічні результати залишаються стабільними до 5 років після процедури, а частота погіршення стану клапана становить приблизно 6,6% через 5 років.109
Таблиця 4 Ехокардіографічна оцінка протезованих аортальних клапанів
| Параметр | |
| Допплер-ехокардіографія аортального клапана | Пікова швидкість/градієнт |
| Середній градієнт Контур швидкості струменя; час прискорення ДІШ (ДІШ = ІШЧ ВТЛШ/ІШЧ ПрАК) ЕПО Наявність, локалізація та тяжкість регургітації | |
| Відповідні камери серця | Розмір, функція та гіпертрофія ЛШ |
| Попередні післяопераційні дослідження, за наявності | Порівняння вищезазначених параметрів є особливо корисним при підозрі на дисфункцію протезованого клапана |
ІШЧ ПрАК, ІШЧ через протез аортального клапана.
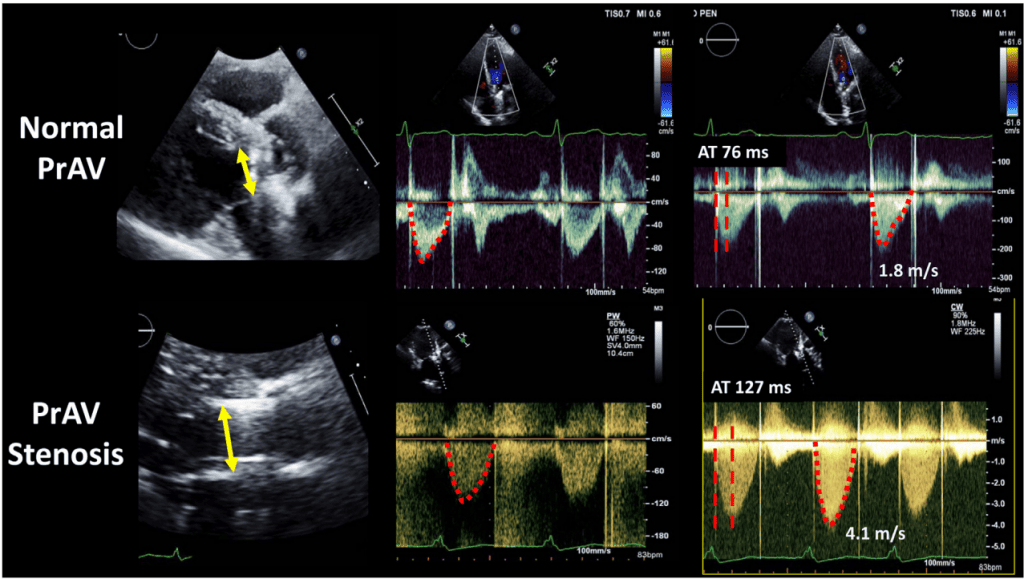
Рис. 11 Допплер-ехокардіографічні дані при нормальному та стенозованому механічному аортальному клапані, що показують різницю у швидкості та її контурі, а також час прискорення (AT). Нормальний клапан: Діаметр ВТЛШ 2 см, ІШЧ ВТЛШ 19 см, ІШЧ ПрАК 31 см, ДІШ 0,6 і ЕПО 1,92 см2 . Розраховане співвідношення AT до часу викиду (ЧВ) в нормі становить 0,24. Стенозуючий клапан: Діаметр ВТЛШ 2 см, ІШЧ ВТЛШ 24 см, ІШЧ ПрАК 98 см, ДІШ 0,24, ЕПО 0,77 см2 , розраховане співвідношення AT/ЧВ 0,4. ПрАК, протез аортального клапана.
B. Ехокардіографічна та допплерівська оцінка регургітації протезованого аортального клапана
- ТТЕ і ТЕЕ: ТТЕ використовується для виявлення як протезованої аортальної внутрішньоклапанної, так і параклапанної регургітації. На додаток до оцінки локалізації та механізму АР, ТТЕ може виявити пов’язані з нею ускладнення, такі як ендокардит, утворення абсцесів, утворень і тромбів (Рис. 14). Для того, щоб переконатися, що всі струмені ідентифіковані, часто необхідні парастернальні довго- і короткоосьові сканування. Для визначення походження струменя можуть знадобитися позаосьові зображення. Через реверберацію і затінення від протеза задня паравальвулярна АР може бути прихована при ТТЕ, тоді як передня регургітація може бути замаскована при ТЕЕ.3 Таким чином, ТТЕ і ТЕЕ доповнюють один одного в цьому відношенні для виявлення всіх локалізацій паравальвулярної АР. Нарешті, технічні обмеження та артефакти, пов’язані з протезами, при проведенні ТТЕ можуть обмежити оцінку структурних аномалій, пов’язаних з механізмом розвитку ЛА, що зумовлює необхідність використання інших методів візуалізації, таких як ТЕЕ або КТ (табл. 2 і 3, рис. 15).
| Норма | Можливий стеноз | Вказує на значний стеноз | |
| Підходить для всіх протезованих аортальних клапанів | |||
| Контур швидкості реактивного струменя * * Контур швидкості реактивного струменя | Трикутний, ранній пік | Трикутний до проміжного | Округлий, симетричний |
| Час розгону, мсек* | <80 | 80-100 | >100 |
| Відношення часу розгону до часу викиду ЛШ | <0.32 | 0.32-0.37 | >0.37 |
| Пікова швидкість, м/с†‡ | <3 | 3-4 | >4 |
| Конкретні міркування щодо AVR | |||
| ХЗАК | |||
| Середній градієнт, мм рт. ст.* | <20 | 20-34 | <35 |
| ДІШ§{ | >0.35 | 0.25-0.35 | ≤0.25 |
| ЕПО§ | Референтне ЄПО 6 1 СВ | На 1 СВ менше за референтну ЕПО | На 2 СВ менше, ніж референтна ЕПО |
| ТІАК (зміна від базового рівня) | |||
| Середній градієнт† | Зміна <10 мм рт.ст. від початкового рівня†. | Підвищення на 10-19 мм рт.ст. від вихідного рівня | Підвищення ≥20 мм рт.ст. від початкового рівня |
| ДІШ§{ | Зміна <0,1 або 20% від базового рівняk | Зменшення на 0,1-0,19 або 20%-39% від базового рівня | Зменшення на ≥0,2 або ≥40% від базового рівняk |
| ЕПО§ | Зміна <0,3 см2 або 25% від початкового рівня | Зменшення на 0,3-0,59 см2 або 25%-49% від базового рівня | Зменшення ≥0,6 см2 або ≥50% від базового рівня |
ЗАК, заміна аортального клапана. Значний стеноз повинен відповідати принаймні одному залежному від потоку параметру (тобто швидкості та середньому градієнту) та одному незалежному від потоку параметру (тобто ЕПО або ДІШ). *На це може впливати функція ЛШ і частота серцевих скорочень. † Залежить від потоку. Дійсний при нормальному ударному об’ємі (50-90 мл) і швидкості потоку (200-300 мл). § Незалежний від потоку. { ДІШ розраховується з використанням ІШЧ, як у таблиці 4. k Базовий рівень визначається як ТТЕ, що виконується при стабільних гемодинамічних умовах.
Рисунок 13 Алгоритм початкової оцінки підвищеної пікової швидкості аортального струменя протеза, що включає ДІШ, контур потоку, а також показники часу прискорення (ЧП) і відношення ЧП до часу викиду (ЧВ). Неправильний об’єм ІХ допплерівської проби впливає на розрахунки ДІШ та ЕПО: занадто близьке розташування до клапана збільшує ДІШ та ЕПО, тоді як занадто далеке (апікальне) – зменшує їх. AVR, заміна аортального клапана.
- Допплер-ехокардіографія: Кольорова допплерівська оцінка струменя АР вимагає візуалізації конвергенції потоку, ВК (vena contracta) та проксимального продовження струменя у ВТЛШ і лівий шлуночок. Обмеженнями цього методу є акустична реверберація і затінення від протеза, які можуть погіршити візуалізацію ділянок конвергенції потоку і ВТС або оцінку ширини струменя у ВТЛШ. У цій ситуації ширину, площу та окружність ВК можна оцінити за допомогою ретельно отриманого короткоосьового зображення.3 Подібно до нативних клапанів, вимірювання ширини ексцентричного струменя у вихідному тракті може переоцінити вираженість регургітації. Крім того, захоплення струменя регургітатора у ВТЛШ може призвести до переоцінки через швидке розширення струменя. І навпаки, пристінковий аортальний паравертебральний струмінь може призвести до недооцінки через невиразну кольорову допплерівську площу струменя.
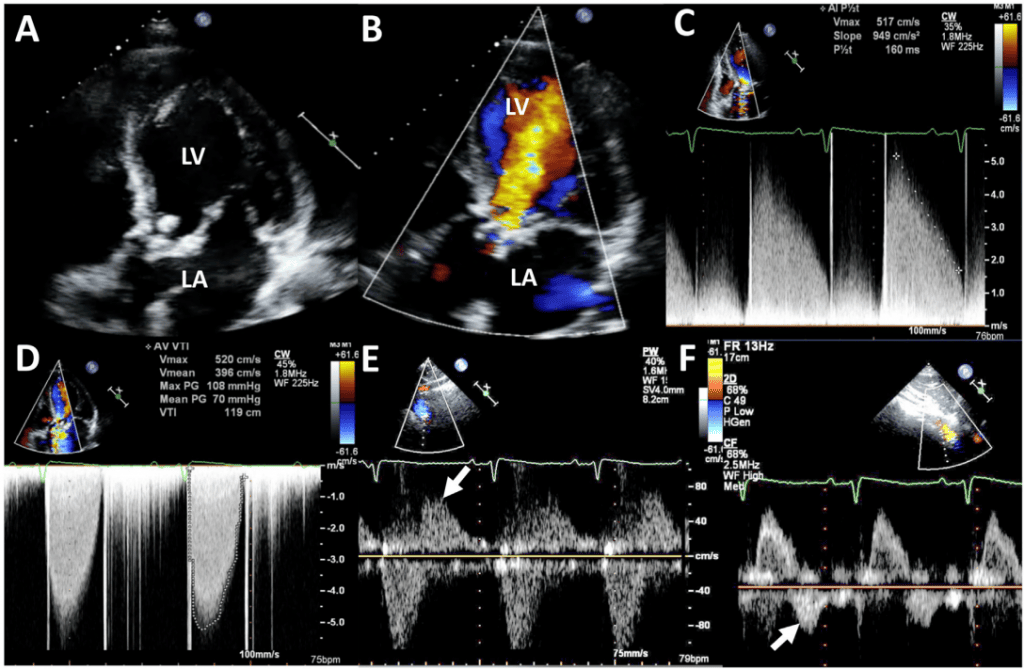
Напівкількісні та кількісні спектральні допплерівські методи оцінки тяжкості АР не залежать від протезованого аортального клапана. Наявність НПТ <200 мс або реверсії голодіастолічного потоку в черевній аорті свідчить про наявність вираженої регургітації (рис. 14). Кількісні параметри, такі як об’єм регургітації, розраховуються за допомогою 2D або 3D методів. Зауважте, що для розрахунку ударного об’єму слід бути обережним, щоб не розміщувати об’єм зразка занадто близько до протеза, що може призвести до завищення ударного об’єму через проксимальне прискорення. Методи кількісного визначення об’єму та фракції регургітації після ХЗАК і ТІАК описані раніше.1,3
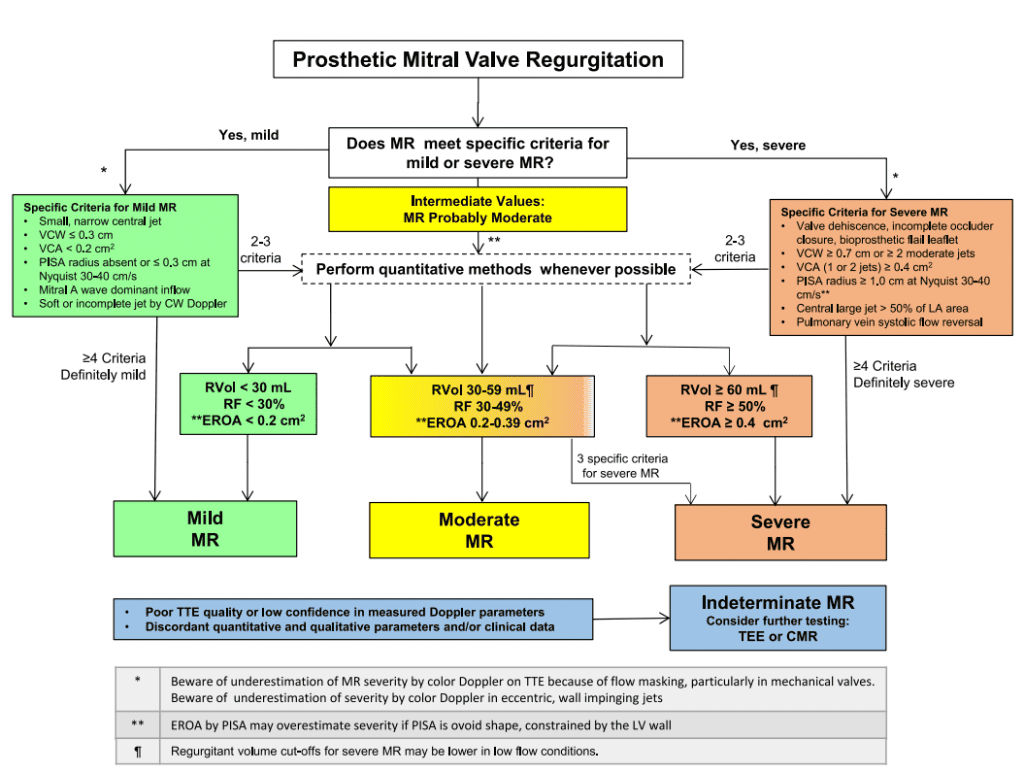
Класифікація тяжкості внутрішньо- та параклапанної протезної АР подібна до запропонованої для нативних клапанів, оскільки оцінка вимагає інтеграції якісних та напівкількісних параметрів (табл. 8).3,58 Однак визначення тяжкості протезної клапанної АР може бути складнішим через наявність комбінованих клапанних та параклапанних струменів регургітації, множинних струменів регургітації або ексцентричних струменів. На рисунку 16 показано запропонований алгоритм оцінки тяжкості протезованої клапанної АР за допомогою ехокардіографії, подібний до нещодавно запропонованого алгоритму.3 Як правило, якщо якісні та напівякісні параметри відповідають легкій формі регургітації, то оцінка вважається завершеною. Якщо є розбіжність або невідповідність між параметрами, то слід з’ясувати причини, пов’язані з якістю зображення, технічними та фізіологічними факторами. Для пацієнтів, у яких неможливо визначити консенсусну градацію і є необхідність ідентифікувати механізм та/або кількісно оцінити тяжкість АР, найімовірніше, потрібно провести ТЕЕ, СМРТ або КТ. Кожна з цих методик має свої переваги та обмеження (табл. 2 і 3). Зверніть увагу, що були опубліковані рекомендації ASE, які описують оцінку АР після черезшкірної заміни аортального клапана.3
Таблиця 6 Гемодинамічні критерії структурного зношування клапана* †
| Можливе структурне зношення клапана | Значне структурне зношення клапана |
| Збільшення середнього трансклапанного градієнта на 10 мм рт.ст., що призводить до середнього градієнта на 20 мм рт.ст. із супутнім зменшенням ЕПО на 0,3 см2 або 25 % та/або зменшенням ДІШ на 0,1 або 20 % порівняно з базовою оцінкою (1-3 місяці) після процедури | Збільшення середнього градієнта на 20 мм рт.ст., що призводить до середнього градієнта на 30 мм рт.ст. із супутнім зменшенням ЕПО на 0,6 см2 або 50% та/або зменшенням ДІШ на 0,2 або 40% порівняно з базовою оцінкою (1-3 місяці) після процедури |
| Нова поява або збільшення принаймні одного ступеня інтрапротезної АР, що призводить до помірної або більшої АР | Нова поява або збільшення щонайменше двох ступенів інтрапротезної АР, що призводить до помірної або від більшої до тяжкої АР |
За наявності супутнього стенозу та регургітації критерії значного структурного ураження клапана можуть бути присутніми при нижчих порогових значеннях. *Критерії припускають стабільну функцію ЛШ та артеріальний тиск. Морфологічні несприятливі зміни протеза повинні бути очевидними
C. Роль КТ в оцінці протезування аортальних клапанів
КТ є поширеним допоміжним методом візуалізації у пацієнтів з дисфункцією ПМК, запідозреною під час ехокардіографії. КТ дозволяє оцінити морфологію клапана, структурні аномалії, стенозовані отвори, регургітаційні отвори, ускладнення зшивного кільця та параклапанні ускладнення. Проспективний електрокардіографічний запуск є адекватним для оцінки морфології, але ретроспективний строб необхідний для динамічної 3D-оцінки клапана і функціональної кількісної оцінки. Непідсилене дослідження корисне для виявлення кальцифікатів і післяопераційних змін, тоді як відтермінована фаза (60-90 сек) допомагає оцінити порожнини абсцесу з посиленням країв і тромбом.
КТ стала корисним додатковим методом візуалізації при подальшій оцінці транскатетерних серцевих клапанів.110 Нещодавнє застосування КТ (подібно до її використання при первинній ТІАК) – це планування імплантації аортального клапана КвК. КТ має перевагу в передопераційному плануванні, оскільки на неї менше впливають металоіндуковані артефакти. Зміщення нативних стулок аортального клапана під час встановлення транскатетерного клапана пов’язане з мінімальним, але важливим ризиком подальшої оклюзії устя коронарних артерій, частота якого становить від 0,6% до 4,1%.111 Пацієнти з великими і сильно кальцинованими стулками клапана і короткою відстанню між кільцевою площиною і устям коронарних артерій піддаються більшому ризику. Отже, важливо повідомляти про відстань між остіями коронарних артерій та кільцевою площиною.112
Таблиця 7 Критерії допплерівських параметрів аортального та мітрального клапанів НПП
| Норма | Помірні | Важкі | |
| Аортальне ЕПО* | >0,85 см2 /м2, якщо ІМТ < 30 кг/м2 >0,70 см2 /м2, якщо ІМТ ≥ 30 кг/м2 | 0,85-0,66 см2 /м2, якщо ІМТ < 30 кг/м2 0,70-0,56 см2 /м2, якщо ІМТ ≥ 30 кг/м2 | ≤0,65 см2 /м2, якщо ІМТ < 30 кг/м2 ≤0,55 см2 /м2, якщо ІМТ ≥ 30 кг/м2 |
| Мітральне ЕПО* | >1,2 см2 /м2, якщо ІМТ < 30 кг/м2 >1,0 см2 /м2, якщо ІМТ ≥ 30 кг/м2 | 1,2-0,91 см2 /м2, якщо ІМТ < 30 кг/м2 1,0-0,76 см2 /м2, якщо ІМТ ≥ 30 кг/м2 | ≤0,90 см2 /м2, якщо ІМТ < 30 кг/м2 ≤0,75 см2 /м2, якщо ІМТ ≥ 30 кг/м2 |
ІМТ – індекс маси тіла. *Структура та рух клапана в нормі; виміряна ЕПО знаходиться в межах 1 СВ від референтної ЕПО.
Зображення 14 Приклад поєднаної АГ та стенозу у пацієнта з тканинним протезом аортального клапана (АК). (А) ТТЕ в апікальному п’ятикамерному зображенні під час діастоли демонструє вегетацію на тканинному протезі АК.
(В) Відповідне кольорове допплерівське зображення демонструє виражену регургітацію. (С) На БХ допплерівському зображенні PHT становить <200 мс, що відповідає вираженій регургітації. (D) Видно високий систолічний градієнт через клапан. (E) ІХ доплерівське зображення проксимального відділу низхідної грудної аорти демонструє реверсію потоку (стрілка). (F) Реверсія потоку також спостерігається в черевній аорті (стрілка). ЛП – ліве передсердя; ЛШ – лівий шлуночок; Max – максимальна; PG – градієнт тиску; Vmax – максимальна швидкість; Vmean – середня швидкість.
Роль КТ в оцінці ускладнень полягає в наступному:
- Стеноз: КТ може допомогти визначити, чи існують патологічні причини підвищеного градієнту тиску на клапані. Їх може бути важко розпізнати на TTE і TEE, особливо в механічних клапанах. Можливі причини включають стеноз внаслідок структурної недостатності, кальцинозу, обструкції паннусом або тромбом, або гіпоаттенуйоване потовщення стулки з обмеженням або без обмеження руху (Зображення 7, 15 і 17).
- Регургітація: Структурна неспроможність біопротезного клапана є найпоширенішою причиною центральної патологічної регургітації і часто виникає близько до спайки в місці розриву стулки. КТ дозволяє ідентифікувати і кількісно оцінити досить великий отвір для регургітації, а також оцінити його вторинні наслідки. Вимірювання площі регургітаційного і стенозованого отвору за допомогою КТ показує хорошу точність, порівнянну з точністю ТТЕ.113,114 Комп’ютерна томографічна ангіографія також може виявити значну дегідратацію клапана і такі ускладнення, як утворення псевдоаневризми (Рис. 15). У таблиці 9 описано потенційну роль КТ в оцінці різних ускладнень ПКС, що призводять до стенозу, регургітації або до обох цих явищ. Порівняльні переваги, обмеження та сильні сторони КТ по відношенню до ТТЕ і CМР детально описані в таблицях 2 і 3.
D. Роль КТ в оцінці протезування аортальних клапанів
- Стеноз протезованого аортального клапана
- Анатомічна ділянка клапана: Використовуючи стопку тонких зрізів (4-5 мм), перпендикулярних до протезованого клапана у двох ортогональних площинах (з використанням перехресних ліній), можна виміряти анатомічну площу клапана, відстежуючи найбільший систолічний отвір (Рис. 18).124 Правильне вирівнювання на кінчиках стулок має вирішальне значення для відтворюваності і точності вимірювання. Це можна зробити на біопротезних клапанах (за відсутності металевих розпірок), але металевий артефакт від механічних клапанів перешкоджає оцінці руху стулок.85 Дослідження in vivo та in vitro показали сильну узгодженість між СМР та ехокардіографією, з вищою між- та внутрішньоспостережною варіабельністю СМРТ.125 Одне дослідження, в якому оцінювали 65 біопротезованих аортальних клапанів, показало сильну кореляцію між анатомічною площею, визначеною за допомогою СМРТ, та ехокардіографічними вимірами ефективної площі (середні розбіжності 0,02 6 0,24 см2 при ТТЕ і 0,05 6 0,15 см2 при ТЕЕ).85 Важливо знати, що анатомічна площа клапана на 10-20% більша за ефективну площу клапана через явище звуження потоку.2
- Фазово-контрастна візуалізація: При стенозі турбулентність потоку створює пустоти сигналу через дефазировку протонів.126,127 СМР має перевагу в оцінці потоку в площинній фазі (як допплерівська ехокардіографія) і в наскрізній фазі (перпендикулярно до максимальної швидкості через протезний клапан). За допомогою двох ортогональних зображень з фазовим кодуванням у площині (отриманих з кінетичного трикамерного зображення та зображення коронарного відділу аорти, щоб побачити місце зміщення струменя) створюється наскрізне зображення перпендикулярно до струменя аортального стенозу, і можна виміряти найвищу швидкість пікселя (Зображення 18). Нова ЕПО, отримана за допомогою СМРТ, була порівняна з площею клапана, отриманою за допомогою допплерівської ехокардіографії у нативних і протезованих аортальних клапанах.128,129 Використовуючи фазово-контрастну візуалізацію для оцінки об’єму трансклапанного прямого потоку і ділення його на ІШЧ для отримання фазово-контрастної ефективної площі регургітаційного отвору (ЕПРО), це вимірювання дало сприятливі результати і показало відмінну узгодженість з клінічною класифікацією ступеня тяжкості стенозу протезованого аортального клапана.129 Нова методика, що використовує тривимірне картування потоку з часовою роздільною здатністю (чотиривимірний [4D] потік), може візуалізувати турбулентний потік з картиною вихроутворення і виміряти оцінку перепаду тиску в тривимірній площині. Ця методика не є широко розповсюдженою і займає багато часу.125,130 Загалом, оскільки дані в CМР усереднюються за декілька серцевих циклів, аритмії і швидкий нерегулярний серцевий ритм можуть вносити похибки в вимірювання. Через обмежену часову роздільну здатність СМР (через ефект часткового об’єму при високих швидкостях струменя) спостерігається недооцінка швидкостей при використанні фазово-контрастних послідовностей СМР порівняно з допплерівською ехокардіографією.124 Несприятливі серцеві ефекти хронічного перевантаження ЛШ тиском (гіпертрофія ЛШ, замісний фіброз) можуть бути точно оцінені за допомогою СМРТ. Вогнищевий замісний або інфарктоподібний фіброз (виявлений за допомогою пізнього гадолінієвого підсилення на СМРТ) спостерігається у 30-50% пацієнтів з аортальним стенозом і, як було показано, прогнозує гірший періопераційний ризик та виживання, пов’язане з серцево-судинними захворюваннями, у пацієнтів, які проходять ТІАК або ХЗАК.131,132
- Регургітація протезованого аортального клапана: CМР має перевагу над ехокардіографією в наданні абсолютних об’ємів і фракцій регургітації незалежно від кількості струменів регургітації, ексцентриситету або типу протезованого клапана.3,58 Крім того, у пацієнтів з аневризмами і/або аортопатією можна одночасно оцінити анатомію кореня аорти та аорти. Послідовності Cine ЗСП разом з фазово-контрастною візуалізацією можуть допомогти розмежувати транс- або паравальвулярні регургітаційні струмені, перші з яких спричиняють дефазировку спіну. Залежно від феромагнітного матеріалу хірургічної стійки або рами, можуть виникати артефакти, що перешкоджають точному визначенню походження регургітації.
- Фазово-контрастна візуалізація: Фазово-контрастна візуалізація у площині може допомогти розмежувати транс- або паравальвулярну регургітацію, використовуючи трикамерні та коронарні зображення аорти. Використовуючи наскрізну фазово-контрастну візуалізацію перпендикулярно до стінки аорти безпосередньо над протезованим клапаном, можна безпосередньо виміряти як антеградний, так і ретроградний потік. Потім можна розрахувати об’єм регургітації і, отже, фракцію (об’єм регургітації/прямий об’єм) (Рис. 9).126,133 Можна використовувати альтернативний метод, що використовує різницю між прямим аортальним і чистим легеневим потоком.133 Крім того, наявність голодіастолічного реверсу потоку в низхідній аорті продемонструвала відмінну чутливість і специфічність для виявлення важкої регургітації.134,135 Дослідження, в яких порівнювали ехокардіографію і КДК в оцінці паравертебральної регургітації, дали різні результати, з недооцінкою об’ємів регургітації при використанні ТТЕ і ТЕЕ.88 У нещодавньому мета-аналізі, в якому оцінювали АР після ТІАК, було виявлено значну розбіжність між ТТЕ і СМРТ, однак ТТЕ змогла відрізнити помірну або тяжку АР від легкої або відсутньої.136 У цих дослідженнях використовували різні значення відсікання для СМРТ, що могло спричинити значні розбіжності між обома методами візуалізації. Обмеження фазово-контрастного методу включають артефакт, пов’язаний з металом, або неламінарний потік, що створює пустоти в сигналі, аритмії, що знижують точність вимірювань, і нижчу часову роздільну здатність. Крім того, діастолічний потік коронарної артерії включається в загальний об’єм регургітації. У майбутньому нові методики, такі як 4D-потік, можуть забезпечити пряму оцінку потоку при регургітаційних ураженнях.127
Зображення 15 Випадок біопротезування аортального клапана (АК), ускладненого великою псевдоаневризмою кореня аорти, зображений за допомогою ТЕЕ та комп’ютерної томографічної ангіографії. На поздовжніх (A, B) та коротко-осьових (C) зображеннях середостіння видно велику псевдоаневризму (стрілки). Клапан має ознаки кальцифікації, але не має дискретних вегетацій. (В) Те саме зображення з кольоровою допплерографією, що демонструє ексцентричну параклапанну регургітацію в діастолу. (D) Ангіографічна комп’ютерна томограма серця в сагітальній проекції показує дегідратацію під лівою верхівкою з великою псевдоаневризмою (дві червоні стрілки). (E) Модифікована сагітальна проекція показує циркулярну гіпотонію на корені аорти, що вказує на прикореневий абсцес (білі стрілки). Спостерігається помірне потовщення і кальцифікація біопротезу AV (візуалізується в систолу). Над лівим синусом видно псевдоаневризму (червона стрілка). Ао – аорта; LA – ліве передсердя; LV – лівий шлуночок; PrV – протез клапана; RA – праве передсердя.
Загалом, рекомендовані показання для проведення КМР при оцінці протезованого аортального клапана є наступними: 1. Розбіжності в клінічному анамнезі та ехокардіографічних даних або коли якість зображення при ТТЕ або ТЕЕ є неоптимальною.
- Випадки, коли на ТТЕ спостерігається невідповідність між площею та градієнтом клапана; СМР є додатковим методом для оцінки анатомічної площі біопротезу клапана та забезпечення найвищої швидкості, що реєструється через клапан.
- Оцінка кореня аорти при ускладненому ендокардиті (паравальвулярне поширення захворювання, псевдоаневризма або абсцес кореня)
- Кількісна оцінка тяжкості АР
- Оцінка несприятливого ремоделювання ЛШ
Таблиця 8 Параметри для оцінки тяжкості регургітації протезованого аортального клапана
| Параметри | Легка | Помірна | Тяжка |
|---|---|---|---|
| Структура та рух клапана | |||
| Механічний або біопротез | Зазвичай нормальна | Абнормальна | Абнормальна |
| Параметри структури | |||
| Розмір ЛШ | Нормальний† | Нормальний або злегка розширений† | Розширений† |
| Допплерівські параметри (якісні або напівкількісні) | |||
| Ширина потоку в центральних каналах, % Діаметр ВТЛШ, (СВ)‡ | Вузький (25%) | Проміжний (26%-64%) | Великий (≥65%) |
| Ширина ВК, см (СВ) | <0.3 | 0.3-0.6 | >0.6 |
| Площа ВК, см2 (2D/3D СВ)§ | <0.10 | 0.10-0.29 | ≥0.30 |
| Колове поширення ПВВ, % (СВ){k | <10 | 10-29 | ≥30 |
| Щільність потоку (БХ) | Неповна або низька | Щільна | Щільна |
| Швидкість сповільнення струменя (НПТ), мс (БХ). | Повільна (>500) | Варіабельна (200-500) | Стрімка (<200) |
| Реверсія діастолічного потоку в низхідній аорті (ІХ) | Відсутня або коротка рання діастола | Проміжна | Виражена, голодіастолічна |
| Допплерівські параметри (кількісні) | |||
| Об’єм регургітації, мл/хв | <30 | 30-59 | ≥60 |
| Фракція регургітації, % | <30 | 30-50 | ≥50 |
КД, кольорова допплерографія. *Аномалії механічних клапанів: наприклад, нерухомий оклюдер (клапанна регургітація), дегісценція або рокіровка (параклапанна регургітація); аномалії біологічних клапанів: наприклад, потовщення або пролапс стулок (клапанна регургітація), дегісценція або рокіровка (параклапанна регургітація). Застосовується до хронічної, пізньої післяопераційної АР за відсутності інших етіологій. Параметр застосовується для центральних струменів і менш точний для ексцентричних струменів; межа Найквіста від 50 до 60 см/сек. § Площа ВК вимірюється шляхом планіметрії ВК струменя (струменів) на 2D або 3D CD-зображеннях у вигляді короткої осі. {Вимірюється як сума окружних довжин кожної регургітаційної стулки (без урахування нерегургітаційного простору між окремими стулками), поділена на окружність зовнішнього краю клапана. k Окружну протяжність ПВВ краще використовувати не окремо, а в комбінації з шириною та/або площею стулки. Впливає на відповідність ЛШ.
Ключові моменти та рекомендації щодо протезування аортальних клапанів
- Трансторакальна ехокардіографічна оцінка протезованих клапанів в аортальній позиції може бути обмежена реверберацією і затіненням заднього кільця/кореня. ТЕЕ рекомендується для покращення візуалізації заднього кільця/кореня при поганій візуалізації за допомогою ТТЕ або якщо є занепокоєння щодо патології заднього кільця/кореня. КТ та СМР можуть надати додаткову інформацію в цих ситуаціях.
- Спеціалізована візуалізація стулок механічного протеза аортального клапана рекомендується з використанням рентгенологічної візуалізації за допомогою КТ або рентгеноскопії, коли діапазон руху не може бути визначений за допомогою ехокардіографії і є клінічне занепокоєння щодо обструкції протезованого аортального клапана.
- При оцінці стенозу протезованого аортального клапана рекомендується отримувати допплерівську інсоляцію з усіх можливих вікон і, за можливості, використовувати невеликий не візуалізуючий датчик.
- У пацієнтів з підвищеними допплерівськими градієнтами протезованого аортального клапана рекомендується виключити такі причини, як стани високого потоку, НПП, над- або підклапанну обструкцію та відновлення тиску.
- Для оцінки стенозу протезованого аортального клапана рекомендується використовувати принаймні одне високозалежне від потоку вимірювання (наприклад, пікова швидкість, середній градієнт) і одне менш залежне від потоку вимірювання (наприклад, ЕПО, ДІШ).
- Для клапанів ТІАК прискорення потоку всередині стента відбувається нижче клапана і на рівні стулок. Рекомендується проводити вимірювання діаметру і швидкості ВТЛШ безпосередньо проксимальніше від стента, щоб запобігти переоцінці ЕПО через прискорення потоку всередині стента.
- Класифікація тяжкості регургітації внутрішньо- та параклапанного протезованого аортального клапана подібна до класифікації нативних клапанів. Якщо існує розбіжність між ехокардіографічними якісними та напівякісними параметрами тяжкості АР, яка не може бути пояснена якістю зображення, технічними або фізіологічними факторами і перешкоджає консенсусній класифікації, тоді необхідне проведення ТЕЕ, СМРТ або КТ. Ці додаткові методи візуалізації також можуть надати інформацію про етіологію дисфункції ПКС.
ІІІ. ОЦІНКА ПРОТЕЗОВАНИХ МІТРАЛЬНИХ КЛАПАНІВ
Як і у випадку з протезами аортального клапана, первинна оцінка функції протезованого мітрального клапана починається зі знання типу і розміру імплантованого протеза.
A. Типи протезування клапанів у мітральній позиції
Основним механічним клапаном, що використовується в мітральній позиції, є тристулковий клапан. Двостулкові механічні клапани схильні до відновлення тиску через невеликий отвір між двома нахиленими дисками, що може призвести до незначної переоцінки градієнту при допплерографії та недооцінки ЕПО за допомогою рівняння безперервності (рис. 3). Тривимірна планіметрія отвору добре корелює з прогнозованою виробником ЕПО.137 ЕПО механічних мітральних клапанів знаходиться в діапазоні від 2 до 3 см2 , а середній градієнт становить від 2 до 3 мм рт.ст., причому деякі менші клапани мають градієнт до 5-6 мм рт.ст. при фізіологічній частоті серцевих скорочень (Таблиця А5 Додатку). Мітральні біопротези клапанів бувають тільки стентувальними. Класичний мітральний біопротез – це стентований гетерографт, що складається з трьох біологічних стулок, реконструйованих з аортального клапана свині або перикарда великої рогатої худоби. Гемодинаміка цих хірургічних клапанів подібна і залежить від розміру імплантату, але має очікувану ЕПО від 2,2 до 3,5 см2 і середній градієнт від 3 до 5 мм рт.ст. при фізіологічній частоті серцевих скорочень (Таблиця А5).
Рисунок 16 Запропонований алгоритм для інтеграції декількох параметрів тяжкості АР після заміни аортального клапана. Передбачається якісна ехокардіографічна візуалізація та повний збір даних. Якщо візуалізація є технічно складною, для оцінки тяжкості слід розглянути можливість проведення ТЕЕ або СМР. Ступінь тяжкості регургітації може бути невизначеною через низьку якість зображення, технічні проблеми з даними, внутрішню неузгодженість між ехокардіографічними даними або розбіжність з клінічними даними. RF – фракція регургітації; Rvol – об’єм регургітації; ВКA – площа ВК.
Наразі лише один протез схвалений для черезшкірного встановлення в мітральній позиції. Клапан Edwards SAPIEN 3 схвалений FDA для черезшкірної установки в мітральній позиції для імплантації КвК і клапана в кільці (станом на липень 2021 року). На момент написання цих рекомендацій він залишається не схваленим для імплантації клапана в мітральне кільце. Гемодинаміка клапана SAPIEN 3 в мітральній позиції138-140 подібна до гемодинаміки клапанів біопротезів, перерахованих вище, і підсумована в Таблиці А6 Додатку. На момент написання цієї статті існувало кілька дослідницьких черезшкірного протезування мітрального клапана, а також систем для відновлення мітрального клапана. В одному з них нещодавно були опубліковані відмінні 2-річні результати141 , однак довготривала довговічність не була встановлена, і жоден з цих клапанів наразі не схвалений FDA. Тому серед черезшкірних мітральних клапанів ми зосередимо нашу дискусію на клапані SAPIEN 3 (Додаток, таблиця А6).
B. Ехокардіографічна оцінка протезованих мітральних клапанів
- Оцінка функції протезованого мітрального клапана: Комплексна оцінка протезованих мітральних клапанів за допомогою ехокардіографії наведена в таблиці 10 і включає наступне: ЧСС; пікову ранню швидкість; середній градієнт тиску; НПТ; висновок про наявність або відсутність значної регургітації, розміри ЛШ, правого шлуночка (ПШ) і лівого передсердя; і, якщо можливо, оцінку тиску в ПШ і тиску в правому передсерді (ПП). ЕПО та ДІШ є особливо важливими для оцінки стенозу, але також можуть вказувати на наявність значного МР, який може збільшувати градієнт та ДІШ через високий потік через клапан та менший системний викид через ВТЛШ. Діагностичні критерії протезованого мітрального стенозу при допплерехокардіографії залишаються подібними до рекомендацій 2009 року (табл. 11). Приклад важкого протезованого мітрального стенозу показаний на рисунку 19. Важливим є повідомлення про частоту серцевих скорочень, при якій проводяться допплерівські вимірювання. Основними критеріями діагностики значного мітрального стенозу є середній градієнт >10 мм рт.ст. при нормальній частоті серцевих скорочень, НПТ >200 мс, ДІШ >2,5 і КДР <1 см2 . 33,52,142,143 В одному дослідженні було показано, що ДІШ, розрахований як ІШЧ ПрМК/ІШЧ ВТЛШ, є найбільш специфічним і чутливим допплерівським параметром стенозу.143 Розрахунок ЕПО описаний вище в загальному розділі про допплерографію. Для мітрального клапана,
ЕПО = ударний об’єм/ІШЧ ПрМК,
де ІШЧ ПрМК – це ІШЧ через протез мітрального клапана, а ударний об’єм вимірюється через ВТЛШ при відсутності значної АР. Причинами протезованого мітрального стенозу є дегенерація клапана, тромбоз клапана, утворення паннуса та великі вегетації. Хоча допплерівська ехокардіографія є основним методом діагностики стенозу та обструкції, ТЕЕ дає змогу побачити мітральний клапан у прямій проекції, що є важливим для підтвердження діагнозу та оцінки механізму дисфункції (Рис. 19). Інші мультимодальні дослідження відіграють допоміжну роль (див. нижче).77,144 НПП значно рідше зустрічається при мітральній позиції порівняно з аортальною. Однак вона може бути недодіагностована. Критерії НПП детально описані в таблиці 7. Клінічні наслідки можуть бути гіршими при мітральній, а не аортальній позиції, особливо у пацієнтів віком до 70 років.145
Зображення 17 (Панель А) Збільшення середнього градієнта (28 мм рт.ст.) і пікової швидкості 3,6 м/с на 23-мм клапані SAPIEN 3 спостерігали приблизно через 4 місяці після ТІАК. КТ серця продемонструвала гіпоатенуйоване потовщення стулок (HALT; червоні стрілки) із залученням від 50% до 75% стулок (B, C) та гіпоатенуацію, що впливає на рух (D). Після початку антикоагуляції середній градієнт знизився до 14 мм рт.ст. (E). Повторна КТ серця продемонструвала усунення HALT (F, G) з нормальною рухливістю стулок (H).
ii. Оцінка МР протезованого клапана: ТТЕ показана для рутинного спостереження і може бути початковим тестом вибору при підозрі на дисфункцію мітрального протеза, але візуалізація МР-струменів при ТТЕ часто обмежена акустичною реверберацією або затіненням від мітрального протеза (рис. 6). Парастернальне вікно часто є оптимальним видом для оцінки МР-струменів протеза, хоча апікальні види можуть бути корисними для виявлення підозри на ексцентричний регургітаційний струмінь або параклапанну регургітацію.146 Апікальні види також можуть забезпечити кращу візуалізацію стулок протезованого клапана для виявлення вегетації, тромбу, паннуса або дегенеративних змін стулок. Враховуючи, що трансторакальна ехокардіографічна візуалізація протезної або паравускулярної МР часто обмежена, особливо важливо шукати непрямі спектральні допплерівські докази вираженої МР. Критерії, що вказують на значну МР, детально описані в таблиці 12 і включають наступне:
- Щільний БХ МР-потік
- Підвищення швидкості мітрального Е (>1,9 м/с у механічних клапанах)1
- Низький системний викид та ІШЧ ВТЛШ, незважаючи на гіпердинамічний лівий шлуночок
- Підвищене співвідношення ІШЧ ПкМР/ІШЧ ВТЛШ (>2,5)
- Велика зона конвергенції систолічного потоку на стороні ЛШ мітрального протеза
- Значне підвищення тиску в ЛА порівняно з попереднім дослідженням При підозрі на значний протезний або паравальбулярний МР на основі цих параметрів часто корисно провести ТЕЕ для остаточної візуалізації морфології протезної стулки і рухливості стулки або диска, а також для кількісної оцінки тяжкості МР (Рис. 20). Комбіновані трансторакальні і черезстравохідні ехокардіографічні параметри і критерії оцінки тяжкості МР детально описані в таблиці 13. Запропонований алгоритм оцінки тяжкості МР за допомогою ехокардіографії показаний на рисунку 21.
iii. Роль ТЕЕ: ТЕЕ відіграє дуже важливу роль в оцінці протезованих мітральних клапанів. Протез мітрального клапана можна візуалізувати в прямій проекції, що дозволяє ретельно оцінити його структуру, рухливість стулок або оклюдера механічних клапанів, а також виявити будь-яку дегісценцію або регургітацію. ТЕЕ має вирішальне значення для оцінки регургітації протезованого клапана, особливо в механічних клапанах, де акустична реверберація і затінення на ТЕЕ є правилом. Тривимірна ТЕЕ відіграє ключову роль у діагностиці патології протезованого мітрального клапана, забезпечуючи повний огляд клапана, його кільця та прилеглих структур (Рис. 19, 20 і 22). Порівняльні переваги та обмеження ТЕЕ та інших методів дослідження детально описані в таблицях 2 і 3.
C. Роль КТ в оцінці протезованих мітральних клапанів
- Стеноз клапана: КТ серця є цінним додатковим інструментом для оцінки стенозу протезованого мітрального клапана з огляду на високу просторову роздільну здатність і отримання 3D-об’єму. Для оцінки протезованого клапана зазвичай виконують ретроспективну електрокардіографічно керовану зйомку, щоб забезпечити оптимальну візуалізацію протезованого клапана протягом усього серцевого циклу; однак доза опромінення є вищою, ніж при проспективній електрокардіографічно керованій зйомці.147-149 Якщо немає протипоказань, можна призначити b-блокатори для зниження ЧСС до 60 уд/хв, щоб зменшити рухові артефакти. Зображення реконструюються з кроком від 5% до 10% від інтервалу R-R, щоб можна було оцінити роботу протезованого клапана протягом усього серцевого циклу. Кути відкриття і закриття механічного клапана можна оцінити на знімках без контрастного підсилення, таких як кіно-рентгеноскопія, але етіологію обмеженого відкриття клапана визначити неможливо.147 Знімки з контрастним підсиленням дозволяють оцінити дегенерацію стулки біопротеза (потовщення і кальцифікацію), рухливість стулки або диска оклюдера, кальцифікацію кільця біопротеза, тромб, паннус або вегетацію.150 Геометричну площу отвору протезованого мітрального клапана можна виміряти, використовуючи мультипланарну реконструкцію.151 У механічних клапанах можна виміряти кути відкриття і закриття на додаток до геометричної площі отвору.152 ТЕЕ і КТ є більш точними у визначенні етіології протезованого мітрального стенозу порівняно з ТТЕ; КТ є більш чутливою у виявленні паннуса як причини обструкції клапана.77 Існують технічні обмеження для КТ, оскільки артефакти “цвітіння” і затвердіння променя від кільця клапана або дискових оклюдерів можуть погіршити оцінку. Ці металеві артефакти можна зменшити, використовуючи вищу напругу на трубці та ітеративну реконструкцію.153
Таблиця 9 Потенційна роль КТ у різних ускладненнях протезування аортальних клапанів
| Ускладнення | Потенційна роль MDCT |
| Механічна дисфункція стулки | Може оцінити рух і кут відкриття механічної стулки (стулок) і порівняти його зі специфікаціями виробника Нормальний кут відкриття становить 73-90 для двостулкових клапанів і 60-80 для одностулкових клапанів |
| НПП | Невелика ЕПО, нормальний рух стулки, відсутність маси та мала геометрична площа отвору115 |
| Структурна неспроможність | Виявлення кальцифікації клапанів, незважаючи на нормальні градієнти116 |
| Дегісценція протеза | Виявлення зазору між кільцем та зшивальним кільцем протеза. Для протеза аортального клапана надмірний рух зшивального кільця з гойданням >15 свідчить про значну параклапанну регургітацію1. |
| ПВВ | Заповнений контрастною речовиною канал у паравальвулярній ділянці, який з’єднує просвіт проксимально і дистально від клапана (наприклад, для аортального клапана, аорти та ВТЛШ) Допомагає відрізнити від псевдоаневризми та абсцесу117 Допомагає відрізнити від матеріалу тромбу (HU тромбу значно вищі, ніж у контрастної речовини [383-494 HU проти 202-367 HU]118) |
| Ендокардит | Великі утворення (>1 см) на стулці клапана або зшивному кільці, зазвичай на шлуночковому боці аортального клапана119; загалом поступається ТЕЕ при виявленні невеликих утворень (<4 мм) та перфорацій (<2 мм), але перевершує її в оцінці параклапанного та екстракардіального розширення120 КТ може виявити інші прояви інфекції, такі як потовщення стінки аорти, медіастинальний газ, жирові прожилки, скупчення119,120. |
| Псевдоаневризма | Заповнені контрастною речовиною мішкоподібні або веретеноподібні випоти, що виникають з кільцевого отвору, які можуть містити тромб При інфікуванні можуть спостерігатися запальні зміни прилеглих м’яких тканин |
| Тромби | Нерегулярне утворення, зазвичай рухливе, без підсилення, прикріплене до ПКС Важливо відрізнити від паннуса Тромб частіше спостерігається на ранніх стадіях після операції, прикріплений, як правило, до аортального боку протеза аортального клапана і має нижчу ослабленість (<200 HU) Паннус спостерігається на пізніх стадіях після операції, зазвичай розташований з боку шлуночка і має вищу ослабленість (>200 HU)121 Для відрізнення тромбу від паннуса корисним є порогове значення 145 HU, при цьому 87. 5% чутливістю та 96% специфічністю121 КТ дозволяє прогнозувати відповідь на тромболізис. Повний лізис частіше спостерігається у тромбах з ослабленням менше 90 HU проти 90-145 HU121 |
| HALT та HAM | Допомагає ідентифікувати HALT, з обмеженням руху або без нього, який сприяє антикоагуляції122 |
| Розшарування аорти | Клапоть інтими з істинним та хибним просвітом, внутрішнє зміщення кальцинозу інтими, затримка збільшення хибного просвіту, розширення аорти та середостіння, виразкоподібні проекції контрастної речовини та стиснення істинного просвіту123 |
HALT, гіпоатенуйоване потовщення листків; HAM, гіпоатенуація, що впливає на рух; HU, одиниця Хаунсфілда; MDCT, мультидетекторна комп’ютерна томографія.
ii. Регургітація клапана: Надмірне погойдування протеза мітрального клапана під час серцевого циклу спостерігається при клапанній дегідратації. Розмір ПВВ на КТ корелював зі ступенем регургітації на ехокардіографії в ранніх спостереженнях, більшість з яких включали значну регургітацію.78 Невеликі ПВВ можуть бути приховані через металеві артефакти від протезного кільця або дискових оклюдерів, або сплутані з задатком. У цих ситуаціях важливим є підтвердження або виключення регургітації за допомогою допплерівської ехокардіографії. Закладки можна ідентифікувати також за допомогою неконтрастного сканування або ретельної перевірки ослаблення на підсиленому контрастом скануванні, оскільки повстяний заділ може мати більше ослаблення, ніж кров, підсилена контрастом.153 Площу регургітаційного отвору можна виміряти в систолічну фазу, при цьому вона добре узгоджується з даними ТЕЕ та результатами хірургічного втручання.154
D. Роль СМР при оцінці Протезованих МІтральних Клапанів
- Стеноз клапана: Оцінка стенозу мітрального клапана за допомогою СМР може бути виконана трьома методами: візуальна оцінка біопротезів або екскурсії оклюдера, пряма планіметрія клапанного отвору біопротеза або вимірювання пікової швидкості через протез за допомогою фазово-контрастної візуалізації. Для візуальної оцінки слід використовувати комбінацію з трьох поздовжніх і короткохвильових зображень. Це може виявити порушення екскурсії механічних ПКС окклюдерів або стулок біопротеза і продемонструвати потенційну причину стенозу, включаючи паннус, тромбоз або ендокардит. Основним обмеженням залишається артефакт чутливості, особливо при використанні механічних клапанів. Для кількісної оцінки вираженості стенозу можна виміряти анатомічну площу отвору на біопротезованих клапанах.86,87 Якщо присутній артефакт, який обмежує оцінку стулок, можна розглянути можливість проведення швидкоградієнтної ехокардіографії.
Таблиця 10 Ехокардіографічні параметри для оцінки функції протезованого мітрального клапана (стеноз або регургітація)
| Допплер-ехокардіографія мітрального клапана | Пікова рання швидкість
Середній градієнт тиску Частота серцевих скорочень на момент допплерографії НПТ ДІШ (ІШЧ ПрМК/ІШЧ ВТЛШ) ЕПО* Наявність, локалізація та вираженість регургітації |
| Інші відповідні ехокардіографічні параметри | Розмір та функція ЛШ
Розмір лівого передсердя Розмір і функція ПШ Оцінка тиску в ПШ |
ІШЧПрМК, ІШЧ через протез мітрального клапана. *З використанням рівняння неперервності.
Зображення 18 Випадок біопротезованого аортального стенозу, оціненого за допомогою СМРТ.
(А) Поздовжній МР знімок аорти в стаціонарному стані з вільною прецесією показує дефазировку обертання в систолу, що відповідає високим швидкостям, які виходять із стенозу. Зверніть увагу на відсутність значного металевого артефакту. (В) Подвійна ортогональна проекція на кінчики стулок клапана під час максимального систолічного відкриття показує відповідний короткоосьовий вид протезованого аортального клапана та ознаки стенозу з анатомічною площею клапана 0,9 см2 . (C, D) Фазово-контрастне зображення демонструє дефазію на рівні аортального клапана. Магнітно-фазове контрастування з використанням подвійної ортогональної площини на рівні аортального клапана з кодованою швидкістю СМР 450 см/с показує відсутність аліасингу та пікову трансклапанну швидкість 4,1 м/с (біла стрілка на графіку потоку).
Зображення 19 Випадок тяжкого механічного стенозу мітрального клапана, вторинного до тромбоутворення. (А) Двовимірна ТЕЕ, вид з середостіння в діастолу, показує обмежену рухливість стулки (жовта стрілка) з високим кольоровим аліасингом притоку (В) і виражений протезний стеноз (середній градієнт 29 мм рт.ст. при ЧСС 86 уд/хв) при БХ допплерографії (С). (D) 3D-ТЕЕ механічного мітрального клапана в реальному часі (вигляд спереду), що демонструє обмежений рух стулки в діастолу (червона стрілка) і дві нерухомі маси (кола) вздовж шарнірних точок механічного клапана.
Таблиця 11 Доплерографічні дані, що вказують на стеноз протезованого мітрального клапана
| Норма | Можливий стеноз† | Припущення щодо значного стенозу* † | |
| Пікова швидкість, м/с § | <1.9 | 1.9-2.5 | ≥2.5 |
| Середній градієнт, мм рт.ст.‡§ | 5 | 6-10 | >10 |
| ІШЧ ПрМК/ІШЧ ВТЛШ‡§ | <2.2 | 2.2-2.5 | >2.5 |
| ЕПО, см2 | ≥2.0 | 1-2 | <1 |
| НПТ, млсек | <130 | 130-200 | >200 |
ІШЧПрМК, ІШЧ через протез мітрального клапана. *Для механічних або біопротезованих клапанів; точність діагностики є найкращою, якщо більшість перелічених параметрів є нормальними або відхиляються від норми відповідно. Значення параметрів повинні спонукати до більш ретельної оцінки функції клапана та/або інших міркувань, таких як збільшення потоку, збільшення частоти серцевих скорочень або НПП. ‡ Ці параметри також є ненормальними за наявності значного протезованого МР. § Дещо вищі значення відсікання, ніж показано, можуть спостерігатися у деяких біопротезованих клапанів.
Основним обмеженням цього методу є припущення, що найвужча ділянка знаходиться в одній площині, що часто не відповідає дійсності. Однак попередні невеликі дослідження показали високу реалістичність, хорошу варіабельність між спостерігачами і узгодженість з планіметрією мітрального клапана за допомогою СМР та ехокардіографією, виміряною за допомогою НПТ.86 Іншим потенційним методом оцінки стенозу біопротезованого клапана є отримання наскрізних фазово-контрастних зображень, перпендикулярних до транспротезного припливного струменя на рівні стулок клапана. Межа Найквіста повинна бути ретельно підібрана, щоб забезпечити відсутність аліасингу. Планіметрія площі потоку забезпечить вимірювання пікової швидкості, а нещодавні дані in vitro продемонстрували можливість вимірювання ІШЧ і розрахунку площі мітрального клапана.87 Основною проблемою цього підходу є наскрізний рух кільця, що ускладнює вимірювання швидкості в одній і тій самій точці протягом серцевого циклу. Крім того, цей підхід обмежений для механічних клапанів через артефакти чутливості. Загальна клінічна валідизація методів оцінки протезованого мітрального стенозу залишається обмеженою.
- Регургітація клапана: Регургітацію протезованого клапана можна візуально оцінити за наявністю СМРТ-індукованої дефазировки інтервокселів у лівому передсерді на ЗСП-зображеннях.155 Розмір струменя можна класифікувати залежно від площі лівого передсердя (легка, менше однієї третини; помірна, від однієї третини до двох третин; важка, більше двох третин) і має добру узгодженість з даними ехокардіографії, особливо при більш ніж помірній МР.155 Хоча міжвоксельна дефазировка може бути першою ознакою біопротезної МР, вона не може бути достовірно ідентифікована через артефакти чутливості від ПКС. Кіно-зображення також можуть допомогти ідентифікувати механізми регургітації, такі як дегісценція, вегетація або абсцес. Однак, перевага СМР полягає в кількісній оцінці МР шляхом вимірювання об’єму та фракції регургітації. Це найкраще досягається за допомогою непрямого методу. В ідеалі це має включати планіметрію лівого шлуночка з використанням ЗСП-кінескопів для вимірювання загального ударного об’єму ЛШ; ударний об’єм передньої частини аорти розраховують за допомогою наскрізних фазово-контрастних зображень на рівні проксимального відділу висхідної аорти. Різниця між загальним ударним об’ємом ЛШ і ударним об’ємом передньої стінки аорти є об’ємом МР.88 Ділення об’єму регургітації на загальний ударний об’єм ЛШ дає фракцію регургітації. Якщо аортальні фазово-контрастні дані недоступні, можна також використовувати наскрізні фазово-контрастні зображення легеневого клапана. Потенційним обмеженням цієї стратегії є ризик виникнення артефакту чутливості на базальних короткоосьових кіно-зображеннях з ПКС, що знижує точність кількісного визначення загального ударного об’єму ЛШ. Нарешті, за відсутності фазово-контрастних даних і трикуспідальної, легеневої або аортальної регургітації різниця між загальним ударним об’ємом ЛШ і ПШ може бути використана для кількісної оцінки об’єму і фракції регургітації.88
| Знахідки | Чутливість | Специфічність | Коментарі |
| Пікова швидкість мітрального викиду ≥1,9 м/сек*. | 90% | 89% | Також враховуйте сильний потік, НПП |
| ІШЧ ПрМК/ІШЧ ВТЛШ ≥ 2.5* | 89% | 91% | Похибки вимірювання збільшуються при фібриляції передсердь через складність узгодження серцевих циклів; також враховуйте НПП |
| Середній градієнт ≥5 мм рт.ст.* | 90% | 70% | При фізіологічній частоті серцевих скорочень; також враховуйте сильний потік, НПП |
| Максимальна швидкість струменя ТР >3 м/с*. | 80% | 71% | Розглянути залишкову післяопераційну легеневу гіпертензію або інші причини |
| Ударний об’єм ЛШ, отриманий за допомогою 2D або 3D ехокардіографії, на >30% вищий, ніж системний ударний об’єм за даними допплерографії | Помірна чутливість | Специфічно | Валідація відсутня; значна МР підозрюється, коли функція ЛШ нормальна або гіпердинамічна, а ІШЧ ВТЛШ невеликий (<16 см) |
| Конвергенція систолічного потоку в лівому шлуночку в напрямку до протеза | Низька чутливість | Специфічрно | Валідація відсутня; технічно складно виявити |
ІШЧ ПрМК, ІШЧ через протез мітрального клапана. *Дані Olmos та співавт. 33 Коли і пікова швидкість, і співвідношення ІШЧ підвищені при нормальній НПТ, специфічність наближається до 100%.
Зображення 20 Випадок паравальвулярної МР в механічному клапані. (А) Апікальна чотирикамерна проекція показує акустичну реверберацію за механічним мітральним клапаном (МК) в систолу (стрілка). (В) Кольорова допплерографія показує ексцентричний МР (стрілка); артефакт, походження і ступінь якого важко встановити. (С) Спектральна допплерографія показує підвищені швидкості та градієнт на клапані (середній градієнт 9 мм рт.ст. при ЧСС 87 уд/хв) з ІШЧ МК 52 см. (D) Спектральна ІХ допплерографія у ВТЛШ показує знижену швидкість та ІШК 17 см. Співвідношення протезного МК ІШЧ до ІШЧ ВТЛШ, що дорівнює 3, вказує на наявність супутньої регургітації за відсутності мітрального стенозу, що виводиться з нормальної НПТ. (E) ТЕЕ середостіння показує два паравальвулярні струмені регургітації (стрілки). (F) Тривимірна ТЕЕ показує широко відкритий клапан в діастолу. (G) Тривимірна TEE з кольором показує два ПВВ, один на 11 годин, а інший на 5 годин (кружечки). Третій більш центральний струмінь – це промивний струмінь, як видно на (E). LA, ліве передсердя; LV, лівий шлуночок
Ключові моменти для оцінки протезованих мітральних клапанів
- Оцінка функції протезованого мітрального клапана починається зі знання типу та розміру імплантованого протеза.
- Структурна та гемодинамічна оцінка за допомогою TTE та TEE дає ключове розуміння функції протезованого мітрального клапана.
- При допплерівському дослідженні протезованих мітральних клапанів слід вимірювати пікову швидкість, середній градієнт, НПТ, ЕПО або ДІШ та частоту серцевих скорочень, коли це можливо, і повідомляти про них.
- Через затінення і маскування потоку в лівому передсерді, особливо при механічних мітральних клапанах, значний протезний МР може бути пропущений при кольоровій допплерографії на ТТЕ. Ознаками значної МР при спектральній допплерографії є підвищена рання пікова швидкість мітрального викиду, середній градієнт, ДІШ та відносно низький системний ударний об’єм по відношенню до загального ударного об’єму ЛШ. ТЕЕ показана у випадках підозри на значну МР.
- TEE (2D і 3D) забезпечує огляд протезованого мітрального клапана в прямій проекції, що дозволяє оцінити структуру клапана, рух оклюдера, а також наявність, локалізацію і ступінь клапанної регургітації; останнє має вирішальне значення для керівництва інтервенційними процедурами.
- КТ і КМР забезпечують додаткову оцінку протезованих мітральних клапанів, особливо коли необхідна додаткова інформація про структуру, функцію протеза або пов’язані з ним ускладнення. КТ дозволяє оцінити структуру клапана і рух механічного оклюдера клапана, а також локалізувати значну параклапанну регургітацію і виявити пов’язані з нею ускладнення. КТ дозволяє оцінити клапанну структуру біопротезованих клапанів і є особливо корисною для кількісної оцінки ремоделювання МР і ЛШ при протезуванні
Таблиця 13 Ехокардіографічні критерії тяжкості регургітації з протезованим мітральним клапаном за даними ТТЕ та ТЕЕ
| Легка | Середня | Тяжка | |
| Структурні параметри | |||
| Розмір ЛШ | Нормальний* | Нормальний або розширений | Зазвичай розширений† |
| Протезований клапан‡ | Зазвичай нормально | Ненормальний§ | Ненормальний§ |
| Допплерівські параметри | |||
| Площа потоку кольорового доплера‡{ | Невеликий центральний потік (зазвичай <4 см2 або <20% площі ЛП) | Варіюється | Великий центральний струмінь (зазвичай >8 см2 або >50% площі ЛП) або пристінковий імпульсний струмінь різного розміру, що закручується в лівому передсерді |
| Конвергенція потокуk | Відсутня або мінімальна | Середня | Велика |
| Щільність потоку (БХ)‡ | Неповна або слабка | Щільна | Щільна |
| Контур потоку(БХ)‡ | Параболічний | Зазвичай Параболічний | Ранній пік: тріангулярнаформа |
| Легеневий венозний кровотік‡ | Систолічна домінанта | Систолічне притуплення. | Реверсія систолічного потоку** |
| Кількісні параметр膆 | |||
| Ширина ВК (см)‡ | <0.3 | 0.3-0.69 | ≥0.7 |
| RVol, мл | <30 | 30-59‡‡ | ≥60‡‡ |
| RF, % | <30 | 30-49 | ≥50 |
| ЕПРО, см2 | <0.20 | 0.20-0.39 | ≥0.40 |
МК, мітральний клапан; ФВ, фракція регургітації; RVol, об’єм регургітації. *Розмір ЛШ застосовується тільки до хронічних уражень з прогресуючим збільшенням. † За відсутності іншої етіології збільшення ЛШ та гострої МР. Параметр може бути найкраще оцінений або отриманий при проведенні ТЕЕ, особливо при наявності механічних клапанів. § Аномалії механічних клапанів: наприклад, нерухомий оклюдер (клапанна регургітація), дегісценція або гойдання (параклапанна регургітація); аномалії біологічних клапанів: наприклад, потовщення або пролапс стулок (клапанних), дегісценція або гойдання (параклапанна регургітація). { При межі Найквіста 50-60 см/сек. k Мінімальна і велика конвергенція потоку визначаються як радіус конвергенції потоку <0,4 і ≥0,9 см для центральних струменів, відповідно, зі зміщенням базової лінії при межі Найквіста 40 см/сек; відсікання для ексцентричних струменів може бути вищим. Якщо немає інших причин систолічного притуплення (наприклад, фібриляція передсердь, підвищений тиск у лівому передсерді). **Реверсія легеневого венозного систолічного потоку є специфічною, але не чутливою для тяжкої МР. ††Ці кількісні параметри менш добре валідовані, ніж при нативній МР. Об’єм відсікання регургітації може бути нижчим в умовах низького потоку.
IV. ОЦІНКА ПРОТЕЗОВАНИХ ЛЕГЕНЕВИХ КЛАПАНІВ
Нативний клапан легеневої артерії розташований спереду і вище аортального клапана і найкраще візуалізується за допомогою TTE з використанням зображення ВТПШ з парастернального вікна (модифікованого з парастернального короткоосьового зображення на рівні аортального клапана) або субкостального вікна. Протезований клапан не завжди знаходиться в тому ж положенні, що і нативний клапан легеневої артерії, особливо якщо залучений кондуїт. Важливо розуміти, що при використанні ехокардіографії можуть знадобитися позаосьові зображення. КТ і СМР забезпечують покращену просторову роздільну здатність і повинні використовуватися для доповнення результатів ехокардіографії. При оцінці протеза легеневого клапана важливо враховувати додаткову інформацію про анатомію ВТПШ і ЛА, а також розмір, функцію і тиск легеневого клапана.
A. Хірургічна та транскатетерна ЗЛК
Рідний хворий легеневий клапан може бути замінений або клапанним кондуїтом для повного усунення вродженої вади, або протезом клапана без кондуїту при ізольованій клапанній патології. Найбільш поширеним показанням для встановлення клапанного кондуїту є тетрада Фалло. Інші показання включають процедуру Растеллі (транспозиція великих артерій при дефекті міжшлуночкової перегородки) або в рамках процедури Росса (вроджений стеноз аортального клапана) чи операції Ясуї (перервана дуга аорти з зменшеною висхідною аортою). Клапанний канал, як правило, є біологічною тканиною (наприклад, гомотрансплантат, ксенотрансплантат). Стентовані біологічні протези зазвичай імплантують при регургітації легеневого клапана, яка найчастіше виникає у пацієнтів, які раніше перенесли реконструкцію ВТПШ.156
Вперше про транскатетерну ЗЛК було повідомлено у 2000 році, і з того часу вона стала життєздатною альтернативою хірургічній ЗЛК у деяких пацієнтів.157 Результати обох типів втручань є сприятливими і порівнянними, при цьому транскатетерна ЗЛК асоціюється з коротшим перебуванням у лікарні і перипроцедурними ускладненнями, але вищим рівнем ендокардиту.158 Кількість процедур ЗЛК зросла з роками, при цьому спостерігається постійна тенденція до збільшення хірургічної ЗЛК.159 Крім того, вік пацієнтів, яким проводять ЗЛК, помітно відрізняється в різних центрах США, а адміністративні дані свідчать про загальне збільшення кількості молодих пацієнтів, яким проводять ЗЛК.160 Тенденції свідчать про те, що для оцінки патологічних ускладнень замінених протезів, ймовірно, буде залучатися більше абсолютних показників дорослих пацієнтів. Важливо розуміти типи хірургічних і транскатетерних замін для кращого розуміння ризику ускладнень.
B. Оцінка стенозу протезованого легеневого клапана
- Ехокардіографічне та допплерівське дослідження: При оцінці тяжкості стенозу протезованого клапана важливо пам’ятати, що високі швидкості потоку можуть спостерігатися в інших місцях, окрім протезованого клапана. Стеноз судин гілки або стеноз краю канальця також можуть бути присутніми і ускладнювати БХ допплерівське дослідження швидкостей через протезований клапан. У попередніх настановах ASE описано загальні міркування щодо візуалізації та проблеми оцінки ЗЛК, включаючи нетрадиційну форму ВТПШ, розташування протеза та асоціацію з хірургічно встановленими каналами.1 Ехокардіографічна оцінка обструкції клапана повинна включати (1) характеристику типу і розміру протеза, як зазначено в таблиці 14, (2) спостереження за якісними показниками обструкції (наприклад, тромб, паннус), (3) кількісну оцінку тяжкості стенозу і (4) будь-які зміни в порівнянні з попередніми оцінками при серійних обстеженнях. Крім того, систолічний тиск у ПШ слід визначати за допомогою струменя ТР, якщо він присутній. Слід зазначити, що систолічний тиск у ЛА при наявності стенозу ЗЛК – це різниця між систолічним тиском у ПШ і градієнтом через обструктивний клапан. Біологічні протези залишаються найпоширенішим типом ЗЛК. Однак, ці клапани, швидше за все, з часом вийдуть з ладу і потребуватимуть заміни. Механічні протези нечасто імплантують у цій позиції, тому даних про патологію, що впливає на ці клапани, небагато. Враховуючи, що молодший вік при ЗЛК є прогностичним для відмови протезованого клапана, а також те, що більше процедур ЗЛК виконується у молодих людей, стеноз протезованого легеневого клапана стане більш поширеним явищем.161 Відмова або дисфункція протезованого клапана переважно проявляється у вигляді стенозу, а не регургітації, з частотою приблизно 80% протягом 10 років після первинної імплантації.161 При виникненні ендокардиту в ЗЛК або кондуїтах обструкція на момент встановлення діагнозу є більш поширеною, ніж тяжка регургітація: 53% проти 29%, відповідно.162 Визначення локалізації стенозу є важливим, оскільки обструкція може виникнути далі по ходу каналу або в ЛА, а не на клапані. ІХ допплерографія допомагає визначити точну локалізацію обструкції. Звуження протоки та вплив на правий шлуночок також є індикаторами обструктивного ураження. Кількісні параметри зазвичай обмежуються піковою швидкістю та середнім градієнтом (Зображення 23). Цікаво, що існують дані, які свідчать про те, що нормально функціонуючі механічні протези частіше мають нижчу пікову швидкість і середній градієнт порівняно з біологічними клапанами в легеневій позиції.163 Індикатори стенозу протезуванних клапанів наведені в Таблиці 15.
- Роль TEE та 3D: TEE може бути складним завданням при оцінці ЗЛК, оскільки легеневий клапан є передньою структурою, і якщо є кондуїт, то його розташування є нетиповим. Класично ТЕЕ легеневого клапана виконується в середостінному положенні з кутом датчика від 50 до 70 або з глибокого трансгастрального положення з кутом датчика приблизно від 50 до 90. 164 Корисно використовувати кольорову допплерографію для локалізації протеза і панорамування від 0 до 90, щоб знайти найкращий кут, особливо при вроджених вадах серця (ВВС). ІХ і БХ допплерографія важлива для оцінки стенозу клапана або протоки. 3D в реальному часі або 3D-зум з використанням середостіння з кутом датчика від 50 до 70 можна використовувати для відображення вигляду легеневого клапана анфас з боку ЛА або з боку ВТПШ з обертанням для відображення передньої стулки в положенні на 12 годин.26 Багатоплощинна реконструкція набору 3D-даних може бути швидко використана для оцінки спайок трьох стулок на предмет кальцифікації або зрощення на додаток до відстеження отвору клапана.165 При черезшкірній реімплантації легеневого клапана ВСЕ забезпечує кращу візуалізацію гомотрансплантата або каналу і може виявити інфекційний ендокардит, пов’язаний з протезованим клапаном.166,167
Рисунок 21 Запропонований алгоритм для інтеграції декількох параметрів тяжкості МР після заміни мітрального клапана. Передбачається якісна ехокардіографічна візуалізація та повний збір даних. Якщо візуалізація є технічно складною, для оцінки тяжкості слід розглянути можливість проведення ТЕЕ або СМР. Тяжкість МР може бути невизначеною через низьку якість зображення, технічні проблеми з даними, внутрішню неузгодженість між ехокардіографічними даними або розбіжність з клінічними даними. LA – ліве передсердя; PISA – площа поверхні проксимальної ізовекторної швидкості; RF – фракція регургітації; Rvol – об’єм регургітації; VCA- площа ВК; VCW – ширина ВК.
iii. Роль СМРТ: Кіно-візуалізаця із ЗСП або градієнтним ехо дозволяє візуалізувати використаний стент, якщо є артефакт стента, і дозволяє оцінити судину, оскільки має знижену чутливість до металевих артефактів, з обмеженням статичного зображення.168 Наскрізне фазово-контрастне зображення через протез дозволяє оцінити пікову швидкість через клапан, кондуїт і/або основну ЛА або ЛА окремо. Якщо є артефакт стента, фазовий контраст може бути розміщений проксимальніше і дистальніше артефакту стента.169 Пікова швидкість, як правило, трохи нижча, ніж та, що отримана при допплерівській ехокардіографії під оптимальним кутом. Магнітно-резонансна ангіографія з контрастним підсиленням дає змогу отримати тривимірний набір даних, який можна використовувати для подальшої ідентифікації ділянок стенозу. Пізнє гадолінієве підсилення з тривалим часом Т1 можна використовувати для виявлення тромбу як причини стенозу.127,170 КТ не можна використовувати для точної оцінки кальцифікації протеза або кондуїту.
- Роль КТ: Якщо значний артефакт, пов’язаний зі стентом, перешкоджає адекватній оцінці за допомогою СМРТ, КТ може бути використана для оцінки легеневого клапана або кондуїту (Рис. 24).171 Це може бути корисним, коли етіологія стенозу нез’ясована або для оцінки для черезшкірного структурного втручання.
Зображення 22 Черезстравохідної ехокардіографії стенозу мітрального клапана (ПрМК) з біопротезом у вихідному положенні та після встановлення транскатетерного КвК. Базові 3D черезстравохідні зображення (А) показують потовщені стулки з різко обмеженим відкриттям в діастолу і середнім діастолічним градієнтом (Гр) 8 мм рт. ст. (В) після каталітичного встановлення КвК. (С) Після встановлення транскатетерного КвК транскатетерний клапан добре прилягає, стулки нормально відкриваються в діастолу, немає значної протезної або паравальвеолярної регургітації, а середній трансклапанний Grстановить 4 мм рт.ст. (D). Max – максимальний; PG – градієнт тиску; Vmax – максимальна швидкість; Vmean – середня швидкість.
Таблиця 14 Найпоширеніші типи ЗЛК
| Тип клапана/кондуіта | Виробник; розмір (діаметр клапана або кондуіта) | |
| Хірургічні | Гомотрансплантат (кріоконсервований аортальний або легеневий) | Різноманітність розмірів |
| Кондуіти ксенографти | Medtronic Contegra; 12-22 мм | |
| Shelhigh; 10-24 мм | ||
| Medtronic Freestyle; 19-29 мм | ||
| Композитні синтетичні канали з біопротезними/механічними клапанами | Клапан Carpentier-Edwards Porcine; 12-30 мм | |
| Medtronic Hancock; 12-26 мм | ||
| Виготовлені вручну; різні розміри | ||
| Біопротезні або механічні клапани | Різноманітність типів і розмірів | |
| Транскатетер | У межах кондуітів або біопротезних клапанах | Medtronic Melody; 18 мм |
| Edwards SAPIEN; 23-29 мм | ||
| У рідному каналі відтоку | Medtronic Harmony; 22 та 25 мм |
Рекомендується електрокардіографічне зображення всього серцевого циклу з контрастним підсиленням, особливо у випадках, коли необхідне черезшкірне втручання. Наявність кальцифікації вказує на структурну дегенерацію клапана, але не може бути використана для кількісної оцінки ступеня стенозу. Наявність потовщення стулки, паннуса або тромбу також може бути оцінена для виявлення інших причин стенозу.172 КТ серця може бути використана для визначення розміру клапана або каналу, використовуючи ефективний діаметр, отриманий на основі вимірювання площі або периметру, якщо попередні хірургічні записи недоступні. Однак слід зазначити, що ці вимірювання є менш точними для кондуїтів, де післяопераційна кальцифікація може призвести до зміни розміру та форми.173
Зображення 23 Приклади нормально функціонуючого протезованого легеневого клапана (A, B) та іншого зі значним стенозом (C, D). PkV, пікова швидкість через легеневий клапан.
Таблиця 15 Параметри протезування стенозу легеневого клапана
| Норма | Можлива обструкція | |
| Якісні | Нормальна структура та рух клапана Ламінарний потік | Порушення структури та руху клапана Використовуйте ІХ доплер для визначення локалізації стенозу Підвищена турбулентність за даними кольорової допплерографії з вузьким струменем потоку |
| Кількісні* | Пікова швидкість <3,2 м/с для біопротеза <2,5 м/с для гомотрансплантата Середній градієнт <20 мм рт.ст. для біопротеза <15 мм рт.ст. для гомотрансплантата | Пікова швидкість ≥3,2 м/с для біопротеза ≥2,5 м/с для гомотрансплантата Середній градієнт ≥20 мм рт.ст. для біопротеза ≥15 мм рт.ст. для гомотрансплантата |
| Послідовне порівняння з базовим рівнем | Стабільний піковий/середній градієнт та пікова швидкість Без змін систолічного тиску ЛШ Без змін розміру та систолічної функції ЛШ Без змін ДІШ | Збільшення пікового/середнього градієнта та пікової швидкості Збільшення систолічного тиску в ПШ Збільшення розміру ПШ та зниження систолічної функції Зменшення ДІШ |
*Вимірювання припускають нормальний ударний об’єм ПШ. Точна БХ допплерографія може бути складною через положення гомотрансплантата або біопротеза клапана; важливо використовувати позавісьові парастернальні та супрастернальні зображення.
Зображення 24 Випадок тетради Фалло з 20-мм гомографтом, встановленим 25 років тому. Систолічний та діастолічний систолічний та діастолічний потік з фазовим контрастуванням (ліворуч) демонструє значний стеноз та регургітацію (4,1 м/сек, з фракцією регургітації 41%). Комп’ютерна томографічна ангіографія з мультипланарною реконструкцією (панелі) показує стеноз гомографта (14-15 мм), вторинний до кальцифікації. Жовті стрілки вказують на легеневий гомографт. Ао – аорта; RV – правий шлуночок.
C. Оцінка регургітації протезованого легеневого клапана
- Ехокардіографічна та допплерографічна оцінка: Існує недостатньо даних, які б конкретно оцінювали ЛР протезованих клапанів, тому наявна інформація екстраполюється з оцінки ЛР нативних клапанів. У таблиці 16 детально описано ехокардіографічні результати при різних ступенях тяжкості протезованої ЛР, а в таблиці 17 показано переваги і недоліки кожного методу візуалізації в оцінці ЛР. Ехокардіографічна оцінка ЛР повинна включати (1) характеристику типу і розміру протеза; (2) наявність відповідних анатомічних аномалій, таких як дегенерація або вегетації; (3) кількісну оцінку вираженості регургітації; і (4) будь-які зміни порівняно з попередніми оцінками при серійних обстеженнях. Крім того, необхідно оцінити розмір ПШ та положення і рух міжшлуночкової перегородки під час діастоли. Як обговорювалося раніше, протезний легеневий стеноз зустрічається частіше, ніж регургітація, як при дегенерації, так і при ендокардиті. Однак за наявності клапанної протоки може виникати як стеноз протоки, так і регургітація клапана (Рис. 23). Для допомоги в оцінці використовують кольоровий, ІХ та БХ допплер (таблиця 16). Кольорова допплерографія демонструє діастолічний потік у ВТПШ, а тривалість і ширина струменя допомагають визначити ступінь тяжкості. Тяжкий ЛР має коротку тривалість струменя, оскільки діастолічний тиск у ПШ і ЛШ швидко вирівнюється, що ускладнює візуальну оцінку ЛР. Ширина кольорового струменя >50% кільця протеза вказує на тяжку ЛР. Ці параметри менш достовірні при ексцентричній та параклапанній регургітації. Реверсія потоку в дистальному відділі ЛП при ІХ допплерографії свідчить про принаймні помірну ЛР. Короткий час діастолічного сповільнення також вказує на тяжку ЛР, але це також залежить від комплаєнтності правого шлуночка. У дослідженні, в якому порівнювали СМР з ехокардіографією, НПТ <95 мс і нахил >4,9 м/с2 вказували на необхідність втручання на легеневому клапані.174 Існує обмежена кількість методів кількісної оцінки ЛР, які можна екстраполювати на протезовані клапани. Порівняння ударного об’єму, отриманого трохи нижче ЗЛК, і ударного об’єму, отриманого на аортальному або мітральному клапані, може забезпечити вимірювання об’єму і фракції регургітації (за відсутності АР або МР відповідно). Фракція регургітації <30% вважається легкою, а >50% – тяжкою.1
Таблиця 16 Ехокардіографічна оцінка тяжкості регургітації протезованого легеневого клапана
| Параметри | Легка | Середня | Тяжка |
| Структура клапана | Зазвичай нормальна | Аномальна або дедисцизія клапана | Аномальна або дедисцизія клапана |
| Розмір ПШ | Нормальний або розширений | Нормальний або розширений* | Дилатятований або прогресуюче розшиерння† |
| Величина потоку за колірною допплерографією (центральні струмені) | Тонкий з вузьким початком; ширина потоку 25% від легеневого кільця | Середня; ширина потоку 26% – 50% від легеневого кільця | Зазвичай велика, з широким початком; ширина потоку>50% легеневого кільця; може бути короткою за тривалістю |
| Щільність потоку за даними БХ доплера | Неповний або слабкий | Щільний | Щільний |
| Швидкість сповільнення потоку за даними БХ доплера | Повільне зниження швидкості потоку | Варіабельне зниження швидкості потоку | Різке уповільнення,§ раннє припинення діастолічного потоку |
| Легеневий систолічний кровотік у порівнянні з системним кровотоком за даними ІХ допплерографії{ | Незначне збільшення | Середнє збільшення | Значне збільшення |
| Реверсія діастолічного потоку в дистальному відділі магістральної ЛА | Немає | Наявна | Наявна |
Адаптовано за Zoghbi et al. 1 *Якщо не існує іншої причини дилатації ПШ, включаючи залишкову післяопераційну дилатацію. † Якщо немає інших причин для вихідного розширення ПШ. Гостра ЛР є винятком. Перевантаження об’ємом ПШ зазвичай супроводжується типовим парадоксальним рухом перегородки. При межі Найквіста 50-60 см/сек; параметр стосується центральних струменів, а не ексцентричних струменів. § Різке сповільнення не є специфічним для тяжкої ЛР, оскільки може виникати при тяжкій діастолічній дисфункції ПШ. {Значення об’єму та фракції регургітації недостатньо обґрунтовані.
Таблиця 17 Оцінка протезованого легеневого клапана та мультимодальна візуалізація: переваги та обмеження
| Ехокардіографія | СМРТ | CT | |
| Первинна недостатність клапана | Переваги Якісна оцінка регургітації/стенозу Оцінка пікових/середніх градієнтів Оцінка гемодинаміки ЛШ Обмеження Складність коаксіального доступу при ЗЛК Складність оцінки стенозу ПШ | Переваги Просторова роздільна здатність Кількісна оцінка стенозу/регургітації Кількісна оцінка об’єму/функції ПШ Анатомічна візуалізація ЛА/біфуркації Обмеження Деякі клапани можуть створювати артефакти | Переваги Просторова роздільна здатність Візуалізація стулок при стенозі Оцінка кальцифікації клапана/проводу Анатомічна візуалізація ЛА/біфуркації Обмеження Оцінка регургітації Відсутня оцінка гемодинаміки Використання випромінювання/контрасту |
| Тромбоз / паннус | Переваги Якісна оцінка регургітація/стеноз Оцінка пікових/середніх градієнтів Оцінка гемодинаміки ПШ Обмеження Важко візуалізувати структуру клапана | Не ідеально підходить для оцінки | Переваги Хороша візуалізація та просторова роздільна здатність Диференціює тромб та паннус Обмеження Випромінювання/контраст |
| Ендокардит | Переваги Часова роздільна здатність Якісна оцінка регургітації/стенозу Обмеження Залежить від акустичних вікон | Не ідеально підходить для оцінки невеликих вегетацій | Не ідеально підходить для оцінки невеликих вегетацій |
Роль TEE та 3D: Використання TEE, описане раніше в розділі про легеневий стеноз, може допомогти оцінити тяжкість ЛР (табл. 17).3 Протезовані клапани можуть мати кальцифікати та тромби, які краще візуалізуються за допомогою TEE. Оцінка ЛР за допомогою 3D-ТЕЕ також може бути досягнута за допомогою 3D в реальному часі, 3D-зуму або мультипланарної реконструкції. Додатковою перевагою 3D-ТЕЕ є можливість побачити клапан впритул до регургітаційного отвору.26 ВСЕ може бути враховано при оцінці ЗЛК, коли ТЕЕ є непереконливою.166,167
iii. Роль КТ: Хоча КТ можна використовувати для виявлення рухливості стулок і наявності пролапсу, її часова роздільна здатність обмежена. Крім того, хоча було продемонстровано, що анатомічна область регургітаційного отвору є корисним інструментом для кількісної оцінки АР, досліджень щодо ЛР немає. Однак КТ може бути корисною для точної локалізації та визначення розмірів ПВВ.78
- Роль СМРТ: Перевагою СМРТ для оцінки регургітації є кількісна оцінка за допомогою фазово-контрастної візуалізації (Рис. 24).169 СМРТ перевершує ехокардіографію для кількісної оцінки ЛР.168 На основі виміряної фракції регургітації тяжкість ЛР вважається легкою при <26%, помірною при 26-35% і тяжкою при >35%.175 Інші дослідники вважають фракцію регургітації >40% тяжкою.176 На фазово-контрастну КМР не впливають множинні або ексцентричні струмені. При необхідності наскрізна площина може бути розміщена за межами клапанного артефакту. Новіші послідовності, такі як 4D потік, можуть бути використані для кращого розуміння напрямку потоку і кількісної оцінки регургітації, однак їх надійність на даний момент не доведена. Крім того, кількісне визначення об’ємів ПШ є важливим для оцінки ЛР і найкраще оцінюється за допомогою СМРТ.
Таблиця 18 Ехокардіографічні параметри, необхідні для комплексної оцінки протезування ТК
| Стандартні параметри | Розмір і тип протеза, а також дата імплантації |
| 2D або 3D візуалізація | Частота серцевих скорочень і артеріальний тиск Потовщення/рухливість стінки Механічна рухливість оклюдера Наявність тромбу, вегетації або паннуса Стабільність/розхитування протеза |
| Кольоровий доплер | Розташування потоку регургітації (центральне, ексцентричне або паравертебральне) Проксимальне місце конвергенції потоку, радіус Струмінь регургітації ВК Площа струменя регургітації |
| БХ Доплерографія | Піковий та середній діастолічний градієнт НПТ ДІШ (ІШЧ ПрТВ/УО ВТЛШ) ЕПО Пікова швидкість ТР Контур та щільність ТР |
| Споріднені камери серця | Розмір і функція ПП, ПШ Розмір і дихальні варіації IВК Профіль печінкового кровотоку в печінкових венах |
Зображення 25 Трансторакальна (A, B) та трансстравохідна (C, D) візуалізація пацієнта з тяжким біопротезним стенозом ТК. (А) Кольорове порівняльне діастолічне зображення, що показує кальциновані та обмежені стулки (жовта стрілка) з турбулентним діастолічним потоком. БХ допплерографія (Б) показує пікову швидкість 3,0 м/с із середнім градієнтом 20 мм рт.ст. Черезстравохідне систолічне зображення показує супутню ТР (червоні стрілки) в умовах помітно обмеженої рухливості стулки біопротеза. Тривимірна візуалізація підтверджує виражене обмеження всіх трьох стулок з малим діастолічним отвором (синя стрілка). RA – праве передсердя; RV – правий шлуночок.
Таблиця 19 Допплерівські показники, які свідчать про стеноз протезованого ТК
| Біопротез | Механічний | |
| Пікова швидкість Е, м/с) | ≥2.1 | ≥1.9 |
| Середній градієнт, мм рт. ст. | ≥9 | ≥6 |
| НПТ, мсек | ≥200 | ≥130 |
| ЕПО, см2 | <1.5 | <2.0 |
| ДІШ (ІШЧ ПрТК /ІШЧ ВТЛШ)* | ≥3.3 | ≥2.1 |
Ключові моменти для оцінки протезованих легеневих клапанів і каналів
- Оцінка протезованого легеневого клапана вимагає розуміння різних типів клапанів та клапанованих каналів, які встановлюються.
- Оцінка за допомогою ехокардіографії може вимагати позаосьового, нетрадиційного огляду.
- Слід виміряти та повідомити про пікову швидкість та середній градієнт (і, можливо, ДІШ), отримані за допомогою допплерографії, якщо це можливо.
- При клапанній регургітації необхідно проводити кольорове допплерівське дослідження, спектральну допплерівську реєстрацію струменя, звертаючи увагу на його інтенсивність та нахил.
- КТ та СМР дають змогу краще розмежувати протезовані легеневі клапани щодо тромбу та кальцинозу. КТ особливо корисна для кількісної оцінки ЛР.
- Існує недостатньо даних щодо оцінки ЛР у протезованих клапанах; наявна інформація здебільшого екстрапольована з оцінки нативних клапанів.
V. ОЦІНКА ПРОТЕЗОВАНИХ ТРИКУСПІДАЛЬНИХ КЛАПАНІВ
Оцінка ТК знаходиться в процесі розвитку, оскільки колись “забутий” клапан привернув до себе більшу увагу після того, як дослідження природної історії показали погані результати, пов’язані з прогресуючим погіршенням захворювання.177,178. Враховуючи сучасні рекомендації настанов,5 більшість ремонтів ТК або замін ТК (ЗТК) виконують під час операції на лівих відділах серця, найчастіше лише на мітральному клапані.179 Майже 90% процедур ТК у США – це відновлення, при цьому кількість замін за останні десятиліття зменшилася. Однак для ізольованих процедур ТК заміни продовжують переважати, що, ймовірно, пов’язано з пізнім виявленням ізольованої хвороби.180 Хоча більшість протезів ТК є біопротезами, мета-аналізи показують, що існує однаковий ризик 30-денної і пізньої смертності, повторних операцій і 5-річної відмови клапана у пацієнтів з механічним і біологічним ЗТК.181 Деякі дослідники показали, що швидкість дегенерації біопротезів є вищою після 7 років.182 Протезовані клапани і протезні кільця мають різні форми і способи виходу з ладу. Хірургічні біопротези можуть вийти з ладу через протезний стеноз або регургітацію. Середній проміжок часу між імплантацією трикуспідального біопротеза і виникненням дисфункції, що вимагає імплантації КВК, становив 12 років (діапазон 3-32 роки).183 Лонгітюдні дослідження відновленнь ТК показали, що значна рецидивуюча регургітація виникає протягом 5-7 років після ремонту.184,185 В умовах стаціонарної смертності від 10% до 13%, пов’язаної як з ізольованою, так і з повторною операцією на ТК,180,186 транскатетерні варіанти стали більш поширеними для вирішення проблеми несправності як нативного ТК, так і протезованого пристрою.183,185,187,188 Оцінка функції протезованого ТК, таким чином, включає оцінку хірургічного і транскатетерного ремонту і заміни ТК, а також процедур КВК і клапана-в-кільці.
Зображення 26 Приклад біопротезування ТК з вираженою регургітацією. TEE показує множинні вегетації (червоні стрілки, A і B) на біопротезі ТК, що призводить до вираженої регургітації (C). БХ доплер (D) показує низькошвидкісний щільний профіль з раннім систолічним піком. ІХ допплерографія печінкової вени (E) демонструє реверсію систолічного потоку (стрілки), що відповідає тяжкій регургітації. RA – праве передсердя; RV – правий шлуночок.
A. Ехокардіографічна оцінка протезування
Функція ТК Для комплексної оцінки ЗТК необхідна візуалізація в декількох площинах, при цьому використовують як 2D, так і 3D ехокардіографію (табл. 18). ТТЕ ЗТК є особливо корисною через переднє розташування клапана. Для оцінки рідного ТК слід виконувати всі стандартні площини візуалізації.189 Швидкість нативного і протезованого ТК змінюється залежно від тривалості циклу і дихання, тому при допплерографії слід отримати декілька серцевих циклів.190,191 Для ІХ і БХ допплерографії необхідно усереднити щонайменше п’ять серцевих циклів при фібриляції передсердь і синусовому ритмі або провести вимірювання в стані апное.1 На НПТ впливає частота серцевих скорочень, комплаєнс камери і умови навантаження, тому його слід інтерпретувати з обережністю при використанні в якості окремого показника функції ТК. Крім того, розрахунок ЕПО на основі НПТ переоцінює площу ТК для біопротезованих клапанів порівняно з методами, що базуються на рівнянні безперервності, і не рекомендується.192
Нові рекомендації ASE щодо виконання комплексної ТЕЕ перед структурним втручанням на клапані пропонують стратегії для повної візуалізації нативного ТК.193 Загалом, ці ж самі стратегії слід використовувати для оцінки протезованих ТК. Настанови пропонують стандартизоване відображення зображень для прямого огляду нативного ТК, і такі ж стандарти слід використовувати для прямого огляду протезованих клапанів ТК.26,194 Візуалізація ТК за допомогою TEE може бути складнішою, ніж за допомогою TTE, через положення клапана відносно стравоходу (переднє і медіальне). Акустичний шум від фіброзного тіла серця, а також матеріал протезу лівої частини серця робить ТЕЕ із середньостравохідної проекції особливо проблематичною. Зображення з глибоких стравохідних або трансстравохідних позицій датчика розташовує датчик ближче до ТК і, отже, може усунути як затінення, викликане структурами лівого серця, так і ослаблення дальнього поля.92,194 Розуміння цих обмежень може допомогти визначити оптимальну площину зображення для виявлення специфічних аномалій.68,195,196
B. Оцінка стенозу протезованого ТК
- Ехокардіографічна оцінка: ЗТК може вийти з ладу рано або пізно після імплантації. Ехокардіографічна оцінка функції протезованого ТК включає оцінку параметрів, перелічених у таблиці 18. Двовимірні або тривимірні зображення, що демонструють потовщення та/або обмеження руху стулок біопротеза або зменшення екскурсії одного чи декількох механічних дисків, є очевидними ознаками стенозу протеза. Стеноз також слід запідозрити при наявності звуженої, зміненої картини притоку ТК при високошвидкісній кольоровій допплерографії (Зображення 25). Дегенерація біопротезів ТК не є рідкістю і трапляється у 0,4%-2,2% пацієнтів на рік.197,198 Рівень свободи від дисфункції біопротезів ТК оцінюється на рівні 66% через 5 років.199 Механічні протези, як правило, стають непрохідними через тромбоз, паннус або вегетацію з частотою тромбозів від 0,5% до 3,3% пацієнтів на рік.197,200,201 Середні значення градієнта <6-9 мм рт.ст. асоціюються з нормальною функцією біопротезів у широкому спектрі біопротезів.192 Аналогічно, середній градієнт <6 мм рт.ст. є маркером нормальної функції механічного ТК.202 Слід підкреслити, однак, що є кілька факторів, які можуть суттєво впливати на середній градієнт за відсутності дисфункції протезованого клапана, включаючи менший клапан і високий вихідний стан. У пацієнтів, які проходять процедуру КвК або клапан-в-кільці, постімплантаційний середній градієнт >10 мм рт.ст. вважається доказом стенозу.203
Таблиця 20 Ехокардіографічні параметри для визначення протезованої ТВ регургітації: переваги та обмеження
| Параметр | Переваги | Обмеження |
| Морфологія ТК (напр., підвищена рухливість стулок, перфорація, дегісценція) | Аномалії повинні бути виявлені, якщо присутня тяжка ТР | Впливає на налаштування апарату та фізику ультразвуку (наприклад, глибина, акустичний артефакт від протезного матеріалу) |
| Розміри та функції ПП і ПШ | Дилатація як правого передсердя, так і правого шлуночка зазвичай спостерігається при значній ТР Відсутність дилатації ПШ та ЛШ свідчить про відсутність тяжкого хронічного ТР | Основна патологія лівих і правих відділів серця, а також легенева гіпертензія також можуть спричинити дилатацію правих відділів серця |
| Кровотік у НПВ та печінкової венах | При значній ТР спостерігається дилатація НПВ та реверсія голосистолічного потоку в печінковій вені | Після ЗТК часто спостерігаються зміни комплаєнсу RA, що призводять до притуплення печінкового венозного кровотоку та/або пізнього систолічного розвороту. Дилатація НПВ може спостерігатися і при інших станах з високим діастолічним тиском RA/RV |
| БХ Доплерографія | Щільна систолічна спектральна реєстрація з трикутною швидкістю з раннім піком свідчить про важку ТР | Щільна систолічна спектральна реєстрація з трикутною ранньою піковою швидкістю свідчить про важку ТР |
| Струмінь кольорового доплера (розмір, кількість струменів, розташування, ексцентриситет) | В режимі реального часу і швидко Великий центральний струмінь (площа > 10 см2 ), що свідчить про важку ТР | Впливає на налаштування апарату та фізику ультразвуку (наприклад, глибина, акустичний артефакт від протезного матеріалу), а також гемодинаміку Множинні та ексцентричні потоки важче інтерпретувати |
| ШВК | Швидкий ШВК ≥0,7 см в режимі реального часу свідчить про важку ТР | Важко оцінити в струменях з часовою мінливістю Обмежена валідність для декількох струменів Обмежена валідність для некруглої форми отвору |
| Радіус ППІШ та ЕПРО* | Велика конвергенція потоку (>0,9 см) свідчить про виражену ЕПРО < 0,2 см2 зазвичай легкого ступеня ТР; ≥0,4 см2 зазвичай ТР важкого ступеня | Може недооцінювати тяжкість ТР за наявності декількох струменів, часової мінливості або помітно асиметричної форми отвору Вплив приладу на зону конвергенції потоку обмежує точність |
| Площа ВК за допомогою 3D планіметрії | Може бути найточнішою оцінкою ТР; однак, погано обґрунтованою | Обмеження роздільної здатності (осьової, бічної та часової), а також артефакти цвітіння Точність у неплоских отворах може бути обмеженою Тривимірна реконструкція кожного отвору займає багато часу Може знадобитися часове усереднення |
НПВ, нижня порожниста вена; ППІШ, площа поверхні проксимальної ізовекторної швидкості; ШВК, ширина ВК. *Недостатньо валідизовано для кількісного визначення в ЗТК; для ППІШ зміщення базової межі Найквіста до 25-35 см/сек.
За відсутності тахікардії обструкцію ТК біопротеза підозрюють, коли швидкість Е-хвилі БХ доплера становить 2,1 м/с, тоді як обструкцію механічного протеза припускають, коли швидкість Е-хвилі становить 1,9 м/с (табл. 19).191,192,204 Попередні настанови рекомендували, що НПТ <230 мс узгоджується з відсутністю протезного стенозу.1 У серії з 285 біопротезів Blauwetet та співавт. 202 виявили, що НПТ <200 мсек є показником нормальної функції біопротеза на ранніх стадіях після імплантації. Механічні ендопротези ТК, навпаки, мають нижчу нормальну точку зрізу НПТ (<130 мсек). НПТ не рекомендується проводити при наявності закруглених спектральних допплерівських контурів, оскільки за таких обставин вимірювання НПТ не може бути достовірним.205 Слід також зазначити, що на НПТ впливає як частота серцевих скорочень, так і комплаєнс правого шлуночка
Таблиця 21 Ехокардіографічна градація ТР після відновлення ЗТК або ТК
| Параметри | Легка | Середня | Тяжка |
| Якісні | |||
| Площа кольорового потоку cтруменя* | Маленька, вузька, централізована | Помірна централізована | Великий центральний потік або ексцентричний пристінковий потік (потік(и)) змінного розміру, що закручується в правому передсерді |
| Зона конвергенції потоку† | Непомітна або мала | Проміжна за розміром | Велика |
| ТР БХ Допплерівська крива швидкості (щільність і форма) | Слабка/часткова/параболічна | Щільна, параболічна або триангулярна | Щільна, часто тріангулярна |
| Трикуспідальний притік | Домінанта А-хвилі | Варіабельно | Домінанта Е-хвилі‡ |
| Напівкількісні | |||
| ВК ширина, см* | <0.3 | 0.3-0.69 | ≥0.7 or ≥2 помірні струмені |
| Радіус ППІШ, см† | 0.5 | 0.6-0.9 | >0.9 |
| Кровотік у печінкових венах§ | Систолічне домінування | Систолічне притуплення | Реверс систолічного потоку |
| Кількісні показники | |||
| ЕПРО, см2§ | <0.20 | 0.20-0.39 | ≥0.40 |
| RVol, mL§ | <30 | 30-44 | ≥45 |
ППІШ, площа поверхні проксимальної ізовекторної швидкості; RVol, об’єм регургітації.
*З межею Найквіста > 50-60 см/сек. † Недостатньо валідований для кількісної оцінки в ЗТК; базова межа Найквіста зміщена до 25-35 см/сек. Неспецифічний, залежить від інших факторів (діастолічна функція ПШ, фібриляція передсердь, тиск РА).
- Показники ЕПРО та RVol з 2D ППІШпотребують подальшої валідації порогових значень або за допомогою ППІШ, або об’ємними методами.
Хоча попередні настанови пропонували використовувати градієнти протезування та НПТ для оцінки функції протезування, ДІШ (ДІШ = ІШЧ ПрТК/ІШЧ ВТЛШ) та ЕПО нещодавно були включені як частина комплексної допплерівської оцінки ЗТК. ДІШ, пов’язаний з нормальною функцією біопротеза ТК, значно варіює залежно від типу і розміру клапана, з верхніми значеннями від 2,4 до 3,6. 192 Аналогічно, ДІШ, пов’язаний з нормальною функцією механічного ТК, значно варіює залежно від типу і розміру клапана, а верхні межі коливаються від 2,3 до 2,8.202 ЕПО можна розрахувати шляхом ділення ударного об’єму у ВТЛШ на діастолічний трикуспідальний протезний ІШЧ.192,202 Цей метод є найбільш точним при легкій або меншій ТР та АР, хоча нормативних даних недостатньо. Якщо є значна АР, об’єм прямого удару може бути виміряний за допомогою ВТПШ.206
Таблиця 22 Перелік анатомій CDH, які можуть потребувати протезування серцевого клапана після первинного хірургічного втручання
| Анатомія ВВС | Хірургічні втручання | Черезшкірні втручання на клапанах | |
| Аортальний клапан | Виражений аортальний стеноз Комплекс Шейна
Перервана дуга аорти з малим аортальним кільцем Двостулковий аортальний клапан Одностулковий аортальний клапан |
Процедура Росса
Процедура Росса-Конно Процедура Ясуї Заміна аортального клапана |
Балонна вальвулопластика КвК ТІАК |
| Мітральний клапан | Вроджений стеноз мітрального клапана Парашутний мітральний клапан Аркадний мітральний клапан Шейн комплекс AVSD | Відновлення мітрального клапана Відновлення AVSD Механічна заміна мітрального клапана | Балонна вальвулопластика КвК (клапан Melody або Edwards SAPIEN) |
| ТК | АВСД Аномалія Ебштейна Дисплазія ТК Трикуспідальна атрезія | Ремонт ТК Реконструкція конуса Механічна ЗТК Процедура Бьорка | КвК (Клапан Melody) |
| Клапан легеневої артерії | Транспозиція магістрального стовбура артерії з обструкцією ВТЛШ ТФ/легенева атрезія Вроджений стеноз клапана легеневої артерії | ПШ-to-ЛА кондуїт Растеллі операція Гомотрансплантат | Балонна вальвулопластика Клапан Melody Клапан Edwards SAPIEN Клапан Harmony Транскатетерний легеневий клапан |
AVSD, дефект атріовентрикулярної перегородки; ТФ, тетрада Фалло.
Допплерівські параметри, які вказують на протезований стеноз ТК, наведені в таблиці 19. Хоча високі градієнти тиску можуть вказувати на протезований стеноз, високі транспротезні градієнти можуть також відображати НПП. Запропоновані значення ЕПО для ТК НПП коливаються від <0,9 до 1,19 см2 /м2 . 192,207На даний час відсутні дані щодо впливу цих індексованих порогових значень ЕПО на результати в лонгітюдних когортах.
- Роль КТ: КТ може допомогти в оцінці стенозу ЗТК шляхом вимірювання геометричної площі отвору та визначення етіології стенозу. Вона показує такі етіології, як дегенерація стулки, аномальна рухливість стулки або оклюдера диска, кальцифікація кільця біопротеза, тромб, паннус або вегетація.150 Для КТ-оцінки протезованого ТК необхідне адекватне помутніння РА і ПЗ з обмеженим артефактом змішування. Цього можна досягти за допомогою трифазного протоколу введення контрасту і часу зйомки для помутніння правого серця, а не лівого.208 Максимальну геометричну площу отвору протезованого ТК можна виміряти в діастолу, використовуючи мультипланарну реконструкцію по короткій осі на кінчику стулки біопротеза.151 У механічних клапанів, окрім геометричної площі отвору, можна виміряти кути відкриття і закриття.152 Необхідно ретельно розглянути ці вимірювання, оскільки геометрична площа отвору при КТ є більшою, ніж ЕПО при ТТЕ, як і очікувалося.151
iii. Роль СМРТ: Протезований трикуспідальний стеноз може бути кількісно оцінений на СМР з планіметрією геометричної площі отвору на кінетичному зображенні або пікової швидкості і градієнту на наскрізному контрастно-швидкісному картуванні. Артефакт чутливості від металевого кільця і дискового оклюдера може обмежити візуалізацію отвору клапана, але його можна мінімізувати за допомогою послідовності градієнт-ехо, а не послідовності ЗСП.209 Використання картування наскрізної площини швидкості може бути обмеженим через артефакт чутливості від кільця клапана або дискового оклюдера і кільцевого руху в положенні ТК.
Таблиця 23 Проблеми оцінки протезованого клапана у пацієнтів з ВВС Погана ехокардіограма
| Погані ехокардіографічні вікна через ◦ Попередні операції ◦ Деформації грудної клітки ◦ Артефакти від протезних матеріалів ◦ Розміри тіла |
| Недооцінка градієнтів протезованого клапана/провідника через ◦ Наявність асоційованих шунтів ◦ Серійні стенози ◦ Ексцентричні потоки |
| Розрахунок ЕПО може бути обмежений ◄ Послідовними стенозами, які впливають на використання рівняння неперервності ◄ Нециркулярною формою ВТЛШ або ВТПШ, що впливає на розрахунок потоку перед протезом ◄ Неточністю ІШЧ у пацієнтів з субаортальним або субпульмональним стенозом, коли картина швидкості потоку перед обструкцією не є ламінарною. |
Довгі трубчасті звуження кондуїтів впливатимуть на градієнт тиску, розрахований за модифікованим рівнянням Бернуллі з використанням пікової швидкості потоку
C. Оцінка регургітації протезуванного ТК
- Ехокардіографічна оцінка: ТР може бути як трансклапанним, так і параклапанним за походженням, тому необхідна ретельна оцінка протезованої ТК з усіх доступних вікон. Регургітація після використання транскатетерного пристрою при захворюванні нативного ТК була розглянута в нещодавніх настановах3 і тут не розглядається. Як і для всіх оцінок клапанної регургітації за допомогою ехокардіографії, для загальної оцінки ТР необхідний інтегративний підхід з використанням кольорового, ІХ і БХ доплерів (Рис. 26, Таблиці 20 і 21). Кольорову допплерографію слід виконувати з декількох трансторакальних ехокардіографічних зображень для оцінки тяжкості ТР, звертаючи увагу на три компоненти струминного потоку – конвергенцію струменя, ВК і напрямок струменя – а також вплив струменя на праве передсердя. Для компенсації акустичного затінення від протезованого стента клапана або дискових оклюдерів важливо отримати модифіковані зображення притоку ПШ і підребер’я. Численні дослідження вказують на значні недоліки використання лише площі кольорового допплерівського струменя для оцінки тяжкості ТР.1,210 За можливості слід проводити кількісні вимірювання. Однак кількісне визначення площі поверхні проксимальної ізовеличини як нативного, так і протезного ТР клапана має ряд недоліків (наприклад, низький потік, неправильна форма отвору, часова варіабельність), і лише в кількох дослідженнях ця методика була валідована при захворюваннях нативного або протезного клапана.211,212 Прогресуюча дилатація камер серця або зміни розміру печінкової вени та її кровотоку під час подальшого спостереження також можуть свідчити про зміну функції протезного клапана. Ехокардіографічні критерії оцінки тяжкості ТР наведені в таблиці 21. На кольоровому допплерівському зображенні велика конвергенція потоку, збільшена ширина ТК (>0,7 см), ЕПРО > 0,4 см2 і об’єм регургітації > 45 мл – все це вказує на тяжку ТР. Щільне допплерівське трасування БХ з трикутною швидкістю з раннім піком, а також підвищеною трансклапанною діастолічною піковою швидкістю і середнім градієнтом також вказує на тяжкий ТР. ДІШ >3,3 на фоні підвищеного трансклапанного градієнта і нормальної НПТ допомагає підтвердити наявність значної ТР. Нечисленні дослідження показали доцільність проведення 3D кольорової допплерівської планіметрії ділянки ВК як за допомогою TTE211, так і TEE при нативній патології клапана.213 Порівняно з багатопараметричною оцінкою вираженої ТР, 3D відсічення площі ТК211,213 і допплерівське відсічення ЕПРО майже вдвічі перевищує проксимальну площу поверхні ізовекторної швидкості ЕПРО.211 Питання про те, чи можна використовувати ці методи для оцінки протезованих клапанів, потребує подальшого вивчення.
- Роль СМРТ: СМРТ може оцінити стан правого шлуночка в умовах ТР завдяки своїй здатності кількісно визначати об’єми ПШ і фракцію викиду без геометричних припущень.5 Хоча в даний час немає опублікованих даних про протезовані ТР, підходи, що використовуються, аналогічні тим, що застосовуються для нативних ТР. Як правило, кількісна оцінка об’ємів регургітації за допомогою СМР спирається на фазово-кодовані за швидкістю фазово-контрастні зображення для вимірювання прямого потоку через легеневий клапан з подальшим відніманням цього об’єму від загального об’єму удару ЛШ, виміряного за допомогою короткоосьової планіметрії з використанням декількох дисків. Цей кількісний підхід продемонстрував помірну узгодженість з багатопараметричним ехокардіографічним підходом при нативному ТР.214 Нещодавнє дослідження, в якому використовували СМР для оцінки результатів при нативному функціональному ТР, показало, що як об’єм регургітації, так і фракція регургітації асоціюються з підвищеною смертністю після поправки на клінічні та візуалізаційні коваріанти, включаючи фракцію викиду ПШ.215 Хоча ризик прогресував зі збільшенням об’єму ТР і фракції регургітації, об’єм ТР 45 мл або фракція регургітації 50% визначали пацієнтів у страті найвищого ризику смертності. Конкретні порогові значення CМР для втручання при протезуванні ТР не встановлені.
iii. Роль КТ: Роль КТ при регургітації протезованого ТК подібна до ролі КТ при протезованому МР. Надмірне розгойдування протеза під час серцевого циклу спостерігається при клапанній дегідратації, при цьому можна ідентифікувати та локалізувати значні ПВВ. Невеликі ПВВ можуть бути приховані через металеві артефакти від протезного кільця або дискових оклюдерів. Роль КТ в даний час полягає насамперед у тому, щоб допомогти у плануванні транскатетерних втручань ТК.216
Ключові моменти для оцінки протезування ТК
- Комплексна оцінка ЗТК вимагає декількох площин візуалізації, в яких використовуються 2D і 3D і допплерівська ехокардіографія для оцінки структури і функції клапанів, а також розміру і функції правих камер серця. Через затінення і маскування потоку в правому передсерді, особливо при механічних ТК, скринінг на ТР повинен включати модифіковані зображення притоку ПШ і підреберних видів, а також ІХ допплерівське дослідження кровотоку в печінкових венах, де це можливо.
- З допплерографічних записів протезованих ТК слід вимірювати пікову швидкість, середній градієнт, НПТ та частоту серцевих скорочень і повідомляти про них, коли це можливо. Існує менше досвіду щодо ЕПО та ДІШ ЗТК.
- Кілька факторів можуть впливати на середній градієнт ТК за відсутності дисфункції протезованого клапана, включаючи частоту серцевих скорочень, потік, розмір і тип протеза; враховуючи ці фактори, ми пропонуємо використовувати специфічні для типу протеза відсікачі для визначення стенозу протезованого ТК.
- Необхідний багатопараметричний ехокардіографічний підхід для оцінки регургітації протезованого ТК, оскільки валідація кількісних методів недостатня.
- СМР може бути корисним для кількісної оцінки об’єму та фракції регургітації, однак валідація його використання при протезованій функції клапана відсутня.
- КТ є корисною для виявлення механізмів клапанної дисфункції, локалізації значних ПВВ та необхідна при плануванні черезшкірних втручань на ТК.
Зображення 27 Черезстравохідне ехокардіографічне зображення з глибокого трансгастрального вікна на висоті близько 60 см у пацієнта, який переніс процедуру Росса з приводу інфекційного ендокардиту, демонструє серцеві структури, що оточують легеневий гомотрансплантат (А). Збільшені глибокі трансгастральні зображення з кольоровим доплерівським скануванням демонструють прискорення кровотоку в гомотрансплантаті (В). Зображення з висоти стравоходу під кутом близько 130 забезпечує чіткий огляд листків гомотрансплантата (червоні стрілки, С), з обмеженим рухом (D) і прискоренням потоку через листки за даними кольорової допплерографії (Е). БХ доплер (F) вимірює піковий і середній систолічний градієнти 52 і 30 мм рт.ст. відповідно. Пацієнту виконали хірургічну заміну легеневого клапана на протез Sorin; показано 3D-зображення клапана (G).
VI. ОЦІНКА ПРОТЕЗУВАННЯ КЛАПАНІВ ПРИ ВВС
A. Протезування клапанів при ВВС
Поява інтервенційних транскатетерних підходів до встановлення ПКС принесла користь багатьом пацієнтам з ВВС. У дітей з клапанними вадами перевага надається відновленню, а не заміні, оскільки НПП неминучі в міру росту дитини. Балонна вальвулопластика є першою лінією лікування вродженого клапанного стенозу, і деяким пацієнтам перед заміною клапана імплантують КвК у відповідну атріовентрикулярну або напівмісячну позицію з використанням черезшкірного доступу.217 Це дозволяє пацієнтам рости до того, як їм встановлять механічні клапани після невдалого ремонту.218,219 Оцінка ПКС при ВВС з використанням описаного в цьому документі підходу у дорослих загалом є ефективною, хоча існують певні обмеження та відмінності, які описані нижче. У таблиці 22 перераховані всі ураження ВВС, які можуть вимагати хірургічного та/або черезшкірного втручання з приводу ПКС. Використання 2D і 3D ехокардіографії, СМРТ і КТ розмежовано в оцінці ПКС у підлітків і дорослих з ВВС.
Таблиця 24 Використання 3D ехокардіографії у пацієнтів з ВВС*.
| Регіон, що цікавить | 3D модальність | Інформація | Доцільність |
| Аортальний клапан | СШ/кольорова допплерографія ТТЗ: PLAX, PSAX, апікальна ТЕЕ: ME 60, 120 | Вигляд/рух стулки протезованого клапана Походження регургітації Покращене вимірювання площі ВТЛШ | Помірна |
| Мітральний клапан | СШ/кольорова допплерографія: PLAX, PSAX, апікальна ТЕЕ: ME 0, 90, 120 | Вигляд/рух стулки протезованого клапана Виникнення регургітації | Висока |
| ТК | СШ/кольорова допплерографія: апыкальний, приплив ПШ, субкостальний ТЕЕ: МЕ 0, 40-60, трансшлункова | Вигляд/рух стулки протезованого клапана Виникнення регургітації | Помірна |
| Легеневий клапан/легеневі гомотрансплантанти | СШ/кольорова допплерографія: ТЕЕ: PSAX TEE: високо стравохідна 0-40, трансстравохідна | Зовнішній вигляд/рух стулки протезованого клапана Походження регургітації Покращення вимірювання площі ВТПШ | Низька |
СШ, сірошкальна; ME, середостіння; PLAX, парастернальний вид по довгій осі; PSAX, парастернальний вид по короткій осі. *Видано за Simpson та співавт. 224
B. Ехокардіографія при оцінці ПКС, асоційованих з ВВС
Ехокардіографія є основним неінвазивним методом візуалізації, який використовується для оцінки протезованих клапанів у пацієнтів з ВВС. Вона дозволяє оцінити як функцію клапана, так і гемодинамічний вплив дисфункції клапана на лівий та/або правий шлуночки. Комплексна ехокардіографічна оцінка включає 2D і 3D трансторакальну або черезстравохідну візуалізацію з використанням кольорового, БХ і ІХ доплера.164 Вона також може включати дослідження з перемішаним фізіологічним розчином, препаратами, що підсилюють ультразвук, і стрес-ехокардіографію. Одним з найважливіших кроків перед візуалізацією пацієнта з ВВС помірної або великої складності є розуміння потоку крові через серце, щоб визначити, які зображення необхідні. Це вимагає розуміння оригінальної анатомії серця і змін, внесених хірургічним втручанням або черезшкірним втручанням. Інформація щодо класифікації ВВС доступна в рекомендаціях Американського коледжу кардіології та Американської асоціації серця щодо ВВС у дорослих.217
- ТТЕ: Опубліковано кілька настанов і рекомендацій щодо ТТЕ у пацієнтів з ВВС. Вони включають загальний трансторакальний ехокардіографічний протокол Міжнародного товариства вроджених вад серця у дорослих.220 Також ASE опублікувала рекомендації щодо мультимодальної візуалізації для пацієнтів з тетрадою Фалло і транспозицією великих артерій.170,221 Виклики при візуалізації та оцінці протезованих клапанів у пацієнтів з ВВС підсумовані в Таблиці 23. Трансторакальні ехокардіографічні зображення пацієнтів з ВВС можуть бути неоптимальними через розміри тіла, деформації грудної стінки та численні хірургічні втручання. Артефакти від протезних матеріалів і клапанів є додатковими перешкодами для отримання інтерпретованих ехокардіографічних зображень. Часто потрібні позаосьові та нетрадиційні вікна візуалізації. Зокрема, структури правого серця можуть бути складними для візуалізації через їх розташування. Наприклад, правобічні канали (наприклад, ПШ-ЛА або ПП-ПШ) розташовані спереду і можуть знаходитись за грудиною. Значні градієнти в цих провідних шляхах можуть бути пропущені, якщо зображення не оптимізовано. Для визначення їх розташування можна використовувати кольорове картування потоку.220 Для покращення візуалізації ПП-ПШ або легеневих клапанів можна спробувати використовувати ракурси, які не часто отримують, наприклад, нахилене допереду зображення в верхівковому вікні. Вища частота серцевих скорочень у пацієнтів дитячого віку може спричинити низьку частоту кадрів, що можна виправити за допомогою ехокардіографії в М-режимі. Якщо зображення неадекватні, слід розглянути можливість проведення ТЕЕ (див. наступний розділ). Крім того, рекомендується використання ультразвукового підсилювача для покращення оцінки розміру та функції камер серця. Зміни можуть вказувати на можливу дисфункцію протезованого клапана/провідника і потребувати подальшої візуалізації за допомогою СМР або КТ. Окрім якості ехокардіографічного зображення, оцінка протезованих клапанів у пацієнтів з ВВС може бути ускладнена співіснуванням декількох рівнів обструкції та наявністю додаткових шунтів. Серійні стенози впливають на застосування рівняння безперервності для визначення ЕПО. Наприклад, на вимірювання градієнту тиску через клапан в каналі ПШ-ЛА буде впливати наявність стенозу. Стрес-ехокардіографія: систола поширюється на праву або ліву ЛА. Наявність додаткових шунтів, як нелікованих, так і залишкових після лікування, впливатиме на градієнти потоку і тиску, а отже, і на розрахунок ЕПО.
- Стрес-ехокардіографія: Використання стрес-ехокардіографії на нативних і протезованих клапанах добре відоме.60 Сучасні рекомендації Європейської асоціації серцево-судинної візуалізації та ASE щодо клінічного використання стрес-ехокардіографії при неішемічних захворюваннях серця включають опис її застосування у пацієнтів з ВВС.60 Пацієнтам з ВВС з протезованими клапанами або клапанними кондуїтами можна проводити стрес-ехокардіографію для оцінки симптомів, здатності до фізичного навантаження, дисфункції шлуночків і скоротливого резерву, а також легеневої судинної реакції.217,222,223 Важливо, що тестування з фізичним навантаженням можна використовувати для покращення ранньої діагностики та втручання.
iii. ТЕЕ: ТЕЕ переважно використовується, коли трансторакальна візуалізація є недостатньою для оцінки функції протезованого клапана. Однак вона також показана, коли є занепокоєння щодо інфекційного ендокардиту протезованого клапана, необхідності повторної оцінки клапана після лікування тромбозу або інфекції, або для планування хірургічних чи черезшкірних втручань на клапані. ASE опублікувала настанови щодо виконання ТЕЕ у пацієнтів з ВВС.164 Подібно до ТТЕ, деякі види черезстравохідної ехокардіографії необхідно модифікувати для ретельної оцінки протезованого клапана/провідника у пацієнтів з ВВС (Рис. 27).
- Тривимірна ехокардіографія: У пацієнтів з хорошими акустичними вікнами тривимірна ехокардіографія може надати цінну анатомічну інформацію. Вона також може покращити оцінку тяжкості клапанної дисфункції та кількісну оцінку об’ємів ЛШ, ПШ та ударного об’єму.224 У 2017 році було опубліковано консенсусну заяву експертів щодо використання 3D-ехокардіографії у пацієнтів з ВВС.224 У таблиці 24 підсумовано доцільність її проведення у пацієнтів з ВВС. Слід зазначити, що пацієнтам зі складною анатомічною будовою, ймовірно, знадобиться багатоканальне сканування для отримання набору даних, який охоплює протез клапана, кондуїт і прилеглі структури, необхідні для орієнтації з адекватною просторовою і часовою роздільною здатністю. Це також може знадобитися для отримання високоякісних кольорових 3D-зображень.
C. Роль КТ серця
КТ з 4D візуалізацією є корисним додатковим методом оцінки ПКС у пацієнтів з ВВС. КТ може бути особливо корисною у пацієнтів з ВВС з наступних причин: (1) положення ПКС не завжди піддається оцінці за допомогою традиційних ехокардіографічних вікон з огляду на численні попередні хірургічні втручання, атипову анатомію або незвичне розташування (напр., канал ПП-to-ПШ при процедурі Bjork); (2) клапани можуть бути розміщені всередині каналів у пацієнтів з ВВС (наприклад, канал ПШ-to-ЛА), що ускладнює оцінку через розташування та артефакти, пов’язані з каналом; і (3) потенційна наявність множинних послідовних обструкцій, що ускладнює допплерівську оцінку. Потенційні причини дисфункції ПМК у пацієнтів з ВВС подібні до таких у пацієнтів без ВВС. Як тільки підвищений градієнт або клапанну регургітацію виявлено за допомогою ехокардіографії або клінічно запідозрено, можна розглянути можливість проведення КТ. Для оцінки причини підвищеного градієнту на механічному протезі клапана може бути достатньо неконтрастної КТ (особливо в контексті ниркової дисфункції) з ретроспективним гейтингом, щоб оцінити рух оклюдерів.
Неконтрастна КТ може також виявити наявність перелому стента клапана (наприклад, від транскутанних легеневих клапанів) і периклапанної кальцифікації, а також допомогти диференціювати застави від потенційних ПВВ, які можуть сприяти збільшенню трансклапанних градієнтів. Якщо є підозра на тромбоз клапана, утворення паннуса, вегетації або дисфункцію біопротеза клапана, слід виконати ретроспективну КТ з контрастуванням. Місце введення контрасту (права рука, ліва рука, нога) має бути ретельно визначене на основі знань анатомії вен. Конкретні сценарії, в яких КТ серця є корисною у пацієнтів з ВВС для оцінки ПКС за межами їх звичайної локалізації, включають оцінку клапанних проток (наприклад, тетрада Фалло) або черезшкірного клапана в проточці від ПШ до ЛА (напр., клапан Melody172), клапан у протоці ПП-to-ПШ (процедура Bjork), щоб диференціювати стеноз краю протоки від клапанної дисфункції та виявити наявність супутнього суб- або надклапанного стенозу (наприклад, стенозу гілки ЛА; Рис. 24).
При цих специфічних показаннях, враховуючи правобічну локалізацію цих аномалій, час отримання зображення відносно введення контрасту повинен максимізувати присутність контрасту в правобічних структурах. З цією метою можуть бути корисними трифазні ін’єкції.172 Слід виконати ретроспективне вентильоване дослідження для оцінки динамічної природи протезованого клапана і рухливості 42 Zoghbi та співавт. Journal of the American Society of Echocardiography січень 2024 стента з клапаном, якщо це можливо. Оцінити регургітацію клапана безпосередньо неможливо через брак даних про потік, однак ретроспективне вентильне дослідження може виявити наявність гойдання клапана. Якщо розшарування чітко виражене, КТ може охарактеризувати його локалізацію, довжину і ширину, що дозволить планувати потенційні черезшкірні процедури. Крім того, в контексті захворювання одного клапана можна виміряти ударні об’єми ПШ і ЛШ для кількісної оцінки об’єму і фракції регургітації. Важливим обмеженням КТ є потенційна можливість виникнення артефактів затвердіння променя або “цвітіння”, які впливають на точність діагностики, особливо в контексті декількох клапанів, стентів, котушок і провідників кардіостимулятора. Їх слід ретельно уникати, коли це можливо, використовуючи описані вище методи.
D. Роль СМРТ
СМР широко використовується як для передопераційної, так і для післяопераційної оцінки простих і складних ВВС. Перевагою СМРТ при ВВС є її здатність (1) візуалізувати клапан у площинах, які можуть бути складними для ехокардіографії, наприклад,a за грудиною; (2) забезпечити кількісну оцінку камер; (3) оцінити анатомію магістральних судин і каналів за допомогою 3D магнітно-резонансної ангіографії з контрастуванням; і (4) охарактеризувати тканину для комплексної оцінки функції клапана.225 У проспективній оцінці випадків найпоширенішим методом ГКР при ВВС було ЗЛК, за яким слідували заміна аортального клапана і гомо- або аутотрансплантат.226 На сьогоднішній день існує недостатньо опублікованої літератури, присвяченої саме ГКР при ВВС.
Використання СМР у цій популяції екстраполюється з літератури, в першу чергу, щодо нативних клапанів, які подібні до гомо- або аутотрансплантатів, а також з даних хірургічних протезів, як обговорювалося вище.124 Використання як 1,5-, так і 3-Т магнітів СМР є безпечним у пацієнтів з усіма типами ПКС. Оцінюючи, яку силу магніту використовувати в ВВС, важливо враховувати інші втручання, які могли бути проведені пацієнту, наприклад, судинні пробки, котушки, кардіостимулятори або дефібрилятори, які можуть вимагати використання магніту 1,5 Т або бути протипоказаними для СМРТ. Для оцінки морфології та руху стулок і розмежування протезної та перипротезної регургітації можна використовувати різні послідовності, як описано вище (рис. 8), що доповнюють ехокардіографію.
Фазово-контрастне картування швидкості може вимірювати швидкість і потік через певний плоский зріз (Рис. 24).124 При виконанні фазового контрастування, в залежності від відсутності сигналу, що виникає при ПКС, оцінка може бути розміщена на 0,25-0,4 мм нижче за течією від ПКС. Крім того, підсилена контрастуванням тканинна характеристика легеневих кондуїтів відзначається при стенозі і корелює із запаленням і фіброзом кондуїту. Чотиривимірний потоковий КТ – це більш нова модальність, яка дозволяє комплексно досліджувати потік в серці і судинах грудної клітки у всіх трьох просторових напрямках. Ця методика дозволяє візуалізувати потік, кількісно оцінити потік і розширені гемодинамічні параметри, включаючи напругу зсуву стінки і оцінку кінетичної енергії. У ВВС 4D-потоки вивчали у пацієнтів з d-транспозицією великих артерій з артеріальним перемикачем, у яких може розвинутися нео-АР і надклапанний легеневий або аортальний стеноз в ділянці анастомозу.
Дослідження показують збільшення асиметричного потоку в передній головній ЛА, кращу візуалізацію надклапанного легеневого стенозу та асиметричне напруження стінки в дистальному відділі висхідної аорти.227 Calkoen та співавт. 228 досліджували пацієнтів з дефектом атріовентрикулярної перегородки після корекції, яка може включати хірургічне втручання на мітральному клапані, і показали здатність 4D-потоку точно кількісно оцінювати і візуалізувати ексцентричну регургітацію лівого атріовентрикулярного клапана. Ці результати можуть допомогти зрозуміти ускладнення, з якими ці пацієнти можуть зіткнутися в довгостроковій перспективі.228
Ключові моменти для оцінки протезування клапанів при ВВС
- Оцінка протезованих клапанів при ВВС може вимагати модифікації стандартних трансторакальних і черезстравохідних ехокардіографічних зображень.
- Для оцінки ПКС при ВВС необхідне розуміння різних анатомічних особливостей ВВС, каналів і гемодинаміки.
- Тривимірна ехокардіографія може надати цінну анатомічну інформацію та візуалізацію ПКС при ВВС.
- КТ і КМС надають додаткові засоби візуалізації ПКС при ВВС.
VII. ВИСНОВКИ ТА МАЙБУТНІ НАПРЯМКИ
Ехокардіографія є методом візуалізації вибору для початкової оцінки та лікування ПКС. Для оцінки структури і функції клапана, а також ступеня зворотного ремоделювання камер серця після черезшкірної або хірургічної заміни клапана необхідний комплексний підхід. Кольорова та спектральна допплерографія відіграють центральну роль в оцінці функції протезованого клапана та пов’язаних з цим ускладнень. Загалом, оцінка функції протезованих клапанів є більш складною, ніж нативних клапанів, через неоптимальну візуалізацію структури протезованого клапана та оклюдерних пристроїв за допомогою TTE та притаманну варіабельність гемодинаміки клапана та площі отвору, що спостерігається при широкому діапазоні типів та розмірів протезованих клапанів. Таким чином, документування типу і розміру встановленого клапана або кондуїту є першочерговим в оцінці протезованих клапанів. Крім того, серійне порівняння з базовим післяопераційним дослідженням має важливе значення для точної оцінки функції клапана. У пацієнтів з підозрою на дисфункцію протезованого клапана часто необхідна розширена візуалізація для визначення механізму дисфункції або тяжкості регургітації, особливо в механічних клапанах. На додаток до традиційної ролі 2D і 3D ТЕЕ в оцінці дисфункції клапанів, КТ і СМР стали потужними методами візуалізації, які доповнюють ехокардіографію.
КТ пропонує зображення з високою роздільною здатністю з особливою перевагою для механічних клапанів, в той час як основною перевагою СМРТ є кількісна оцінка вираженості регургітації. Таким чином, роль візуалізації значно розширилася з часу появи першого документа ASE щодо протезування клапанів у 2009 році. Вибір розширеного методу візуалізації, якщо він необхідний після первинної ТТЕ, повинен бути ретельно зваженим, оскільки кожен метод має свої переваги та обмеження. Цей вибір найкраще узгоджувати з клінічним станом пацієнта, типом і положенням протезованого клапана, а також підозрюваним основним станом обструкції та/або регургітації. Цілі майбутніх досліджень включатимуть покращення автоматизованої кількісної оцінки вираженості регургітації за допомогою кольорового та спектрального доплера, збільшення часової роздільної здатності КТ та СМРТ, а також зменшення артефактів від металевих конструкцій, що покращить візуалізацію клапана.
Посилання на джерела
- Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultra- sound: a report from the American Society of Echocardiography’s guide- lines and standards Committee and the Task force on prosthetic valves, developed in conjunction with the American College of Cardiology Car- diovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiog- raphy, a registered branch of the European Society of Cardiology, the Jap- anese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echo- cardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 2009;22:975-1014; quiz 1082-4.
- Lancellotti P, Pibarot P, Chambers J, et al. Recommendations for the im- aging assessment of prosthetic heart valves: a report from the European association of cardiovascular imaging endorsed by the Chinese Society of Echocardiography, the inter-American Society of Echocardiography, and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardi- ovasc Imaging 2016;17:589-90.
- Zoghbi WA, Asch FM, Bruce C, et al. Guidelines for the evaluation of valvular regurgitation after percutaneous valve repair or replacement: a report from the American society of echocardiography developed in collaboration with the society for cardiovascular angiography and inter- ventions, Japanese Society of Echocardiography, and Society for Cardio- vascular Magnetic Resonance. J Am Soc Echocardiogr 2019;32:431-75.
- Goldstone AB, Chiu P, Baiocchi M, et al. Mechanical or biologic prosthe- ses for aortic-valve and mitral-valve replacement. N Engl J Med 2017; 377:1847-57.
- Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. J Am Coll Cardiol 2021;77: e25-197.
- Alkhouli M, Alqahtani F, Simard T, et al. Predictors of use and outcomes of mechanical valve replacement in the United States (2008-2017). J Am Heart Assoc 2021;10:e019929.
- Eug`ene M, Duchnowski P, Prendergast B, et al. Contemporary manage- ment of severe symptomatic aortic stenosis. J Am Coll Cardiol 2021;78: 2131-43.
-
Halkos ME, Puskas JD. Are all bileaflet mechanical valves equal? Curr Opin Cardiol 2009;24:136-41. - Yang B, Malik A, Farhat L, et al. Influence of age on longevity of a stentless aortic valve. Ann Thorac Surg 2020;110:500-7.
- Windecker S, Okuno T, Unbehaun A, et al. Which patients with aortic ste- nosis should be referred to surgery rather than transcatheter aortic valve implantation? Eur Heart J 2022;43:2729-50.
- Hahn RT, Leipsic J, Douglas PS, et al. Comprehensive echocardiographic assessment of normal transcatheter valve function. JACC Cardiovasc Im- aging 2019;12:25-34.
- Kunadian B, Vijayalakshmi K, Thornley AR, et al. Meta-analysis of valve hemodynamics and left ventricular mass regression for stentless versus stented aortic valves. Ann Thorac Surg 2007;84:73-8.
- Varc-3 Writing C, Genereux P, Piazza N, et al. Valve academic research Consortium 3: updated Endpoint definitions for aortic valve clinical research. J Am Coll Cardiol 2021;77:2717-46.
- Butany J, Collins MJ, Nair V, et al. Morphological findings in explanted Toronto stentless porcine valves. Cardiovasc Pathol 2006;15:41-8.
- Vongpatanasin W, Hillis LD, Lange RA. Prosthetic heart valves. N Engl J Med 1996;335:407-16.
- Barbetseas J, Nagueh SF, Pitsavos C, et al. Differentiating thrombus from pannus formation in obstructed mechanical prosthetic valves: an evalua- tion of clinical, transthoracic and transesophageal echocardiographic pa- rameters. J Am Coll Cardiol 1998;32:1410-7.
- Ueda T, Teshima H, Fukunaga S, et al. Evaluation of prosthetic valve obstruction on electrocardiographically gated multidetector-row computed tomography–identification of subprosthetic pannus in the aortic position. Circ J 2013;77:418-23.
- Habib G, Hoen B, Tornos P, et al. Guidelines on the prevention, diag- nosis, and treatment of infective endocarditis (new version 2009): the Task force on the prevention, diagnosis, and treatment of infec- tive endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and In- fectious Diseases (ESCMID) and the International Society of Chemo- therapy (ISC) for infection and Cancer. Eur Heart J 2009;30: 2369-413.
- Afridi I, Apostolidou MA, Saad RM, et al. Pseudoaneurysms of the mitral- aortic intervalvular fibrosa: dynamic characterization using transesopha- geal echocardiographic and Doppler techniques. J Am Coll Cardiol 1995;25:137-45.
- Kouchoukos NT, Wareing TH, Murphy SF, et al. Sixteen-year experience with aortic root replacement. Results of 172 operations. Ann Surg 1991; 214:308-18. discussion 318-20.
- Summers MR, Leon MB, Smith CR, et al. Prosthetic valve endocarditis after TAVR and ХЗАК: insights from the PARTNER trials. Circulation 2019;140:1984-94.
- Roudaut R, Serri K, Lafitte S. Thrombosis of prosthetic heart valves: diag- nosis and therapeutic considerations. Heart 2007;93:137-42.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Bioprosthetic valve thrombosis versus structural failure: clinical and echocardiographic predictors. J Am Coll Cardiol 2015;66:2285-94.
- Salah HM, Almaddah N, Xu J, et al. Gender differences and outcomes of hypoattenuated leaflet thickening (HALT) following transcatheter aortic valve replacement: a meta-analysis of randomized and cohort studies. Curr Probl Cardiol 2022;48:101155.
- Carlson S, Habib G, Chen T, et al. Multimodality imaging for prosthetic valves evaluation: current understanding and future directions. Prog Car- diovasc Dis 2022;72:66-77.
- Lang RM, Badano LP, Tsang W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiogra- phy. J Am Soc Echocardiogr 2012;25:3-46.
- Baumgartner H, Schima H, Tulzer G, et al. Effect of stenosis geometry on the Doppler-catheter gradient relation in vitro: a manifestation of pressure recovery. J Am Coll Cardiol 1993;21: 1018-25.
- Baumgartner H, Stefenelli T, Niederberger J, et al. “Overestimation” of catheter gradients by Doppler ultrasound in patients with aortic stenosis: a predictable manifestation of pressure recovery. J Am Coll Cardiol 1999;33:1655-61.
- Chafizadeh ER, Zoghbi WA. Doppler echocardiographic assessment of the St. Jude Medical prosthetic valve in the aortic position using the con- tinuity equation. Circulation 1991;83:213-23.
- Muraru D, Cecchetto A, Cucchini U, et al. Intervendor consistency and accuracy of left ventricular volume measurements using three- dimensional echocardiography. J Am Soc Echocardiogr 2018;31: 158-68.e1.
- Kitano T, Nabeshima Y, Otsuji Y, et al. Accuracy of left ventricular vol- umes and ejection fraction measurements by contemporary three- dimensional echocardiography with Semi- and fully automated software: systematic review and meta-analysis of 1,881 Subjects. J Am Soc Echocar- diogr 2019;32:1105-15.e5.
- Hahn RT, Douglas PS, Jaber WA, et al. Doppler velocity index outcomes following surgical or transcatheter aortic valve replacement in the PART- NER trials. JACC Cardiovasc Interv 2021;14:1594-606.
- Olmos L, Salazar G, Barbetseas J, et al. Usefulness of transthoracic echo- cardiography in detecting significant prosthetic mitral valve regurgitation. Am J Cardiol 1999;83:199-205.
- Baumgartner H, Khan S, DeRobertis M, et al. Discrepancies between Doppler and catheter gradients in aortic prosthetic valves in vitro. A manifestation of localized gradients and pressure recovery. Circulation 1990;82:1467-75.
- Heinrich RS, Fontaine AA, Grimes RY, et al. Experimental analysis of fluid mechanical energy losses in aortic valve stenosis: importance of pressure recovery. Ann Biomed Eng 1996;24:685-94.
- Levine RA, Schwammenthal E. Stenosis is in the eye of the observer: impact of pressure recovery on assessing aortic valve area. J Am Coll Car- diol 2003;41:443-5.
- Herrmann HC, Pibarot P, Wu C, et al. Bioprosthetic aortic valve hemody- namics: definitions, outcomes, and evidence gaps: JACC state-of-the-art review. J Am Coll Cardiol 2022;80:527-44.
- Baumgartner H, Khan S, DeRobertis M, et al. Effect of prosthetic aortic valve design on the Doppler-catheter gradient correlation: an in vitro study of normal St. Jude, Medtronic-Hall, Starr-Edwards and Hancock valves. J Am Coll Cardiol 1992;19:324-32.
- Pibarot P, Dumesnil JG. Hemodynamic and clinical impact of prosthesis- patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol 2000;36:1131-41.
- Pibarot P, Magne J, Leipsic J, et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardi- ovasc Imaging 2019;12:149-62.
- Abbas AE, Ternacle J, Pibarot P, et al. Impact of flow on prosthesis-patient mismatch following transcatheter and surgical aortic valve replacement. Circ Cardiovasc Imaging 2021;14:e012364.
- Dumesnil JG, Honos GN, Lemieux M, et al. Validation and applications of indexed aortic prosthetic valve areas calculated by Doppler echocar- diography. J Am Coll Cardiol 1990;16:637-43.
- Schwammenthal E, Chen C, Benning F, et al. Dynamics of mitral regur- gitant flow and orifice area. Physiologic application of the proximal flow convergence method: clinical data and experimental testing. Circulation 1994;90:307-22.
- Schwammenthal E, Vered Z, Agranat O, et al. Impact of atrioventricular compliance on pulmonary artery pressure in mitral stenosis: an exercise echocardiographic study. Circulation 2000;102:2378-84.
- Zorn GL 3rd, Little SH, Tadros P, et al. Prosthesis-patient mismatch in high-risk patients with severe aortic stenosis: a randomized trial of a self-expanding prosthesis. J Thorac Cardiovasc Surg 2016;151:1014-22. 1023.e1-3.
- Pibarot P, Weissman NJ, Stewart WJ, et al. Incidence and sequelae of prosthesis-patient mismatch in transcatheter versus surgical valve replacement in high-risk patients with severe aortic stenosis: a PARTNER trial cohort–a analysis. J Am Coll Cardiol 2014;64:1323-34.
- Blais C, Dumesnil JG, Baillot R, et al. Impact of valve prosthesis-patient mismatch on short-term mortality after aortic valve replacement. Circu- lation 2003;108:983-8.
- Ruel M, Al-Faleh H, Kulik A, et al. Prosthesis-patient mismatch after aortic valve replacement predominantly affects patients with preexisting left ventricular dysfunction: effect on survival, freedom from heart fail- ure, and left ventricular mass regression. J Thorac Cardiovasc Surg 2006;131:1036-44.
- Castro LJ, Arcidi JM Jr., Fisher AL, et al. Routine enlargement of the small aortic root: a preventive strategy to minimize mismatch. Ann Thorac Surg 2002;74:31-6. discussion 36.
- Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart 2006;92:1022-9.
- Pibarot P, Dumesnil JG. Prosthesis-patient mismatch in the mitral posi- tion: old concept, new evidences. J Thorac Cardiovasc Surg 2007;133: 1405-8.
- Bitar JN, Lechin ME, Salazar G, et al. Doppler echocardiographic assess- ment with the continuity equation of St. Jude Medical mechanical pros- theses in the mitral valve position. Am J Cardiol 1995;76:287-93.
- Dumesnil JG, Honos GN, Lemieux M, et al. Validation and applications of mitral prosthetic valvular areas calculated by Doppler echocardiogra- phy. Am J Cardiol 1990;65:1443-8.
- Pibarot P, Herrmann HC, Wu C, et al. Standardized definitions for bio- prosthetic valve dysfunction following aortic or mitral valve replacement: JACC state-of-the-art review. J Am Coll Cardiol 2022;80:545-61.
- Hwang HY, Kim YH, Kim KH, et al. Patient-prosthesis mismatch after mitral valve replacement: a propensity score analysis. Ann Thorac Surg 2016;101:1796-802.
- Tomˇsiˇc A, Arabkhani B, Schoones JW, et al. Prosthesis-patient mismatch after mitral valve replacement: a pooled meta-analysis of Kaplan-Meier- derived individual patient data. J Card Surg 2020;35:3477-85.
- Ionescu A, Fraser AG, Butchart EG. Prevalence and clinical significance of incidental paraprosthetic valvar regurgitation: a prospective study using transoesophageal echocardiography. Heart 2003;89:1316-21.
- Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for nonin- vasive evaluation of native valvular regurgitation: a report from the American society of echocardiography developed in collaboration with the society for cardiovascular magnetic resonance. J Am Soc Echocar- diogr 2017;30:303-71.
- Kinno M, Raissi SR, Olson KA, et al. Three-dimensional echocardiogra- phy in the evaluation and management of paravalvular regurgitation. Echocardiography 2018;35:2056-70.
- Lancellotti P, Pellikka PA, Budts W, et al. The clinical use of stress echo- cardiography in non-ischaemic heart disease: recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr 2017;30:101-38.
- Gentry Iii JL, Phelan D, Desai MY, et al. The role of stress echocardiogra- phy in valvular heart disease: a current appraisal. Cardiology 2017;137: 137-50.
- Nicoara A, Skubas N, Ad N, et al. Guidelines for the use of transesopha- geal echocardiography to assist with surgical decision-making in the oper- ating room: a surgery-based approach: from the American society of echocardiography in collaboration with the Society of Cardiovascular Anesthesiologists and the Society of Thoracic Surgeons. J Am Soc Echo- cardiogr 2020;33:692-734.
- Little SH, Bapat V, Blanke P, et al. Imaging guidance for transcatheter mitral valve intervention on prosthetic valves, rings, and annular calcifica- tion. JACC Cardiovasc Imaging 2021;14:22-40.
- Hahn RT, Nicoara A, Kapadia S, et al. Echocardiographic imaging for transcatheter aortic valve replacement. J Am Soc Echocardiogr 2018; 31:405-33.
- Hahn RT, Kodali S, Tuzcu EM, et al. Echocardiographic imaging of pro- cedural complications during balloon-expandable transcatheter aortic valve replacement. JACC Cardiovasc Imaging 2015;8:288-318.
- Su€ndermann SH, Biaggi P, Gru€nenfelder J, et al. Safety and feasibility of novel technology fusing echocardiography and fluoroscopy images dur- ing MitraClip interventions. EuroIntervention 2014;9:1210-6.
- Hahn RT, Kodali SK. State-of-the-art intra-procedural imaging for the mitral and tricuspid PASCAL Repair System. Eur Heart J Cardiovasc Im- aging 2022;23:e94-110.
- Muraru D, Hahn RT, Soliman OI, et al. 3-Dimensional echocardiography in imaging the tricuspid valve. JACC Cardiovasc Imaging 2019;12:500-15.
- Hahn RT, Kodali S, Fam N, et al. Early multinational experience of trans- catheter tricuspid valve replacement for treating severe tricuspid regurgi- tation. JACC Cardiovasc Interv 2020;13:2482-93.
- Hahn RT, George I, Kodali SK, et al. Early single-site experience with transcatheter tricuspid valve replacement. JACC Cardiovasc Imaging 2019;12:416-29.
- Cianciulli TE, Lax JA, Beck MA, et al. Cinefluoroscopic assessment of me- chanical disc prostheses: its value as a complementary method to echo- cardiography. J Heart Valve Dis 2005;14:664-73.
- Gorlin R, Gorlin SG. Hydraulic formula for calculation of the area of the stenotic mitral valve, other cardiac valves, and central circulatory shunts. I. Am Heart J 1951;41:1-29.
- Kober G, Hilgermann R. Catheter entrapment in a Bjo€urk-Shiley pros- thesis in aortic position. Cathet Cardiovasc Diagn 1987;13:262-5.
- Burstow DJ, Nishimura RA, Bailey KR, et al. Continuous wave Doppler echocardiographic measurement of prosthetic valve gradients: a simulta- neous Doppler-catheter correlative study. Circulation 1989;80:504-14.
- Schoenfeld MH, Palacios IF, Hutter AM, et al. Underestimation of pros- thetic mitral valve areas: role of transseptal catheterization in avoiding unnecessary repeat mitral valve surgery. JAm Coll Cardiol 1985;5: 1387-92.
- Suh YJ, Im DJ, Hong YJ, et al. Absolute-delay multiphase reconstruction reduces prosthetic valve-related and atrial fibrillation-related artifacts at cardiac CT. AJR Am J Roentgenol 2017;208:W160-7.
- Kim JY, Suh YJ, Han K, et al. Diagnostic value of advanced imaging mo- dalities for the detection and differentiation of prosthetic valve obstruc- tion: a systematic review and meta-analysis. JACC Cardiovasc Imaging 2019;12:2182-92.
- Koo HJ, Lee JY, Kim GH, et al. Paravalvular leakage in patients with pros- thetic heart valves: cardiac computed tomography findings and clinical features. Eur Heart J Cardiovasc Imaging 2018;19:1419-27.
- Makkar RR, Blanke P, Leipsic J, et al. Subclinical leaflet thrombosis in transcatheter and surgical bioprosthetic valves: PARTNER 3 cardiac computed tomography substudy. J Am Coll Cardiol 2020;75:3003-15.
- Cartlidge TRG, Doris MK, Sellers SL, et al. Detection and prediction of bioprosthetic aortic valve degeneration. J Am Coll Cardiol 2019;73: 1107-19.
- Jain V, Wang TKM, Bansal A, et al. Diagnostic performance of cardiac computed tomography versus transesophageal echocardiography in infective endocarditis: a contemporary comparative meta-analysis. J Car- diovasc Comput Tomogr 2021;15:313-21.
- Edwards MB, Ordidge RJ, Hand JW, et al. Assessment of magnetic field (4.7 T) induced forces on prosthetic heart valves and annuloplasty rings. J Magn Reson Imaging 2005;22:311-7.
- Shellock FG. Prosthetic heart valves and annuloplasty rings: assessment of magnetic field interactions, heating, and artifacts at 1.5 Tesla. J Cardi- ovasc Magn Reson 2001;3:317-24.
- Shellock FG. Biomedical implants and devices: assessment of magnetic field interactions with a 3.0-Tesla МР system. J Magn Reson Imaging 2002;16:721-32.
- von Knobelsdorff-Brenkenhoff F, Rudolph A, Wassmuth R, et al. Feasi- bility of cardiovascular magnetic resonance to assess the orifice area of aortic bioprostheses. Circ Cardiovasc Imaging 2009;2:397-404. 2 p following 404.
- von Knobelsdorff-Brenkenhoff F, Rudolph A, Wassmuth R, et al. Assess- ment of mitral bioprostheses using cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2010;12:36.
- Maragiannis D, Jackson MS, Autry K, et al. Functional assessment of bio- prosthetic mitral valves by cardiovascular magnetic resonance: an in vitro validation and comparison to Doppler echocardiography. J Cardiovasc Magn Reson 2020;22:55.
- Haberka M, Malczewska M, Pysz P, et al. Cardiovascular magnetic reso- nance and transesophageal echocardiography in patients with prosthetic valve paravalvular leaks: towards an accurate quantification and stratifi- cation. J Cardiovasc Magn Reson 2021;23:31.
- Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC guidelines for the management of infective endocarditis: the Task force for the manage- ment of infective endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36:3075-128.
- Roque A, Pizzi MN, Fern´andez-Hidalgo N, et al. Morpho-metabolic post- surgical patterns of non-infected prosthetic heart valves by [18F]FDG PET/CTA: “normality” is a possible diagnosis. Eur Heart J Cardiovasc Im- aging 2020;21:24-33.
- Wahadat AR, Tanis W, Scholtens AM, et al. Normal imaging findings after aortic valve implantation on 18F-Fluorodeoxyglucose positron emission tomography with computed tomography. J Nucl Cardiol 2021;28: 2258-68.
- Hahn RT, Abraham T, Adams MS, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination: rec- ommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2013;26:921-64.
- Winter MP, Zbiral M, Kietaibl A, et al. Normal values for Doppler echo- cardiographic assessment of prosthetic valve function after transcatheter aortic valve replacement: a systematic review and meta-analysis. Eur Heart J Cardiovasc Imaging 2018;19:361-8.
- Capodanno D, Petronio AS, Prendergast B, et al. Standardized defini- tions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interventions (EAPCI) endorsed by the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2017;38:3382-90.
- Dvir D, Bourguignon T, Otto CM, et al. Standardized definition of struc- tural valve degeneration for surgical and transcatheter bioprosthetic aortic valves. Circulation 2018;137:388-99.
- Roslan AB, Naser JA, Nkomo VT, et al. Performance of echocardio- graphic algorithms for assessment of high aortic bioprosthetic valve gra- dients. J Am Soc Echocardiogr 2022;35:682-91.e2.
- Shames S, Koczo A, Hahn R, et al. Flow characteristics of the SAPIEN aortic valve: the importance of recognizing in-stent flow acceleration for the echocardiographic assessment of valve function. J Am Soc Echo- cardiogr 2012;25:603-9.
- Hahn RT, Pibarot P, Stewart WJ, et al. Comparison of transcatheter and surgical aortic valve replacement in severe aortic stenosis: a longitudinal study of echocardiography parameters in cohort A of the PARTNER trial (placement of aortic transcatheter valves). J Am Coll Cardiol 2013;61: 2514-21.
- Pibarot P, Salaun E, Dahou A, et al. Echocardiographic results of trans- catheter versus surgical aortic valve replacement in low-risk patients: the PARTNER 3 trial. Circulation 2020;141:1527-37.
- Duncan A, Moat N, Simonato M, et al. Outcomes following transcatheter aortic valve replacement for degenerative stentless versus stented bio- prostheses. JACC Cardiovasc Interv 2019;12:1256-63.
- Alnasser S, Cheema AN, Simonato M, et al. Matched comparison of self- expanding transcatheter heart valves for the treatment of failed aortic sur- gical bioprosthesis: insights from the valve-in-valve International data reg- istry (VIVID). Circ Cardiovasc Interv 2017;10:e004392.
- Bleiziffer S, Erlebach M, Simonato M, et al. Incidence, predictors and clin- ical outcomes of residual stenosis after aortic valve-in-valve. Heart 2018; 104:828-34.
- Abbas AE, Mando R, Hanzel G, et al. Invasive versus echocardiographic evaluation of transvalvular gradients immediately post-transcatheter aortic valve replacement. Circ Cardiovasc Interv 2019;12:e007973.
- Rodes-Cabau J, Abbas AE, Serra V, et al. Balloon- vs self-expanding valve systems for failed small surgical aortic valve bioprostheses. J Am Coll Car- diol 2022;80:681-93.
- Hatoum H, Hahn RT, Lilly S, et al. Differences in pressure recovery be- tween balloon expandable and self-expandable transcatheter aortic valves. Ann Biomed Eng 2020;48:860-7.
- Hatoum H, Samaee M, Sathananthan J, et al. Comparison of perfor- mance of self-expanding and balloon-expandable transcatheter aortic valves. JTCVS Open 2022;10:128-39.
- Alperi A, Robichaud M, Panagides V, et al. Impact of residual transvalv- ular gradient on clinical outcomes following valve-in-valve transcatheter aortic valve replacement. Int J Cardiol 2022;366:90-6.
- de Freitas Campos Guimaraes L, Urena M, Wijeysundera HC, et al. Long- term outcomes after transcatheter aortic valve-in-valve replacement. Circ Cardiovasc Interv 2018;11:e007038.
- Hahn RT, Webb J, Pibarot P, et al. 5-Year follow-up from the PARTNER 2 aortic valve-in-valve registry for degenerated aortic surgical bio- prostheses. JACC Cardiovasc Interv 2022;15:698-708.
- Otto CM, Kumbhani DJ, Alexander KP, et al. 2017 ACC expert consensus decision pathway for transcatheter aortic valve replacement in the management of adults with aortic stenosis: a report of the Amer- ican College of Cardiology Task force on clinical expert consensus docu- ments. J Am Coll Cardiol 2017;69:1313-46.
- Ribeiro HB, Rodes-Cabau J, Blanke P, et al. Incidence, predictors, and clin- ical outcomes of coronary obstruction following transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves: insights from the VIVID registry. Eur Heart J 2018;39:687-95.
- Blanke P, Weir-McCall JR, Achenbach S, et al. Computed tomography imaging in the context of transcatheter aortic valve implantation (ТІАК)/Transcatheter aortic valve replacement (TAVR): an expert consensus document of the society of cardiovascular computed tomog- raphy. JACC Cardiovasc Imaging 2019;12:1-24.
- Feuchtner GM, Spoeck A, Lessick J, et al. Quantification of aortic regur- gitant fraction and volume with multi-detector computed tomography comparison with echocardiography. Acad Radiol 2011;18:334-42.
- Feuchtner GM, Dichtl W, Friedrich GJ, et al. Multislice computed tomog- raphy for detection of patients with aortic valve stenosis and quantifica- tion of severity. J Am Coll Cardiol 2006;47:1410-7.
- Freeman M, Webb JG, Willson AB, et al. Multidetector CT predictors of prosthesis-patient mismatch in transcatheter aortic valve replacement. J Cardiovasc Comput Tomogr 2013;7:248-55.
- Saleeb SF, Newburger JW, Geva T, et al. Accelerated degeneration of a bovine pericardial bioprosthetic aortic valve in children and young adults. Circulation 2014;130:51-60.
- Pham N, Zaitoun H, Mohammed TL, et al. Complications of aortic valve sur- gery: manifestations at CTand MRimaging. Radiographics 2012;32:1873-92.
- Habets J, Meijer TS, Meijer RC, et al. CT attenuation measurements are valuable to discriminate pledgets used in prosthetic heart valve implanta- tion from paravalvular leakage. Br J Radiol 2012;85:e616-21.
- Feuchtner GM, Stolzmann P, Dichtl W, et al. Multislice computed tomog- raphy in infective endocarditis: comparison with transesophageal echo- cardiography and intraoperative findings. J Am Coll Cardiol 2009;53: 436-44.
- Fagman E, Perrotta S, Bech-Hanssen O, et al. ECG-gated computed to- mography: a new role for patients with suspected aortic prosthetic valve endocarditis. Eur Radiol 2012;22:2407-14.
- Gunduz S, Ozkan M, Kalcik M, et al. Sixty-four-section cardiac computed tomography in mechanical prosthetic heart valve dysfunction: thrombus or pannus. Circ Cardiovasc Imaging 2015;8:e003246.
- Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thick- ening in balloon-expandable transcatheter aortic heart valves. Eur Heart J 2016;37:2263-71.
- McMahon MA, Squirrell CA. Multidetector CT of aortic dissection: a pictorial review. Radiographics 2010;30:445-60.
- Gulsin GS, Singh A, McCann GP. Cardiovascular magnetic resonance in the evaluation of heart valve disease. BMC Med Imaging 2017;17:67.
-
von Knobelsdorff-Brenkenhoff F, Dieringer MA, Greiser A, et al. In vitro assessment of heart valve bioprostheses by cardiovascular magnetic reso- nance: four-dimensional mapping of flow patterns and orifice area planimetry. Eur J Cardiothorac Surg 2011;40:736-42. - Myerson SG. CМР in evaluating valvular heart disease: diagnosis, severity, and outcomes. JACC Cardiovasc Imaging 2021;14:2020-32.
- Leiner T, Bogaert J, Friedrich MG, et al. SCМР Position Paper (2020) on clinical indications for cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2020;22:76.
- Garcia J, Kadem L, Larose E, et al. Comparison between cardiovascular magnetic resonance and transthoracic Doppler echocardiography for the estimation of effective orifice area in aortic stenosis. J Cardiovasc Magn Reson 2011;13:25.
- Maragiannis D, Jackson MS, Flores-Arredondo JH, et al. Functional assessment of bioprosthetic aortic valves by CMR. JACC Cardiovasc Im- aging 2016;9:785-93.
- Ha H, Kvitting JP, Dyverfeldt P, et al. 4D Flow MRI quantification of blood flow patterns, turbulence and pressure drop in normal and stenotic prosthetic heart valves. Magn Reson Imaging 2019;55:118-27.
- Barone-Rochette G, Pierard S, De Meester de Ravenstein C, et al. Prog- nostic significance of LGE by CМР in aortic stenosis patients undergoing valve replacement. J Am Coll Cardiol 2014;64:144-54.
- Musa TA, Treibel TA, Vassiliou VS, et al. Myocardial scar and mortality in severe aortic stenosis. Circulation 2018;138:1935-47.
- Lee JC, Branch KR, Hamilton-Craig C, et al. Evaluation of aortic regurgi- tation with cardiac magnetic resonance imaging: a systematic review. Heart 2018;104:103-10.
- Bolen MA, Popovic ZB, Rajiah P, et al. Cardiac МР assessment of aortic regurgitation: holodiastolic flow reversal in the descending aorta helps stratify severity. Radiology 2011;260:98-104.
- Kammerlander AA, Wiesinger M, Duca F, et al. Diagnostic and prog- nostic utility of cardiac magnetic resonance imaging in aortic regurgita- tion. JACC Cardiovasc Imaging 2019;12:1474-83.
- Papanastasiou CA, Kokkinidis DG, Jonnalagadda AK, et al. Meta-analysis of transthoracic echocardiography versus cardiac magnetic resonance for the assessment of aortic regurgitation after transcatheter aortic valve im- plantation. Am J Cardiol 2019;124:1246-51.
- Krim SR, Vivo RP, Patel A, et al. Direct assessment of normal mechanical mitral valve orifice area by real-time 3D echocardiography. JACC Cardi- ovasc Imaging 2012;5:478-83.
- Whisenant B, Kapadia SR, Eleid MF, et al. One-year outcomes of mitral valve-in-valve using the SAPIEN 3 transcatheter heart valve. JAMA Car- diol 2020;5:1245-52.
- Guerrero M, Vemulapalli S, Xiang Q, et al. Thirty-day outcomes of trans- catheter mitral valve replacement for degenerated mitral bioprostheses (Valve-in-Valve), failed surgical rings (Valve-in-Ring), and native valve with severe mitral annular calcification (Valve-in-Mitral annular calcifica- tion) in the United States: data from the Society of Thoracic Surgeons/ American College of Cardiology/Transcatheter Valve Therapy Registry. Circ Cardiovasc Interv 2020;13:e008425.
- Eleid MF, Cabalka AK, Williams MR, et al. Percutaneous Transvenous transseptal transcatheter valve implantation in failed bioprosthetic mitral valves, ring annuloplasty, and severe mitral annular calcification. JACC Cardiovasc Interv 2016;9:1161-74.
- Muller DWM, Sorajja P, Duncan A, et al. 2-Year outcomes of transcath- eter mitral valve replacement in patients with severe symptomatic mitral regurgitation. J Am Coll Cardiol 2021;78:1847-59.
- Fernandes V, Olmos L, Nagueh SF, et al. Peak early diastolic velocity rather than pressure half-time is the best index of mechanical prosthetic mitral valve function. Am J Cardiol 2002;89:704-10.
- Spencer RJ, Gin KG, Tsang MY, et al. Doppler parameters derived from transthoracic echocardiography accurately detect bioprosthetic mitral valve dysfunction. J Am Soc Echocardiogr 2017;30:966-73.e1.
- Chang S, Suh YJ, Han K, et al. The clinical significance of perivalvular pan- nus in prosthetic mitral valves: can cardiac CT be helpful? Int J Cardiol 2017;249:344-8.
- Tsubota H, Sakaguchi G, Arakaki R, et al. Impact of prosthesis-patient mismatch after mitral valve replacement: a propensity score analysis. Semin Thorac Cardiovasc Surg 2021;33:347-53.
- Cohen GI, Davison MB, Klein AL, et al. A comparison of flow conver- gence with other transthoracic echocardiographic indexes of prosthetic mitral regurgitation. J Am Soc Echocardiogr 1992;5:620-7.
- Konen E, Goitein O, Feinberg MS, et al. The role of ECG-gated MDCT in the evaluation of aortic and mitral mechanical valves: initial experience. AJR Am J Roentgenol 2008;191:26-31.
- Symersky P, Budde RP, de Mol BA, et al. Comparison of multidetector- row computed tomography to echocardiography and fluoroscopy for evaluation of patients with mechanical prosthetic valve obstruction. Am J Cardiol 2009;104:1128-34.
- LaBounty TM, Agarwal PP, Chughtai A, et al. Evaluation of mechanical heart valve size and function with ECG-gated 64-MDCT. AJR Am J Roentgenol 2009;193:W389-96.
- Grunenfelder J, Plass A, Alkadhi H, et al. Evaluation of biological aortic valve prostheses by dual source computer tomography and anatomic measurements for potential transapical valve-in-valve procedure. Interact Cardiovasc Thorac Surg 2008;7:195-9. discussion 199-200.
- Chenot F, Montant P, Goffinet C, et al. Evaluation of anatomic valve opening and leaflet morphology in aortic valve bioprosthesis by using multidetector CT: comparison with transthoracic echocardiography. Radiology 2010;255:377-85.
- LaBounty TM, Agarwal PP, Chughtai A, et al. Hemodynamic and func- tional assessment of mechanical aortic valves using combined echocardi- ography and multidetector computed tomography. J Cardiovasc Comput Tomogr 2009;3:161-7.
- Habets J, Symersky P, Leiner T, et al. Artifact reduction strategies for pros- thetic heart valve CT imaging. Int J Cardiovasc Imaging 2012;28: 2099-108.
- Suh YJ, Hong GR, Han K, et al. Assessment of mitral paravalvular leakage after mitral valve replacement using cardiac computed tomography: comparison with surgical findings. Circ Cardiovasc Imaging 2016; 9:e004153.
- Simprini LA, Afroz A, Cooper MA, et al. Routine cine-CМР for prosthesis-associated mitral regurgitation: a multicenter comparison to echocardiography. J Heart Valve Dis 2014;23:575-82.
- Emani SM. Options for prosthetic pulmonary valve replacement. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2012;15:34-7.
- Bonhoeffer P, Boudjemline Y, Saliba Z, et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet 2000;356:1403-5.
- Ribeiro JM, Teixeira R, Lopes J, et al. Transcatheter versus surgical pulmo- nary valve replacement: a systemic review and meta-analysis. Ann Thorac Surg 2020;110:1751-61.
- Egbe AC, Vallabhajosyula S, Connolly HM. Trends and outcomes of pul- monary valve replacement in tetralogy of Fallot. Int J Cardiol 2020;299: 136-9.
- O’Byrne ML, Glatz AC, Mercer-Rosa L, et al. Trends in pulmonary valve replacement in children and adults with tetralogy of fallot. Am J Cardiol 2015;115:118-24.
- Caldarone CA, McCrindle BW, Van Arsdell GS, et al. Independent fac- tors associated with longevity of prosthetic pulmonary valves and valved conduits. J Thorac Cardiovasc Surg 2000;120:1022-30. discussion 1031.
- Miranda WR, Connolly HM, Bonnichsen CR, et al. Prosthetic pulmonary valve and pulmonary conduit endocarditis: clinical, microbiological and echocardiographic features in adults. Eur Heart J Cardiovasc Imaging 2016;17:936-43.
- Sadeghpour A, Saadatifar H, Kiavar M, et al. Doppler echocardiographic assessment of pulmonary prostheses: a comprehensive assessment including velocity time integral ratio and prosthesis effective orifice area. Congenit Heart Dis 2008;3:415-21.
- Puchalski MD, Lui GK, Miller-Hance WC, et al. Guidelines for perform- ing a comprehensive transesophageal echocardiographic: examination in children and all patients with congenital heart disease: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2019;32:173-215.
- Ahmed MI, Escanuela MG, Crosland WA, et al. Utility of live/real time three-dimensional transesophageal echocardiography in the assessment and percutaneous intervention of bioprosthetic pulmonary valve steno- sis. Echocardiography 2014;31:531-3.
- Ostergaard L, Vejlstrup N, Kober L, et al. Diagnostic potential of intracar- diac echocardiography in patients with suspected prosthetic valve endo- carditis. J Am Soc Echocardiogr 2019;32:1558-64.e3.
- Bouajila S, Chalard A, Dauphin C. Usefulness of intracardiac echocardi- ography for the diagnosis of infective endocarditis following percuta- neous pulmonary valve replacement. Cardiol Young 2017;27:1406-9.
- Sucha D, Symersky P, Tanis W, et al. Multimodality imaging assessment of prosthetic heart valves. Circ Cardiovasc Imaging 2015;8:e003703.
- Nayak KS, Nielsen JF, Bernstein MA, et al. Cardiovascular magnetic reso- nance phase contrast imaging. J Cardiovasc Magn Reson 2015;17:71.
- Valente AM, Cook S, Festa P, et al. Multimodality imaging guidelines for patients with repaired tetralogy of fallot: a report from the American So- ciety of Echocardiography: developed in collaboration with the Society for Cardiovascular Magnetic Resonance and the Society for Pediatric Radiology. J Am Soc Echocardiogr 2014;27:111-41.
- Chung R, Taylor AM. Imaging for preintervention planning: transcatheter pulmonary valve therapy. Circ Cardiovasc Imaging 2014;7:182-9.
- Han BK, Moga FX, Overman D, et al. Diagnostic value of contrast- enhanced multiphase computed tomography for assessment of percu- taneous pulmonary valve obstruction. Ann Thorac Surg 2016;101: e115-6.
- Curran L, Agrawal H, Kallianos K, et al. Computed tomography guided sizing for transcatheter pulmonary valve replacement. Int J Cardiol Heart Vasc 2020;29:100523.
- Dellas C, Kammerer L, Gravenhorst V, et al. Quantification of pulmo- nary regurgitation and prediction of pulmonary valve replacement by echocardiography in patients with congenital heart defects in comparison to cardiac magnetic resonance imaging. Int J Cardiovasc Imaging 2018; 34:607-13.
- Lotz J, Sohns JM. [Imaging technique and current status of valvular heart disease using cardiac MRI]. Radiologe 2013;53:872-9.
- Mercer-Rosa L, Yang W, Kutty S, et al. Quantifying pulmonary regurgita- tion and right ventricular function in surgically repaired tetralogy of Fal- lot: a comparative analysis of echocardiography and magnetic resonance imaging. Circ Cardiovasc Imaging 2012;5:637-43.
- Wang N, Fulcher J, Abeysuriya N, et al. Tricuspid regurgitation is associ- ated with increased mortality independent of pulmonary pressures and right heart failure: a systematic review and meta-analysis. Eur Heart J 2019;40:476-84.
- Benfari G, Antoine C, Miller WL, et al. Excess mortality associated with functional tricuspid regurgitation complicating heart failure with reduced ejection fraction. Circulation 2019;140:196-206.
- Kilic A, Saha-Chaudhuri P, Rankin JS, et al. Trends and outcomes of tricuspid valve surgery in North America: an analysis of more than 50,000 patients from the Society of Thoracic Surgeons database. Ann Thorac Surg 2013;96:1546-52. discussion 1552.
- Zack CJ, Fender EA, Chandrashekar P, et al. National trends and out- comes in isolated tricuspid valve surgery. J Am Coll Cardiol 2017;70: 2953-60.
- Negm S, Arafat AA, Elatafy EE, et al. Mechanical versus bioprosthetic valve replacement in the tricuspid valve position: a systematic review and meta-analysis. Heart Lung Circ 2021;30:362-71.
- Rizzoli G, Vendramin I, Nesseris G, et al. Biological or mechanical pros- theses in tricuspid position? A meta-analysis of intra-institutional results. Ann Thorac Surg 2004;77:1607-14.
- Godart F, Baruteau AE, Petit J, et al. Transcatheter tricuspid valve implan- tation: a multicentre French study. Arch Cardiovasc Dis 2014;107:583-91.
- Taramasso M, Gavazzoni M, Pozzoli A, et al. Tricuspid regurgitation: pre- dicting the need for intervention, procedural success, and recurrence of disease. JACC Cardiovasc Imaging 2019;12:605-21.
- Aboulhosn J, Cabalka AK, Levi DS, et al. Transcatheter valve-in-ring im- plantation for the treatment of residual or recurrent tricuspid valve dysfunction after prior surgical repair. JACC Cardiovasc Interv 2017; 10:53-63.
- Dreyfus J, Flagiello M, Bazire B, et al. Isolated tricuspid valve surgery: impact of aetiology and clinical presentation on outcomes. Eur Heart J 2020;41:4304-17.
- Rahgozar K, Ho E, Goldberg Y, et al. Transcatheter tricuspid valve repair and replacement: a landscape review of current techniques and devices for the treatment of tricuspid valve regurgitation. Expert Rev Cardiovasc Ther 2021;19:399-411.
- Sanon S, Cabalka AK, Babaliaros V, et al. Transcatheter tricuspid valve-in- valve and valve-in-ring implantation for degenerated surgical prosthesis. JACC Cardiovasc Interv 2019;12:1403-12.
- Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American society of echocardiography. J Am Soc Echocardiogr 2019;32:1-64.
- Yuan L, Cao T, Duan Y, et al. Noninvasive assessment of influence of resistant respiration on blood flow velocities across the cardiac valves in humans–a quantification study by echocardiography. Echocardiogra- phy 2004;21:391-8.
- Connolly HM, Miller FA Jr., Taylor CL, et al. Doppler hemodynamic pro- files of 82 clinically and echocardiographically normal tricuspid valve prostheses. Circulation 1993;88:2722-7.
- Blauwet LA, Danielson GK, Burkhart HM, et al. Comprehensive echo- cardiographic assessment of the hemodynamic parameters of 285 tricuspid valve bioprostheses early after implantation. J Am Soc Echocar- diogr 2010;23:1045-59. 1059.e1-2.
- Hahn R, Saric M, Faletra FF, et al. Recommended standards for the per- formance of transesophageal echocardiographic screening for structural heart intervention: from the American society of echocardiography. J Am Soc Echocardiogr 2022;35:1-76. Erratum in: J Am Soc Echocardiogr. 2022 Apr;35(4):447.
- Hahn RT. State-of-the-Art review of echocardiographic imaging in the evaluation and treatment of functional tricuspid regurgitation. Circ Car- diovasc Imaging 2016;9:e005332.
- Badano LP, Agricola E, Perez de Isla L, et al. Evaluation of the tricuspid valve morphology and function by transthoracic real-time three-dimen- sional echocardiography. Eur J Echocardiogr 2009;10:477-84.
- Hahn RT. Transcathether valve replacement and valve repair: review of procedures and intraprocedural echocardiographic imaging. Circ Res 2016;119:341-56.
- Garatti A, Nano G, Bruschi G, et al. Twenty-five year outcomes of tricuspid valve replacement comparing mechanical and biologic prosthe- ses. Ann Thorac Surg 2012;93:1146-53.
- Ratnatunga CP, Edwards MB, Dore CJ, et al. Tricuspid valve replace- ment: UK Heart Valve Registry mid-term results comparing mechanical and biological prostheses. Ann Thorac Surg 1998;66:1940-7.
- Burri M, Vogt MO, Horer J, et al. Durability of bioprostheses for the tricuspid valve in patients with congenital heart disease. Eur J Cardio- thorac Surg 2016;50:988-93.
- Nakano K, Koyanagi H, Hashimoto A, et al. Tricuspid valve replacement with the bileaflet St. Jude Medical valve prosthesis. J Thorac Cardiovasc Surg 1994;108:888-92.
- Peterffy A, Szentkiralyi I. Mechanical valves in tricuspid position: cause of thrombosis and prevention. Eur J Cardiothorac Surg 2001;19:735-6.
- Blauwet LA, Burkhart HM, Dearani JA, et al. Comprehensive echocar- diographic assessment of mechanical tricuspid valve prostheses based on early post-implantation echocardiographic studies. J Am Soc Echocar- diogr 2011;24:414-24.
- McElhinney DB, Aboulhosn JA, Dvir D, et al. Mid-term valve-related out- comes after transcatheter tricuspid valve-in-valve or valve-in-ring replacement. J Am Coll Cardiol 2019;73:148-57.
- Kobayashi Y, Nagata S, Ohmori F, et al. Serial Doppler echocardio- graphic evaluation of bioprosthetic valves in the tricuspid position. J Am Coll Cardiol 1996;27:1693-7.
- Maragiannis D, Aggeli C, Nagueh SF. Echocardiographic evaluation of tricuspid prosthetic valves: an update. Hellenic J Cardiol 2016;57: 145-51.
- Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Soci- ety of Echocardiography endorsed by the European Association of Echo- cardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010;23:685-713. quiz 786-8.
- van Slooten YJ, Freling HG, van Melle JP, et al. Long-term tricuspid valve prosthesis-related complications in patients with congenital heart disease. Eur J Cardiothorac Surg 2014;45:83-9.
- Han BK, Rigsby CK, Leipsic J, et al. Computed tomography imaging in patients with congenital heart disease, Part 2: technical recommenda- tions. An expert consensus document of the Society of Cardiovascular Computed Tomography (SCCT): endorsed by the Society of Pediatric Radiology (SPR) and the North American Society of Cardiac Imaging (NASCI). J Cardiovasc Comput Tomogr 2015;9:493-513.
- Saremi F, Grizzard JD, Kim RJ. Optimizing cardiac МР imaging: practical remedies for artifacts. Radiographics 2008;28:1161-87.
- Hahn RT, Thomas JD, Khalique OK, et al. Imaging assessment of tricuspid regurgitation severity. JACC Cardiovasc Imaging 2019;12: 469-90.
- Dahou A, Ong G, Hamid N, et al. Quantifying tricuspid regurgitation severity: a comparison of proximal isovelocity surface area and novel quantitative Doppler methods. JACC Cardiovasc Imaging 2019;12: 560-2.
- Hahn RT, Meduri CU, Davidson CJ, et al. Early feasibility study of a trans- catheter tricuspid valve annuloplasty: SCOUT trial 30-day results. J Am Coll Cardiol 2017;69:1795-806.
- Utsunomiya H, Harada Y, Susawa H, et al. Comprehensive evaluation of tricuspid regurgitation location and severity using vena contracta analysis: a color Doppler three-dimensional transesophageal echocardiographic study. J Am Soc Echocardiogr 2019;32:1526-37.e2.
- Zhan Y, Senapati A, Vejpongsa P, et al. Comparison of echocardiographic assessment of tricuspid regurgitation against cardiovascular magnetic resonance. JACC Cardiovasc Imaging 2020;13:1461-71.
- Zhan Y, Debs D, Khan MA, et al. Natural history of functional tricuspid regurgitation quantified by cardiovascular magnetic resonance. J Am Coll Cardiol 2020;76:1291-301.
- Pulerwitz TC, Khalique OK, Leb J, et al. Optimizing cardiac CT protocols for comprehensive acquisition prior to percutaneous MV and ТК repair/ replacement. JACC Cardiovasc Imaging 2020;13:836-50.
- Stout KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC guideline for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task force on clinical practice guidelines. Circulation 2019;139:e698-800.
- Choi PS, Sleeper LA, Lu M, et al. Revisiting prosthesis choice in mitral valve replacement in children: Durable alternatives to traditional bio- prostheses. J Thorac Cardiovasc Surg 2021;61:213-25.
- Ibezim C, Sarvestani AL, Knight JH, et al. Outcomes of mechanical mitral valve replacement in children. Ann Thorac Surg 2019;107:143-50.
- Li W, West C, McGhie J, et al. Consensus recommendations for echocar- diography in adults with congenital heart defects from the International Society of Adult Congenital Heart Disease (ISAВВС). Int J Cardiol 2018;272:77-83.
- Cohen MS, Eidem BW, Cetta F, et al. Multimodality imaging guidelines of patients with transposition of the great arteries: a report from the American Society of Echocardiography developed in collaboration with the Society for Cardiovascular Magnetic Resonance and the Society of Cardiovascular Computed Tomography. J Am Soc Echocardiogr 2016;29:571-621.
- Hasan BS, Lunze FI, Chen MH, et al. Effects of transcatheter pulmonary valve replacement on the hemodynamic and ventricular response to ex- ercise in patients with obstructed right ventricle-to-pulmonary artery conduits. JACC Cardiovasc Interv 2014;7:530-42.
- Hasan BS, Lunze FI, McElhinney DB, et al. Exercise stress echocardio- graphic assessment of outflow tract and ventricular function in patients with an obstructed right ventricular-to-pulmonary artery conduit after repair of conotruncal heart defects. Am J Cardiol 2012;110:1527-33.
- Simpson J, Lopez L, Acar P, et al. Three-dimensional echocardiography in congenital heart disease: an expert consensus document from the Eu- ropean association of cardiovascular imaging and the American society of echocardiography. J Am Soc Echocardiogr 2017;30:1-27.
- Fratz S, Chung T, Greil GF, et al. Guidelines and protocols for cardiovas- cular magnetic resonance in children and adults with congenital heart disease: SCМР expert consensus group on congenital heart disease. J Cardiovasc Magn Reson 2013;15:51.
- Freling HG, van Slooten YJ, van Melle JP, et al. Prosthetic valves in adult patients with congenital heart disease: rationale and design of the Dutch PROSTAVA study. Neth Heart J 2012;20:419-24.
- Rizk J. 4D flow MRI applications in congenital heart disease. Eur Radiol 2021;31:1160-74.
- Calkoen EE, Westenberg JJ, Kroft LJ, et al. Characterization and quantifi- cation of dynamic eccentric regurgitation of the left atrioventricular valve after atrioventricular septal defect correction with 4D Flow cardiovascu-lar magnetic resonance and retrospective valve tracking. J Cardiovasc Magn Reson 2015;17:18.
- Duncan A, Davies S, Di Mario C, et al. Valve-in-valve transcatheter aortic valve implantation for failing surgical aortic stentless bioprosthetic valves: a single-center experience. J Thorac Cardiovasc Surg 2015;150:91-8.
- Webb JG, Murdoch DJ, Alu MC, et al. 3-Year outcomes after valve-in-valve transcatheter aortic valve replacement for degenerated bioprostheses: the PARTNER 2 registry. J Am Coll Cardiol 2019;73:2647-55.
- Rajani R, Mukherjee D, Chambers JB. Doppler echocardiography in nor- mally functioning replacement aortic valves: a review of 129 studies. J Heart Valve Dis 2007;16:519-35.
- Rosenhek R, Binder T, Maurer G, et al. Normal values for Doppler echo- cardiographic assessment of heart valve prostheses. J Am Soc Echocar- diogr 2003;16:1116-27.
- Egbe AC, Connolly HM, Miranda WR, et al. Outcomes of bioprosthetic valves in the pulmonary position in adults with congenital heart disease. Ann Thorac Surg 2019;108:1410-5.
- Jalal Z, Valdeolmillos E, Malekzadeh-Milani S, et al. Mid-term outcomes following percutaneous pulmonary valve implantation using the “Folded Melody valve” technique. Circ Cardiovasc Interv 2021;14:e009707.
- Shojaeifard M, Daryanavard A, Karimi Behnagh A, et al. Assessment of normal hemodynamic profile of mechanical pulmonary prosthesis by Doppler echocardiography: a prospective cross-sectional study. Cardio- vasc Ultrasound 2020;18:14.