Резюме
Передумови
Неінвазивне пренатальне тестування (НІПТ) з використанням безклітинної ДНК широко застосовується для пренатального скринінгу з метою виявлення поширених анеуплоїдій плода (таких як трисомія 21, 18 і 13). У попередніх дослідженнях було показано, що НІПТ є високочутливим і специфічним методом, але трапляються хибнопозитивні (ХП) і хибнонегативні (ХН) результати. Хоча поширеність хибнопозитивних результатів НІПТ при синдромі Дауна є рідкісною, вплив на сім’ї та суспільство є значним.
Подання справи
У цій статті описано два випадки плодів, які отримали “негативний” результат на трисомію 21 за технологією НІПТ з використанням напівпровідникової платформи секвенування. Однак каріотипи амніотичної рідини плодів були 46,XY, + 21 der(21;21)(q10;q10) і 47,XY, + 21 каріотип відповідно. Біопсії плаценти підтвердили, що в першому випадку коефіцієнт химерності хромосоми 21 плаценти коливався від 13 до 88% з каріотипом 46,XX, + 21,der(21;21)(q10;q10)[86]/46,XX[14] клітин хоріона плаценти (середина плацентарної тканини з боку плода). Однак у другому випадку серед усіх біоптатів плаценти відсоток загального химеризму становив менше 30%; а біоптати плаценти, взяті в середині материнської частини і в середині плодової частини, також мали різний рівень мозаїчності трисомії 2 – 10% і 8% відповідно. Зрештою, вагітності були перервані на 30-му та 27-му термінах гестації відповідно.
Висновки
У цьому дослідженні ми представляємо два випадки результатів ХН НІПТ, які могли бути спричинені біологічними механізмами, а не низькою якістю, технічними помилками чи недбалістю. Клінічні генетики та їхні пацієнти повинні розуміти, що НІПТ – це скринінгова процедура.
Передумови
Трисомія 21 (Т21, також відома як синдром Дауна) є однією з найпоширеніших хромосомних аномалій у світі, що зустрічається приблизно на 1:700 живонароджених [1]. Неінвазивне пренатальне тестування (НІПТ) швидко змінило світовий ландшафт пренатального скринінгу поширених хромосомних анеуплоїдій плода завдяки своїй високій чутливості та специфічності [2, 3]. НІПТ оцінює фракцію безклітинної ембріональної ДНК плода (бкеДНК), що циркулює в материнській крові, яка може бути виявлена на терміні вагітності вже в 9 тижнів [4]. НІПТ застосовується для скринінгу пацієнток з високим ризиком анеуплоїдії плода в рамках антенатального спостереження і все частіше використовується в клінічній практиці.
Порівняно з іншими методами скринінгу, НІПТ має неперевершену чутливість та специфічність для виявлення трисомії 21 [5, 6]. Понад 99% випадків можна виявити за допомогою НІПТ, а частота хибнопозитивних результатів становить менше 0,1% [7]. БкеДНК у материнській плазмі походить з апоптичних цитотрофобластів [8]; таким чином, у більшості вагітностей генетичні компоненти плаценти та тканин плода є ідентичними. Однак через обмежений плацентарний мозаїцизм результати НІПТ не завжди можуть бути репрезентативними для істинного каріотипу плода, і можуть траплятися як хибнонегативні (ХН), так і ХП результати [9,10,11,12]. Плацентарний мозаїцизм [10], хромосомні перебудови плода, зникнення двійні або близнюків [13], сімейні хромосомні аномалії та злоякісні новоутворення є поширеними причинами ХП результатів НІПТ [14].
На противагу цьому, серед багатьох проаналізованих клінічних спостережень результати НІПТ ХН, пов’язані з анеуплоїдією плода, зустрічалися рідко [15, 16]. Наявність низького вмісту бкеДНК і плацентарного мозаїцизму асоціюється з деякими результатами ХН, тоді як інші залишаються нез’ясованими [17]. Вплив вищезазначених факторів на результати НІПТ ХН залишається незрозумілим. Зокрема, існує висока ймовірність того, що ХН клінічно неправильно діагностуються, і причини результатів НІПТ ХН повинні бути досліджені. Клінічні генетики повинні розпізнавати такі результати ХН, а пацієнти повинні бути поінформовані про розбіжності між результатами НІПТ та наступними цитогенетичними аналізами.
У цьому дослідженні повідомляється про два випадки Т21 плода, пов’язані з плацентарним мозаїцизмом, які призвели до одного ХН НІПТ результату.
Подання справи
Випадок 1
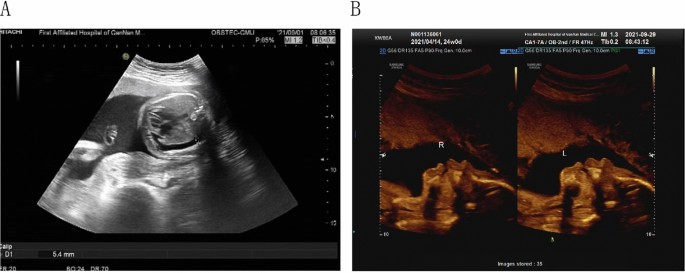
23-річну здорову жінку з первинною вагітністю з одним плодом направили до Першої афілійованої лікарні при Медичному університеті Ганнана. Серологічний скринінг у 12 тижнів у поєднанні з вимірюванням прозорості шийки матки (2,1 мм) показав критичний ризик Т21 плода 1 на 529. НІПТ-обстеження в іншій лікарні дало негативний результат у 15 тижнів (фракція ДНК плода: 15,67%, показник хромосоми 21 Z: – 0,201; Табл. 1). Однак пацієнтку скерували до нашої лікарні на 27GA на рутинне УЗД, яке показало, що у плода спостерігається правобічний плевральний випіт (Зобр. 1А). Згодом вагітну направили в лікарню міста Гуанчжоу для подальшого обстеження. Ультразвукове сканування показало двосторонній плевральний випіт та дисплазію носа на рівні 28GA. У 29 тижнів за допомогою кількісної флуоресцентної полімеразної ланцюгової реакції (QF-PCR) та хромосомного мікрочипового аналізу (ХМА) шляхом кордоцентезу була виявлена трисомія 21 у плода. Пацієнтку перевели назад до нашої лікарні, де після генетичного консультування та спілкування з членами сім’ї провели плановий кесарів розтин у терміні 30 тижнів. Після отримання згоди від пацієнтки ми отримали амніотичну рідину, периферичну кров матері, шість біоптатів плаценти (три з боку плода і три з боку матері), а також тканину пуповини при перериванні вагітності і детально дослідили ці зразки, щоб зрозуміти біологічне підґрунтя невідповідності.
Таблиця 1 Результати НІПТ для випадків 1 і 2
| Пацієнт | Тижні вагітності | Унікальні читання/М | Частка ембріональної ДНК (%) | Z-показники НІПТ | Результати НІПТ | ||
| 13 хромосома | 18 хромосома | 21 хромосома | |||||
| Випадок 1 | 15a | 3.79 | 15.67 | − 0.001 | 0.906 | − 0.201 | Низький ризик |
| 15b | 8.54 | 14.89 | − 0.432 | − 0.01 | 0.951 | Низький ризик | |
| 29c | 5.62 | 20.30 | 0.52 | 0.249 | 1.219 | Низький ризик | |
| 15d | 9.86 | 20.10 | − 1.22 | 0.93 | 0.566 | Низький ризик | |
| 29e | 9.85 | 17.90 | 0.606 | − 0.731 | 3.414 | Критичний ризик Т21 | |
| Випадок 2 | 17 | 3.90 | 19.70 | 1.527 | 0.466 | 0.932 | Низький ризик |
- Жирним шрифтом позначено результат НІПТ з високим ризиком
- Показники Z розраховували, як описано раніше [18], з нормальним діапазоном > – 3 та < 3
- a Клініко-лабораторні дані при першому обстеженні
- b Клінічні лабораторні дані при повторному обстеженні
- c Клініко-лабораторні дані перед стимуляцією пологів
- d Дані третьої сторони при першому обстеженні
- e Дані третьої сторони перед стимуляцією пологів
Зобр. 1
Зображення ультразвукового дослідження. A Результат УЗД на 27 тижнів. B Результат УЗД на 22 тижні
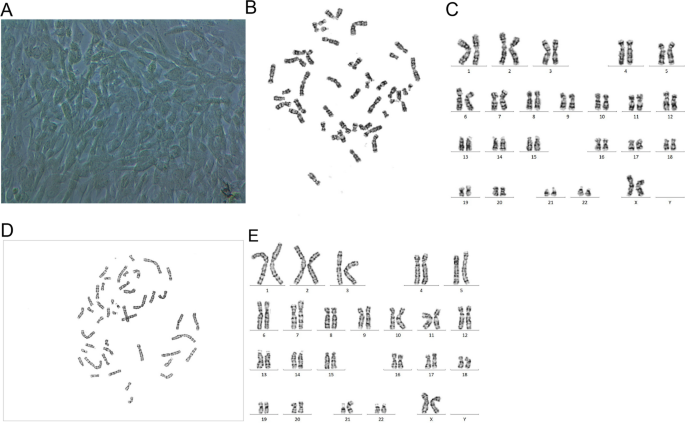
Як показано в Таблиці 1, серед п’яти НІПТ-тестів, проведених у різних лабораторіях, не було виявлено позитивних Z-рахунків для хромосоми 21. Хоча за даними третіх осіб перед індукцією пологів цей показник був більшим за 3 (Табл. 1), концентрація в організмі плода на той час була дуже високою. Мозаїчність плаценти може пояснити хибнонегативний результат НІПТ, а в процесі клінічного виявлення НІПТ не було виявлено жодних очевидних проблем. Крім того, варіація кількості копій за допомогою аналізу секвенування наступного покоління (CNV-seq) показала, що ступінь мозаїчності трисомії 21 сильно варіював між різними ділянками плацентарної тканини; зокрема, частка мозаїчності трисомії 21 в плацентарній тканині з боку матері становила менше 30% (Табл. 2). Крім того, цитогенетичний аналіз клітин хоріона плаценти (середина плацентарної тканини з боку плода) продемонстрував каріотип mos 46,XX, + 21,der(21;21)(q10;q10)[86]/46,XX[14], що вказує на те, що 86% клітин мали трисомію 21 (Зобр. 2), що узгоджується з результатами CNV-seq аналізу плацентарної тканини з середини з боку плода. Однак цитогенетичний аналіз амніотичної рідини показав каріотип 46,XX, + 21,der(21;21)(q10;q10) без мозаїчності, а обидва батьки мали нормальні каріотипи (Зобр. 3).
Таблиця 2 Результати аналізу CNV-seq
| Пацієнт | Номер експерименту | Обʼєкт досліду | Тип зразку | Результати CNV-seq | Каріотип | ||
| Показники Z у хромосоми 2 | Показники Z у хромосоми 21 | Припущення про химерну частку Т21 | |||||
| Випадок 1 | 1 | Сам пацієнт | Периферична кров | − 1.287 | − 1.545 | 46,XX | 46,XX |
| 2 | Центр з материнського боку | Плацентарна тканина | − 0.224 | 26.864 | 47,XX, + 21[28%] | – | |
| 3 | Середина з материнського боку | Плацентарна тканина | 0.275 | 16.952 | 47,XX, + 21[18%] | – | |
| 4 | Край з материнського боку | Плацентарна тканина | − 1.128 | 20.968 | 47,XX, + 21[22%] | – | |
| 5 | Центр з плодового боку | Плацентарна тканина | − 0.412 | − 1.901 | 46,XX | – | |
| 6 | Середина з плодового боку | Плацентарна тканина | 1.302 | 83.744 | 47,XX, + 21[88%] | 46,XX, + 21,der(21;21)(q10;q10) [86]/46,XX[14] | |
| 7 | Край з плодового боку | Плацентарна тканина | − 0.106 | 12.236 | 47,XX, + 21[13%] | – | |
| 8 | Корінь пуповини | Пуповинна тканина | 0.355 | 88.798 | 47,XX, + 21[93%] | – | |
| 9 | Амніотична рідина | Амніотична рідина | – | – | – | 46,XX, + 21,der(21;21)(q10;q10) | |
| Випадок 2 | 1 | Центр з материнського боку | Плацентарна тканина | − 1.731 | 28.879 | 47,XY, + 21[30%] | – |
| 2 | Середина з материнського боку | Плацентарна тканина | 19.806 | 16.314 | 47,XY, + 21[17%]/47,XY, + 2[10%] | – | |
| 3 | Край з материнського боку | Плацентарна тканина | − 0.576 | 20.569 | 47,XY, + 21[21%] | – | |
| 4 | Центр з плодового боку | Плацентарна тканина | 5.93 | 17.806 | 47,XY, + 21[19%] | – | |
| 5 | Середина з плодового боку | Плацентарна тканина | 15.118 | 19.83 | 47,XY, + 21[21%]/47,XY, + 2[8%] | – | |
| 6 | Край з плодового боку | Плацентарна тканина | 3.818 | 17.52 | 47,XY, + 21[18%] | – | |
| 7 | Корінь пуповини | Пуповинна тканина | 0.805 | 91.624 | 47,XY, + 21[96%] | – | |
| 8 | Амніотична рідина | Амніотична рідина | – | – | – | 47,XY, + 21 | |
Зобр. 2
Морфологія клітин хоріона плаценти та G-смугових каріотипів. A Морфологія клітин хоріона плаценти, культивованих на 21 добу (× 40). B–E G-смугові каріотипи хоріонічних клітин плаценти
Зобр. 3
Каріотипи G-смуги плода та його батька. A і B Плід: 46,XX, + 21,der(21;21)(q10;q10); C і D Мати: 46,XX; E і F Батько: 46,XY
Випадок 2
35-річна вагітна мати двох здорових дітей пройшла НІПТ-тест 17GA, який показав нормальний результат (Табл. 1). Ультразвукове дослідження на 22GA виявило дисплазію кісток носа плода (Зобр. 1B). Після консультування пара пройшла тестування плоду за допомогою амніоцентезу в терміні 25 тижнів, яке показало каріотип плоду Т21 47,XY, + 21. Крім того, результати ХМА показали патогенну мікроделецію 15q11.2. Пацієнтка перервала вагітність у терміні 27 тижнів, а плацентарна тканина була негайно зібрана для аналізу плацентарного мозаїцизму (Табл. 2). CNV-seq аналіз біоптатів плаценти підтвердив, що плацентарна тканина мала Т21 мозаїчність, з химерним співвідношенням від 17 до 30%, а тканина пуповини мала химерне співвідношення 96% (Табл. 2). Слід зазначити, що плацентарна тканина з середини плодової частини і середини материнської частини також демонструвала мозаїчність Т2 з химерним співвідношенням 8% і 10% відповідно (Табл. 2).
Обговорення та висновки
З’являється все більше доказів того, що ДНК плода, яка циркулює в материнській крові, здебільшого походить з трофобластичних клітин плаценти, хоча тканини плода також роблять невеликий внесок [20]. З моменту виявлення безклітинної ДНК (бкДНК), НІПТ широко пропагується для пренатального скринінгу на Т21, Т18 і Т13 [21]. Однак на результати НІПТ може впливати багато факторів, таких як плацентарний химеризм, ожиріння матері та рак матері [22]. Загалом, результати ХН, ймовірно, зумовлені двома факторами. По-перше, якщо частка бкеДНК не відповідає певному значенню, позитивний сигнал може не відрізнятися від фонового сигналу. По-друге, завдяки плацентарному химеризму, плазмова бкеДНК може бути отримана з ділянки плаценти, в якій химеризм відсутній або має низьку частку химеризму. Завдяки вдосконаленню методів збагачення бкДНК, НІПТ може досягти нижчих меж виявлення, ніж попередні підходи. Обмежений плацентарний мозаїцизм є основною причиною, яка призводить до результатів ХП або ХП за допомогою НІПТ [10]. Плацентарний мозаїцизм – це різниця в каріотипі між тканинами плаценти та плода [23]. У цьому дослідженні ми надаємо інформацію про два рідкісні ХН випадки НІПТ результатів з частковим Т21, спричиненим плацентарним мозаїцизмом. Ця ситуація повинна бути відома клінічним спеціалістам, а пацієнти повинні бути проінформовані про можливість отримання суперечливих результатів НІПТ.
У першому випадку плацентарного мозаїцизму багаторазові експерименти з плазмою та CNV-seq аналіз окремих ділянок плацентарної тканини показали, що негативні результати НІПТ, ймовірно, пов’язані з низьким рівнем плацентарного мозаїцизму. Однак цитогенетичний аналіз амніотичної рідини виявив 46,XX, + 21,der(21;21)(q10;q10) без мозаїчності, і обидва батьки мали нормальні каріотипи. Відповідно, ця перебудова 21q;21q була перебудовою 21q хромосоми плода de novo. Згідно з деякими відповідними дослідженнями, більшість перебудов 21q;21q є ізохромосомними [24], і синдром Дауна, що виникає внаслідок de novo ізохромосоми 21q, з більшою ймовірністю призводить до результату ХН НІПТ, ніж стандартні каріотипи (47,XN, + 21) [25, 26]. Цікаво, що каріотип клітин хоріона плаценти (отриманих з тканини плаценти з боку середини плода) був 46,XX, + 21,der(21;21)(q10;q10)[86]/46,XX[14]. Наскільки нам відомо, це дослідження вперше вивчає мозаїчність плаценти з цитогенетичної точки зору [25]. Ці результати вказують на те, що плацентарний мозаїцизм, спричинений перебудовами 21q;21q, майже напевно є біологічною причиною ХН.
Щодо мозаїчності плаценти у другому випадку, аналіз CNV-seq виявив низький відсоток мозаїчності Т21 у всіх досліджуваних ділянках плацентарної тканини. Несподівано, біоптати плаценти, взяті з середини материнської сторони і середини плодової сторони, також мали різний рівень мозаїчності Т2 – 10% і 8% відповідно. Загалом, відсоток загального химеризму був меншим за 30% у всіх біоптатах плаценти. Наведені вище результати вказують на те, що негативні результати НІПТ також, ймовірно, пов’язані з низьким рівнем мозаїчності плаценти.
Для того, щоб дослідити кореляцію між мозаїчними пропорціями плацентарної тканини та Z-рахунком для Т21 НІПТ, був проведений пошук опублікованих випадків хибнонегативних результатів НІПТ, пов’язаних з Т21. На жаль, у більшості випадків ХН НІПТ не ідентифікували тканини біопсії плаценти. Зрештою, загалом було зібрано п’ять випадків ХН НІПТ (Табл. 3). Результати поточного дослідження вказують на те, що Z-рахунок для Т21 НІПТ не завжди відображає рівень Т21, наявний у плаценті (Табл. 3). Ці результати мають значення як для клініцистів, так і для пацієнтів, оскільки вони підкреслюють складність біології скринінгу бкДНК.
Таблиця 3 Опубліковані випадки хибнонегативних результатів НІПТ через Т21
| Номер випадку | Технологія скринінгу бкДНК | Показання для НІПТ | Вік вагітної жінки (роки) | Забір крові на GA (wk + d) | Частка ембріональної ДНК | Z-показник для T21 | Каріотип | Пояснення хибнонегативного результату НІПТ | Дослідження |
| 1 | МПСС | 1/370 ризик Т21 за допомогою скринінгу сироватки крові | 32 | 18 + 0 | 15.60% | 2.04 | 46,XX,der(21;21)(q10;q10), + 21 | Біопсії плаценти мали 17-53% з мозаїчністю Т21 | Wang та співавт. (2013) [9] |
| 2 | МПСС | 1/529 ризик Т21 за допомогою скринінгу сироватки крові | 23 | 15 | 15.67% | − 0.201 | 46,XY,der(21;21)(q10;q10), + 21 | Біопсії плаценти мали 13–88% з мозаїчністю Т21 | Це дослідження |
| 3 | МПСС | Маркери УЗД | 35 | 17 | 19.70% | 0.932 | 47,XY, + 21 | Біопсії плаценти мали 17–30% з мозаїчністю Т21 | Це дослідження |
| 4 | МПСС | Маркери УЗД | 35 | 18 | 19.72 | 1.33 | 47,XY, + 21 | Біопсії плаценти мали 2.6–76% з мозаїчністю Т21 | Wang та співавт. (2013) [9] |
| 5 | цМПС | наявність в анамнезі багаторазових несприятливих наслідків при вагітності | 37 | 16 + 5 | 7.52% | 2.503 | 47,XX, + 21[22]/46,XX[4] | Біоптати плаценти мали близько 42,9%% з мозаїчністю Т21 | Kang та співавт. (2022) [19] |
- МПСС Масивне паралельне сигнатурне секвенування; цМПС цільове масивне паралельне секвенування
Описані тут випадки підкреслюють важливість і необхідність додаткового ультрасонографічного контролю при негативних результатах НІПТ. Тому лікарі та пацієнти повинні розуміти, що НІПТ – це скринінговий тест. Особи з негативними результатами НІПТ повинні перебувати під регулярним ультразвуковим моніторингом для запобігання помилкових діагнозів і, за необхідності, проходити подальшу пренатальну діагностику.
Посилання на джерела
- Weijerman ME, van Furth AM, Vonk Noordegraaf A, van Wouwe JP, Broers CJ, Gemke RJ. Prevalence, neonatal characteristics, and first-year mortality of Down syndrome: a national study. J Pediatr. 2008;152(1):15–9.
- Allyse MA, Wick MJ. Noninvasive prenatal genetic screening using cell-free DNA. JAMA. 2018;320(6):591–2.
- Nshimyumukiza L, Menon S, Hina H, Rousseau F, Reinharz D. Cell-free DNA noninvasive prenatal screening for aneuploidy versus conventional screening. A systematic review of economic evaluations. Clin Genet. 2018;94(1):3–21.
- Zimmermann B, Hill M, Gemelos G, Demko Z, Banjevic M, Baner J, et al. Noninvasive prenatal aneuploidy testing of chromosomes 13, 18, 21, X, and Y, using targeted sequencing of polymorphic loci. Prenat Diagn. 2012;32(13):1233–41.
- Bianchi DW, Parker RL, Wentworth J, Madankumar R, Saffer C, Das AF, et al. DNA sequencing versus standard prenatal aneuploidy screening. N Engl J Med. 2014;370(9):799–808.
- Norton ME, Jacobsson B, Swamy GK, Laurent LC, Ranzini AC, Brar H, et al. Cell-free DNA analysis for noninvasive examination of trisomy. N Engl J Med. 2015;372(17):1589–97.
- Gil MM, Accurti V, Santacruz B, Plana MN, Nicolaides KH. Analysis of cell-free DNA in maternal blood in screening for aneuploidies: updated meta-analysis. Ultrasound Obstet Gynecol. 2017;50(3):302–14.
- Faas BH, de Ligt J, Janssen I, Eggink AJ, Wijnberger LD, van Vugt JM, et al. Non-invasive prenatal diagnosis of fetal aneuploidies using massively parallel sequencing-by-ligation and evidence that cell-free fetal DNA in the maternal plasma originates from cytotrophoblastic cells. Expert Opin Biol Ther. 2012;12(Suppl 1):S19-26.
- Wang Y, Zhu J, Chen Y, Lu S, Chen B, Zhao X, et al. Two cases of placental T21 mosaicism: challenging the detection limits of non-invasive prenatal testing. Prenat Diagn. 2013;33(12):1207–10.
- Grati FR, Malvestiti F, Ferreira JC, Bajaj K, Gaetani E, Agrati C, et al. Fetoplacental mosaicism: potential implications for false-positive and false-negative noninvasive prenatal screening results. Genet Med. 2014;16(8):620–4.
- Lebo RV, Novak RW, Wolfe K, Michelson M, Robinson H, Mancuso MS. Discordant circulating fetal DNA and subsequent cytogenetics reveal false negative, placental mosaic, and fetal mosaic cfDNA genotypes. J Transl Med. 2015;13:260.
- Van Opstal D, Srebniak MI, Polak J, de Vries F, Govaerts LC, Joosten M, et al. False negative NIPT results: risk figures for chromosomes 13, 18 and 21 based on chorionic villi results in 5967 cases and literature review. PLoS ONE. 2016;11(1): e0146794.
- Lau TK, Cheung SW, Lo PS, Pursley AN, Chan MK, Jiang F, et al. Non-invasive prenatal testing for fetal chromosomal abnormalities by low-coverage whole-genome sequencing of maternal plasma DNA: review of 1982 consecutive cases in a single center. Ultrasound Obstet Gynecol. 2014;43(3):254–64.
- Cai YH, Yao GY, Chen LJ, Gan HY, Ye CS, Yang XX. The combining effects of cell-free circulating tumor DNA of breast tumor to the noninvasive prenatal testing results. A simulating investigation. DNA Cell Biol. 2018;37(7):626–33.
- Dar P, Curnow KJ, Gross SJ, Hall MP, Stosic M, Demko Z, et al. Clinical experience and follow-up with large scale single-nucleotide polymorphism-based noninvasive prenatal aneuploidy testing. Am J Obstet Gynecol. 2014;211(5):527.e521-7.e517.
- Zhang H, Gao Y, Jiang F, Fu M, Yuan Y, Guo Y, et al. Non-invasive prenatal testing for trisomies 21, 18 and 13: clinical experience from 146,958 pregnancies. Ultrasound Obstet Gynecol. 2015;45(5):530–8.
- Hartwig TS, Ambye L, Sørensen S, Jørgensen FS. Discordant non-invasive prenatal testing (NIPT) – a systematic review. Prenat Diagn. 2017;37(6):527–39.
- Yin AH, Peng CF, Zhao X, Caughey BA, Yang JX, Liu J, et al. Noninvasive detection of fetal subchromosomal abnormalities by semiconductor sequencing of maternal plasma DNA. Proc Natl Acad Sci USA. 2015;112(47):14670–5.
- Kang KM, Kim SH, Park JE, Kim H, Jang HY, Go M, et al. Inconsistency between non-invasive prenatal testing (NIPT) and conventional prenatal diagnosis due to confined placental and fetal mosaicism: two case reports. Front Med. 2022;9:1063480.
- Liao GJ, Gronowski AM, Zhao Z. Non-invasive prenatal testing using cell-free fetal DNA in maternal circulation. Clin Chim Acta. 2014;428:44–50.
- Langlois S, Brock JA. RETIRED: current status in non-invasive prenatal detection of Down syndrome, trisomy 18, and trisomy 13 using cell-free DNA in maternal plasma. J Obstet Gynaecol Can. 2013;35(2):177–81.
- Yaron Y. The implications of non-invasive prenatal testing failures: a review of an under-discussed phenomenon. Prenat Diagn. 2016;36(5):391–6.
- Flori E, Doray B, Gautier E, Kohler M, Ernault P, Flori J, et al. Circulating cell-free fetal DNA in maternal serum appears to originate from cyto- and syncytio-trophoblastic cells. Case Rep Hum Reprod. 2004;19(3):723–4.
- Shaffer LG, McCaskill C, Haller V, Brown JA, Jackson-Cook CK. Further characterization of 19 cases of rea(21q21q) and delineation as isochromosomes or Robertsonian translocations in Down syndrome. Am J Med Genet. 1993;47(8):1218–22.
- Huijsdens-van Amsterdam K, Page-Christiaens L, Flowers N, Bonifacio MD, Ellis KMB, Vogel I, et al. Isochromosome 21q is overrepresented among false-negative cell-free DNA prenatal screening results involving Down syndrome. Eur J Hum Genet. 2018;26(10):1490–6.
- Xu HH, Dai MZ, Wang K, Zhang Y, Pan FY, Shi WW. A rare Down syndrome foetus with de novo 21q;21q rearrangements causing false negative results in non-invasive prenatal testing: a case report. BMC Med Genom. 2020;13(1):96.