Резюме
Передумови: З’являється все більше доказів на користь використання ультразвукового дослідження грудної клітки (УЗДГК) у порівнянні з традиційною рентгенографією грудної клітки (РГК) для діагностики післяопераційних ускладнень. Однак дані щодо його використання після торакальної хірургії є недостатніми та суперечливими. Метою цього дослідження було проведення систематичного огляду для оцінки точності УЗД після торакальної хірургії.
Методи: Для визначення відповідних досліджень було проведено електронний пошук в MEDLINE (через PubMed), доповнений ручним пошуком в посиланнях на статті.
Результати: До метааналізу було включено шість досліджень із загальною кількістю пацієнтів 789. Виконання РГК зменшилося до 61,6% випадків, причому основними причинами для виконання РГК були масивна підшкірна емфізема або складний гідроторакс. У деяких дослідженнях узгодженість між УЗДГК і рутинними терапевтичними варіантами становила до 97%.
Підсумки: Вибіркове післяопераційне використання УЗДГК може зменшити кількість рутинних РГК. Однак, якщо результати УЗДГК є непереконливими, подальші радіологічні дослідження є обов’язковими.
Введення
У різних галузях медицини ультразвукове дослідження органів грудної клітки довело свою ефективність у діагностиці патологій грудної клітки. Особливо в інтенсивній терапії та травматології УЗДГК включено до настанов кожного суспільства і демонструє точність у підтвердженні різних невідкладних станів [1,2,3].. УЗДГК забезпечує дослідження в режимі “реального часу”, що дозволяє дослідити грудну порожнину в будь-якій післяопераційній клінічній ситуації. Більшість даних щодо валідності УЗДГК порівняно з РГК походять від пацієнтів після спонтанного пневмотораксу (ПТ), травми грудної клітки, яким проводили ультразвукове дослідження у відділенні інтенсивної терапії [4,5]. УЗДГК має певні переваги над РГК. УЗДГК не має радіаційного випромінювання і може виконуватися незалежно і багаторазово діагностами біля ліжка пацієнта. Його функція залежить від інтерпретації артефактів, які виникають при відбитті звукових хвиль від поверхонь. Однак УЗДГК не є настільки об’єктивним, оскільки залежить від експерта і від того, як він інтерпретує зображення. Крім того, вона вимагає спеціальної підготовки та знань фізіології грудної клітки [2,3].
У післяопераційному періоді після торакальних хірургічних втручань РГК є стандартним дослідженням. У деяких торакальних хірургічних відділеннях РГК все ще залишається рутинною практикою, навіть у пацієнтів без ускладнень. Були зроблені зусилля та пропозиції щодо зменшення кількості післяопераційних РГК. Однак такі дії потребують ретельного клінічного моніторингу з боку досвідчених хірургів [6]. У цьому випадку виконання УЗДГК, планового або на вимогу, теоретично могло б сприяти зменшенню використання РГК. Як наслідок, УЗДГК мав би особливе значення в післяопераційному перебігу після некардіальних торакальних операцій. Однак у цій хірургічній галузі кількість відповідних досліджень обмежена, а подекуди і з суперечливими результатами [7,8].
У цьому дослідженні ми провели систематичний огляд і мета-аналіз когортних досліджень, які всебічно оцінюють, чи може УЗДГК замінити РГК як післяопераційне візуалізаційне дослідження після торакальної хірургії.
Матеріали та методи
Цей систематичний огляд і мета-аналіз виконано відповідно до протоколу “Переважні елементи звітності для систематичних оглядів і мета-аналізів” (PRISMA). Ми проаналізували результати досліджень УЗДГК після торакальної хірургії та їх клінічні рекомендації.
2.1. Пошукова стратегія
Ми провели пошук в MEDLINE (через PubMed) до червня 2022 року, щоб виявити дослідження, що мають відношення до цього огляду. В якості пошукових термінів використовували комбінацію наступних ключових слів: “торакальне ультразвукове дослідження /ультразвукове дослідження грудної клітки”, “торакальна сонографія/сонографія грудної клітки “, “хірургія легень/торакальна хірургія ” та “резекція легень/грудної клітки”. Крім того, списки літератури знайдених статей були переглянуті вручну для виявлення додаткових релевантних звітів.
Придатність знайдених досліджень до участі в огляді була проведена двома авторами (Konstantinos Grapatsas і Vasileios Leivaditis) незалежно один від одного. Автори огляду вирішували будь-які розбіжності в думках шляхом обговорення або, за необхідності, шляхом звернення до третього автора огляду (Benjamin Ehle). Нарешті, двома дослідниками був проведений додатковий ручний пошук за посиланнями з знайдених досліджень для виявлення релевантних статей.
2.2. Критерії включення та виключення
Дослідження вважалися прийнятними, якщо вони стосувалися післяопераційного УЗДГК після некардіальних торакальних хірургічних операцій.
Дослідження були виключені на основі будь-якого з наступних критеріїв:
- (I) наступні типи статей: огляди, листи, лабораторні дослідження та експерименти на тваринах;
- (II) якщо мова була не англійською;
- (III) дослідження, що включають лише пацієнтів після кардіохірургічних операцій;
- (IV) дослідження однієї і тієї ж установи, що ретроспективно вивчають одну і ту ж групу населення.
2.3. Оцінка якості
Якість кожного включеного дослідження оцінювали за допомогою Ньюкасл-Оттавської шкали (НОШ). На основі якості відбору, порівнянності та експозиції виставлялася оцінка з максимальним значенням 9 балів.
Результати
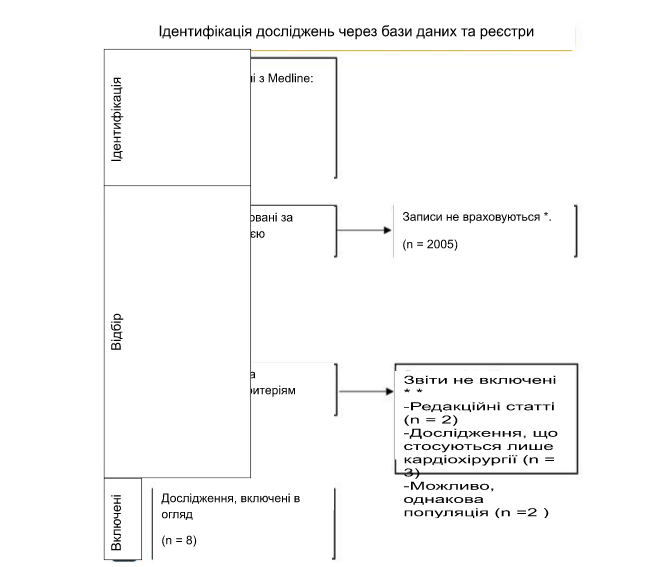
Після первинного пошуку в Medline до нашого початкового дослідження було включено 2020 потенційно релевантних досліджень. Потім 2005 статей були виключені як нерелевантні за назвою або відбіром рефератів. Повні тексти були отримані з 15 досліджень, що залишилися. Вісім з них відповідали всім критеріям включення в аналіз (Зображення 1, Таблиця 1).
Зображення 1. Ідентифікація досліджень УЗДГК відповідно до протоколу звітності Переважні елементи звітності для систематичних оглядів і мета-аналізів (PRISMA).* Якщо використовувалися засоби автоматизації, вказується, скільки записів було виключено за допомогою засобів автоматизації. ** Якщо використовувалися засоби автоматизації, вказується, скільки записів було виключено людьми в ручну.
Таблиця 1. Основні характеристики включених досліджень.
| Дослідження | Походження пацієнта | Загальна кількість пацієнтів | Кількість лобектомій | Ідентифіковані ПТ з РГК проти УЗДГК | Ідентифіковані ПЕ з РГК проти УЗДГК | Основні результати | Шкала НОШ |
|---|---|---|---|---|---|---|---|
| Goudie, 2011 | Канада | 120 | 36 | 157 проти 29 | 148 проти 118 | – Чутливість ПЕ: 83%, специфічність: 59% – ПТ: чутливість: 21%, специфічність: 95% – адекватний метод оцінки ПЕ, невизначений для ПТ – Після операції УЗДГК може зменшити використання РГК, якщо попередньо було виключено ПТ – УЗДГК не має достатньо високої точності, щоб замінити РГК. – Обмеження: – УЗДГК тільки в положенні сидячи – легенева точка не завжди шукалась |
7 |
| Patella, 2017 | Швейцарія | 50 | 33 | 15 проти 24 | -УЗДГК замість РГК: -71% позитивного прогностичного значення -100% негативного прогностичного значення -86% РГК уникнуто |
7 | |
| Chiapetta, 2018 | Італія | 24 | 6 | 0 проти 11 | 0 проти 5 | – УЗДГК вичерпний в -67% випадків відкритої хірургії -85% випадків лапароскопії – РГК потрібна лише у 20,8% через масивну підшкірну емфізему |
8 |
| Malik, 2020 | Словаччина | 297 | 45 | 69 проти 51 | 169 проти 117 | – Чутливість та специфічність УЗДГК для – для ПТ до 59,4% та 94,8% відповідно – для ПЕ до 60,9% та 91,3% відповідно -61.6% РГК уникнуто – Не фізіологічна знахідки -> інші способи візуалізації |
7 |
| Dzian, 2021 | Словаччина | 48 | – Чутливість УЗДГК до – ПТ до 58,5% – ПЕ до 86,2% -2 ПТ пропущено на РГК, всі інші невідповідності клінічно несуттєві – УЗДГК може зменшити РГК – Протокол BLUE |
6 | |||
| Galetin, 2019 | Німеччина | 123 | 44 | 44 проти 26 | – Чутливість і специфічність УЗДГК для великих ПТ 100% і 82%. – Не пропущено жодного клінічно значущого ПТ. – Відповідність між УЗДГК та рутинними терапевтичними рішеннями ≧ 97%. |
8 | |
| Galetin, 2021 | Німеччина | 68 | 31 | 23 проти 18 | – Чутливість та специфічність УЗДГК до ПТ 81% та 81-100%. | 8 | |
| Touw, 2019 | Нідерланди | 177 | 0 | 7 проти 2 | 51 проти 60 | – УЗДГК виявляє більше клінічно значущих післяопераційних легеневих ускладнень і раніше, ніж РГК – Протокол BLUE |
8 |
Ми включили дані дослідження Touw та співавт., хоча вони стосувалися іншої категорії післяопераційних пацієнтів після кардіохірургічних втручань, оскільки відповідна інформація про УЗДГК у цих пацієнтів могла бути використана як екстраполяція для поточного дослідження [9]. Однак дослідження Canty та співавт. [10], Vezzani та співавт. [11], Alsaddique та співавт. [12], що також стосувалися кардіохірургії, не відповідали критеріям дослідження і тому були виключені.
3.1. Характеристики та якості включених досліджень
Дослідження, які були включені, підсумовані в Таблиці 1. Загалом у цих дослідженнях брали участь 730 пацієнтів. Було три дослідження з розміром вибірки менше 50 пацієнтів. Усі вісім досліджень, що були включені, є когортними проспективними дослідженнями. Чотири з них були опубліковані після 2018 року. Обширні резекції легень (лобектомії) варіювали між дослідженнями і коливалися в межах 29-66% когортних популяцій [7,8,13,14,15,16,17]. Сім з восьми представлених досліджень були однозначно на користь УЗДГК в післяопераційному спостереженні за пацієнтами після торакальної хірургії [8,9,13,14,15,16,17]. Оцінки якості окремих досліджень наведені в таблиці 1.
3.2. Післяопераційна оцінка ПТ
ПТ був виявлений після операції у 315 пацієнтів за допомогою РГК після торакальної хірургії. У 161 випадку діагноз ПТ був встановлений при проведенні УЗДГК. Більшість випадків ПТ не мали клінічного значення. Чутливість і специфічність УЗДГК, особливо до ПТ, була дуже високою і в деяких випадках досягала 100% [14,15]. У деяких дослідженнях узгодженість між РГК і УЗДГК досягала 97% [14].
3.3. Післяопераційна оцінка плеврального випоту (ПВ)
Діагноз післяопераційного ПВ вивчався в чотирьох дослідженнях. Після торакальних хірургічних операцій ПВ був діагностований в 368 випадках при РГК і в 300 випадках при УЗДГК. Діагностична розбіжність між двома дослідженнями була мінімальною і не призвела до відповідних клінічних втручань.
3.4. Оцінка інших патологій грудної клітки
Інші патології грудної клітки, такі як післяопераційна консолідація або гіпоконтрактильність, не були ретельно досліджені. Підшкірна емфізема (ПЕ) частіше діагностувалася при УЗДГК. У 16 пацієнтів з УЗДГК та у 8 з РГК було виявлено ПЕ [8].
Післяопераційна консолідація легень (КЛ) і ателектаз легень (АЛ) вивчалися лише в двох дослідженнях [8,9]. За допомогою УЗДГК вдалося виявити більше КЛ, ніж за допомогою РГК. Двадцять пацієнтів були виявлені в обох дослідженнях за допомогою УЗДГК, в той час як всі ці випадки були пропущені за допомогою РГК. УЗДГК також показло значну перевагу в діагностиці АЛ. У дослідженні Touw та співавт. в день операції (День 0) у 154 пацієнтів з АЛ було діагностовано проти 74, у яких було діагностовано РГК [9]. Крім того, в дослідженні Chiappetta та співавт. випадок лобарного ателектазу при УЗДГК був помилково інтерпретований як гідропневмоторакс при проведенні РГК. У цьому ж дослідженні повна відповідність між двома обстеженнями щодо АЛ і КЛ становила лише 8,33% [8].
Chiappetta та співавт. досліджували гіпоконтрактильність діафрагми після торакальної хірургії. УЗДГК виявило два додаткових випадки в порівнянні з РГК. Однак виявлені випадки не мали жодного клінічного значення [8].
3.5. Виявлення набряку легень
УЗДГК був більш ефективним у виявленні післяопераційного набряку легень після торакальної хірургії. У дослідженні Touw та співавт. за допомогою УЗДГК було виявлено тенденцію до частішого діагностування післяопераційного набряку легень у всі три дні, коли проводилося обстеження (0-й день: 36 випадків проти 26; 2-й день: 14 проти 9; і 3-й день: 20 проти 11) [9]. Galetin та співавт. виявили лише один випадок набряку легень за допомогою УЗДГК, який був пропущений при проведенні РГК [14].
3.6. Випадкові знахідки при виконанні УЗДГК
УЗДГК також виявило зміщення середостіння (n = 2) і фібриляцію передсердь (n = 3, один з яких був діагностований вперше) [8,14].
3.7. Подолання труднощів у виконанні УЗДГК
Goudie та співавт. в першому дослідженні, яке вивчало корисність післяопераційного УЗДГК у торакальних хірургічних пацієнтів, припустили, що ПЕ є відносно поширеним обмеженням для УЗДГК. Автори виявили ПЕ на 110 гемітораксах, що обмежувало візуалізацію при УЗДГК. Однак, коли він був обмежений областю гемітораксу, часткова оцінка була можлива [7]. Однак Chiappetta та співавт. повідомили, що виконання РГК було необхідним лише в чотирьох випадках масивної ПЕ (25% від усіх випадків ПЕ) [8]. Додатковими обмеженнями для Goudie та співавт. були місця швів, бинти та обмежена рухливість пацієнта, оскільки це іноді ускладнювало або унеможливлювало візуалізацію заднього костодіафрагмального кута [7].
3.8. Зменшення РГК шляхом прведення УЗДГК
Застосування УЗДГК дозволило обмежити післяопераційну РГК. Використання УЗДГК для візуалізації післяопераційних торакальних хірургічних пацієнтів зменшило потребу в післяопераційній РГК до 86%. Зокрема, за даними Malik та співавт. обсяг респіраторної реанімації можна було зменшити до 61,6%, тоді як, за даними Platella, в деяких випадках це зменшення могло досягати 86% [13,17].
Обговорення
Наскільки нам відомо, вперше було проведено всебічний і детальний систематичний огляд і мета-аналіз, щоб оцінити, чи може УЗДГК замінити РГК в клінічній практиці після торакальної хірургії. Різноманітні дослідження і мета-аналізи, такі як Winker та співавт., підкреслили перевагу УЗДГК над РГК порівняно з золотим стандартом КТ у виявленні легеневих патологій у критично хворих пацієнтів [18]. Однак щодо післяопераційного застосування УЗДГК в торакальній хірургії лише Bhakhir та співавт. та Nooitgedacht та співавт. внесли редакційні пропозиції [19,20]. Роль УЗДГК у післяопераційному перебігу після резекції легень знаходиться в стадії обговорення. В існуючій літературі, яка порівнює УЗДГК і РГК у внутрішній медицині і травматології, УЗДГК демонструє перевагу. Однак тут слід зазначити, що у цих пацієнтів рентгенівський знімок виконувався в положенні лежачи, що погіршувало його чутливість [21,22].
Хоча в дослідженні Goudie та співавт. були отримані докази того, що УЗДГК може бути корисним для діагностики ПТ, це дослідження мало певні недоліки, оскільки УЗДГК виконували лише в положенні сидячи [7]. Виконання УЗДГК у положенні лежачи, як у травматології та інтенсивній терапії, могло б забезпечити кращі результати [21, 23]. Зокрема, УЗДГК виявляє розширення легень, оцінюючи рух плеври щодо грудної стінки, який відбувається при диханні. Як результат, “ознака морського узбережжя” – зернистий вигляд легені на відміну від нерухомої частини грудної стінки. У разі проведення ПТ в М-режимі, відсутність руху буде відображати лише один патерн паралельних горизонтальних ліній над і під плевральною лінією. Цей візерунок нагадує “штрих-код” і часто називається “ознакою стратосфери” [24,25]. Автори припустили, що УЗДГК може зменшити ККС у пацієнтів з раніше виключеним ПТ, але вони вагалися, рекомендуючи замінити РГК на УЗДГК [7]. П’ять років по тому італійське дослідження, проведене Chiappetta та співавт, виступило проти цієї ідеї, припустивши, що РГК можна замінити, особливо в малих і мініінвазивних хірургічних втручаннях і у неускладнених пацієнтів, і що в цих випадках його слід зберегти як обстеження другого рівня [8]. У цьому дослідженні оцінювали вичерпність УЗДГК для діагностики ПТ в обмеженої кількості пацієнтів (n = 24), зосереджуючись на обраному хірургічному підході. Хоча УЗДГК було обмежено наявністю підшкірної емфіземи (ПЕ), у п’яти випадках з масивною ПЕ (з 16 випадків з ПЕ) знадобилося проведення РГК [8]. У тому ж році команда Platella підтримала результати Chiappetta та співавт, які показали, що лише у 1% пацієнтів не було відповідності між УЗДГК і РГК у виявленні ПТ [13]. З іншого боку, Platella та співавт. звернули увагу на занепокоєння Goudie та співавт. щодо того, що у деяких пацієнтів УЗДГК може переоцінити ПТ, тому можуть знадобитися додаткові рентгенологічні дослідження перед повторним встановленням дренажу для післяопераційного ПТ [13]. Зокрема, Goodie та співавт. використовували відсутність ковзання легені як ознаку ПТ, і не проводили подальших досліджень для пошуку точки легені, що вони запропонували як обмеження у своєму дослідженні, яке могло призвести до хибнопозитивних результатів [7]. У той час як Patella та співавт. заявили, що хибнопозитивні результати в їхньому дослідженні можуть бути наслідком проведених процедур, при яких залишковий порожній плевральний простір, як апікальний, так і передній, не виявляється на РГК і може розглядатися як нормальний [13]. В якості ключового процесу для підвищення специфічності УЗДГК в діагностиці ПТ Malik та співавт. запропонували створити стратифікований алгоритм, в якому центральною частиною є додавання більшої кількості ультразвукових ознак, що виключають ПТ, таких як ковзання легень, В-лінії, пульс в легенях або більш складний алгоритм, такий як протокол BLUE (Приліжкове УЗД легень у невідкладних станах) [17]. Протокол BLUE включений в контроль гострої дихальної недостатності і описує використання ультразвуку у критично хворих пацієнтів з метою діагностики пневмонії, набряку легень, загострення ХОЗЛ, тромбоемболії легеневої артерії або ПТ [24,25]. Цей протокол BLUE був застосований у 123 пацієнтів Galetin та співавт. для диференціальної діагностики між ПТ та іншими патологіями після анатомічної та неанатомічної резекції легень. УЗДГК показав високу чутливість і специфічність (100% і 82% відповідно) для великих ПТ (ПТ ≧ 3 см) і дозволив діагностувати всі клінічно значущі ПТ в цьому дослідженні [14]. У новішому дослідженні, проведеному в тій самій установі, післяопераційне УЗДГК замінило РГК з такою ж чутливістю для виявлення ПТ і призвело до однаково безпечного ведення пацієнтів [15]. У своєму третьому дослідженні Galetin та співавт. порівнювали УЗДГК і РГК для виявлення ПТ після хірургічних втручань на легенях, об’єднавши популяції (340 обстежень у 208 пацієнтів) двох попередніх проспективних досліджень. Найважливішим результатом цього дослідження стало те, що на чутливість або специфічність УЗДГК не впливають такі периопераційні фактори, як вік, стать, індекс маси тіла, статус куріння або тяжкість хронічного обструктивного захворювання легень (ХОЗЛ). Крім того, хірургічні або онкологічні фактори, такі як попередні операції на легенях, опромінення або торакотомія як хірургічні підходи, не мали суттєвого впливу на специфічність і чутливість УЗДГК [26].
Що стосується видалення дренажу грудної клітки, то більшість досліджень сходяться на думці, що УЗДГК є ефективним і надійним методом. Patella та співавт. у своєму обсерваційному дослідженні вивчали корисність УЗДГК у 50 пацієнтів щодо видалення післяопераційного дренажу грудної клітки [13]. Автори запропонували видаляти дренаж, якщо існував мінімальний витік повітря, а УЗДГК підтверджував розширення легені. Таким чином, РГК можна було уникнути. Однак у цьому дослідженні УЗДГК проводили лише у відібраній популяції пацієнтів, і це може бути упередженням, оскільки ускладнені пацієнти, такі як пацієнти з хірургічною емфіземою, тяжким ХОЗЛ, резекцією грудної стінки або діафрагми, були виключені [13]. Подібно до цих доказів, Chiappetta та співавт. оцінювали ефективність УЗДГК у видаленні дренажу після торакальної операції, але вони також зосередилися на типі операції. Було висловлено припущення, що за допомогою локалізованого апікального ПТ без витоку повітря можна безпечно видалити дренаж грудної клітки [8]. В результаті вищезазначених досліджень можна припустити, що пацієнти з неускладненими хірургічними втручаннями або мінімально інвазивними операціями є ідеальними групами пацієнтів для післяопераційного спостереження з використанням УЗДГК [8,13].
Відомо, що за допомогою УЗДГК можна легко виявити ПЕ, навіть якщо кількість рідини ще дуже низька [27]. Однак діагностика ПЕ за допомогою РГК може бути складною для пацієнтів у гострому періоді після операції, які перебувають у лежачому положенні. Dzian та співавт. показали, що УЗДГК може безпечно діагностувати ПЕ з першого обстеження з високою чутливістю і специфічністю (до 86,2% і 88,4% відповідно) і хорошою узгодженістю з результатами РГК [16]. Malik та співавт. показали, що показники чутливості та специфічності УЗДГК для ПЕ були подібними до показників для ПТ (60,9% і 91,3%; і 59,4 і 94,8 відповідно) і що специфічність УЗДГК зростала після першого обстеження [17]. Обидва дослідження дійшли висновку, що післяопераційне УЗДГК, яке виконується торакальним хірургом, може безпечно замінити РГК як основне обстеження в післяопераційному спостереженні [16,17].
У 2018 році дослідження Touw та співавт. виявило перевагу УЗДГК порівняно з РГК у виявленні ПТ або інших легеневих патологій, а також у пацієнтів, які перенесли кардіоторакальну операцію [9]. Використовуючи протокол BLUE у 177 пацієнтів, це дослідження виявило більш ранні та клінічно значущі легеневі ускладнення при застосуванні УЗДГК, ніж при застосуванні РГК. Більше того, щодо діагностики післяопераційних АЛ і КЛ, УЗДГК показав перевагу. У цих випадках УЗДГК давала можливість розрізнити, чи причиною АЛ була гіповентиляція, чи контузія легені внаслідок резекції паренхіми [9]. Основним обмеженням цього дослідження було те, що автори не порівнювали результати УЗДГК і РГК з методом золотого стандарту – КТ грудної клітки. Крім того, суб’єктивність лікаря може бути проблемою, хоча виконання УЗДГК декількома дослідниками з різним рівнем досвіду, що відображає щоденну клінічну практику, може її подолати [9,28,29]. Необхідно провести більше подвійних сліпих рандомізованих досліджень за участю післяопераційних пацієнтів після кардіохірургічних втручань, щоб ми могли зробити більш безпечні висновки, але з огляду на вищезазначені дослідження, ми можемо рекомендувати УЗДГК як основний метод візуалізації для виявлення патологій грудної клітки і допомоги в прийнятті рішень біля ліжка хворого.
4.1. Обмеження цього мета-аналізу
Найважливішим обмеженням цього мета-аналізу є гетерогенність досліджуваних популяцій. У деяких дослідженнях обширні резекції легень становили більшість операцій, тоді як в інших випадках вони були обмежені [8,13]. Відмінності в обсязі операцій, а також різний хірургічний підхід (відкритий проти лапароскопічного) могли призвести до різних результатів ультразвукового дослідження. Крім того, в деяких дослідженнях УЗДГК абсолютно не виконували у відібраних пацієнтів [13,14]. Як наслідок, не можна було зробити висновки щодо проведення УЗДГК у невідібраних пацієнтів, наприклад, з емфіземою легень. Крім того, виконання УЗДГК і виключення патології органів грудної клітки проводилося за різними алгоритмами. У всіх включених дослідженнях час або частота обстеження, визначення патологій грудної клітки або положення пацієнта під час обстеження не були схожими. Наприклад, Goudie та співавт. виконували УЗДГК кілька разів після операції [7]. У дослідженні Patella та співавт. УЗДГК виконували після видалення грудної трубки [13]. У деяких пацієнтів УЗДГК виконували протягом 48 год після операції [8]. Так само відрізнялося і положення пацієнтів. У дослідженні Goudie та співавт. УЗДГК виконували в положенні сидячи або принаймні під кутом 45° напівлежачи [7]. Patella та співавт. виконували УЗДГК також у положенні сидячи [13]. Така гетерогенність щодо виконання УЗДГК могла призвести до різних результатів. Наприклад, у вищезгаданих дослідженнях чутливість УЗДГК та РГК суттєво відрізнялася (0,2 проти 1,00). Крім того, відсутність стандартизованого алгоритму у всіх дослідженнях або загальноприйнятого протоколу могла призвести до різних результатів. Malik та співавт. запропонували алгоритм для того, щоб мати стандартизовану діагностичну процедуру [17]. Patella та співавт., щоб краще оцінити ступінь післяопераційного ПТ, виконували УЗДГК з використанням двох різних анатомічних точок оцінки (2-ге і 3-тє міжребер’я) [13]. Galetin та співавт. використовували, як ознаку, легеневий пульс для виключення ПТ [14,15]. Крім того, використання КТ грудної клітки як методу золотого стандарту для оцінки чутливості та специфічності УЗДГК порівняно з РГК не було застосовано у всіх дослідженнях [8,9,13]. Таким чином, результати можуть бути суперечливими.
Потреба в нових дослідженнях з кращою методологією і більшими популяціями не викликає сумнівів. Однак, як свідчать наявні дослідження, незалежно від протоколу/алгоритму УЗДГК, візуалізація за допомогою РГК може бути замінена або зменшена за рахунок виконання УЗДГК. Отже, можна припустити, що використання УЗДГК в післяопераційному періоді як основного інструменту діагностики легеневих патологій має багато переваг для пацієнтів після резекції легень. УЗДГК не піддає пацієнтів опроміненню. Його можна виконувати біля ліжка пацієнта, і він є повторюваним. Той факт, що УЗДГК виконується біля ліжка, також є комфортним для пацієнта. Крім того, велика кількість УЗДГК може бути виконана за низькою вартістю і без перевантаження системи охорони здоров’я. Нарешті, якщо УЗДГК виконується торакальним хірургом, який вже має клінічну інформацію щодо післяопераційних анатомічних змін, то потреба в додаткових візуалізаційних дослідженнях може бути ще більше зменшена.
4.2. Майбутні напрямки діяльності
Останнім часом неінвазивні, недорогі та вільні від променевого навантаження методи оцінки, такі як УЗДГК, отримали більший доступ у щоденній клінічній практиці. Все більше фахівців навчені розпізнавати патології у своїй сфері інтересів, хоча повинні бути створені освітні програми, офіційно прийняті різними медичними товариствами (пульмонологів, торакальних хірургів і т.д.). Крім того, штучний інтелект з використанням складних алгоритмів міг би надавати підтримку в аналізі всіх наявних даних про пацієнта разом з ультразвуковою візуалізацією і ставити найбільш точний діагноз. Оскільки важливо уникати суб’єктивності та інтерпретувати зображення більш об’єктивно, впровадження програми штучного інтелекту може допомогти в цьому, а паралельно з цим можна було б перевірити повторюваність певного результату. Нові контрольовані, рандомізовані дослідження за участю післяопераційних пацієнтів повинні перевірити цю можливість, щоб оптимізувати цей діагностичний інструмент в руках клініцистів.
Висновки
УЗДГК може замінити РГК в клінічній практиці після торакальної хірургії, навіть після обширних резекцій легень. Подальші дослідження в цій галузі можуть бути зосереджені на зміцненні позицій УЗДГК у прийнятті рішень, а не на прямому порівнянні УЗДГК з РГК. Використання стандартизованих ультразвукових протоколів, таких як протокол BLUE, може зменшити кількість невизначених результатів, а також проведення непотрібних РГК. Однак, саме лікар, знаючи обмеження та переваги кожного методу, повинен обирати, яке обстеження може принести користь пацієнту в кожному конкретному випадку.
Посилання
- MacDuff, A.; Arnold, A.; Harvey, J.; BTS Pleural Disease Guideline Group. Management of spontaneous pneumothorax: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010, 65 (Suppl. 2), ii18–ii31.
- Baumann, M.H.; Strange, C.; Heffner, J.E.; Light, R.; Kirby, T.J.; Klein, J.; Luketich, J.D.; Panacek, E.A.; Sahn, S.A.; Group, A.P.C. Management of spontaneous pneumothorax: An American College of Chest Physicians Delphi consensus statement. Chest 2001, 119, 590–602.
- Schnell, J.; Beer, M.; Eggeling, S.; Gesierich, W.; Gottlieb, J.; Herth, F.J.F.; Hofmann, H.S.; Jany, B.; Kreuter, M.; Ley-Zaporozhan, J.; et al. Management of Spontaneous Pneumothorax and Post-Interventional Pneumothorax: German S3 Guideline. Respiration 2019, 97, 370–402.
- Alrajab, S.; Youssef, A.M.; Akkus, N.I.; Caldito, G. Pleural ultrasonography versus chest radiography for the diagnosis of pneumothorax: Review of the literature and meta-analysis. Crit. Care 2013, 17, R208.
- Wilkerson, R.G.; Stone, M.B. Sensitivity of bedside ultrasound and supine anteroposterior chest radiographs for the identification of pneumothorax after blunt trauma. Acad. Emerg. Med. 2010, 17, 11–17.
- Reeb, J.; Falcoz, P.E.; Olland, A.; Massard, G. Are daily routine chest radiographs necessary after pulmonary surgery in adult patients? Interact. Cardiovasc. Thorac. Surg. 2013, 17, 995–998.
- Goudie, E.; Bah, I.; Khereba, M.; Ferraro, P.; Duranceau, A.; Martin, J.; Thiffault, V.; Liberman, M. Prospective trial evaluating sonography after thoracic surgery in postoperative care and decision making. Eur. J. Cardiothorac. Surg. 2012, 41, 1025–1030.
- Chiappetta, M.; Meacci, E.; Cesario, A.; Smargiassi, A.; Inchingolo, R.; Petracca Ciavarella, L.; Lopatriello, S.; Contegiacomo, A.; Congedo, M.T.; Margaritora, S. Postoperative chest ultrasound findings and effectiveness after thoracic surgery: A pilot study. Ultrasound Med. Biol. 2018, 44, 1960–1967.
- Touw, H.R.; Parlevliet, K.L.; Beerepoot, M.; Schober, P.; Vonk, A.; Twisk, J.W.; Elbers, P.W.; Boer, C.; Tuinman, P.R. Lung ultrasound compared with chest X-ray in diagnosing postoperative pulmonary complications following cardiothoracic surgery: A prospective observational study. Anaesthesia 2018, 73, 946–954.
- Canty, D.; Ford, J.; Heiberg, J.; Brennan, A.; Royse, C.; El-Ansary, D.; Royse, A. Point-of-care diagnosis of perioperative lung pathology with lung ultrasound in cardiothoracic surgery—Comparison with clinical examination and chest X-ray. J. Cardiothorac. Vasc. Anesth. 2017, 31, S44–S45.
- Vezzani, A.; Manca, T.; Brusasco, C.; Santori, G.; Valentino, M.; Nicolini, F.; Molardi, A.; Gherli, T.; Corradi, F. Diagnostic value of chest ultrasound after cardiac surgery: A comparison with chest X-ray and auscultation. J. Cardiothorac. Vasc. Anesth. 2014, 28, 1527–1532.
- Alsaddique, A.; Royse, A.G.; Royse, C.F.; Mobeirek, A.; El Shaer, F.; AlBackr, H.; Fouda, M.; Canty, D.J. Repeated Monitoring with Transthoracic Echocardiography and Lung Ultrasound After Cardiac Surgery: Feasibility and Impact on Diagnosis. J. Cardiothorac. Vasc. Anesth. 2016, 30, 406–412.
- Patella, M.; Saporito, A.; Puligheddu, C.; Mongelli, F.; La Regina, D.; Pini, R.; Inderbitzi, R.; Cafarotti, S. Lung Ultrasound to Detect Residual Pneumothorax after Chest Drain Removal in Lung Resections. Ann. Thorac. Surg. 2018, 105, 1537–1542.
- Galetin, T.; Defosse, J.; Schieren, M.; Marks, B.; Lopez-Pastorini, A.; Koryllos, A.; Kosse, N.; Wappler, F.; Stoelben, E. Sensitivity of chest ultrasound for postoperative pneumothorax in comparison to chest X-ray after lung resecting surgery. Eur. J. Cardiothorac. Surg. 2020, 57, 846–853.
- Galetin, T.; Schieren, M.; Marks, B.; Defosse, J.; Stoelben, E. Sensitivity of lung ultrasound for the detection of pneumothorax one day after pulmonary resection—a prospective observational study. Eur. Surg. 2021, 53, 23–28.
- Dzian, A.; Malik, M.; Hamada, L.; Skalicanova, M.; Zelenak, K.; Stevik, M.; Grendar, M. Lung ultrasound could reduce X-ray after major lung resection. Bratisl. Lek. Listy 2021, 122, 871–875.
- Malik, M.; Dzian, A.; Skalicanova, M.; Hamada, L.; Zelenak, K.; Grendar, M. Chest Ultrasound Can Reduce the Use of Roentgenograms in Postoperative Care After Thoracic Surgery. Ann. Thorac. Surg. 2021, 112, 897–904.
- Winkler, M.H.; Touw, H.R.; van de Ven, P.M.; Twisk, J.; Tuinman, P.R. Diagnostic Accuracy of Chest Radiograph, and When Concomitantly Studied Lung Ultrasound, in Critically Ill Patients with Respiratory Symptoms: A Systematic Review and Meta-Analysis. Crit. Care Med. 2018, 46, e707–e714.
- Bhakhri, K.; Coonar, A. Editorial of current practise in the use of chest ultrasound in thoracic surgery. J. Thorac. Dis. 2019, 11, 5706–5707.
- Nooitgedacht, J.; Haaksma, M.; Touw, H.R.W.; Tuinman, P.R. Perioperative care with an ultrasound device is as Michael Jordan with Scotty Pippen: At its best! J. Thorac. Dis. 2018, 10, 6436–6441.
- Blaivas, M.; Lyon, M.; Duggal, S. A prospective comparison of supine chest radiography and bedside ultrasound for the diagnosis of traumatic pneumothorax. Acad. Emerg. Med. 2005, 12, 844–849.
- Soldati, G.; Testa, A.; Sher, S.; Pignataro, G.; La Sala, M.; Silveri, N.G. Occult traumatic pneumothorax: Diagnostic accuracy of lung ultrasonography in the emergency department. Chest 2008, 133, 204–211.
- Knudtson, J.L.; Dort, J.M.; Helmer, S.D.; Smith, R.S. Surgeon-performed ultrasound for pneumothorax in the trauma suite. J. Trauma 2004, 56, 527–530.
- Lichtenstein, D.A.; Meziere, G.A. Relevance of lung ultrasound in the diagnosis of acute respiratory failure: The BLUE protocol. Chest 2008, 134, 117–125.
- Lichtenstein, D.A. BLUE-protocol and FALLS-protocol: Two applications of lung ultrasound in the critically ill. Chest 2015, 147, 1659–1670.
- Galetin, T.; Merres, J.; Schieren, M.; Marks, B.; Haffke, Y.; Defosse, J.; Wappler, F.; Koryllos, A.; Stoelben, E. Most patient conditions do not a priori debilitate the sensitivity of thoracic ultrasound in thoracic surgery-a prospective comparative study. J. Cardiothorac. Surg. 2021, 16, 75.
- Maskell, N.A.; Butland, R.J.; Group Pleural Diseases; Comittee Standards of Care; Society British Thoracic. BTS guidelines for the investigation of a unilateral pleural effusion in adults. Thorax 2003, 58 (Suppl. 2), ii8–ii17.
- Jeppesen, K.M.; Bahner, D.P. Teaching bedside sonography using peer mentoring: A prospective randomized trial. J. Ultrasound Med. 2012, 31, 455–459. [Google Scholar] [CrossRef]
- House, J.B.; Choe, C.H.; Wourman, H.L.; Berg, K.M.; Fischer, J.P.; Santen, S.A. Efficient and Effective Use of Peer Teaching for Medical Student Simulation. West. J. Emerg. Med. 2017, 18, 137–141.