Резюме
Задания
Исследование активности и повреждения тканей суставов (Joint tissue Activity and Damage Exam, JADE) – это протокол ультразвукового исследования опорно-двигательного аппарата (УЗОДА) для оценки артропатии при гемофилии в пунктах оказания медицинской помощи (ПМП). Нашей целью было определить согласованность кроссекционного анализа прямых исследований тканей (протокол JADE) и клинической оценки состояния суставов при гемофилии [ОССГ] и функциональной оценки суставов (дуга) во время трех визитов в клинику.
Методы
Мы провели проспективное исследование взрослых (n = 44) с гемофилией (A или B) любой степени тяжести и артропатией на 3 североамериканских участках. Мы оценивали параметры ОССГ, общую дугу и JADE (локти, голеностопные суставы и колени билатерально) в начале исследования, через ≈12-18 месяцев и через ≈24-36 месяцев, а также использовали УЗОДА для оценки эпизодов боли между визитами на обследование. Измерения JADE включали остеохондральные изменения, толщину хряща и расширение мягких тканей в обследуемых позициях. Ассоциации между суставной ОССГ и общей дугой с каждой переменной JADE исследовали с помощью моделей случайного перехвата.
Результаты
Во время каждого визита увеличение ОССГ и уменьшение общей дуги были связаны в ожидаемом направлении с увеличением длины ОИ и разрастанием мягких тканей во всех суставах, а также уменьшением толщины хряща в коленном суставе. Однако ассоциации ОССГ с толщиной хряща имели U-образную форму для локтевого и голеностопного суставов (то есть утончение и утолщение хряща). Ассоциации между общей дугой и толщиной хряща имели похожую кривую. (Почти) нормальные уровни обоих суставных параметров (ОССГ и общей дуги) были связаны с нормальными диапазонами толщины хряща. Виды JADE также были полезными для выявления гемартроза в ассоциации с болями в суставах.
Выводы
ПМП УЗОДА с применением прямых измерений тканей с использованием протокола JADE обеспечил кроссекционные воспроизводимые взаимосвязи между результатами состояния суставов во время трех визитов. Эти результаты способствуют валидации протокола и позволяют проводить итеративные адаптации, что привело к созданию версии 2 протокола JADE.
Вступление
Протокол исследования активности и повреждения суставных тканей (JADE) был разработан для обеспечения визуализации с помощью ультразвукового исследования опорно-двигательного аппарата (УЗОДА) в месте оказания медицинской помощи (ПМП) для нерадиологов с целью оценки степени и прогрессирования артропатии при гемофилии в амбулаторных условиях [1]. Протокол JADE использует количественные цифровые измерения (с разрешением 1/10 миллиметра) для оценки остеохондральных изменений, толщины хряща и разрастания мягких тканей в сторожевых положениях локтевого, коленного и голеностопного суставов [1]. Валидация протокола JADE происходила в соответствии с процессами, рекомендованными международными установками Outcomes Measures in Rheumatology (OMERACT) (“истина, дискриминация, осуществимость” [2]) для обеспечения распознавания патологической ткани при артропатии [3], высокой внутри/между исследователями и межоператорской надежности [1], а также перекрестных ассоциаций с клиническими параметрами на начальном этапе [4].
Ранее мы сообщали, что измерение суставной ткани по протоколу JADE связано с клинической (Hemophilia Joint Health Score [ОССГ]) и функциональной (общая дуга) оценкой суставов на начальном этапе у людей с гемофилией (ЛСГ), страдающих от широкого спектра артропатических проявлений. Предыдущие усилия были ограничены одноразовыми измерениями в кросс-секционном когортном анализе [4]. В этом исследовании мы дополнительно оцениваем надежность измерений JADE на той же когорте, оценивая кросс-секционную связь прямых исследований тканей с клиническими и функциональными оценками суставов, выполненных последовательно во время нескольких визитов в клинику (с интервалом ≈1 год) в течение проспективного ≈3-летнего периода исследования. Эти анализы были направлены на определение согласованности таких ассоциаций для оценок по протоколу JADE при различных визитах в клинику с течением времени согласно руководствам OMERACT [2], которые рекомендуют итеративную валидацию.
Материалы и методы
Отбор пациентов
В период с мая 2016 года по апрель 2019 года мы набирали взрослых (в возрасте ≥ 18 лет) ЛСГ (гемофилия А или В) независимо от степени тяжести в трех центрах лечения гемофилии в США (Центр ортопедического лечения гемофилии в Лос-Анджелесе, Калифорнийский университет в Сан-Диего и Вашингтонский центр по изучению нарушений свертываемости крови). ЛСГ были включены, если они имели по крайней мере один артропатический сустав, определенный по шкале ОССГ, которая недавно была валидирована для использования у взрослых ЛСГ [5]. Показатели ОССГ должны были иметь значение не менее трех баллов или выше, чтобы предположить наличие артропатических изменений [6]. Кроме отсутствия артропатии по этим критериям, других критериев исключения из исследования не было. Каждый пациент совершил три визита в свой лечебный центр в течение примерно 2-3 лет. Здесь представлены кросс-секционные результаты, полученные во время каждого визита, без включения продольных анализов. Исследование было одобрено Институциональными наблюдательными советами учреждений, участвовавших в исследовании (Institutional Review Board #:120,510). Каждый пациент и/или его законный представитель предоставил письменное информированное согласие на участие в исследовании. Исследование проводилось в соответствии с Хельсинской декларацией.
Оценка состояния суставов
Состояние обоих локтевых, коленных и голеностопных суставов оценивали с помощью ОССГ, общей дуги и ПМП УЗОДА в течение трех периодов (“визитов”): в начале исследования (начальный), через ≈12-18 месяцев (“средний”) и через ≈24-36 месяцев (“заключительный”). Визиты к врачу проводились, когда пациенты находились в обычном состоянии здоровья. Пациенты также обследовались в течение 48 часов при возникновении острой боли в суставах. Мы использовали ОССГ версии 2.1 (ОССГ для каждого сустава: 0 лучший, 20 худший; общий ОССГ для 6 суставов вместе: 0 лучших, 120 худших [6]). ОССГ версии 2.1 – это общепринятая оценка результатов, которая дает клиническую оценку для каждого сустава, суммируя отек, продолжительность отека, боль, силу, потерю объема движений, мышечную атрофию и крепитацию. ОССГ проводил лицензированный физический терапевт с опытом работы в общей практике более 5 лет и примерно 2 года опыта работы с пациентами с гемофилией (BS, PA, CB). Физические терапевты прошли обучение по проведению ОССГ в соответствии с инструкциями и рекомендациями, предоставленными в онлайн-тренингах и видеомодулях, разработанных Международной исследовательской группой по профилактике. Общую дугу, функциональную оценку суммы степеней сгибания и разгибания в диапазоне движений (ДД), измеряли с помощью гониометрии [7,8,9]. Более высокие показатели ОССГ и более низкие показатели общей дуги отражают худшее состояние суставов.
Визуализация ПМП УЗОДА
Измерение ПМП УЗОДА проводили с помощью ультразвукового аппарата высокого разрешения GE Logiq S8 (General Electrics, Fairfield, Connecticut) с пространственной визуализацией в реальном времени, высокочастотным линейным датчиком с оттенками серого (B-режим) 8-15 МГц и возможностями устранения количества артефактов реверберации в соответствии с рекомендациями производителей. В каждом учреждении, участвовавшем в исследовании, изображения получали специалисты с опытом работы не менее 3 лет, имеющие дело с пациентами с гемофилией, которые прошли формальную подготовку на аккредитованном курсе UCSD CME (https://cme.ucsd.edu/httc/index.html) в ПМП УЗОДА. Два врача (AvD и BS) сертифицированы в УЗОДА Альянсом по сертификации и повышению квалификации врачей (APCA), а PA и CB находились в процессе сертификации (PA сейчас сертифицирован). Изображения были получены по протоколу JADE версии 1 [1]. Во время всех визитов в Центр ортопедического лечения гемофилии в Лос-Анджелесе (CB) и Вашингтонский центр нарушений свертываемости крови (BS) работали одни и те же операторы. В Калифорнийском университете в Сан-Диего было два оператора (PA и AF). В 21 стандартном положении в локтевом, коленном и голеностопном суставах оценивали толщину хряща, остеохондральные изменения и разрастание мягких тканей. Толщину хряща и остеохондральные изменения измеряли на локтевом суставе по короткой и длинной оси, коленном суставе по короткой оси, по длинной оси на медиальном и латеральном отростках бедренной кости сзади и спереди, а также на куполе таранной кости голеностопного сустава (короткая ось для остеохондральных изменений и длинная ось – для толщины хряща). Расширение мягких тканей измеряли в локтевой ямке, медиальной и латеральной впадинах коленного сустава и передней впадине голеностопного сустава. К мягким тканям относятся жировые прослойки, синовиальная оболочка и капсульные мягкотканные структуры, которые определяются как конгломерат, поскольку они не могут быть дифференцированы с помощью ПМП УЗОДА в патологических состояниях [3]. Ухудшение состояния суставов отображается увеличением протяженности остеохондральных изменений, уменьшением толщины хряща и/или увеличением разрастания мягких тканей. Оценка УЗОДА во время болевых эпизодов включает сонопальпацию для оценки и смещения внутрисуставного материала в суставных впадинах для различения простых и сложных (кровянистых) выпотов [10].
Статистический анализ
Результаты представлены на уровне суставов (JADE): локтевого, коленного и голеностопного суставов. Для каждого сустава мы исследовали два результата: суставную ОССГ и общую дугу. Значения ОССГ не были нормально распределены, а скорее положительно смещены, поэтому мы применили преобразование квадратного корня, где sqrt ОССГ = √(0,5 + ОССГ). В отличие от этого, отрицательный наклон значений для общей дуги был исправлен с помощью преобразования, отражающего [11], где преобразованное значение Y = ln(170 – Общая дуга).
Тремя предикторами были измерения JADE УЗОДА протяженности остеохондральных изменений, толщины хряща и разрастания мягких тканей. Значения, которые не были нормально распределены и могли иметь непропорциональное влияние на оценки, перед анализом были преобразованы в логарифмическую функцию. Значения, которые превышали 3,29 стандартных отклонений от среднего значения, считались полученными из другой популяции (P <0,001) [11]. Они были классифицированы как погрешности и исключены из анализа.
Для каждого визита (начальный, средний и заключительный) мы строили графики и рассчитывали кривую наилучшего соответствия для связи между каждым предиктором переменной JADE и двумя результатами. Поскольку каждый субъект имел левый и правый суставы, мы скорректировали внутрииндивидуальную корреляцию, подобрав модели случайного перехвата [12], чтобы вычислить линию, которая лучше всего описывает связь между предикторами и результатами. Кривые были подогнаны путем добавления полиномиальных членов. Как ранее описали Меслех Шаеб и соавт. [4], связь между результатом и переменной JADE была показана с помощью коэффициента регрессии b и 95% доверительного интервала. Использование зеркального преобразования для общей дуги означает, что отрицательный коэффициент регрессии указывает на положительную связь между результатом и независимой переменной, и наоборот [4]. В квадратичной модели связь описывалась двумя коэффициентами регрессии b1 и b2 [4]. Мы построили кривые для начального, среднего и конечного визитов на одном графике. Если тесты на параллельность и равенство перехватов не показывали различий, мы делали вывод, что три кривые совпадают [13]. Для оценки острых болевых эпизодов в суставах применяли описательную статистику.
Результаты
Характеристики пациентов
В таблице 1 приведены основные характеристики 44 участников исследования. Средний возраст составлял 36 лет (интерквартильный размах [ИКР]: 28, 49). Большинство участников были белыми, имели тяжелую форму гемофилии А и получали профилактическую замену фактора. Время между начальным и конечным визитами составляло от 1 до 2,9 года с медианой 1,6 года (ИКР: 1,3, 1,9). Три четверти участников наблюдались в течение почти 2 лет. Ни один из участников не перенес гемартроз или травму в течение 3 месяцев, предшествовавших оценочным визитам.
Таблица 1 Базовые характеристики
| Признак | |
| Центрa | |
| ЛА | 14 (32) |
| Сиэтл | 15 (34) |
| Сан-Диего | 15 (34) |
| Тип гемофилииa | |
| A | 35 (80) |
| B | 9 (20) |
| Степень тяжестиa | |
| Легкая | 1 (2) |
| Умеренная | 7 (16) |
| Тяжелая | 36 (82) |
| Раса/Этничностьa | |
| Испанская | 7 (16) |
| Белая | 26 (59) |
| Афроамериканская | 4 (9) |
| Азиатская | 2 (5) |
| Другая | 5 (11) |
| Возраст (лет)b | 36 [28, 49] |
| Общий ОССГb | 27 [18, 42] |
| Суставный ОССГb | |
| Локоть | 2 [0, 7] |
| Колено | 2 [0, 7] |
| Голеностопный сустав | 6 [1, 9] |
| ОССГb | |
| Локоть: Левый | 2 [0, 7] |
| Правый | 2 [0, 7] |
| Колено: Левое | 2 [0, 7] |
| Правое | 2 [0, 8] |
| Голеностопный сустав: Левый | 6 [1, 9] |
| Правый | 6 [2, 9] |
| Общая дуга суставовb | |
| Локоть | 130 [100, 143] |
| Колено | 130 [105, 140] |
| Голеностопный сустав | 32 [22, 56] |
| Общие дугиb | |
| Локоть: Левый | 130 [99, 143] |
| Правый | 130 [100, 143] |
| Колено: Левое | 131 [105, 140] |
| Правое | 130 [97, 140] |
| Голеностопный сустав: Левый | 32 [22, 56] |
| Правый | 30 [22, 53] |
| Профилактика | |
| Регулярная профилактика | 39 |
| По требованию | 3 |
| Генная терапия | 2 |
| Замена суставов | |
| Голеностопный сустав | 1 |
| Локоть | 1 |
| Колено | 18 |
| Срастание суставов | |
| Голеностопный сустав | 6 |
| Локоть | 0 |
| Колено | 0 |
- ОССГ Оценка состояния суставов при гемофилии
- aзначения выражены как N (%)
- bзначения, выраженные как медиана [интерквартильный размах]
Ассоциации измерения JADE ПМП УЗОДА с ОССГ и общей дугой
Эффект от трансформаций
Трансформация общих значений ОССГ несколько улучшила распределение с точки зрения лучшего приближения к нормальному (тест Колмогорова-Смирнова для двух выборок): D = 0,117, p = 0,130 для ОССГ; D = 0,095, p > 0,150 после трансформации). Сравнение подгонки к нормальному распределению на уровне сустава показало, что трансформация ОССГ привела к небольшому улучшению для колена; трансформация общей дуги несколько улучшила подгонку для локтевого, коленного и голеностопного суставов. Влияние на модели можно проиллюстрировать с помощью анализа остатков и стандартных ошибок. Преобразование ОССГ принесло небольшие улучшения остатков модели для локтя и голеностопного сустава, но не для колена. Преобразование полной дуги несколько улучшило остатки для локтя и колена, но не для голеностопного сустава. Модели с остатками, более близкими к нормальным, дали регрессионные оценки с меньшими стандартными ошибками и, соответственно, более узкими доверительными интервалами. Таким образом, трансформация привела к более точным оценкам для двух третей моделей.
Локти
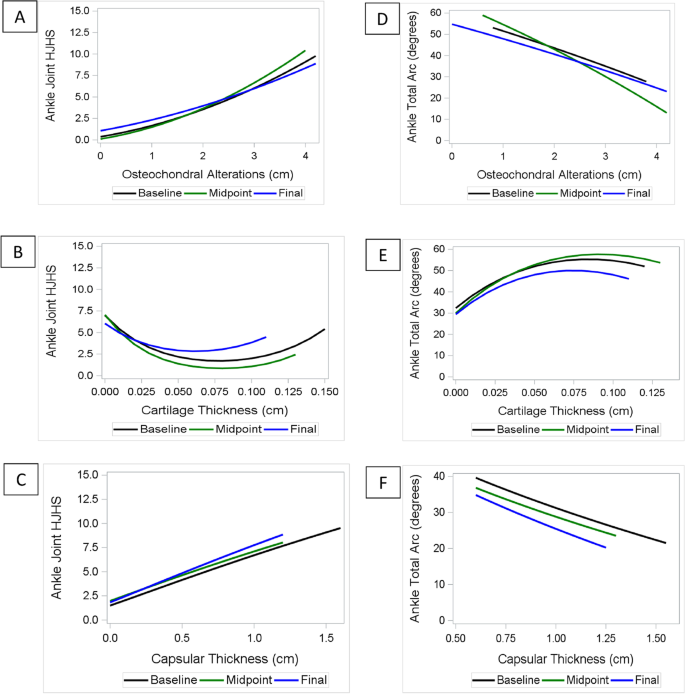
Во время каждого из трех визитов наблюдалась положительная связь между ОССГ и увеличением длины остеохондральных изменений на головке плечевой кости и разрастанием мягких тканей в локтевой ямке (рис. 1а и 1c). Что касается толщины хряща головки плечевой кости, то ОССГ был самым низким (≈0-2) при толщине хряща ≈0,1-0,15 см (нормальный диапазон составляет 0,04-0,18 [14]), но увеличивался, когда толщина хряща была либо меньше 0,1, либо больше 0,15 см (рис. 1b).
Рис.1 Локтевой сустав: Связь переменных обследования активности суставной ткани и повреждения с ОССГ и общей дугой в каждой временной точке. Каждый пациент имел три временные точки (начальный, средний и заключительный визит в клинику). В каждой точке времени представлена связь между показателями ОССГ и переменными JADE: a протяженность остеохондральных изменений; b толщина хряща; и c и разрастание мягких тканей локтевой ямки. В каждой временной точке представлена связь между общим количеством дуг и переменными JADE: d протяженностью остеохондральных изменений; e толщиной хряща; f разрастание мягких тканей локтевой ямки. JADE: Исследование активности и повреждения суставных тканей; ОССГ: Оценка состояния суставов при гемофилии
Изменения общей дуги происходили по аналогичной схеме. На каждом визите уменьшение общей дуги было связано с увеличением остеохондральных изменений и большим разрастанием мягких тканей (рис. 1d и 1f). Также, как и при ОССГ, общая дуга была самой высокой при толщине хряща головки плечевой кости ≈0,1-0,15 см и уменьшалась с утончением хряща (рис. 1e).
Колено
Во время каждого из трех визитов наблюдалась положительная связь между ОССГ и увеличением протяженности остеохондральных изменений в области надколенно-бедренного сустава, а также большим разрастанием мягких тканей в медиальной и латеральной впадинах (рис. 2a и 2c). Рост ОССГ также ассоциировался с уменьшением толщины хряща в пространстве надколенно-бедренного сустава по относительно линейной траектории (рис. 2b).
Рис. 2 Колено: Ассоциация переменных обследования активности и повреждения суставной ткани с ОССГ и общей дугой в каждой временной точке. Каждый пациент имел три временные точки (начальный, средний и заключительный визит в клинику). В каждой точке времени представлена связь между ОССГ и переменными JADE: a протяженность остеохондральных изменений; b толщина хряща; c расширение мягких тканей в средних латеральных и медиальных углублениях. В каждой временной точке представлена связь между общим количеством дуг и переменными JADE: d протяженностью остеохондральных изменений; e толщиной хряща; f расширением мягких тканей средней латеральной и медиальной впадины. JADE: Исследование активности и повреждения суставных тканей; ОССГ: Оценка состояния суставов при гемофилии.
Изменения общей дуги происходили по аналогичной схеме, демонстрируя почти линейную связь общей дуги с остеохондральными изменениями и расширением мягких тканей (рис. 2d и 2f). Однако для толщины хряща была заметна перевернутая U-образная форма, когда значения общей дуги были самыми высокими, когда толщина хряща была в пределах нормы (от 0,2 до 0,3 см [15]), но уменьшались, когда толщина хряща была ниже 0,2 см или выше 0,3 см. (рис. 2e).
При измерении остеохондральных изменений и толщины хряща по длинной оси на переднем и заднем отростках бедренной кости, медиально или латерально, не было обнаружено никаких ассоциаций для ОССГ или общей дуги (результаты не показаны).
Голеностопный сустав
Во время каждого визита наблюдалась положительная связь между ОССГ с увеличением протяженности остеохондральных изменений на куполе таранной кости и большим расширением капсулы в передней большеберцово-таранной впадине (рис. 3а и 3с). Что касается толщины хряща на куполе таранной кости, то ОССГ был самым низким (≈0-2) при толщине хряща ≈0,05-0,1 см, но увеличивался, когда толщина хряща была ниже 0,05 см или выше 0,1 см (рис. 3b) нормальный диапазон составляет 0,1-0,17 мм [16]).
Рис. 3 Голеностопный сустав: связь переменных обследования активности суставных тканей и повреждений с ОССГ и общей дугой в каждой точке времени. Каждый пациент имел три временные точки (начальный, средний и заключительный визит в клинику). В каждой точке времени представлена связь между ОССГ и переменными JADE: a протяженность остеохондральных изменений; b толщина капсулы; и c толщина хряща. В каждой временной точке представлена связь между общим количеством дуг и переменными JADE: d протяженностью остеохондральных изменений; e толщиной капсулы; и f толщиной хряща. JADE: Исследование активности и повреждения суставных тканей; ОССГ: Оценка состояния суставов при гемофилии
Изменения общей дуги происходили по аналогичной схеме. На каждом визите уменьшение общей дуги было связано с увеличением длины остеохондральных изменений и большим расширением капсулы (рис. 3d и 3f). Что касается ОССГ, то ухудшение общей дуги наблюдалось, когда толщина хряща была ниже 0,075 или выше 0,1 см (рис. 3e).
Обновление протокола JADE версии 2
Для локтевого и голеностопного суставов дозорные позиции не изменились по сравнению с предыдущей версией, поскольку соответствующие ассоциации остеохондральных изменений, толщины хряща и исследований мягких тканей с ОССГ и общей дугой, сделанные во время трех визитов, были согласованными.
Для коленного сустава дозорная позиция в пространстве коленного сустава по короткой оси осталась, поскольку соответствующие ассоциации остеохондральных и хрящевых исследований с ОССГ и общей дугой, выполненных во время трех визитов, были достоверными. Однако оценка переднего и заднего отростков по длинной оси не показала никаких корреляций, поэтому не была признана полезной и была изъята из протокола JADE. Соответствующие ассоциации клинического и функционального состояния сустава с измерениями расширения мягких тканей в медиальной и латеральной впадинах были согласованными и поэтому будут продолжены.
Оценка острой боли в суставах
Девятнадцать пациентов имели 33 эпизода боли (Голеностопный сустав: n = 15, локтевой сустав: n = 9, коленный сустав: n = 7, плечевой сустав: n = 1, тазобедренный сустав: n = 1), из которых 24 эпизода (72%) были связаны с кровотечением, а 9 эпизодов не были связаны с кровотечением (28%), что было подтверждено с помощью УЗОДА. Оценка УЗОДА показала, что этиология боли, которую пациент воспринимал как наличие или отсутствие гемартроза, была правильной в 20 случаях (60%). УЗОДА подтвердила, что 16/24 (66%) эпизодов кровотечения, которые пациент воспринимал как гемартроз, действительно были гемартрозами, тогда как отсутствие гемартроза было подтверждено для 4/9 (44%) эпизодов, которые пациент воспринимал как такие, которые не сопровождались кровотечением.
Обсуждение
В этой когорте ассоциации между внутрисуставными структурными исследованиями по протоколу JADE с клиническими показателями ОССГ и общей дугой в кровоточащих суставах (локтевых, коленных и голеностопных) были воспроизведены при каждом визите. Перекрестные оценки были последовательными в течение достаточно длительного времени (период исследования в среднем составлял чуть более полутора лет), в течение которого ожидаются изменения состояния суставов у стареющих ЛСГ [17]. Более того, согласованность сохранялась, несмотря на широкий спектр суставных проявлений при гемофилии, о чем свидетельствует значительный диапазон ОССГ.
Ранее мы уже сообщали об ассоциации JADE с клиническим параметром (ОССГ) и функциональной оценкой (общая дуга) артропатии при гемофилии во время начального визита в этой когорте [4]. Анализ, представленный здесь, добавляет согласованность этих ассоциаций во время трех визитов в клинику в течение 1-3 лет в той же когорте. В частности, во время каждого визита ухудшение показателей ОССГ и общей дуги коррелировало с остеохондральными изменениями и расширением мягких тканей, измеренными с помощью ПМП УЗОДА, в ожидаемом направлении. Однако и в локтевом, и в коленном суставах наблюдалась U-образная кривая зависимости ОССГ от толщины хряща. Общая дуга увеличивалась с увеличением толщины хряща, достигая плато для локтевого и голеностопного суставов, а для коленного сустава она уменьшалась с увеличением толщины хряща. Когда толщина хряща измерялась в пределах или близко к нормальному диапазону, показатели ОССГ были самыми низкими, а показатели общей дуги – самыми высокими, то есть здоровье суставов было наилучшим. По сравнению со здоровыми людьми, пациенты с остеоартрозом могут иметь изменения хряща в обоих направлениях (“истончение” и “утолщение”), что обнаруживается с помощью магнитно-резонансной томографии [18]. Утолщение или гипертрофия хряща может происходить до потери хряща, что наблюдается на более поздних стадиях. В исследованиях на животных увеличение толщины хряща может отражать дегенеративный артрит, включая синтез матрикса de novo, гипертрофию хряща и синовии и/или фиброз [19]. Здесь мы наблюдали не только истончение хряща (как ожидалось), но и утолщение хряща, оба из которых были связаны с ухудшением состояния здоровья суставов. Мы предполагаем, что эти изменения могут представлять различные стадии остеоартроза в кровоточащих суставах, что обусловливает необходимость проведения больших долговременных исследований для определения связанных с ними качественных структурных изменений, таких как потеря прозрачности хряща и повышение его эхогенности [20].
Исходя из этих результатов, очевидно, необходимы новые исследования для изучения ультрасонографических особенностей утолщения хряща, эхогенных и структурных изменений в кровоточащих суставах в связи с состоянием здоровья и функцией суставов, включая корреляцию с визуальными и гистологическими исследованиями живых суставных эксплантатов или трупов.
Обнаруженные в этой когорте серийные кросс-секционные ассоциации прямых измерений тканей с помощью УЗОДА с ОССГ и/или общей дугой являются еще одним шагом вперед в процессе валидации протокола JADE в итеративной манере. Обновленная версия 2 протокола JADE (2-е издание, дополнение 2) была разработана путем изъятия нескольких позиций датчика для коленного сустава, которые должны были обеспечить изображение целостности костно-хрящевой ткани на медиальном и латеральном переднем и заднем мыщелках. Эти снимки были удалены из-за отсутствия связи с клиническими и функциональными параметрами здоровья сустава. В противоположность этому, измерение хряща в надколенно-бедренном пространстве выявило связь с ОССГ и общей дугой во время каждого визита. На основе этих корректировок, новая версия JADE 2, ориентированная на прямые измерения тканей, включает 3 ракурса локтевого сустава, 3 ракурса коленного сустава (ранее было 7) и 2 ракурса голеностопного сустава. Дополнительные ракурсы, позволяющие качественно оценить другие аномалии опорно-двигательного аппарата, включая (кровянистые) выпоты, остались без изменений.
Получение изображения, включая измерения, является быстрым и занимает всего ≈1-2 мин на один осмотр. Таким образом, после удаления посторонних ракурсов коленного сустава, JADE версии 2 является более компактным и упрощенным инструментом для амбулаторной визуализации коленного сустава. УЗОДА, используя изображения протокола JADE для оценки суставных впадин, оказался также ценным инструментом для оценки возникновения гемартроза во время болевых эпизодов в суставах. Это представляется клинически ценным, учитывая ненадежность симптомов, связанных с гемартрозом, которые воспринимаются пациентами [21, 22], что привело к частому использованию УЗОДА по этому показанию в клиниках гемофилии [23].
К ограничениям исследования можно отнести 1) отсутствие возможности применения у детей, 2) неспособность УЗОДА очертить глубокие суставные структуры, 3) осведомленность на счет проведения исследования врачей, выполняющих УЗОДА, на ОССГ и общую дугу, 4) неспособность ПМП УЗОДА обеспечить полную диагностическую ультразвуковую оценку из-за ограниченных дозорных позиций, и 5) отсутствие обобщения для внешних групп населения. Кроме того, исследование предполагает, что изменения структур суставной ткани в основном связаны с последствиями кровотечения вызванного гемофилией. Вовлечение раннего остеоартроза или кристаллического артрита представляется маловероятным, учитывая молодой возраст когорты (средний возраст = 36 лет). Так же маловероятным представляется наличие воспалительного/ревматоидного артрита, исходя из отсутствия их клинических характеристик.
Выводы
Это исследование продемонстрировало, что серийные кросс-секционные взаимосвязи между непосредственными измерениями тканей, сделанными с помощью ПМП УЗОДА с использованием протокола JADE, и результатами состояния здоровья суставов были воспроизведены в трех случаях, разделенных многими месяцами, для 8 из 12 дозорных положений датчика, использовавшихся для измерений в голеностопных, локтевых и коленных суставах. Результаты состояния суставов не ограничивались клиническими оценками ОССГ, но также включали функциональные оценки (общая дуга) как важный параметр для повседневной мобильности. Исследования тканей включали разрастание мягких тканей (синовиальных) в суставных впадинах, а также остеохондральные изменения и толщину хряща. Стремление доказать ценность позиций (ракурсов) датчика через повторяющиеся ассоциации с клиническими и функциональными параметрами с течением времени привело к исключению 4 ракурсов из протокола JADE, в то же время усиливая обоснованность остальных 8 ракурсов. Эти 8 позиций (3 для локтевого сустава, 3 для коленного сустава, 2 для голеностопного сустава) должны обеспечить быстрое проведение объективных и клинически/функционально значимых измерений суставной ткани в клинической практике.
Таким образом, эти результаты способствуют валидации протокола JADE на нескольких уровнях и позволили провести итеративные адаптации, в результате которых появилась версия 2 протокола JADE, прилагаемая к этой рукописи.
Аббревиатуры
УЗОДА:
Протокол ультразвукового исследования опорно-двигательного аппарата
ПМП:
Пункт оказания медицинской помощи
ОССГ:
Клиническая оценка состояния суставов при гемофилии
JADE:
Исследование активности и повреждения тканей суставов
ИКР:
Интерквартильный размах
ЛСГ:
Люди с гемофилией
ДД:
Диапазон движений
Ссылки на источники
- Volland LM, Zhou JY, Barnes RFW, Kruse-Jarres R, Steiner B, Quon DV, et al. Development and Reliability of the Joint Tissue Activity and Damage Examination for Quantitation of Structural Abnormalities by Musculoskeletal Ultrasound in Hemophilic Joints. J Ultrasound Med. 2019;38(6):1569–81.
- Tugwell P, Boers M, Brooks P, Simon L, Strand V, Idzerda L. OMERACT: an international initiative to improve outcome measurement in rheumatology. Trials. 2007;8:38.
- von Drygalski A, Moore RE, Nguyen S, Barnes RFW, Volland LM, Hughes TH, et al. Advanced Hemophilic Arthropathy: Sensitivity of Soft Tissue Discrimination With Musculoskeletal Ultrasound. J Ultrasound Med. 2018;37(8):1945–56.
- Mesleh Shayeb A, Barnes RFW, C. H, Aguero P, Steiner B, Bailey C, et al. Quantitative measurements of haemophilic joint tissues by point-of-care musculoskeletal ultrasound: Associations with clinical and functional joint outcome parameters. Haemophilia. 2021; 27:866-75.
- St-Louis J, Abad A, Funk S, Tilak M, Classey S, Zourikian N, et al. The Hemophilia Joint Health Score version 2.1 Validation in Adult Patients Study: A multicenter international study. Res Pract Thromb Haemost. 2022;6(2):e12690.
- Poonnoose PM, Hilliard P, Doria AS, Keshava SN, Gibikote S, Kavitha ML, et al. Correlating clinical and radiological assessment of joints in haemophilia: results of a cross sectional study. Haemophilia. 2016;22(6):925–33.
- Chapleau J, Canet F, Petit Y, Laflamme GY, Rouleau DM. Validity of goniometric elbow measurements: comparative study with a radiographic method. Clin Orthop Relat Res. 2011;469(11):3134–40.
- Peters PG, Herbenick MA, Anloague PA, Markert RJ, Rubino LJ 3rd. Knee range of motion: reliability and agreement of 3 measurement methods. Am J Orthop (Belle Mead NJ). 2011;40(12):E249–52.
- Brockett CL, Chapman GJ. Biomechanics of the ankle. Orthop Trauma. 2016;30(3):232–8.
- Nguyen S, Lu X, Ma Y, Du J, Chang EY, von Drygalski A. Musculoskeletal ultrasound for intra-articular bleed detection: a highly sensitive imaging modality compared with conventional magnetic resonance imaging. J Thromb Haemost. 2018;16(3):490–9.
- Tabachnick B, Fidell L. Using Multivariate Statistics. 6th ed. Boston, MA: Pearson; 2013.
- Shoukri M, Chaudhary M. Analysis of correlated data with SAS and R. Boca Raton, FL: Chapman & Hall/CRC; 2007.
- Kleinbaum D, Kupper L, Nizam A, Muller K. Applied regression analysis and other multivariable methods. Belmont, CA: Thomson Brooks/Cole; 2008.
- Giannicola G, Spinello P, Scacchi M, Gumina S. Cartilage thickness of distal humerus and its relationships with bone dimensions: magnetic resonance imaging bilateral study in healthy elbows. J Shoulder Elbow Surg. 2017;26(5):e128–36.
- Bedewi MA, Elsifey AA, Naguib MF, Saleh AK, Nwihadh NB, Abd-Elghany AA, et al. Sonographic assessment of femoral cartilage thickness in healthy adults. J Int Med Res. 2020;48(8):300060520948754.
- Adam C, Eckstein F, Milz S, Putz R. The distribution of cartilage thickness within the joints of the lower limb of elderly individuals. J Anat. 1998;193:203–14.
- Manco-Johnson MJ, Kempton CL, Reding MT, Lissitchkov T, Goranov S, Gercheva L, et al. Randomized, controlled, parallel-group trial of routine prophylaxis vs. on-demand treatment with sucrose-formulated recombinant factor VIII in adults with severe hemophilia A (SPINART). Journal of Thrombosis and Haemostasis. 2013;11(6):1119-27.
- Buck RJ, Wyman BT, Le Graverand MP, Hudelmaier M, Wirth W, Eckstein F, et al. Osteoarthritis may not be a one-way-road of cartilage loss–comparison of spatial patterns of cartilage change between osteoarthritic and healthy knees. Osteoarthritis Cartilage. 2010;18(3):329–35.
- Adams ME, Brandt KD. Hypertrophic repair of canine articular cartilage in osteoarthritis after anterior cruciate ligament transection. J Rheumatol. 1991;18(3):428–35.
- Lee CL, Huang MH, Chai CY, Chen CH, Su JY, Tien YC. The validity of in vivo ultrasonographic grading of osteoarthritic femoral condylar cartilage: a comparison with in vitro ultrasonographic and histologic gradings. Osteoarthritis Cartilage. 2008;16(3):352–8.
- Ceponis A, Wong-Sefidan I, Glass CS, von Drygalski A. Rapid musculoskeletal ultrasound for painful episodes in adult haemophilia patients. Haemophilia. 2013;19(5):790–8.
- Berro M, Elichiry M, Wasen K, Insagaray J, Rodriguez I. Use of ultrasound for evaluation of painful joint episodes perceived as haemarthrosis in adult patients with severe haemophilia. Haemophilia. 2018;24(3):e124–5.
- Ignas DM, Doria AS, von Drygalski A, Blanchette VS, Chang EY, Dover S, et al. Use of ultrasound for assessment of musculoskeletal disease in persons with haemophilia: Results of an International Prophylaxis Study Group global survey. Haemophilia. 2020;26(4):685–93.