Ключевые слова: Пренатальная диагностика, Врожденные пороки сердца, Аритмия плода, Гидропсия, Кардиомиопатия
Аббревиатуры
2D = двумерный
3СТ = Трехсосудисто-трахеальный срез
3СC = Трехсосудистый срез
ААС = Американская ассоциация сердца
АИУМ = Американский институт ультразвука в медицине
СОКЛА = Синдром отсутствия клапана легочной артерии
АОЭ = Американское общество эхокардиографии
АВ = Атриовентрикулярный
ВПС = Врожденный порок сердца
CW = Непрерывно-волновой
d-ТМА = D-транспозиция магистральных артерий
ТЦД = Тканевая цветная допплерография
СГЛОС = Синдром гипоплазии левых отделов сердца
НПВ = Нижняя полая вена
l-ТМА = L-транспозиция магистральных артерий
ЛЖ = Левый желудочек
МИ = Механический индекс
PW = Импульсно-волновой
ПЖ = Правый желудочек
ЕЖ = Единый желудочек
ВПВ = Верхняя полая вена
ТИ = Тепловой индекс
ТФ = Тетрада Фалло
ТК = Трикуспидальный клапан
БТК = Болезнь трикуспидального клапана
ДМЖП = Дефект межжелудочковой перегородки
ИСП = Интеграл линейной скорости потока
I. ВСТУПЛЕНИЕ
В 2004 году Американское общество эхокардиографии (АОЭ) опубликовало руководство и стандарты выполнения эхокардиографии плода.1 Авторская группа, созданная по заказу Педиатрического совета АОЭ, провела обзор медицинской литературы, а также обобщила консенсус экспертов, чтобы создать документ, который был крайне необходим и служил сообществу эхокардиологов плода и детей в течение почти двух десятилетий. Однако эта отрасль продолжает стремительно развиваться, и со времени этой публикации появилось много новой информации.
За последние 5 лет несколько профессиональных групп, включая Американскую ассоциацию сердца (ААС)2, Международное общество ультразвука в акушерстве и гинекологии 3 и Американский институт ультразвука в медицине (АИУМ)4, опубликовали обновленные руководства и стандартные документы по оценке состояния сердца плода. Со времени публикации документа АОЭ в 2004 году многое из того, что было изучено, объясняется интенсивным стремлением к междисциплинарному сотрудничеству, объединением многоцентровых данных и опыта узких специалистов, включая детских кардиологов, радиологов, акушеров, специалистов по медицине матери и плода и врачей-сонографов, которые являются важными участниками ухода за плодами с сердечно-сосудистыми заболеваниями. Постоянные исследования и сотрудничество поддерживают усилия, направленные на лучшее понимание физиологии плода, а также процессов развития и прогрессирования заболеваний. Это привело к значительным улучшениям в визуализации плода, клинической практике и результатах лечения пациентов.
Учитывая, что будущее фетальной кардиологии связано с междисциплинарным сотрудничеством 5, появилась новая информация, которую следует обобщить и изложить в пересмотренном заявлении АОЭ, чтобы поддерживать лучшие практики по эхокардиографии плода, фетальной и перинатальной сердечно-сосудистой помощи в различных областях медицины. Целью этого документа является предоставление обновленных рекомендаций по выполнению и интерпретации эхокардиографии плода при выявлении, классификации, оценке риска и планировании перинатального ухода за беременностью, в которой плод имеет сердечно-сосудистые заболевания. Этот документ заменяет упомянутое выше руководство АОЭ 2004 года.
II. ПОКАЗАНИЯ
Показания к проведению эхокардиографии плода (Таблица 1), золотого стандартного теста для диагностики врожденных пороков сердца (ВПС) у плода, менялись в течение многих лет. Обсуждение в этом разделе касается качества и чувствительности пренатального ультразвукового скрининга сердечных аномалий, базового или детального акушерского анатомического ультразвукового исследования, которое выполняется во втором триместре беременности. Как и в случае с большинством скрининговых тестов, базовое или детальное анатомическое УЗИ для выявления врожденной аномалии предлагается популяции здоровых людей с низкой вероятностью заболевания. Однако, в отличие от других медицинских скрининговых тестов, существует огромная региональная вариабельность результатов акушерского анатомического УЗИ как скринингового инструмента для выявления ВПС. Таким образом, решение о показаниях для направления на эхокардиографию плода является сложной задачей на уровне населения и политики здравоохранения. При обсуждении вопросов выявления заболеваний в рамках популяционной системы здравоохранения полезно понимать, что рекомендация по направлению на окончательное тестирование зависит как от уровня заболеваемости в популяции, подлежащей скринингу, так и от результатов скринингового теста.
Достоверно оценить индивидуальный базовый риск ВПС на основе факторов у беременной и/или плода достаточно сложно. В США популяционные оценки даже общей частоты ВПС плода не являются четкими из-за отсутствия данных о прерывании беременности и гибели плода, а также из-за отсутствия стандартизированной регистрации данных в пренатальном периоде. Таким образом, большинство популяционных оценок ВПС основываются на записях о рождении и являются оценками распространенности, которые колеблются от 0,3% до 1,2%.13 В большинстве ситуаций направление на эхокардиографию плода рекомендуется тогда, когда вероятность ВПС плода превышает примерно в 3 раза фоновый популяционный риск, или >1%. Пациенты с вероятностью заболевания ниже фонового уровня после нормальных результатов скринингового ультразвукового исследования не требуют дополнительного обследования с использованием эхокардиографии плода, но постскрининговая вероятность зависит как от дотестовой вероятности ВПС плода, так и от чувствительности и специфичности примененного метода скрининга (Рисунок 1). Если скрининг указывает на сердечную аномалию, существует высокая вероятность того, что результаты эхокардиографии плода будут ненормальными, а следовательно, эхокардиографию плода необходимо выполнить для подтверждения и уточнения диагноза. Однако, где установить порог для направления на эхокардиографию плода, несмотря на нормальные результаты скрининга, зависит от того, насколько хорошо выполняется скрининговое ультразвуковое исследование в конкретной общине и от толерантности к пропущенным диагнозам. За последнее десятилетие стандартные акушерские рекомендации по кардиологическому скринингу расширились с четырехкамерного изображения до изображения обоих путей оттока 3 , а также трехсосудистого среза (3СС) и трехсосудисто-трахеального среза (3СТ), когда это технически возможно. 15 Получение дополнительных видов увеличивает чувствительность акушерского кардиоскрининга,16 но местная практика и опыт влияют на степень улучшения. Наличие определенных факторов риска (материнских, плодовых и/или семейных) может повысить дотестовую вероятность ВПС у потомков настолько, что эхокардиография плода рекомендуется независимо от нормальных результатов акушерского ультразвукового исследования. Практические схемы могут отличаться в зависимости от региональных оценок чувствительности и специфичности выявления ВПС с помощью акушерского ультразвука в конкретном регионе или общине, а также от соображений экономической эффективности и распределения ресурсов, как описано ниже. Дополнительными важными факторами могут быть система здравоохранения, проблемы со страхованием и имеющиеся ресурсы, которые могут усилить существующие диспропорции в здравоохранении и доступ к медицинской помощи, а также навыки операторов скрининга, требования к непрерывному образованию и оценке навыков, а также доступ к ним. В ситуациях, когда эхокардиография плода является ограниченным ресурсом или существует повышенный риск, связанный с поездкой пациента для проведения эхокардиографии плода, можно использовать систему сортировки, которая учитывает местные показатели выявления скрининга, например, описанную в руководствах АОЭ по коронавирусной болезни 2019 года 17. Если есть возможность, следует рассмотреть использование телемедицины.
Таблица 1 Потенциальные показания для проведения эхокардиографии плода
| Источник | Рекомендация АОЭ 2023 | Рекомендация АИУМ 2020 | Рекомендация ААС 2014* |
| Материнские факторы (Абсолютный Риск) | |||
| Сахарный диабет до беременности (3%-5%) | Указано | Указано | І (Указано) |
| Сахарный диабет, выявленный после второго триместра (<1%) | Не указано | Не указано | III (нет пользы) |
| Фенилкетонурия (12%-14%) | Указано | Указано | І (Указано) |
| Аутоиммунное заболевание: SSA/SSB положительное (1%-5%)‡ | Указано | Указано | ІІа (наверное, указано) |
| Экстракорпоральное оплодотворение (1.1%-3.3%) | Может быть рассмотрено§ | Указано | ІІа (наверное, указано) |
| Материнская Инфекция: Краснуха (3%-4%) | Указано | Указано | І (Указано) |
| Семейный анамнез ВПС: родственник первой степени родства
(3%-20%){ |
Указано | Указано | І (Указано) |
| Семейный анамнез ВПС: родственник второй степени родства или
более дальний родственник (<2%)k |
Не указано | Может быть указано | ІІb (наверное, указано) |
| Ожирение (ИМТ > 30 кг/м²) (1-2%) | Не указано | Не указано | — |
| Ретиноиды (8%-20%) | Указано | Указано | І (Указано) |
| Ингибиторы АПФ (3%) | Может быть рассмотрено§ | Может быть указано | ІІа (наверное, указано) |
| Пароксетин (3%) | Может быть рассмотрено§ | Может быть указано | ІІb (наверное, указано) |
| Другие избирательные ингибиторы обратного захвата серотонина (1%-2%)6,7 | Не указано | Не указано | III (нет пользы) |
| Противоэпилептические препараты (1%-2%) | Не указано | Может быть указано | ІІb (можливо Указано) |
| Литий (1%-2%) | Не указано | Может быть указано | ІІb (можливо Указано) |
| Варфарин (<1%)8 | Не указано | Не указано | III (нет пользы) |
| Фетальные факторы, выявленные во время скрининга (абсолютный риск) | |||
| Фетальный гидропс (15%-20%)9 | Указано | Указано | І (Указано) |
| Внесердечная аномалия (20%-45%)10,11 | Указано | Указано | І (Указано) |
| Хромосомные аномалии (10%-90%) | Указано | Указано | І (Указано) |
| Монохорионическая двойня (2%-10%) | Указано | Указано | І (Указано) |
| Затылочная прозрачность плода 3.0-3.4 мм (3%) | Может быть рассмотрено§ | Может быть указано | ІІа (наверное, указано) |
| Затылочная прозрачность плода ≥3.5 мм (6%-60%) | Указано | Указано | І (Указано) |
| Единственная пупочная артерия в изоляции (1.2%-1.8%)12 | Не указано | Не указано | ІІb (наверное, указано) |
АПФ – ангиотензинпревращающий фермент; ИМТ – индекс массы тела.
Эхокардиография плода показана в случае аномальных результатов скринингового ультразвукового исследования сердца независимо от дополнительных факторов риска; ниже приведены рекомендуемые показания к проведению эхокардиографии плода на основе априорного риска из ранее опубликованных руководств и этого документа. В рекомендациях “АОЭ 2023” (данный документ) классификация “не указано” предполагает нормальный результат кардиоскрининга при акушерском анатомическом сканировании во втором триместре беременности. Если не указано иное, справочные данные приведены в работе Donofrio и соавт. 2.
*Используя “классификацию рекомендаций “2 : I = процедуру следует выполнить; IIa = процедуру целесообразно выполнить; IIb = процедуру можно рассмотреть; III = вред/отсутствие пользы.
† ‘”Абсолютный риск”: базовая оценка риска ВПС независимо от результатов УЗИ.
‡ Ранее болел ребенок с полной сердечной блокадой, риск возрастает до 11%-19%.
- Решение о направлении на эхокардиографию плода, несмотря на отрицательные результаты скринингового УЗИ, должно основываться на чувствительности и специфичности выявления ВПС в местных скрининговых практиках.
{ Может составлять до 50% при генетических нарушениях с менделеевским наследованием.
k Не показан, если нет генетического заболевания с менделеевским типом наследования.
Рисунок 1 До- и послетестовая вероятность ВПС плода при нормальных результатах скринингового ультразвукового исследования. Вероятность ВПС плода на уровне ≤1% (фоновый риск) после скринингового УЗИ зависит от дотестовой вероятности ВПС плода и чувствительности и специфичности используемого метода скрининга. При использовании трехмерного метода скрининга (пунктирные линии) дотестовая вероятность ВПС плода должна составлять ≤2%, чтобы после проведения скринингового УЗИ вероятность ВПС плода снизилась до 1% (пунктирная зеленая линия). При использовании метода пятиосевого скрининга (сплошные линии), предварительная вероятность ВПС плода должна составлять ≤3%, чтобы после скрининга вероятность ВПС плода снизилась до 1% (сплошная синяя линия). При дотестовой вероятности ВПС плода 5% ни один из методов не приводит к постскрининговой ультразвуковой вероятности ВПС плода <1% (красные линии). Расчеты отрицательного отношения правдоподобия базируются на чувствительности и специфичности, о которых сообщают Bak и соавт. 14
Расходы, связанные с эхокардиографией плода по различным показаниям, также являются критически важными как для пациента, так и для системы здравоохранения. Расходы и экономическая эффективность пренатального скрининга ВПС значительно отличаются в зависимости от используемой стратегии. Опубликованные анализы экономической эффективности ВПС плода сосредоточены, в основном, на стратегиях скрининга состояний высокого риска, таких как прегестационный диабет и экстракорпоральное оплодотворение. Некоторые из них пришли к выводу, что хорошо выполненное акушерское сканирование является экономически более эффективным по сравнению с направлением таких беременных с высоким риском непосредственно на эхокардиографию плода. Однако этот вывод в значительной степени зависит от качества скринингового ультразвукового исследования и его интерпретации, а соотношение стоимости и эффективности скрининга связано с чувствительностью, специфичностью и посттестовой достоверностью, как описано выше.18,19 И наоборот, при рассмотрении популяции низкого риска многочисленные исследования показали, что высококачественное скрининговое ультразвуковое исследование, которое выполняется в общей акушерской практике, является наиболее экономически эффективным, в то время как использование универсальной эхокардиографии плода – не является таким. Включение дополнительных видов, как показано в недавнем анализе скринингового подхода с пятью видами 14 , также является экономически эффективным, поскольку повышает чувствительность при очень небольших дополнительных затратах. Таким образом, оптимальная стратегия скрининга и направления зависит от готовности общества платить за повышенную эффективность. ВПС является более распространенной и летальной, чем трисомия 21,13, для которой программы пренатального скрининга в среднем стоят от $27 000 до $78 000 за один выявленный дефект.20,21
Для сравнения, затраты на одну выявленную ВПС в среднем составляют лишь $38,000-47,000 при применении современного ультразвукового скрининга во втором триместре 22 , хотя это приводит к выявлению лишь 50%-70% случаев ВПС. Понимание компромисса между стоимостью и эффективностью скрининга ВПС в группах низкого и высокого риска и совершенствование акушерского скрининга может предоставить дополнительные доказательства для проведения эхокардиографии плода, рассмотрения альтернативных стратегий и/или сосредоточения усилий для эффективного внедрения на практике. Краткий обзор ключевых исследований в этой области приведен в Таблице 2.
Таблица 2 Обобщение основных исследований экономической эффективности скрининга на ВПС в условиях стандартного риска и определенных состояний высокого или промежуточного риска
| Автор и год | Популяция | Сравнительные стратегии | Показатель эффективности | Выводы | Рассуждения |
| Odibo и соавт. (2006)18 | Прегестационный диабет | 1. Без ЭКГП | QALYs | Селективная ЭКГП после патологического сканирования наиболее экономически эффективна Модель предполагает детальную анатомическую диагностику Чувствительность сканирования 61% и специфичность 99% Вероятность прерывания 50% Проведен анализ чувствительности | |
| Chung и соавт. (2021)23 | Экстракорпоральное оплодотворение | 1. Селективная ЭКГП после аномального сканирования 2. ЭКГП только для ИКСИ 3. ЭКГП для всех ЭКО | QALYs | Только селективная ЭКГП после аномального сканирования была экономически эффективной
Те же самые предположения относительно УЗИ выше Чувствительность ЭКГП предполагается 88%. |
ICER для (2) и (3) от $2 млн до $5 млн за QALY |
| NHS (2008)24 | Беременности со стандартным риском | 1. Стандартный четырехкамерный срез 2. Четырехкамерный срез + вид на отток | QALYs | На 33% больше ВПС выявлено $24 000 на QALY для оттока
Предполагается 36% выявленных с d-ТМА |
|
| Pinto и соавт. (2014)22 | Беременности со стандартным риском | 1. Стандартный четырехкамерный срез 2. четырехкамерный срез + вид на отток 3. Ярусная с ЗПП 4. Четырехкамерный + вид на отток, выполненный ММП 5. Универсальный ЭКГП | ВПС обнаружено | Четырехкамерный + отток с направлением в ММП является наиболее экономически эффективным
Для дополнительных $580 за обнаруженный ВПС, четырехкамерный + отток с направлением в кардиологию увеличил выявление ВПС на 13%. |
Предполагаемая АК чувствительность 67% Скрининг ММП 77% ЭКГП ММП 80% Кардиологическая ЭКГП 94% |
| Bak и соавт. (2020)14 | Беременности со стандартным риском | 1. Три сердечных среза 2. Пять срезов 3. Шесть срезов 4. Пять аксиальных срезов | QALYs | ICER для пяти осевых видов по сравнению с тремя видами составил 35 000 на QALY Модель предположила затраты на дополнительный вид $10
Чувствительность Три среза: 44% Пять срезов: 55% Шесть срезов: 67% Пять осевых срезов: 66% |
ЭКГП: 94% |
ЭКГП, эхокардиография плода; ICER, инкрементное соотношение затрат и эффективности; Hgb A1c, гликированный гемоглобин; ИКСИ, интрацитоплазматическая инъекция сперматозоидов; ЭКО, экстракорпоральное оплодотворение; ММП, специалист по медицине матери и плода; ЗПП, затылочная прозрачность плода в 10-14 недель; АК, акушерский; QALY, количество качественных лет жизни.
На основе этой информации факторы риска матери и плода с сопутствующим абсолютным риском ВПС у плода представлены в Таблице 1; также включены консенсусные рекомендации по направлению на эхокардиографию плода, а также сравнение с опубликованными рекомендациями других организаций, включая АИУМ 4 и ААС.2 Опять же, эхокардиография плода показана, если результаты скринингового УЗИ сердца являются аномальными, независимо от дополнительных факторов риска, поскольку риск истинной ВПС приближается к 40% до 70% в этих случаях.25
Ключевые моменты
- Эхокардиография плода показана при получении аномальных результатов скринингового УЗИ сердца независимо от наличия или отсутствия дополнительных факторов риска.
- Существует широкая вариабельность в выполнении акушерского ультразвукового исследования в среднем сроке беременности. Таким образом, целесообразно продолжать текущую стратегию включения как материнских, так и плодовых факторов риска в решение о направлении на эхокардиографию плода, даже если базовое или детальное акушерско-анатомическое сканирование выглядит нормальным.
- В ситуациях, когда эхокардиография плода является ограниченным ресурсом или проведение исследования связано с повышенным риском, может быть рассмотрена система сортировки, которая учитывает местные показатели выявления скрининга и возможность использования телемедицины.
III. ЭХОКАРДИОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ ПЛОДА
Конкретные требования к обучению и поддержанию компетентности выходят за рамки этого документа. Однако, рекомендации были разработаны Американским колледжем кардиологов совместно с ААС и АОЭ и одобрены нашей группой.1 ААС 2 рекомендует, чтобы “только хорошо подготовленные или опытные детские кардиологи, специалисты по медицине матери и плода, акушеры или радиологи, которые приобрели соответствующую базу знаний и навыков, могли контролировать и выполнять эхокардиограммы плода”, а также чтобы постоянные усилия по улучшению качества были задокументированы.
A. Время обследования, оборудования и хранения изображений
Время. Оптимальным сроком для проведения комплексной трансабдоминальной эхокардиографии плода является 18-22 недели гестации. Достижения в ультразвуковых технологиях позволили проводить оценку сердца плода уже на 12-14 неделе беременности.26 Такие ранние исследования особенно подходят для плодов с высоким риском развития сердечных аномалий. Раннее сканирование следует повторить позже во втором триместре, даже если первоначальные результаты визуализации являются нормальными.27 Серийная оценка аномалий сердца обычно проводится с интервалом от 2 до 8 недель (в зависимости от поражения и клинических проблем) примерно до 34-36 недель беременности. Оценка сердца плода ближе к сроку беременности предназначена для ситуаций, в которых результаты могут повлиять на немедленное постнатальное ведение, например, оценка ущемления предсердий при d-транспозиции магистральных артерий (d-ТМА) или синдроме гипоплазии левых отделов сердца (СГЛОС). Если результаты эхокардиографии плода в среднем триместре являются нормальными, дальнейшая оценка, как правило, не требуется, однако рекомендуется проводить ее с интервалом до 2-4 недель, если есть беспокойство относительно развития прогрессирующего поражения сердца, такого как кардиомиопатия, обструкция левых отделов сердца или значительный стеноз клапана или регургитация. Точный интервал наблюдения должен определяться командой кардиологов и акушеров, которые ведут пациентку, поскольку прогрессирование заболевания может повлиять на внутриутробный уход, сроки родов и послеродовое ведение пациентки.
Оборудование. Ультразвуковые системы, используемые для эхокардиографии плода, должны иметь высокое пространственное и временное разрешение, учитывая малый размер быстро бьющегося сердца плода. Трансабдоминальное сканирование является стандартом, за исключением очень ранних сроков беременности. Криволинейные датчики являются наиболее часто используемым типом датчиков ввиду широкого обзора ближнего поля и почти параллельных ультразвуковых пучков; эти датчики специально разработаны для трансабдоминального сканирования и являются лучшими для исследования сердца плода, хотя могут использоваться линейные и секторные датчики. Частотный диапазон датчика должен составлять 2-7 МГц для сканирования в конце второго и третьего триместра, в то время как для сканирования в конце первого и в начале второго триместра может быть полезным датчик с частотным диапазоном 5-12 МГц. Технологические возможности должны включать двумерный (2D; В-режим), М-режим, цветной поток и импульсно-волновой (PW) допплеровский ультразвук как минимальные требования. Непрерывно-волновой (CW) допплеровский ультразвук может быть использован для характеристики высоких скоростей потока, если он доступен. Такие параметры, как частота, гармоники, ширина сектора и глубина, должны регулироваться для максимизации частоты кадров и поперечного разрешения на требуемой глубине.
Хранение. Ниже приведена адаптированная версия практических параметров АИУМ по документированию ультразвукового исследования28 и стандартов и рекомендаций Межобщественной аккредитационной комиссии по аккредитации детской эхокардиографии (published June 1, 2017, revised April 27,2018; https://intersocietal.org/wp-content/uploads/2021/10/IAC PediatricEchocardiographyStandards2017.pdf).
Эхокардиографические исследования плода должны включать как неподвижные, так и подвижные изображения, сопровождаемые структурированным отчетом. Необходимые видеозаписи включают, но не ограничиваются следующим:
- Осевая развертка от желудка до верхнего средостения, включая срез четырех камер, артериальных путей оттока, а также срез магистральных сосудов и дуги.
- Четырехкамерный срез: 2D и цветное допплеровское ультразвуковое исследование
- Вид выходного тракта левого желудочка (ЛЖ): 2D и цветное допплеровское ультразвуковое исследование
- Вид выводного тракта правого желудочка (ПЖ): 2D и цветное допплеровское ультразвуковое исследование
- 3СС и 3СТ срезы: 2D и цветное допплеровское ультразвуковое исследование
- Сагиттальный срез дуг аорты и протока: 2D и цветное допплеровское ультразвуковое исследование
Изображения следует хранить в защищенном цифровом архиве, чтобы их можно было найти и просмотреть при необходимости. Рекомендации по содержанию сохраненных изображений были предоставлены АИУМ.28 Важным является соблюдение местных законодательных требований по продолжительности хранения. Приведенная ниже минимальная информация должна содержаться в метаданных и быть доступной для чтения/отображения при просмотре сохраненных изображений (для аналоговых записей идентификаторы должны присутствовать на изображении):
- Имя пациента и другая идентификационная информация
- Идентификационная информация учреждения
- Дата и время проведения ультразвукового исследования
- Стандарт отображения результатов (тепловой индекс [TИ] и механический индекс [MИ])
- Обозначение анатомической локализации и латеральности, при необходимости
- Ориентация изображения, при необходимости
B. Безопасность
Инфекционный контроль. Фетальные эхокардиографы должны придерживаться всех действующих институциональных и национальных рекомендаций по инфекционному контролю, касающихся оборудования, беременных и медицинских работников. Конкретные рекомендации могут быть адаптированы в соответствии с обстоятельствами, такими как пандемия коронавирусной болезни 2019 года.29
Акустические биоэффекты. На сегодняшний день не было подтверждено никаких вредных последствий, связанных с ультразвуковым исследованием сердца плода.30 Однако при эхокардиографическом исследовании плода используются различные ультразвуковые методы, включая 2D-визуализацию, PW и CW допплер, цветную допплерографию и тканевый цветной допплер (ТЦД), которые излучают энергию. Следовательно, фетальные эхокардиографы должны осознавать, что существуют теоретические соображения по безопасности применения ультразвука к развивающемуся плоду. Эффекты диагностического ультразвука можно разделить на тепловые (связанные с повышением температуры в области инсоляции) и механические (например, кавитация от расширения и сжатия или коллапс пузырьков из-за акустического давления ультразвукового луча). Ввиду этих потенциальных биоэффектов, ультразвуковые системы имеют стандарты отображения выходных данных – ТИ и МИ – для того, чтобы обеспечить руководство для врачей, которые сканируют плоды. Лица, проводящие эхокардиографию плода, должны знать о ТИ и МИ и должны ограничить выходную мощность и время экспозиции до уровня, необходимого для завершения исследования. Все эхокардиографические исследования плода должны руководствоваться принципом “настолько низкого уровня, насколько это возможно”, который влияет на способы ультразвукового исследования и продолжительность исследования.31 Различные ультразвуковые системы, даже от одного производителя, могут отличаться по выявлению МИ и ТИ.32
C. Техника обследования
Во время подготовки к исследованию пациента обычно кладут в положение лежа на спине с мягкой подушкой под головой и с небольшим наклоном верхней части туловища для повышения комфорта. Ультразвуковая система должна быть расположена таким образом, чтобы минимизировать напряжение и повторяющиеся нагрузки на руку сканирующего оператора и верхнюю часть туловища. Если габитус тела матери, а также положение и движения плода ограничивают проведение исследования, пациентке можно предложить повторное обследование в другое время, о чем следует четко указать в отчете. После установления положения плода и его правой/левой и передней/задней ориентации, проводится первичный осмотр плода для определения приблизительного срока беременности, а также для установления положения органов брюшной полости и сердечного предлежания. Следует обратить внимание на наличие или отсутствие жидкости в перикардиальном, плевральном и перитонеальном пространствах. Массу плода можно оценить во время эхокардиографии плода, на усмотрение клинической бригады.
D. Оптимизация изображения
Для оптимизации качества изображения и визуализации анатомии сердца плода во время исследования можно использовать несколько методов. Применение адекватного давления датчика и изменение положения матери – это методы, которые могут улучшить позиционирование плода и качество изображения, особенно у пациенток с ожирением и чрезмерным брюшным паникулусом. У таких пациенток может быть полезным сканирование ниже уровня паникулуса или через пупок. Настройки системы должны быть отрегулированы для поддержания высокой частоты кадров (например, сужение сектора или поля зрения, использование соответствующей глубины визуализации и сужение интересующей области цветного допплера). Поскольку частота сердечных сокращений плода обычно колеблется от 120 до 160 уд/мин, для оптимизации временного и пространственного разрешения рекомендуется поддерживать частоту кадров сканирования >30-40 Гц. Кроме того, для просмотра важных событий, происходящих при ЧСС >140 уд/мин, или для получения функциональной информации о сердце с помощью спекл-трекинга, может потребоваться еще более высокая частота кадров от 80 до 100 Гц (то есть около 40 кадров на один сердечный цикл).33 Увеличение изображения следует установить таким образом, чтобы сердце занимало примерно треть экрана, а фокусная зона изображения должна быть должным образом установлена на уровне желаемой интересующей области для достижения наилучшего возможного бокового разрешения. Сердечные перегородки следует визуализировать в ортогональных проекциях, при этом плоскости перегородок должны быть перпендикулярны к плоскости визуализации. Цветное и спектральное допплеровское исследование внутрисердечных шунтов, а также клапанной и сосудистой гемодинамики необходимо проводить под углами, коаксиальными к кровотоку, для оптимизации точности. Ультразвуковая допплерография может быть особенно полезной для получения более детальной картины кровотока, связанного с мелкими сосудистыми структурами и дефектами межпредсердной перегородки сердца. Если, несмотря на оптимизацию, визуализация остается недиагностической, пациенту может быть предложено повторное обследование в другое время, а ограничения должны быть четко указаны в отчете.
E. Стандартные срезы и плоскости визуализации
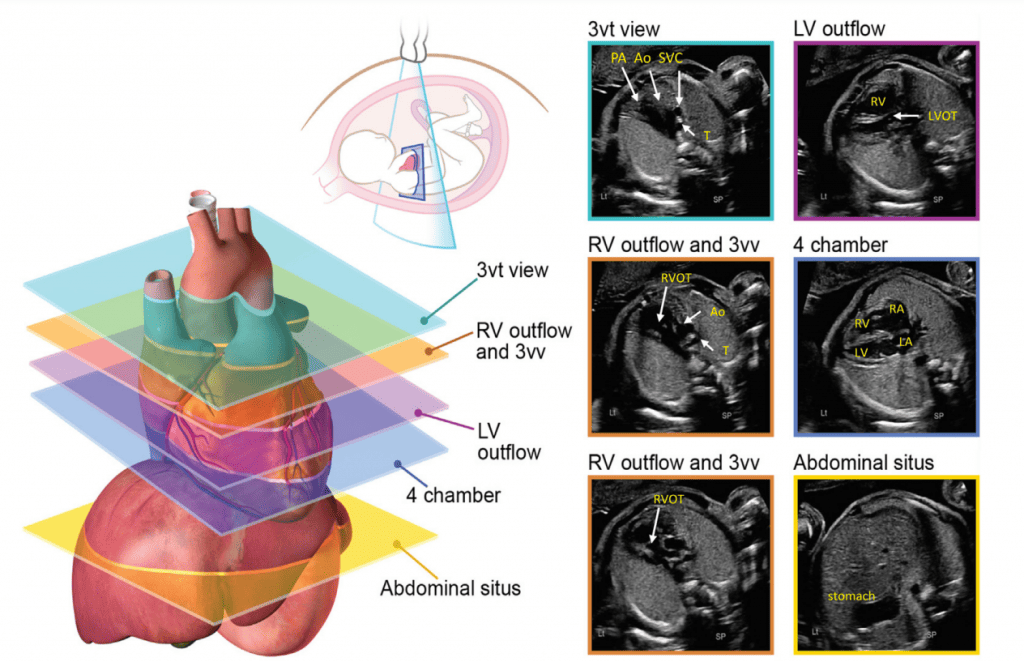
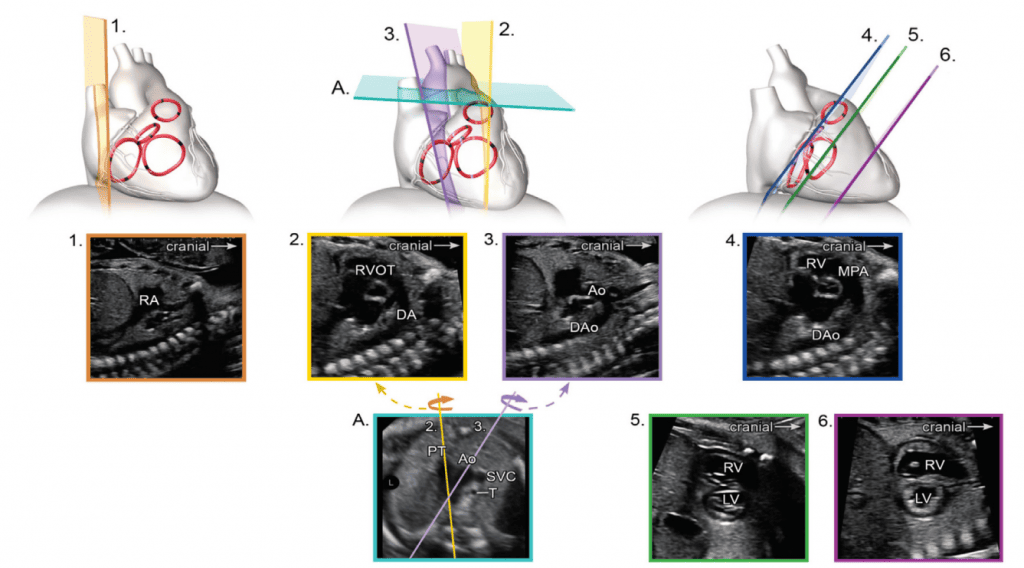
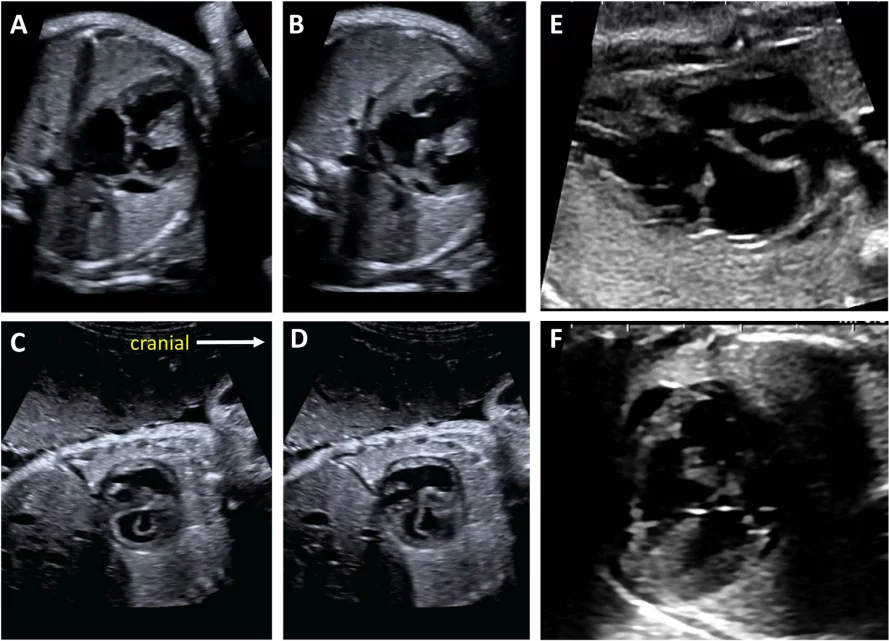
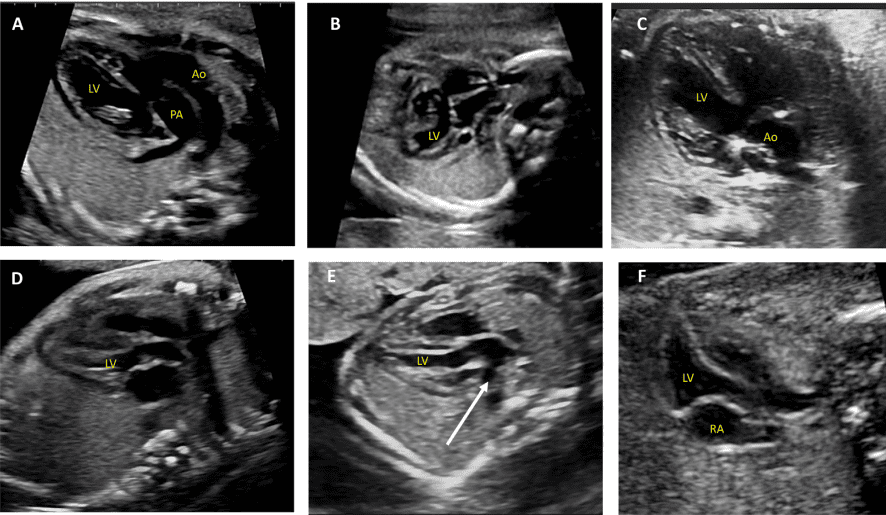
Для адекватной визуализации сердца плода необходимо использовать несколько позиций сканирования и разверток. Современные общественные рекомендации рекомендуют сочетать комплексную оценку в аксиальной плоскости с сагиттальной и парасагиттальной визуализацией целевых структур.4 На Рисунках 2 и 3 показано анатомические корреляты с плоскостями томографического изображения, которые следует использовать для оценки анатомии и функции сердца. Подробный перечень структурных элементов для полного эхокардиографического исследования плода представлен в Таблице 3, а иллюстративные примеры приведены на Рисунках 4-9.
Рисунок 2 Аксиальные плоскости, предложенные для скрининга сердца плода во время акушерского анатомического исследования и как начальная серия, полученная во время эхокардиографии плода. Обратите внимание, что на изображениях показано плод в головном предлежании; тазовое предлежание приведет к зеркальному изменению изображения, чем показано здесь. Ао – аорта; DA – артериальный проток; LV – левый желудочек; LVOT – выходной тракт левого желудочка; PA – легочная артерия; RV – правый желудочек; RVOT – выходной тракт правого желудочка; T – трахея. Перерисовано и адаптировано с разрешения Yagel и соавт. 34
Рисунок 3 Сагиттальная и парасагиттальная плоскости для эхокардиографической оценки плода. Ао – аорта; DA – артериальный проток; DAo – нисходящая аорта; LA – левое предсердие; LV – левый желудочек; MPA – главная легочная артерия; RA – правое предсердие; RV – правый желудочек; RVOT – выходной тракт правого желудочка.
Таблица 3 Рекомендуемые основные и факультативные компоненты эхокардиографической 2D визуализации плода с использованием 2D и цветного допплера
| Компонент | 2D | Цветной допплер | Другое |
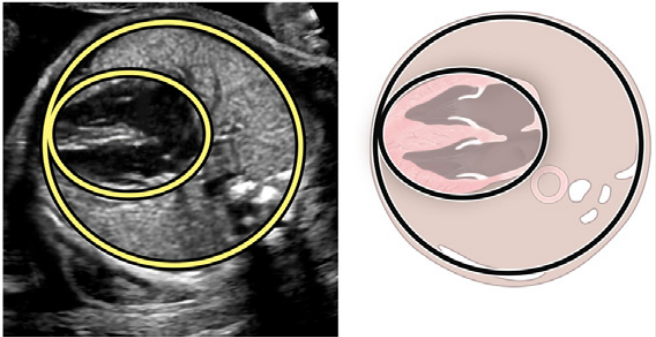
| Размер сердца | Обязательно | Нету | Обязательно: измерение соотношения сердечно-грудной площади (норма <0.34) |
| Сердечная ось (верхушка слева, справа, впереди) | Обязательно | Может быть полезным в случае сложного изображения | Необязательно: измерение оси (норма 35-65) |
| Положение сердца в грудной клетке (справа, слева) | Обязательно | Нету | |
| Определение внутренних и атриальных ситусов | Обязательно | Необязательно | |
| Анатомия/соединение системных вен | Обязательно | Обязательно | |
| Анатомия/соединение легочных вен | Обязательно | Обязательно | По крайней мере, с обеих сторон |
| Качественный размер предсердий и морфология межпредсердной перегородки | Обязательно | Обязательно | |
| АВ-соединение | Обязательно | Обязательно | |
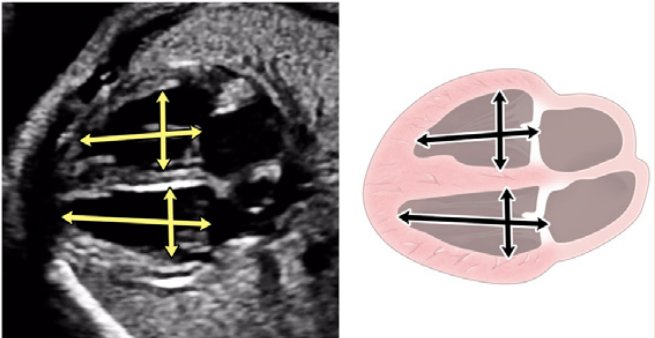
| Морфология и размеры трикуспидального и митрального клапанов (сравнение правого и левого) | Обязательно | Может быть полезным в случае сложного изображения | Обязательно: измерение анулусов трикуспидального и митрального клапанов |
| Морфология желудочков, определение петель, размеры (сравнение правого и левого) | Обязательно | Нету | Необязательно: измерение максимальной длины и ширины |
| Морфология межжелудочковой перегородки с исключением/локализацией дефекта, если присутствует | Обязательно | Обязательно | Необязательно: измерение толщины стенки |
| Желудочково-артериальные соединения | Обязательно | Обязательно | |
| Морфология и размеры легочного и аортального клапанов (сравнение правого и левого) | Обязательно | Обязательно | Обязательно: измерение размеров аортального и легочного клапанов |
| Взаимосвязь и размер магистральной артерии (со сравнением правой и левой) | Обязательно | Может быть полезным в случае сложного изображения | Необязательно: измерение восходящей аорты и главной легочной артерии |
| Морфология и размеры аорты и дуги протока (со сравнением правой и левой стороны) | Обязательно | Обязательно | Необязательно: измерение протока и аортального перешейка |
| Соотношение аорты/дуги аорты относительно трахеи | Обязательно | Обязательно | Необязательно: цветовая допплерография для аберрантной подключичной артерии |
| Проксимальные ветви правой и левой легочных артерий (разветвления) | Обязательно | Обязательно | Необязательно: измерение диаметров ветвей |
| Оценка перикардиальных или плевральных выпотов | Обязательно | Нету |
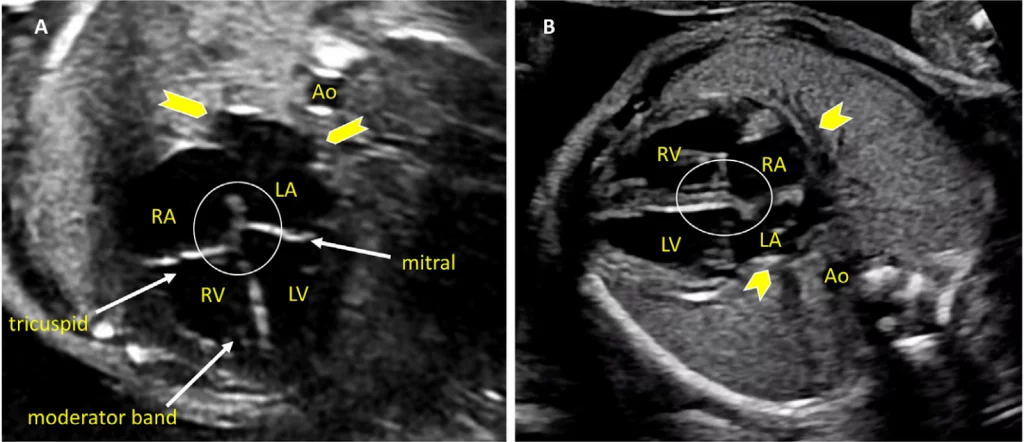
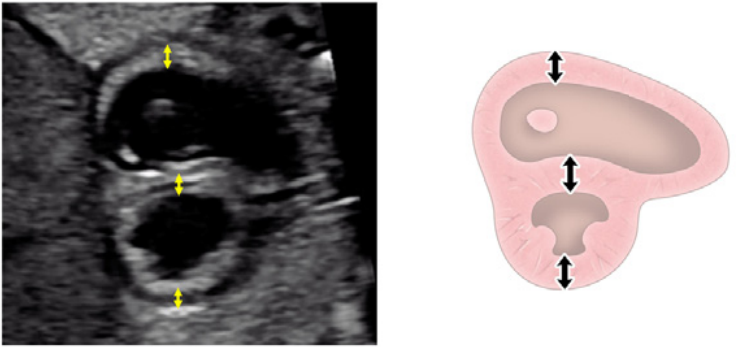
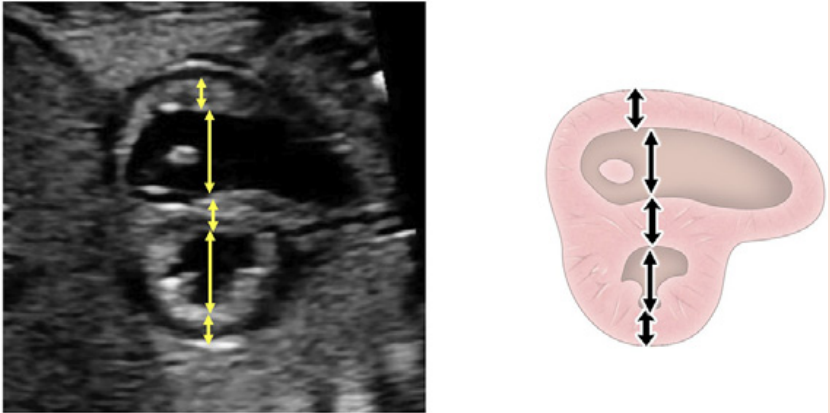
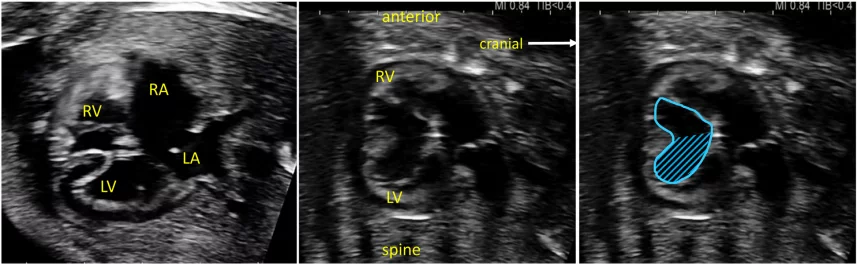
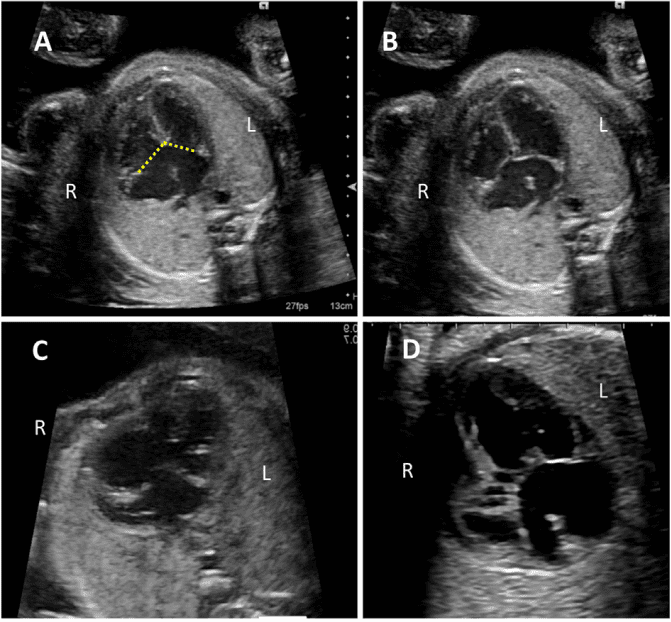
Рисунок 4 Четырехмерные аксиальные срезы в ортогональных плоскостях. Сердце плода следует исследовать как минимум из двух ортогональных плоскостей, в зависимости от размера, толщины и ориентации структуры к инсонирующему лучу. На (А) хорошо видно крест сердца (круг), трехстворчатый и митральный клапаны, но предсердно-желудочковые перегородки лучше всего видны на (В), где более четко видно створку овального отверстия (овал). Обратите внимание, что кроме “четырех камер” видны и другие структуры, в частности легочные вены (стрелки), нисходящая аорта (Ао) и срединная полоса. LA, левое предсердие; LV, левый желудочек; RA, правое предсердие; RV, правый желудочек.
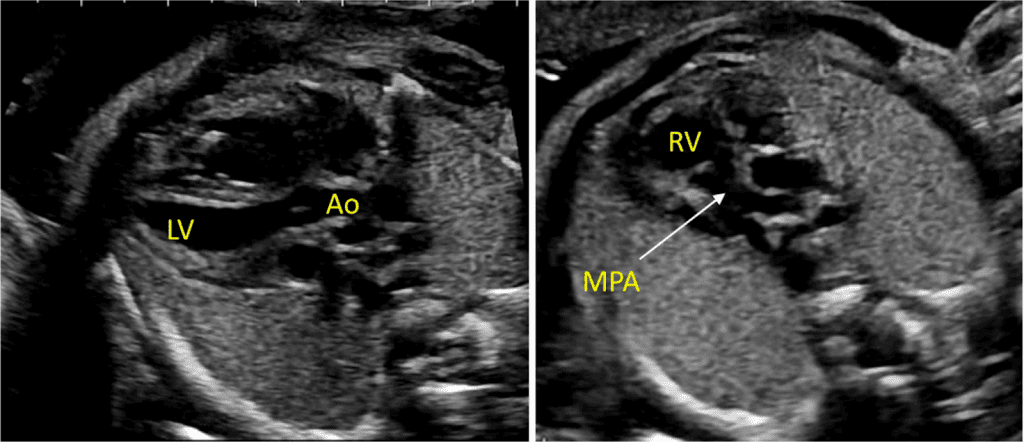
Рисунок 5 Детальная визуализация выходного тракта левого (left) и правого (right) желудочков. Желудочковая перегородка интактна на участке от левого желудочка (LV) до восходящей аорты (Ao) в выходном тракте левого желудочка, или “продольном” срезе, и отток ПЖ, легочный клапан и бифуркация ветви легочной артерии дистальнее главной легочной артерии детально визуализируются на этом срезе. Аортальный и легочный клапаны видны в закрытом положении как тонкие, недиспластические структуры.
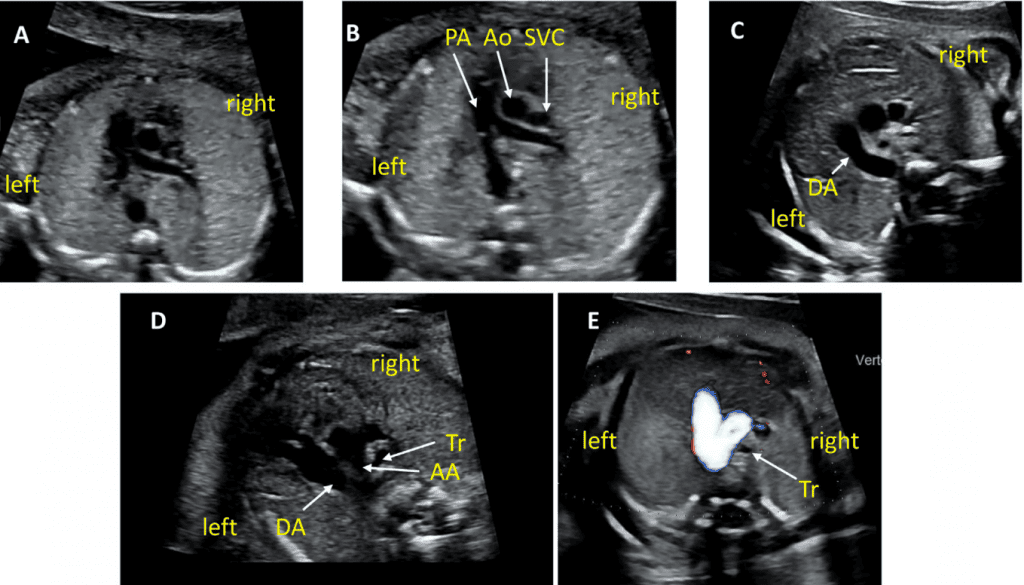
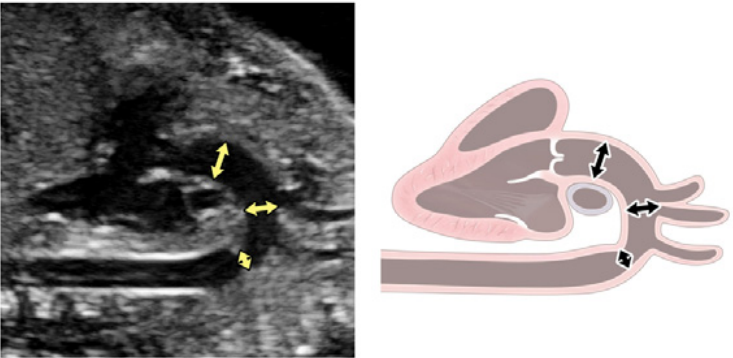
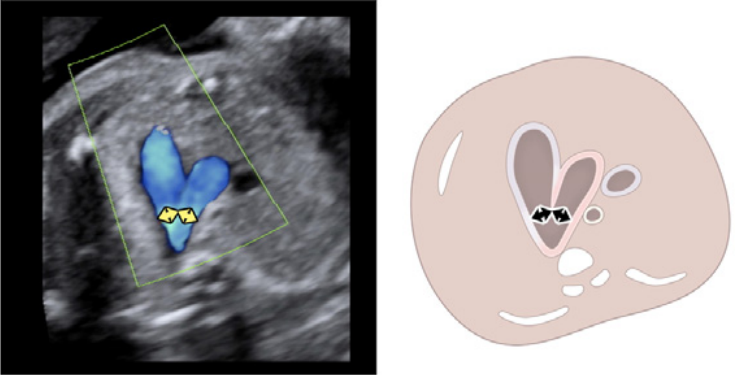
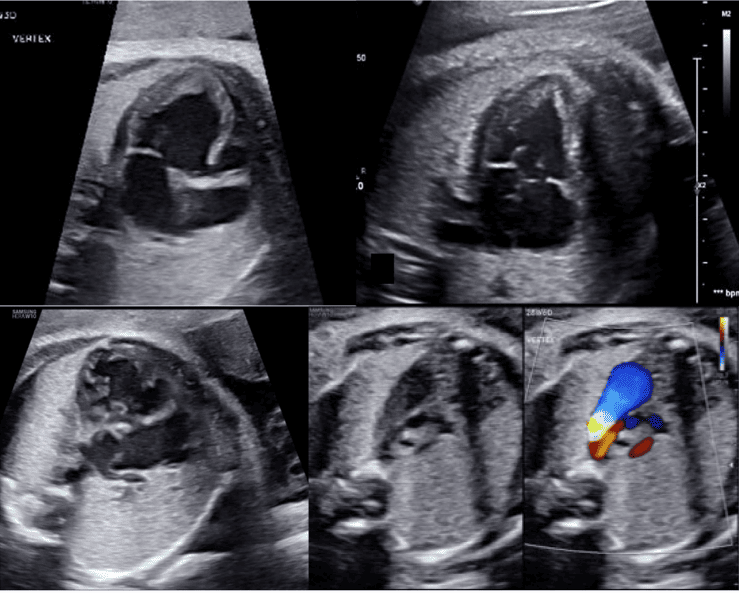
Рисунок 6 Трехсосудистый срез и 3СТ. Очень незначительное движение датчика при визуализации верхнего средостения в аксиальной плоскости может создать эти срезы. (А) – (С) являются приемлемыми вариантами 3СС, причем (А) демонстрирует большую часть выходного тракта ПЖ (ВТПЖ) и легочного клапана, (В) демонстрирует главную легочную артерию и ветви легочных артерий, а (С) визуализирует дугу протока и уже не в плоскости, которая показывает ветви легочных артерий. (D) и (E) – немного более краниальные и немного косые, чтобы показать дуги протока и аорты и их нормальное отношение к трахее. Когда условия визуализации менее оптимальны или на ранних сроках беременности, добавление цветного или энергетического допплера может облегчить визуализацию 3СТ среза (E). AA – дуга аорты; Ao – аорта; DA – дуга протока; PA – легочная артерия; Tr – трахея.
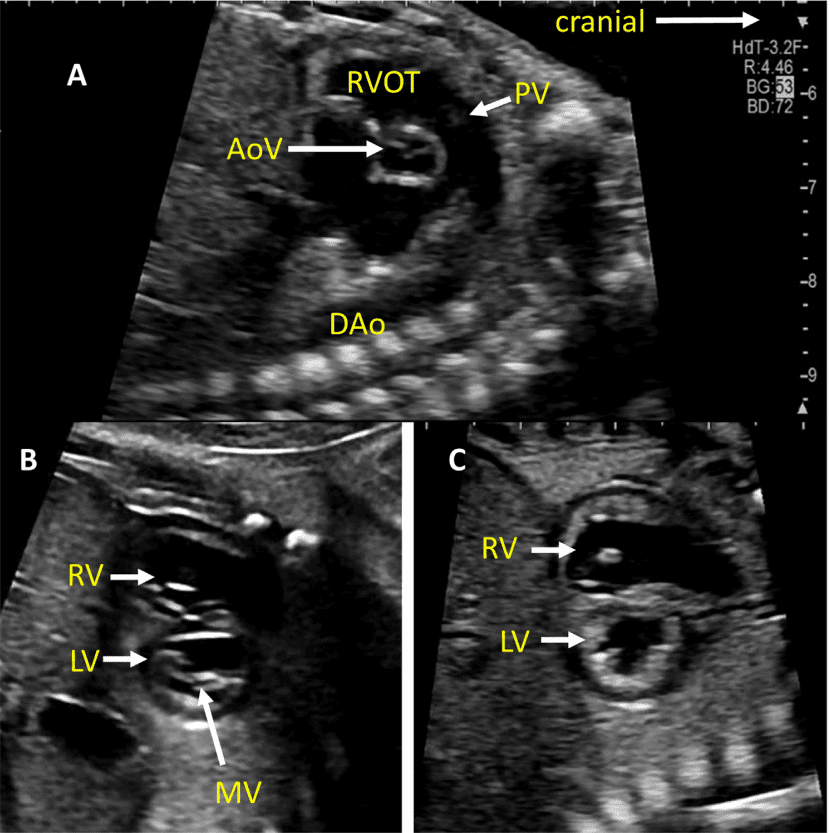
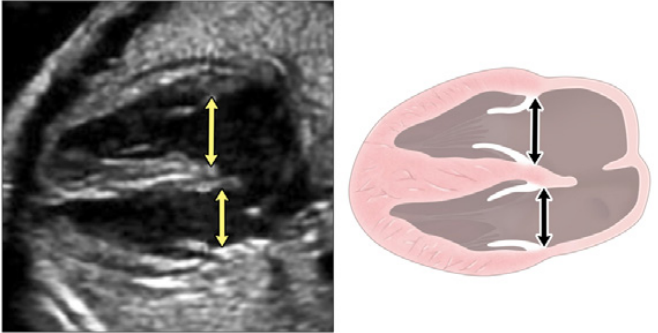
Рисунок 7 Короткоосевые срезы сердца плода. (А) показывает высокую короткую ось у основания, показывая аортальный клапан (AoV) и легочный клапан (PV), ориентированные ортогонально друг к другу, TV в нормальном положении, IVC, входящий в правое предсердие, и левое предсердие, расположенное более позади. (B) и (C) получены путем небольшого смещения к верхушке сердца. На изображении (В) четко видно митральный клапан (MV) с двумя правильно расположенными папиллярными мышцами и нормальной передней створкой. На (С) хорошо видны тела обоих желудочков и можно измерить стенки желудочков и межжелудочковую перегородку. Визуализация на этом уровне позволяет оценить функцию и рассчитать фракционное укорочение LV.
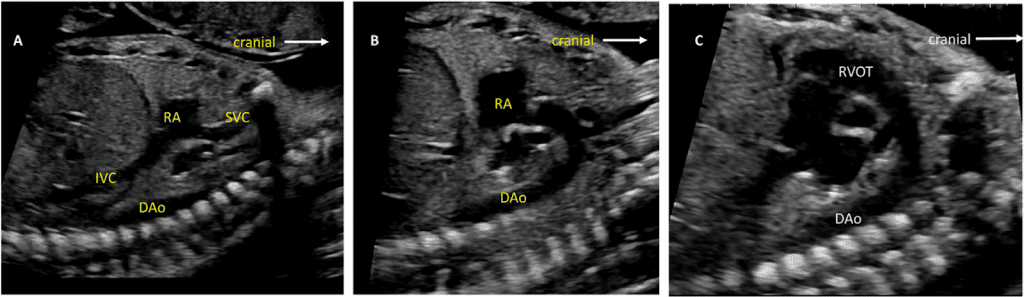
Рисунок 8 Сагиттальное (А, С) и парасагиттальное (В) изображение бокового среза, а также дуги аорты и протока легочной артерии. Обратите внимание на уплощенную дугу, характерную для артериального протока (С), и высшую дугу аорты (В) с видимыми сосудами головы и верхних конечностей. DAo – нисходящая аорта; RA – правое предсердие; RVOT – выходной тракт правого желудочка.
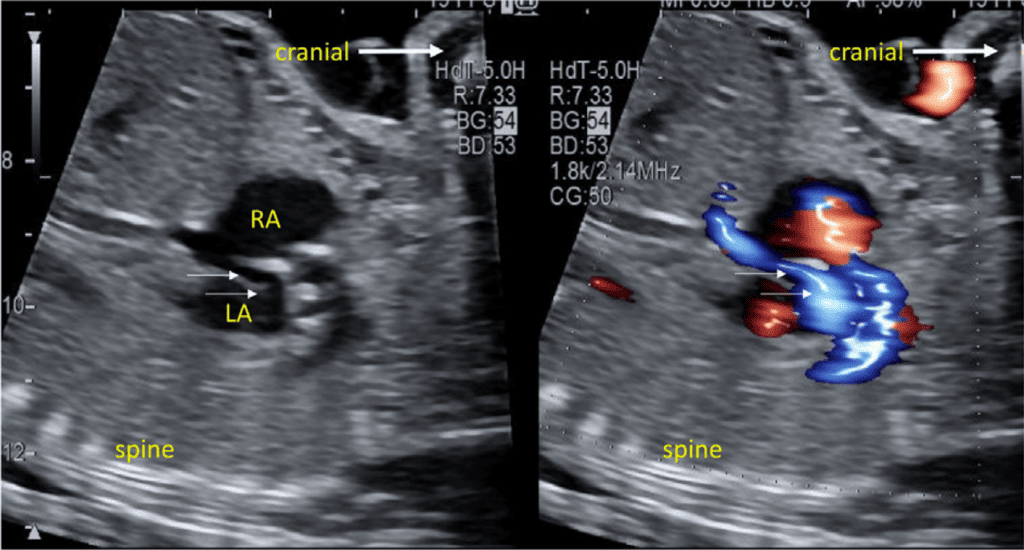
Рисунок 9 Сагиттальный кавальный срез в 2D и с цветной допплерографией показывает движение предсердного потока справа налево (синий) через овальное отверстие (стрелки). LA – левое предсердие; RA – правое предсердие.
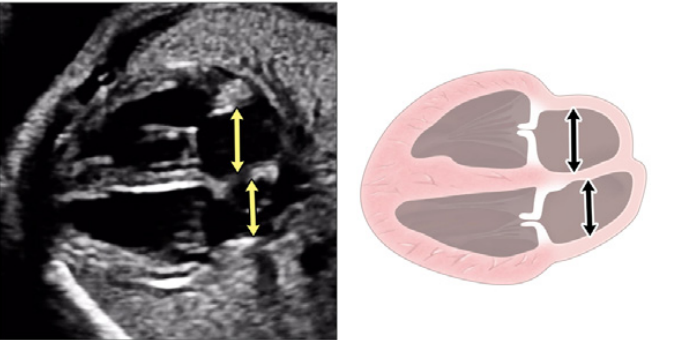
- Абдоминальное положение: При определении абдоминального положения плода необходимо обратить особое внимание на положение плода и ориентацию датчика (выемка слева или выемка справа), а также ориентацию дисплея. Поперечный вид верхней части живота плода (Рисунок 2, внизу справа), на котором видно желудок, печень, нисходящую аорту и системные венозные структуры, оценивают для определения положения плода (как правило, с меткой). На этом изображении обычно видно левый желудок и правую долю печени и желчный пузырь. Когда плоскость сканирования перемещается головой к грудной клетке и создается четырехкамерный срез, можно визуализировать печеночные вены и их соединения.
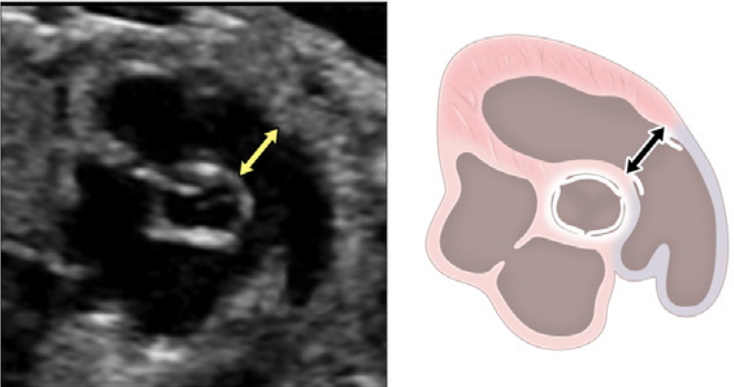
- Четырехкамерный срез: Плоскость инсоляции, находящаяся непосредственно возле диафрагмы плода, позволяет увидеть “четырехкамерный” срез сердца, включая предсердия и желудочки (Рисунок 2, справа посередине, и Рисунок 4). Кроме положения сердца и размеров предсердий и желудочков, можно различить анатомию предсердно-желудочковой перегородки, морфологию атриовентрикулярного (АВ) клапана и легочные венозные связки. Цветной допплер следует использовать для оценки регургитации АВ-клапана, направления потока в овальном отверстии, целостности межжелудочковой перегородки и легочных венозных соединений.
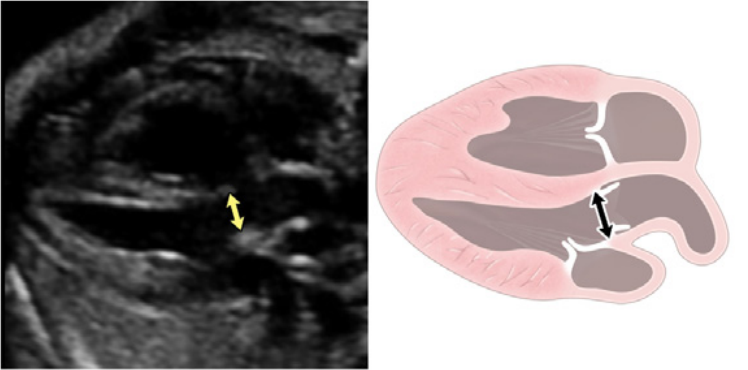
iii. Выходной тракт ЛЖ: этот вид выполняется путем перемещения плоскости инсоляции слегка краниально от четырехкамерного среза (Рисунок 2, справа вверху, и Рисунок 5). В нормальном сердце можно визуализировать субаортальную область, аортальный клапан, надклапанную область и восходящую аорту. Для оценки наличия регургитации аортального клапана или обструкции оттока следует использовать цветную допплерографию.
- Выходной тракт ПЖ: Когда развертка продолжается краниально от выходного тракта ЛЖ, в поле зрения попадает выходной тракт ПЖ. В нормальном сердце этот вид демонстрирует субпульмональную область, легочный клапан и проксимальную главную легочную артерию, а также может включать бифуркацию легочной артерии (Рисунки 2 и 6А). С помощью цветной и PW допплерографии можно выявить стеноз легочного клапана или регургитацию.
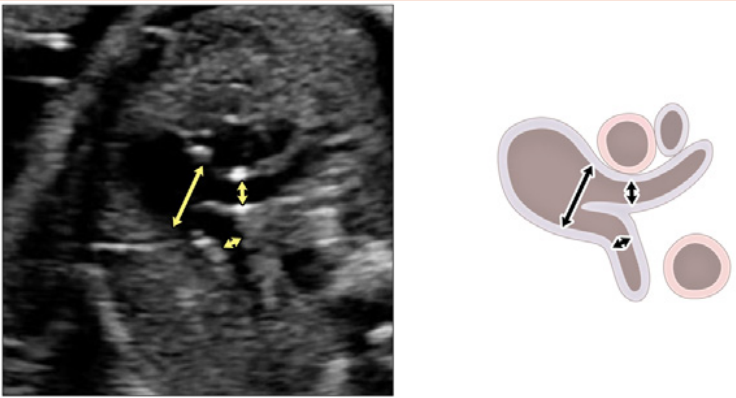
- 3СС: Отходя от выходного тракта ПЖ, получают 3CC (Рисунок 2, слева внизу и посередине, и Рисунок 6А-С). В этой плоскости в нормальном сердце слева направо видно главную легочную артерию, восходящую аорту в поперечном сечении и верхнюю полую вену (ВПВ) в поперечном сечении. Одна или обе легочные артерии также могут быть включены. Следует обратить внимание на аномалии количества, размера, выравнивания и расположения сосудов.
- 3СТ: На основе 3СС получают 3СТ. В нормальном сердце дуги аорты и протока можно увидеть в виде длинной оси поперечных сегментов, которые расположены слева от трахеи и сходятся, образуя проксимальный нисходящий отдел грудной аорты (Рисунок 2, верхняя левая панель, и Рисунок 6, нижняя панель). Для демонстрации проходимости и направления потока в обеих дугах следует использовать цветную допплерографию.
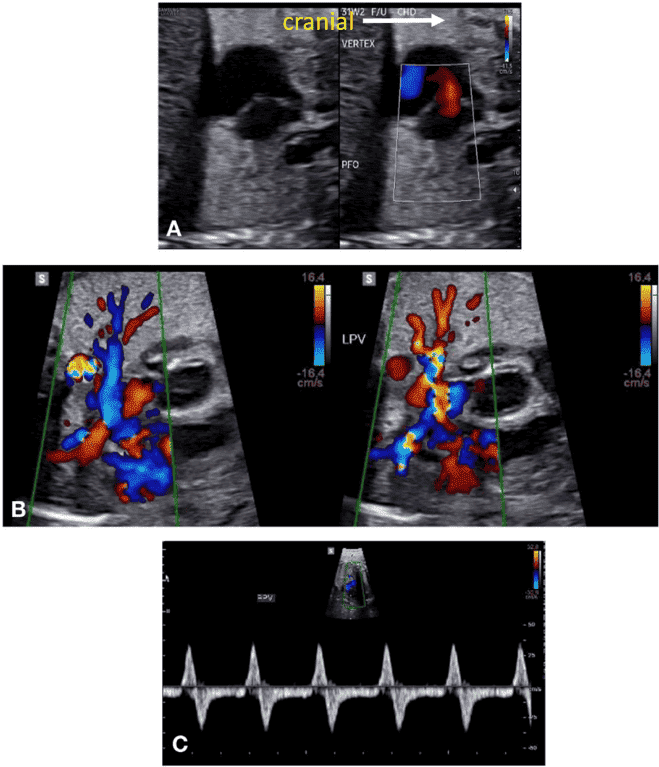
vii. Бикавальный вид: Бикавальное изображение получают при сагиттальной визуализации грудной клетки и живота плода (Рисунок 3, панель 1, и Рисунок 8А). Этот вид позволяет подтвердить, что нижняя полая вена (НПВ) интактна, а не прервана, и находится ли ВПВ на той же стороне, что и НПВ. Этот вид также используется для оценки анатомии межпредсердной перегородки, проходимости и направления потока через овальное отверстие с помощью цветной допплерографии (Рисунок 9).
viii. Продольный срез дуги аорты: Парасагиттальная визуализация грудной клетки плода (Рисунок 3, панель 3 и Рисунок 8B) необходима для полной визуализации дуги аорты. Дугу следует оценивать для определения непрерывности между восходящей и нисходящей аортой и гипоплазии отдельных сегментов (восходящего, поперечного, перешейка). Для оценки кровотока следует использовать цветную допплерографию. Нормальный поток должен быть антеградным, по направлению к нисходящей аорте, с минимальным прямым потоком во время диастолы.
- Продольный срез дуги протока: Дугу протока обычно получают при прямом сагиттальном срезе грудной клетки плода, перемещая плоскость инсоляции немного левее средней линии (Рисунок 3, панель 2, и Рисунок 8C). Следует оценить артериальный проток на предмет его сужения как в аорте, так и в главной легочной артерии, определяя скорость кровотока в систолу и диастолу с помощью цветной и/или спектральной допплерографии. Также следует отметить направление потока.
- Короткоосевые срезы: Изображение плоскости сердца по короткой оси полезно для оценки межжелудочковой перегородки, сердечной функции, анатомии АВ-клапанов и желудочково-артериальных взаимоотношений. Высокий короткоосный срез в основании сердца (Рисунок 3, панель 4 и Рисунок 7A) демонстрирует аортальный клапан, окруженный выходным трактом ПЖ и легочной артерией, огибающей его спереди. Обычно хорошо видно бифуркацию легочной артерии и трехстворчатый клапан (ТК), а также перепончатую и выходную желудочковую перегородки. Регургитация ТК и целостность межжелудочковой перегородки также можно оценить с помощью цветной допплерографии.
Низкий короткоосевой срез по направлению к верхушке желудочка (Рисунок 3, панели 5 и 6, а также Рисунок 7B и C) используется для оценки функции желудочков и выявления мышечных дефектов межжелудочковой перегородки (ДМЖП) с применением цветного допплера. При небольшом наклоне плана сканирования к основанию сердца можно оценить морфологию АВ-клапанов (Рисунок 7B).
F. Биометрия сердца и данные измерений
Сердечные структуры, которые следует измерять при всех исследованиях плода, включают кольца аортального и легочного клапанов в систолу, а также митральное и ТК кольца в диастолу (Таблица 4). Частота и ритм сердечных сокращений плода должны быть задокументированы для всех исследований. Дополнительные измерения сердца и сосудов следует проводить при специфических структурных пороках (Таблица 4).
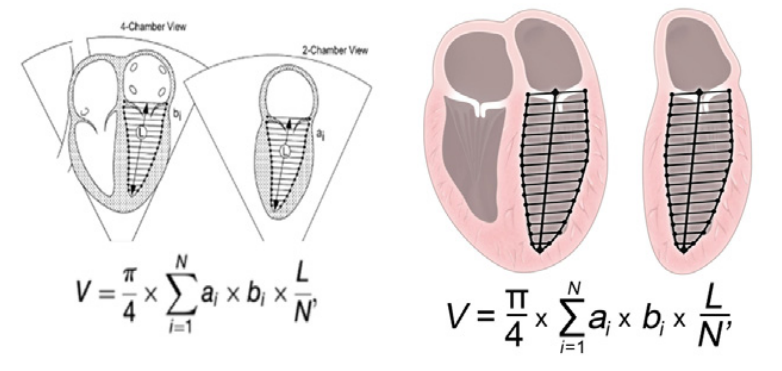
Как правило, индексация измерений предполагает преобразование в Z-оценку, или количество СО от среднего значения, которое представляет наблюдаемое значение.35 Опубликовано несколько уравнений Z-оценки для измерений с поправкой на гестационный возраст, хотя существуют альтернативные формулы, использующие бипариетальный диаметр и длину бедренной кости 36(Таблица 5).
G. Допплерография
Допплеровское исследование является неотъемлемым компонентом полного эхокардиографического обследования плода. Детальная оценка сердечных структур, которая позволит выявить основную сердечную патологию, должна быть первоочередной задачей этого исследования. Дополнительное использование допплерографии предоставляет дополнительную информацию о нормальном и аномальном кровотоке, а также сердечной функции, ритма и проводимости, которая не может быть получена только с помощью изображения в оттенках серого.
Цветная и энергетическая допплерография. Ценность цветной допплерографии в оценке нормальной и аномальной анатомии сердца плода и кровотока признается уже более трех десятилетий.42 Использование этого метода визуализации начинается с определения границы Найквиста для демонстрации скорости кровотока, представляющего интерес, и исключения стеноза клапанов и аномального кровотока. Во время исследования необходимо также отрегулировать усиление и устойчивость цвета, чтобы цвет заполнял камеру или кровеносный сосуд, не заслоняя морфологию тканей в градациях серого. Модальность энергетического допплера анализирует амплитуду допплеровских сигналов вместо частотных сдвигов 43; другие модальности, такие как направленный энергетический допплер, сочетают амплитуду и частотные сдвиги, что позволяет двунаправленную визуализацию потока.44 Использование энергетического допплера как дополнение к цветному допплеру может дополнительно очертить и определить меньшие сосудистые структуры и низкие скорости кровотока, например, в легочных и системных венах.
Таблица 4 Рекомендуемые сердечные биометрические показатели
СВОДП, синдром врожденной обструкции верхних дыхательных путей; ПЛДП, врожденный порок легочных дыхательных путей; ЧСС, частота сердечных сокращений; ККТ, крестцово-копчиковая тератома; ФФТС, фето-фетальный трансфузионный синдром; ИСП, интеграл линейной скорости потока. Измерения для всех исследований плода, для сравнения с опубликованными или внутренними нормальными значениями, включают частоту и ритм сердечных сокращений, аортальный и легочный клапаны в систолу, а также митральное и ТК кольца в диастолу. Дополнительные измерения, особенно если отмечаются отклонения от нормы, включают, но не ограничиваются теми, что перечислены в таблице.
Таблица 5 Опубликованные уравнения Z-оценки
| Автор | Год | Диапазон ГВ | n | Тип | Модели | Независимая переменная | Преимущества | Недостатки |
| Schneider и соавт. | 2005 | 15-39 | 130 | Z-оценка | Линейная регрессия | Длина бедра, бипариетальный диаметр, месячный возраст | Исследовано 17 показателей | Небольшой объем выборки |
| Lee и соавт. | 2010 | 20-40 | 2,735 | Z-оценка | Линейная регрессия | Длина бедра, бипариетальный диаметр, месячный возраст | Опубликована формула СО, большой объем выборки | Исследованы только аортальный и легочный клапаны, размеры короткой оси желудочков и окружность сердца |
| Colan | 2016 | 16-40 | 104 | Z-оценка | Линейная регрессия | ГВ | Во многих системах ультразвука исследовано 17 показателей | Методы не опубликованы, небольшой объем выборки |
| Krishnan и соавт. | 2016 | 12-39 | 296-414 | Z-оценка | Полиномиальная регрессия | Длина бедра, бипариетальный диаметр, ГВ | Исследовано 13 показателей | Не эффективно при экстремальных значениях ГВ и измерениях |
| Gu и соавт. | 2018 | 17-39 | 6,343 | q оценка | Квантильная регрессия | ГВ | Лучше учитывают нелинейные изменения со временем, большой объем выборки | Клиникам меньше известно, трудно быстро рассчитать |
| Vigneswaran и соавт. | 2018 | 13-36 | 7,945 | Z-оценка | Полиномиальная регрессия | ГВ | Большой размер выборки | Сообщалось только об аортальном и легочном клапанах, артериальном протоке, дистальной поперечной дуге |
ГВ, гестационный возраст на основе даты первого триместра.
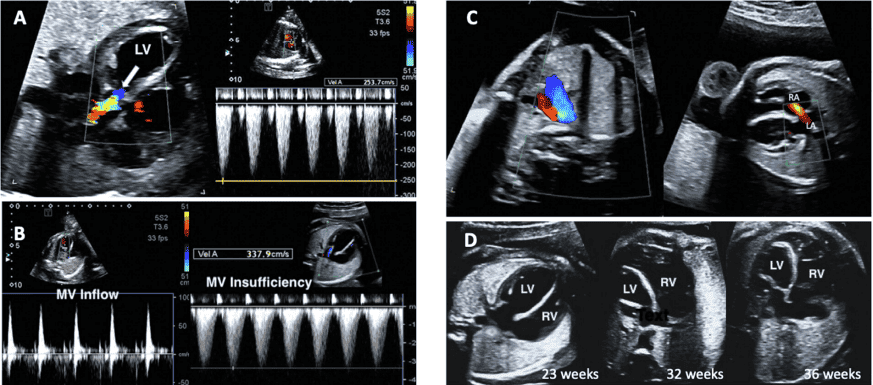
PW допплерография. PW допплер предоставляет дополнительные данные о профиле и направлении кровотока. Точная оценка скорости требует, чтобы линия исследования была коаксиальной к потоку (или под углом <20). Минимизация ворот объема образца уменьшает риск нежелательного одновременного исследования нескольких участков сердца плода. Опубликованы нормальные значения для притоков и оттоков желудочков, а также для овального отверстия, легочных вен и потоков НПВ.45-49 PW допплер следует использовать рутинно для оценки, как минимум, структуры потока в притоках, оттоках желудочков, дугах, легочных венах, боталловом протоке и пупочных сосудах (Таблица 6, Рисунок 10). Оценка скорости кровотока в пупочной артерии (свободно плавающей петли пуповины) и средней мозговой артерии, включая измерение пульсации и/или индексов резистентности, может предоставить дополнительную информацию о состоянии плаценты и изменений церебрального сопротивления, что является распространенным явлением при некоторых ВПС.50
CW допплеровское УЗИ. CW допплер не требуется для визуализации нормального сердца плода, но может потребоваться для оценки сердечных и внесердечных патологий, которые способствуют аномальному кровотоку и давлению в желудочках. Как и в случае допплерографии в прямой проекции, выравнивание допплеровского курсора коаксиально к потоку является критически важным для точной оценки скорости и расчета градиента. При оценке стеноза клапана расчет CW допплеровского градиента дает представление о степени тяжести обструкции. Дополнительные данные можно получить, оценив давление в правом или ЛЖ с помощью исследования соответствующей струи регургитанта АВ-клапана.51
H. Полная кардиологическая оценка плода с использованием сегментарного анализа
Сегментарный анализ сердца плода предлагается в Таблице 7, включающей все необходимые ракурсы и допплеровскую информацию. Иногда не все стандартные плоскости визуализации могут быть получены, хотя все сердечно-сосудистые структуры должны быть адекватно визуализированы определенным образом, чтобы исследование считалось завершенным, за исключением случаев, когда структура действительно отсутствует. Порядок получения изображений может быть разным.
Таблица 6 Рекомендуемые компоненты PW допплерографии при полном эхокардиографическом обследовании плода (обязательные и факультативные)
| Компонент | Обязательный/Необязательный |
| Пупочная вена | Обязательно* |
| Венозный проток | Обязательно |
| Вены печени | Необязательно |
| ВПВ и НПВ | Необязательно |
| Легочные вены (по крайней мере по одной правой и левой) | Обязательно |
| ТК и митральный (приливной) клапан | Обязательно |
| Аортальный и легочный (полумесячный, оттоковый) клапаны | Обязательно |
| Большие артерии и дуги (поперечная аорта, перешейок) | Необязательно |
| Артериальный проток (дистальный отдел, у входа в аорту) | Обязательно* |
| Ветви легочных артерий | Необязательно |
| Пупочная артерия | Обязательно* |
| Средняя мозговая артерия | Необязательно |
| Прилив-выток ЛЖ (ВИВР) | Необязательно |
| Тканевая доплерография трикуспидального/митрального латерального кольца | Необязательно |
ВИВР, время изоволюмической релаксации.
*Это консенсусное изменение по сравнению с предыдущими документами.
Рисунок 10 PW допплерография. Этот метод следует использовать рутинно для оценки, как минимум, структуры потока в желудочковых притоках, оттоках, дугах, легочных и системных венах, венозном протоке и пуповинных сосудах. Репрезентативные формы волн включают (A) Венозный проток, (B) НПВ, (C) печеночная вена, (D) приток-отток ЛЖ, (E) артериальный проток, (F) ветвь легочной артерии, (G) легочная вена, (H) легочный клапан и (I) пупочная артерия и вена.
Таблица 7 Сегментарный анализ сердца плода с рекомендованными и необязательными компонентами эхокардиографии плода
| Для демонстрации/установки | Рекомендуемый срез | Дополнительные срезы |
| Положение плода в матке и анатомический осмотр
Номер и положение плода в матке Положение живота и абдоминальный ситус Сердечная позиция Пуповина |
Однократное осевое сканирование от живота к голове (или от головы к животу)
Пуповина по короткой оси или мочевой пузырь плода с цветной допплерографией для демонстрации количества пуповинных сосудов PW ПА, ПВ, венозный проток +- печеночная вена, +- НПВ |
Метод Кордеса для определения односторонности |
| Системные венозные соединения | 3СС сагиттальный “бикавальный” срез | Осевая развертка живота от введения пуповины до диафрагмы, 2D и цветная |
| Легочные венозные соединения | Четырехкамерный срез: 2D. Четырехкамерный с цветом (низкий Nyquist), PW допплер (две вены, одна левая и одна правая) | Дополнительные легочные вены из правого и левого легкого |
| Анатомия предсердий и АВ-взаимосвязь
Морфология и функция АВ-клапана Морфология и функция желудочков |
Четырехкамерный срез. 2D, цветная допплерография АВ-клапанов и межпредсердно-желудочковой перегородки, PW трикуспидального и митрального притока, притока-истока ЛЖ, латерального трикуспидального кольца ТЦД. Короткая ось желудочков: 2D, цвет | Ортогональная плоскость, четырехкамерная 2D, цветная межпредсердная и межжелудочковая перегородки, PW поток овального отверстия
Измерение трикуспидального и митрального клапанов в диастолу |
| Желудочково-артериальные взаимоотношения, аортальный и легочный клапаны | Продольная ось ЛЖ, 2D цвет
Развертка краниально к ВТПЖ, 2D и цвет Высокая база короткой оси 2D, цвет, PW главной легочной артерии Апикальная четырехкамерная развертка, PW ВТЛЖ |
Измерьте аортальный и легочный клапаны в систолу |
| Дуга аорты | Сагиттальное изображение дуги, 2D и цветовое, PW.
3СС, начать с бифуркации легочной артерии и развернуть до 3СТ с 2D и цветом |
Измерьте размер протока и перешейка аорты на 2D в сагиттальной проекции или 3СТ |
| Дуга протока | Сагиттальный срез дуги, 2D и цвет, PW 3СC, начните с бифуркации легочной артерии и разверните до 3СТ с 2D и цветом | Короткоосевая основа, поверните, чтобы показать проток, 2D и цвет |
| Ветви легочных артерий | 3СС, показать бифуркационный срез | Короткоосевая база, 2D. Четырехкамерный, угловой краниальный, PW измеряет диаметры ветвей, когда каждая ветвь ЛА входит в легкое (гилум) |
ВТЛЖ, выходной тракт ЛЖ; ЛА, легочная артерия; ВТПЖ, выходной тракт ПЖ; ПА, пупочная артерия; ПВ, пупочная вена.
I. Альтернативные методы УЗИ
Для визуализации сердечно-сосудистой структуры и физиологии плода могут быть использованы другие ультразвуковые технологии. Пространственно-временная корреляция изображений фиксирует статический или динамический трехмерный объемный набор данных с помощью специально разработанного ультразвукового датчика и программного обеспечения для анализа.53 Трехмерная эхокардиографическая визуализация в реальном времени с помощью этого метода может быть использована для улучшения выявления анатомических дефектов и количественной оценки гемодинамики, например, функции желудочков и сердечного выброса,54 хотя пространственно-временная корреляция изображений не была валидирована для клинического применения. ТЦД и визуализация деформации миокарда были широко исследованы в постнатальной популяции и могут обеспечить более тщательную оценку механики миокарда плода.55 Для выявления субклинической сердечной дисфункции может быть использован онлайн или офлайн анализ сердечной функции с 2D деформацией (спекл-трекинг).56 То, как лучше всего применять эти методы во время беременности, требует дальнейшего исследования.
J. Эхокардиография плода на ранних сроках беременности (<15 недель)
Впервые о диагностике ВПС в сроке <15 недель было сообщено в начале 1990-х годов, вскоре после внедрения эндовагинальных датчиков в акушерскую практику.57 Ранняя диагностика имеет много преимуществ, включая больше времени для принятия решения и исключения сопутствующих патологий, возможность более раннего прерывания беременности и понимание развития ВПС с более ранних сроков гестации.58 На сегодняшний день в сроке <15 недель диагностируется широкий спектр структурных и миокардиальных болезней и аритмий. Чувствительность и специфичность ранней эхокардиографии плода составляет 78,6% и 98,9% соответственно,57 а в опытных руках чувствительность 89% и специфичность 100% возможны для базовой кардиологической диагностики.59,60
Таблица 8 содержит обзор подхода к ранней эхокардиографии плода, включая его преимущества и ограничения, а также важные соображения по сравнению с эхокардиографией плода во втором и третьем триместрах.
Таблица 8 Эхокардиография плода на ранних сроках (<15 недель): рекомендации, уникальные элементы, преимущества и ограничения
| Элемент | Рекомендации и задания | Сильные стороны, ограничения, примечания |
| Время | >10 недель для ЭВ-визуализации
>12 недель для трансабдоминальной визуализации (в идеале 13-15 недель) |
Зависит от времени направления, уровня комфорта сонографа и доступности ЭВ-изображений |
| Показания | Наиболее выгодные индикации (см. таблицу 1) | Увеличение ЗПП: 3-3.5 мм (95-й перцентиль) 3% риск, ≥3.5 мм (99-й перцентиль) 6% риск, 6 мм 24% риск, и >8.5 мм >60% риск
Голосистолическая ТР, ВП реверсия А-волны |
| Визуализация | Придерживайтесь принципа ALARA | ТИ и МИ на уровне ≤1,0 ТИм <10 недель и ТИк ≥10 недель
Ограниченное использование допплеровских режимов Узкий сектор и увеличение |
| Высокочастотный датчик (> 8 МГц) | Малые сердечные структуры | |
| Должно быть как можно ближе к сердцу плода | При <12 недель <4 см от сердца плода предполагается | |
| ЭВ-визуализация | Может потребоваться лишь до 12 недель | |
| Ожидания от кардиологического обследования | Через 11 недель четырехкамерный ~100% | Симметричные четыре камеры
Сердечная ось изменяется с 8-14 недель |
| В 11 недель >90% крупных артерий и дуг | Ожидаются симметричные крупные артерии и дуги | |
| Использование цветного отображения потока, когда 2D ограничено | Помогает подтвердить наличие и проходимость четырех камер, оттоков и дуг | |
| Оценка легочных и системных вен ограничена | Самый сложный аспект обследования на ранних сроках беременности | |
| Определение положения | Может быть легче выполнить трансабдоминально, а не через ЭВ | |
| Патология сердца | Общая чувствительность и специфичность хорошие | 78,6% и 98,9% соответственно |
| Основная структурная болезнь сердца, похожая по внешнему виду на поздние сроки беременности | Большинство можно обнаружить на 10-14 неделе
Сложно обнаружить тонкие дефекты, включая поражения клапанов из-за неоптимального разрешения |
|
| Основные ограничения связаны с разрешением (потенциально могут быть преодолены с помощью технологического прогресса) и сроками | Если неясно или подозрительно, предложите вернуться в течение 1-2 недель, учитывая экспоненциальный рост сердца на этой стадии | |
| Консультирование и отчетность | Интегрирующая роль генетического скрининга и тестирования, ограничения обследования | Потенциал для пропущенных диагнозов и прогрессирующих поражений |
| Дополнительные соображения | Более высокие показатели прерывания беременности | Некоторые заболевания, особенно с ассоциированной анеуплоидией, могут протекать тяжелее, чем на поздних сроках беременности, что в анамнезе приводит к потере беременности |
| Хотя и детальное, но считается скрининговым обследованием | Рекомендуется переоценка на 18-20 неделе |
ALARA – настолько низкий, насколько это возможно; ВП – венозный проток; ЭВ – эндовагинальный; МИ – механический индекс; ЗПП – затылочная прозрачность плода; ТИ – тепловой индекс; ТИк – тепловой индекс для костей; ТИм – тепловой индекс для мягких тканей.
Ключевые моменты
- Эхокардиографию плода необходимо проводить с использованием соответствующего оборудования и с соблюдением принципа “настолько низкого уровня, насколько это возможно”.
- Необходимо придерживаться существующих рекомендаций по хранению и документации.
- Следует использовать двумерную, спектральную допплеровскую и цветную допплеровскую эхокардиографию, а настройки визуализации оптимизировать специально для исследования сердца плода.
- Следует использовать стандартные виды и плоскости визуализации.
- Необходимо придерживаться минимальных стандартов для 2D, спектрального допплера и цветного допплера статических и динамических изображений, включая позицию плода, структуру и функцию сердца, а также биометрию сердца.
- Эхокардиография плода может быть выполнена ранее 18 недель и должна быть рассмотрена для пациенток, обратившихся в конце первого триместра с подозрением на сердечную аномалию, в зависимости от местных ресурсов и опыта.
- Нет достаточных доказательств, чтобы рекомендовать проведение эхокардиографии плода на ранних сроках (<16 недель) при беременности с низким риском, но было доказано, что она является целесообразной и может использоваться при беременности с высоким риском или с известными аномальными результатами скрининговых исследований.
IV. РУКОВОДСТВО ПО ЭХОКАРДИОГРАФИЧЕСКОЙ ОЦЕНКЕ АНАТОМИЧЕСКИХ, ФИЗИОЛОГИЧЕСКИХ И ФУНКЦИОНАЛЬНЫХ ОСОБЕННОСТЕЙ ПЛОДА ПРИ КОНКРЕТНОМ ЗАБОЛЕВАНИИ
A. Нарушения ритма и инструменты для оценки
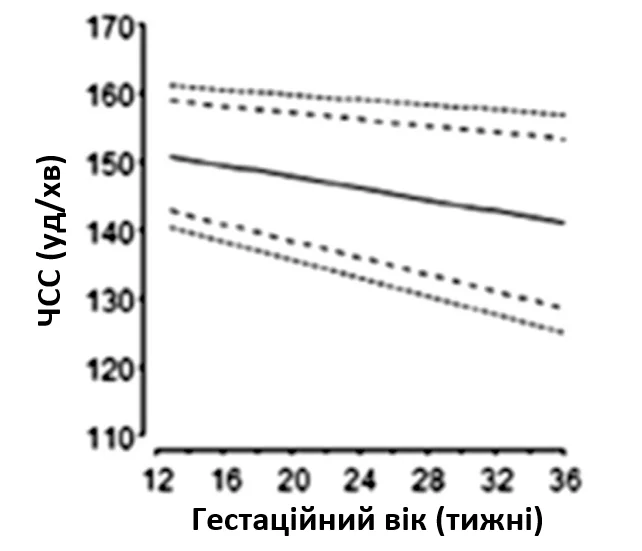
Для эхокардиографической оценки сердечного ритма плода используют 2D, М-режим, PW допплер и тканевый допплер (Рисунок 11). Оценка типа и механизма аритмии имеет важное значение для планирования лечения и прогнозирования. Нормальная частота сердечных сокращений плода зависит от срока беременности, и были опубликованы нормальные референтные диапазоны (Рисунок 12).65,66 На любом сроке беременности устойчивая частота сердечных сокращений >160-180 уд/мин или <120 уд/мин является аномалией.
Рисунок 11 Ультразвуковые инструменты для оценки частоты сердечных сокращений, ритма и АВ-проводимости плода. (А) ВПВ-допплер восходящей аорты (Ао). (B) Допплерография притока-истока ЛЖ, полученная с помощью широкодиапазонного датчика с одновременным сканированием митрального притока на передней створке и аортального оттока чуть ниже аортального клапана. (С) Одновременное исследование легочной артерии и легочной вены. (D) Тканевая допплерография латерального трикуспидального кольца. (E) Допплер венозного протока. (F) М-режим с курсором, размещенным через стенку предсердия и свободную стенку правого или левого желудочка. Частота и ритм сердечных сокращений плода являются нормальными на всех вышеупомянутых трассировках. a – сокращение предсердий; v – сокращение желудочков.
Рисунок 12 Частота сердечных сокращений плода (ЧСС), измеренная с помощью эхокардиографии, в соответствии со сроком беременности. Обозначены первый, пятый, 50-й, 95-й и 99-й процентили. Адаптировано с разрешения Zidere и соавт. 65
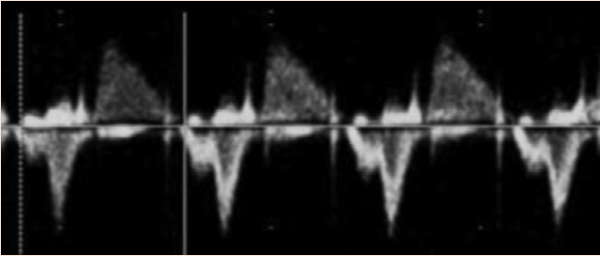
Эхокардиография в М-режиме для оценки ритма плода использует преимущества высокого временного разрешения для исследования точного времени сокращения миокарда предсердий и желудочков, которые обычно оцениваются одновременно. Для определения времени сокращения предсердий и желудочков можно использовать допплеровскую эхокардиографию одновременного притока митрального клапана/оттока аорты, легочной вены/ветви легочной артерии или ВПВ/аортального кровотока. PW тканевый допплер может быть использован для измерения скоростей и временных интервалов миокарда предсердий и желудочков путем исследования латерального митрального или ТК кольца. Допплеровские методы оценки ритма позволяют количественно оценить частоту сердечных сокращений плода, взаимосвязь между сокращением предсердий и желудочков, а также оценить интервалы времени проведения, такие как механический интервал PR (АВ-интервал). У беременных, которые, как известно, являются носителями анти-Ro/La антител, измерение механического интервала PR плода может быть выполнено для оценки нарушений АВ-проводимости, хотя еще нет четких доказательств эффективности рутинного наблюдения для снижения частоты возникновения более высоких степеней АВ-блокады.67 Измерение допплеровских изоволюмических временных интервалов (Рисунок 13) может помочь в диагностике врожденного синдрома удлиненного интервала QT плода 68 или в различении сложных ритмов, таких как блокада предсердной мерцательной аритмии и АВ-блокада 2:1.69.
Самые распространенные аритмии и их диагностическая оценка с помощью эхокардиографии представлены в Таблице 9 и на Рисунках 14-17. Если результаты эхокардиографии неоднозначны, для непосредственной оценки электрического сигнала сердца плода можно использовать магнитокардиографию и электрокардиографию плода, но на данный момент они имеют ограничения для широкого клинического использования. Магнитокардиография плода может точно охарактеризовать сердечный ритм плода, а также свойства проводимости и реполяризации.70
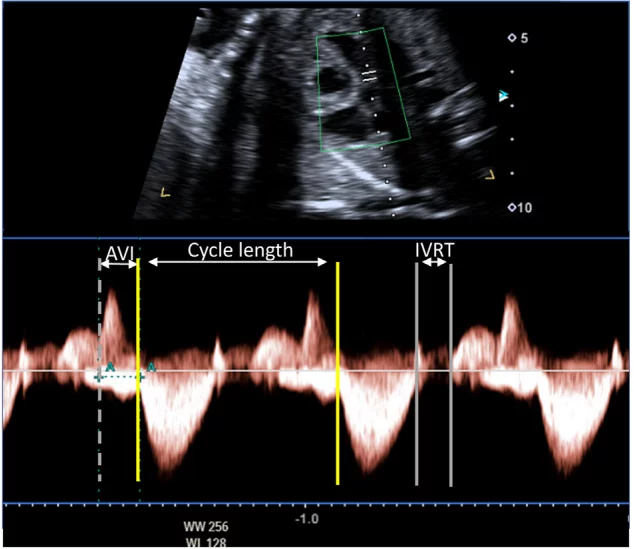
Рисунок 13 Допплеровское исследование плода с подозрением на синдром удлиненного интервала QT. Допплеровский курсор размещен между притоком через митральный клапан (выше базовой линии) и аортальным потоком (ниже базовой линии). Продолжительность цикла составляет 560 мсек (ЧСС 110 уд/мин). АВ-интервал (AVI) в норме и есть АВ-конкордантность, за исключением АВ-блокады. Время между закрытием аортального клапана и началом потока через митральный клапан (время изоволюмического расслабления [IVRT]) составляет 100 мсек. IVRT, выраженный в процентах от продолжительности цикла, составляет 17%, что значительно превышает нормальный диапазон для беременности, что согласуется с диагнозом синдрома удлиненного интервала QT.
Таблица 9 Рекомендации по оценке нарушений частоты и ритма сердечных сокращений плода
| Нарушение | Диагноз | Оценка | Примечания |
| Нерегулярные сердечные ритмы с нормальной общей частотой | Атриальные эктопические сокращения (>95%) Вентрикулярные эктопические сокращения гораздо реже (<5%) | Любой доступный инструмент: a-a и V-V интервалы времени продемонстрируют сброс предсердного ритма при ПСП (с “неполной компенсаторной паузой”), в то время как ПСЖ не изменяют предсердный интервал a-a | Дальнейший мониторинг частоты сердечных сокращений до решения проблемы |
| Тахикардия | Синусовая тахикардия | М-режим или артериальный/венозный допплер; длительная ЖА тахикардия с регулярным ритмом, обычно <200 ударов/мин | |
| НЖТ | М-режим или артериальный/венозный допплер; соотношение между сокращениями предсердий и желудочков 1:1 (Рисунок 14); чаще всего ортодромная реципрокная (путь опосредованный), короткая ЖА тахикардия | Оценка митрального клапана/ аортального потока не рекомендуется из-за слияния моделей притока, что не позволяет измерить время сокращения предсердий | |
| Эктопическая предсердная тахикардия или ПЖРТ | М-режим или артериальная/венозная допплерография; тахикардия с соотношением А/В 1:1, но типа “длинный ЖА”, может иметь вариабельный интервал V-V | Эхокардиографическое определение механизма является важным для выбора лечения аритмии | |
| Трепетание предсердий | М-режим, 2D, допплер; чрезвычайно быстрая частота предсердий с характерным “пилообразным” паттерном на М-режиме (Рисунок 14); частота предсердий > 400 уд/мин, ассоциируется с различной степенью АВ-блокады (чаще всего 2:1, 3:1) | Предсердия часто расширены с ассоциированной АВ-регургитацией и нарушением функции желудочков | |
| Желудочковая тахикардия | М-режим или артериальный/венозный допплер; тахикардия с диссоциацией А/В, регулярная частота предсердий с (обычно) замедленной частотой желудочков, могут быть вариабельные интервалы V-V | ||
| Брадикардия | Синусовая брадикардия | Любая модальность, демонстрирующая одновременное сокращение предсердий и желудочков; большинство синусовых брадикардий имеют ЧСС >90-100 уд/мин; эхокардиографические данные у плода с синусовой брадикардией, обусловленной синдромом удлиненного интервала QT, приведены на Рисунке 13, с использованием допплерографии для измерения ВИВР в этом контексте | ТЦД на латеральном трехстворчатом кольце может быть полезной |
| Полная блокада сердца | Любая модальность, демонстрирующая одновременное сокращение предсердий и желудочков; при полной блокаде сердца частота сокращений предсердий и желудочков полностью диссоциирована (Рисунок 15), а частота желудочков, как правило, находится в диапазоне 50-80 уд/мин | ||
| Множественные блокированные эктопические сокращения предсердий, бигеминия предсердий и блокированная предсердная бигеминия на фоне АВ-блокады второй или третьей степени | Множественные блокированные предсердные эктопические сокращения могут привести к субнормальной или нерегулярной частоте желудочков, которую необходимо отличать от АВ-блокады второй или третьей степени; эхокардиографический подход к эктопическим сокращениям показан на Рисунках 17 и 18 и использует любую доступную модальность | Подтвердить с помощью УЗИ, поскольку внешний мониторинг плода не может отличить брадикардию от дистресса плода (М-режим может быть лучше допплеровских методов, если синусектопические интервалы длинные) |
ВИВР – время изоволюмического расслабления; ПСП – преждевременное сокращение предсердий; ПЖРТ – постоянная желудочковая реципрокная тахикардия; ПСЖ – преждевременное сокращение желудочков; НЖТ – наджелудочковая тахикардия; ЖА – желудочково-артериальная.
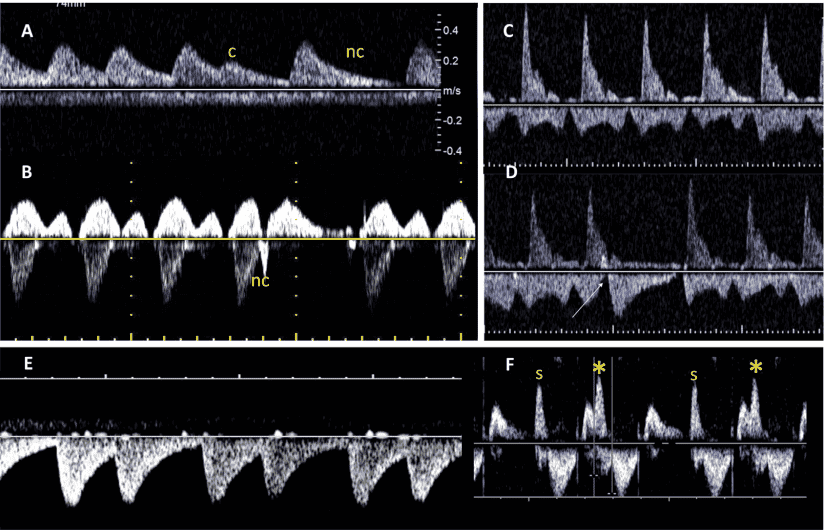
Рисунок 14 Диагностика тахиаритмии плода с помощью М-режима. (А) Трепетание предсердий. Сокращения предсердий демонстрируют типичный “пилообразный” паттерн трепетания предсердий (открытая стрелка [^]). Попеременные волны трепетания проводятся к желудочкам (V), создавая блок 2:1. Частота предсердий составляла 474 уд/мин. (В) Реципрокная (путево-опосредованная) наджелудочковая тахикардия. Частота предсердных (a) и желудочковых (v) сокращений одинакова (240 уд/мин), ритм регулярный.
Рисунок 15 М-режим трассировки полной сердечной блокады. Частота сокращений предсердий (стрелки) является нормальной при 120 уд/мин. Частота сокращений желудочков (V) значительно медленнее – 55 уд/мин, без взаимосвязи между сокращениями предсердий и желудочков (АВ-диссоциация). В этом примере структура сердца была нормальной, а сердечная блокада была вызвана материнскими анти-Ro антителами.
Рисунок 16 Нерегулярный ритм из-за проведенных и непроведенных преждевременных сокращений предсердий (ПСП). (А) Допплерография пупочной артерии/вены, демонстрирующая проведенные (c) и непроведенные (nc) ПСП у одного и того же пациента. Если АВ-проводимость является нормальной, преждевременное предсердное событие сопровождается связанным с ним преждевременным желудочковым событием. Если же ПСП является достаточно преждевременным, чтобы не провести через рефрактерный АВ-узел, активации желудочков не происходит. (В) Допплеровские записи с ВПВ и аорты у плода с ПСП. Трассировка показывает нормальный венозный поток выше исходного уровня с одним непроведенным преждевременным сокращением предсердий (nc), что приводит к временной реверсии потока в конце систолы; поток реверсирует из-за сокращения предсердий на фоне закрытой ТК. Возникает длительная пауза из-за отсутствия проводимости, поскольку импульс блокируется в АВ-узле. (C, D) Легочный венозный приток – отток легочной артерии. Поток легочной артерии выше базовой линии и венозный поток ниже базовой линии, отобранные одновременно из-за их близости в грудной клетке, демонстрируют нормальный ритм (C) и единственный непроводящий ПСП, обозначенный стрелкой (D). (E, F) Частые ПСП. Допплерография пупочной артерии (E) демонстрирует нерегулярный ритм со средней частотой около 120 уд/мин. С помощью допплерографии притока-оттока ЛЖ четко видно, что причиной нерегулярности являются частые преждевременные сокращения предсердий (звездочка), которые чередуются с нормальными синусовыми сокращениями по типу бигеминии.
Рисунок 17 Частота сердечных сокращений плода, чередующаяся с частыми ПСП по схеме блокированной предсердной бигеминии и нормального синусового ритма, что не следует путать с АВ-блокадой второй степени. Из-за неполной компенсаторной паузы после экстрасистолического сокращения предсердий предыдущий интервал V-V укорочен, поэтому видимая частота желудочков (86 уд/мин) составляет более половины частоты, которая наблюдается в следующем периоде синусового ритма (163 уд/мин), что отличает более медленный ритм от интермиттирующей АВ-блокады второй степени и слишком быстрый для типичной АВ-блокады третьей степени.
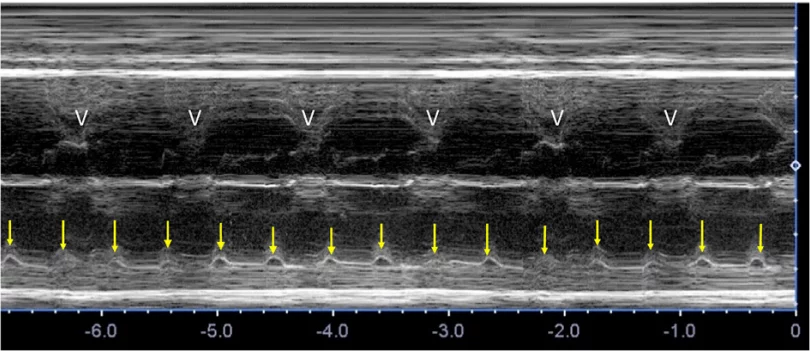
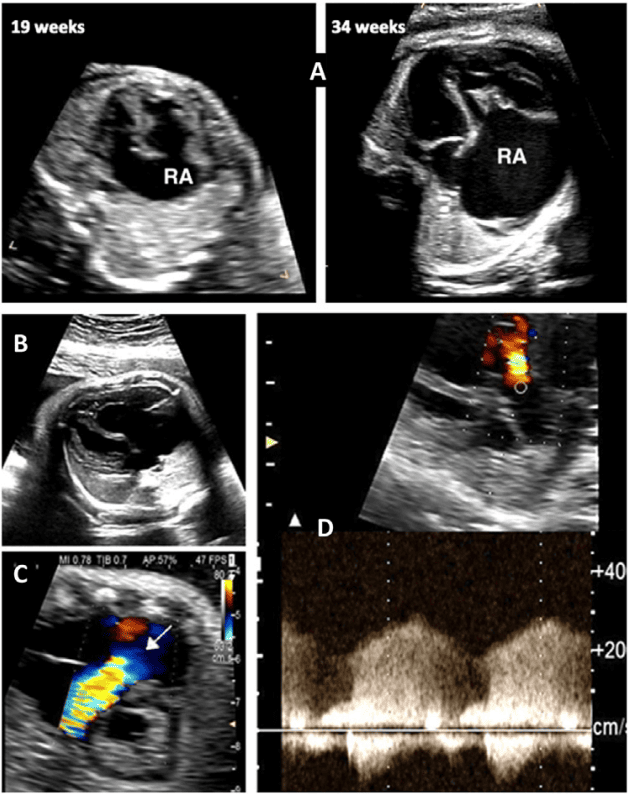
Оценка гемодинамического компромисса вследствие аритмии. Длительные аритмии плода могут привести к застойной сердечной недостаточности плода и неиммунной водянки плода, что увеличивает риск гибели плода.71,72 Тщательная оценка сердечно-сосудистого статуса и самочувствия плода имеет решающее значение для определения тактики лечения. Сердечно-сосудистый статус плода определяется путем измерения соотношения сердечно-грудной площади (Рисунок 18), отмечая наличие регургитации АВ-клапана и/или дисфункции желудочков, а также отмечая результаты, указывающие на многоводие. Допплерометрические показатели, особенно увеличение венозного протока и пульсации пупочной вены, могут быть трудно интерпретированы, если они являются аномальными на фоне эктопических сокращений предсердий плода, тахикардии или полной сердечной блокады. Аномальный сердечный ритм плода нарушает нормальную последовательность электрических событий в сердечном цикле, поэтому реверс А-волны в венозном протоке или пуповинная венозная насечка могут свидетельствовать об аритмии плода, а не о нарушении сердечной функции или задержке развития плода.
Ключевые моменты
- Частота и ритм сердечных сокращений плода должны быть задокументированы в рамках эхокардиографического исследования плода.
- Если сердечный ритм нерегулярный, или если наблюдается брадикардия или тахикардия, следует задокументировать механизм с помощью М-режима, PW допплерографии, тканевой допплерографии или комбинации этих методов.
- Эхокардиографическое измерение временных интервалов у плода в определенных ситуациях (анти-Ro/La положительность матери, подозрение или подтверждение генетического синдрома удлиненного интервала QT) может быть полезным.
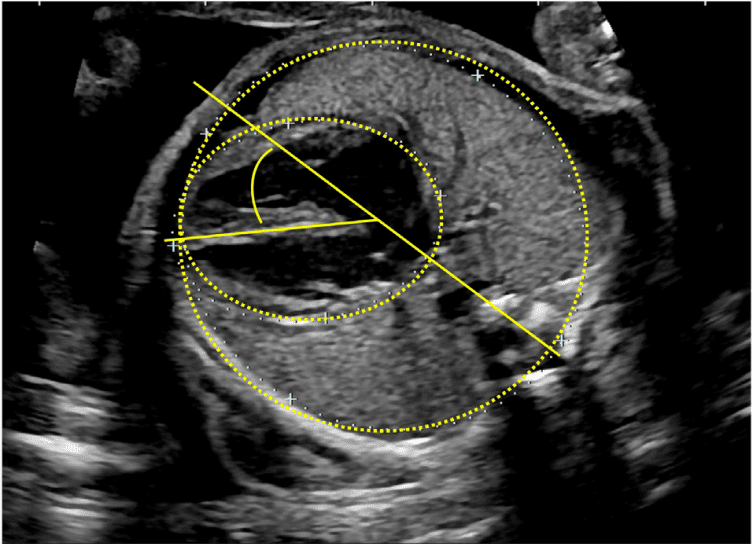
Рисунок 18 Стандартные биометрические измерения с аксиального изображения на уровне четырехкамерного среза. Кардиоторакальный коэффициент рассчитывается на основе измерения внутренней окружности (или площади) грудной клетки и эпикардиальной поверхности сердца, как показано желтыми пунктирными линиями. Сердечный угол определяется путем биссектрисы грудной клетки; линией от грудины к позвоночнику и измерения угла, под которым межжелудочковая перегородка пересекает линию (желтые сплошные линии).
B. Оценка функциональных нарушений сердца плода
Двумерная и допплеровская эхокардиография являются важными инструментами в оценке сердечной функции плода. Для оценки сердечно-сосудистой функции (Таблица 10) у плода с сердечными и несердечными состояниями с риском развития сердечной дисфункции и компрометации плода могут быть использованы различные методы (Таблица 11). Выявление сердечной дисфункции плода является важным для определения необходимости и времени потенциального вмешательства при состояниях, которые можно лечить пренатально. Характеристика сердечной дисфункции плода может предоставить клиницистам средства для лучшего отбора пациентов для вмешательства, прогнозирования результатов и проведения дальнейшего наблюдения после интервенционных процедур у плода. Оценка сердечной функции также важна для планирования и определения времени родов, даже в тех случаях, когда вмешательство в организм плода не является возможным.
Таблица 10 Рекомендации по компонентам комплексной оценки функционального состояния сердца плода
| Функциональный индекс | Модальность | |
| Систолическая функция |
|
|
| Диастолическая функция |
|
|
| Функция клапана |
|
|
| Сердечный выброс |
|
|
| Оценка сердечно-сосудистого профиля (см. Таблицу 13) |
|
|
DFTc – время диастолического наполнения, скорректированное на продолжительность сердечного цикла; ПМП – предполагаемая масса плода; MAPSE – систолическая экскурсия митрального кольца в плоскости; TAPSE – систолическая экскурсия трикуспидального кольца в плоскости.
Таблица 11 Типы гемодинамических нарушений, вызванных состоянием плода
| Нарушение гемодинамики | Состояние плода | Распространенные отклонения, выявляемые с помощью эхокардиографии |
| Поражения с высоким сердечным выбросом |
|
|
| Увеличенная предварительная нагрузка (объемная перегрузка) |
|
|
| Повышенные посленагрузочные повреждения |
|
|
| Компрессия сердца (уменьшение преднагрузки) |
|
|
ДАВП, дефект атриовентрикулярной перегородки, КИСВ, комбинированный индекс сердечного выброса, ВДГ, врожденная диафрагмальная грыжа, СВОДП, синдром врожденной обструкции верхних дыхательных путей; ПЛДП, врожденный порок легочных дыхательных путей; CTAR, соотношение сердечно-грудной площади; ИПМ, индекс производительности миокарда; ОАПБ, обратная артериальная перфузия близнецов; ФФТС, фето-фетальный трансфузионный синдром.
i. Визуализационные инструменты для оценки сердечной функции плода. Компоненты комплексной функциональной оценки сердечной деятельности приведены в Таблице 10. При первичной визуализации плода с подозрением на сердечную дисфункцию важно оценить наличие водянки плода и/или ее компонентов. Общий размер сердца, определенный по соотношению сердечно-грудной площади, может быть признаком измененной гемодинамики у плода.83 Следует провести двумерную и/или М-режимную эхокардиографическую оценку размера камер сердца и функции желудочков. Допплеровская картина потока АВ-клапана 65 может указывать на диастолическую дисфункцию, а регургитация АВ-клапана, визуализированная с помощью цветной допплерографии или PW допплерографии, может указывать на систолическую дисфункцию. Допплеровский индекс производительности миокарда оценивает глобальную функцию желудочков, учитывая как систолический, так и диастолический временные интервалы (Рисунок 19). Венозный допплеровский кровоток демонстрирует увеличение скорости ретроградного кровотока во время сокращения предсердий, поскольку функция сердца плода ухудшается (Рисунок 20). На величину реверсии А-волны также влияет размер сосудов, чистый пупочный кровоток через сосуды и адренергическое состояние плода. Венозный допплеровский анализ реверсии А-волны является ненадежным при других ритмах, кроме синусового ритма.
Рисунок 19 Индекс производительности миокарда (MPI) и время диастолического наполнения (DFT) в норме и при отклонениях от нормы (А) PW допплеровское отслеживание притока-истечения ЛЖ, демонстрирующее расчет допплеровского индекса производительности миокарда. MPI выражается как суммарное время изоволюмического расслабления (IRT) и изоволюмического сокращения (ICT), разделенное на время выброса (интервал B) или (интервал A – интервал B)/интервал B. Обратите внимание на щелчки клапанов (белые стрелки), которые используются для обозначения начала и конца IRT и ICT. Также проиллюстрировано DFT от начала зубца Е до конца зубца А. (B) Изменения индекса производительности миокарда при заболеваниях плода. На верхней панели показано нормальный MPI. Средняя и нижняя панели являются примерами ухудшения MPI у близнеца-реципиента при монохориальной/диамниотической двойне с гестацией с синдромом трансфузии между двойней и близнецами. (C) Время диастолического наполнения, скорректированное на частоту сердечных сокращений (DFTc). DFTc рассчитывается как общая продолжительность спектрального допплеровского отслеживания притока, разделенная на продолжительность сердечного цикла. При ухудшении диастолической функции нормальный DFTc прогрессивно сокращается и приток становится монофазным.
Рисунок 20 Венозная допплерография изменяется с увеличением центрального венозного давления (ЦВД). При повышении ЦВД (белая стрелка) наблюдаются репрезентативные изменения в IVC, печеночных венах (HV), венозном протоке (DV) и пупочной вене (UV).
PW допплерографию можно использовать для количественного определения ударного объема ПЖ и ЛЖ, что дает дополнительное представление о кровообращении плода человека.84,85 Ударный объем рассчитывается с помощью диаметра полулунного кольца клапана и допплеровского интеграла линейной скорости потока (ИСП) по следующей формуле:
Ходовой объем = [(0,785 * кольцевой диаметр2 ) * ИСП].
Учитывая, что кровообращение плода происходит параллельно, часто используется комбинированный сердечный выброс из обоих желудочков. Нормальный комбинированный сердечный выброс у плода составляет 425 мл/мин/кг и колеблется от 225 до 625 мл/мин/кг.85 Нормативные данные для гестационного возраста были опубликованы 85 и использовались для прогнозирования результатов в состояниях с высоким выбросом.73
ТЦД. Хотя нет доказательств, свидетельствующих о пользе рутинного применения ТЦД во время визуализации плода, она может быть полезной для оценки сердечной функции и ритма плода. Опубликованы нормативные данные для скоростей ТЦД e0, a0 и s0, временных интервалов изоволюмического расслабления и сокращения, а также индексов ПЖ и ЛЖ Tei и соотношения E/e`.86,87
Оценка сердечно-сосудистого профиля. Оценка сердечно-сосудистого профиля является глобальной мерой сердечно-сосудистого статуса и включает в себя несколько сердечно-сосудистых исследований плода, выражая их в виде кумулятивного балла, где лучший показатель равен 10, а худший – 0 (Таблица 12). Этот показатель используется для описания степени сердечно-сосудистого компромисса плода при некоторых заболеваниях 89, включая синдром фето-фетальной трансфузии 90, состояния высокого сердечного выброса плода,73,74 задержку роста плода,88 и неиммунную водянку плода.75,83 Этот показатель может быть полезным для описания и отслеживания продольных изменений в степени сердечного компромисса плода.
Таблица 12 Оценка сердечно-сосудистого профиля*
| Балы субшкалы | |||
| Категория | 2 | 1 | 0 |
| Гидропс | Нету | Асцит или плевральный или перикардиальный выпот | Отек кожи |
| Размер сердца (соотношение СЗ/ГЗ) | 0.20-0.35 | 0.35-0.50 | >0.50 or <0.20 |
| Сердечная функция | Нормальный двухфазный приток АВ, ФУ ЛЖ и ПЖ > 0,28 | Голосистолический ТР или ФУ ПЖ/ЛЖ < 0,28 | Голосистолический МР или ТР dP/dt < 400 или монофазный АВ-приток |
| Венозный допплер | Непульсирующая ПВ и нормальный ВП | Непульсирующая ПВ и отрицательная волна А в ВП | Пульсирующая ПВ |
| Артериальная допплерография | Прямой диастолический поток в ПА | Отсутствует конечный диастолический поток в ПА | Ретроградный конечный диастолический поток в ПА |
СЗ – сердечная зона; ВП – венозный проток; МР – митральная регургитация; ФУ – фракция укорочения; ГЗ – грудная зона; ТР – трикуспидальная регургитация; ПА – пупочная артерия; ПВ – пупочная вена.
Адаптировано с разрешения Makikallio € и соавт. 88
*Сумма баллов во всех пяти категориях = оценка; “10” – лучшее, “0” – худшее.
ii. Специфические типы сердечно-сосудистых нарушений у плода. Рассматривая аномалии развития плода, которые могут вызвать сердечно-сосудистый компромисс, полезно рассмотреть, о каком типе гемодинамических нарушений идет речь в первую очередь, и как сердце плода адаптируется к этим изменениям. Хотя все плоды с риском сердечной дисфункции должны проходить полную оценку систолической и диастолической функции, понимание гемодинамических нарушений, характерных для определенного состояния, позволяет клиницистам “нацелиться” на то, какой параметр сердечной функции плода может быть наиболее полезным для оценки степени гемодинамических нарушений. Хотя полное обсуждение конкретных эхокардиографических результатов при каждом состоянии плода выходит за рамки этого руководства, важным является понимание и документирование результатов, которые являются прогностически важными для каждого состояния, как показано в Таблице 11.
iii. Дополнительная визуализация: Экстракардиальная допплерография и вспомогательные/прогрессивные методы. Полная оценка состояния сердечно-сосудистой системы у скомпрометированного плода должна включать PW допплерометрическую оценку кровотока в артериях пуповины и средней мозговой артерии, хотя это можно сделать как во время акушерского сканирования, так и во время эхокардиографии плода. Было показано, что у плода с сердечно-сосудистым компромиссом перераспределение сердечного выброса – так называемый “щадящий мозг” – происходит как компенсаторная реакция, сопровождающаяся очевидным снижением церебрального сопротивления. Это явление было продемонстрировано при задержке роста плода,76 состояниях высокого сердечного выброса,91 и синдроме фето-фетальной трансфузии.78 Эти изменения могут предшествовать изменениям венозного кровотока, а следовательно, могут быть важным ранним признаком сердечного компромисса плода. Также следует провести измерение пиковой систолической скорости в средней мозговой артерии и сравнить ее с нормальными значениями для гестационного возраста при сердечной дисфункции, чтобы исключить анемию плода.92 Описаны и другие современные методы, такие как ТЦД и напряжение миокарда. Полезность этих методов в оценке функции и прогнозировании последствий менее понятна, и их использование в основном ограничивается исследовательскими целями.
Ключевые моменты
- Качественная оценка систолической и диастолической функции сердца должна быть частью эхокардиографического исследования плода. Это включает 2D-визуализацию, цветную и PW допплерографию притока и регургитации АВ-клапана (при наличии), а также PW допплерографию венозного протока.
- Количественные измерения следует проводить при подозрении на нарушение сердечной функции или сердечного выброса на основании экстракардиального диагноза или при угрозе для плода (например, выпоты, аномалии в двумерном изображении, аномалии венозной допплерографии); также могут быть показаны серийные измерения.
- Оценка сердечно-сосудистого профиля может быть полезной для описания и документирования продольных изменений в степени сердечного компромисса.
C. Структурные заболевания сердца
i. Единственные желудочки. ВПС единственного желудочка (ЕЖ) часто выявляют во время рутинного ультразвукового скрининга из-за наличия аномалии на четырехкамерном срезе; большинству пациентов диагноз ставят еще до рождения.93 Самой распространенной формой ЕЖ ВПС является СГЛОС, частота которой составляет 0,26 на 1 000 живорожденных.13 Другие формы ЕЖ ВПС включают гипопластический синдром правых отделов сердца (0. 22 на 1000 живорожденных) и одноузловое АВ-соединение, которое описывает группу сердечных пороков, при которых АВ-соединение полностью или преимущественно соединяется с одной камерой желудочка и включает двустворчатый левый желудочек, одностворчатый (с атрезией левого или правого АВ-клапана) и совместный вход (дефект АВ-перегородки с общим желудочком). ЕЖ формы ВПС являются одними из самых сложных форм ВПС, каждая из которых требует серии паллиативных операций, которые в конечном итоге завершаются полным кавапульмональным аностомозом (“Фонтан”) кровообращения. В этом разделе мы рассмотрим общие подходы к визуализации всех форм ЕЖ ВПС, необходимые для консультирования семей относительно диагноза и прогноза, а также то, какая визуализационная информация необходима для ведения родов и неонатального менеджмента.
Общий подход к визуализации. Как и при эхокардиографии плода у структурно нормальных сердцах, следует оценить висцероатриальный ситус, системные венозные связи, АВ-соединения, морфологию и функцию ЕЖ, а также частоту и ритм сердечных сокращений плода. Рекомендуется сегментарный подход к эхокардиографической визуализации ЕЖ ВПС плода для выявления важных ассоциированных находок.
Венозные соединения. Следует оценить системные и легочные венозные соединения, а также положение/морфологию предсердий, поскольку аномалии могут иметь значение для консультирования относительно последствий и хирургического подхода к паллиации ЕЖ. Для системных вен следует выполнить оценку НПВ на предмет внутрипеченочного прерывания (при соединении печеночной вены непосредственно с предсердием) и наличия билатеральной ВПВ. Следует оценить легочные венозные соединения, поскольку аномальный дренаж существенно влияет на хирургический подход и результаты.94 При СГЛОС для выявления гипертензии левого предсердия используют допплерографию легочной вены и соотношение прямого/обратного ИСП (Рисунок 21). В некоторых центрах для оценки легочной сосудистой реактивности в третьем триместре у плода с СГЛОС применяют тестирование материнской гипоксии для повышения специфичности и чувствительности прогнозирования потребности в ургентном вмешательстве. Исследования показали, что недостаточная легочная вазореактивность (снижение индекса пульсации легочной артерии <10%)95 ассоциируется с неонатальной гемодинамической нестабильностью и необходимостью срочного вмешательства для открытия межпредсердной перегородки после рождения.
Рисунок 21 Полная эхокардиографическая оценка степени ограничения межпредсердной перегородки у плода с обструкцией левых отделов сердца. (А) Показан поток слева направо через межпредсердную перегородку. (В) Продемонстрировано расширение легочной вены и поток слева направо. (С) PW допплерография демонстрирует аномальную картину прямого/обратного потока, что соответствует умеренно повышенному давлению в левом предсердии.
АВ-апоневрозы. ЕЖ ВПС может иметь гипопластические или атретические трикуспидальный или митральный клапаны или общий АВ-клапан, который является несбалансированным (преимущественно ограничен одним желудочком; Рисунок 22). Следует измерить размер АВ-клапана (см. Таблицу 13) и оценить степень клапанной регургитации с помощью цветной допплерографии. Наличие значительной регургитации АВ-клапана может повлиять как на благополучие плода, так и на постнатальный результат хирургического паллиативного лечения ЕЖ.99
Рисунок 22 Примеры поражений сердца при ЕЖ на четырехкамерном срезе и 3СТ с цветным допплеровским исследованием и без него.
Таблица 13 Руководства по анатомической, физиологической и функциональной оценке анатомических, физиологических и функциональных особенностей при самых распространенных поражениях ВПС плода, связанных с конкретным заболеванием
| Категория | Заподозрили, когда | |||||
| ЕЖ и желудочковая диспропорция | Аксиальный снимок грудной клетки показывает асимметричные камеры желудочков | |||||
| Повреждение | Ключевые наблюдения | Распространенные венозные вариации | Специфические проблемы с АВ-клапаном | Визуализация оттока | Дополнительные измерения | Другие ключевые моменты |
| Несбалансированный ДАВП (правая или левая доминанта) | Наличие ДАВП с одним АВ-клапаном, первичным ДМПП или выходным ДМЖП | Течение ВПВ и НПВ, примитивные азиготные системы, раздельные печеночные соединения, TAPVR | Регургитация общего клапана; может быть прогрессирующей
Необходима фронтальная визуализация АВ-соединения |
Определить вентрикулоартериальные соединения; оценить выходной тракт желудочка на наличие стеноза или атрезии. | Измерьте размер правого и левого АВ-клапана (Рисунок 23), индекс Коэна, ИАВК, угол притока ПЖ/ЛЖ | Оцените сбалансированность АВ-клапана в разделе “Общий АВ-клапан”; рассмотрите изомерию/гетеротаксис предсердий |
| Атрезия трикуспидального клапана | Отсутствует АВ-соединение, малый правый желудочек, ДМЖП | Двусторонние ВПВ
Доброкачественная реверсия А-волны при ВП |
Пролапс, дилатация или регургитация митрального клапана | Определить вентрикулоартериальные соединения; могут быть транспонированы. Оценить стеноз оттока ПЖ; проверить кровоток дуги на зависимость от протока | Может измерять размеры ДМЖП в двух ортогональных плоскостях | Прогрессирующая обструкция ДМЖП нарушает кровоток в выходном тракте ПЖ (что приводит к легочному стенозу, коарктации) |
| СГЛОС | Малый левый желудочек с митральным/аортальным стенозом или атрезией на четырехкамерном срезе | Двусторонние ВПВ | ТР с дисфункцией ПЖ может повышать риск внутриутробной гибели плода и постнатальной болезни/смерти | Оцените аортальный клапан, размер восходящей аорты и поперечной дуги. Проведите допплерографию легочного клапана.
Проверьте направление потока в поперечной дуге |
Определите диаметр восходящей аорты, прогнозируя результаты после процедуры Норвуда | Оцените наличие ущемления межпредсердной перегородки: допплеровский коэффициент ИСП легочной вены < 3 свидетельствует о недостаточном выходе левого предсердия, что повышает вероятность неонатальной септопластики предсердий |
| Сложная аномалия АВ-соединения | Аксиальный четырехкамерный срез не имеет четкого разделения АВ-клапана в основании | |||||
| Левый желудочек с двойным входом | Оба АВ-клапана ЛЖ с “большой” ДМЖП или отсутствующей перегородкой на четырехкамерном срезе | Двусторонние ВПВ | Оценить размер каждого АВ-клапана (один клапан может быть стенозированным или атретичным), а также степень клапанной регургитации
АВ-клапан может проникать в выходную камеру |
Определите АВ и вентрикулоартериальные соединения (могут быть D- или L-образные желудочки, ДСПЖ)
Оцените проходимость выходного тракта, соединенного с морфологическим ПЖ, на предмет подклапанной или клапанной обструкции |
При риске полной блокады сердца с L-образными желудочками, если левый АВ-клапан гипопластический или атретический, оцените адекватность дефекта межпредсердной перегородки | |
| Общий АВ-клапан, ДАВП | Отсутствие смещенных или АВ-клапанов на одном уровне, большое предсердие или ДМЖП | Двусторонняя ВПВ, прерванная НПВ, TAPVR | Морфология, баланс, регургитация; конфигурация сосочковых мышц | Нормально связанные или транспонированные, подклапанная обструкция или гипоплазия клапана, обратный поток в протоке или дуге аорты | Индекс Коэна ИАВК
Угол притока ПЖ/ЛЖ |
Дополнительные ДМЖП могут быть пропущены, если не искать их специально |
| Перекрестные сердца | Неправильное расположение АВ-клапана путает подсчет желудочков (перекошенные ПЖ или ЛЖ) | Аномалии висцероатриального положения двусторонних ВПВ | ТР или МР, комбинирование, переопределение | Тщательно определите соединения, могут быть ДСПЖ/d-ТМА, l-ТМА при наличии L-образной формы, обструкции выходных трактов | Размеры кольца АВ-клапана | Постнатальную физиологию трудно предсказать, если визуализация не направлена на определение связей, а не взаимоотношений |
| Промежуточные клапаны | Четырехкамерный срез показывает ДМЖП или перекрывающую аорту | Двусторонние ВПВ | Размер, регургитация, степень растянутости клапана и распределение хорд | D- или L-образные желудочки и риск сердечной блокады, подклапанной и клапанной обструкции, неправильного расположения аорты | Если левый АВ-клапан гипопластичный, есть риск развития гипертензии левого предсердия | |
| Митральный стеноз: парашютовидный, гипоплазия | Асимметрия ПЖ > ЛЖ | ЛВПВ
Аортальный стеноз, коарктация |
Морфология, папиллярные мышцы; измерение Z-оценки | Рассмотрите ДСПЖ при наличии ДМЖП и нормальных размерах восходящей аорты и ее кровотока | Размер овального отверстия; Соотношение прямой/обратной легочной вены; Соотношение прямой/обратной легочной вены | Направление потока через овальное отверстие имеет решающее значение для определения адекватности митрального клапана |
| Поражение путей оттока с нормальным 4-ch | Аномальная ось, отток ЛЖ или недостижимые 3СC | |||||
| ТФ | Аномальная ось или отток ЛЖ с ДМЖП и перекрывающим сосудом | Двусторонние ВПВ, ретроаортальная непарная вена
Правая дуга аорты Сосудистые кольца Аортолегочное окно |
Редкие митральные или трикуспидальные пороки и связь с ДАВП | 3СС: малая легочная артерия. Вид трахеи: наличие протока, направление течения, отсутствие артериального протока. Непрерывность ветвей легочных артерий | Оцените ветви легочных артерий, кольцо ПЖ, воронку последовательно и основные коллатеральные сосуды | Направление протока в 28 недель прогнозирует потребность в неонатальном вмешательстве. Соотношение Ao/ЛК < 0,6 и показатель ЛК Z < 5 прогнозируют потребность во вмешательстве |
| Общий артериальный ствол | Двусторонние ВПВ
Правая дуга аорты, сосудистое кольцо Ретроаортальная непарная вена |
ТР, МР | Аортальная или легочная доминанта, одна или две дуги или прерывание аорты (тип) происхождения ЛА | Скорость прохождения, регургитация Размеры проксимальной ветви ЛА | Правая дуга аорты ассоциируется с >50% риском del22q11 | |
| ДСПЖ | Двусторонние ВПВ | Оцените размер, регургитацию, расслоение митрального клапана, расслоение ТК, ДАВП АВ-клапана | Нормально связанные или транспонированные, оценить обструкцию/гипоплазию, поток протока/дуги аорты, окно AP, проходимость легочной артерии | Отношение ДМЖП к сосудам: Определить ЛЖ-аортальный путь, оценить размер ДМЖП, прикрепление АВ-клапана | Желудочковые петли, взаимосвязь и гипоплазия | |
| d-ТМА | Аномальный 3СС, вид оттока из ЛЖ аномальный, параллельные оттоки | Нету | d-ТМА при ДМЖП ± легочный стеноз может иметь аномальный МК: расщепленный МК | Аортальный и легочный клапаны в норме; гипоплазия аорты связана с гипоплазией ТК, ЛК, возможно, двустворчатый | Размер овального отверстия
Индекс экскурсии перегородки |
Обычно аортальный клапан имеет большие размеры, чем в норме |
| l-ТМА | Нету | Аномальный крест на четырехкамерном срезе; смещение ТК, общая ТР и влияние на прогноз | Оценка легочной или сублегочной обструкции
Оценка гипоплазии дуги |
АВ-интервалы
Наличие и размер ДМЖП |
Может иметь аномальную ось, мезо- или декстропозицию
Серийный мониторинг для выявления сердечной блокады |
|
| Прогрессирующая обструкция полулунного клапана | 3СС ненормальный; четырехкамерная асимметрия | |||||
| Стеноз аорты | Утолщенный клапан ЛЖ, расширенная аорта на 3СС, гипертрофия/дисфункция ЛЖ на четырехкамерном срезе | Допплерография легочной вены с реверсией в систолу предсердий | Аномалии митрального клапана: гипоплазия, аркадная МР-скорость для функции ЛЖ | Реверсия потока поперечной дуги прогнозирует тяжелую обструкцию; допплерография может недооценивать тяжесть при дисфункции ЛЖ | Дуга и перешеек аорты (риск коарктации)
Продолжительность митрального притока Продолжительность пиковой скорости МР (при наличии) |
Задокументируйте направление потока через овальное отверстие. Оцените, повышено ли давление в ЛЖ вследствие ограничения межпредсердной перегородки |
| Стеноз легочной артерии | Аномалия четырехкамерного: Увеличение ЛА, ПЖ < ЛЖ, гипертрофия; инверсия цвета в 3СC | Повышенный реверс А-волны в системных венах является распространенным явлением | Размер трикуспидального кольца, продолжительность притока PW ТР. Умеренная ТР связана с низким синусоидным риском | Анатомия протоков: Стеноз левой ЛА, проблемы с оттоком. Реверс потока указывает на проточную зависимость | Размеры ветки ЛА
ТР пиковая скорость (если присутствует) |
Оцените коронарно-камерные свищи (“синусоиды”) с помощью низкоскоростной цветной допплерографии |
| Аномалия Эбштейна и дисплазия ТК | Увеличение ПП, кардиомегалия, диспластические ТК-стулки; кольцевой поток туда-сюда | Повышенный реверс А-волны при НПВ, а также пульсации венозного протока и ПВ | Размер трикуспидального кольца и пиковая скорость трискупидальной регургитации прогнозируют прогрессирование | Стеноз или атрезия ЛА, функциональная атрезия; PR Гипоплазия ветвей ЛА Направление протокового шунта Редкие ассоциации с коарктацией | Серийное измерение: ТК кольцо, пиковая скорость ТР, легочный поток, PR, функция ЛЖ, допплерография ПА и СМА | |
| СОКЛА | Ассоциированные с ТФ или изолированные: Гипоплазия ЛВ, дилатация ЛА, увеличение ПП/ПЖ | Реверсия А-волны в НПВ и венозном протоке сигнализирует о повышении давления ПП | Оцените ТР с помощью PW и CW допплерографии для определения систолического давления/функции ПЖ | Артериальный проток, как правило, отсутствует, но его наличие следует оценивать, поскольку он влияет на прогноз | Серийное измерение размера ветвей ЛА, бивентрикулярной функции, CTR ПА и допплерография СМА | |
| Аномалии дуги | 3СС или 3СТ аномалия | |||||
| Коарктация | ПЖ>ЛЖ, восходящая Ао меньше ВПВ, малый поперечный и нисходящий/перешеек, малый поперечный и нисходящий/перешеек | ЛВПВ к коронарному синусу | Анатомия митрального отверстия, направление потока через межпредсердную перегородку | Стеноз аортального клапана, двустворчатый аортальный клапан | Перешеек аорты | Уровень ложноположительных и ложноотрицательных результатов является значительным |
| Сосудистые кольца | 3СТ образует U-образную форму вокруг пищевода и трахеи | Нету | Нету | Исключить аберрантные подключичные артерии, двойную дугу аорты | При необходимости | Повышенный риск развития аномалий трахеи, трахеальных колец |
| Аневризма протока | На поздних сроках беременности аномальная 3СС, 3СТ или сагиттальная дуга выглядит извилистой | Нету | Нету | Перешеек аорты
Диаметр артериального протока в самом широком месте |
В целом нормальный вариант, без клинической корреляции у новорожденных |
Ао – аорта; ДАВП – дефект атриовентрикулярной перегородки; ИАВК – индекс АВ-клапана; CTR – соотношение сердечно-грудной площади; ДСПЖ – двустворчатый правый желудочек; ВП – венозный проток; ЛП, левое предсердие; ЛВПВ, левая ВПВ; СМА, средняя мозговая артерия; ЛА, легочная артерия; ЛК, легочный клапан; ПП, правое предсердие; TAPVR, тотальный аномальный легочно-венозный возврат. Эта общая информация не является исчерпывающей и не заменяет специальную литературу по анатомии и физиологии сердца плода при ВПС.
Желудочково-артериальное соединение. Поражения ЕЖ могут иметь различные желудочково-артериальные связи и вариации обструкции легочного или системного кровотока. Поэтому у плода с ЕЖ ВПС необходимо тщательно визуализировать отток (токи), включая ориентацию (нормальная, транспонированная, неправильная), проходимость, размер и направление кровотока. У пациентов со стенозом или атрезией аорты следует измерить диаметр восходящей аорты. Цветная допплерография дуг в 3СС, 3СТ и сагиттальной плоскостях является ключевой, поскольку ретроградный поток в дуге аорты или протока является едва ли не самым мощным показателем необходимости инфузии простагландинов после рождения.100 У плодов с гипоплазией аортального или легочного клапана стеноз клапана может прогрессировать во время гестации, поэтому следует проводить серийную оценку гемодинамики клапанов и крупных артерий (Таблицы 13 и 14).
Таблица 14 Механизмы и закономерности прогрессирования ВПС плода
| Развитие/прогресс | Заболевания сердца, связанные с эволюцией | Эволюция/прогресс |
| АВ и полулунный клапан/препятствие оттоку |
|
|
| АВ и полулунная регургитация клапана |
|
|
| Желудочек, клапан, большая артерия, ветвь ЛА, гипоплазия дуги |
|
|
| Сужение овального отверстия |
|
|
| Сужение протока или образование аневризмы |
|
|
| Регрессия/прогрессирование опухоли |
|
|
| Расширение камер |
|
|
| Желудочковая дисфункция |
|
|
| Сердечная недостаточность |
|
|
| Аритмии при ВПС плода |
|
|
| Уменьшение размера ДМЖП |
|
|
ПБС – предсердная баллонная септостомия; ВУГП – внутриутробная гибель плода; ЛА – легочная артерия; ПЛГН – персистирующая легочная гипертензия новорожденного; ТМА – транспозиция магистральных артерий.
Ритм, функция и морфология. В клинической практике функция оценивается качественно, хотя сообщалось о количественных показателях, включая фракционное укорочение, экскурсию трикуспидального и митрального кольца и индекс сферичности.104 Методы визуализации миокарда, такие как деформация и скорость деформации, могут предоставить более количественную картину функции желудочков, но в настоящее время не используются в клинической практике.105 Брадиаритмии (например, полная блокада сердца или дисфункция синусового узла) ассоциируются с изомерией левого предсердия и дискордантными АВ-связями. Эта комбинация имеет плохой прогноз и высокий риск внутриутробной смертности.106
Ключевые моменты
- При подозрении на ВПС необходимо провести полное эхокардиографическое исследование плода, прежде чем можно будет сделать обоснованный прогноз.
- Необходимо продемонстрировать направление потока и любые ограничения на межпредсердной перегородке, артериальном протоке (при наличии) и перешейке аорты (при наличии).
- Для консультирования и планирования постнатального ведения следует выполнить визуализацию системной и легочной венозной анатомии.
- Следует измерить диаметр или площадь АВ-клапана и оценить степень регургитации АВ-клапана с помощью цветной допплерографии.
- У плодов с СГЛОС (и вариантами с отсутствием выхода из левого предсердия) следует измерять соотношение прямого/обратного легочного кровотока для определения риска постнатального ургентного вмешательства при каждой эхокардиографической оценке плода, с последним измерением в ближайшие сроки.
- Для ВПС с СГЛОС (и вариантами с отсутствием выхода из левого предсердия) в отдельных случаях для оценки легочной сосудистой реактивности может рассматриваться проведение теста на гипероксигенацию матери в конце третьего триместра.
ii. Сложные АВ-соединения. Поражения АВ-соединения могут быть изолированными (хотя часто связаны с анеуплоидией, включая трисомию 21) или могут быть чрезвычайно сложными и проявляться в сочетании с несколькими сопутствующими пороками.107 Область АВ-соединения называется “крестом” сердца и является анатомической точкой соединения предсердной камеры (камер) с желудочками. В норме левый митральный клапан – это двустворчатый клапан с хордовым прикреплением к двум отдельным папиллярным мышцам на свободной стенке левого желудочка. Правосторонний ТК несколько больше смещен апикально с тремя створками и хордовыми прикреплениями, распределенными по всему телу правого желудочка, включая поверхность межжелудочковой перегородки. Хотя четырехкамерный срез позволяет оптимально визуализировать морфологию сердечной мышцы и АВ-клапана, а также наличие ДМЖП и аномалий выходного тракта, при подозрении на аномалию необходима дополнительная визуализация. ВПС с аномальными или неправильно сформированными АВ-клапанами имеют высокую частоту диспропорции желудочков, ассоциированных дефектов межжелудочковой перегородки и недоразвития оттоков и крупных артерий, что может привести к необходимости паллиативного хирургического подхода к ЕЖ.
Общий подход к визуализации. При наличии аномалий АВ-клапана важное значение имеет оценка общих структур сердца плода, включая размер и функцию желудочков, а также АВ-баланс над желудочками, является важным. После первичного определения положения плода, оптимальной отправной точкой для оценки этих пороков является четырехкамерный срез. В этом срезе следует позаботиться о выравнивании АВ-перегородки в более перпендикулярной плоскости, чтобы четко определить морфологию АВ-клапана и точки вставки створок, а также хордовое распределение и вставку. Определяются желудочковые петли и выравнивание. Кольцевые размеры АВ-клапана следует измерять в ранней диастоле в точках шарниров клапана. Поскольку в этой группе аномалий часто встречаются аномалии путей оттока и крупных артерий, обязательным является получение краниальных разверток для определения анатомии, размера и проходимости как выходного тракта, так и крупных артерий. Сагиттальная проекция грудной клетки плода лучше всего обеспечивает короткоосевую визуализацию морфологии АВ-клапана, хордовых прикреплений, а также расположение и морфологию папиллярных мышц (Рисунок 23). Аномальный приток через АВ-клапан или регургитацию следует оценивать с помощью цветной допплерографии. PW допплерографическая оценка структуры притока является очень важной.
Рисунок 23 Количественная оценка степени дисбаланса при дефекте межпредсердной перегородки. Из парасагиттальной проекции в диастолу можно измерить площадь общего АВ-клапана, распределенную на каждый желудочек, и рассчитать индекс АВ-клапана (ИАВК). В зависимости от используемого уравнения, соотношение примерно 2:1 или выше указывает на необходимость паллиации ЕЖ. LA – левое предсердие; LV – левый желудочек; RA – правое предсердие; RV – правый желудочек.
Дефекты АВ-перегородки. Общее АВ-соединение или дефект АВ-перегородки визуализируется на четырехкамерном срезе, при этом отмечается аномальная сердцевина, в которой створка правостороннего АВ-клапана находится на том же уровне, что и передняя створка левого АВ-клапана в закрытом состоянии (Рисунки 23 и 24). Этот результат должен побудить к оценке левого АВ-клапана на предмет наличия щели или общего отверстия, межпредсердной перегородки на предмет первичных дефектов и входной перегородки желудочков. Если по данным 2D или цветной потоковой визуализации клапан преимущественно прилегает к одному из желудочков с диспропорцией размеров желудочков или без нее, площадь общего АВ-клапана, распределенную на каждый желудочек, можно измерить в парасагиттальной проекции в диастолу (Рисунок 23), а индекс АВ-клапана можно рассчитать как площадь левой/правой створок 108 или измерить угол притока ПЖ/ЛЖ в апикальной проекции четырехкамерного среза (Рисунок 24). Следует оценить пути оттока, чтобы определить наличие обструкции со стороны конусной перегородки, подклапанной фиброзной ткани, АВ-клапана или вспомогательных тканей.
Рисунок 24 Сбалансированного (A, B) и несбалансированного праводоминантного (C) и леводоминантного (D) дефекта межпредсердной АВ-перегородки в четырехкамерном аксиальном срезе. Степень дисбаланса можно количественно оценить с помощью измерения угла наклона створок (А, пунктирная линия), причем меньший угол ассоциируется с увеличением дисбаланса.
Врожденные пороки митрального клапана. Аномалии митрального клапана могут привести к уменьшению потока через левые отделы сердца и реверсии потока в овальном отверстии. Следует выполнить двумерную визуализацию и цветную допплерографию митрального клапана и межпредсердной перегородки, а также PW допплерографию легочных вен для оценки повышенного давления в левом предсердии. Изолированная дисплазия митрального клапана и “аркада” митрального клапана 109,110 являются аномалиями, которые вызывают значительную митральную регургитацию, хотя любая степень регургитации митрального клапана является аномальной. При наличии митральной регургитации следует учитывать сопутствующие обструктивные поражения оттока ЛЖ.111
Комбинированные/перекрывающие АВ-клапаны и перекрестное сердце. “Перекрывающий АВ-клапан” – это термин, который применяется, когда хордальный аппарат проходит через ДМЖП и прикрепляется к стенке или папиллярно-мышечной структуре противоположного желудочка. Перекрывающий АВ-клапан характеризуется клапанным кольцом, которое анатомически расположено над межжелудочковой перегородкой и открывается в оба желудочка.112 При перекрестных АВ-связях или “скрученных” АВ-связях аппарат каждого из двух АВ-клапанов пересекается друг над другом, обычно так, что предсердие с правой стороны открывается в левый желудочек, а предсердие с левой стороны открывается в правый желудочек. Кроме того, желудочковая петля может быть такой, что имеет место АВ-конкордантность или АВ-дискордантность.113 При АВ-дискордантности почти всегда наблюдается ДМЖП с высокой частотой АВ-клапана, проходящего через порок. Тщательная визуализация клапанов, включая размеры, функцию и прикрепление, с использованием комбинации 2D, цветной допплерографии и PW допплерографии с различных срезов (Рисунок 25), должна сопровождать диагностику. При наличии пролабирующих или перекрывающих АВ-клапанов восстановление путем хирургического закрытия ДМЖП может быть невозможным и потребовать паллиативного хирургического подхода к ЕЖ.
Ключевые моменты
- При наличии аномалий АВ-клапана следует оценить все сердечные структуры плода, включая оценку размера и функции желудочков, а также баланс АВ-клапана.
- У плода с подозрением на аномалию АВ-соединения следует использовать нестандартные плоскости и анфас для детальной оценки анатомии клапанов, хорд и их вставок.
- Полное допплеровское исследование сердца плода, включая оценку АВ-клапана (клапанов) на предмет стеноза, регургитации и направления потока на межпредсердной перегородке и артериальном протоке, должно проводиться при каждом обследовании.
- Дополнительные поражения, которые могут повлиять на хирургический подход, должны быть очерчены для определения окончательной хирургической стратегии паллиации (паллиация ЕЖ или бивентрикулярная пластика).
Рисунок 25 Пролабирование левого АВ-клапана, что затрудняет или делает невозможным стратегию бивентрикулярной пластики. (A-D) d-ТМА с ДМЖП. Плод с атипичной щелью митрального клапана и перекрещиванием хорд митрального клапана через выходное отверстие ДМЖП. (А) и (В) показывают аксиальную плоскость с аномальным открытием митрального клапана в сторону перегородки, тогда как анатомия клапана лучше видна на (С) и (D), где парасагиттальная плоскость демонстрирует вид митрального клапана анфас в двух разных диастолических кадрах. На практике эту анатомию лучше демонстрировать с помощью видеоклипов и сканирования в реальном времени. (E, F) Двустворчатый правый желудочек с подлегочным ДМЖП и пролабированием митрального клапана, что делает неонатальную процедуру Damus-Kaye-Stansel более целесообразной, чем операцию артериального переключения.
iii. “Похожие” поражения выходных трактов. Поражения, касающиеся путей оттока, выявляются во время акушерского анатомического ультразвукового скрининга с использованием срезов выходных трактов, 3СС и 3СТ. Часто при аномалиях выходных трактов имеются минимальные аномалии, отмечаемые на четырехкамерном срезе. Хотя многие из этих пороков могут выглядеть похожими при ультразвуковом скрининге, полное эхокардиографическое исследование плода предоставляет подробную информацию, которая затем влияет на перинатальное планирование, вмешательства, необходимые при рождении, а также на долгосрочное ведение и прогноз, что зависит от точного физиологического и анатомического диагноза.
Общий подход к визуализации. ВПС, затрагивающие пути оттока, часто ассоциируются с другими аномалиями, включая аномалии системных или легочных венозных связей, АВ-клапана, межпредсердной или межжелудочковой перегородки, ветвей легочных артерий и дуги аорты. Как и при других ВПС, следует тщательно оценить висцероатриальное положение, системные венозные связи, АВ-соединение, морфологию и функцию желудочков, а также частоту и ритм сердечных сокращений. Визуализационные изображения и развертки от четырехкамерного среза до срезов выходного тракта, 3СС и 3СТ позволят детализировать сегментарную анатомию, включая АВ и вентрикулоартериальные соединения, а также взаимоотношения магистральных артерий. Короткоосевые и коронарные изображения могут быть использованы для локализации любых дефектов межжелудочковой перегородки и определения взаимоотношения магистральных артерий между собой и с желудочками.
Поражение с ДМЖП и расширение магистрального сосуда. Дифференциальная диагностика при картине со стороны выходного тракта, которая включает ДМЖП и расширение магистрального сосуда включает тетраду Фалло (ТФ) и атрезию легочной артерии с ДМЖП, двустворчатым правым желудочком и общим артериальным стволом (Рисунок 26). ТФ характеризуется преобладанием аорты и различной степенью обструкции подлегочного и легочного клапанов, варьирующей от легкого легочного стеноза до легочной атрезии или дилатации при наличии синдрома отсутствия легочного клапана (СОЛК). ТФ также может наблюдаться в сочетании с дефектом межпредсердной перегородки.114 Ветви легочных артерий должны быть идентифицированы в месте их происхождения, поскольку прерывание, сегментарный стеноз и основные аорто-легочные коллатерали могут сосуществовать с очевидно исправными выходными трактами и/или артериальным протоком и иметь последствия для лечения и долгосрочного исхода 115-119 (Таблица 13). Визуализация ассоциированных аномалий дуги и тимуса позволяет проводить индивидуальное консультирование относительно риска делеции 22q11.120 При ТФ с отсутствующим легочным клапаном дисфункция желудочков прогнозирует эмбриональную и перинатальную заболеваемость и смертность.121
При двустворчатом правом желудочке ДМЖП может быть субаортальным, субпульмональным, двойным или отдаленным, поэтому необходимо определить ориентацию и относительные размеры аорты и легочной артерии при выходе из желудочка, а также их отношение к ДМЖП. Если ДМЖП находится под легочной артерией, передняя аорта может быть отягощена в субаортальной области, что требует тщательной визуализации дуги аорты с помощью двумерной и цветной допплерографии, поскольку коарктация часто сопровождает эту ситуацию. Если ДМЖП является субаортальной, анатомия и постнатальная физиология могут быть подобными ТФ.
Общий артериальный ствол, характеризуется единственным артериальным стволом, который дает начало непосредственно коронарным артериям, аорте и одной или обеим легочным артериям. Функция стволового клапана, особенно значительная регургитация, может влиять на внутриутробное выживание.77 Существует значительная анатомическая вариабельность с доминирующей приверженностью к легочному кровообращению (ответвления легочных артерий от общего ствола, меньшая перегородка аорты с прерыванием дуги или без него) или к аортальному кровообращению (доминирующая восходящая аорта с ответвлениями легочных артерий, выходящими вместе или отдельно от общего ствола). 122 Хотя артериальный проток часто отсутствует, он может присутствовать во всех формах общего артериального ствола, причем более легочно-доминантные варианты и ствол с прерванной дугой аорты полностью зависят от проходимости артериального протока для перфузии нижней части тела. Эти плоды зависят от инициации простагландина Е1 при рождении.
Рисунок 26 Аномалии, выявляемые при оценке выходного тракта левого желудочка (ВТЛЖ), которые могут быть невидимыми на четырехкамерном срезе. Изображение (А) показывает задний сосуд, который дает начало легочной артерии, с подлежащим ДМЖП и аортой, расположенной спереди (аномалия Тауссиг-Бинга). Изображение (B) – плод с общим артериальным стволом, (C) – плод с ТФ, (D) – d-ТМА с параллельными путями оттока. (E) демонстрирует сосуд, который рано отходит от ветвей ВТЛЖ (стрелка) и, таким образом, является легочной артерией, что также позволяет диагностировать d-ТМА. (F) l-ТМА, показывает, что правое предсердие (с визуализацией ВПВ) соединено с левым желудочком, а ВТЛЖ дает начало задней легочной артерии. Ао – аорта; LV – левый желудочек; PA – легочная артерия; RA – правое предсердие.
Поражение с оттоком крови из ЛЖ, что приводит к формированию задней легочной артерии. Как d-ТМА, так и l-транспозиция магистральных артерий (l-ТМА) демонстрируют схожую заднюю легочную артерию, выходящую из выходного тракта ЛЖ (Рисунок 26). Диагноз d-ТМА должен побуждать к проведению визуализации межпредсердной перегородки на поздних сроках беременности, а также к родоразрешению в условиях, которые позволяют увеличить дефект межпредсердной перегородки, если шунтирование не является адекватным. l-ТМА может быть идентифицирована на четырехкамерном срезе путем визуализации аномальной сердцевины и средней полосы в верхушке левостороннего правого желудочка. Сочетание АВ и вентрикулоартериальной дискордантности приводит к физиологически скорректированному кровотоку. Частота ДМЖП при l-ТМА может составлять от 60% до 70%, хотя тип и локализация ДМЖП вариабельны.123 Дисплазия ТК и мальформация Эбштейна могут быть связаны с l-ТМА, как и коарктация аорты. Нарушения ритма и врожденная блокада сердца могут проявляться во время внутриутробной жизни и влиять на выживаемость, поэтому показано серийное обследование.124
Ключевые моменты
- Подозрения на аномалии путей оттока следует оценивать с помощью эхокардиографии плода, прежде чем обсуждать с пациенткой прогноз, сопутствующие аномалии и дополнительное обследование (в том числе генетическое).
- При подозрении на аномалии путей оттока полное обследование включает визуализацию ветвей легочных артерий у их истоков. Прерывание, сегментарный стеноз и основные аорто-легочные коллатерали могут сосуществовать с очевидно нормальным путем оттока и/или артериальным протоком; направление потока в протоке с помощью допплерографии должно быть задокументировано.
- Латеральность дуги аорты должна быть задокументирована по крайней мере один раз во время гестации, а также сделана попытка очертить схему разветвления, особенно если дуга аорты и проток находятся по разные стороны трахеи.
- Дуга аорты находится в зоне риска при любом поражении с субаортальной обструкцией или подлегочной ДМЖП; дугу следует визуализировать с помощью двумерной и допплеровской эхокардиографии в аксиальной и сагиттальной плоскостях для оценки проходимости и размеров.
- Любому плоду с ДАВП следует провести оценку проходимости овального отверстия на поздних сроках гестации.
- При беременности с диагнозом l-ТМА плода следует предложить серийную эхокардиографическую оценку плода для выявления прогрессирующей регургитации АВ-клапана и нарушений ритма, включая полную блокаду сердца.
iv. Прогрессирующие поражения, обструктивные и регургитационные. То, что сначала выглядит как легкий порок сердца плода, может эволюционировать в более тяжелую структурную и функциональную болезнь (Таблицы 13 и 14). К поражениям с наибольшим потенциалом прогрессирования в утробе матери относятся полулунная клапанная обструкция при интактной межжелудочковой перегородке и поражения, связанные со значительной клапанной регургитацией. Эхокардиографическая оценка таких поражений плода требует всестороннего определения сегментарной и клапанной анатомии, а также функции бивентрикулярного и АВ-клапанов, а учитывая их прогрессирующий характер, важным является проведение серийных исследований. При прогрессировании эти поражения могут привести к сердечно-сосудистой компрометации, поэтому рутинное допплерографическое исследование системного венозного кровотока, венозного протока, артериальной и венозной артерии пуповины, а также артериального кровотока средней мозговой артерии является чрезвычайно важным.
Полулунная клапанная обструкция при интактной межжелудочковой перегородке. Стенозы аортального и легочного клапанов плода имеют широкий спектр тяжести. Более тяжелая обструкция, особенно на ранних сроках гестации, может привести к прогрессирующей гипоплазии желудочков 125,126 или вызвать водянку плода, если есть нарушение наполнения контралатерального желудочка.127 Оценка морфологии полулунного клапана, его размера, проходимости и функциональности, включая использование цветного, PW и CW допплера, является важной для постановки диагноза и определения степени тяжести поражения (Рисунок 27). Рост большой артерии ниже по течению от обструкции может быть нарушен, что приводит к дилатации или гипоплазии при длительной обструкции, что требует повторных измерений. Ретроградный поток в ипсилатеральной дуге свидетельствует о критической обструкции полулунного клапана на любом сроке беременности 100 и его следует искать повторно в течение беременности, если он не был обнаружен при первичном обследовании (Рисунок 28). Тяжесть стеноза, вероятность прогрессирующей гипоплазии клапана и показания к пренатальному вмешательству можно определить путем оценки размеров желудочков (конечный диастолический диаметр и длина), определения верхушечного желудочка, а также наличия гипертрофии и / или фиброэластоза эндокарда,128 и оценки систолической и диастолической функции ипсилатерального желудочка.128-131 CW допплерография митральной и ТК регургитации дает ключевую гемодинамическую информацию о тяжести аортального и легочного стеноза соответственно, а также о функции желудочков, причем более высокие скорости при более тяжелом заболевании свидетельствуют о сохраненной функции желудочков. И наоборот, низкая скорость регургитационной струи может свидетельствовать о менее выраженной обструкции, тяжелой дисфункции миокарда или указывать на то, что первичное поражение является миокардиальным или связано с выраженной регургитацией АВ-клапана (см. ниже), а не с обструкцией оттока. Оценка функции контралатерального желудочка и АВ-клапана имеет решающее значение для прогнозирования потенциальной возможности сердечно-сосудистой компрометации.
Кроме общих черт, существуют уникальные аспекты обструкции аортального и легочного клапанов плода. При аортальном стенозе следует оценить размер овального отверстия и поток через него. Высокое давление наполнения левого предсердия и ЛЖ при более тяжелой обструкции приводит к шунтированию левого предсердия на правое и может привести к ограничению предсердий с гипертензией левого предсердия, что в конечном итоге влияет на допплеровскую картину потока легочной вены.132 При критической обструкции легочного оттока, особенно при клапанной атрезии или близкой к ней атрезии с малым правым желудочком, могут присутствовать фистулы коронарной артерии, которые можно заподозрить по наличию потока “туда-сюда” на свободной стенке ЛЖ и межпредсердной перегородке.133
Ключевые моменты
- При подозрении на стеноз клапана следует провести серийное исследование сердца, включая оценку размера и функции желудочков, а также наличие фиброэластоза эндокарда.
- Направление потока в протоке и дуге аорты должно быть задокументировано при каждом обследовании; аномальное направление потока является предвестником критической постнатальной обструкции.
- Допплеровские градиенты давления могут быть измерены и зарегистрированы, но не обязательно указывают на выраженность стеноза.
- Направление потока через межпредсердную перегородку должно быть задокументировано при каждом обследовании.
- При стенозе аортального и легочного клапанов рекомендуется оценка бивентрикулярной функции, включая, но не ограничиваясь этим, допплеровскую картину венозного и желудочкового притока, временные интервалы, наличие клапанной регургитации, изменение площади фракций, фракционное укорочение и сердечно-грудной коэффициент.
Рисунок 27 Прогрессирование аортального стеноза. Выраженный аортальный стеноз у 23-недельного плода с расширенным и гипокинетическим левым желудочком (LV) с фиброэластозом эндокарда. (А) С помощью цветной допплерографии демонстрируется алиация, начинающаяся на аортальном клапане (стрелка) (слева) с градиентом спектральной допплерографии 25 мм рт. (B) Приток через митральный клапан (MV) однофазный и кратковременный (слева), а струя митральной регургитации свидетельствует о высоком систолическом давлении LV (градиент давления 46 мм рт. ст. плюс давление в левом предсердии; правая панель). (С) Наличие ретроградного потока дуги аорты (красный, слева) и потока слева направо через предсердия (красный, справа) являются дополнительными признаками, которые прогнозируют прогрессирующую гипоплазию левых отделов сердца, развивающуюся во время гестации из-за уменьшения кровотока через левые отделы сердца. (D) LV становится постепенно более шарообразным и уменьшается в длину, а к 36 неделям больше не имеет верхушки. RV, Правый желудочек.
Рисунок 28 Ретроградный поток в дуге ипсилатерально от обструкции полулунного клапана. (Верхняя панель) Тяжелая обструкция выходного тракта ПЖ, при которой 3СТ выглядит несколько нормальным, но цветная допплерография показывает ретроградный поток в артериальном протоке (синий цвет). (Нижняя панель) Сагиттальный вид дуги аорты выглядит нормальным на 2D изображении, но цветная допплерография обнаруживает ретроградный (синий) систолический поток в поперечной дуге.
Тяжелая атриовентрикулярная и полулунная клапанная регургитация. Значительная АВ или полулунная клапанная регургитация ассоциируется с увеличением объемной нагрузки, что проявляется прогрессирующей кардиомегалией, и плохо переносится кровообращением плода. Объемная нагрузка и, как следствие, бивентрикулярная дисфункция могут привести к невозможности перераспределения преднагрузки сердца, что приводит к гемодинамической нестабильности, повышению давления наполнения и многоводию.121,128 Болезнь ТК плода (БТК) и СОКЛА являются самыми распространенными поражениями с такой патофизиологией, хотя обычная регургитация АВ-клапана (рассмотренная в предыдущих разделах) также может прогрессировать и влиять на прогноз, особенно у пациентов с изомерией левого или правого предсердий (гетеротаксис).
Общий подход к визуализации. Первым признаком наличия БТК, как и при аномалии Эбштейна и дисплазии ТК, является значительная дилатация правого предсердия с дилатацией ПЖ или без нее. Оценка анатомии ТК в четырехкамерном и короткоосевом срезах проясняет основной диагноз (Таблица 13). Выраженность регургитации ТК можно оценить с помощью измерения ширины вены контрактуры относительно кольца клапана. Допплеровское исследование (PW и CW) недостаточной скорости струи имеет решающее значение для исключения первичной легочной обструкции (высокие скорости) и для определения способности правого желудочка генерировать систолическое давление. Оценка потока и проходимости легочного клапана является важной, поскольку это поражение может быть связано с анатомической или псевдолегочной атрезией, при которой легочный клапан не открывается, поскольку давление в ПЖ не может превышать системное давление (Рисунок 29). Структурная или функциональная атрезия легочной артерии при тяжелой БТК всегда связана с ретроградным протоковым потоком, который может развиться в любой момент гестации, поэтому направление потока в артериальном протоке должно быть задокументировано последовательно в течение всего срока гестации. Гипоплазия легочного клапана и главной легочной артерии является распространенным явлением из-за уменьшения оттока из ПЖ. Ветви легочных артерий следует визуализировать и измерять, поскольку артериальная гипоплазия коррелирует с ассоциированной гипоплазией легких.129 Следует оценить морфологию ЛЖ (эксцентриситет, наличие или отсутствие неуплотнения), размер и функцию ЛЖ, поскольку дисфункция ЛЖ при БТК может привести к сердечно-сосудистому компромиссу.128,130
Отсутствие увеличенного радиального смещения, уменьшенная окружная деформация и наличие диссинхронии ЛЖ также являются ключевыми признаками тяжелой БТК, которые, вероятно, отражают неоптимальное желудочково-желудочковое взаимодействие,128 хотя эти модальности все еще считаются исследуемыми. Следует оценить сердечный ритм, чтобы исключить часто встречающиеся эктопию предсердий и наджелудочковые тахиаритмии.131 Наконец, важно оценить наличие других структурных пороков, включая коарктацию аорты и ДМЖП.
СОКЛА чаще всего ассоциируется с ТФ с субаортальной ДМЖП, но может возникать и при интактной межжелудочковой перегородке. Учитывая последствия для хирургического лечения, а также ассоциированную делецию 22q11.2, дифференциация между этими двумя состояниями является критически важной. Прогрессирующая дисфункция ПЖ является предиктором перинатальной смертности.121 В дополнение к оценке размеров ветвей легочной артерии и соотношения сердечно-грудной площади, оценка положения сердца является важной, поскольку изменение СОКЛА указывает на наличие обструкции дыхательных путей с гиперинфляцией легкого ипсилатерально от обструкции дыхательных путей.121,134 Боталов проток встречается редко, но может быть обнаружена в ассоциации с прерывистыми легочными артериями или у плодов без ДМЖП. Следует оценить анатомию левых отделов сердца и функцию ЛЖ, поскольку было показано, что дисфункция ЛЖ независимо прогнозирует гибель плода.121 Оценка положения дуги аорты при ТФ или СОКЛА является важной, поскольку это может способствовать компрессии дыхательных путей, если ветвь легочной артерии ипсилатерально от дуги является аневризматической.
Ключевые моменты
- Следует проводить серийную оценку клапанной регургитации, поскольку она может ухудшаться с прогрессированием беременности.
- Прогрессирующая кардиомегалия является распространенным признаком порока сердца плода, что ассоциируется со значительной АВ и полулунной клапанной регургитацией.
- При тяжелой аномалии Эбштейна или тяжелой дисплазии ТК следует проводить PW и/или CW допплерографическое исследование трикуспидальной струи регургитации как показатель функции ЛЖ, поскольку он может быть использован для прогнозирования клинического исхода.
- Оценка положения сердца при ТФ с СОКЛА должна выполняться, учитывая, что аномальная ось вследствие сегментарного защемления легочной жидкости может быть связана со значительной обструкцией дыхательных путей после рождения и может быть использована для прогнозирования исхода.
Рисунок 29 Аномалия Эбштейна и дисплазия ТК у плода. (А) У этого плода выраженная трикуспидальная регургитация ассоциируется с прогрессирующей кардиомегалией, особенно дилатацией правого предсердия (RA), как показано на этих серийных изображениях в 19, а затем 34 недели, и может быть связана с развитием сердечной недостаточности/гидропсии. (B-D) Изображение плода с тяжелой аномалией Эбштейна, демонстрирующее выраженную кардиомегалию на четырехкамерном срезе. (С) Широкая струя трикуспидальной регургитации (стрелка) в сагиттальной проекции, причем струя регургитации начинается значительно ниже кольца ТК и даже по направлению к выходному тракту ПЖ из-за смещения створок перегородки. Также наблюдалась непрерывная легочная регургитация по данным цветной и CW допплерографии. (D) Последнее свидетельствует о том, что правый желудочек не способен генерировать достаточное давление для открытия легочного клапана.
V. Изолированные аномалии дуги. С введением 3СС и 3СТ срезов в акушерско-анатомические ультразвуковые протоколы за последние 10 лет увеличилось количество направлений с подозрением на аномалии магистральной артерии и дуги, несмотря на то, что в других случаях четырехкамерная оценка и оценка выходного тракта выглядят нормально.135 В частности, 3СТ срез имеет характерный вид с двумя одинаковыми по размеру дугами, образующими букву “V” слева от трахеи (Рисунок 6D и E). Несоответствие размеров, аномальное направление кровотока, U-образная форма и разделение ВПВ и трахеи одной или двумя промежуточными дугами укажут эксперту на такие патологии, как коарктация, аневризма протока, правая дуга аорты и сосудистые кольца, включая двойную дугу аорты и правую дугу аорты с левым артериальным протоком с аберрантной подключичной артерией или без нее (Рисунок 30).
Рисунок 30 Изолированные аномалии дуги. (А) Нормальное сердце в возрасте 13 недель, с 2D изображением (справа) и дополнительным значением силовой допплерографии (слева) для визуализации “V” слева от ВПВ и трахеи. (B) Правая дуга аорты с левым артериальным протоком. (С) Изолированная аберрантная правая подключичная артерия, проходящая позади пищевода, более четко видна при цветной допплерографии. (D) Изолированную коарктацию заподозрили, когда поперечная аорта оказалась меньше дуги протока. (E) Аневризма протока (звездочка) в третьем триместре. (F) Двойная дуга аорты с тремя “дугами”, которые визуализируются в трех несколько разных плоскостях: дуга протока (DA), дуга левой аорты (LAA) и дуга правой аорты (RAA). Правая дуга аорты является доминирующей. (G) Еще один пример двойной дуги аорты с цветной допплерографией, показывающий две дуги аорты, которые окружают трахею и пищевод (стрелка), а также поток в непарной вене красного цвета, который проходит впереди обеих дуг по направлению к ВПВ справа.
Общий подход к визуализации. Предполагая, что внутрисердечные аномалии исключены, визуализация является простой. Сочетание аксиальной, сагиттальной и парасагиттальной визуализации с 2D и цветным допплеровским сканированием для отслеживания хода дуги протока и аорты с вниманием к истокам сосудов головы и верхних конечностей позволит поставить правильный диагноз. Использование цветного и энергетического допплера в 3СТ срезе помогает выявить аберрантную подключичную артерию, ретроградный поток в сосудах или антеградный поток в меньшей из двух дуг при двойной аортальной дуге. На этом срезе также можно распознать перевязку легочной артерии; хотя перевязка не является сосудистым кольцом, у таких пациентов могут быть аномалии дыхательных путей, включая кольца трахеи, и родоразрешение должно происходить в соответствующих условиях, чтобы обеспечить возможность проведения вспомогательной вентиляции, если это будет необходимо.
Ключевые моменты
- Латеральность (односторонность) дуги аорты и протока должна быть задокументирована в рамках каждого эхокардиографического исследования плода.
- Сосудистую анатомию следует оценивать в 3СТ срезе, учитывая, что сосудистые кольца, перевязки и правая дуга аорты легко обнаруживаются во время эхокардиографии плода.
- Следует попытаться диагностировать аберрантное происхождение подключичной артерии, особенно если есть подозрение на аномалию латеральной дуги аорты.
D. Оценка риска на основе визуализации и планирование родоразрешения при беременности с пороками сердца плода
Эхокардиографическая диагностика плода занимает центральное место в оказании помощи плодам с ВПС, нарушениями сердечного ритма или функции, поскольку она дает возможность провести полное пренатальное консультирование семьи, организовать психосоциальную поддержку, оказать комплексную перинатальную помощь и координировать планирование родов. После установления диагноза ВПС фетальный кардиолог должен сотрудничать с акушером(ами) для определения последствий для плода и беременной в течение оставшегося срока беременности и необходимости дальнейших визитов, а также ожидаемого уровня неонатального ухода.136 В зависимости от типа и тяжести сердечной патологии плода может быть целесообразным проведение серийных эхокардиографических исследований плода с целью оценки изменений в состоянии плода и предоставления рекомендаций по предполагаемому постнатальному ведению.137,138 В Таблицах 14 и 15 подробно описаны различные ситуации, в которых рекомендуется проведение серийных эхокардиографических исследований плода из-за риска прогрессирования ВПС. Существуют определенные формы критических ВПС, которые требуют кардиологического вмешательства сразу после рождения, чтобы уменьшить риск неонатальной смерти и/или тяжелых осложнений. Для лучшего информирования медицинской бригады об уровне риска и координации надлежащего и быстрого послеродового ухода за такими пациентами рекомендуется использовать системы стратификации риска на основе изображений в сочетании с планами оказания помощи при пренатально диагностированной ВПС.2 Хотя установление детального пренатального диагноза является ключевым, именно скоординированный перинатальный план лечения имеет наибольший потенциал влияния на результаты лечения этих пациентов. Остаются пробелы в способности эхокардиографии плода прогнозировать необходимость немедленного постнатального вмешательства при таких поражениях, как d-ТМА с рестриктивной межпредсердной перегородкой.139,140 Изучалось дополнительное использование тестирования материнской гипоксии для моделирования постнатальной физиологии, однако данные пока являются неполными. Магнитно-резонансную томографию плода можно проводить для измерения объемов легких или задержки жидкости при ТФ с отсутствующим легочным клапаном, или для оценки признаков лимфангиоэктазов при СГЛОС с рестриктивной или интактной межпредсердной перегородкой или затрудненным тотальным аномальным легочным венозным возвратом. Это может быть полезным для прогнозирования результата и планирования.141,142
Ключевые моменты
- После установления диагноза ВПС плода медицинские работники, оказывающие помощь матери, плоду и новорожденному, должны работать вместе, чтобы определить последствия для плода и беременной в течение оставшейся беременности и перинатального/неонатального периода.
- Серийное эхокардиографическое наблюдение за состоянием плода для оценки изменений в состоянии плода и рекомендаций по ожидаемому постнатальному ведению показано при определенных кардиологических диагнозах, связанных с риском постнатальной гемодинамической компрометации.
- Стратификация риска на основе эхокардиографии плода может быть использована для облегчения коммуникации и стандартизации клинического подхода к перинатальному ведению беременной и плода.
Таблица 15 Рекомендации по оценке риска на основе визуализации и дальнейшей визуализации при конкретных диагнозах ВПС.
| Показания к проведению эхокардиографии плода | Предложенный мониторинг | Ключевые результаты эхокардиографической визуализации плода для оценки | Пример диагноза |
| ВПС плода в группе риска ЗСН | Каждые 2-4 недели | Комплексная оценка сердечной функции* | СГЛОС с МР, тетрада с отсутствующим легочным клапаном, аномалия Эбштейна, ДАВП с АВ-клапанной регургитацией, опухоли сердца |
| ВПС плода с риском аритмии | Каждые 2-4 недели | Документирование темпа и ритма | Синдром удлиненного интервала QT, l-ТМА, ИЛП |
| Экстракардиальная аномалия плода в группе риска при гидропсии | Каждые 2-4 недели | Комплексная оценка сердечной функции* | ПЛДП, ККТ, ФФТС, артериовенозная мальформация ОАПБ, анемия |
| Плод в группе риска постнатального цианоза | Каждые 4-8 недели + конец третьего триместра | Экскурсия межпредсердной перегородки и открытие предсердно-желудочкового отверстия, картина шунтирования протоков, рассмотреть возможность проведения теста на гипоксию матери | d-ТМА/IVS, d-ТМА, ДМЖП, ДСПЖ с субпульмональным ДМЖП, ТФ |
| Плод с риском постнатальной легочной венозной обструкции | Каждые 4-8 недели + конец третьего триместра | Допплеровское соотношение прямого/обратного ИСП; положение и толщина межпредсердной перегородки, пиковая скорость и форма волны допплерографии вертикальной вены, рассмотреть возможность проведения теста на гипоксию у матери | СГЛОС/РПП, обструкция TAPVR, трехпредсердное сердце |
| Тахикардия плода | Каждые 2 недели, если нет надлежащего контроля | Оцените частоту и ритм сердечных сокращений, размер сердца, гидропсии, ЗСН | Трепетание предсердий, НЖТ |
| Плод подвергается риску постнатального респираторного компромисса | Каждые 4-8 недели + конец третьего триместра | Смещение средостения, соотношение сердечно-грудной площади, функция ПЖ и ЛЖ, Рассмотрите МРТ плода для оценки легких | Тетрада с отсутствующим легочным клапаном, аномалией Эбштейна, СГЛОС/РПП |
| Риск АВ-блокады плода (l-ТМА, ИЛП, другое) | Каждые 2-4 недели | Оценить АВ-интервал плода, частоту сердечных сокращений плода (предсердий и желудочков), гидропсию, экстракардиальную допплерографию | АВ-блокада первой степени; АВ-блокада второй и третьей степени |
| Пост-КВП при АС плода | Третий триместр, каждые 4 недели | Оценить аортальный отток, направление потока дуги, скорость и направление потока межпредсердной перегородки, размер и функцию левого желудочка, митральную регургитацию, яркость эндокардиальной эхокардиограммы | Тяжелый АС с прогрессирующим течением СГЛОС |
| Пост-КВП для СГЛОС/РПП | Третий триместр, каждые 4 недели | Оценить проходимость предсердно-желудочкового сообщения, допплерография легочной вены прямая/обратная ИСП | СГЛОС/РПП |
АС, аортальный стеноз; ДАВП, дефект атриовентрикулярной перегородки; ПЛДП, врожденный порок легочных дыхательных путей; ЗСН, застойная сердечная недостаточность; ДСПЖ, двустворчатый правый желудочек; КВП, кардиохирургическое вмешательство у плода; ИЛП, изомерия левого предсердия; МР, митральная регургитация; РПП, рестриктивная межпредсердная перегородка; ККТ, крестцово-копчиковая тератома; НЖТ, наджелудочковая тахикардия; TAPVR, тотальный аномальный легочно-венозный возврат; ФФТС, фето-фетальный трансфузионный синдром; ОАПБ, обратная артериальная перфузия близнецов; ИСП, интеграл линейной скорости потока.
*Подробнее см. раздел “Оценка функциональных нарушений сердца плода”.”.
V. ИТОГ И ВЫВОДЫ
Эхокардиография плода развивалась в течение последних четырех десятилетий и стала высокочувствительным и специфическим неинвазивным инструментом для выявления, классификации и оценки риска сердечно-сосудистых заболеваний плода. Стандарты визуализации, отчетности и передачи результатов теста также эволюционировали. Этот документ содержит доказательные и консенсусные рекомендации по проведению эхокардиографии плода как в нормальном, так и в аномальном сердце плода, а также для детальной оценки структурных, функциональных и связанных с ритмом аномалий. Хотя этот документ далеко не исчерпывающий, авторский коллектив представил здесь общие рекомендации относительно того, что представляет собой полное эхокардиографическое обследование плода при наличии аномалий, которые могут быть использованы как для студентов, так и для опытных врачей-практиков.
ССЫЛКИ НА ИСТОЧНИКИ
- Rychik J, Ayres N, Cuneo B, et al. American Society of Echocardiography guidelines and standards for performance of the fetal echocardiogram. J Am Soc Echocardiogr 2004;17:803-10.
- Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation 2014;129:2183-242.
- International Society of Ultrasound in Obstetrics and Gynecology, Carvalho JS, Allan LD, Chaoui R, et al. ISUOG Practice Guidelines (updated): sonographic screening examination of the fetal heart. Ultrasound Obstet Gynecol 2013;41:348-59.
- AIUM practice parameter for the performance of fetal echocardiography. J Ultrasound Med 2020;39:E5-16.
- Pinto NM, Morris SA, Moon-Grady AJ, et al. Prenatal cardiac care: goals, priorities & gaps in knowledge in fetal cardiovascular disease: perspectives of the Fetal Heart Society. Prog Pediatr Cardiol 2020; 59:101312.
- Wang S, Yang L, Wang L, et al. Selective serotonin reuptake inhibitors (SSRIs) and the risk of congenital heart defects: a meta-analysis of prospective cohort studies. J Am Heart Assoc 2015;4:e001681.
- Melov SJ, Shetty PS, Pasupathy D, et al. Selective serotonin reuptake inhibitor or serotonin-norepinephrine reuptake inhibitors and epidemiological characteristics associated with prenatal diagnosis of congenital heart disease. Prenat Diagn 2021;41:35-42.
- Schaefer C, Hannemann D, Meister R, et al. Vitamin K antagonists and pregnancy outcome. A multi-centre prospective study. Thromb Haemost 2006;95:949-57.
- Society for Maternal-Fetal Medicine (SMFM), Norton ME, Chauhan SP, Dashe JS. Society for maternal-fetal medicine (SMFM) clinical guideline #7: nonimmune hydrops fetalis. Am J Obstet Gynecol 2015;212:127-39.
- Barris DM, Brailovschi Y, Shah A, et al. The role of fetal echocardiogram after detection of extracardiac anomalies in utero (fetal echocardiogram for extracardiac malformations). Prenat Diagn 2021;41:1134-9.
- Ghimire LV, Chou FS, Moon-Grady AJ. Risk of congenital heart disease is increased among newborns with non-cardiac congenital anomalies: survey-based analysis using 2016 Kids’ Inpatient Database. Ultrasound Obstet Gynecol 2021;57:841-2.
- Tai C, Conner T, Pevyandi S, et al. Prevalence of congenital heart disease in an isolated single umbilical artery is low at a tertiary referral center. J Ultrasound Med 2021;40:1729-30.
- Hoffman JIE, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol 2002;39:1890-900.
- Bak GS, Shaffer BL, Madriago E, et al. Detection of fetal cardiac anomalies: cost-effectiveness of increased number of cardiac views. Ultrasound Obstet Gynecol 2020;55:758-67.
- AIUM practice parameter for the performance of detailed second- and third-trimester diagnostic obstetric ultrasound examinations. J Ultrasound Med 2019;38:3093-100.
- Li Y, Hua Y, Fang J, et al. Performance of different scan protocols of fetal echocardiography in the diagnosis of fetal congenital heart disease: a systematic review and meta-analysis. PLoS One 2013;8:e65484.
- Barker PCA, Lewin MB, Donofrio MT, et al. Specific considerations for pediatric, fetal, and congenital heart disease patients and echocardiography service providers during the 2019 Novel Coronavirus outbreak: Council on Pediatric and Congenital Heart Disease. J Am Soc Echocardiogr 2020;33:658-65.
- Odibo AO, Coassolo KM, Stamilio DM, et al. Should all pregnant diabetic women undergo a fetal echocardiography? A cost-effectiveness analysis comparing four screening strategies. Prenat Diagn 2006 Jan;26:39-44.
- Bernard LS, Ramos GA, Fines V, et al. Reducing the cost of detection of congenital heart disease in fetuses of women with pregestational diabetes mellitus. Ultrasound Obstet Gynecol 2009;33:676-82.
- Gekas J, Gagne G, Bujold E, et al. Comparison of different strategies in prenatal screening for Down’s syndrome: cost effectiveness analysis of computer simulation. BMJ 2009;338:b138.
- Cunningham GC, Tompkinison DG. Cost and effectiveness of the California triple marker prenatal screening program. Genet Med 1999;1: 199-206.
- Pinto NM, Nelson R, Puchalski M, et al. Cost-effectiveness of prenatal screening strategies for congenital heart disease. Ultrasound Obstet Gynecol 2014;44:50-7.
- Chung EH, Lim SL, Havrilesky LJ, et al. Cost-effectiveness of prenatal screening methods for congenital heart defects in pregnancies conceived by in-vitro fertilization. Ultrasound Obstet Gynecol 2021; 57:979-86.
- National Collaborating Centre for Women’s and Children’s Health (UK). Antenatal Care: Routine care for the healthy pregnant woman. London: RCOG Press; 2008.
- Simpson LL. Indications for fetal echocardiography from a tertiary-care obstetric sonography practice. J Clin Ultrasound 2004;32:123-8.
- Huggon IC, Ghi T, Cook AC, et al. Fetal cardiac abnormalities identified prior to 14 weeks’ gestation. Ultrasound Obstet Gynecol 2002;20:22-9.
- Zidere V, Bellsham-Revell H, Persico N, et al. Comparison of echocardiographic findings in fetuses at less than 15 weeks’ gestation with later cardiac evaluation. Ultrasound Obstet Gynecol 2013;42:679-86.
- AIUM practice parameter for documentation of an ultrasound examination. J Ultrasound Med 2020;39:E1-4.
- Abramowicz JS, Basseal JM, Brezinka C, et al. ISUOG Safety Committee Position Statement on use of personal protective equipment and hazard mitigation in relation to SARS-CoV-2 for practitioners undertaking obstetric and gynecological ultrasound. Ultrasound Obstet Gynecol 2020;55:886-91.
- Torloni MR, Vedmedovska N, Merialdi M, et al. Safety of ultrasonography in pregnancy: WHO systematic review of the literature and metaanalysis. Ultrasound Obstet Gynecol 2009 May;33:599-608.
- American Institute of Ultrasound in Medicine. Prudent use and safety of diagnostic ultrasound in pregnancy; 2020. Available at: https://www. aium.org/officialStatements/79. Accessed November 19, 2022.
- Nemescu D, Berescu A, Onofriescu M, et al. Safety indices during fetal echocardiography at the time of first-trimester scan are machine dependent. PLoS One 2015;10:e0127570.
- Semmler J, Day TG, Georgiopoulos G, et al. Fetal speckle-tracking: impact of angle of insonation and frame rate on global longitudinal strain. J Am Soc Echocardiogr 2020;33:1141-6.e2.
- Yagel S, Cohen SM, Achiron R. Examination of the fetal heart by five short-axis views: a proposed screening method for comprehensive cardiac evaluation. Ultrasound Obstet Gynecol 2001;17:367-9.
- DeVore GR. Computing the Z Score and centiles for cross-sectional analysis: a practical approach. J Ultrasound Med 2017;36:459-73.
- Lee W, Riggs T, Amula V, et al. Fetal echocardiography: z-score reference ranges for a large patient population. Ultrasound Obstet Gynecol 2010; 35:28-34.
- Schneider C, McCrindle BW, Carvalho JS, et al. Development of Z -scores for fetal cardiac dimensions from echocardiography. Ultrasound Obstet Gynecol 2005;26:599-605.
- McElhinney DB, Marshall AC, Wilkins-Haug LE, et al. Predictors of technical success and postnatal biventricular outcome after in utero aortic valvuloplasty for aortic stenosis with evolving hypoplastic left heart syndrome. Circulation 2009;120:1482-90.
- Krishnan A, Pike JI, McCarter R, et al. Predictive models for normal fetal cardiac structures. J Am Soc Echocardiogr 2016;29:1197-206.
- Gu X, Zhu H, Zhang Y, et al. Quantile score: a new reference system for quantitative fetal echocardiography based on a large multicenter study. J Am Soc Echocardiogr 2019;32:296-302.e5.
- Vigneswaran TV, Akolekar R, Syngelaki A, et al. Reference ranges for the size of the fetal cardiac outflow tracts from 13 to 36 weeks gestation: a single-center study of over 7000 cases. Circ Cardiovasc Imaging 2018; 11:e007575.
- Chiba Y, Kanzaki T, Kobayashi H, et al. Evaluation of fetal structural heart disease using color flow mapping. Ultrasound Med Biol 1990;16:221-9.
- Abuhamad A, Chaoui R. A Practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts. Fourth Edition. Philadelphia: Lippincott-Williams & Wilkins; 2016.
- Heling KS, Chaoui R, Bollmann R. Advanced dynamic flow – a new method of vascular imaging in prenatal medicine. A pilot study of its applicability. Ultraschall Med 2004;25:280-4.
- Huisman TW, Stewart PA, Wladimiroff JW, et al. Flow velocity waveforms in the ductus venosus, umbilical vein and inferior vena cava in normal human fetuses at 12-15 weeks of gestation. Ultrasound Med Biol 1993;19:441-5.
- Carceller-Blanchard AM, Fouron JC. Determinants of the Doppler flow velocity profile through the mitral valve of the human fetus. Br Heart J 1993;70:457-60.
- Paladini D, Palmieri S, Celentano E, et al. Pulmonary venous blood flow in the human fetus. Ultrasound Obstet Gynecol 1997;10:27-31.
- Mielke G, Benda N. Blood flow velocity waveforms of the fetal pulmonary artery and the ductus arteriosus: reference ranges from 13 weeks to term. Ultrasound Obstet Gynecol 2000;15:213-8.
- Fouron JC. The unrecognized physiological and clinical significance of the fetal aortic isthmus. Ultrasound Obstet Gynecol 2003;22:441-7.
- Bhide A, Acharya G, Baschat A, et al. ISUOG Practice Guidelines (updated): use of Doppler velocimetry in obstetrics. Ultrasound Obstet Gynecol 2021;58:331-9.
- Yamamoto Y, Hornberger LK. Progression of outflow tract obstruction in the fetus. Early Hum Dev 2012;88:279-85.
- Cordes TM, O’Leary PW, Seward JB, et al. Distinguishing right from left: a standardized technique for fetal echocardiography. J Am Soc Echocardiogr 1994;7:47-53.
- Gonc¸alves LF, Lee W, Chaiworapongsa T, et al. Four-dimensional ultrasonography of the fetal heart with spatiotemporal image correlation. Am J Obstet Gynecol 2003;189:1792-802.
- Wang Y, Fan M, Siddiqui FA, et al. Strategies for accurate diagnosis of fetal aortic arch anomalies: benefits of three-dimensional sonography with spatiotemporal image correlation and a novel algorithm for volume analysis. J Am Soc Echocardiogr 2018;31:1238-51.
- Patey O, Carvalho JS, Thilaganathan B. Intervendor discordance of fetal and neonatal myocardial tissue Doppler and speckle-tracking measurements. J Am Soc Echocardiogr 2019;32:1339-49.e23.
- DeVore GR, Polanco B, Satou G, et al. Two-dimensional speckle tracking of the fetal heart: a practical step-by-step approach for the fetal sonologist. J Ultrasound Med 2016;35:1765-81.
- Clur SAB, Bilardo CM. Early detection of fetal cardiac abnormalities: how effective is it and how should we manage these patients? Prenat Diagn 2014;34:1235-45.
- McBrien A, Hornberger LK. Early fetal echocardiography. Birth Defects Res 2019;111:370-9.
- Wiechec M, Knafel A, Nocun A. Prenatal detection of congenital heart defects at the 11- to 13-week scan using a simple color Doppler protocol including the 4-chamber and 3-vessel and trachea views. J Ultrasound Med 2015;34:585-94.
- Quarello E, Lafouge A, Fries N, et al. Basic heart examination: feasibility study of first-trimester systematic simplified fetal echocardiography. Ultrasound Obstet Gynecol 2017;49:224-30.
- American Institute of Ultrasound in Medicine. Medical Ultrasound Safety. Laurel, Maryland; 2020. Available at: http://aium.s3.amazonaws.com/ resourceLibrary/mus4.pdf. Accessed November 17, 2022.
- Salvesen K, Lees C, Abramowicz J, et al. ISUOG statement on the safe use of Doppler in the 11 to 13 +6-week fetal ultrasound examination. Ultrasound Obstet Gynecol 2011;37:628.
- Hutchinson D, McBrien A, Howley L, et al. First-trimester fetal echocardiography: identification of cardiac structures for screening from 6 to 13 Weeks’ gestational age. J Am Soc Echocardiogr 2017;30:763-72.
- Carvalho JS, Moscoso G, Tekay A, et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart 2004;90:921-6.
- Zidere V, Vigneswaran TV, Syngelaki A, et al. Reference ranges for pulsedwave Doppler of the fetal cardiac inflow and outflow tracts from 13 to 36 weeks’ gestation. J Am Soc Echocardiogr 2021;34:1007-16.e10.
- Mitchell JL, Cuneo BF, Etheridge SP, et al. Fetal heart rate predictors of long QT syndrome. Circulation 2012;126:2688-95.
- Friedman DM, Kim MY, Copel JA, et al. Utility of cardiac monitoring in fetuses at risk for congenital heart block: the PR Interval and Dexamethasone Evaluation (PRIDE) prospective study. Circulation 2008;117:485-93.
- Clur SAB, Vink AS, Etheridge SP, et al. Left ventricular isovolumetric relaxation time is prolonged in fetal Long-QT Syndrome. Circ Arrhythm Electrophysiol 2018;11:e005797.
- Sonesson SE, Eliasson H, Conner P, et al. Doppler echocardiographic isovolumetric time intervals in diagnosis of fetal blocked atrial bigeminy and 2:1 atrioventricular block. Ultrasound Obstet Gynecol 2014;44: 171-5.
- Cuneo BF, Strasburger JF, Yu S, et al. In utero diagnosis of long QT syndrome by magnetocardiography. Circulation 2013;128:2183-91.
- Jaeggi ET, Carvalho JS, De Groot E, et al. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation 2011;124:1747-54.
- Krapp M, Kohl T, Simpson JM, et al. Review of diagnosis, treatment, and outcome of fetal atrial flutter compared with supraventricular tachycardia. Heart 2003;89:913-7.
- Byrne FA, Lee H, Kipps AK, et al. Echocardiographic risk stratification of fetuses with sacrococcygeal teratoma and twin-reversed arterial perfusion. Fetal Diagn Ther 2011;30:280-8.
- Statile CJ, Cnota JF, Gomien S, et al. Estimated cardiac output and cardiovascular profile score in fetuses with high cardiac output lesions. Ultrasound Obstet Gynecol 2013;41:54-8.
- Derderian SC, Jeanty C, Fleck SR, et al. The many faces of hydrops. J Pediatr Surg 2015;50:50-4; discussion 54.
- Flood K, Unterscheider J, Daly S, et al. The role of brain sparing in the prediction of adverse outcomes in intrauterine growth restriction: results of the multicenter PORTO Study. Am J Obstet Gynecol 2014;211: 288.e1-5.
- Duke C, Sharland GK, Jones AM, et al. Echocardiographic features and outcome of truncus arteriosus diagnosed during fetal life. Am J Cardiol 2001;88:1379-84.
- Votava-Smith JK, Habli M, Cnota JF, et al. Diastolic dysfunction and cerebrovascular redistribution precede overt recipient twin cardiomyopathy in early-stage twin-twin transfusion syndrome. J Am Soc Echocardiogr 2015;28:533-40.
- Moon-Grady AJ, Rand L, Gallardo S, et al. Diastolic cardiac pathology and clinical twin-twin transfusion syndrome in monochorionic/diamniotic twins. Am J Obstet Gynecol 2011;205:279.e1-11.
- Mahle WT, Rychik J, Tian ZY, et al. Echocardiographic evaluation of the fetus with congenital cystic adenomatoid malformation. Ultrasound Obstet Gynecol 2000;16:620-4.
- Vogel M, McElhinney DB, Marcus E, et al. Significance and outcome of left heart hypoplasia in fetal congenital diaphragmatic hernia. Ultrasound Obstet Gynecol 2010;35:310-7.
- Byrne FA, Keller RL, Meadows J, et al. Severe left diaphragmatic hernia limits size of fetal left heart more than does right diaphragmatic hernia. Ultrasound Obstet Gynecol 2015;46:688-94.
- Hofstaetter C, Hansmann M, Eik-Nes SH, et al. A cardiovascular profile score in the surveillance of fetal hydrops. J Matern Fetal Neonatal Med 2006;19:407-13.
- Rasanen J, Wood DC, Weiner S, et al. Role of the pulmonary circulation in the distribution of human fetal cardiac output during the second half of pregnancy. Circulation 1996;94:1068-73.
- Mielke G, Benda N. Cardiac output and central distribution of blood flow in the human fetus. Circulation 2001;103:1662-8.
- Harada K, Tsuda A, Orino T, et al. Tissue Doppler imaging in the normal fetus. Int J Cardiol 1999;71:227-34.
- Chan LY, Fok WY, Wong JT, et al. Reference charts of gestation-specific tissue Doppler imaging indices of systolic and diastolic functions in the normal fetal heart. Am Heart J 2005;150:750-5.
- M€akikallio K, R€as€anen J, M€akikallio T, et al. Human fetal cardiovascular profile score and neonatal outcome in intrauterine growth restriction. Ultrasound Obstet Gynecol 2008;31:48-54.
- Huhta JC. Fetal congestive heart failure. Semin Fetal Neonatal Med 2005;10:542-52.
- Shah AD, Border WL, Crombleholme TM, et al. Initial fetal cardiovascular profile score predicts recipient twin outcome in twin-twin transfusion syndrome. J Am Soc Echocardiogr 2008;21:1105-8.
- Peyvandi S, Feldstein VA, Hirose S, et al. Twin-reversed arterial perfusion sequence associated with decreased fetal cerebral vascular impedance. Ultrasound Obstet Gynecol 2015;45:447-51.
- Mari G, Adrignolo A, Abuhamad AZ, et al. Diagnosis of fetal anemia with Doppler ultrasound in the pregnancy complicated by maternal blood group immunization. Ultrasound Obstet Gynecol 1995;5: 400-5.
- Krishnan A, Jacobs MB, Morris SA, et al. Impact of socioeconomic status, race and ethnicity, and geography on prenatal detection of hypoplastic left heart syndrome and transposition of the great arteries. Circulation 2021;143:2049-60.
- Hancock HS, Romano JC, Armstrong A, et al. Single ventricle and total anomalous pulmonary venous connection: implications of prenatal diagnosis. World J Pediatr Congenit Heart Surg 2018;9:434-9.
- Szwast A, Tian Z, McCann M, et al. Vasoreactive response to maternal hyperoxygenation in the fetus with hypoplastic left heart syndrome. Circ Cardiovasc Imaging 2010;3:172-8.
- Cohen MS, Jegatheeswaran A, Baffa JM, et al. Echocardiographic features defining right dominant unbalanced atrioventricular septal defect: a multi-institutional Congenital Heart Surgeons’ Society study. Circ Cardiovasc Imaging 2013;6:508-13.
- Carvajal HG, Canter MW, Abarbanell AM, et al. Does ascending aorta size affect Norwood outcomes in hypoplastic left heart with aortic atresia? Ann Thorac Surg 2020;110:1651-8.
- Divanovic A, Hor K, Cnota J, et al. Prediction and perinatal management of severely restrictive atrial septum in fetuses with critical left heart obstruction: clinical experience using pulmonary venous Doppler analysis. J Thorac Cardiovasc Surg 2011;141:988-94.
- Shamszad P, Gospin TA, Hong BJ, et al. Impact of preoperative risk factors on outcomes after Norwood palliation for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2014;147:897-901.
- Berning RA, Silverman NH, Villegas M, et al. Reversed shunting across the ductus arteriosus or atrial septum in utero heralds severe congenital heart disease. J Am Coll Cardiol 1996;27:481-6.
- Dyamenahalli U, Smallhorn JF, Geva T, et al. Isolated ductus arteriosus aneurysm in the fetus and infant: a multi-institutional experience. J Am Coll Cardiol 2000;36:262-9.
- Paladini D, Palmieri S, Lamberti A, et al. Characterization and natural history of ventricular septal defects in the fetus. Ultrasound Obstet Gynecol 2000;16:118-22.
- Axt-Fliedner R, Schwarze A, Smrcek J, et al. Isolated ventricular septal defects detected by color Doppler imaging: evolution during fetal and first year of postnatal life. Ultrasound Obstet Gynecol 2006;27:266-73.
- Peixoto AB, Bravo-Valenzuela NJ, Martins WP, et al. Reference ranges for the fetal mitral, tricuspid, and interventricular septum annular plane systolic excursions (mitral annular plane systolic excursion, tricuspid annular plane systolic excursion, and septum annular plane systolic excursion) between 20 and 36 + 6 weeks of gestation. J Perinat Med 2020;48: 601-8.
- Crispi F, Sepulveda-Swatson E, Cruz-Lemini M, et al. Feasibility and reproducibility of a standard protocol for 2D speckle tracking and tissue Doppler-based strain and strain rate analysis of the fetal heart. Fetal Diagn Ther 2012;32:96-108.
- Friedberg MK, Ursell PC, Silverman NH. Isomerism of the left atrial appendage associated with ventricular noncompaction. Am J Cardiol 2005;96:985-90.
- Huggon IC, Cook AC, Smeeton NC, et al. Atrioventricular septal defects diagnosed in fetal life: associated cardiac and extra-cardiac abnormalities and outcome. J Am Coll Cardiol 2000;36:593-601.
- Szwast AL, Marino BS, Rychik J, et al. Usefulness of left ventricular inflow index to predict successful biventricular repair in right-dominant unbalanced atrioventricular canal. Am J Cardiol 2011;107:103-9.
- Losada E, Moon-Grady AJ, Strohsnitter WC, et al. Anomalous mitral arcade in twin-twin transfusion syndrome. Circulation 2010;122: 1456-63.
- Layman TE, Edwards JE. Anomalous mitral arcade. A type of congenital mitral insufficiency. Circulation 1967;35:389-95.
- Pluchinotta FR, Teot LA, Sanders SP. Left ventricular aneurysm, aortic stenosis, and arcade mitral valve: coexistence of three rare congenital heart defects. Pediatr Cardiol 2012;33:1206-9.
- Bevilacqua M, Sanders SP, Van Praagh S, et al. Double-inlet single left ventricle: echocardiographic anatomy with emphasis on the morphology of the atrioventricular valves and ventricular septal defect. J Am Coll Cardiol 1991;18:559-68.
- Yang YL, Wang XF, Cheng TO, et al. Echocardiographic characteristics of the criss-cross heart. Int J Cardiol 2010;140:133-7.
- Apitz C, Webb GD, Redington AN. Tetralogy of Fallot. Lancet 2009;374: 1462-71.
- Rodenbarger A, Thorsson T, Stiver C, et al. Third trimester predictors of interventional timing and accuracy of fetal anticipatory guidance in tetralogy of Fallot: a multi-center study. Prenat Diagn 2020;40:870-7.
- Arya B, Levasseur SM, Woldu K, et al. Fetal echocardiographic measurements and the need for neonatal surgical intervention in Tetralogy of Fallot. Pediatr Cardiol 2014;35:810-6.
- Arunamata A, Balasubramanian S, Punn R, et al. Impact of fetal somatic growth on pulmonary valve annulus Z-Scores during gestation and through birth in patients with Tetralogy of Fallot. Pediatr Cardiol 2018;39:1181-7.
- Kwon EN, Parness IA, Srivastava S, et al. Subpulmonary stenosis assessed in midtrimester fetuses with tetralogy of Fallot: a novel method for predicting postnatal clinical outcome. Pediatr Cardiol 2013;34: 1314-20.
- Friedman K, Balasubramanian S, Tworetzky W. Midgestation fetal pulmonary annulus size is predictive of outcome in tetralogy of Fallot. Congenit Heart Dis 2014;9:187-93.
- Goldmuntz E. 22q11.2 deletion syndrome and congenital heart disease. Am J Med Genet C Semin Med Genet 2020;184:64-72.
- Chelliah A, Moon-Grady AJ, Peyvandi S, et al. Contemporary outcomes in tetralogy of Fallot with absent pulmonary valve after fetal diagnosis. J Am Heart Assoc 2021;10:e019713.
- Russell HM, Jacobs ML, Anderson RH, et al. A simplified categorization for common arterial trunk. J Thorac Cardiovasc Surg 2011;141:645-53.
- Krummholz A, Gottschalk I, Geipel A, et al. Prenatal diagnosis, associated findings and postnatal outcome in fetuses with congenitally corrected transposition of the great arteries. Arch Gynecol Obstet 2021;303:1469-81.
- Vorisek CN, Enzensberger C, Willomeit S, et al. Prenatal diagnosis and outcome of congenital corrected transposition of the great arteries – a multicenter report of 69 cases. Ultraschall Med 2021;42:291-6.
- Hornberger LK, Sanders SP, Rein AJ, et al. Left heart obstructive lesions and left ventricular growth in the midtrimester fetus. A longitudinal study. Circulation 1995;92:1531-8.
- Gardiner HM, Kovacevic A, Tulzer G, et al. Natural history of 107 cases of fetal aortic stenosis from a European multicenter retrospective study. Ultrasound Obstet Gynecol 2016;48:373-81.
- Vogel M, McElhinney DB, Wilkins-Haug LE, et al. Aortic stenosis and severe mitral regurgitation in the fetus resulting in giant left atrium and hydrops: pathophysiology, outcomes, and preliminary experience with pre-natal cardiac intervention. J Am Coll Cardiol 2011;57: 348-55.
- Eckersley LG, Howley LW, van der Velde ME, et al. Quantitative assessment of left ventricular dysfunction in fetal Ebstein’s anomaly and tricuspid valve dysplasia. J Am Soc Echocardiogr 2019;32:1598-607.
- Nathan AT, Marino BS, Dominguez T, et al. Tricuspid valve dysplasia with severe tricuspid regurgitation: fetal pulmonary artery size predicts lung viability in the presence of small lung volumes. Fetal Diagn Ther 2010;27:101-5.
- Selamet Tierney ES, McElhinney DB, Freud LR, et al. Assessment of progressive pathophysiology after early prenatal diagnosis of the Ebstein anomaly or tricuspid valve dysplasia. Am J Cardiol 2017; 119:106-11.
- Hornberger LK, Sahn DJ, Kleinman CS, et al. Tricuspid valve disease with significant tricuspid insufficiency in the fetus: diagnosis and outcome. J Am Coll Cardiol 1991;17:167-73.
- Taketazu M, Barrea C, Smallhorn JF, et al. Intrauterine pulmonary venous flow and restrictive foramen ovale in fetal hypoplastic left heart syndrome. J Am Coll Cardiol 2004;43:1902-7.
- Maeno YV, Boutin C, Hornberger LK, et al. Prenatal diagnosis of right ventricular outflow tract obstruction with intact ventricular septum, and detection of ventriculocoronary connections. Heart 1999;81:661-8.
- Sun HY, Boe J, Rubesova E, et al. Fetal MRI correlates with postnatal CT angiogram assessment of pulmonary anatomy in tetralogy of Fallot with absent pulmonary valve. Congenit Heart Dis 2014;9:E105-9.
- Jain S, Kleiner B, Moon-Grady A, et al. Prenatal diagnosis of vascular rings. J Ultrasound Med 2010;29:287-94.
- American Academy of Pediatrics Committee on Fetus And Newborn. Levels of neonatal care. Pediatrics 2012;130:587-97.
- Donofrio MT, Skurow-Todd K, Berger JT, et al. Risk-stratified postnatal care of newborns with congenital heart disease determined by fetal echocardiography. J Am Soc Echocardiogr 2015;28:1339-49.
- Sanapo L, Pruetz JD, S1odki M, et al. Fetal echocardiography for planning perinatal and delivery room care of neonates with congenital heart disease. Echocardiography 2017;34:1804-21.
- Patey O, Carvalho JS, Thilaganathan B. Urgent neonatal balloon atrial septostomy in simple transposition of the great arteries: predictive value of fetal cardiac parameters. Ultrasound Obstet Gynecol 2021;57:756-68.
- Punn R, Silverman NH. Fetal predictors of urgent balloon atrial septostomy in neonates with complete transposition. J Am Soc Echocardiogr 2011;24:425-30.
- Chelliah A, Berger JT, Blask A, et al. Clinical utility of fetal magnetic resonance imaging in tetralogy of Fallot with absent pulmonary valve. Circulation 2013;127:757-9. \
- Barrera CA, Johnson AM, Rychik J, et al. Prognostic value of the nutmeg lung pattern/lymphangiectasia on fetal magnetic resonance imaging. Pediatr Radiol 2021;51:1809-17.
- Mekjarasnapha M, Traisrisilp K, Luewan S, et al. Reference ranges for fetal septum primum excursion from 14 to 40 weeks’ gestation. J Ultrasound Med 2013;32:1729-34.