Резюме
Цель
Сообщить о 5-летней безрецидивной выживаемости (БВ) после высокоинтенсивного фокусированного ультразвука (ВИФУЗ).
Пациенты и методы
В этом обсервационном когортном исследовании были использованы данные Национального канцер-реестра, данные о лучевой терапии, административные данные больниц и записи о смертности 1381 мужчины, получавших лечение ВИФУЗ по поводу клинически локализованного рака предстательной железы в Англии. Первичный результат, БВ, определялся как отсутствие необходимости в местном спасительном лечении и смертность от рака. Вторичными результатами были отсутствие повторных ВИФУЗ, специфическая выживаемость при раке простаты (СВР) и общая выживаемость (ОВ). Регрессия Кокса была использована для определения того, были ли базовые характеристики, включая возраст, год лечения, Т-стадию и группу по классификации Международного общества урологической патологии (МОУП), связаны с БВ.
Результаты
Медиана (межквартильный размах [МКР]) наблюдения составляла 37 (20-62) месяцев. Средний возраст (МКР) составлял 65 (59-70) лет, 81% имели группу 1-2 по шкале МОУП. БВ составила 96,5% (95% доверительный интервал [ДИ] 95,4%-97,4%) через 1 год, 86,0% (95% ДИ 83,7%-87,9%) через 3 года и 77,5% (95% ДИ 74,4%-80,3%) через 5 лет. 5-летняя ВР для групп 1-5 по шкале МОУП составляла 82,9%, 76,6%, 72,2%, 52,3% и 30,8% соответственно (P < 0,001). Отсутствие повторного ВИФУЗ составляло 79,1% (95% ДИ 75,7%-82,1%), СВР – 98,8% (95% ДИ 97,7%-99,4%) и ОВ – 95,9% (95% ДИ 94,2%-97,1%) через 5 лет.
Заключения
Четыре из пяти мужчин не нуждались в местной радикальной терапии через 5 лет, но неудачи лечения значительно отличались в зависимости от группы по классификации МОУП. Пациенты должны быть должным образом проинформированы относительно спасительного радикального лечения после ВИФУЗ.
Аббревиатуры
СВР
специфическая выживаемость при раке
БВ
безрецидивная выживаемость
СБЭ
Статистика больничных эпизодов
ВИФУЗ
Высокоинтенсивный фокусированный ультразвук
ПУКЗ
Партнерство по улучшению качества здравоохранения
КР
Коэффициент риска
МКБ
Международная классификация болезней
МКР
Межквартильный размах
МОУП
Международное общество урологической патологии
OPCS-4
Управление переписей населения и обследований Классификация хирургических операций и процедур, четвертая редакция
ОВ
Общая выживаемость
РП
Радикальная простатэктомия
ЛТ
Лучевая терапия
НДЛТ
Набор данных по лучевой терапии
ССС
Событие, связанное со скелетом
Вступление
Национальные руководства рекомендуют радикальное лечение пациентов с клинически значимым раком предстательной железы с использованием хирургического вмешательства или лучевой терапии (ЛТ) [1, 2]. Обычно эти методы лечения направлены на всю железу и могут иметь значительные побочные эффекты, в частности недержание мочи и эректильную дисфункцию, а лучевая терапия также вызывает проктит и ректальное кровотечение [3].
Огневая терапия, такая как высокоинтенсивный сфокусированный ультразвук (ВИФУЗ), имеет целью уменьшить побочные эффекты, связанные с лечением, сохраняя при этом контроль над раком. Существуют доказательства того, что ВИФУЗ имеет значительно меньше побочных эффектов, чем хирургическое вмешательство или лучевая терапия, но сравнительных данных о результатах лечения рака мало [4, 5].В исследовании Guillaumier и соавт. [6] сообщается о 5-летней безрецидивной выживаемости (БВ) 88% у 599 мужчин, получавших очаговое лечение в период между 2006 и 2015 годами в Англии. Случаи, включенные в это исследование, были проспективно введены в клинический реестр, охватывающий девять центров. В недавнем исследовании Reddy и соавт. [7] на основе того же клинического реестра сообщили, что 5- и 7-летняя БВ составляла 82% и 69% соответственно у 1379 мужчин, получавших очаговое лечение в период между 2005 и 2020 годами. Используя тот же клинический реестр, Shah и соавт. [8] сообщили, что онкологические результаты через 8 лет после очагового лечения у 501 пациента были сходными между очаговой терапией и радикальной простатэктомией (РП) у пациентов с раком предстательной железы низкого или промежуточного риска.
В этой статье мы сообщаем о результатах лечения рака у пациентов с клинически локализованным раком предстательной железы, которые проходили лечение ВИФУЗ в Национальной службе здравоохранения Англии в период с 2010 по 2018 год. Мужчины были идентифицированы на основе данных Национального канцер-реестра в Англии. Это исследование более чем вдвое превышает по объему предыдущие исследования, о которых сообщали Guillaumier и соавт. [6] и Shah и соавт. [8], и сравнимо с исследованием Reddy и соавт. [7], включая большинство пациентов, о которых сообщалось в этих предыдущих исследованиях. Ключевое отличие заключается в том, что мы использовали результаты, полученные из связанных наборов клинических административных данных, которые регулярно собираются на уровне больниц, а не из событий, о которых сообщали клиницисты в конкретных лечебных центрах ВИФУЗ.
Пациенты и методы
Контингент пациентов
Поскольку в этом исследовании использовались данные реестра и рутинные данные, априорные расчеты объема выборки не проводились. Мы использовали данные Английского канцер-реестра [9] и Статистики больничных эпизодов (СБЭ) [10], связанные на уровне пациента, для наблюдения за мужчинами с раком предстательной железы, которые получали лечение с использованием ВИФУЗ в период с 1 января 2010 года по 31 декабря 2018 года. Для идентификации мужчин, больных раком предстательной железы, использовали код “С61” Международной классификации болезней 10-го издания (МКБ-10) [11] в данных канцер-реестра. Управление переписей населения и обследований Классификация хирургических операций и процедур, четвертая редакция (OPCS-4), код “M711” в СБЭ указывает на лечение ВИФУЗ, но не уточняет, было ли это лечение целой железы или очаговое. Благодаря дополнительной связи с Национальным набором данных по лучевой терапии (НДЛТ) [12] когорта была ограничена первичными случаями ВИФУЗ путем исключения мужчин, которые лечились лучевой терапией или брахитерапией. В результате окончательная когорта состояла из 1381 мужчины, которые проходили лечение в 31 больнице.
Первичный результат
Безотказная выживаемость определялась как избежание спасительной РП или ЛТ и любой смерти от рака предстательной железы после первичной ВИФУЗ. Повторная ВИФУЗ не была включена в первичный показатель результата. Случаи РП были идентифицированы с использованием кода OPCS-4 “M61” в рамках СБЭ. Пациенты, получавшие ЛТ по поводу рака предстательной железы, были идентифицированы в рамках НДЛТ при наличии первичного кода МКБ “C61”. Национальная статистическая служба Великобритании (НСС) предоставила данные о причине и дате смерти. Смерть от рака предстательной железы определялась как любая смерть, в которой рак предстательной железы был идентифицирован в свидетельстве о смерти как часть последовательности, приведшей к смерти.
Вторичные результаты
Наши вторичные результаты включали специфическую выживаемость при раке предстательной железы (СВР) и общую выживаемость (ОВ). Возникновение событий, связанных со скелетом (ССС), определяли с помощью системы кодирования, ранее разработанной и валидированной исследовательской группой [13]. Коротко говоря, ССС определялись как патологический перелом, компрессия спинного мозга, костная хирургия или паллиативная ЛТ на основе диагностических и процедурных кодов в данных СБЭ и кодов ЛТ в НДЛТ. Мы также измеряли свободу от повторных ВИФУЗ, определенных как последующее появление любого дополнительного кода OPCS-4 для ВИФУЗ в СБЭ после даты первичной ВИФУЗ (‘M711’).
Объясняющие и контрольные переменные
Т-стадия, N-стадия, классификация Международного общества урологической патологии (МОУП) и ПСА были определены на основе данных Национального канцер-реестра [14]. Возраст на момент госпитализации в ВИФУЗ был взят из данных СБЭ на основе возраста на момент госпитализации.
Статистический анализ
Анализ данных проводился с помощью программы Stata версии 15 (StataCorp LLC, Колледж Стейшн, Техас, США). Исходные характеристики представлены в виде медианы (межквартильного размаха [МКР]) или доли, в зависимости от обстоятельств. Оценки времени до события по Каплану-Мейеру описаны с 95% ДИ для всех мужчин. Время наблюдения определялось как время с момента госпитализации до 31 декабря 2018 г., если результат не наблюдался [15].Для анализа результатов, которые включают смерть от рака предстательной железы, пациенты, умершие от других причин, обрабатывались как цензурированные наблюдения [16]. Для анализа свободы от повторной ВИФУЗ пациенты, которые прошли радикальное лечение или умерли от любой причины, рассматривались как цензурированные наблюдения.
Для определения связи исходных характеристик с неудачей использовали многомерную регрессию Кокса с поправкой на возраст (как непрерывную переменную), год лечения, группу по классификации МОУП и стадию Т (последние три – как категориальные переменные). Анализ чувствительности был использован для мужчин с диагнозом, установленным с апреля 2014 года, для которых мы имели данные ПСА. Эта многомерная регрессионная модель Кокса была дополнительно скорректирована на ПСА. Модели были скорректированы на кластеризацию результатов в пределах больниц с использованием надежных стандартных ошибок на уровне больниц. Отношение рисков (ОР) оценивали с 95% ДИ, а для расчета значений Р использовали критерий Вальда. Этот аналитический подход был выбран для того, чтобы сделать наши результаты максимально сопоставимыми с исследованиями Guillaumier и соавт. [6] и Reddy и соавт. [7].
Отсутствующие значения для групп по классификации МОУП и Т стадию были имплицированы с помощью метода множественной импликации с помощью цепных уравнений [17]. Всего было создано 10 имплицитных наборов данных, а для объединения оценок исследований использовались правила Рубина. Отсутствующие значения ПСА были дополнительно вычислены для анализа чувствительности для мужчин с диагнозом, установленным в апреле 2014 года.
Результаты
Основные демографические показатели
В общем 1381 человек получил первичную ВИФУЗ в период с 2010 по 2018 год, с медианой (МКР) наблюдения после лечения 37 (20-62) месяцев. В целом 31 отдельная больница в Англии была определена как провайдер ВИФУЗ, из которых 10 больниц лечили ≥10 пациентов и пять больниц лечили ≥30 пациентов. На одну больницу приходится 62% всех случаев лечения в ВИФУЗ. В целом 625 (50%) пациентов имели группу 2 по шкале МОУП и 392 (31%) – группу 1 по шкале МОУП. Средний возраст (МКР) составлял 65 (59-70) лет. У 309 (81%) мужчин с диагнозом, установленным с апреля 2014 года, уровень ПСА был <10 нг/мл (Табл. 1).
Таблица 1. Исходные характеристики 1381 пациента, которые проходили ВИФУЗ.
| Характеристики | Значение |
| Возраст, годы, медиана (МКР) | 65 (59–70) |
| Год лечения, n (%) | |
| 2010 | 98 (7.1) |
| 2011 | 95 (6.9) |
| 2012 | 106 (7.7) |
| 2013 | 148 (11) |
| 2014 | 147 (11) |
| 2015 | 200 (14) |
| 2016 | 216 (16) |
| 2017 | 227 (16) |
| 2018 | 144 (10) |
| Группа оценки МОУП, n (%) | |
| 1 (Глисон 6) | 392 (31) |
| 2 (Глисон 3 + 4) | 625 (50) |
| 3 (Глисон 4 + 3) | 196 (16) |
| 4 (Глисон 8) | 30 (2.4) |
| 5 (Глисон 9 или 10) | 16 (1.3) |
| Пропавшие | 122 |
| T Стадия, n (%) | |
| 1 | 257 (25) |
| 2 | 677 (65) |
| 3 | 102 (9.8) |
| Пропавшие | 345 |
| Уровень ПСА (с апреля 2014 года), n (%) | |
| ≤10 нг/мл | 309 (81) |
| 10–20 нг/мл | 62 (16) |
| >20 нг/мл | 11 (2.9) |
| Пропавшие | 268 |
Первичный результат
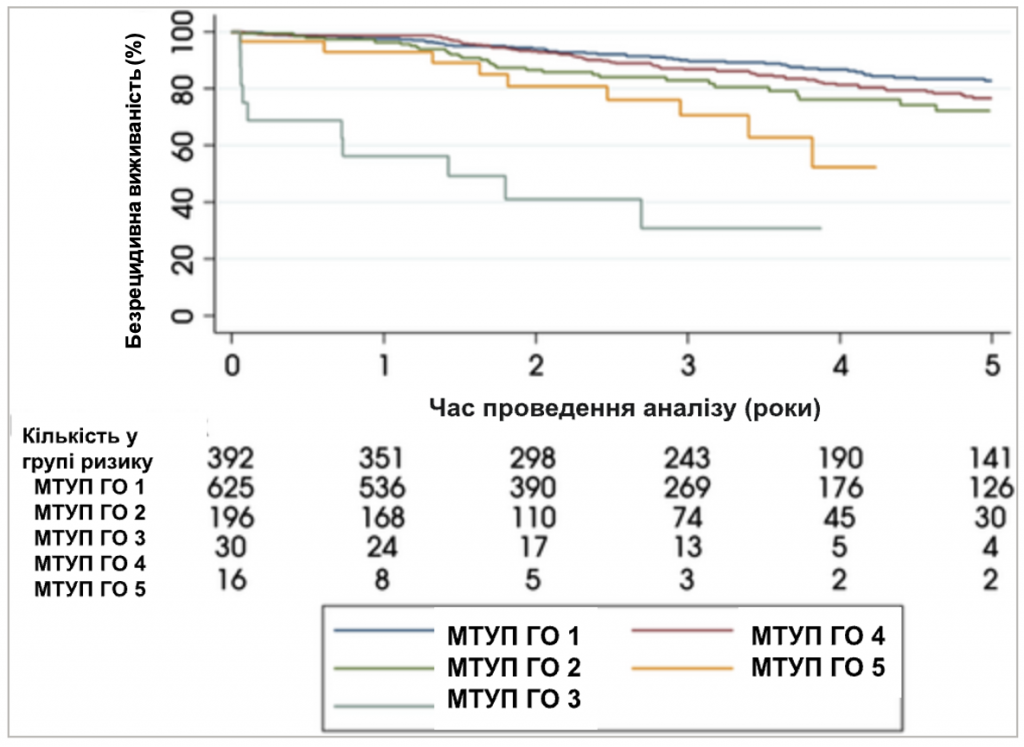
После первичного лечения в ВИФУЗ 145 мужчинам была выполнена внешняя лучевая ЛТ, а 111 – спасительная РП в течение периода наблюдения (Табл. 2). БВ составляла 96,5% через 1 год, 86,0% через 3 года и 77,5% через 5 лет (Табл. 2). БВ варьировала в зависимости от группы по МОУП, с наиболее заметной разницей между мужчинами с группами 1, 2 и 3, а также мужчинами с группами 4 и 5 (5-летняя БВ составляла 82,9% у мужчин с группой 1 по МОУП, 76,6% у мужчин с группой 2, 72,2% у мужчин с группой 3 по МОУП, 52,3% у мужчин с группой 4 и 30,8% у мужчин с группой 5; Табл. 2, Рис. 1).
Таблица 2. Оценки Каплана-Мейера для ОВ, СВР простаты, БВ и свободы от повторного ВИФУЗ.
| Оценка Каплана-Мейера, % (95% ДИ) | P* | |||
| 1 год | 3 годы | 5 лет | ||
| Первичный результат | ||||
| БВ | 96.5 (95.4–97.4) | 86.0 (83.7–87.9) | 77.5 (74.4–80-3) | <0.001 |
| МОУП ГО 1 | 97.6 (95.5–98.8) | 90.0 (86.2–92.8) | 82.9 (77.8–86.9) | |
| МОУП ГО 2 | 98.7 (97.4–99.4) | 86.9 (83.2–89.8) | 76.6 (71.2–81.1) | |
| МОУП ГО 3 | 96.3 (92.4–98.2) | 82.9 (75.7–88.2) | 72.2 (61.5–80.3) | |
| МОУП ГО 4 | 93.0 (74.6–98.2) | 70.6 (47.3–85.0) | 52.3 (24.5–74.2) | |
| МОУП ГО 5 | 56.3 (29.5–76.2) | 30.8 (9.1–56.1) | 30.8 (9.1–56.1) | |
| Вторичные результаты | ||||
| Отсутствие повторных ВИФУЗ | 98.6 (97.8–99.1) | 89.1 (86.9–90.9) | 79.1 (75.7–82.1) | 0.050 |
| МОУП ГО 1 | 97.9 (95.7–98.9) | 90.0 (86.1–92.9) | 83.5 (78.2–87.6) | |
| МОУП ГО 2 | 99.3 (98.2–99.8) | 89.1 (85.6–91.8) | 76.0 (70.0–81.1) | |
| МОУП ГО 3 | 97.8 (84.0–98.9) | 87.7 (80.7–92.3) | 72.4 (58.5–82.4) | |
| МОУП ГО 4 | 93.3 (75.9–98.3) | 76.4 (50.4–90.0) | 76.4 (50.4–90.0) | |
| МОУП ГО 5 | 100 | 100 | 100 | |
| СВР | 99.8 (99.3–100) | 99.6 (99.0–99.8) | 98.8 (97.7–99.4) | <0.001 |
| МОУП ГО 1 | 100 | 100 | 99.6 (97.1–100) | |
| МОУП ГО 2 | 100 | 100 | 99.1 (96.3–99.8) | |
| МОУП ГО 3 | 100 | 100 | 98.9 (92.5–99.8) | |
| МОУП ГО 4 | 100 | 100 | 100 | |
| МОУП ГО 5 | 87.5 (58.6–96.7) | 80.8 (51.4–93.4) | 80.1 (51.4–93.4) | |
| ОВ | 99.6 (99.0–99.8) | 98.2 (07.2–98.8) | 95.9 (94.2–97.1) | <0.001 |
| МОУП ГО 1 | 100 | 99.1 (97.3–99.7) | 98.2 (95.6–99.3) | |
| МОУП ГО 2 | 99.7 (98.7–100) | 98.7 (97.2–99.4) | 97.4 (94.9–98.7) | |
| МОУП ГО 3 | 100 | 97.8 (93.4–99.3) | 93.1 (85.6–96.7) | |
| МОУП ГО 4 | 96.3 (76.5–99.5) | 96.3 (76.5–99.5) | 91.0 (67.7–97.7) | |
| МОУП ГО 5 | 87.5 (58.6–96.7) | 73.4 (43.5–89.2) | 73.4 (43.5–89.2) | |
- ГО, группа оценки.
- * Для расчета P-значений использовали критерий Вальда многофакторной регрессионной модели Кокса (с поправкой на возраст, год лечения, МОУП ГО и Т стадию) для проверки гипотезы о том, что каждая переменная результата через 5 лет существенно изменялась в зависимости от МОУП ГО.
Рисунок. 1
Кривые Каплана-Мейера, отражающие БВ.
Используя многомерную регрессию Кокса, мы обнаружили статистически значимую связь между увеличением группы МОУП и частотой БВ согласно коэффициенту Вальда (P <0,001). По сравнению с группой 2 по классификации МОУП, БВ был статистически значимо ниже в группах 3 (КР 1,50, 95% ДИ 1,02-2,20), 4 (КР 3,04, 95% ДИ 1,58-5,85) и 5 (КР 9,86, 95% ДИ 4,45-21,87). Не было статистически значимой разницы в показателе БВ между группами 1 и 2 по шкале МОУП (КР 0,76, 95% ДИ 0,56-1,03). Это также наблюдалось при анализе чувствительности для мужчин с диагнозом, установленным с апреля 2014 года, где мы также могли скорректировать уровень ПСА (P < 0,001).
Вторичные результаты
Через 5 лет 21% мужчин прошли по крайней мере одно повторное лечение ВИФУЗ (всего 187 пациентов: одно повторное лечение у 172, два повторных лечения у 13 и три повторных лечения у двух; Табл. 2). Отсутствие повторной ВИФУЗ через 1 год составляло 98,6% (95% ДИ 97,8%-99,1%), через 3 года – 89,1% (95% ДИ 86,8%-90,9%) и через 5 лет – 79,1% (95% ДИ 75,7%-82,1%).
В общем, девять мужчин перенесли ССС и было 44 смерти, 13 из которых были связаны с раком предстательной железы (Табл. 2). СВР простаты составляла 99,8% через 1 год, 99,6% через 3 года и 98,8% через 5 лет. ОВ составляла 99,6% через 1 год, 98,2% через 3 года и 95,9% через 5 лет.
Обсуждение
Это одна из крупнейших серий исследований, опубликованных на сегодняшний день, описывающая результаты лечения рака предстательной железы после первичного лечения ВИФУЗ. Мы стремились включить всех мужчин, которые прошли первичное лечение ВИФУЗ в период с 2010 по 2018 год в Национальной службе здравоохранения Англии. Наши результаты имеют важные последствия. Во-первых, они указывают на то, что примерно один из каждых 100 мужчин с этим типом рака предстательной железы умрет от своей болезни, а примерно один из пяти мужчин, прошедших ВИФУЗ, потерпит неудачу лечения, что требует спасительного вмешательства в течение 5 лет после первичного лечения ВИФУЗ. Во-вторых, БВ тесно связана с группой по шкале МОУП, причем мужчины в двух самых высоких группах по шкале МОУП имели плохие результаты лечения. Например, мы обнаружили, что только половина мужчин в 4-й группе МОУП и только треть мужчин в 5-й группе МОУП не потерпели неудачу лечения в течение 5 лет.
Ключевым преимуществом нашего исследования является то, что оно направлено на описание результатов у всех пациентов, которые проходили лечение в Национальной службе здравоохранения Англии в течение последнего периода. Наше исследование включает любого пациента, который имеет код ВИФУЗ в СБЭ, и, таким образом, включает все больницы НСС в Англии, а не только те больницы, которые предоставляют данные в клинический реестр ВИФУЗ. Точность административных данных больниц оказалась высокой (84%) по сравнению с клинической документацией, и эти типы данных считаются достаточно надежными для поддержки их использования в исследованиях [18].
Кроме того, наши источники данных способны идентифицировать случаи неудач, которые случаются в местных больницах, расположенных на периферии от специализированного центра, где изначально проводилось ВИФУЗ. Это одно из возможных объяснений того, почему мы сообщаем о несколько более низком показателе 5-летнего БВ – 78% по сравнению с 88% в исследовании Guillaumier и соавт. [6]. Более масштабное исследование Reddy и соавт. [7] включало 1379 мужчин и показало 5-летнюю БВ 82%, что ближе к 5-летней БВ, о которой мы сообщаем, а также к 7-летней БВ 69%. Однако неясно, в какой степени национальный охват наших данных объясняет различия в показателях БВ между нашим исследованием и исследованиями, которые используют клинические реестры, включающие пациентов в выбранных больницах. Наше исследование, основанное на связанных национальных клинических и административных данных больниц, не в состоянии исследовать происхождение этих различий.
Другим возможным объяснением разницы является то, что пациенты в нашем исследовании включали некоторые случаи ВИФУЗ целой железы, поскольку код процедуры для ВИФУЗ не различает ВИФУЗ целой железы и очаговую ВИФУЗ, что является ограничением административной базы данных больницы, которую мы использовали. Однако важно также отметить, что наш анализ чувствительности, который исключал случаи до апреля 2014 года, когда в Великобритании значительно реже применяли операцию ВИФУЗ целой железы, чем очаговую ВИФУЗ, показал подобные результаты БВ, как и наш основной анализ.
Другие потенциальные причины разницы могут заключаться в различных больницах и периодах времени, которые были включены в исследование. Наше исследование охватило все больницы НСС в Англии, и мы зафиксировали дополнительные случаи, которые не были включены в клинический реестр, о котором сообщают Guillaumier и соавт. [6] и Reddy и соавт. [7]. При этом 1214 из 1389 пациентов (87%), включенных в эту статью, получали ВИФУЗ в одной из пяти больниц НСС, которые вносили пациентов в клинический реестр ВИФУЗ, использованный в работах Guillaumier и соавт. [6] и Reddy и соавт. [7]. Однако следует отметить, что в этот клинический реестр авторы включили небольшое количество пациентов из четырех частных больниц, которые не были включены в наше исследование.
Наконец, наше определение БВ не включало избежание системной терапии или развитие метастазов, поскольку они не были точно зафиксированы в наших базах данных. Однако, поскольку это редкие события в течение 5 лет после постановки диагноза у пациентов с раком предстательной железы, получавших радикальное местное лечение, мы считаем, что их исключение мало повлияло на наши результаты. Более того, любое влияние уменьшило бы приведенные нами оценки БВ, что еще больше увеличило бы разницу между нашими результатами и исследованиями Guillaumier и соавт. [6] и Reddy и соавт. [7].
Что касается СВР, то наши результаты, которые показывают 98,8% выживаемости в течение 5 лет, согласуются с исследованиями Guillaumier и соавт. [6] и Reddy и соавт. [7]. Это обнадеживает, поскольку нет никаких доказательств того, что первичная ВИФУЗ приводит к ухудшению выживаемости при СВР в течение 5 лет. Однако, согласно нашим данным, 21% пациентов, получавших ВИФУЗ в качестве первичного лечения, нуждались в более одном лечении ВИФУЗ, а 22% нуждались в спасительном лечении или умерли от рака простаты в течение 5 лет. В будущих исследованиях связь данных клинических реестров с данными, полученными из рутинно собранных канцер-реестров и административных больничных баз данных, поможет устранить расхождения между источниками данных.
Важной будет отчетность о результатах через 10 лет и далее, учитывая, что СВР при локализованном раке предстательной железы является высокой в краткосрочной и среднесрочной перспективе, независимо от метода лечения, особенно при активном наблюдении за группами 1 и 2 по классификации МОУП [19–21]. Ожидаются результаты исследования “Частичная абляция предстательной железы против радикальной простатэктомии” (PART), которые будут важными для оценки ценности ВИФУЗ при раке предстательной железы промежуточного риска [22].
Учитывая наши данные, что пятая часть мужчин, получающих первичную ВИФУЗ, будут нуждаться в местном спасительном лечении в течение 5 лет, очевидно, что отбор пациентов для ВИФУЗ является ключевым, и наши результаты подчеркивают важность учета пожеланий пациента и соответствующего консультирования при начальном планировании лечения.
Еще одним аспектом, который требует рассмотрения, является профиль побочных эффектов после первичного лечения ВИФУЗ. Отчеты указывают на то, что очаговая терапия имеет минимальное влияние на качество жизни и что мочеполовая функция хорошо сохраняется [4, 5], что согласуется с результатами исследования Guillaumier и соавт. [6], которое показало, что 98% мужчин были без прокладок и 80% были без прокладок, без протекания через 2-3 года. Однако, в исследовании с использованием данных СБЭ 1742 пациентов, пролеченных с 2007 по 2018 год в английской НСС, сообщается, что частота возникновения стриктур уретры после ВИФУЗ составляла 10%, а у 1,3% развился мочевой свищ (без уточнения продолжительности наблюдения) [23]. Это исследование также изучало дальнейшее лечение после ВИФУЗ и показало, что среди пациентов с по крайней мере 5-летним периодом наблюдения 18% получили спасительное лечение (либо ЛТ, либо хирургическое вмешательство, либо и то, и другое) в течение 5 лет после первичного лечения ВИФУЗ. Его результаты больше соответствуют 5-летней БВ 78%, о которой сообщалось в нашем исследовании, и БВ 82%, о которой сообщали Reddy и соавт. [7], а не БВ 88%, о которой сообщали Guillaumier и соавт. [6].
В заключение, наш анализ связанных рутинно собранных национальных данных показал, что 5-летняя БВ после первичной ВИФУЗ в Англии составляет 78%, что ниже, чем в других сериях исследований с использованием клинических реестров. Пациенты должны быть должным образом проинформированы о возможной потребности в повторной ВИФУЗ и спасительном лечении, частота которого связана со степенью рака. Для полной оценки влияния ВИФУЗ на контроль рака в долгосрочной перспективе необходимо дальнейшее наблюдение после 5 лет.
Ссылки на источники
- European Association of Urology. Guidelines on Prostate Cancer. 2017. Available at: http://uroweb.org/guideline/prostate-cancer/. Accessed December 2022.
- National Institute for Health and Care Excellence. Prostate Cancer: Diagnosis and Management. 2019. Available at: https://www.nice.org.uk/guidance/ng131/resources/prostate-cancer-diagnosis-and-management-pdf-66141714312133. Accessed December 2022.
- National Prostate Cancer Audit. Annual Report 2018: Results of the NPCA Prospective Audit in England and Wales for Men Diagnosed from 1 April 2016–31 March 2017. Available at: https://www.npca.org.uk/reports/npca-annual-report-2018/. Accessed December 2022.
- Valerio M, Ahmed HU, Emberton M et al. The role of focal therapy in the management of localised prostate cancer: a systematic review. Eur Urol 2014; 66: 732–751
- Valerio M, Cerantola Y, Eggener SE et al. New and established technology in focal ablation of the prostate: a systematic review. Eur Urol 2017; 71: 17–34
- Guillaumier S, Peters M, Arya M et al. A multicentre study of 5-year outcomes following focal therapy in treating clinically significant nonmetastatic prostate cancer. Eur Urol 2018; 74: 422–429
- Reddy D, Peters M, Shah TT et al. Cancer control outcomes following focal therapy using high-intensity focused ultrasound in 1379 men with nonmetastatic prostate cancer: a multi-institute 15-year experience. Eur Urol 2022; 81: 407–413
- Shah TT, Reddy D, Peters M et al. Focal therapy compared to radical prostatectomy for non-metastatic prostate cancer: a propensity score-matched study. Prostate Cancer Prostatic Dis 2021; 24: 567–574
- National Cancer Intelligence Network. National Cancer Data Repository. Available at: http://www.ncin.org.uk/collecting_and_using_data/national_cancer_data_repository/. Accessed December 2022.
- National Health Service. Hospital Episode Statistics. Available at: http://www.hesonline.nhs.uk. Accessed December 2022.
- World Health Organisation. International Statistical Classification of Diseases and Related Health Problems (10th Revision). Available at: http://www.who.int/classifications/icd/ICD10Volume2_en_2010.pdf. Accessed December 2022.
- National Cancer Registration and Analysis Service. National Radiotherapy Dataset (RTDS). Available at: http://www.ncin.org.uk/collecting_and_using_data/rtds. Accessed December 2022.
- Parry MG, Cowling TE, Sujenthiran A et al. Identifying skeletal-related events for prostate cancer patients in routinely collected hospital data. Cancer Epidemiol 2019; 63: 101628
- Epstein JI, Egevad L, Amin MB, Delahunt B, Srigley JR, Humphrey PA. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason grading of prostatic carcinoma: definition of grading patterns and proposal for a new grading system. Am J Surg Pathol 2016; 40: 244–252
- Schemper M, Smith TL. A note on quantifying follow-up in studies of failure time. Control Clin Trials 1996; 17: 343–346
- Mariotto AB, Noone AM, Howlader N et al. Cancer survival: an overview of measures, uses, and interpretation. J Natl Cancer Inst Monogr 2014; 2014: 145–186
- White IR, Royston P, Wood AM. Multiple imputation using chained equations: issues and guidance for practice. Stat Med 2011; 30: 377–399
- Burns EM, Rigby E, Mamidanna R et al. Systematic review of discharge coding accuracy. J Public Health (Oxf) 2012; 34: 138–148
- Gnanapragasam VJ, Lophatananon A, Wright KA, Muir KR, Gavin A, Greenberg DC. Improving clinical risk stratification at diagnosis in primary prostate cancer: a prognostic modelling study. PLoS Med 2016; 13: e1002063
- Gnanapragasam VJ, Bratt O, Muir K et al. The Cambridge Prognostic Groups for improved prediction of disease mortality at diagnosis in primary non-metastatic prostate cancer: a validation study. BMC Med 2018; 16: 31
- Hamdy FC, Donovan JL, Lane JA et al. 10-year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer. N Engl J Med 2016; 375: 1415–1424
- Oxford Clinical Trials Research Unit. PART: Partial Ablation versus Radical ProsTatectomy 2020. Available at: https://part.octru.ox.ac.uk/. Accessed December 2022.
- Dosanjh A, Harvey P, Baldwin S et al. High-intensity focused ultrasound for the treatment of prostate cancer: a national cohort study focusing on the development of stricture and fistulae. Eur Urol Focus 2020; 7: 340–346