Резюме
В отличие от прогрессирующего фиброза печени, практические правила ранней неинвазивной диагностики цирроза печени при НАЖБП остаются недостаточно определенными. В этой статье мы сообщаем о разработке и валидации поэтапного диагностического алгоритма у 1568 пациентов с НАЖБП и биопсией печени из четырех независимых когорт. Алгоритм исследования, используя сначала тесты на основе эластографии Agile3+ и Agile4, а затем специализированные анализы крови FibroMeterV3G и CirrhoMeterV3G, обеспечивает стратификацию на четыре группы, последняя из которых обогащена циррозом печени (71% распространенности в валидационном наборе). Также получен график прогнозирования риска, позволяющий оценить индивидуальную вероятность развития цирроза печени. Прогнозируемый риск демонстрирует отличную калибровку в валидационном наборе, а средняя разница с идеальным прогнозом составляет лишь -2,9%. Эти инструменты улучшают персонализированную неинвазивную диагностику цирроза печени при НАЖБП.
Вступление
Прогноз для пациентов с неалкогольной жировой болезнью печени (НАЖБП), самой распространенной причиной хронических заболеваний печени во всем мире, тесно связан со стадией фиброза печени 1,2. Сейчас существует несколько неинвазивных стратегий, в основном с использованием анализов крови и эластографии, для выявления подгруппы пациентов из группы риска в клинической практике 3. Предложены алгоритмы, объединяющие неинвазивные тесты, не только для повышения точности диагностики, но и для определения оптимальной последовательности их использования для выявления пациентов, нуждающихся в направлении к гепатологу 4,5. В своих последних рекомендациях 2021 года Европейская ассоциация по изучению печени (ЕАИП) предложила трехуровневый алгоритм диагностики прогрессирующего фиброза печени при НАЖБП с использованием сначала простого анализа крови FIB4, затем измерения жесткости печени с помощью вибрационно контролируемой транзиентной эластографии (ВКТЭ) и, наконец, запатентованных анализов крови 6. Поскольку он позволяет диагностировать прогрессирующий фиброз печени без биопсии печени, когда все три диагностические линии согласуются, этот алгоритм является инновационным и представляет собой значительный прогресс в лечении пациентов с НАЖБП.
Выявление пациентов с циррозом печени неинвазивным путем, в отличие от прогрессирующего фиброза, является основным приоритетом в области НАЖБП, поскольку такие пациенты нуждаются в особом клиническом ведении, включая скрининг на гепатоцеллюлярную карциному, варикозное расширение вен пищевода и саркопению, как это рекомендовано большинством международных рекомендаций 7,8,9. Кроме того, для пациентов с цирротическим НАСГ 10 проводятся специфические терапевтические исследования, что делает необходимым тщательный отбор кандидатов для этих исследований. Сейчас доступны новые неинвазивные тесты, специально разработанные для диагностики цирроза. Agile4 сочетает результаты ВКТЭ с рутинными параметрами оценки печени (сывороточные трансаминазы, тромбоциты, пол и диабет) в формуле, посвященной циррозу 11. CirrhoMeterV3G (CMV3G) был разработан для определения цирроза печени с использованием тех же биомаркеров, что и в специализированном анализе крови FibroMeterV3G (FMV3G) 12. Эти тесты, предназначенные для диагностики цирроза, дают возможность усовершенствовать рекомендуемые на сегодня алгоритмы неинвазивной диагностики прогрессирующего фиброза печени. Действительно, рассчитанные одновременно с тестами, используемыми в этих алгоритмах, без необходимости использования дополнительных биомаркеров, они могут способствовать дискриминации новой группы, включающей пациентов с циррозом печени.
В этой работе мы использовали самые эффективные неинвазивные тесты, доступные в настоящее время специалистам по печени, для разработки и валидации точного диагноза цирроза печени у пациентов с НАЖБП, который переведен в категорию “цирроз печени” в рекомендуемых в настоящее время диагностических алгоритмах.
Результаты
Пациенты
Из 1757 пациентов, которые были первоначально доступны, 1568 были включены в исследование. Их характеристики приведены в таблице 1. Средний возраст составил 57,6 лет, 59,1% пациентов были мужчинами, средний ИМТ – 31,6 кг/м2, 51,3% имели сахарный диабет 2 типа. Средняя длина биоптата составляла 25 мм, а 91,6% биоптатов были длиной не менее 15 мм. Распространенность прогрессирующего фиброза печени F34 составила 38,3%, а цирроза – 12,1%.
Таблица 1 Характеристики пациентов
|
|
Всего(n = 1568) |
Набор дериваций (n = 872) |
Набор валидаций (n = 696) |
p |
Возраст (лет) |
57.6 [48.6;64.9] |
57.0 [48.0;64.0] |
58.4 [49.4;65.7] |
0.020 |
Мужской пол (%) |
59.1 |
56.4 |
62.5 |
0.015 |
ИМТ (кг/м2) |
31.6 [28.3;36.3] |
31.9 [28.1;36.8] |
31.6 [28.5;36.0] |
0.776 |
СД2(%) |
51.3 |
52.5 |
49.9 |
0.309 |
Длина биоптата (мм) |
25 [20;33] |
24 [18;30] |
30 [22;35] |
1.1e−19 |
Оценка активности НАЖБП |
4 [3;5] |
5[3;6] |
4 [3;5] |
1.1e−9 |
Стадия фиброза (%): |
|
|
|
0.015 |
– F0 |
12.1 |
12.4 |
11.6 |
|
– F1 |
22.6 |
23.4 |
21.6 |
|
– F2 |
27.1 |
24.2 |
30.7 |
|
– F3 |
26.2 |
26.1 |
26.3 |
|
– F4 |
12.1 |
13.9 |
9.8 |
|
Фиброз F34 (%) |
38.3 |
40.0 |
36.1 |
0.117 |
Цирроз F4 (%) |
12.1 |
13.9 |
9.8 |
0.015 |
АсАТ (МЕ/л) |
39 [29;55] |
39 [30;56] |
38 [28;54] |
0.137 |
АлАТ (МЕ/л) |
55 [36;79] |
54 [35;79] |
56 [37;82] |
0.244 |
Гамма-ГТ (МЕ/л) |
72 [40;139] |
71 [41;141] |
73 [40;133] |
0.759 |
Билирубин (мкмоль/л) |
10 [7;13] |
10 [7;13] |
10 [7;14] |
0.715 |
Альбумин (г/л) |
43.4 [41.0;46.0] |
43.4 [41.1;46.0] |
43.9 [41.0;46.0] |
0.569 |
Тромбоциты (Г/л) |
222 [181;265] |
224 [183;266] |
218 [179;261] |
0.163 |
Протромбиновое время (%) |
95 [88;101] |
93 [86;100] |
97 [90;103] |
1.9e−11 |
Оценка фиброза при НАЖБП |
−0.801 [−1.936;0.279] |
−0.800 [−1.974;0.300] |
−0.801 [−1.885;0.218] |
0.704 |
FIB4 |
1.36 [0.92;2.04] |
1.34 [0.91;2.07] |
1.37 [0.93;2.00] |
0.915 |
FibroMeterV3G |
0.48 [0.28;0.73] |
0.47 [0.28;0.74] |
0.48 [0.28;0.70] |
0.219 |
CirrhoMeterV3G |
0.02 [0.01;0.10] |
0.02 [0.01;0.10] |
0.02 [0.01;0.09] |
0.105 |
ВКТЭ (кПа) |
8.7 [6.1;13.2] |
8.5 [6.1;12.5] |
8.8 [6.1;13.9] |
0.213 |
Agile3+ |
0.43 [0.14;0.77] |
0.43 [0.13;0.77] |
0.43 [0.14;0.76] |
0.826 |
Agile4 |
0.04 [0.01;0.17] |
0.05 [0.01;0.19] |
0.04 [0.01;0.16] |
0.869 |
-
АлАТ Аланинаминотрансфераза, АсАТ Аспартатаминотрансфераза, ИМТ Индекс массы тела, НАЖБП Неалкогольная жировая болезнь печени, СД2 Сахарный диабет 2 типа, ВКТЭ Вибрационно контролируемая транзиентная эластография.
-
Непрерывные переменные выражались как медиана с первым и третьим квартилями и сравнивались с помощью теста Манна-Уитни или теста Краскела-Уоллиса, когда это было целесообразно. Категориальные переменные выражались в процентах и сравнивались с помощью критерия хи-квадрат или Фишера, когда это было уместно. Все статистические тесты были двусторонними.
Точность неинвазивных тестов
Наши результаты подтвердили очень хорошие и отличные области под рабочей характеристикой приемника (AUROC) неинвазивных тестов для диагностики цирроза печени с результатами, достигающими 0,90 для лучших тестов (Табл. 2). Как для прогрессирующего фиброза, так и для цирроза, оценка фиброза по NAFLFD была наименее точным тестом на фиброз, а тесты на основе эластографии показали лучшие результаты, чем тесты на фиброз крови (Табл. 2).
Таблица 2 AUROC неинвазивных тестов на прогрессирующий фиброз и цирроз печени
| Цель диагностики | Тест на фиброз | Всего(n = 1568) | Набор дериваций (n = 872) | Набор валидаций (n = 696) | p |
| Расширенный | ОФН | 0.743 (0.718–0.767) | 0.750 (0.718–0.783) | 0.733 (0.695–0.770) | 0.505 |
| Фиброз | FIB4 | 0.779 (0.756–0.802) | 0.791 (0.761–0.821) | 0.763 (0.727–0.799) | 0.232 |
| F34 | FibroMeterV3G | 0.792 (0.769–0.815) | 0.789 (0.758–0.820) | 0.795 (0.761–0.830) | 0.797 |
| CirrhoMeterV3G | 0.758 (0.732–0.783) | 0.760 (0.727–0.793) | 0.753 (0.715–0.792) | 0.790 | |
| ВКТЭ | 0.820 (0.799–0.841) | 0.816 (0.787–0.845) | 0.829 (0.798–0.860) | 0.553 | |
| Agile3+ | 0.852 (0.832–0.871) | 0.846 (0.820–0.872) | 0.860 (0.831–0.888) | 0.464 | |
| Agile 4 | 0.838 (0.841–0.879) | 0.832 (0.804–0.860) | 0.845 (0.815–0.875) | 0.526 | |
| Цирроз | ОФН | 0.767 (0.734–0.801) | 0.766 (0.723–0.809) | 0.774 (0.723–0.826) | 0.814 |
| F4 | FIB4 | 0.816 (0.785–0.848) | 0.818 (0.781–0.856) | 0.814 (0.758–0.870) | 0.908 |
| FibroMeterV3G | 0.820 (0.789–0.851) | 0.813 (0.774–0.853) | 0.832 (0.783–0.880) | 0.553 | |
| CirrhoMeterV3G | 0.812 (0.778–0.846) | 0.801 (0.756–0.846) | 0.830 (0.778–0.881) | 0.403 | |
| ВКТЭ | 0.870 (0.845–0.895) | 0.859 (0.825–0.893) | 0.900 (0.870–0.931) | 0.079 | |
| Agile3+ | 0.893 (0.871–0.915) | 0.875 (0.844–0.905) | 0.925 (0.898–0.952) | 0.019 | |
| Agile 4 | 0.893 (0.869–0.917) | 0.875 (0.841–0.908) | 0.925 (0.897–0.953) | 0.023 |
-
- ОФН Оценка фиброза НАЖБП, ВКТЭ Вибрационно контролируемая транзиторная эластография.
- AUROC сравнивали с помощью двустороннего теста Делонга.
Мы оценили точность порогов исключения/включения для тестов, предназначенных для диагностики цирроза печени, а также для тестов, направленных на диагностику прогрессирующего фиброза. Диагностическая точность этих пороговых значений была согласованной между деривационным и валидационным наборами. Для исключения цирроза печени низкий порог F34 оказался лучше, чем низкий порог F4, с двух-трехкратным уменьшением количества ложноотрицательных результатов, что привело к повышению чувствительности до > 95%. С другой стороны, высокий порог F4 оказался лучше, чем высокий порог F34 для определения цирроза печени, с 2-6-кратным уменьшением количества ложноположительных результатов и более высокой специфичностью, которая достигла > 92%. В совокупности эти результаты свидетельствуют о том, что сочетание низкого порога F34 с высоким порогом F4 является лучшим подходом для исключения и подтверждения цирроза печени.
Комплементарность тестов на фиброз
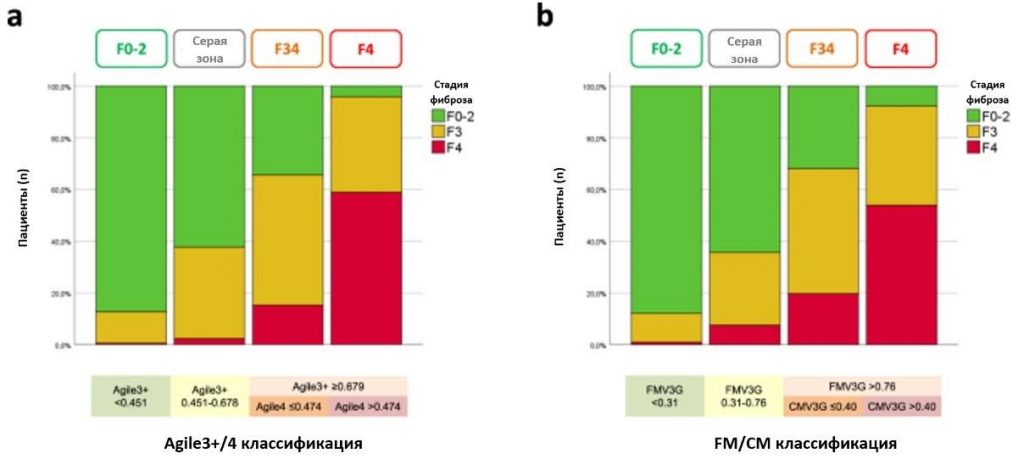
Тесты на фиброз из каждой соответствующей пары, FMV3G/CMV3G и Agile3+/Agile4, включают одинаковые переменные, хотя один тест предназначен для диагностики прогрессирующего фиброза печени (FMV3G, Agile3+), а другой – для диагностики цирроза (CMV3G, Agile4). Поэтому мы оценили взаимодополняемость тестов каждой из этих двух пар. Agile3+ и Agile4 очень хорошо коррелировали, а связь между этими двумя тестами имела экспоненциальную форму. Таким образом, путем перекрестной связи трех интервалов, определенных пороговыми значениями F34 Agile3+, с тремя интервалами, определенными пороговыми значениями F4 Agile4, мы увидели, что Agile4 стратифицирует риск развития цирроза в пределах высшего интервала Agile3+ (Рис. 1а). Действительно, у пациентов с Agile3+ ≥0,679 распространенность цирроза печени была еще выше, когда Agile4 составлял > 0,474. Это побудило нас разработать классификацию Agile3 + / 4, включающую четыре группы с возрастающей распространенностью прогрессирующего фиброза и цирроза печени (Рис. 1b): (i) Agile3 + <0,451; (ii) Agile3+ между 0,451 и 0,678; (iii) Agile3 + ≥ 0,679 с Agile4 ≤ 0,474; и (iv) Agile3 + ≥0,679 с Agile4 > 0,474. Аналогичные результаты были получены для FMV3G и CMV3G, причем CMV3G также стратифицирует риск цирроза в пределах высшего интервала FMV3G (Рис. 1c), что приводит к выделению четырех групп по классификации FM/CM (Рис. 1d): (i) FMV3G < 0,31; (ii) FMV3G между 0,31 и 0,76; (iii) FMV3G > 0,76 с CMV3G ≤ 0,40; и (iv) FMV3G > 0,76 с CMV3G > 0,40.
Рисунок 1: Классификации Agile3+/4 и FibroMeterV3G/CirrhoMeterV3G (FM/CM) в деривационном набореa Стадии фиброза как функция подгрупп, определенных пороговыми значениями F34 Agile3+ и F4 Agile4. b Стадии фиброза как функция четырех групп классификации Agile3 + /4. Четыре группы классификации Agile3 + /4 являются результатом пересечения результатов Agile3+ и Agile4 следующим образом: (i) Agile3+ < 0,451; (ii) Agile3+ между 0,451-0,678; (iii) Agile3+ ≥ 0,679 при Agile4 ≤ 0,474; и (iv) Agile3+ ≥ 0,679 при Agile4 > 0,474. c Стадии фиброза как функция подгрупп, определенных пороговыми значениями F34 FibroMeterV3G (FMV3G) и F4 CirrhoMeterV3G (CMV3G). d Стадия фиброза как функция четырех групп по классификации FM/CM. Четыре группы классификации FM/CM является результатом пересечения результатов FMV3G и CMV3G следующим образом: (i) FMV3G < 0,31; (ii) FMV3G между 0,31-0,76; (iii) FMV3G > 0,76 при CMV3G ≤ 0,40; и (iv) FMV3G > 0,76 при CMV3G > 0,40. Исходные данные предоставляются в виде файла Source Data.
В выборке валидации распространенность цирроза печени составляла менее 1% в первой группе по классификациям Agile3+/4 и FM/CM (Рис. 2а, b). В четвертой группе распространенность цирроза составляла 59% для классификации Agile3+/4 и 54% для классификации FM/CM.
Рисунок 2: Классификации Agile3+/4 и FibroMeterV3G/CirrhoMeterV3G (FM/CM) в валидационном наборе.Стадии фиброза в зависимости от четырех групп классификации Agile3+/4 (а) и четырех групп классификации FM/CM (б) в валидационном наборе. Исходные данные предоставляются в виде файла Source Data.
Алгоритм исследования
На основе предыдущих результатов мы выбрали лучшего кандидата среди простых анализов крови (FIB4), специализированных анализов крови (комбинация FMV3G/CMV3G) и тестов на основе эластографии (комбинация Agile3 + / 4). Многофакторный анализ, включавший эти три кандидата, показал, что комбинации Agile3 + / Agile4 и FMV3G/CMV3G являются независимыми предикторами цирроза печени без существенного влияния FIB4. Последние рекомендации ЕАИП предлагают использовать специализированные анализы крови для подтверждения диагноза фиброза печени, установленного с помощью ВКТЭ 6. Поэтому мы оценили, помогает ли классификация FM/CM (на основе специализированных анализов крови) уточнить диагноз фиброза печени, установленный с помощью классификации Agile3+/4 на основе эластографии. Распространенность стадий фиброза в 16 полученных подгруппах позволила нам окончательно стратифицировать пациентов по четырем диагнозам (Рис. 3а): F0-2; Необходима биопсия печени (серая зона); Углубленный фиброз F34; Цирроз F4. На Рис. 3b (деривационный набор) и Рис. 3c (валидационный набор) показаны стадии фиброза в зависимости от этих четырех групп. В валидационном наборе 71% пациентов из группы F4 имели подтвержденный цирроз по результатам биопсии печени. Среди пациентов с циррозом печени 47% были в группе F4, 43% – в группе F34, 7% – в группе биопсии, и только 3% были ошибочно классифицированы в группе F0-2. Алгоритм исследования поставил правильный диагноз 86% пациентов и требовал проведения биопсии печени только у 20% пациентов. Важно, что 88% неправильно классифицированных пациентов в валидационном наборе имели только одну стадию фиброза. Все эти результаты были надежными и не отличались между деривационным и валидационным набором.
Рисунок 3: Алгоритм исследования.a Описание алгоритма. Последовательность использования неинвазивных тестов является такой же, как и недавно рекомендованная Европейской ассоциацией по изучению печени: сначала ВКТЭ, а затем специализированный анализ крови 6. Специализированный анализ крови выполняется после ВКТЭ только при условии Agile3+ ≥0,451 для подтверждения диагноза при подозрении на прогрессирующий фиброз/цирроз печени. Алгоритм исследования стратифицирует пациентов на четыре диагностические группы: F0-2 (отсутствие/легкий фиброз), Биопсия (то есть неопределенный диагноз с необходимостью проведения биопсии печени), F34 (прогрессирующий фиброз) и F4 (цирроз). b Стадии фиброза как функция четырех групп, определенных алгоритмом исследования в наборе для вывода. c Стадии фиброза как функция четырех групп, определенных алгоритмом исследования в наборе для валидации. CMV3G: CirrhoMeterV3G; FMV3G: FibroMeterV3G; FM/CM классификация: Классификация FibroMeterV3G/CirrhoMeterV3G; ВКТЭ: вибрационно контролируемая транзиторная эластография. Исходные данные предоставляются в виде файла Source Data.
По сравнению с ЕАИП, классификация Agile3 + /4 и алгоритм исследования включали больше пациентов в категорию “F0-2”, сохраняя при этом высокую точность диагностики в этой категории 85-90%. Алгоритм исследования превзошел классификацию Agile3 + /4 по количеству пациентов, правильно отнесенных к категориям F34 и F4 (то есть положительное прогностическое значение), а также во всей популяции. Наконец, по сравнению с ныне рекомендуемым путем ЕАИП, алгоритм исследования поддерживал высокую диагностическую точность в валидационном наборе (соответственно 86,1% против 85,9%, p = 1,000), обеспечивая при этом категорию цирроза печени F4 без использования дополнительных биомаркеров.
Далее мы сосредоточились на точности исследуемого алгоритма бинарной диагностики цирроза печени по сравнению с классификацией Agile3 + /4. Для этого анализа мы рассматривали категории F0-2 и серую зону этих алгоритмов как зону исключения цирроза, категорию F34 – как неопределенную зону цирроза (без дискриминации между пациентами F4 и F3), а категорию F4 – как зону включения. По сравнению с классификацией Agile3 + /4 в валидационном наборе, алгоритм исследования обеспечил 20% повышение точности диагностики в зоне действия правил (положительное прогностическое значение с 58,9% до 71,1%) и, соответственно, меньшее количество ложноположительных результатов относительно цирроза печени.
Фиброз печени, измеренный с помощью морфометрии биоптатов из Анжерского центра, хорошо коррелировал со стадиями фиброза, особенно с площадью фиброза (Rs = 0,548) и еще больше с площадью портального фиброза (Rs = 0,711). Площадь фиброза и площадь портального фиброза постепенно увеличивались во всех четырех группах нашего алгоритма исследования, причем разница была значимой между всеми парами соседних групп.
Диаграммы прогнозирования рисков
В рамках деривационного набора было разработано две диаграммы прогнозирования риска: одна для диагностики цирроза, а другая – для прогрессирующего фиброза печени. Эти диаграммы были представлены с помощью контурных графиков, показывающих совместное влияние Agile3+/Agile4 и FMV3G/CMV3G на риск развития цирроза (Рис. 4а) и риск развития прогрессирующего фиброза печени (Рис. 4b). Например, для пациента с Agile3+ на уровне 0,85, Agile4 на уровне 0,68, FMV3G на уровне 0,91 и CMV3G на уровне 0,40 прогнозируемый риск прогрессирующего фиброза печени составляет > 90% (Рис. 4б), а риск цирроза – 60-80% (Рис. 4а).
Рисунок 4: Диаграммы прогнозирования рисков.
Диаграммы риска для прогнозирования цирроза печени (а) и прогрессирующего фиброза (б). Когда Agile3+ >0,678, перейдите к шкале Agile4; когда FibroMeterV3G >0,76, перейдите к шкале CirrhoMeterV3G.
На Рис. 5а показан калибровочный график диаграммы риска цирроза печени в валидационном наборе. Калибровка между прогнозируемым риском по диаграмме и наблюдаемой распространенностью цирроза была отличной. Средняя разница между прогнозируемым риском с помощью графика риска цирроза печени (сплошная черная линия) и идеальным прогнозом (пунктирная синяя линия) составляла лишь -2,9% (крайние значения: -5% и -2%). Мы также оценили распространенность цирроза печени в 7 группах, выделенных с помощью диаграммы риска цирроза. Как и ожидалось, после анализа калибровочного графика наблюдаемая распространенность цирроза очень хорошо совпадала с прогнозируемой распространенностью в каждой группе (Рис. 5c), что демонстрирует релевантность диаграммы риска цирроза для клинической практики. Наша таблица прогнозирования риска улучшила прогнозирование цирроза по сравнению с Agile4 или CMV3G, причем высокие результаты этих тестов были связаны с переоценкой вероятности развития цирроза на 25%.
Рисунок 5: Калибровка прогнозируемого риска по диаграммам рисков исследования в валидационном набореа Калибровочный график прогнозируемого риска развития цирроза печени по диаграмме риска, представленной на Рис. 4а. Синяя пунктирная линия отражает идеальный прогноз (прогнозируемый риск развития цирроза = наблюдаемая распространенность цирроза). Черная сплошная линия отражает наблюдаемую распространенность цирроза как функцию прогнозируемого риска по диаграмме риска цирроза. b Калибровочный график прогнозируемого риска прогрессирующего фиброза по диаграмме риска, представленный на Рис. 4b. c Пациенты были распределены на 7 групп, очерченных диаграммой риска цирроза печени, и наблюдаемая распространенность цирроза представлена для каждой из этих 7 групп. d Пациенты были распределены на 10 групп, очерченных диаграммой риска прогрессирующего фиброза, и наблюдаемая распространенность прогрессирующего фиброза представлена для каждой из этих 10 групп. Исходные данные предоставляются в виде файла Source Data.
Такой же анализ был проведен для прогрессирующего фиброза в валидационном наборе. Калибровка между прогнозом графика риска прогрессирующего фиброза и наблюдаемой распространенностью прогрессирующего фиброза была отличной (Рис. 5b). Средняя разница между прогнозируемым риском и идеальным прогнозом составляла лишь -2,7% (крайние значения: -5% и +2%). Наблюдаемая распространенность прогрессирующего фиброза в 10 группах, выделенных с помощью диаграммы риска прогрессирующего фиброза, очень хорошо совпадала с прогнозируемой распространенностью (Рис. 5d).
Наконец, морфометрический анализ показал, что площадь фиброза прогрессивно увеличивалась с риском цирроза печени и риском прогрессирующего фиброза, как и предполагалось нашими диаграммами рисков.
Обсуждение
Предыдущие исследования неинвазивной диагностики цирроза печени при НАЖБП были сосредоточены на точности отдельных тестов, без изучения тестов в комбинации 13,14. Более того, недавнее исследование показало, что неинвазивные тесты являются точными в исключении цирроза, но они гораздо менее точны в подтверждении диагноза 15. Недавно были испытаны инновационные методы комбинации биомаркеров с помощью машинного обучения, но, по сравнению с имеющимися в клинической практике тестами на фиброз, они существенно не повысили AUROC для цирроза и не улучшили способность подтверждать цирроз с плохим положительным прогностическим значением между 40 и 60% 16. Мы предлагаем подход, который сочетает неинвазивные тесты на фиброз для точного определения наличия или отсутствия цирроза печени в клинической практике, а также инновационные схемы прогнозирования риска, позволяющие персонализировано оценить индивидуальную вероятность прогрессирующего фиброза печени и цирроза печени.
Наше исследование подчеркивает интерес к сочетанию одних и тех же наборов биомаркеров в различных уравнениях, разработанных для конкретных диагностических целей. В этом контексте тесты на основе эластографии Agile3+ и Agile4 включают результаты ВКТЭ с простыми маркерами крови и клиническими параметрами, причем первый тест предназначен для диагностики прогрессирующего фиброза печени, а второй – для цирроза печени. Мы обнаружили, что цирроз лучше исключать, используя порог исключения теста на прогрессирующий фиброз (Agile3+), и лучше подтверждать, используя порог включения теста на цирроз (Agile4). Такие же результаты были получены с помощью специализированных анализов крови FMV3G (предназначенный для выявления прогрессирующего фиброза) и CMV3G (предназначенный для выявления цирроза печени). Эти результаты побудили нас предложить классификацию фиброза Agile3+/4 и FM/CM. По сравнению с отдельными тестами, эти две классификации позволили стратифицировать пациентов на четыре группы с низкой частотой необходимой биопсии печени, в то время как синергетическое преимущество комбинированных тестов с очень низкой частотой цирроза в первой группе исключения и последней группой, обогащенной на цирроз печени, было обеспечено.
Накопленные доказательства в области диагностики фиброза печени показывают, что последовательное сочетание неинвазивных тестов, особенно из разных модальностей (биопсия и эластография), повышает точность диагностики. Согласно этим данным, мы обнаружили, что сочетание Agile3+/4 на основе эластографии и классификации FM/CM на основе крови улучшило способность подтверждать диагноз цирроза печени с 71% распространенностью в последней группе (Рис. 3c). Алгоритм нашего исследования (Рис. 3а) не требует дополнительных измерений к тем, что используются в последних рекомендациях EASL 6. Ведь, кроме ВКТЭ, Agile3+ и Agile4 включают только общие маркеры крови (сывороточные трансаминазы, тромбоциты). Во-вторых, специализированный анализ крови не нужен, если диагноз Agile3+/4 по классификации F0-2. В-третьих, специализированные анализы крови, необходимые после классификации Agile3 +/4, включают FibroMeter (рекомендованный ЕАИП после обследования ВКТЭ) и CirrhoMeter (рассчитывается на основе тех же переменных, что и FibroMeter). В конечном итоге, наш алгоритм исследования можно рассматривать как усовершенствование и расширение алгоритма ЕАИП, используя те же параметры и последовательность тестов на фиброз, но обеспечивая более точную и достоверную диагностику фиброза печени.
Несмотря на все эти значительные улучшения, 43% пациентов с F4 из валидационного набора были включены в группу F34 нашего алгоритма исследования, и поэтому не могли быть дифференцированы от пациентов с F3. Такая подгруппа пациентов с циррозом, который трудно диагностировать, была ожидаемой, поскольку ни один тест на фиброз не мог четко разграничить пациентов с циррозом и без цирроза печени. Поскольку вероятность цирроза печени прогрессивно возрастала с получением результатов каждого теста на фиброз, мы перешли от классического подхода, заключающегося в последовательном использовании тестов на фиброз, интерпретированных с диагностическими порогами, и предоставлении окончательной полуколичественной классификации (Рис. 3а), к более количественному подходу, заключающемуся в персонализированной оценке индивидуальной вероятности цирроза печени на основе результатов тестов на фиброз (Рис. 4а). Разработанные нами таблицы прогнозирования риска имеют то преимущество, что позволяют врачу выбрать свой уровень требований, который может меняться в зависимости от клинической ситуации. Например, для исключения цирроза печени у пациента врач должен иметь очень низкий риск. С другой стороны, чтобы включить пациента в клиническое исследование, врач должен иметь приемлемый уровень неудач скрининга, например, 30% (то есть вероятность цирроза печени 70%). Такая вариативность выбора невозможна в последовательном алгоритме с фиксированными пороговыми значениями тестов, что подчеркивает высокий интерес наших графиков прогнозирования риска для клинической практики. Наконец, этот подход, основанный на оценке риска, соответствует персонализированной медицине, развивающейся в других медицинских специальностях, например, прогнозированию сердечно-сосудистого риска 17.
Стадирование, которое проводит патологоанатом, является широко используемым методом гистологической оценки фиброза печени, но морфометрия обеспечивает более количественную, чувствительную и воспроизводимую оценку 18. Морфометрия имеет преимущество в том, что она позволяет выделить значительные эффекты, которые не были обнаружены при стадировании фиброза в клинических исследованиях 19. Более того, лонгитюдные исследования продемонстрировали, что площадь фиброза, измеренная с помощью морфометрии, является лучшим прогностическим маркером, чем стадия фиброза при хронических заболеваниях печени 20,21. Используя этот точный метод, мы обнаружили, что наш алгоритм исследования дискриминирует четыре группы со значительной разницей в объеме фиброза печени. Более того, площадь фиброза прогрессивно возрастала с повышением риска, оцененного с помощью наших карт прогнозирования, что подтверждает актуальность такого вероятностного подхода для клинической практики. Два преимущества количественной шкалы, предоставленной нашими картами прогнозирования риска, заключаются в том, что они позволят четко очертить популяцию с риском осложнений, связанных с печенью, а также точно оценить порог рентабельности специализированного менеджмента. Сейчас необходимы дальнейшие лонгитюдные исследования, чтобы оценить прогностическую значимость стратификации тяжести заболевания и экономическую эффективность лечения с использованием наших новых инструментов.
Сильными сторонами нашей работы являются очень большое количество включенных пациентов (n = 1568); наличие нескольких тестов на фиброз (простых и специализированных), использующих различные методы (биологические, эластография) и направленные на различные диагностические цели (прогрессирующий фиброз печени, цирроз); многоцентровый дизайн фазы 3 с независимыми наборами для вывода и валидации, что обеспечивает наивысший уровень доказательности в соответствии с рекомендациями TRIPOD 22; надежность разработанных инструментов, точность которых, наблюдавшаяся в деривационном наборе, была подтверждена в валидационном наборе на каждом этапе их разработки; и, наконец, возможность подтвердить наши результаты с помощью морфометрии печени, количественного метода измерения фиброза печени, который является более чувствительным, чем классическое полуколичественное определение стадии на биопсии печени. Некоторые характеристики пациентов отличались между деривационной и валидационной наборами, что отражает разницу в практике набора пациентов в разных центрах. Тем не менее, полученные нами результаты существенно не отличались между двумя наборами, что свидетельствует о надежности результатов нашего исследования.
Мы признаем, что наше исследование имеет определенные ограничения. ОФП является точным неинвазивным тестом, который также предлагается в рекомендуемых алгоритмах неинвазивной диагностики фиброза печени при НАЖБП 6,23. К сожалению, ОФП не был доступен и не мог быть протестирован в нашем исследовании. Необходима дальнейшая работа, чтобы оценить интерес ОФП в комбинациях тестов для диагностики цирроза печени. Кроме анализов крови и эластографии, в клинической практике доступны другие приборы для неинвазивной оценки цирроза, такие как допплерография, но эти данные не были доступны в нашем исследовании. Необходимо оценить, помогает ли допплерография уточнить диагноз цирроза печени у пациентов, классифицированных по алгоритму нашего исследования как F34. В британской когорте проводилось консенсусное чтение биоптатов печени (PB, VP), но гистологическое чтение во французских центрах выполнялось местным патологоанатомом (SM, BL, NS). Тем не менее, все эти патологоанатомы были экспертами, специализирующимися на гепатологии, с опытом работы не менее 20 лет. Предыдущие исследования показали, что воспроизводимость между наблюдателями для определения стадии фиброза намного лучше, даже отлично, когда она выполняется экспертами 24,25,26. Алгоритм нашего исследования и графики прогнозирования риска были разработаны на основе наборов данных, поступающих из центров третичной медицинской помощи, и поэтому хорошо подходят для использования в контексте клиник, специализирующихся на лечении печени. С ростом осведомленности о заболевании и дальнейшим широким применением неинвазивных тестов можно ожидать, что наши инструменты будут распространяться в условиях, где распространенность цирроза печени ниже, например, в диабетологических клиниках. Необходима дальнейшая работа, чтобы оценить их в таком контексте использования, а также определить, нужно ли их перекалибровать для этих условий.
Следовательно, неинвазивная диагностика цирроза печени остается неудовлетворенной потребностью при НАЖБП. Разработанный и валидированный нами последовательный алгоритм и таблицы прогнозирования риска являются значительным прогрессом для ведения пациентов в клинической практике. Поскольку в них используются те же самые тесты на фиброз и последовательность их проведения, эти инструменты являются расширением и усовершенствованием действующих рекомендаций.
Методы
Пациенты
В этом исследовании были использованы четыре когорты взрослых пациентов с неалкогольной жировой болезнью печени (НАЖБП), биопсию печени и вибрационно контролируемую транзиторную эластографию (ВКТЭ). Три из них были локальными и независимыми когортами из трех французских университетских больниц (Анже, n = 579; Бордо, n = 525; и Гренобль, n = 117), которые ранее были опубликованы в ссыл. 27 и обновлены для этой работы. Четвертая когорта (n = 347) была получена из многоцентрового исследования, проведенного в 7 центрах печени в Великобритании 28. Все четыре когорты получили одобрение от этических комитетов: CPP Ouest II Angers (CB2010-01) для когорты Анже; CPP Sud-Ouest et Outre Mer III для когорты Бордо; ARS Rhone Alpes (AC-2014-2094) для когорты Гренобля; и Комитет по этике исследований Северного Уэльса (13/WA/0385) для когорты Великобритании. Одобрение IRB для когорт охватывало работу, выполненную здесь. Все пациенты дали письменное информированное согласие перед включением.
Пациентам, включенным в исследование, была проведена биопсия печени в рамках исследования НАЖБП после исключения сопутствующих препаратов, вызывающих стеатоз (таких как кортикостероиды, тамоксифен, амиодарон или метотрексат), чрезмерного употребления алкоголя (> 30 г/сут у мужчин или > 20 г/сут у женщин), хронической инфекции гепатита В или С, или признаков других сопутствующих хронических заболеваний печени. Пациентов не включали, если они имели в наличии или в анамнезе осложнения, связанные с печенью (асцит, варикозное кровотечение, желтуха, энцефалопатия, гепатоцеллюлярная карцинома). Критериями исключения из исследования были длина биоптата печени < 10 мм, неудача ВКТЭ и отсутствие маркеров крови для расчета тестов на фиброз. Все пациенты были госпитализированы из гепатологических клиник, и ни одна из биопсий не была выполнена во время бариатрической операции.
Данные из четырех когорт были объединены в файле Excel (Excel v2303, Microsoft, Редмонд, штат Вашингтон, США). Три французские когорты не участвовали в разработке тестов на фиброз, которые оценивались в этом исследовании, тогда как британская когорта была частью многоцентрового набора, в котором были разработаны тесты на фиброз Agile3+ и Agile4. Кроме того, данные морфометрии (площадь фиброза) были доступны только для пациентов, включенных в исследование из центра Анже. Поэтому мы решили объединить когорты Великобритании и Бордо в качестве деривационного набора для нашего исследования, а когорты Анже и Гренобля – в качестве валидационного набора. Такой дизайн позволил получить (i) валидационный набор, который не включал ни одного пациента, использованного для получения различных оцениваемых тестов на фиброз; (ii) дизайн фазы 3 в соответствии с рекомендациями TRIPOD 22; (iii) хорошо сбалансированные деривационные (n = 872) и валидационные (n = 696) наборы; и (iv) использование морфометрии как дополнительного метода оценки в валидационном наборе.
Гистологическое исследование печени
Патологоанатомические исследования проводились в каждом из трех французских центров одним и тем же старшим экспертом, который специализировался на гепатологии (SM, BLB, NS) и был слепым к данным пациента. Мы и другие исследователи продемонстрировали отличную воспроизводимость результатов оценки фиброза печени между наблюдателями, когда их выполняли эксперты-патологоанатомы 24,25,26. В британской когорте гистологические препараты анализировали независимо два эксперта-патологоанатома (PB, VP), которые были слепыми к чтению друг друга и к данным пациента. В случае разногласий они просматривали слайды вместе для достижения консенсуса. Все эксперты, привлеченные к исследованию, имели по меньшей мере 20-летний опыт работы в области гистопатологии печени. Фиброз печени оценивали в соответствии с балльной системой NASH CRN 24, то есть F0: отсутствие фиброза; F1: перисинусоидальный или портальный/перипортальный фиброз, F2: перисинусоидальный и портальный/перипортальный фиброз, F3: промежуточный фиброз и F4: цирроз. Запущенный фиброз печени определялся как стадии фиброза F3 + F4 (F34).
Для всех пациентов, включенных в когорту Анже, окрашенный пикрофуксином красным срез биоптата всей печени оцифровывали в виде высококачественных изображений (30 000 × 30 000 пикселей, разрешение 0,5 мкм/пиксель). Площадь всего фиброза, площадь портального фиброза и площадь перисинусоидального фиброза были автоматически измерены на оцифрованном биоптате с помощью программного обеспечения для морфометрии 29.
Измерение жесткости печени
Измерение жесткости печени проводили с помощью технологии ВКТЭ (аппарат FibroScan; Echosens, Париж, Франция), опытными операторами и в соответствии с рекомендациями производителя. Измерения проводили натощак, в течение трех месяцев после биопсии печени (в течение недели для 89% пациентов). Операторы были слепы к гистологическим и биологическим результатам. Оценки Agile3+ и Agile4 рассчитывали в соответствии с опубликованными формулами 11.
Тесты на фиброз крови
Образцы крови натощак брали в течение недели после биопсии печени. Следующие тесты на фиброз крови были рассчитаны в соответствии с опубликованными или запатентованными формулами: FIB4, оценка фиброза НАЖБП, FibroMeterV3G (FMV3G) и CirrhoMeterV3G (CMV3G)12,30,31. CMV3G – это анализ крови, который сочетает в себе те же переменные, что и FMV3G, но объединенные в формуле с коэффициентами, рассчитанными специально для диагностики цирроза печени. Все анализы крови были выполнены в лабораториях исследовательских центров. Ранее мы уже демонстрировали отличную межлабораторную воспроизводимость тестов на фиброз крови 32. Когда диагностические пороги были недоступны в литературе, мы рассчитывали их в деривационном наборе исследования с последующей валидацией в валидационном наборе.
Статистика
Непрерывные переменные выражались как медианы с первым и третьим квартилями и сравнивались с помощью тестов Манна-Уитни или Краскела-Уоллиса. Категориальные переменные выражались в процентах и сравнивались с помощью критерия Хи-квадрат или Фишера. Корреляции между количественными переменными определялись с помощью коэффициента корреляции Спирмена. Следующие анализы были выполнены в деривационном наборе и дополнительно подтверждены в валидационном наборе.
Точность неинвазивных тестов для диагностики цирроза печени
Диагностическая точность 7 доступных неинвазивных тестов (оценка фиброза НАЖБП, FIB4, FMV3G, CMV3G, VCTE, Agile3+ и Agile4) оценивалась с помощью площади под рабочей характеристикой приемника (AUROC) и сравнивалась с тестом Делонга. Также оценивалась точность порогов исключения (чувствительность, отрицательная прогностическая ценность) и включения (специфичность, положительная прогностическая ценность).
Дополнение между неинвазивными тестами
Затем мы оценили взаимодополняемость между тестами, разработанными для прогрессирующего фиброза и цирроза печени. Целью было оценить, как взаимодействуют тесты, включающие одинаковые биомаркеры, но предназначенные для различных диагностических целей (в нашем исследовании: Agile3+ и Agile4, FibroMeter и CirrhoMeter), и позволяет ли их комбинация лучше стратифицировать пациентов. Если это подтвердится, такой подход поможет улучшить неинвазивную диагностику на различных этапах рекомендованных алгоритмов (эластография, специализированный анализ крови).
Согласование между неинвазивными тестами
Лучшая комбинация тестов для диагностики цирроза печени была определена с помощью многомерной бинарной логистической регрессии, которая включала лучших кандидатов, определенных на основе предыдущих результатов. Затем была оценена согласованность между выбранными тестами для постановки окончательного диагноза, в результате чего был разработан диагностический алгоритм, включающий категорию цирроза печени. Наконец, наш алгоритм исследования был сравнен с алгоритмом, предложенным Европейской ассоциацией по изучению печени, чтобы продемонстрировать улучшения, сделанные нашим методом.
Диаграммы прогнозирования рисков
Наконец мы разработали диаграмму прогнозирования риска, которая показывает вероятность развития цирроза печени (выраженную в процентах) на основе результатов тестов на фиброз. Эта диаграмма была представлена с помощью контурных графиков, показывающих совместное влияние тестов на фиброз, предварительно отобранных с помощью многомерного анализа. Также была разработана диаграмма прогнозирования риска, которая указывает на вероятность развития прогрессирующего фиброза.
Статистический анализ проводился с помощью программного обеспечения SPSS версии 25.0 (IBM, Армонк, Нью-Йорк, США) и R версии 3.6.2.
Ссылки на источники
- Sanyal, A. J. et al. Prospective Study of Outcomes in Adults with Nonalcoholic Fatty Liver Disease. N. Engl. J. Med. 385, 1559–1569 (2021).
- Taylor, R. S. et al. Association Between Fibrosis Stage and Outcomes of Patients With Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. Gastroenterology 158, 1611–1625 e1612 (2020).
- Boursier, J. & Tsochatzis, E. A. Case-finding strategies in non-alcoholic fatty liver disease. JHEP Rep. 3, 100219 (2021).
- Boursier, J. et al. New sequential combinations of non-invasive fibrosis tests provide an accurate diagnosis of advanced fibrosis in NAFLD. J. Hepatol. 71, 389–396 (2019).
- Srivastava, A. et al. Prospective evaluation of a primary care referral pathway for patients with non-alcoholic fatty liver disease. J. Hepatol. 71, 371–378 (2019).
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis − 2021 update. J. Hepatol. 75, 659–689 (2021).
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J. Hepatol. 69, 182–236 (2018).
- Heimbach, J. K. et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology 67, 358–380 (2018).
- Omata, M. et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update. Hepatol. Int. 11, 317–370 (2017).
- Anania, F. A., Dimick-Santos, L., Mehta, R., Toerner, J. & Beitz, J. Nonalcoholic Steatohepatitis: Current Thinking From the Division of Hepatology and Nutrition at the Food and Drug Administration. Hepatology 73, 2023–2027 (2021).
- Sanyal, A. J. et al. Enhanced diagnosis of advanced fibrosis and cirrhosis in individuals with NAFLD using FibroScan-based Agile scores. J. Hepatol. 78, 247–259 (2023).
- Cales, P. et al. Optimization and robustness of blood tests for liver fibrosis and cirrhosis. Clin. Biochem. 43, 1315–1322 (2010).
- Mozes, F. E. et al. Diagnostic accuracy of non-invasive tests for advanced fibrosis in patients with NAFLD: an individual patient data meta-analysis. Gut 71, 1006–1019 (2021).
- Xiao, G. et al. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fibrosis in patients with nonalcoholic fatty liver disease: A meta-analysis. Hepatology 66, 1486–1501 (2017).
- Brandman, D. et al. Comparison of clinical prediction rules for ruling out cirrhosis in nonalcoholic fatty liver disease (NAFLD). Aliment Pharm. Ther. 55, 1441–1451 (2022).
- Chang, D. et al. Machine learning models are superior to noninvasive tests in identifying clinically significant stages of NAFLD and NAFLD-related cirrhosis. Hepatology 77, 546–557 (2022).
- SCORE2 working group and ESC Cardiovascular risk collaboration. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur. Heart J. 42, 2439–2454 (2021).
- Nam, D., Chapiro, J., Paradis, V., Seraphin, T. P. & Kather, J. N. Artificial intelligence in liver diseases: Improving diagnostics, prognostics and response prediction. JHEP Rep. 4, 100443 (2022).
- Taylor-Weiner, A. et al. A Machine Learning Approach Enables Quantitative Measurement of Liver Histology and Disease Monitoring in NASH. Hepatology 74, 133–147 (2021).
- Huang, Y. et al. Image analysis of liver biopsy samples measures fibrosis and predicts clinical outcome. J. Hepatol. 61, 22–27 (2014).
- Buzzetti, E. et al. Collagen proportionate area is an independent predictor of long-term outcome in patients with non-alcoholic fatty liver disease. Aliment Pharm. Ther. 49, 1214–1222 (2019).
- Collins, G. S., Reitsma, J. B., Altman, D. G. & Moons, K. G. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): the TRIPOD statement. BMJ 350, g7594 (2015).
- Vali, Y. et al. Enhanced liver fibrosis test for the non-invasive diagnosis of fibrosis in patients with NAFLD: A systematic review and meta-analysis. J. Hepatol. 73, 252–262 (2020).
- Kleiner, D. E. et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 41, 1313–1321 (2005).
- Bedossa, P., Consortium, F.P. Utility and appropriateness of the fatty liver inhibition of progression (FLIP) algorithm and steatosis, activity, and fibrosis (SAF) score in the evaluation of biopsies of nonalcoholic fatty liver disease. Hepatology 60, 565–575 (2014).
- Boursier, J. et al. Screening for therapeutic trials and treatment indication in clinical practice: MACK-3, a new blood test for the diagnosis of fibrotic NASH. Aliment Pharm. Ther. 47, 1387–1396 (2018).
- Canivet, C. M. et al. Validation of the new 2021 EASL algorithm for the noninvasive diagnosis of advanced fibrosis in NAFLD. Hepatology 77, 920–930 (2022).
- Eddowes, P. J. et al. Accuracy of FibroScan Controlled Attenuation Parameter and Liver Stiffness Measurement in Assessing Steatosis and Fibrosis in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 156, 1717–1730 (2019).
- Sandrini, J. et al. Quantification of portal-bridging fibrosis area more accurately reflects fibrosis stage and liver stiffness than whole fibrosis or perisinusoidal fibrosis areas in chronic hepatitis C. Mod. Pathol. 27, 1035–1045 (2014).
- Shah, A. G. et al. Comparison of noninvasive markers of fibrosis in patients with nonalcoholic fatty liver disease. Clin. Gastroenterol. Hepatol. 7, 1104–1112 (2009).
- Angulo, P. et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 45, 846–854 (2007).
- Cales, P. et al. Reproducibility of blood tests of liver fibrosis in clinical practice. Clin. Biochem. 41, 10–18 (2008).