Заболевания в брюшной полости, к которым относят синдром компрессии чревного ствола, перекрут ножки кисты яичника, расслоение аорты, коарктацию аорты и другие, относительно трудно диагностировать из-за нехватки явных симптомов. В таком случае эффективным методом является использование допплерографии.
СЛУЧАЙ 1. СИНДРОМ КОМПРЕССИИ БРЮШНОГО СТВОЛА
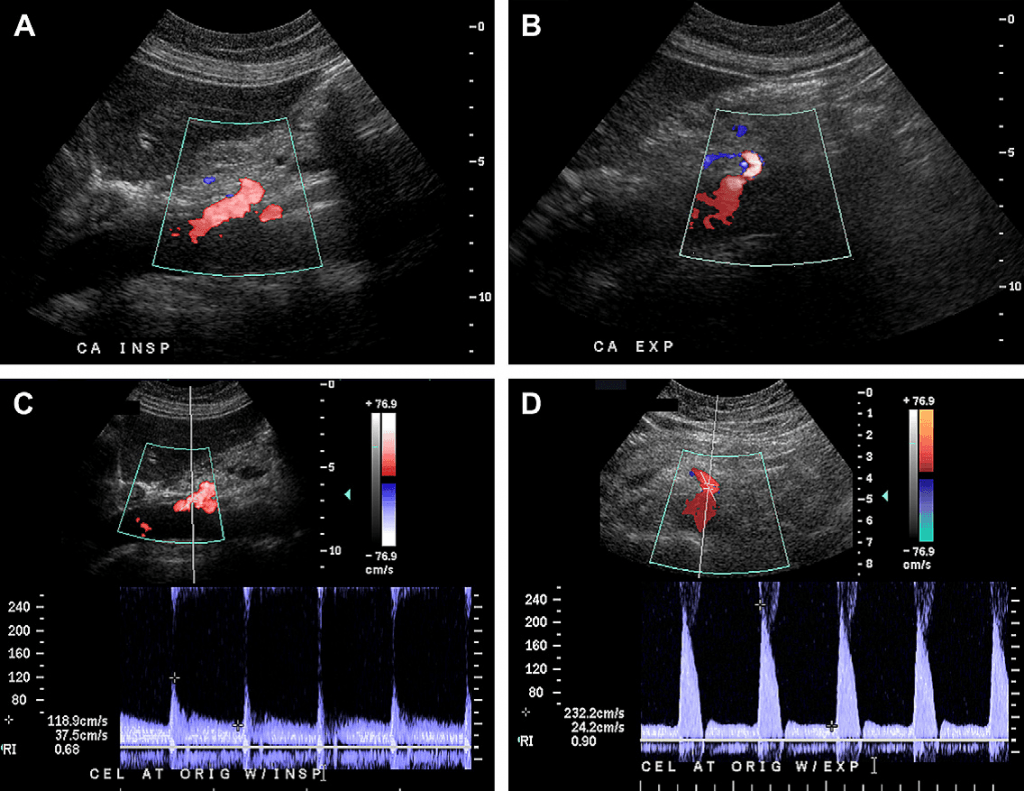
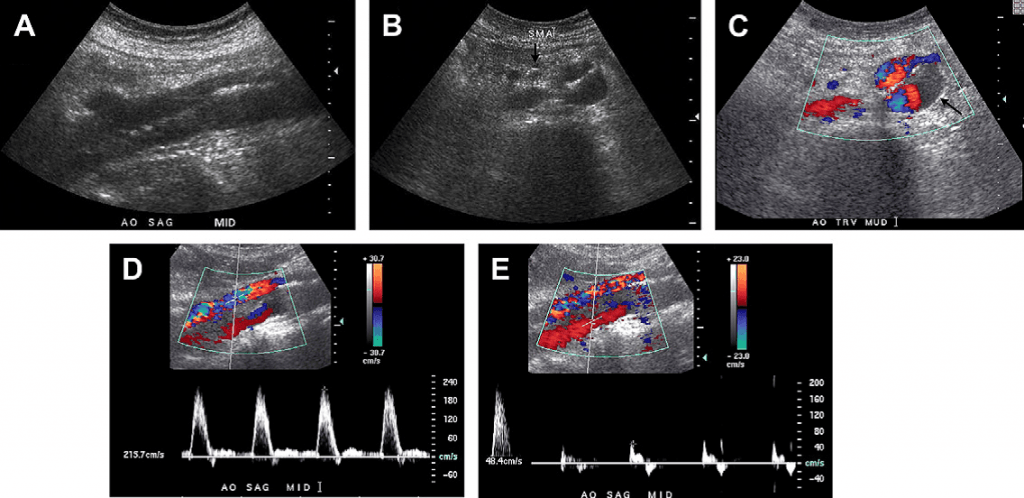
Случай 1. 34-летняя женщина с жалобами на боль в животе и потерю веса. Цветные допплеровские изображения брюшной артерии на вдохе (А) и выдохе (В) показывают изменение внешнего вида брюшной артерии. Во время выдоха брюшная артерия становится более остро изогнутой в краниальном направлении, обретая крючкообразную форму. Обратите внимание на то, что пиковая систолическая скорость (ПСС) также увеличилась от 118 см/с на выдохе (С) до 232 см/с на вдохе (D). У этой пациентки диагностирован синдром срединной дугообразной связки (ССДС), который лечили с помощью хирургического вмешательства с последующим уменьшением симптомов.
Срединная дугообразная связка диафрагмы – это фиброзная связка, которая у большинства людей проходит над брюшной аортой и над уровнем брюшного ствола, соединяя правую и левую ножки диафрагмы, расположенные с обеих сторон аортального отверстия.
Однако, примерно у 10-24 % людей эта связка проходит ниже, пересекая проксимальную часть брюшного ствола и вызывая его компрессию, что более четко выражено на выдохе. Несмотря на то, что такой врожденный вариант у многих пациентов обнаруживается случайно, от 87 % до 50 % из них имеют явные симптомы компрессии проксимального брюшного ствола, такие как боль, тошнота, рвота и/или потеря веса: совокупность симптомов, впервые упомянутая в 1963 году Harjola. Клинически значимую компрессию брюшного ствола называют компрессионным стенозом брюшного ствола (КСБС), хотя это достаточно противоречивое клиническое состояние. Он чаще всего проявляется у худых женщин в возрасте от 20 до 40 лет. Болевые ощущения могут быть, либо не быть связаны с приемом пищи. При физикальном обследовании в подложечной зоне можно услышать характерный шум, который изменяется во время дыхания.
Патологическая физиология КСБС пока еще точно не определена. Некоторые исследователи считают, что вследствие сжатия брюшного ствола возникает дистальная ишемия, которая вызывает боль в брюшной полости, несмотря на хорошо известный факт, что для появления брыжеечной ишемии необходимо сужение двух из трех брыжеечных сосудов. Другие поддерживают гипотезу о том, что боль в животе вызвана обворовыванием коллатералей с верхней брыжеечной артерией. Компрессию или ишемию брюшного сплетения также включили к возможным причинам возникновения боли в брюшной полости у пациентов с диагнозом КСБС.
КСБС чаще диагностируют с помощью традиционной ангиографии или З-D компьютерной томографической ангиографии (КТА), отражая фокальное сужение проксимальной части брюшного ствола, обычно на пятисантиметровом расстоянии от места его выхода, которое становится более выразительным на выдохе. Кроме того, во время выдоха можно увидеть характерный крючкообразный вид проксимальной части брюшного ствола. Наличие постстенотического расширения и/или наличие коллатерального кровотока от ветвей верхней брыжеечной артерии к бассейну брюшного ствола, что приводит к появлению специфических агиографических и КТА симптомов, которые помогают дифференцировать другие причины, приводящие к сужению брюшного ствола, такие как атеросклероз. Ультразвуковая дуплексная ангиография может использоваться как более дешевая альтернатива для скрининга. Для ультразвукового диагностирования КСЧС используются следующие критерии: (1) изменение пиковой систолической скорости (ПСС) в брюшном стволе во время дыхания и ее повышение до 200 см/с и более на выдохе, (2) соотношение ПСС в брюшной артерии на выдохе к ПСС в брюшной аорте, расположенной сразу под диафрагмой, больше, чем 3:1, и (3) крючкообразный вид брюшного ствола на цветном допплеровском или серошкальном изображении на выдохе. Некоторые исследователи высказали мнение о том, что специфичность этих симптомов увеличивается, когда ультразвуковой осмотр проводят в вертикальном положении. Однако специфичность данных проявлений является противоречивой, ведь они могут встречаться как у бессимптомных пациентов, так и у тех, чей стеноз брюшного ствола был вызван атеросклерозом.
Большинство считают лапароскопическую хирургию с разделением или резекцией срединной дугообразной связи для ослабления компрессии проксимальной двенадцатиперстной кишки оптимальным методом лечения пациентов с диагнозом ПСС. Сужение связки над брюшным стволом некоторых пациентов приводит к повреждению сосудов, которые могут нуждаться в реконструкции. В случае других доказано, что декомпрессия, разделение, резекция или невролиз фиброзного брюшного сплетения приносят положительный результат. Однако, в связи с тем, что симптомы, обнаруженные при КТА и ультразвуковой диагностике, не являются специфичными, хирургическая декомпрессия не всегда может гарантировать значительное облегчение. Reilly вместе с коллегами сообщил, что пациентов в возрасте от 40 до 60 лет, которые жалуются на болевые ощущения после приема пищи и потерю более 9 кг веса, а при ангиографии и КТА у которых обнаружено постстенотическое расширение коллатеральных сосудов, наиболее эффективно оперировать.
СЛУЧАЙ 2: ПЕРЕКРУТ НОЖКИ КИСТЫ ЯИЧНИКА
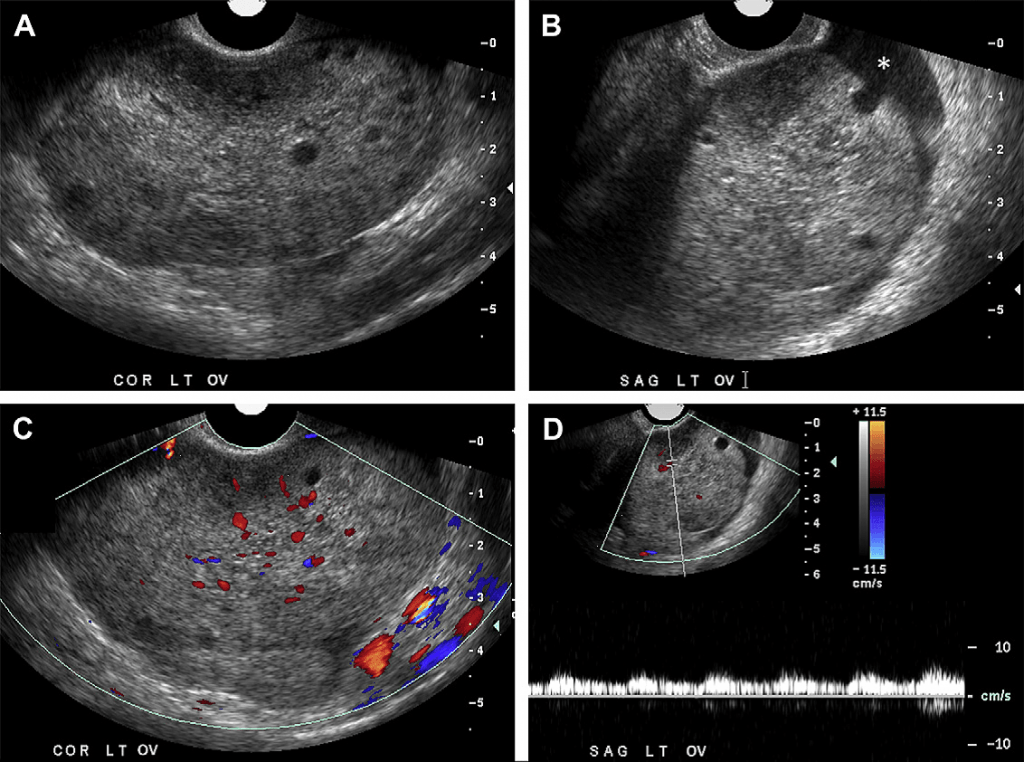
Случай 2. 24-летняя женщина попала в отделение неотложной помощи с жалобами на периодические боли в области малого таза. На серошкальном изображении (A, B) видно, что левый яичник увеличен в размерах с гетерогенной стромой в центре и периферийным смещением маленьких фолликулов. Обратите внимание на незначительное количество свободной жидкости вокруг яичника (звездочка на Рис. В). На изображении цветного доплера (С) наблюдается кровоток в паренхиме яичников с артериальным потоком, что подтверждается на изображении спектрального Доплера (D). Перекрут левого яичника обнаружили во время лапароскопии.
Диагноз перекрута ножки кисты яичника составляет примерно 2,7 % от всех неотложных случаев, которые подлежат оперативному лечению в гинекологии. Перекрут ножки кисты яичника чаще всего возникает в правых приложениях, что, скорее всего, связано с недостатком места в области левых приложений, через проекцию сигмовидной кишки. Обычно у пациентов с перекрутом кисты яичника возникает внезапная сильная боль в области малого таза, после которой часто наступает полное облегчение. Однако почти в 50 % случаев искажение придатков может быть частичным или интермиттирующим, сопровождаясь незначительными или периодическими симптомами, присущими также и для других заболеваний женских половых органов.
Перекрут ножки кисты яичника наиболее характерный для женщин репродуктивного возраста, однако встречается во всех возрастных группах. В 50-80 % случаев в яичниках обнаруживают новообразования. Чаще всего они являются доброкачественными и считается, что воспаление, спаечный процесс или местная инвазия злокачественного новообразования предотвращает перекручивание ножки яичника. Почти в 20 % случаев перекруты кисты связанны с беременностью, чаще происходя в первом триместре или после родов. Пациентки, которые проходят процедуру симуляции овуляции, также имеют повышенный риск перекрута ножки яичника. Предыдущее хирургическое вмешательство, особенно трубная стерилизация, также относится к факторам риска перекрута ножки кисты яичника. У детей с диагнозом перекрута ножки кисты яичника, яичник в большинстве случаев является нормальным, а факторами, которые вызывают перекрут, считается слабость собственных связок яичника и внезапное изменение внутрибрюшного давления.
Перекрут ножки кисты яичника может охватывать яичник, маточную трубу или обоих. При перекруте ножки кисты происходит лимфатический застой, вызывая отек яичника и его увеличение. Дальнейший перекрут ножки кисты ячника приводит к венозной и артериальной обструкции. Если не провести хирургическую декомпрессию, то сразу после артериальной обструкции развивается некроз яичника. Обнаружено, что лечение на ранней стадии снижает степень риска развития осложнений, среди которых перитонит и тромбоэмболия легочной артерии, и повышает шансы сохранения яичника. Однако не стоит забывать о том, что в связи с наличием двойного притока крови к яичнику, перекрут одной артериальной системы может скрываться или компенсироваться усилением кровотока в другой артерии. Перекрут ножки кисты яичника во многих случаях может также быть периодическим или частичным, не смотря на циклическое сохранение кровотока. Кроме того, в случае хронического перекрута ножки кисты яичника может появиться как венозный, так и артериальный коллатеральный кровоток.
Для осмотра пациента с подозрениями на диагноз перекрута ножки кисты яичника можно воспользоваться ультразвуковой диагностикой, которая считается оптимальным методом визуализации. Увеличенные в размере яичники с нечеткой и гетерогенной в центре стромой и периферийным размещением в яичнике малых фолликулов (см. Рис. 2) являются наиболее характерным изображением в В-режиме УЗИ, которое, однако, не всегда наблюдается. После некроза ультразвуковое изображение сильно меняется, иногда напоминая геморрагическую кисту или гематому, если паренхима полностью находится в разреженном состоянии. Обычно при обследовании визуализируется опухолевидное отверстие и в меньшей степени паренхима яичника. Часто в малом тазу имеется незначительное количество свободной жидкости. Увеличенный в размере яичник при обследовании является чувствительным и расположен атипично, в срединной позиции. При внимательном осмотре зоны между яичником и маткой можно обнаружить увеличенную, набухшую фаллопиеву трубу, которая при перекрестном сканировании может напоминать мишень с поочередно расположенных гипоэхогенных и эхогенных кругов, первые из которых выглядят искаженными или обмотанными сосудами в отечной ножке кисты яичника. Кроме того, ультразвуковое обследование играет важную роль в исключении других причин появления боли в области живота и малого таза, к которым относится разорванная или геморрагическая киста, тубоовариальный абсцесс, аппендицит и камни в мочеточнике.
Хотя считалось, что отсутствие кровотока при допплерографическом осмотре будет важным специфическим симптомом перекрута ножки кисты яичника, однако симптомы у пациентов с перекрутом ножки кисты яичника, выявленные при цветной и спектральной допплерографии, варьируются, отражая как степень перекрута и давления в извращенной ножке кисты яичника, и ее хронический или периодический характер, так и наличие двойного кровоснабжения яичника. Отсутствие венозного или артериального кровотока в новообразовании придатков связано с диагнозом перекрута ножки кисты яичника. Однако если яичник находится глубоко по отношению к ультразвуковому лучу, Доплер может не отражать кровоток в нормальном яичнике, с чем будет связан ошибочный диагноз, основанный на выводах допплерографического осмотра. На изображении цветного Доплера, сосуды в перекрученой ножке кисты яичника отмечаются цветом (если не закупорены тромбом), создавая так называемый «симптом закрутки», т.е. допплеровское изображение, аналогичное симптому «мишени», описанному ранее. «Симптом закрутки» также определяют как специфический симптом перекрута ножки кисты яичника. Однако во многих случаях при доплеровском ультразвуковом обследовании был обнаружен артериальный и венозный кровоток в яичнике, но во время хирургического вмешательства обнаружен перекрут ножки кисты яичника (см. Рис. 2). В случае периодического искажение или скручивания/раскручивания скорость кровотока может временно увеличиваться. Именно поэтому кровоток в сосудах яичника, который наблюдается при допплеровском обследовании у пациента, симптомы на серошкальном изображении которого указывают на перекрут ножки кисты яичника или другие серьезные клинические проблемы, не должен препятствовать диагностике перекрута ножки кисты яичника. Спорным остается вопрос наличия артериального и венозного кровотока в яичнике, предполагающий жизнеспособность яичника во время хирургического вмешательства.
СЛУЧАЙ 3: АРТЕРИОВЕНОЗНАЯ ФИСТУЛА И ПСЕВДОАНЕВРИЗМЫ В ТРАНСПЛАНТИРОВАННОЙ ПОЧКЕ
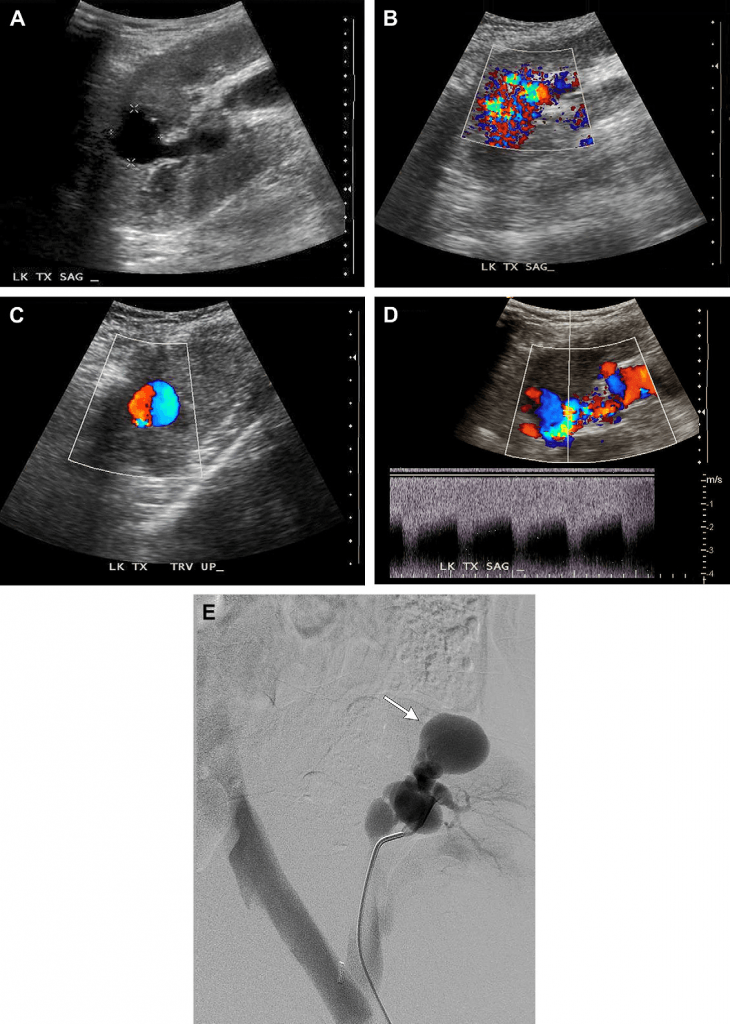
Случай 3. У этого 73-летнего мужчины после трансплантации почки имеются симптомы гематурии, которая проявилась после чрескожной биопсии почки, проведенной из-за повышения уровня креатинина. (А) На серошкальном изображении трансплантированной почки видно анэхогенное круглое образование (калиперы) в корковом веществе почки на уровне верхнего полюса. У пациента после почечной биопсии это скорее всего псевдоаневризмы (ПСА) или фокально расширенная дренирующая вена с артериовенозной фистулой (АВФ). Обратите внимание на трубчатое анэхогенное образование, попадающее в эту зону от эхогенного почечного синуса, являясь расширенной питательной артерией, или дренирующей веной. (В) На изображении цветного Доплера видно цветной aliasing-эффект в фокальной зоне, что указывает на высокоскоростной кровоток в данной точке, и красные и синие пятна вокруг, обозначающие «шумы в мягких тканях», вызванные вибрацией (турбулентностью). Красным и синим цветом обозначен кровоток с более низкой скоростью, что характерно для «шумов в мягких тканях». Такая совокупность симптомов присуща как для АВФ, так и ПСА. (С) Изображение цветного Доплера после увеличения колориметрической шкалы и фильтра движения стенок сосудов. «Шум в мягких тканях» больше не регистрируется, вместо него видно чередование кровотока, обозначенное красным и синим цветом – так называемый кровоток в виде «инь – янь», характерный для ПСА. (D) На спектральном допплеровском изображении не показано высокоскоростного движения крови «туда и обратно», что обычно характерно для шейки ПСА, а волну с усиленным систолическим и диастолическим кровотоком, характерную для АВФ. (Е) На ангиограмме видно как выпячивание ПСА (стрелка), так и расположен внизу клубок кровеносных сосудов с ранним венозным оттоком, что характерно для АВФ.
Артериовенозная фистула (АВФ) это аномальная прямая связь между артерией и веной. Псевдоаневризмы (ПСА) появляются когда кровь вытекает через разрыв в артериальной стенке и окружает псевдокапсулу с компресированных окружающих мягких тканей. Как АВФ, так и ПСА являются известными осложнениями биопсии почек. Несмотря на то, что АВФ и ПСА являются распространенными осложнениями после чрескожной биопсии, их обычно диагностируют отдельно, а случаи выявления смежных АВФ и ПСА как у этого пациента редкие.
Частота выявления АВФ после почечной биопсии составляет от 0,3 % до 19 % в собственной почке и от 6 % до 8 % в трансплантированной. Обнаружение клинически значимых АВФ после биопсии является значительно ниже, если ее проводят под прицельным контролем УЗИ. АВФ, которые появляются после биопсии, обычно протекают бессимптомно и обнаруживаются случайно. Однако большие по размеру АВФ иногда могут вызывать боль в боку, макрогематурию, гипертонию, хроническую сердечную недостаточность и, изредка, почечную недостаточность. Не смотря на то, что симптомы чаще проявляются сразу после проведения биопсии, известно также и о случаях поздних проявлений. Большинство клинически значимых АВФ можно диагностировать с помощью ультразвукового доплеровского обследования. Усиление кровотока из-за АВФ вызывает вибрацию окружающих мягких тканей, что на изображении цветного доплеровского картирования будет выглядеть как фокальная цветная мозаика над смежными мягкими тканями, которую называют «шумом мягких тканей» (см. Рис.3). Повышенные пиковая систолическая и конечная диастолическая скорости, так называемый низкорезистентный профиль кривой кровотока (см. Рис. 3), будут видны на спектральных доплеровских изображениях питательной артерии, а в дренирующей вене увеличится скорость кровотока с пульсирующим профилем кривой. Малые АВФ могут со временем рассасываться. Однако симптоматические, очень большие по размеру или внепочечные АВФ обычно лечат с помощью чрескожной эмболизации.
На УЗИ в В-режиме ПСА выглядит как анэхогенное круглое или мешковидное кистозное образование, присоединенное к артерии, которое при обследовании с помощью цветного допплеровского картирования заполняется цветом, напоминая «инь – янь» (см. Рис. 3). На серошкальном изображении тромб в ЮВА показан гиппоэхогенным, а при сканировании в цветном режиме – бесцветным. При осмотре шейки ПСА с помощью спектрального допплеровского обследования обычно виден профиль кривой кровотока «туда и обратно», с движением крови над изолинией в направлении ПСА во время систолы, и под изолинией в направлении от ПСА во время диастолы, если шейка узкая. Если же шейка широкая, то наблюдаем более нерегулярную, беспорядочную модель кровотока. Большинство ПСА являются бессимптомными. Можно наблюдать за малой ПСА, чтобы обнаружить происходит ли в ней спонтанный тромбоз. Однако из-за риска возможного разрыва ПСА с диаметром более 2 см, растущие или внепочечные ПСА обычно лечат с помощью чрескожной эмболизации. В лечении внепочечных ПСА преимущество может предоставляться стентированию.
СЛУЧАЙ 4: ВОЗДУХ В ВОРОТНОЙ ВЕНЕ
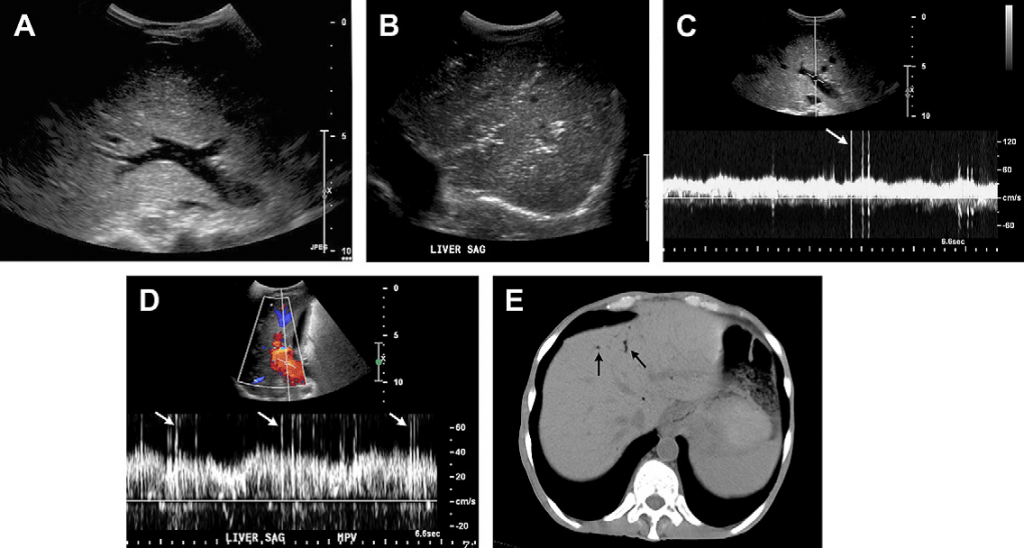
Случай 4. 54-летний пациент после трансплантации почек с жалобами на боль в животе. (А) На УЗИ-изображении в В-режиме в продольном срезе воротной вены видно точкообразные эхогенные фокусы в просвете сосуда. Не смотря на то, что они могут быть артефактами, при сканировании в режиме реального времени появляется возможность увидеть их движение периферийно. (В) Серошкальное изображение печени показывает гиперэхогенные очаги в паренхиме печени, которые в основном имеют линейную форму и распространяются в направлении капсулы печени. Не наблюдается дистального затенения или артефакта реверберации. Большая концентрация гиперэхогенных очагов в просвете меньших сосудов, ближе к разветвлению воротной вены (C, D). На изображениях спектрального Доплера, полученных при исследовании кровотока в воротной вене, видно пикообразные артефакты (стрелки) вызванные наличием пузырьков воздуха. Появление пикообразных артефактов связано с чрезвычайно высокой отражающей способностью воздуха. (Е) Обследование с помощью КТ подтверждает наличие воздуха в периферийных воротных венах печени (стрелки). Этот пациент принимал преднизолон и имел заметно растянутую толстую кишку, что связано с скопростазом, без видимых признаков ишемии кишечника на КТ. После очистки кишечника состояние пациента улучшилось.
Наличие газа в воротной вене является редким, однако клинически значимым симптомом, обнаруженным во время рентгеновского обследования, выступающим предвестником ишемической болезни кишечника, и требующим немедленного хирургического вмешательства. Впервые его описание на рентгеновских снимках живота 6 новорожденных, умерших из-за некроза кишечника, сделали в 1955 году Wolfe и Evans. Почти в 50 % случаев кроме газа в воротной вене у пациентов также диагностируют пневматоз кишечника или газ в его стенках [39,40]. Считается, что воздух из стенок кишки попадает в дренирующие вены в брыжейки кишечника и проходит в систему воротной вены, таким образом, пневматоз кишечника и воздух в воротной вене вместе демонстрируют прогрессирование в развитии одного и того же процесса [38]. Серьезные, опасные для жизни последствия могут вызвать бактериальный колит/некротический энтероколит, ишемию/инфаркт кишечника (особенно толстой кишки), забрюшинное или внутрибрюшинный абсцесс, инфицированный желчный пузырь, абсцесс печени, некротический панкреатит и злокачественные опухоли в кишечнике. Наличие воздуха в воротной вене характерно также и для более доброкачественных процессов, среди которых растяжение кишечника (особенно желудка и толстой кишки), воспалительное заболевание кишечника, язва желудка, недавние медицинские вмешательства/операции и эмфизема. В редких случаях наличие воздуха в портальной и печеночной венозной системе при ультразвуковой диагностике у абсолютно асимптомных пациентов без видимых заболеваний кишечника, возможно вследствие турбулентности или повышенной скорости кровотока в сосудах.
На серошкальном ультразвуковом изображении в режиме реального времени видно, как крошечные фокусы с высокой отражающей способностью, которые представляют пузырьки воздуха в воротной вене, движутся периферийно. Гиперэхогенные очаги линейной формы без дорзального затмения на периферии паренхимы печени также можно увидеть при распространении воздуха в портальной венозной системе к капсуле печени. Фокусы с высокой отражающей способностью встречаются в менее четко обособленных зонах, когда воздух распространяется в паренхиму печени сквозь небольшие разветвленные каналы воротной вены. На изображении спектрального импульсного Доплера видно пикообразные сигналы, наложенные на спектр кровотока воротной вены, что связано с очень высокой отражающей способностью воздушных пузырьков в воротной вене. Когда при ультразвуковом обследовании диагностируют или подозревают наличие воздуха в воротной вене, для верификации диагноза рекомендуется провести КТ, ведь это состояние может быть опасным для жизни. Однако выводы нескольких исследований показывают, что УЗИ является более чувствительным методом в диагностике наличия газа в воротной вене, чем КТ. Если наличие газа в воротной вене не подтверждается при дальнейшем КТ-сканировании, обнаруженный симптом скорее всего является доброкачественным или случайным.
Нужно дифференцировать наличие воздуха в воротной вене и в желчных протоках. На серошкальных изображениях воздух во внутрипечёночных и внепеченочных желчных протоках выглядит как эхогенные фокусы в различных частях печени, которые в пределах портальной триады имеют линейную конфигурацию. Можно часто наблюдать дистальное затемнения или артефакт реверберации, которые занимают центральное положение вблизи воротной вены, в отличие от газа в воротной вене, для которого характерно периферийное размещение. Эхогенность воздуха в желчных протоках часто выше, чем в воротной вене, что, скорее всего, связано со статичностью воздуха во внешних протоках и большей склонностью к накоплению, а не диффузии в паренхиму печени. Шансы увидеть паренхиматозные зоны с повышенной эхогенностью у пациентов с воздухом в желчном протоке незначительны. Кроме того, эхогенные фокусы в желчных протоках обычно являются статическими, с редкими случаями смещения, которые наблюдаются при изменении положения тела пациента.
СЛУЧАЙ 5: РАССЛОЕНИЕ АОРТЫ
Случай 5. В 57-летнего мужчины внезапно появилась сильная боль в спине. (А) На сагиттальном срезе (SAG) аорты (АО) в серошкальном режиме видно эхогенный лоскут в просвете, появление которого связано с расслоением аорты. Обратите внимание, что аорта не является расширенной. (В) На поперечном срезе аорты в режиме серой шкалы видно эхогенный лоскут интимы. Верхняя брыжеечная артерия (SMA) (стрелка). (С) На цветном допплеровском изображении наблюдаем, что оба просвещения являются раскрытыми, хотя ложный просвет, который находится позади, не обозначен цветом, что связано с наличием тромба (стрелка). (D) На изображениях спектрального Доплера видно нормальный высокорезистентный профиль кривой кровотока в настоящем просвете. Однако обратите внимание на увеличенную пиковую систолическую скорость – ПСС (215 см/с), связанную с сужением настоящего просвета. (Е) Спектральное допплеровское изображение ложного просвета показывает аномальный профиль кривой кровотока с пониженной ПСС.
Расслоение аорты начинается с разрыва интимы стенки аорты и попадания крови в мышечный слой стенки сосуда сквозь прорыв, отделяя интиму от окружающего ее мышечного слоя (медиа) и/или от внешней эластичной мембраны (адвентиции), образуя ложный просвет. Расслоение может распространяться дистально и/или проксимально по отношению к месту разрыва, включая ветви аорты и аортальный клапан, позволяя крови попасть в просвет перикарда. С этим процессом связаны многочисленные клинические проявления, среди которых ишемия (коронарная, церебральная, спинальная или висцеральная), аортальная недостаточность и тампонада сердца. Ложный просвет может питать ветви аорты. Поэтому, если ложный просвет будет закупорен, подобное может также произойти с сосудами, которые разветвляются от аорты. Расслоения аорты обычно начинаются в грудном отделе аорты, однако могут также достигать брюшного отдела аорты. Редко случается, что расслоение аорты происходит только в брюшном отделе аорты. Среди факторов, способствующих возникновению расслоение аорты, можно выделить гипертонию, атеросклероз, предварительную аневризму аорты, васкулит, коллагеновые сосудистые заболевания (например синдромы Элерса-Данлоса и Марфана), травмы, двустворчатый аортальный клапан, коарктацию аорты, кокаиновую зависимость и интенсивные силовые тренировки. Расслоение аорты можно диагностировать у пациента с клиническими проявлениями внезапных приступов острой/режущей боли в груди или животе, изменениями в периферийном пульсе (например, отсутствие пульса в верхних конечностях или в сонной артерии) или разницей между систолическим давлением правой и левой руки более чем на 20 мм рт. ст., и расширением средостения, видимым на рентгеновском изображении грудной клетки.
В условиях неотложной терапии предпочтение отдается КТ грудной клетки. Чреспищеводная эхокардиография (ЧПЭ) и магнитно-резонансное сканирование также подходят для обследования гемодинамически стабильных пациентов. Особенно важно быстро идентифицировать характер расслоений в восходящей аорте (тип А по Стэнфордской классификации), которые рассматриваются как требующие немедленного хирургического вмешательства. Для сравнения, расслоение в нисходящей аорте (тип В по Стэнфордский классификации) имеют больше шансов быть гемодинамически стабильными и обычно лечатся медикаментозно.
Несмотря на то, что ультразвуковая диагностика не является оптимальным методом диагностики при подозрении наличия у пациента расслоения аорты в грудной клетке, однако расслоение в брюшном отделе аорты легко визуализировать с помощью ультразвука. Выявление в В-режиме эхогенного лоскута отслоившейся интимы в просвете сосуда указывает на наличие расслоения. При сканировании в режиме реального времени данный лоскут может быть подвижным. При условии, что один из просветов закупорен тромбом, внутри может появиться эхогенный сигнал. С помощью цветной допплерографии можно определить являются ли оба просвета незаполненными. На изображении спектрального Доплера можно увидеть различия между волной кровотока в настоящем и ложном просвете, с характерной для ненастоящего просвета сниженной скоростью и атипичным видом волны кровотока. Необходимо тщательно проверить место разветвления брюшного ствола, верхней брыжеечной артерии и почечных артерий в брюшной полости, чтобы определить нет ли там расслоения. Распространение расслоения на эти сосуды может вызвать их стеноз или тромбоз.
СЛУЧАЙ 6: АНЕВРИЗМА СЕЛЕЗЕНОЧНОЙ АРТЕРИИ
Случай 6. У этой 40-летней женщины есть жалобы на боль в левом верхнем квадранте живота. (А) На поперечном срезе в В-режиме видно анэхогенное образование (звездочка), которое находится за поджелудочной железой и селезеночной веной (S). А, аорта, С, нижняя пол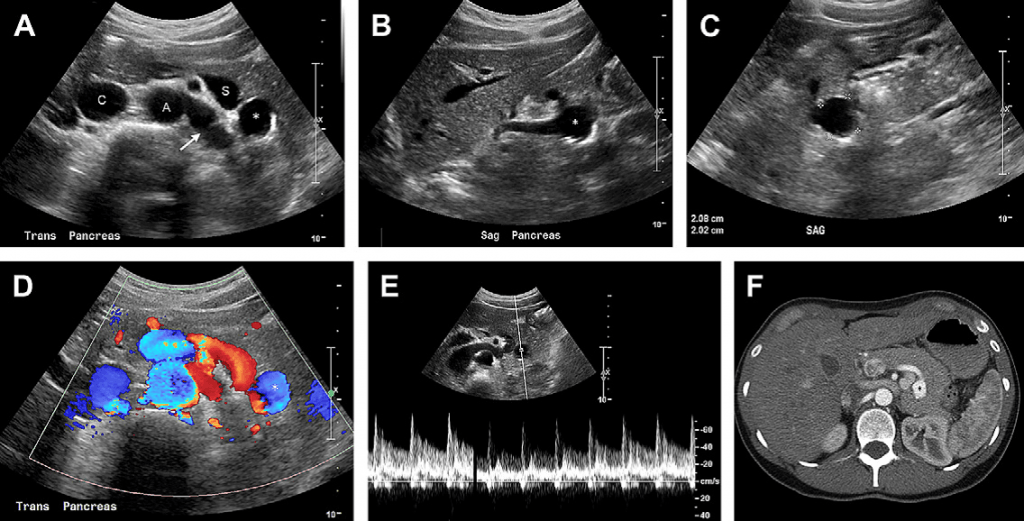
Аневризма селезеночной артерии (АСА) является самой распространенной аневризмой висцеральных артерий. Существует связь между АСА и портальной гипертензией, поэтому риск заболевания у таких пациентов может достигать 7,1 % по сравнению с 1,6 % среди населения в общем. АСА также связана с фиброзно – мышечной дисплазией и другими типами васкулита, панкреатитом (часто псевдоаневризмы), атеросклерозом, гипертонией, аутоиммунными или коллагеновыми сосудистым расстройствами, травмами и злоупотреблением внутривенными наркотиками (грибковыми). АСА в четыре раза более распространена среди женщин, чем среди мужчин, и до 95 % чаще происходят во время беременности. Частые случаи проявления симптомов АСА у беременных женщин связаны с гормональным воздействием, или с шунтированием крови в селезеночную артерию. Наиболее критическим осложнением АСА является ее разрыв, который происходит в 3-10% случаев. Разрыв во время беременности сопровождается непропорционально высокими показателями смерти матерей и плодов. Феномен двойного разрыва, впервые описанный Brockman, характерный в 20-25 % случаев. По данному клиническому сценарию состояние пациентов с симптомами внезапного приступа боли в животе, гипотонией и потерей сознания, в большинстве случаев быстро улучшается благодаря переливанию крови, которое проводят после того как, сальник или тромб закупоривает сальниковую сумку, которая окружает АСА. Считается, что это временное закупоривание повышает шансы пациента выжить, ведь появляется дополнительное время для диагностики и соответствующего лечения. Однако, в пределах двух суток после латентного периода происходит прорыв в брюшину и внезапное развитие сердечно-сосудистой недостаточности. К другим выраженным симптомам можно включить боль в животе и спине, симптом Кера (боль в левом плече, вызванная раздражением диафрагмы) и гемодинамическую нестабильность, которая появляется после разрыва. В редких случаях может произойти инфаркт селезенки. Однако, диаметр большинства АСА не превышает 2,5 см, а новообразования такого размера обычно являются бессимптомными и обнаруживаются случайно. Разрывы АСА с диаметром менее 2,5 см – очень редкие явления.
Большинство АСА являются подоночными (71%) и мешкообразными (80 %), они расположены в средней или дистальной части селезеночной артерии (80 %), чаще у ворот селезенки [50,53,54]. Хирургическая реконструкция сосудов остается наиболее оптимальным методом лечения. Однако чрескожная эмболизация или стентирование проводятся все чаще, несмотря на то, что продолжительность эффекта чрескожной терапии пока не доказана. Лечение следует начинать при наличии симптомов/разрыва, в случае беременности или намерения забеременеть, при увеличении размера АСА до двух и более см. Бессимптомные АСА с диаметром менее 2 см подлежат выборочному удалению, или внимательному мониторингу. Возможный риск при выборочном удалении низкий с минимальной смертностью. Если есть возможность, следует сохранить селезенку, а спленэктомия применяется при аневризме, обнаруженной в воротах селезенки или во время экстренных ситуаций.
Если АСА является кальцинированной, это можно обнаружить на рентгеновских снимках живота или на изображениях КТ. На контрастном КТ-изображении незаполненная АСА визуализируется как выпячивание селезеночной артерии. Если АСА заполнена тромбом, а стенка не кальцинированная, ее может быть сложно обнаружить из-за сходства с лимфатическими узлами и брыжеечными венами. Хотя АСА чаще диагностируют при КТ-сканировании, с помощью ультразвука можно неинвазивно и недорого проводить мониторинг изменения размера АСА без ионизирующего излучения. В связи с этим во время беременности преимущество в диагностике предоставляется дуплексной допплерографии. При ультразвуковой диагностике АСА может выглядеть как анэхогенное выпячивание селезеночной артерии на серошкальном изображении, которое при цветной допелрографии будет заполнено цветом. Если стенка кальцинированная, она будет визуализироваться как гиперэхогенное образование с дистальным затмением. Если АСА закупорена тромбом, будут обнаружены низкоуровневые эхо-сигналы и отсутствие кровотока на картинке цветного Доплера. В ходе ультразвуковой диагностики также легко обнаружить свободную жидкость или гемоперитонеум, которые появляются после разрыва. Ограничение возможностей ультразвуковой диагностики зависят от врача и от степени затухания ультразвуковых волн, которые проходят через жировую ткань и/или газ в кишечнике. Именно поэтому в связи с затенением от газа в кишечнике даже лучший специалист не сможет обнаружить все срединные или центральные АСА. Достаточно сложной может быть идентификация сильно кальцинированных АСА. Несмотря на то, что стандартное проведение скрининга всех беременных пациенток не является практичным, ведь процент выявленных АСА низкий, некоторые склоняются к мысли, что обследование групп с высоким риском может дать положительные результаты.
СЛУЧАЙ 7: КОАРКТАЦИЯ АОРТЫ В ВИДЕ СТЕНОЗА ПОЧЕЧНОЙ АРТЕРИИ
Случай 7. Этот 11-летний мальчик страдает от гипертонии. На цветных доплеровских изображениях правой (А) и левой (В) почечной артерии видно уменьшение величины пульсовой волны или кривую tardus parvus (parvus – низкая скорость, tardus – замедленное нарастание скорости), в обоих случаях связаны с проксимальным стенозом. Кривая tardus parvus настолько ярко выражена, что по профилю почти напоминает венозный кровоток. Однако обратите внимание на изображение нормальной левой почечной вены (синяя, кровоток от почки), которая идет параллельно с почечной артерией (красная, кровоток к почке), на цветном допплеровском картировании. (В) В месте ответвления почечной артерии не обнаружено повышения скорости. Подобная форма волны замечена в аорте выше ответвления почечных артерий. (С) Именно поэтому стеноз должен быть проксимальнее к брюшной аорте. У парня диагностировали коарктацию аорты.
Ультразвук часто используют для оценки стеноза почечной артерии (СПА). Почка может быть уменьшена в размерах с повышенной эхогенностью или истончением коркового вещества почки, вызванным хронической ишемией.
На изображении цветного Доплера можно наблюдать aliasing – эффект в области стеноза почечной артерии. К обнаруживаемым на спектральном допплеровском изображении симптомам, которые позволяют диагностировать СПА (> 60 %), относится увеличение пиковой систолической скорости в почечной артерии от 180-200 см/с и выше, соотношение между ПСС в почечной артерии и в аорте на уровне почечных артерий выше, чем 3,0 до 3,5, постстенотическое спектральное расширение и замедление систолического ускорения на спектральной кривой кровотока сегментарных или междольковых артерий, показано на ультразвуковом изображении. Замедленное систолическое ускорение указывает на проксимальный стеноз. Однако это не является специфическим симптомом, ведь точный уровень стеноза определить невозможно, за исключением того, что он является более проксимальным к точке передачи сигнала. Замедление систолического ускорения можно вычислить, измерив время ускорения (ВУ), то есть промежуток времени от начала систолы до момента приближения к пику систолической скорости, или индекс ускорения (ИУ), который представляет собой кривую, соединяющую начало систолы с моментом приближения к пику систолической скорости. Аномальными считаются ВУ продолжительностью более 70 миллисекунд и ИУ менее 3 мс². И наоборот, повышение систолической скорости можно субъективно оценить, глядя на кривую tardus parvus, для которой характерно медленное движение вверх (tardus) и медленный, округлый (parvus) систолический пик. Когда атеросклероз вызывает вазоренальную гипертензию, в исходной или проксимальной точке почечной артерии, или, реже, в месте разветвления, обнаруживается сужение. Если вазоренальную гипертензию вызвала фиброзно-мышечная дисплазия, поражается участок от середины к дистальной части почечной артерии с возможным появлением симптома «ожерелья».
Некоторые исследователи пришли к выводу, что в случае пониженной скорости кровотока в аорте (например, замедленное сокращение сердечной мышцы) и ПСС в аорте, которая не превышает 40 см/с, показатель ПСС в почечной артерии будет искусственно завышенным. И наоборот, в случае серьезных признаков атеросклероза или гипертонии в брюшной аорте и ПСС в аорте, которая превышает 100 см/с, показатель ПСС в почечной артерии будет ошибочно заниженным. При таких условиях в качестве основного фактора, который определяет клиническую значимость СПА, следует использовать показатель ПСС, который превышает 200 см/с и постстенотическую турбулентность в почечной артерии. Однако все еще необходимо доказать, можно ли использовать одинаковый абсолютный показатель ПСС в случае значительно увеличенной или уменьшенной скорости кровотока в аорте.
СЛУЧАЙ 8: АСИММЕТРИЧНЫЕ ПРОФИЛИ КРИВЫХ КРОВТОКА В ЛЕВОЙ И ПРАВОЙ ПЕЧОНОЧНОЙ АРТЕРИИ
Случай 8. У этой 54-летней женщины обнаружен сепсис, вызванный многочисленными абсцессами печени. (А) На спектральном допплеровском изображении печеночной артерии (ПА) видно кривую «tardus parvus», связанную с проксимальным стенозом. В правой печеночной артерии было обнаружено похожий профиль кривой кровотока (не показано). Однако, на спектральном изображении левой печеночной артерии (ЛПА) (В) видно нормальный острый систолический комплекс (+). При ангиографии было обнаружено стеноз длинного отрезка общей печеночной артерии с ответвлением левой почечной артерии от левой желудочной артерии.
Данный вариант анатомии печеночной артерии является распространенным явлением, с количеством зарегистрированных случаев от 23 % до 45 % [61]. Обследовав 180 пациентов, Jones и Hardy доказали, что левая печеночная артерия ответвляется из ствола общей печеночной артерии в 80 % случаев, от левой желудочной артерии в 15 % случаев, от селезеночной артерии в 2% случаев, от гастродуоденальной артерии в 1% и еще реже из аорты, брюшного ствола и верхней брыжеечной артерии (ВБА). Правая печеночная артерия (ППА) выходит из главного ствола общей печеночной артерии в 75 % случаев, их ВБА в 18 %, от гастродуоденальной артерии в 6% и от правой желудочной артерии или аорты в 1,6 % случаев [61]. Подсчитали, что частота ответвления левой печеночной артерии (ЛПА) от левой желудочной артерии 10 %, а ответвление ППА от ВБА – 11% (тип II и III классификации анатомии печеночной артерии Michel, соответственно). Подобные варианты анатомии могут иметь серьезные последствия во время хирургии, в связи с чем рентгенологу важно знать о их наличии [64]. Хотя сразу визуализировать врожденные изменения мест происхождения печеночных артерии может оказаться сложно, на их наличие может указать асимметричность профилей кривых кровотока в печени.
СЛУЧАЙ 9: АРТЕРИОВЕНОЗНАЯ МАЛЬФОРМАЦИЯ В ПЕЧЕНИ
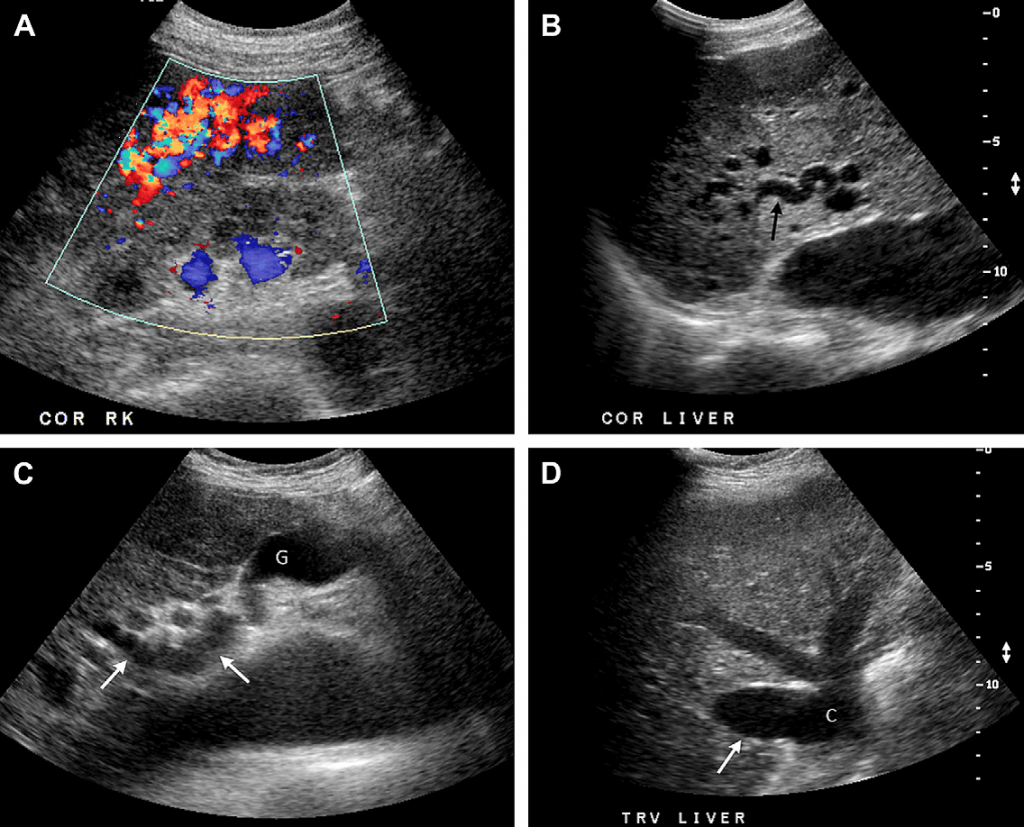
Случай 9. У этой 48-летней женщины диагностировано наследственную геморрагическую телеангиоэктазию (НГТ) и жалобы на боль в правом верхнем квадранте. (А) На цветном допплеровском изображении правой доли печени видно клубок увеличенных сосудов, связанный с артериовенозной мальформацией. COR, коронарный; RK, правая почка. Более центральное УЗИ- изображение в В-режиме (В) показывает увеличенную питательную артерию (стрелка). УЗИ – изображение «ворот» печени в В-режиме (С) показывает увеличенную извилистую печеночную артерию (стрелки). G, желчный пузырь. (D) Обратите внимание на значительно увеличенную дренирующую праву печеночную вену (стрелка) по сравнению с нормальными средней и левой печеночными венами. С, нижняя полая вена.
Диффузные артериовенозные мальформации печени (АВМ) можно наблюдать в случае проявления наследственной геморрагической телеангиоэктазии (НГТ), известной также как болезнь Ослера-Вебера-Рандю. Частота проявлений АВМ печени у пациентов с диагнозом НГТ достигает от 8 % до 31%. Несмотря на бессимптомное протекание, поражение печени может вызвать сердечную недостаточность с высоким выбросом. В редких случаях шунтирование крови приводит к некрозу желчного пузыря, абсцесса печени или даже к портальной гипертензии. К другим причинам образования артериовенозных фистул (АВФ) и АВМ относятся травмы печени, врожденные аномалии, цирроз печени, синдром Бадда – Киари и новообразования.
К симптомам, обнаруженным при сонографическом обследовании пациентов с диагнозом НГТ и АВМ печени, относят большие питательные артерии, пульсирующий венозный кровоток, наличие многочисленных расширенных извилистых трубчатых образований в паренхиме печени и большие дренирующие вены. Расширенная общая печеночная артерия в печеночно – дуоденальной связке и «ворота» печени могут напоминать расширенные желчные протоки на серошкальном изображении. Однако на изображение цветного Доплера кровоток в увеличенных извилистых артериях выделен цветом [76]. При спектральном Допплерографическом сканировании в зоне АВМ может оказаться спектральное расширение, а в питательных артериях – высокоскоростной кровоток и низкорезистентный профиль кривой кровотока. Анализ дренирующей вены показывает артериализированный профиль кривой кровотока во время систолы и отсутствие дыхательной фазности. Спектральная и цветная допплерография также может быть полезной для мониторинга пациентов после лечения путем эмболизации или для обнаружения печеночных аномалий у родственников пациентов с диагнозом НГТ.
СЛУЧАЙ 10: ЭМБОЛИЯ ПОЧЕЧНОЙ АРТЕРИИ
Случай 10. 65-летняя женщина с симптомами острой боли в боку и почечной недостаточностью. У нее диагностировали камни и поэтому отправили в отделение интервенционной радиологии для проведения нефростомии и возможного стентирования. Однако на изображении цветного Доплера не было обнаружено симптомов гидронефроза (А). Кроме того, в почечном синусе или в корковом веществе не наблюдается артериальный кровоток. (В) Поперечное цветное допплеровское изображение аорты (А) левая почечная артерия (стрелки). Ангиограмма подтвердила окклюзию левой почечной артерии (стрелка) (С).
У пациентов тромбоэмболия почечной артерии обычно проявляется с появлением острой боли в боку. Ранняя диагностика и лечение с помощью антикоагулянтов, фибринолитических средств или эмболэктомия имеет решающее значение для предотвращения необратимого повреждения почек. Окклюзия почечной артерии может происходить в связи с прогрессированием атеросклероза от стеноза до полного закупоривания; эмболическими осложнениями при травме, расслоением аорты или сердечной недостаточностью; и в качестве осложнения после хирургической операции или ангиопластики/стентирования почечной артерии (обычно после расслоения, разрыва или кровоизлияния в бляшку). Сердце является источником эмболов в артериальной системе артериальной эмболии в 94 % пациентов. Четыре основные причины возникновения системной эмболии включают мерцательную аритмию, острый инфаркт миокарда (постинфарктные тромбы обычно в аневризмах желудочка), протезные клапаны и ревматический митральный стеноз. К менее распространенным факторам появления системной эмболии принадлежит атриальная миксома, бактериальный эндокардит, и атероматозное вещество из аневризмы или бляшки. Только 2-3 % эмболов периферических артерий поражают почки. Однако эмболы являются самой распространенной причиной возникновения сегментарного инфаркта почки.
Диагностирование острой реноваскулярной окклюзии часто является сложным и требует высокой степени клинической настороженности. Ее следует заподозрить, когда сразу после манипуляций с аортой или почечной артерией появляется острая почечная недостаточность, особенно если видны симптомы внепочечных тромбоемболических проявлений. При возникновении инфаркта почек можно наблюдать возросший уровень сывороточной лактатдегидрогеназы.
На серошкальном изображение сразу нельзя обнаружить аномальные симптомы. Однако на цветном энергетическом допплеровском изображении будет показано отсутствие кровотока в корковом веществе почки и в почечной артерии. Со временем почка уменьшится в размере, а пробковое вещество почки станет тонким и гиперэхогенным. На ультразвуковом изображении фокальные или сегментарные инфаркты почек могут быть гиперэхогенными или гипоэхогенными. Наконец, зоны паренхимального некроза могут стать кистозными. Фокальные инфаркты обычно имеют клиновидную форму и легко идентифицируются, но могут становиться более округлыми с нечеткими границами. На энергетическом цветном допплеровском изображении, путем четкой визуализации окружающих тонких мелких сосудов в нормально перфузируемой почечной паренхиме можно обнаружить фокальные дефекты перфузии.
УЗИ аппарат Toshiba Aplio XG – только лучшие предложения от компании RH.