Резюме
Кольорова допплерографія (ЦДГ), будучи неінвазивним методом, широко використовується в акушерстві для дослідження кровообігу плода і плаценти. Традиційні режими ЦДГ включають кольорове допплерівське дослідження потоку (ЦДИП) та енергетичне допплерівське дослідження (ЭДИ). В останні роки все частіше застосовуються нові режими, включаючи візуалізацію потоку високої чіткості (ВПВЧ), променистий потік, візуалізацію мікросудинного потоку (ВМСП) і три-/чотиривимірну візуалізацію в режимі “Glass-body”. У порівнянні з ЦДИП, ВПВЧ має вищу роздільну здатність і чутливість і дозволяє виявляти повільніші потоки. ВМСП підвищує чутливість до тонких судин або судин з низьким кровотоком, створюючи при цьому мало або зовсім не створюючи артефактів руху. Променистий потік показує кровотік з відчуттям глибини і зменшує переповнення крові. Режим скляного тіла, що відображає як сіру шкалу, так і кольорову інформацію про потік, може продемонструвати пов’язані з серцевим циклом події потоку і просторове співвідношення судин. У цьому огляді обговорюються характеристики та застосування різних режимів ЦДГ в акушерстві. Зокрема, представлено, як ці нові технології інтегровані в детальну діагностику та раннє морфологічне сканування.
Ключові слова: 3D/4D ультразвук, ПЧКЗ, кольоровий доплер, акушерство, променистий потік, покращена візуалізація мікросудин
1. Вступ
Кольорова допплерографія (ЦДГ), будучи неінвазивним методом, широко використовується в акушерстві для дослідження кровообігу плода і плаценти. ЦДГ можна використовувати для визначення наявності та напрямку кровотоку, оцінки анатомії серця та периферичних судин плода, а також для корекції кута між променем та судиною для правильного вимірювання швидкості [1]. Додавання ЦДГ до сірошкальної ультразвукової діагностики може покращити пренатальну діагностику, серед іншого, вад серця, аномалій пуповини та плацентарних порушень [2,3,4,5,6,7]. Традиційні режими ЦДГ включають кольорове допплерівське дослідження потоку (ЦДИП) та енергетичне допплерівське дослідження (ЭДИ). В останні роки все частіше застосовуються нові режими, включаючи візуалізацію потоку високої чіткості (ВПВЧ), візуалізацію мікросудинного потоку (ВМСП), променевий потік і три-/чотиривимірний рендеринг в режимі “glass-body”. Мета цього огляду – узагальнити характеристики різних режимів ЦДГ та оцінити їх застосування в акушерстві. Зокрема, обговорюється, як ці нові технології інтегруються в детальну діагностику та раннє морфологічне сканування, як це нещодавно було рекомендовано [8,9,10,11,12,13].
2. Режимы цветной допплерографии
В отличие от ЦДИП, который измеряет сдвиг частоты, генерируемый скоростью потока эритроцитов в сосуде(Рисунок 1A), ЭДИ измеряет амплитуду (мощность) допплеровского сигнала, генерируемого интенсивностью их сигнала. Вычисляя разницу в интенсивности свечения без учета направления и скорости, ЭДИ не имеет алиасинга сигнала и может позволить обнаружить потоки с меньшими скоростями[1]. Однако ЭДИ не предоставляет информации о направлении кровотока и не может продемонстрировать наличие или отсутствие турбулентности.
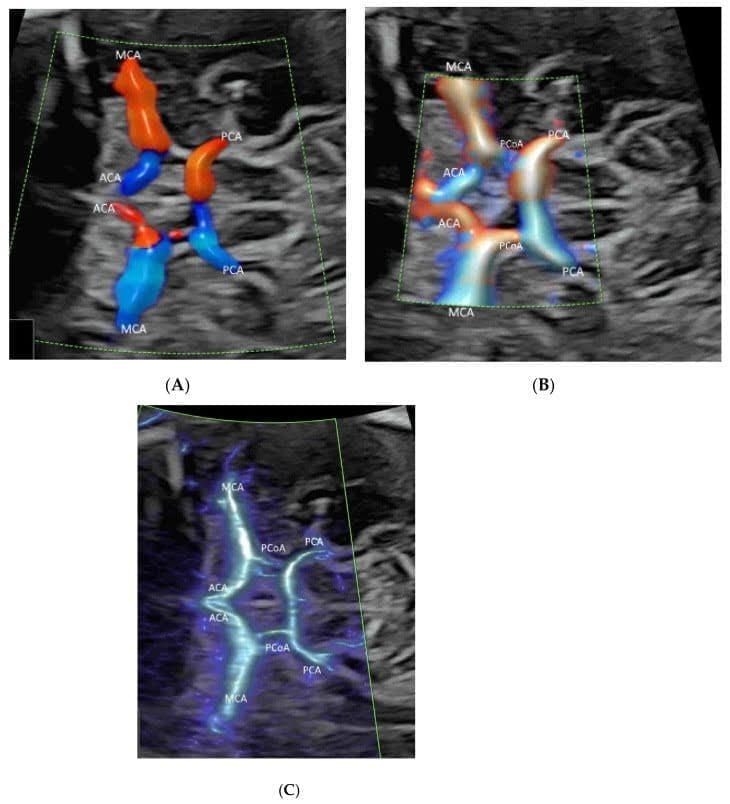
Рисунок 1
Демонстрация Вилизиева круга (ВК) в поперечной плоскости нормального плода в 25 недель гестации с помощью цветного допплеровского изображения потока (ЦДИП)(A), визуализации потока высокой четкости (ВПВЧ) (B) и визуализации микрососудистого потока (ВМСП) (C) с лучистым потоком. Обратите внимание, что передняя мозговая артерия (ПМА), средняя мозговая артерия (СМА) и задняя мозговая артерия (ЗМА) хорошо визуализируются во всех трех режимах, в то время как задняя соединительная артерия (ЗСА) визуализируется при ВПВЧ (B) и ВМСП (C), но не при ЦДИП (A).
Визуализация потока высокой четкости (ВПВЧ), которую также называют двунаправленной энергетической допплеровской визуализацией, использует цифровую широкополосную оценку допплеровских сигналов, которая сочетает допплеровские частотные смещения с амплитудами сигналов. ВПВЧ присваивает цвет на основе измеренного допплеровского смещения, не принимая во внимание направление или скорость[14,15]. По сравнению с ЦДИП, ВПВЧ имеет более высокое разрешение и чувствительность(Рисунок 1B). Однако на ЦДИП, ЭДИ и ВПВЧ влияют помехи и артефакты движения, которые являются производными от движений, пульсации и дыхания беременной женщины[16]. Для удаления этих артефактов обычно применяют одномерный пристенный фильтр. К сожалению, этот фильтр также удаляет перекрывающиеся сигналы низкоскоростного потока, что приводит к потере низкоскоростных компонентов потока[16].
Визуализация микрососудистого потока (ВМСП) – это новая технология, которая применяет многомерную или очень сложную систему пристенной фильтрации для отделения сигналов низкоскоростного потока от перекрывающихся артефактов[17,18,19,20]. Таким образом, ВМСП повышает чувствительность к тонким или низкоскоростным сосудам, создавая при этом мало или совсем не создавая артефактов движения(Рисунок 1C). Кроме того, ВМСП использует высокочастотные методы дискретизации и высокую частоту кадров, отображая изображения с высоким разрешением[17,18,19,20]. ВМСП может обнаруживать поток, даже когда угол инсоляции неоптимален. Некоторые недавно разработанные системы ВМСП способны предоставлять цветную информацию о направлении движения, накладываемую на изображение в В-режиме. Подобная технология была разработана в нескольких отраслях, включая технологию Superb Microvascular Imaging (SMI) (TOSHIBA Inc., Токио, Япония), MicroFlow imaging (Philips Healthcare), MV-Flow (Samsung Medison) и SlowFlowHD (GE Healthcare).
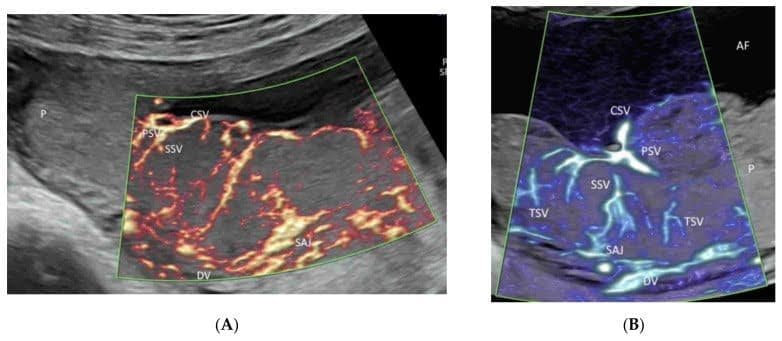
Лучистый поток (GE Healthcare) или LumiFlow (Samsung Medison) – это новая технология, которая преобразует показатель плотности эритроцитов в определенной области в индекс высоты и может быть применена для ЦДИП, ЭДИ, ВПВЧ или ВМСП[21](Рисунок 2A-C). Эта новая двумерная (2D) технология показывает кровоток с ощущением глубины или “трехмерного (3D) вида”, уменьшает переполнение крови и улучшает пространственное восприятие кровеносных сосудов и их границ[21].
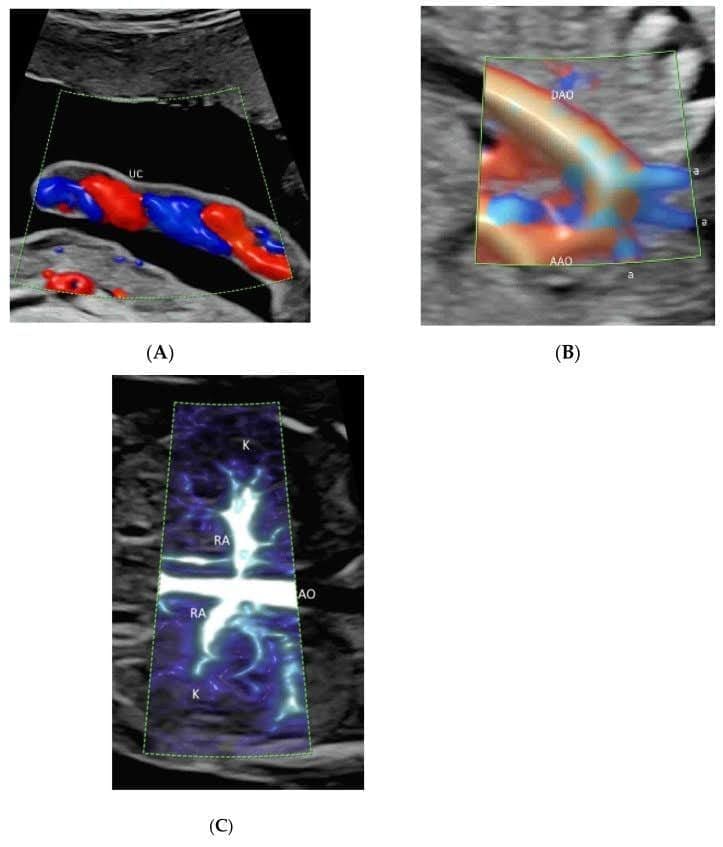
Рисунок 2
Демонстрация лучистого потока, примененного к цветной допплерографии (А), высокой четкости (В) и микрососудистой визуализации (С) визуализации потока. Обратите внимание, что кровоток показан с ощущением глубины в сосудах пуповины (А), дуги аорты и ее ветвей (а) (В), а также почечных артерий (НА) и их ветвей (С). AAO – восходящая аорта; DAO – нисходящая аорта; AO – аорта.
Недавно разработанный режим “glass-body”, после получения объемного 3D или 4D пространственно-временной корреляции изображений (ПВКЗ), демонстрирует связанные с сердечным циклом события кровотока и пространственные взаимоотношения сосудов, отображая как серошкальную, так и цветную информацию[4,22](Рисунок 3А). Кроме того, специальное программное обеспечение позволяет регулировать источник света для достижения эффектов освещения и затенения, а следовательно, улучшить восприятие глубины и пространственное впечатление от сосудистых структур[4]. HDlive silhouette, еще один специальный режим, отображает кровоток, стенки сосудов и их полупрозрачные просветы с повышенной четкостью[23](Рисунок 3В).
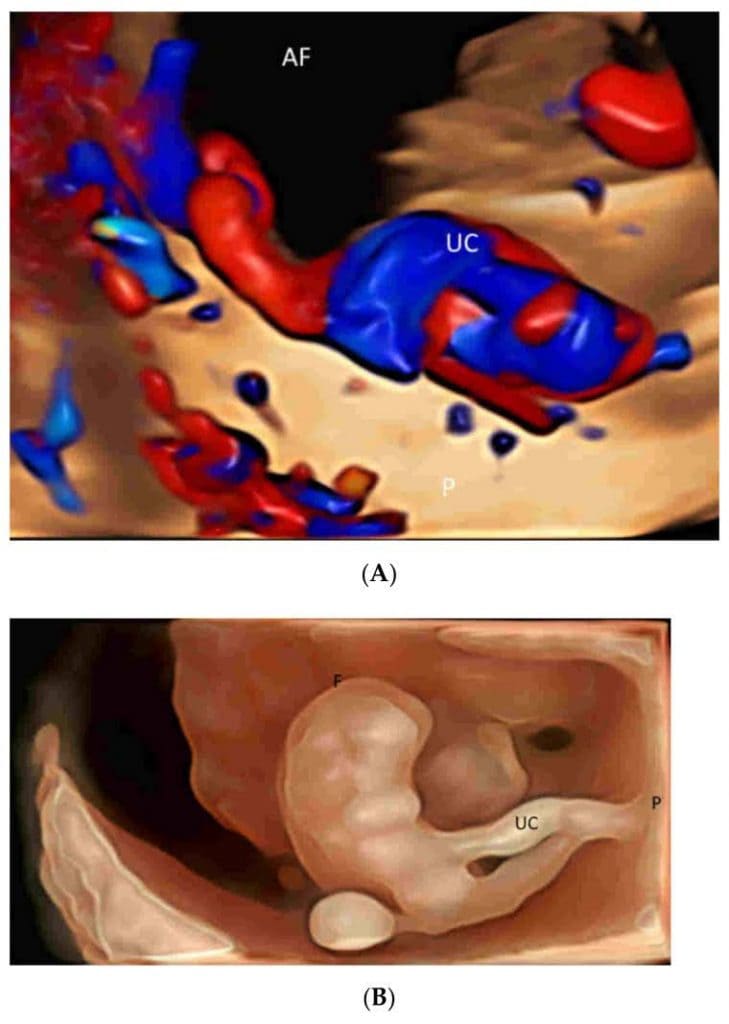
Рисунок 3
(А) Объемное изображение с пространственно-временной корреляцией изображений (ПЧКЗ), отображаемое в режиме “glass-body” как с серошкальной, так и с цветной информацией, демонстрирует вставление пуповины (UC) в плаценту (P). AF- амниотическая жидкость. (B) Трехмерное ультразвуковое изображение, показанное в режиме HDlive силуэта, демонстрирует пуповину (UC), соединяющую нормальный плод (F) с плацентой (P) в сроке 8 недель гестации.
3. Оптимизация безопасности
Диагностическая акушерская ультрасонография в целом считается безопасной[1]. Особое внимание следует уделять использованию ЦДГ, поскольку выход энергии при ЦДГ выше, чем при В-режиме. Важно ограничить влияние ЦДГ на плод до минимально допустимого уровня (МДУ), особенно во время первого триместра беременности. Как термический индекс, так и механический индекс следует поддерживать на уровне ≤1,0[1].
Для оптимизации качества изображения необходим выбор правильного ультразвукового оборудования, соответствующего маршрута исследования (трансабдоминального или трансвагинального), пресетов и режимов ЦДГ[1,8]. Важно, чтобы область интереса (ROI) была как можно меньшей за счет сужения угла сканирования, увеличения глубины визуализации, а затем применения ЦДГ с увеличением[1]. Чтобы избежать артефактов движения, ультразвуковые исследования проводят во время покоя плода и без движений матери. Для ВМСП уменьшение акустической мощности и усиления может уменьшить артефакты вспышек[20]. Для исследования различных типов кровообращения следует выбирать соответствующий режим ЦДГ. ЦДИП, ЭДИ/ВПВЧ и ВМСП позволяют выявлять быстрые, промежуточные и медленные потоки соответственно(Рисунок 1B и Рисунок 2A,C).
4. Клиническое применение в гинекологии
ЦДГ обычно используется для оценки анатомии и кровотока сердца плода, периферических сосудов, пуповины и плаценты [1,2,3,4,5,6,7]. ЦДГ также полезна для оценки различных структур в первом триместре и при беременности двойней [9,24].
4.1. Сердце плода
ISUOG рекомендует добавлять ЦДГ к рутинному скринингу в середине триместра беременности[13]. ЦДГ может облегчить визуализацию различных структур сердца, особенно у женщин с ожирением[25], и помочь в выявлении пороков сердца, таких как стеноз легочной артерии или аорты с аномальным кровотоком[5,26]. Поперечное развертывание сердца от четырехкамерного среза, через пути оттока к трехкамерному срезу трахеи является полезным для оценки[13]. Полученный клип может облегчить дальнейший покадровый просмотр ультразвуковых изображений. Разумное использование функции cine-loop может частично преодолеть влияние артефактов движения[1].
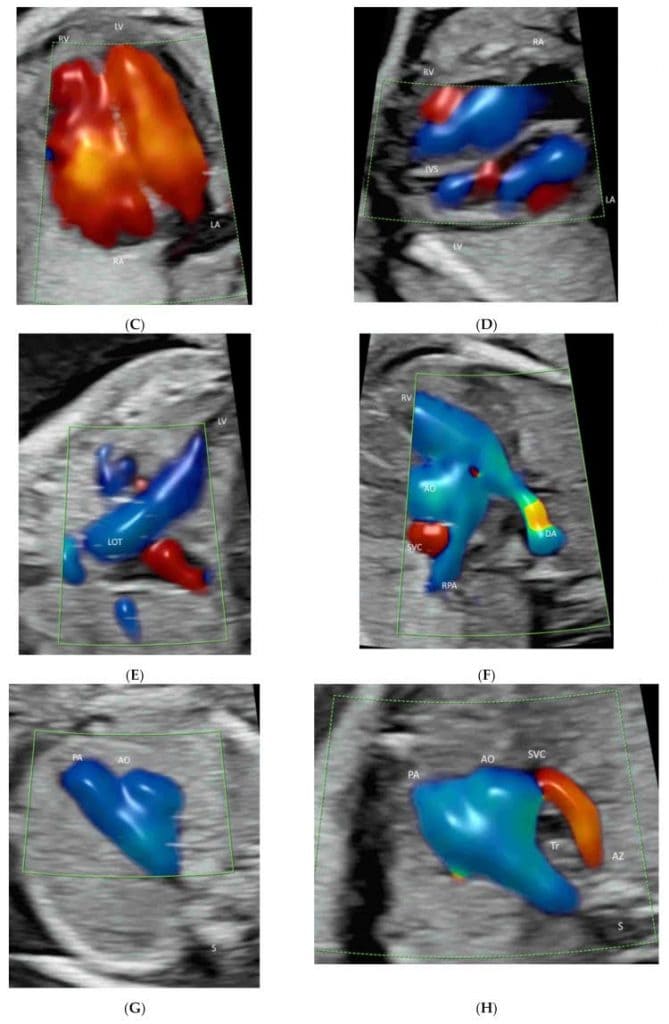
ISUOG рекомендует добавлять ЦДГ при эхокардиографии плода[13]. AIUM рекомендует использовать ЦДГ для оценки (а) системных вен (включая верхнюю и нижнюю полые вены и венозный проток), (b) легочных вен (по меньшей мере две: одна правая и одна левая вены), (c) межпредсердная перегородка и овальное отверстие, (d) атриовентрикулярные клапаны, (e) межжелудочковая перегородка, (f) полулунные клапаны, (g) дуга протока и (g) дуга аорты[11](Рисунок 4A-J). Лучевой поток показывает подробную информацию о внутрисердечном кровотоке[21]. ВПВЧ полезна для обнаружения легочных вен[27].
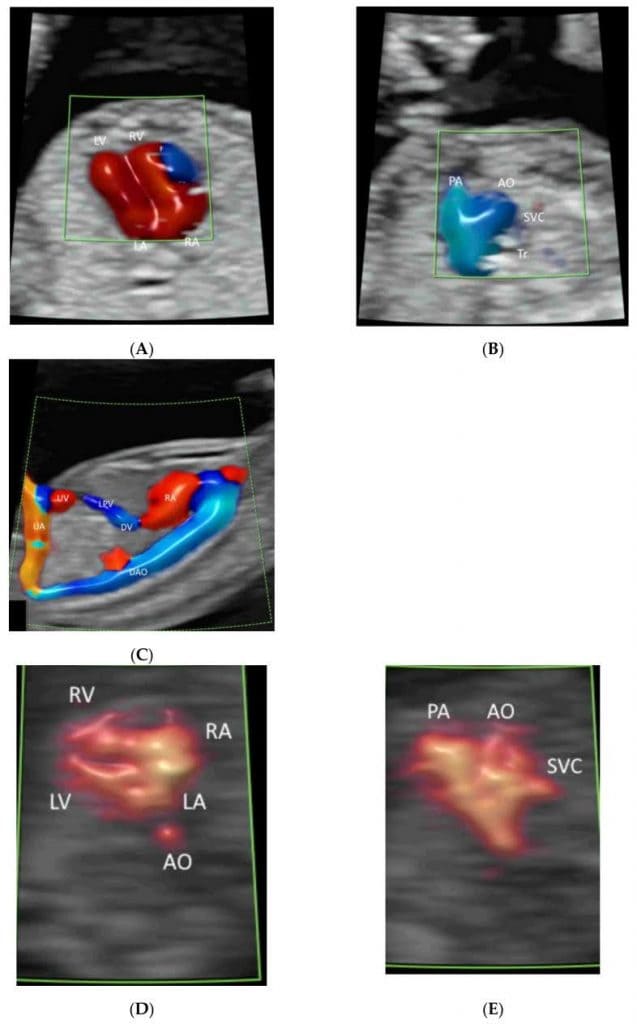
Рисунок 4
Цветная допплерография кровотока в эхокардиографии плода: Венозный проток (DV) и нижняя полая вена (IVC)(A), легочные вены (PV), межпредсердная перегородка и овальное отверстие(B), атриовентрикулярные клапаны (C), межжелудочковая перегородка (D), полулунные клапаны(E-H), дуга протока(I) и (g) дуга аорты (J). Обратите внимание на выходной тракт левого желудочка (LOT)(E), ветви RPA(F), трехсосудистый срез(G), срез трех сосудов и трахеи(H) и три восходящие ветви (1-3)(J). LPV, левая воротная вена; LHV, левая печеночная вена; RA, правое предсердие, LA, левое предсердие; RV, правый желудочек; LV, левый желудочек; IAS, межпредсердная перегородка; IVS, межжелудочковая перегородка; DA, артериальный проток; PA, легочная артерия; RPA, правая легочная артерия; Tr, трахея; AZ, непарная вена; AO, аорта; DAO, нисходящая аорта; AAO, восходящая аорта.
Четырехмерная эхокардиография плода может помочь в оценке сложных пороков сердца, включая конотрункулярные пороки, аномалии дуги аорты и аномалии легочного венозного возврата[28,29,30,31]. Использование цветной допплерографии с ПЧКЗ в режиме “glass-body” может показать нормальную и аномальную анатомию сердца и магистральных сосудов плода[4]. В частности, можно продемонстрировать взаимоотношения магистральных сосудов при пороках сердца. HDlive flow и/или HDlive flow силуэт можно использовать для исследования различных пороков сердца, выявляя пространственные взаимоотношения между сердечными структурами плода[23]. Трехмерные визуализированные изображения полезны для консультирования родителей, а объем ПЧКЗ может облегчить проведение телеконсультаций[21].
4.2. Мозг плода
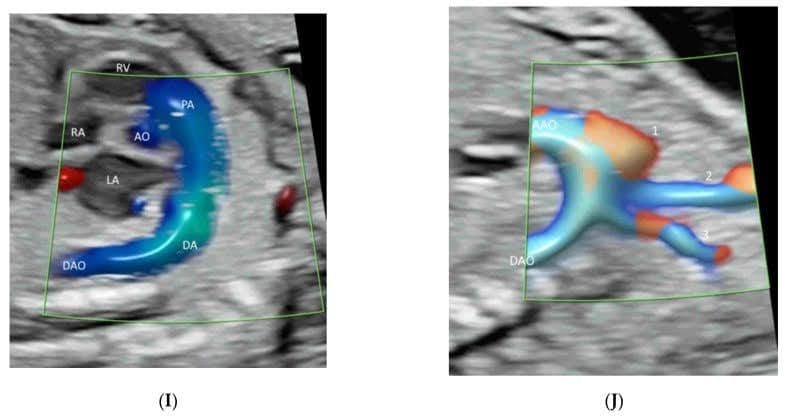
Применение ЭДИ, ВПВЧ или ВМСП в среднесагиттальной плоскости может продемонстрировать переднюю мозговую артерию и перикаллозальные артерии с их ветвями(Рисунок 5А,В). Однако, согласно рекомендациям ISUOG[12], ее роль в оценке мозолистого тела является маргинальной. В корональной плоскости через таламус кровеносные сосуды вокруг зрительной хиазмы можно увидеть близко к основанию черепа и по средней линии(Рисунок 6)[12]. ЦДИП, ВПВЧ и ВМСП могут показывать круг Виллиса в поперечной плоскости с различной степенью детализации(Рисунок 1A-C). Трансвагинальное 3D УЗИ с высоким разрешением с помощью ВПВЧ может продемонстрировать медуллярные сосуды белого вещества[32]. Использование ВМСП в поперечной плоскости может показать медленный кровоток в мелких внутричерепных сосудах и сосудах орбиты(Рисунок 7)[33]. Оценка васкуляризации головного мозга может помочь в диагностике и прогнозировании неврологического прогноза при некоторых заболеваниях центральной нервной системы[32]. Двумерная и трехмерная КДКП/ВПВЧ являются эффективными инструментами для диагностики и характеристики вены аневризматической мальформации Галена[34].
Рисунок 5
Демонстрация перикаллозальной артерии (PCA) и ее ветвей в среднесагиттальной плоскости двух нормальных плодов в 21-23 недели гестации с помощью визуализации потока высокого разрешения (A) и визуализации микрососудистого потока (B). Обратите внимание на нормальный ход ВСА вокруг мозолистого тела (СС).
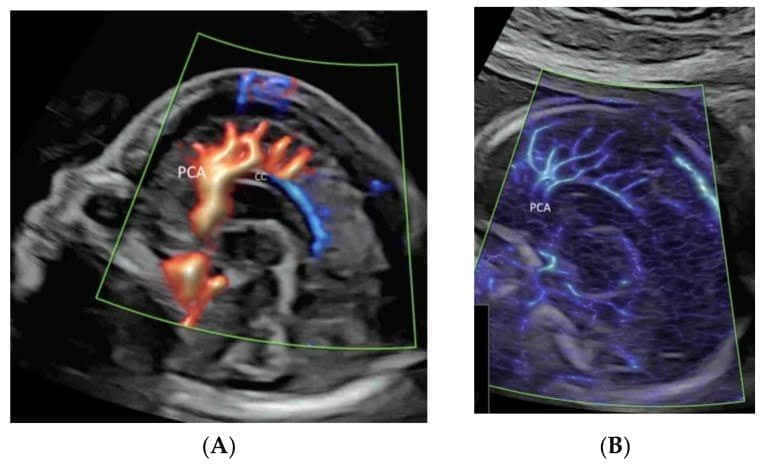
Рисунок 6
Корональное изображение в высоком разрешении через передний родничок нормального плода в 20 недель гестации показывает зрительную хиазму, Х-образную структуру в центре, окруженную супракавернозным сегментом внутренней сонной артерии (ICA) и передней мозговой артерией (ACA).
Рисунок 7
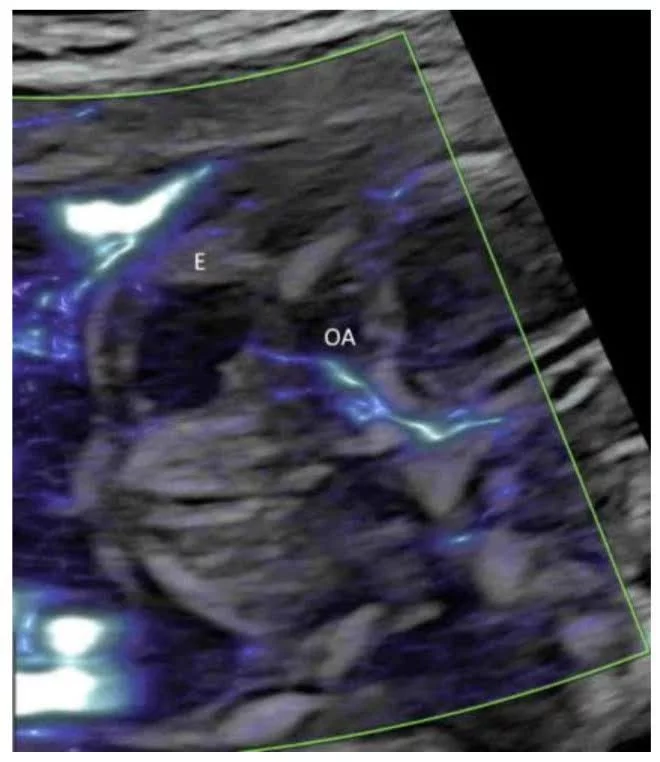
Визуализация микрососудистого кровотока в поперечном изображении нормального мозга плода в 20 недель гестации, показывающая глазную артерию (ОА). Е – глаз.
4.3. Брюшная полость и другие сосуды плода
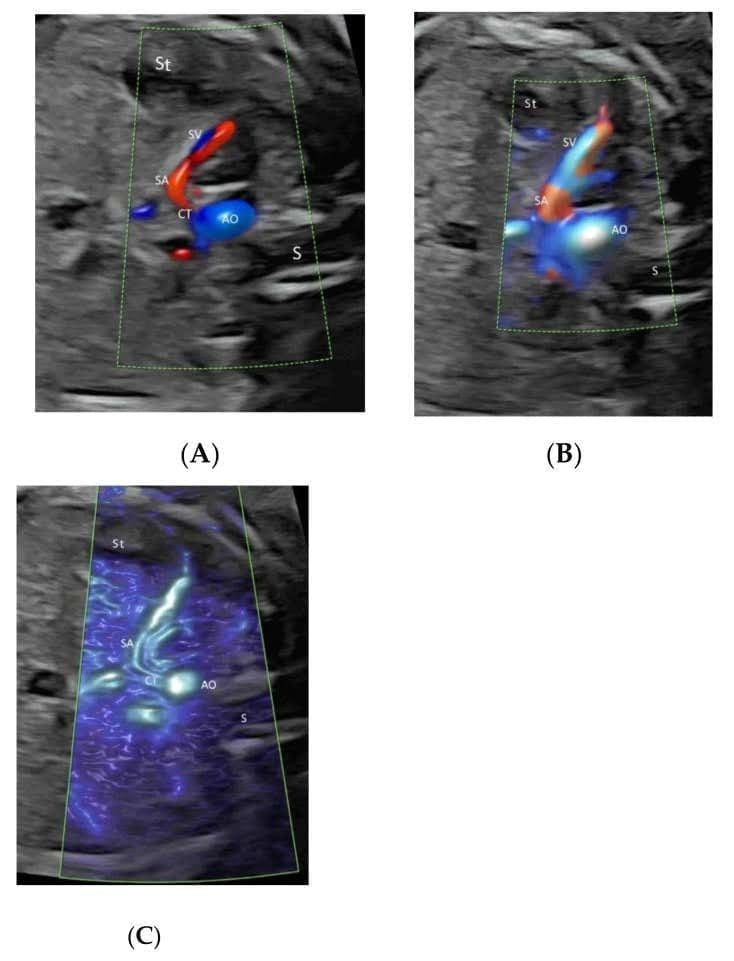
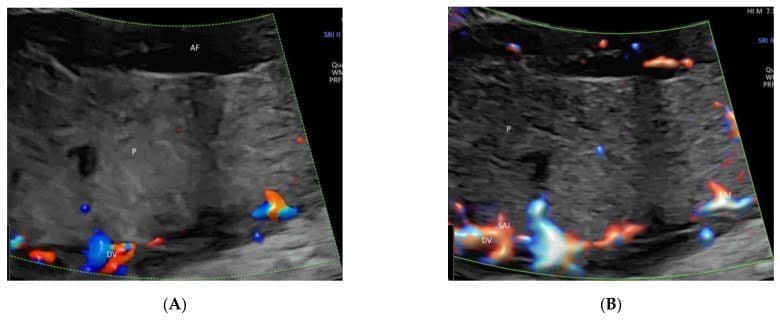
Целенаправленное исследование пупково-портальной венозной системы плода необходимо при обнаружении или подозрении на аномалию венозной системы во время измерения окружности живота плода или при обнаружении порока сердца или другой аномалии плода[35]. Систематическая оценка этой венозной системы может быть достигнута с помощью ЦДИП или ВПВЧ в двух поперечных плоскостях и одной сагиттальной плоскости, как предложено Yagel[36](Рисунок 4А и Рисунок 8А,В). Такая оценка может облегчить пренатальную диагностику венозных аномалий[36]. Использование ВПВЧ и лучевого потока помогает пренатальной диагностике аберрантного течения венозного протока[37].
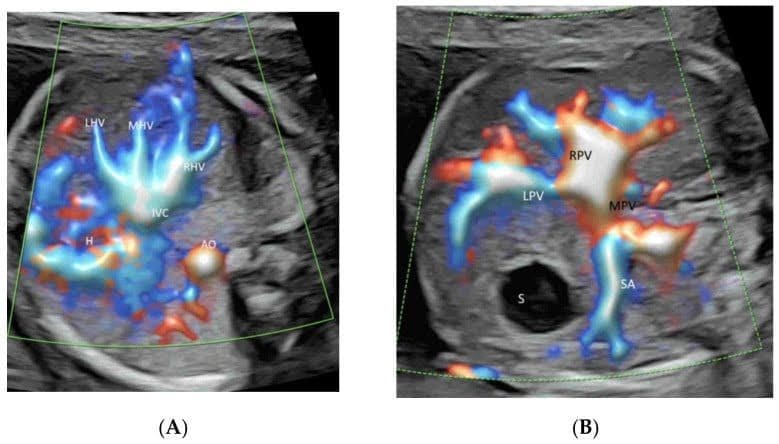
Рисунок 8
Высокочеткое потоковое изображение прекордиальной венозной системы в двух поперечных плоскостях живота нормального плода в сроке гестации 22 недели. Изображение верхней части живота плода демонстрирует нормальный “знак трезубца” левой (LHV), средней (MHV) и правой (RHV) печеночных вен, соединяющихся с нижней полой веной (IVC)(A). Обратите внимание на соединение левой воротной вены (LPV) и главной воротной вены (MPV) с правой воротной веной (RPV) на уровне желудка(B). S – желудок; аорта (Ao), селезеночная артерия (SA) и желудок (St).
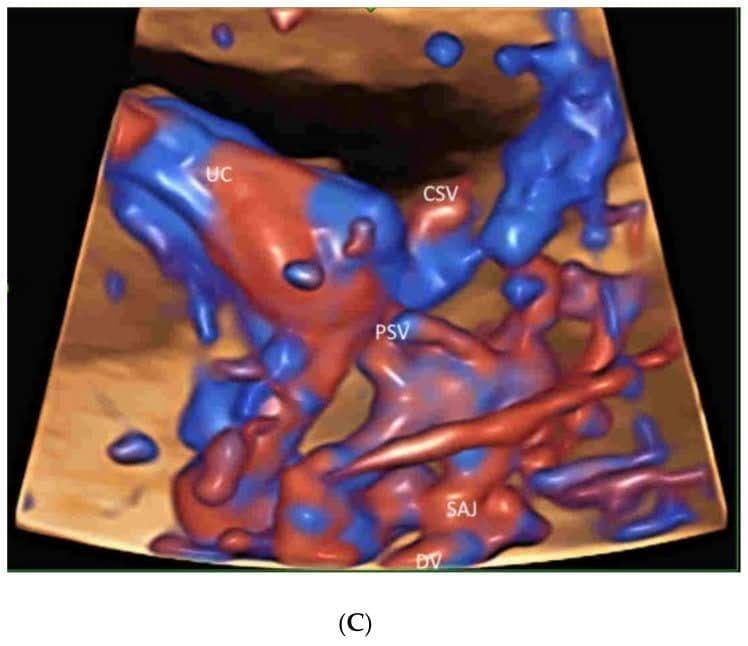
Leung KY недавно описал новый подход использования ПЧКЗ с визуализацией объема в режиме стеклянного тела и TUI для облегчения оценки этой сложной венозной системы[38](Рисунок 9). Связь печеночных вен, венозного протока и нижней полой вены с сердцем плода и их пространственные взаимоотношения можно отобразить в режиме “glass-body”. ПЧКЗ cine-петля может показать кровоток прекордиальной венозной системы в сердечном цикле с двумя различными путями к правому предсердию[38]. Нужны дальнейшие исследования, чтобы оценить, может ли этот подход улучшить пренатальную диагностику венозных аномалий.
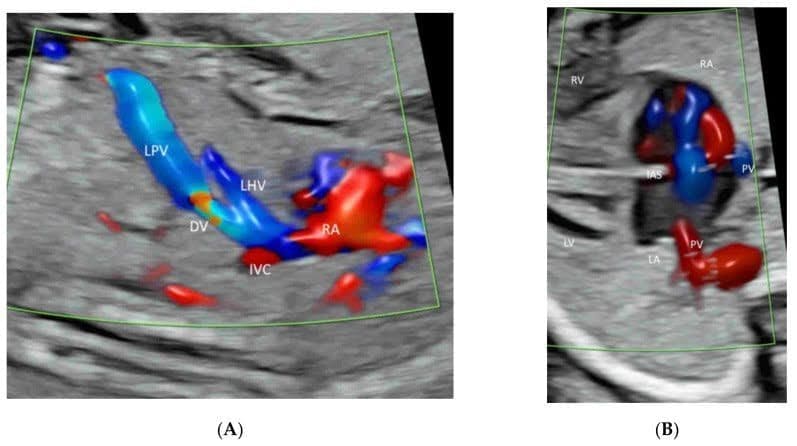
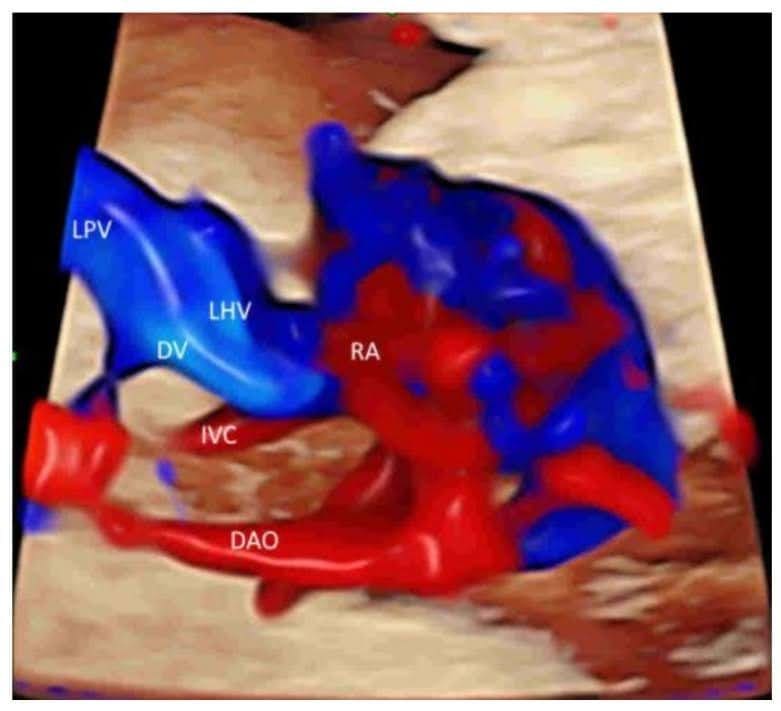
Рисунок 9
Пространственно-временное корреляционное объемное изображение в цветном допплеровском режиме, отображаемое в режиме “glass-body”, в продольном изображении нормального плода в 20 недель гестации, показывающее пупочную вену (UV), левую воротную вену (LPV), левую печеночную вену (LHV), венозный проток (DV) и нижнюю полую вену (IVC). Обратите внимание, что венозный проток (DV), который возникает из левой воротной вены (LPV), левой печеночной вены (LHV) и нижней полой вены (IVC), соединяется с поддиафрагмальным преддверием. Правое предсердие (RA), нисходящая аорта (DAO).
Для оценки количества сосудов пуповины общепринятой практикой является использование ЦДГ с низким потоком для выявления двух пуповинных артерий, которые окружают мочевой пузырь, а затем направляются к месту вставки пуповины(Рисунок 10)[39]. Это может облегчить пренатальную диагностику одной пупочной артерии.
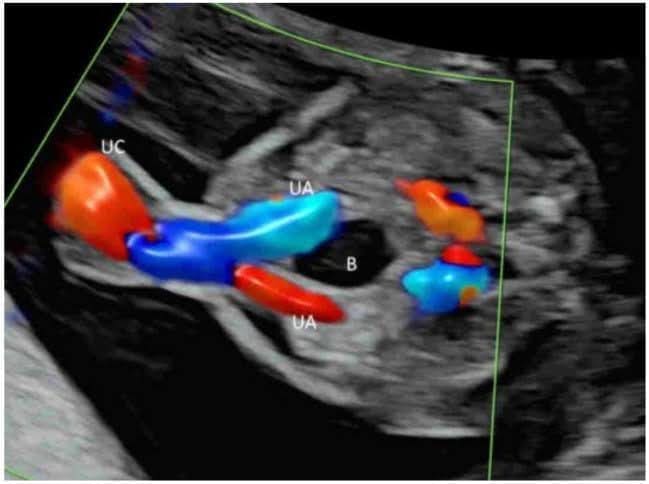
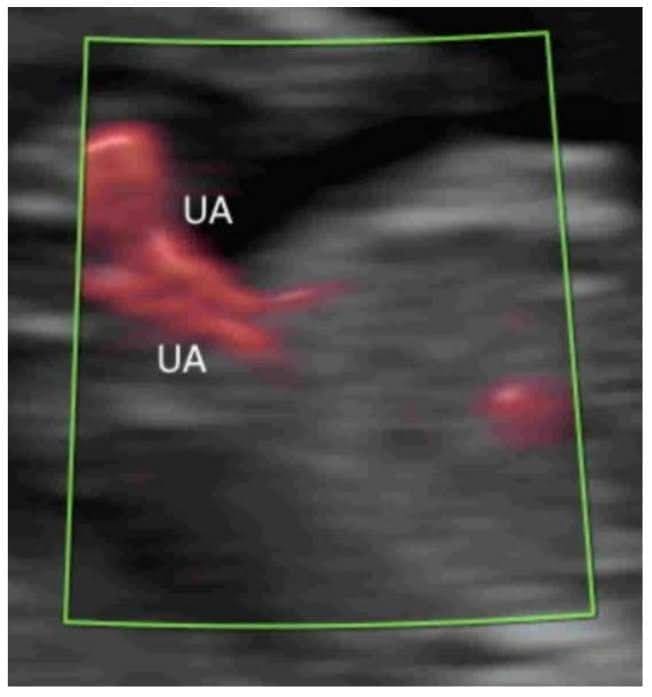
Рисунок 10
Цветная допплерография в поперечной плоскости нормального плода в 20 недель гестации показывает две пупочные артерии (UA), окружающие мочевой пузырь (B). Пуповина – пуповина – пуповина.
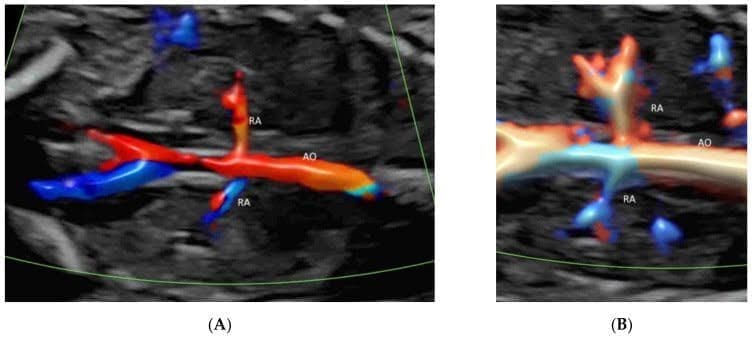
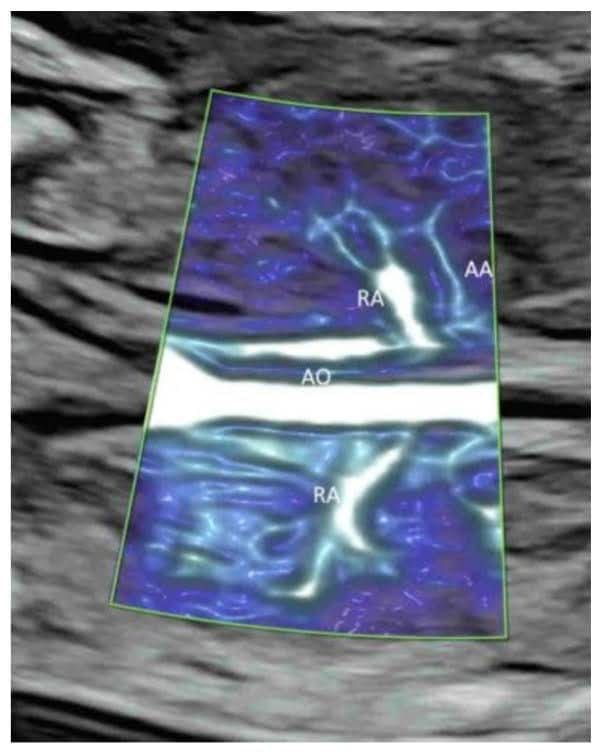
В коронарной плоскости через спину плода, непосредственно перед позвоночником, ЦДГ с низкими настройками потока показывает почечные артерии и их продолжение в почечную лоханку(Рисунок 2C и Рисунок 11A,B)[39]. ВМСП показывает сосуды от ветвей почечной артерии до периферических мелких кровеносных капилляров(Рисунок 2C)[33]. ВМСП можно использовать для подтверждения отсутствия кровотока к мультикистозной диспластической почке или отсутствующей почке[40].
Рисунок 11
Цветная допплерография(А) и изображение высокой четкости(В) потока в коронарной плоскости через спину нормального плода в 20 недель гестации показывает обе почечные артерии (RA), выходящие из аорты (AO).
ВПВЧ или ВМСП можно использовать выборочно в легких, печени, селезенке, надпочечниках и конечностях плода при обнаружении или подозрении на аномалию в этих структурах(Рисунок 12А-С)[40]. У плодов с врожденной диафрагмальной грыжей ЭДИ/ВПВЧ можно использовать для исследования сегментов легочных артерий в легком, контралатеральном к грыже, а измененный легочный ЭДИ/ВПВЧ в возрасте от 26 до 38 недель ассоциируется с неонатальной смертностью[41]. ЦДГ селезеночной артерии может помочь в пренатальной диагностике гетеротаксических синдромов[42].
Рисунок 12
Цветная допплерография(А), изображение высокой четкости(В) и микрососудистого кровотока(С) в поперечной плоскости нормального плода в 23 недели гестации, демонстрирует селезеночную артерию (SA), ветвь брыжеечного ствола (CT), отходящую от аорты (AO). St – желудок; S – позвоночник.
ЦДИП или ВПВЧ могут выявлять эмбриональные сосудистые опухоли, такие как гемангиомы печени, опухоли сосудов конечностей и крестцово-копчиковые тератомы[43,44]. При обнаружении поверхностной кистозной структуры над конечностью или телом на ультразвуковом исследовании ЦДГ полезна для оценки наличия и интенсивности сигналов кровотока в области поражения и/или наличия артериовенозных свищей[45]. В то время как гиперваскуляризация указывает на то, что поражение является гемангиомой, отсутствие кровотока в условиях низкой скорости кровотока указывает на лимфангиому[45].
Недавние исследования показали, что размер надпочечника плода в третьем триместре изменяется при задержке роста плода или гестационном сахарном диабете[46,47]. Артерия надпочечника хорошо демонстрируется при ВМСП(Рисунок 13). При обнаружении кистозного образования надпочечника на пренатальном ультразвуковом исследовании трудно дифференцировать, является ли это образование кровоизлиянием в надпочечник или кистозной нейробластомой[48]. Наличие сосудов во внешней стенке или внутренней перегородке образования свидетельствует в пользу последней[49].
Рисунок 13
Визуализация микрососудистого потока в корональной плоскости через спину нормального плода в 20 недель гестации, показывающая надпочечную артерию (АА). АО – аорта; RА – почечная артерия.
4.4. Плацента
ЦДГ полезна для оценки плацентарных озер или кист. Если на ЦДГ с низким уровнем потока нет кровотока, небольшие гипоэхогенные сосудистые озерца обычно не имеют клинического значения[50], тогда как множественные крупные плацентарные озерца ассоциируются с задержкой роста плода[51]. Наличие мультикистозных поражений с разной степенью кровотока внутри кист при ЦДГ с низким уровнем кровотока (витражный вид) и расширенными сосудами хориона свидетельствуют о мезенхимальной болезни плаценты, которая ассоциируется с неблагоприятными последствиями для матери и плода[52]. Повышенный сосудистый поток в лакунах плаценты и субплацентарная и/или маточно-вагинальная гиперваскуляризация являются признаками нарушений спектра прикрепления плаценты (PAS)[53]. Сочетание 3D УЗИ с ЭДИ и последующим мультипланарным анализом позволяет точно оценить интерфейс плацента-плодный пузырь[54]. Вопрос, является ли ВМСП полезным на ранних стадиях инвазивных патологий плаценты, требует дальнейших исследований[33]. ЦДГ полезна для пренатальной диагностики и мониторинга хорангиомы плаценты с демонстрацией питающих сосудов и васкуляризации[55].
ВМСП предоставляет новые возможности для неинвазивной характеристики микрососудистого рисунка плаценты во время беременности без контрастирования[33]. ВМСП показывает внутриплацентарные мелкие сосуды более четко, чем ЦДГ или ЭДИ[33], сохраняя при этом относительно высокую частоту кадров(Изображение 14A-C)[56]. Недавнее продольное исследование показало, что ВМСП можно использовать для оценки развития микроваскуляризации плаценты в течение нормальной беременности[57].
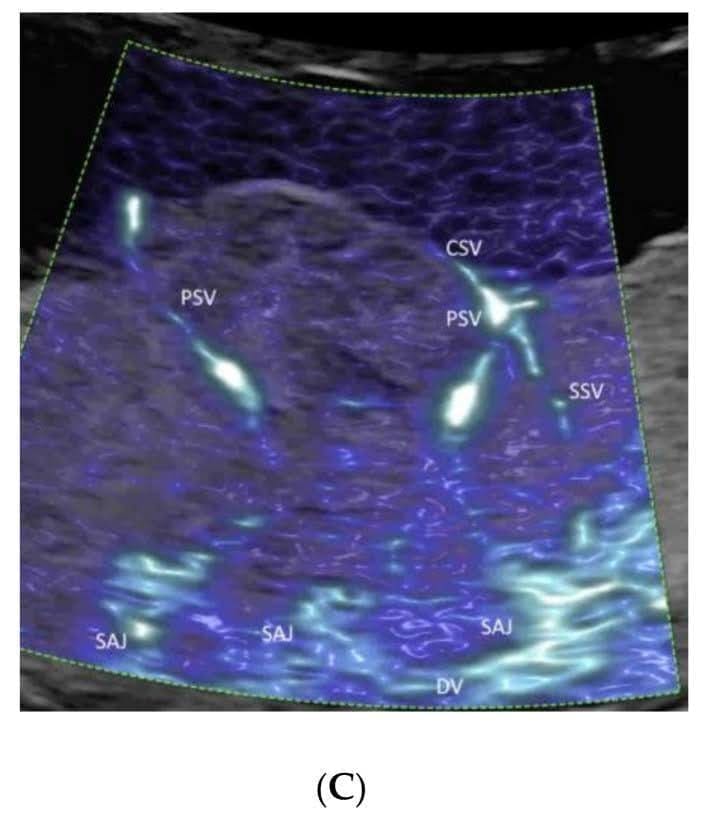
Рисунок 14
Цветная допплерография(A), изображение высокой четкости(B) и микрососудистого кровотока(C) сосудов плаценты при нормальной беременности в 23 недели гестации. Обратите внимание на демонстрацию спиральной артериальной струи (SAJ), а также первичных (PSV) и вторичных (SSV) стволовых ворсинок на изображении(C). DV – децидуальные сосуды, CSV – поверхностные сосуды хориона; AF – амниотическая жидкость.
В первом триместре беременности ВМСП может показывать первичные и вторичные стволовые ворсинчатые сосуды и струю спиральной артерии[58](Рисунок 15А). Во втором и третьем триместрах беременности на ВМСП, кроме вышеупомянутых сосудов, можно увидеть третичные стволовые ворсинчатые сосуды(Рисунок 15В)[58]. Трехмерное визуализированное изображение может показывать пространственное соотношение внутриплацентарных сосудов, поверхностных сосудов хориона и децидуальных сосудов(Рисунок 15C)[58].
Рисунок 15
Визуализация микрососудистого потока сосудов плаценты (P) в двух нормальных беременностях в сроке 13 недель (A) и 23 недели (B). Обратите внимание на демонстрацию спиральной артериальной струи (SAJ) и первичных (PSV) и вторичных (SSV) стволовых ворсинок на изображении (A). Кроме того, третичные стволовые ворсинки показаны на(В). Трехмерное ультразвуковое исследование с высоким разрешением, отображаемое в режиме “glass-body”, демонстрирует пространственное соотношение сосудов плаценты в 20 недель гестации(С). Пуповина – UC, децидуальные сосуды – DV, поверхностные сосуды хориона – CSV, околоплодные воды – AF, амниотическая жидкость – AF.
Визуализация микрососудистого потока сосудов плаценты (P) в двух нормальных беременностях в сроке 13 недель (A) и 23 недели (B). Обратите внимание на демонстрацию спиральной артериальной струи (SAJ) и первичных (PSV) и вторичных (SSV) стволовых ворсинок на изображении (A). Кроме того, третичные стволовые ворсинки показаны на(В). Трехмерное ультразвуковое исследование с высоким разрешением, отображаемое в режиме “glass-body”, демонстрирует пространственное соотношение сосудов плаценты в 20 недель гестации(С). Пуповина – UC, децидуальные сосуды – DV, поверхностные сосуды хориона – CSV, околоплодные воды – AF, амниотическая жидкость – AF.
4.5. Пуповина
Идентификация места введения пуповины в плаценту облегчается с помощью ЦДИП или ЭДИ/ВПВЧ. Веламентарное или маргинальное введение пуповины можно четко увидеть(Рисунок 16A,B). ЦДИП или ЭДИ над внутренним глазком может помочь исключить vasa previa, что является критически важной находкой[39].
Рисунок16
Цветная допплерография плаценты, демонстрирующая краевое(А) и оболочечное(В) прикрепление пуповины (UC) к плаценте (P). AF – амниотическая жидкость; CSV – поверхностные сосуды хориона; U – матка.
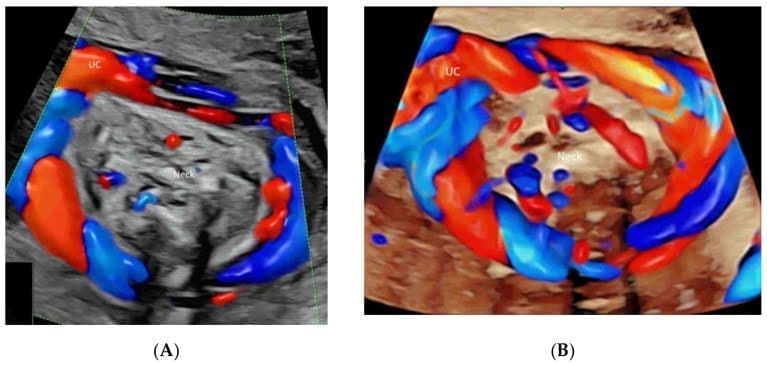
ЦДГ полезна для выявления пуповины и оценки ее характеристик, включая количество кругов обвития, направление запутывания и типы(Рисунок 17А,В)[60]. Отличить настоящий узел от ложного узла пуповины непросто. Диагноз может облегчить 3D/4D сонография с ЦДИП или ВПВЧ[61,62].
Рисунок 17
Цветная допплерография в поперечной плоскости шеи плода в сроке гестации 24 недели, демонстрирующая обвитую вокруг шеи пуповину(A). Пространственно-временная корреляция объема изображения отображается в режиме “glass-body“(B).
4.6. Первый триместр
Краткая оценка паравезикальной области с помощью ЦДГ помогает подтвердить наличие двух пупочных артерий, хотя это не является частью рутинной оценки(Рисунок 18)[8]. Для раннего выявления крупных пороков сердца добавляют ЦДИП для оценки четырехкамерного изображения сердца и путей оттока, а также кровотока через трехстворчатый клапан и в венозном протоке(Рисунок 19A-C)[63]. ВМСП может повысить разрешение изображения в В-режиме, показывая кровоток в четырех камерах сердца(Рисунок 19D) и двух путях оттока(Рисунок 19E)[20]. Включение и выключение лучевого потока может облегчить визуализацию путей оттока и четырех камер, соответственно, в первом триместре[20].
Рисунок 18
Визуализация микрососудистого кровотока в поперечной плоскости плода в 11 недель гестации, показывающая две пупочные артерии (UA).
Рисунок 19
Цветное допплеровское изображение с лучевым потоком, демонстрирующее четырехкамерный вид нормального сердца плода(А), трехсосудистую трахею(В) и венозный проток (ВВ), соединяющийся с сердцем(С), в возрасте 12-13 недель беременности. Визуализация микрососудистого кровотока сердца нормального плода в 11 недель гестации: четырехкамерный вид(D) и вид с тремя сосудами(E). RA – правое предсердие; RV – правый желудочек; LA – левое предсердие; LV – левый желудочек; PA – легочная артерия; AO – аорта; SVC – верхняя полая вена; Tr – трахея; LPV – левая воротная вена; UA – пупочная артерия; UV – пупочная вена; DAO – нисходящая аорта.
4.7. Близнецы
Сосудистые анастомозы монохориальных плацент являются основной причиной развития трансфузионного синдрома близнецов (ТСБ) и других осложнений. Недавнее исследование показало, что для выявления плацентарных анастомозов при монохориальной двойне возможно использовать 2D и 3D ультразвуковое исследование с использованием ВПВЧ в сочетании с томографической ультразвуковой визуализацией (ТУВ)[24]. Артерио-артериальные анастомозы являются поверхностными с сигналами кровотока туда и обратно во время различных частей сердечного цикла. Артерио-венозные анастомозы являются глубокими, при этом в одну дольку плаценты попадают не сопутствующие артерии и вены от двух близнецов[24]. Эти результаты интересны, поскольку разработка точного ультразвукового картирования плацентарных анастомозов является важной предпосылкой для будущей разработки неинвазивных методов лечения ТСБ[24].
Близнецовая обратная артериальная перфузия (БЗАП) характеризуется обратной артериальной перфузией через пуповину близнеца-реципиента, что демонстрируется с помощью ЦДИП или ВПВЧ[64]. При монохориальной и моноамниотической беременности двойней одним из основных осложнений является переплетение пуповины, которое можно визуализировать с помощью ЦДИП или ВПВЧ.
5. Подводные камни ЦДГ
ЦДГ подвержены ошибкам, которые обычно вызваны эффектом частичного объема, ограниченным временным и скоростным разрешением, несоответствующими углами инсоляции, алиасингом и неспособностью выявить медленный поток[65]. Такие ошибки могут привести к неправильной интерпретации нормальной или аномальной сосудистой анатомии и кровотока. Таким образом, необходима оптимизация изображения, как обсуждалось в разделе 2.
Допплеровские артефакты могут быть следствием неправильных настроек аппарата, неправильной организации исследования, реверберации от окружающих тканей или движений оператора или пациента. К распространенным артефактам относятся случайные шумы, алиасинг, движение и “цветение”. Важно распознавать, предотвращать и исправлять эти артефакты во время ЦДГ, насколько это возможно.
Хотя ЦДГ может предоставить информацию о потоке на большой площади, предоставляемая информация является ограниченной. Например, расчет объема вены аневризмы Галена должен базироваться на 3D оттенках серого, а не на 3D цветной/энергетической допплеровской визуализации[34]. Использование индексации сосудистости 3D-гистограммы, а именно индекса васкуляризации, индекса потока и индекса васкуляризация-поток, должно быть осторожным из-за низкой внутри- и межнаблюдательной надежности этих индексов, например, при оценке васкуляризации плаценты[66]. Для измерения скоростей и оценки формы волны необходимо двумерное спектральное допплеровское исследование. Кроме того, получение объема ПЧКЗ занимает от 7,5 до 12,5 с и подвержено артефактам движения. Электронно-матричный датчик – это новая технология, которая позволяет быстро получить объем ПЧКЗ с повышенным разрешением[4].
6. Особые показания к применению новых режимов ЦДГ
У беременных с задержкой роста плода или преэклампсией, или с риском их возникновения, ВМСП предоставляет новые возможности для неинвазивной характеристики микрососудистого рисунка плаценты с первого по третий триместр[33,56,57,58]. ВМСП также может быть использована для подтверждения отсутствия кровотока, в частности, при мультикистозной диспластической почке, отсутствующей почке[40] или плацентарных озерах[50,51].
Для оценки аномалий головного мозга, легких, печени, селезенки, надпочечников и конечностей плода можно использовать либо ВПВЧ, либо ВМСП для оценки их сосудистой структуры[32,33,40]. ВМСП является предпочтительным, если необходима оценка мелких сосудов или кровеносных капилляров[32,33].
При подозрении на сложные пороки сердца плода использование цветной допплерографии с ПЧКЗ в режиме “glass-body” может помочь в оценке состояния сердца и магистральных сосудов плода[28,29,30,31]. Недавно эта методика была использована для оценки прекордиальной венозной системы брюшной полости в сердечном цикле[38]. Добавление лучевого потока в ЦДГ может улучшить отображение кровотока в сердце или сложных сосудистых структурах[21].
Из соображений безопасности использование новых режимов, так же как и традиционных режимов ЦДГ, должно быть ограничено кратчайшей возможной продолжительностью для получения адекватной клинической информации с помощью одного или обоих режимов, в соответствии с принципом МДР[1]. В настоящее время новые режимы не являются широко доступными. Внедрение новых методов связано с дополнительными затратами, но они являются неинвазивными и более дешевыми по сравнению с КТ или МРТ-ангиографией. Анализ затрат и преимуществ использования новых режимов по сравнению с традиционными режимами ЦДГ требует дальнейших исследований.
7. Выводы
В отличие от предыдущих обзоров новых ультразвуковых технологий в акушерстве[67,68], этот обзор сосредоточен на характеристиках и применении новых, а также традиционных режимов ЦДГ. ВПВЧ и ВМСП, которые являются более чувствительными к маловодию и кровотоку в мелких сосудах, являются дополнением к традиционной ЦДИП. Для исследования различных плодово-плацентарных кровотоков с разной скоростью кровотока следует выбирать соответствующий режим ЦДГ. Мы выделили конкретные показания к применению новых режимов. Растет использование ВМСП для исследования микрососудистого русла плаценты. К новым или новым применениям относятся (а) ВМСП для исследования сердца плода в первом триместре, (b) ВМСП для выявления ранних стадий ПАС или отслойки плаценты, (c) ПЧКЗ с режимом “glass-body” для исследования прекордиальной венозной системы брюшной полости и (d) ВПВЧ в сочетании с ТУИ для выявления плацентарных анастомозов при монохориальной беременности двойней. Для оценки их потенциальных преимуществ необходимы дальнейшие исследования.
Ссылки на источники
- Bhide A., Acharya G., Baschat A., Bilardo C.M., Brezinka C., Cafici D., Ebbing C., Hernandez-Andrade E., Kalache K., Kingdom J., et al. ISUOG Practice Guidelines (updated): Use of Doppler velocimetry in obstetrics. Ultrasound Obstet. Gynecol. 2021;58:331–339. doi: 10.1002/uog.23698.
- Sepulveda W., Rojas I., Robert J.A., Schnapp C., Alcalde J.L. Prenatal detection of velamentous insertion of the umbilical cord: A prospective color Doppler ultrasound study. Ultrasound Obstet. Gynecol. 2003;21:564–569. doi: 10.1002/uog.132.
- Wiechec M., Knafel A., Nocun A. Prenatal detection of congenital heart defects at the 11- to 13-week scan using a simple color Doppler protocol including the 4-chamber and 3-vessel and trachea views. J. Ultrasound Med. 2015;34:585–594. doi: 10.7863/ultra.34.4.585.
- Chaoui R., Abuhamad A., Martins J., Heling K.S. Recent development in three and four dimension fetal echocardiography. Fetal Diagn. Ther. 2020;47:345–353. doi: 10.1159/000500454.
- Nadel A.S. Addition of color Doppler to the routine obstetric sonographic survey aids in the detection of pulmonic stenosis. Fetal Diagn. Ther. 2010;28:175–179. doi: 10.1159/000318192.
- Grosvenor A., Silver R., Porter T.F., Zempolich K. Optimal management of placenta accreta. Am. J. Obstet. Gynecol. 2006;195:S82. doi: 10.1016/j.ajog.2006.10.261.
- Committee on Obstetric Practice Committee opinion no. 529: Placenta accreta. Obstet. Gynecol. 2012;120:207–211. doi: 10.1097/AOG.0b013e318262e340.
- Salomon L.J., Alfirevic Z., Bilardo C.M., Chalouhi G.E., Ghi T., Kagan K.O., Lau T.K., Papageorghiou A.T., Raine-Fenning N.J., Stirnemann J., et al. ISUOG Practice Guidelines: Performance of first-trimester fetal ultrasound scan. Ultrasound Obstet. Gynecol. 2013;41:102–113.
- Syngelaki A., Hammami A., Bower S., Zidere V., Akolekar R., Nicolaides K.H. Diagnosis of fetal non-chromosomal abnormalities on routine ultrasound examination at 11–13 weeks’ gestation. Ultrasound Obstet. Gynecol. 2019;54:468–476. doi: 10.1002/uog.20844.
- Anonymous. AIUM Practice Parameter for the Performance of Detailed Second- and Third-Trimester Diagnostic Obstetric Ultrasound Examinations. J. Ultrasound Med. 2019;38:3093–3100. doi: 10.1002/jum.15163.
- Anonymous. AIUM Practice Parameter for the Performance of Fetal Echocardiography. J. Ultrasound Med. 2020;39:E5–E16.
- Paladini D., Malinger G., Birnbaum R., Monteagudo A., Pilu G., Salomon L.J., Timor-Tritsch I.E. ISUOG Practice Guidelines (updated): Sonographic examination of the fetal central nervous system. Part 2: Performance of targeted neurosonography. Ultrasound Obstet. Gynecol. 2021;57:661–671. doi: 10.1002/uog.23616.
- International Society of Ultrasound in Obstetrics and Gynecology. Carvalho J.S., Allan L.D., Chaoui R., Copel J.A., DeVore G.R., Hecher K., Lee W., Munoz H., Paladini D., et al. ISUOG Practice Guidelines (updated): Sonographic screening examination of the fetal heart. Ultrasound Obstet. Gynecol. 2013;41:348–359. doi: 10.1002/uog.12403.
- Wang Z., Tyson M., Casey C. LV Function Evaluation Using LV eFlow. White paper, Hitachi Aloka Medical America. [(accessed on 15 December 2021)]. Available online: http://www.hitachi-aloka.com/assets/pdf/white-paper-LV-eFlow%20pdf
- Wu G., Xie T.R., Dimaano M.M., Alghrouz M.I., Ahmad M. High-definition blood flow imaging in the assessment of left ventricular function: Initial experience and comparison with contrast echocardiography. Echocardiography. 2019;36:546–557. doi: 10.1111/echo.14282.
- Karaca L., Oral A., Kantarci M., Sade R., Ogul H., Bayraktutan U., Okur A., Yüce I. Comparison of the superb microvascular imaging technique and the color Doppler techniques for evaluating children’s testicular blood flow. Eur. Rev. Med. Pharmacol. Sci. 2016;20:1947–1953.
- Wu L., Yen H.H., Soon M.S. Spoke-wheel sign of focal nodular hyperplasia revealed by superb micro-vascular ultrasound imaging. QJM Int. J. Med. 2015;108:669–670. doi: 10.1093/qjmed/hcv016.
- Ma Y., Li G., Li J., Ren W.D. The diagnostic value of superb microvascular imaging (SMI) in detecting blood flow signals of breast lesions. Medicine. 2015;94:e1502. doi: 10.1097/MD.0000000000001502.
- Ishikawa M., Ota Y., Nagai M., Kusaka G., Tanaka Y., Naritaka H. Ultrasonography monitoring with superb microvascular imaging technique in brain tumor surgery. World Neurosurg. 2017;97:749.e11–749.e20. doi: 10.1016/j.wneu.2016.10.111.
- Athanasopoulos N., Seale A.N., Kilby M.D. SlowflowHD for the Examination of the Fetal Heart in the First Trimester. [(accessed on 15 December 2021)]. Available online: https://www.womens-health.net/img/first-trimester/SlowFlow_HD_Whitepaper_JB83959XXf_v9.pdf
- Wang Y., Zhang Y. Fetal Vascular Rings and Pulmonary Slings: Strategies for Two- and Three- Dimensional Echocardiographic Diagnosis. J. Am. Soc. Echocardiogr. 2021;34:336–351. doi: 10.1016/j.echo.2020.10.013.
- Gindes L., Pretorius L.H., Romine L.E., Kfir M., D’Agostini D., Hull A., Achiron R. Three-Dimensional Ultrasonographic Depiction of Fetal Abdominal Blood Vessels. J. Ultrasound Med. 2009;28:977–988. doi: 10.7863/jum.2009.28.8.977.
- Ito M., AboEllail M.A.M., Yamamoto K., Kanenishi K., Tanaka H., Masaoka H., Hata T. HDlive Flow silhouette mode and spatiotemporal image correlation for diagnosing congenital heart disease. Ultrasound Obstet. Gynecol. 2017;50:411–415. doi: 10.1002/uog.17519.
- Sun W., Chen L.Z., Yin S.W., Cai A.L., Yang Z.Y. Non-invasive dynamic observation of placental vascular anastomoses in monochorionic twins: Assessment using three-dimensional sonography combined with tomographic ultrasound imaging. Placenta. 2020;95:84–90. doi: 10.1016/j.placenta.2020.04.015.
- Paladini D. Sonography in obese and overweight pregnant women: Clinical, medicolegal and technical issues. Ultrasound Obstet. Gynecol. 2009;33:720–729. doi: 10.1002/uog.6393.
- Del Bianco A., Russo S., Lacerenza N., Rinaldi M., Rinaldi G., Nappi L., Greco P. Four chamber view plus three-vessel and trachea view for a complete evaluation of the fetal heart during the second trimester. J. Perinat. Med. 2006;34:309–312. doi: 10.1515/JPM.2006.059.
- He Y.H., Liu K., Gu X.Y., Zhang Y., Han J.C., Liu X.W., Li Z.A. The application of high definition flow imaging in fetal hemodynamics. Clin. Exp. Obstet. Gynecol. 2015;42:11–17.
- Molina F.S., Faro C., Sotiriadis A., Dagklis T., Nicolaides K.H. Heart stroke volume and cardiac output by four-dimensional ultrasound in normal fetuses. Ultrasound Obstet. Gynecol. 2008;32:181–187. doi: 10.1002/uog.5374.
- Paladini D., Volpe P., Sglavo G., Vassallo M., De Robertis V., Marasini M., Russo M.G. Transposition of the great arteries in the fetus: Assessment of the spatial relationships of the arterial trunks by four-dimensional echocardiography. Ultrasound Obstet. Gynecol. 2008;31:271–276. doi: 10.1002/uog.5276.
- Volpe P., Campobasso G., De Robertis V., Di Paolo S., Caruso G., Stanziano A., Volpe N., Gentile M. Two- and four-dimensional echocardiography with B-flow imaging and spatiotemporal image correlation in prenatal diagnosis of isolated total anomalous pulmonary venous connection. Ultrasound Obstet. Gynecol. 2007;30:830–837. doi: 10.1002/uog.5145.
- Volpe P., Tuo G., De Robertis V., Campobasso G., Marasini M., Tempesta A., Gentile M., Rembouskos G. Fetal interrupted aortic arch: 2D-4D echocardiography, associations and outcome. Ultrasound Obstet. Gynecol. 2010;35:302–309. doi: 10.1002/uog.7530.
- Pooh R.K. Normal anatomy by three-dimensional ultrasound in the second and third trimesters. Semin. Fetal Neonatal Med. 2012;17:269–277. doi: 10.1016/j.siny.2012.06.003.
- Hasegawa J., Yamada H., Kawasaki E., Matsumoto T., Takahashi S., Suzuki N. Application of superb micro-vascular imaging (SMI) in obstetrics. J. Matern. Fetal Neonatal Med. 2018;31:261–263. doi: 10.1080/14767058.2016.1278206.
- Paladini D., Deloison B., Rossi A., Chalouhi G.E., Gandolfo C., Sonigo P., Buratti S., Millischer A.E., Tuo G., Ville Y., et al. Vein of Galen aneurysmal malformation (VGAM) in the fetus: Retrospective analysis of perinatal prognostic indicators in a two-center series of 49 cases. Ultrasound Obstet. Gynecol. 2017;50:192–199. doi: 10.1002/uog.17224.
- Yagel S., Cohen S.M., Valsky D.V., Shen O., Lipschuetz M., Messing B. Systematic examination of the fetal abdominal precordial veins: A cohort study. Ultrasound Obstet. Gynecol. 2015;45:578–583. doi: 10.1002/uog.13444.
- Yagel S., Cohen S.M., Valsky D.V. Simplifying imaging of the abdominal fetal precordial venous system. Ultrasound Obstet. Gynecol. 2019;53:571–575. doi: 10.1002/uog.19053.
- Wang Y., Zhang Y., Wang M. Prenatal diagnosis of an aberrant ductus venosus draining into the coronary sinus using two- and three-dimensional echocardiography: A case report. BMC Pregnancy Childbirth. 2021;21:392. doi: 10.1186/s12884-021-03870-x.
- Leung K.Y. Imaging of fetal precordial venous system by four-dimensional ultrasound with spatiotemporal image correlation technology. J. Clin. Ultrasound. 2021 doi: 10.1002/jcu.23111.
- Bethune M., Alibrahim E., Davies B., Yong E. A pictorial guide for the second trimester ultrasound. Australas. J. Ultrasound Med. 2013;16:98–113. doi: 10.1002/j.2205-0140.2013.tb00106.x.
- Aboellail M.A., Ito M., Hata T., Kanenishi K., Mori N., Nitta E., Miyake T. Advances in Color Doppler in Obstetrics. J. South Asian Fed. Obstet. Gynecol. 2019;11:1–12. doi: 10.5005/jp-journals-10006-1641.
- Sepulveda W., Sepulveda F., Corral E., Gutierrez J. Giant hepatic hemangioma in the fetus: Case reports and updated review of the literature. J. Matern. Fetal Neonatal Med. 2021;34:2554–2566. doi: 10.1080/14767058.2019.1669555.
- Abuhamad A.Z., Robinson J.N., Bogdan D., Tannous R.J. Color Doppler of the splenic artery in the prenatal diagnosis of heterotaxic syndromes. Am. J. Perinatol. 1999;16:0469–0474. doi: 10.1055/s-1999-6806.
- Tenkumo C., Hanaoka U., AboEllail M.A.M., Ishimura M., Morine M., Maeda K., Hata T. HDlive Flow with HDlive silhouette mode in diagnosis of fetal hepatic hemangioma. Ultrasound Obstet. Gynecol. 2017;49:541–542. doi: 10.1002/uog.16215.
- Gucciardo L., Uyttebroek A., De Wever I., Renard M., Claus F., Devlieger R., Lewi L., De Catte L., Deprest J. Prenatal assessment and management of sacrococcygeal teratoma. Prenat. Diagn. 2011;31:678–688. doi: 10.1002/pd.2781.
- Ivanitskaya O., Andreeva E., Odegova N. Prenatal diagnosis of Klippel-Trenaunay syndrome: Series of four cases and review of the literature. Ultrasound. 2020;28:91–102. doi: 10.1177/1742271X19880327.
- Garcia-Flores J., Cruceyra M., Cañamares M., Garicano A., Espada M., Nieto O., Tamarit I., de la Cuesta R.S. Sonographic Evaluation of Fetal Adrenal Gland in Gestational Diabetes: Relation to Fetal Growth and Maternal Biochemical Markers. J. Ultrasound Med. 2017;36:999–1007. doi: 10.7863/ultra.16.03005.
- Mohajeri Z.F., Aalipour S., Sheikh M., Shafaat M., Hantoushzadeh S., Borna S., Khazardoost S. Ultrasound measurement of fetal adrenal gland in fetuses with intrauterine growth restriction, an early predictive method for adverse outcomes. J. Matern. Fetal Neonatal Med. 2019;32:1485–1491. doi: 10.1080/14767058.2017.1410125.
- De Luca J., Rousseau T., Durand C., Sagot P., Sapin E. Diagnostic and therapeutic dilemma with large prenatally detected cystic adrenal masses. Fetal Diagn. Ther. 2002;17:11–16. doi: 10.1159/000047998.
- Eo H., Kim J.H., Jang K.M., Yoo S.Y., Lim G.Y., Kim M.J., Kim O.H. Comparison of Clinico-Radiological Features between Congenital Cystic Neuroblastoma and Neonatal Adrenal Hemorrhagic Pseudocyst. Korean J. Radiol. 2011;12:52–58. doi: 10.3348/kjr.2011.12.1.52.
- Thompson M.O., Vines S.K., Aquilina J., Wathen N.C., Harrington K. Are placental lakes of any clinical significance? Placenta. 2002;23:685–690. doi: 10.1053/plac.2002.0837.
- Schiffer V., van Haren A., De Cubber L., Bons J., Coumans A., van Kuijk S.M., Spaanderman M., Al-Nasiry S. Ultrasound evaluation of the placenta in healthy and placental syndrome pregnancies: A systematic review. Eur. J. Obstet. Gynecol. Reprod. Biol. 2021;262:45–56. doi: 10.1016/j.ejogrb.2021.04.042.
- Colpaert R.M., Ramseyer A.M., Luu T., Quick C.M., Frye L.T., Magann E.F. Diagnosis and Management of Placental Mesenchymal Disease. A Review of the Literature. Obstet. Gynecol. Surv. 2019;74:611–622.
- Pagani G., Cali G., Acharya G., Trisch I.T., Palacios-Jaraquemada J., Familiari A., Buca D., Manzoli L., Flacco M.E., Fanfani F., et al. Diagnostic accuracy of ultrasound in detecting the severity of abnormally invasive placentation: A systematic review and meta-analysis. Acta Obstet. Gynecol. Scand. 2018;97:25–37. doi: 10.1111/aogs.13238.
- Calì G., Foti F., Minneci G. 3D power Doppler in the evaluation of abnormally invasive placenta. J. Perinat. Med. 2017;45:701–709. doi: 10.1515/jpm-2016-0387.
- Amer H.Z.M., Heller D.S. Chorangioma and related vascular lesions of the placenta–A review. Fetal Pediatr. Pathol. 2010;29:199–206. doi: 10.3109/15513815.2010.487009.
- Mack L.M., Mastrobattista J.M., Gandhi R., Castro E.C., Burgess A.P.H., Lee W. Characterization of Placental Microvasculature Using Superb Microvascular Imaging. J. Ultrasound Med. 2019;38:2485–2491. doi: 10.1002/jum.14919.
- Sainz J.A., Carrera J., Borrero C., García-Mejido J.A., Fernández-Palacín A., Robles A., Sosa F., Arroyo E. Study of the Development of Placental Microvascularity by Doppler SMI (Superb Microvascular Imaging): A Reality Today. Ultrasound Med. Biol. 2020;46:3257–3267. doi: 10.1016/j.ultrasmedbio.2020.08.017.
- Hata T., Kanenishi K., Yamamoto K., AboEllail M.A.M., Mashima M., Mori N. Microvascular imaging of thick placenta with fetal growth restriction. Ultrasound Obstet. Gynecol. 2018;51:837–839. doi: 10.1002/uog.18837.
- García-Jiménez R., Arroyo E., Borrero C., Garcia-Mejido J.A., Sosa F., Fernández-Palacín A., Sainz J.A. Evaluation of Placental Micro-vascularization by Superb Micro-vascular Imaging Doppler in Cases of Intra-uterine Growth Restriction: A First Step. Ultrasound Med. Biol. 2021;47:1631–1636. doi: 10.1016/j.ultrasmedbio.2021.01.029.
- Chen Y.H., Liu X., Xu C.M., Yan S.P., Hu Q., Long F.W., Qin G.C. Standardization of diagnosis for coiling of the umbilical cord around fetal neck by ultrasound. Int. J. Gynecol. Obstet. 2019;147:96–101. doi: 10.1002/ijgo.12909.
- Abuhamad A. Three-dimensional ultrasound with color Doppler imaging of an umbilical cord true knot. Ultrasound Obstet. Gynecol. 2014;43:360. doi: 10.1002/uog.13297.
- Hasbun J., Alcalde J.L., Sepulveda W. Three-dimensional power Doppler sonography in the prenatal diagnosis of a true knot of the umbilical cord: Value and limitations. J. Ultrasound Med. 2007;26:1215–1220. doi: 10.7863/jum.2007.26.9.1215.
- Minnella G.P., Crupano F.M., Syngelaki A., Zidere V., Akolekar R., Nicolaides K.H. Diagnosis of major heart defects by routine first-trimester ultrasound examination: Association with increased nuchal translucency, tricuspid regurgitation and abnormal flow in ductus venosus. Ultrasound Obstet. Gynecol. 2020;55:637–644. doi: 10.1002/uog.21956.
- Wong A.E., Sepulveda W. Acardiac anomaly: Current issues in prenatal assessment and treatment. Prenat. Diagn. 2005;25:796–806. doi: 10.1002/pd.1269.
- Winkler P., Helmke K., Mahl M. Major pitfalls in doppler investigations. Pediatr. Radiol. 1990;20:304–310. doi: 10.1007/BF02013161.
- Martins W., Lima J.C., Welsh A.W., Araujo E., Miyague A.H., Filho F.M., Raine-Fenning N.J. Three-dimensional Doppler evaluation of single spherical samples from the placenta: Intra- and interobserver reliability. Ultrasound Obstet. Gynecol. 2012;40:200–206. doi: 10.1002/uog.11076.
- Abramowicz J.S. Obstetric ultrasound: Where are we and where are we going? Ultrasonography. 2021;40:57–74. doi: 10.14366/usg.20088.
- Leung K.Y. Applications of advanced ultrasound technology in obstetrics. Diagnostics. 2021;11:1217. doi: 10.3390/diagnostics11071217.