Резюме
Хорангіокарцинома – дуже рідкісне і часто помилково діагностоване новоутворення плаценти. Унікальні морфологічні особливості ураження відрізняють її від інших трофобластичних пухлин та судинних аномалій. Ми представляємо систематичний огляд літератури, щоб внести ясність щодо сутності та біології хорангіокарциноми. Пошук літератури проводився в грудні 2022 року за ключовими словами ” Плацентарна хорангіокарцинома”, “хоріонангіома”, “плацента” та “проліферація трофобласту”. Статті, опубліковані з 1988 по 2022 рік, були отримані зі Scopus, Google Scholar та PUBMED. У нашому огляді ми вивчали вік матері, термін вагітності на момент пологів, перенесені пологи, тип вагітності, масу плаценти, ультразвукові особливості плаценти, макроскопічне дослідження і розмір пухлини, мікроскопічне дослідження, імуногістохімію, материнський бета-хоріонічний гонадотропін людини, результат для плода і матері. Було виявлено вісім рукописів. Всі вони є звітами про випадки захворювання. Макроскопічна характеристика уражень була представлена наявністю добре відмежованого круглого вузла сіро-жовто-білого кольору. Мікроскопічно всі автори описали такі типові ознаки злоякісності, як висока швидкість мітозу, ядерна атипія та некротичні ділянки. У деяких випадках повідомлялося про наявність цитоплазматичної позитивності AE1/AE3, забарвлення ядер p63 і бета-хоріонічного гонадотропіну людини (ХГЛ). Повідомлялося про сприятливий прогноз для плода у всіх випадках новонароджених з нормальною вагою при народженні, за винятком одного випадку із затримкою внутрішньоутробного розвитку плода. Результат для матері був сприятливим у всіх випадках, за винятком одного випадку з метастазами в легенях матері через три місяці після пологів. Клінічний перебіг, ймовірно, недооцінює реальну частоту цієї патології. Лише глибші знання її гістології та клінічного перебігу дозволять нам оцінити реальну поширеність захворювання.
Ключові слова: хорангіокарцинома; плацента; проліферація трофобласту; хоріонангіома
1. Вступ
Відповідно до класифікації уражень плаценти, фетальні стромально-судинні ураження охоплюють підгрупу станів розвитку, таких як затримка дозрівання ворсин хоріона, ураження ворсинчастих капілярів (хорангіома, хорангіоз, хорангіоматоз, мультифокальний хорангіоматоз) та дисморфічні ворсинки (що нагадують ознаки, які спостерігаються при анеуплоїдній вагітності), які можуть негативно впливати на матір та плід під час вагітності [1,2,3,4]. З іншого боку, трофобластичні пухлини охоплюють доброякісні або передзлоякісні пухлини (такі як гідатидіформна родимка, вузлик плацентарної ділянки, аномальне збільшення плацентарної ділянки), а також злоякісні ураження (такі як хоріокарцинома, пухлина плацентарної ділянки, інвазивна родимка) [3].
Хорангіокарцинома є дуже рідкісним і помилково діагностованим [5] новоутворенням плаценти, про яке в літературі описано лише сім випадків. Унікальні морфологічні особливості ураження відрізняють його від інших трофобластичних пухлин і судинних аномалій, і, схоже, воно характеризується аномальною трофобластичною проліферацією, пов’язаною з гіперваскулярним хорангіозом в стромі ворсин хоріона. Етіологія та патогенез ураження досі не визначені. У той час як патогенез відомих уражень капілярів ворсин хоріону пов’язаний з надмірною експресією судинних факторів росту внаслідок хронічного гіпоксичного ураження [6,7,8], немає різниці між рівнем експресії ангіогенних факторів (фактор росту судинного ендотелію, основний фактор росту фібробластів, Ang-1 і Ang-2, а також тромбоцитарний фактор росту) в хорангіокарциномі і нормальних ворсинах. Лише в одному випадку повідомлялося про аномалію в плаценті при дихоріальній вагітності двійнею [9].
У цій статті ми представляємо систематичний огляд літератури, щоб внести ясність щодо сутності та біології хорангіокарциноми. По-друге, ми хочемо довести гіпотезу, висунуту Khong [5], згідно з якою частота хорангіокарциноми є вищою, ніж це випливає з небагатьох повідомлень про випадки захворювання в літературі, і це пов’язано зі складністю її діагностики.
2. Матеріали та методи
Це дослідження було схвалено Інституційною наглядовою радою IRCCS Бурло Гарофоло, Трієст, Італія. (RC 08/2022).
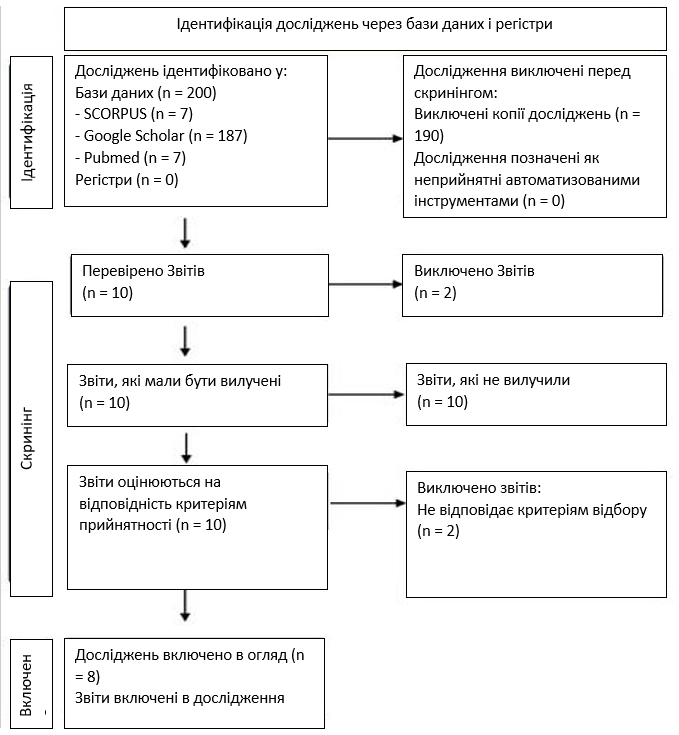
У грудні 2022 року було проведено пошук наукової літератури за ключовими словами “Плацентарна хорангіокарцинома”, “Хоріонангіома”, “Плацента” та “Проліферація трофобласту”. Статті, опубліковані з 1988 по 2022 рік, були отримані зі Scopus, Google Scholar та PUBMED. У нашому огляді ми проаналізували вік матері, термін вагітності на момент пологів, кількість пологів, тип вагітності (одноплідна/двійня), масу плаценти, ультразвукові характеристики плаценти, макроскопічне дослідження та розмір пухлини, мікроскопічне дослідження, імуногістохімію, рівень бета-хоріонічного гонадотропіну людини у матері (базальний та при подальшому спостереженні), результат для плода та матері, а також подальше спостереження за патологією. Ми виключили з огляду всі роботи, які стосувалися випадків поодинокої хоріонангіоми або поодинокої трофобластичної проліферації. Також були виключені статті, що не мають відношення до теми. Всі знайдені дослідження були перевірені за роком, цитуванням, назвою, авторами, анотаціями та повними текстами. Дублікати були виявлені за допомогою ручного скринінгу, виконаного двома дослідниками, а потім видалені. При цьому дотримувалися рекомендацій PRISMA [10]. Блок-схема процесу відбору за стандартом PRISMA представлена на зображенні 1. Систематичний огляд не був поданий до Prospero [11], оскільки в літературі було знайдено лише обмежену кількість повідомлень про випадки захворювання. Три автори незалежно проаналізували назви та реферати всіх робіт, що не дублюються, і виключили ті, що не стосуються теми. Ці ж три автори незалежно переглянули повний текст статей, які пройшли перший скринінг, і визначили ті, які повинні бути включені в огляд. Розбіжності вирішувалися шляхом пошуку консенсусу між дослідниками. У зв’язку з рідкісністю цієї патології, всі включені дослідження – це звіти про клінічні випадки. З цієї причини ми представляємо дані в описовій формі. Включення в огляд лише звітів про клінічні випадки створює ризик упередженості. Для оцінки методологічної якості включених досліджень ми використовували контрольний список Інституту Джоанни Бріггс (Joanna Briggs Institute, JBI) [12] для критичної оцінки клінічних випадків (табл. 1).
Зображення 1. Структурна схема PRISMA.
Таблиця 1. Контрольний список критичної оцінки JBI для оглядів
| Автор, рік | Тип дослідження | D1 | D2 | D3 | D4 | D5 | D6 | D7 | D8 |
| Jauniaux та співавт.
(1988) [13] Placenta |
Звіт про клінічний випадок | ||||||||
| Trask C. та співавт.
(1994) [9] Int J Gynecol Pathol |
Звіт про клінічний випадок | Немає застосування | |||||||
| Ariel I. та співавт.
(2009) [14] Int J Gynecol Pathol |
Звіт про клінічний випадок | Немає застосування | |||||||
| Guschmann M. та співавт..
(2003) [8] Pathologe |
Звіт про клінічний випадок | Незрозуміло | Незрозуміло | ||||||
| Faes T. та співавт.
(2012) [7] Placenta |
Звіт про клінічний випадок | ||||||||
| Huang B.та співавт.
(2015) [15] Int J Clin Exp Med |
Звіт про клінічний випадок | Немає застосування | |||||||
| Garcìa-Molina F. та співавт.
(2016) [16] Patalogìa |
Звіт про клінічний випадок | Немає застосування | Незрозуміло | ||||||
| Sagar N. та співавт.
(2021) [17] Turk Patoloji Derg |
Звіт про клінічний випадок | Немає застосування | Незрозуміло |
Контрольний список критичної оцінки JBI для звітів про клінічні випадки. D1. Чи були чітко описані демографічні характеристики пацієнтів? D2. Чи була історія хвороби пацієнта чітко описана і представлена у вигляді хронології? D3. Чи був чітко описаний поточний клінічний стан пацієнта на момент звернення? D4. Чи були чітко описані діагностичні тести або методи оцінки та їх результати? D5. Чи було чітко описано інтервенцію (інтервенції) або процедуру (процедури) лікування? D6. Чи був чітко описаний клінічний стан після інтервенції? D7. Чи були ідентифіковані та описані несприятливі події (шкода) або непередбачувані події? D8. Чи містить звіт про клінічний випадок висновки, які можна взяти на озброєння?
3. Результати
Ми ідентифікували 200 рукописів. Записів, знайдених за допомогою пошуку в базах даних, було 7 з Pubmed, 7 з Scopus, 187 з Google Scholar. Записів, виключених за критеріями відбору та дублікатів, було n = 190. Ми знайшли десять опублікованих випадків хорангіокарциноми. Одна серія випадків була виключена, оскільки містила неповні клінічні дані (патологоанатомічні дані). Таким чином, залишилося ще вісім випадків (див. зображення 1). Всі вони були звітами про клінічні випадки [Таблиця 2]. У нашому аналізі середній вік жінок з патологією становив 32 роки, середній термін вагітності на момент пологів – 36,4 тижнів, і в 75% випадків жінки мали принаймні одну попередню вагітність. Вагітності були переважно одноплідними, за винятком двох багатоплідних дихоріально-діамніотичних вагітностей. Середня вага плаценти становила 559,8 г. Підозра на патологію плаценти при ультразвуковому дослідженні виникла лише у 3 з 8 випадків, а ураження були описані як гіперехогенні з гіпоехогенними ділянками з або без гіперваскуляризації. Середній основний діаметр уражень плаценти становив 4,3 см. Макроскопічна характеристика уражень була представлена наявністю сіро-жовто-білого кольору, добре відмежованого круглого вузла. Мікроскопічно всі автори описали такі типові ознаки злоякісності, як висока швидкість мітозу, ядерна атипія та некротичні ділянки. У деяких випадках повідомлялося про наявність цитоплазматичної позитивності АЕ1/АЕ3, ядерного забарвлення р63, бета-хоріонічного гонадотропіну людини (ХГЛ), PLAP і позитивності Ki-67. Рівень материнського ХГЛ швидко знижувався після пологів і в більшості випадків був негативним через 1 місяць після пологів. Лише в одному випадку спостерігалося підвищення рівня ХГЛ через 6 тижнів після пологів, що закінчилося метастазуванням у легені через 3 місяці після пологів. У всіх випадках новонароджених з нормальною вагою при народженні, за винятком одного, який мав затримку внутрішньоутробного розвитку, відзначався добрий наслідок для плода. Спостереження за пацієнтками проводилося у 6 з 8 випадків і тривало від 1 місяця до 9 місяців після пологів. Прогноз для матері були добрими у всіх випадках, за винятком випадку, описаного Huang та співавт. [15], з метастазами в легені матері через три місяці після пологів. Про подальше онкологічне спостереження систематично не повідомлялося.
Таблиця 2. Доповіді про наукову літературу.
| Посилання | Вік матері | ГВ при пологах (тижні), пологи одна дитина/двійня | Маса плаценти (г) | Особливості ультразвукового дослідження | Макроскопічне дослідження
Розмір пухлини |
Мікроскопічне дослідження | Імуногістохімія | Материнський b-ХГЛ
(Вихідний рівень, подальші дослідження) |
Оцінка стану плода | Нагляд | Прогноз для матері |
| Jauniaux E. та співавт., 1988 [13] | 35 | 35 т, 3003
КР при плечовому передлежанні та вагінальних кровотечах Одна дитина |
600 | Не визначено | Добре відмежована округлий вузлик, мультилобулярний, обмежений білою псевдокапсулою
1,5 × 1,5 см |
Добре диференційований капілярний малюнок, що підтримується клітинами строми хоріона та фіброзною тканиною із зовнішнім шаром синцитіотрофобласту та цитотрофобласту з ядерною атипією | -PAS-позитивне відкладення фібрину в зоні, близькій до пухлини
-ХГЛ сильно позитивний у трофобластичному шарі та псевдокапсулі -лПЛ позитивний до синцитію ворсинок |
-Не визначено
-Нижче попереднього виявлення через 6 місяців після пологів |
Нормальний | 9 місяців | Нормальний |
| Trask C. та співавт., 1994 [9] |
36 | 36 т, 1011
Спонтанні пологи та розродження Двійня БХ/БА |
250 (при наявності подвійної плаценти) | Не визначено | Тверде ураження, схоже на інфаркт
3 × 2,5 см |
Стовбурові ворсинки з вираженою проліферацією ворсинчастих стромальних судин, циркулярною проліферацією злоякісного трофобласту, що виступає в міжворсинчастий простір (ядерна атипія, висока швидкість мітозу) | -кератин (E1/AE3, Boehringer-Mannheim, Indianapolis, IN, U.S.A.) в аномальному трофобласті
-ХГЛ позитивний -лПЛ слабкий і вогнищевий в злоякісному трофобласті, сильний в нормальному синцитіотрофобласті |
-Не визначено
-698 мМО/мл через 7 днів після пологів -Нижче попереднього виявлення через 29 днів та 3 місяці після пологів |
Нормальний | 7 днів
29 днів 3 місяці |
Нормальний |
| Ariel I. та співавт., 2009 [14] |
23 | 37 т, 0000
Мимовільні пологи та КР при кондиломах Одна дитина |
678 | Товсте утворення 5-6 см з гіперехогенними та гіпоехогенними ділянками без гіперваскуляризації | Добре відмежоване утворення з чергуванням червоної та жовтуватої тканини на розрізах
8 × 5 см |
Злоякісна епітеліальна пухлина з центральним некрозом, що формує складну розгалужену структуру в межах хорангіоми (частота мітозів >90%, плеоморфні ядра) | -панцитокератин позитивний
-b-ХГЛ позитивний -hsd3b1 вогнищево позитивний -лПЛ слабко позитивний |
-Відповідає рівню ГВ на вихідному рівні
-Нижчий за попередньо виявлений через 1 місяць після пологів |
Нормальний | 1 місяць після пологів | Нормальний |
| Guschmann M. та співавт., 2003 [8] |
31 | 34 т, 1001
КР при дистресі плода та ЗВУР Одна дитина |
496 | Не визначено | Вузлик з сіро-жовтими вогнищами
3 см |
Ворсинки оточені атипією синцитіотрофобласту та хорангіозом з прилеглими ділянками некрозу (ядерна атипія, мітози) | -ХГЛ в синцитіотрофобласті
-лПЛ слабкий та переважаючий у проміжному трофобласті -експресія VEGF, bFGF, Ang-1,2, ПФР у трофобласті подібна до нормальних ворсинок |
-Відповідає ГВ на вихідному рівні
-Не визначено |
ЗВУР | Не визначено | Нормальний |
| Faes T. та співавт., 2012 [7] |
36 | 40 т, 2002
Спонтанні перейми та пологи Одна дитина |
812 | Вузлик 8×7 см з гіперехогенними та гіпоехогенними ділянками з гіперваскуляризацією на межі. Живильна артерія ІП 0,87,ІР 0,58, PSF 39,34 см/с. | Тверда пухлина червонувато-коричневого кольору, дольчастого вигляду на розрізі з множинними дрібними білими вузликами
8 × 7 см |
Розширені ангіоматозні судини, переповнені клітинами з неопластичною проліферацією та розділені фіброзними перегородками, що містять численні кровоносні судини капілярного типу; обширний центральний некроз з дистрофічною кальцифікацією (плеоморфізм ядер, багатоядерність, висока частота мітозів). | цитоплазматична позитивність -AE1/AE3
-забарвлення ядер Р63 -вогнищева позитивність інгібіну-альфа -b-ХГЛ сильна позитивність по краях -Ki-67 високий індекс проліферації |
-Не визначено
-Нижче від попереднього виявлення через 1 місяць після пологів |
Нормальний | 1 місяць після пологів | Нормальний |
| Huang B. та співавт., 2015 [15] |
27 | 39 т, 0000
Спонтанні пологи та КР при підозрі на макросомію Одна дитина |
500 | Не визначено | Тверде сірувато-жовто-біле утворення з притаманною інфаркту структурою.
5 × 4,5 см |
Аномальна трофобластична проліферація в поєднанні з хорангіомою в стромі ворсин хоріона. Клітини, що утворюють тверді маси з масивним центральним коагуляційним некрозом, оточені трьома-шістьма шарами епітеліальних пухлинних клітин (високий індекс проліферації, мітози) | -висока інтенсивність ХГЛ, PLAP, CK, CD31 (+) і CD34 (+) у вогнищі ураження.
-високий індекс проліферації Ki67 |
-Відповідає рівню ГВ на вихідному рівні
-Зростання через 6 тижнів після пологів -Нижче попереднього виявлення після 3 циклів хіміотерапії |
Нормальний | -6 тижнів після пологів
-3 місяці після пологів |
Метастази в легенях через 3 місяці після пологів |
| Garcìa-Molina F. та співавт. (2016) Patalogìa [16] |
36 | 41
3013 Елективна C-секція Близнюки/ БХ/БА |
587 (зрощена біхоріальна плацента) | Не визначено | Невелика неправильна білувата ділянка | Аномальна трофобластична проліферація, з клітинною атипією та розростанням стромальних клітин і рясними судинами (клітинні мітози, коагуляційний некроз, плеоморфізм) | -позитивність на ХГЛ, CK 8-18, PAN CK
-судинна проліферація віментину та CD-34 (+) -Високий рівень Ki-67 в зоні трофобластичної проліферації |
-не визначено
-негативний через місяць після пологів |
Нормальний | 1 місяць після пологів | Нормальний |
| Sagar N. та співавт., 2021 [17] |
29 | 30 т, 1021
pProm, Хоріонамніоніт КР Одна дитина |
Не визначено | Невелике гіпоехогенне ураження по відношенню до дна матки зі збереженим контуром матки | Сіро-білий вузлик, на розрізі суцільно-кістозна з рихлими ділянками
5,5 × 4,5 × 3 см |
Множинні чітко окреслені клітинні скупчення з центральним некрозом, розсіяні в хорангіоматозній стромі (мітози, апоптозні тільця, багатоядерність) | -AE1/AE3, PathnSitu, США, цитокератин позитивний
-b-ХГЛ-позитивність -PLAP та Ki-67 |
-Відповідає ГВ на вихідному рівні
-Не визначено |
Нормальний | Не визначено | Нормальний |
Умовні позначення: ГВ: гестаційний вік; КР: Кесарів розтин; Бета ХГЛ: бета хоріонічний гонадотропін людини; Т: тиждень, лПЛ: Людський плацентарний лактоген, ПФР: Плацентарний фактор росту.
4. Обговорення
Хорангіокарцинома – це неоднозначна проліферація з невизначеною нозологією. Вона була описана як варіант хоріонангіоми, що характеризується високим проліферативним індексом з домішкою синцитіотрофобласту та цитотрофобласту з ядерною атипією [18]. Jauniaux і колеги [13] ввели термін “хорангіокарцинома”, припускаючи, що ця пухлина є “відсутньою ланкою” між хоріоангіомами і хоріокарциномами. Хорангіокарцинома – надзвичайно рідкісна пухлина плаценти, ймовірно, трофобластичного походження, про яку у відповідній літературі описано лише кілька випадків [Зображення 1].
Однак існує думка, що її частота, ймовірно, вища, ніж повідомляється [4]. Насправді, в кількох роботах підкреслюється частота асоційованої гіперплазії трофобласта при хоріонангіомах [5,19]. Khong та співавт. [4] описали, що гіперплазія присутня у 50-65% випадків, що підтверджується підвищеним проліферативним індексом, який коливається між 50 і 65%, а також посиленим забарвленням MIB-1 (Ki-67). Цей результат може бути пов’язаний з надмірною кількістю факторів росту. Ki-67 – це негістоновий ядерний білок, який експресується протягом активної фази клітинного циклу і є маркером проліферації клітин.
Що стосується трофобластичної проліферації, то хоріонангіоми зі значною атипією отримали назву “атипові хоріонангіоми” або “хоріонангіоми з трофобластичною проліферацією” [5,20,21,22]. З іншого боку, хоріонангіоми з численними проліферуючими вузлами плеоморфного, атипового трофобласту, пов’язаного з некрозом (однозначний злоякісний трофобластичний компонент), тісно пов’язані з хоріокарциномою, з метастазами або без них, повинні визначатися як хорангіокарцинома [13,14,15].
Хорангіокарцинома зазвичай є випадковою знахідкою плаценти. Макроскопічні характеристики ураження представлені наявністю добре відмежованих круглих вузлів сіро-жовто-білого кольору та наявністю некрозу. Середній найбільший діаметр уражень плаценти становив 4,86 см.
Мікроскопічно він характеризується аномальною трофобластичною проліферацією, пов’язаною з гіперваскулярним хорангіозом (або хорангіомою) в стромі ворсин хоріона [23,24,25,26]. Клітини в епітеліальному відділі утворюють суцільні маси з масивним центральним коагуляційним некрозом, який оточений кількома (від трьох до шести) шарами життєздатних епітеліальних (трофобластичних) пухлинних клітин. При малому збільшенні некротичні ділянки можуть переважати. Епітеліальні плеоморфні клітини мають виражені ядра і поширені мітотичні фігури. Життєздатні пухлинні клітини в епітеліальному компоненті позитивно реагують на ХГЛ. Відсоток мічених MIB-1 (Ki-67) епітеліальних клітин є високим (>90%) у життєздатному епітелії. На відміну від цього, судинний/хорангіозний компонент (ангіоматозна частина пухлини) є негативним на цитокератин і HSD3B1, але позитивним на віментин, CD31, CD34 і фактор 8 [14,27]. У деяких випадках повідомлялося про наявність цитоплазматичної позитивності AE1/AE3, ядерного забарвлення p63 і PLAP.
Патогенез розвитку хорангіокарциноми не визначений. Припускають, що ураження може являти собою або хоріонангіому з асоційованою трофобластичною гіперплазією, або справжнє трофобластичне новоутворення з реактивним хорангіозом. Також припускають, що ці ураження можуть відображати реактивну проліферацію трофобластичних клітин і ворсинчастих судинних каналів або пухлину внаслідок злиття хоріонангіоми і хоріокарциноми [7,15,25]. Враховуючи гістологічну та цитологічну складність цього типу пухлин та їх рідкісність, можна зрозуміти труднощі гінекологів і навіть патологоанатомів у їх діагностиці.
Клінічний досвід лікування хорангіокарциноми дуже обмежений. Однак, розглядаючи випадки, доступні в літературі, ми спробували визначити схожість між ними, щоб окреслити унікальну схему розпізнавання. З точки зору віку матері, ніхто не здається більш схильним до ризику, ніж інші (середній вік матері: 32 роки). Першою характеристикою, яка повторюється у вибраних клінічних випадках, є недоношеність п’яти з восьми дітей. Шестеро з восьми перенесли кесарів розтин. Хоча невелика кількість випадків і те, що один і два з 6 кесаревих розтинів, відповідно, були плановими або мали як покази вульварний кондиломатоз і підозру на макросомію, наштовхує на думку, що патологія може бути передумовою до кесаревого розтину. Що стосується розміру пухлини, то найбільша була виявлена у вагітних у термін (3 з 7 з розміром > 5 см), що, ймовірно, пов’язано з більш тривалим часом, який дається новоутворенню для росту. Враховуючи, що лише один випадок ЗВУР був виявлений при відносно невеликому ураженні (3 см) і що єдиний випадок, пов’язаний з материнським метастазуванням, був виявлений при ураженні невеликого діаметру, об’єм новоутворення, схоже, не пов’язаний з прогнозами для плода або матері. Найбільша хорангіокарцинома дала сприятливий наслідок для плода та матері. Про низьку злоякісність свідчить швидке зниження рівня бета-ХГЛ, яке спостерігається в більшості випадків.
Неможливо визначити рецидив патології, оскільки наявної літератури недостатньо.
Клінічно протікає безсимптомно, зазвичай з’являється як випадкова знахідка на 20 тижні або під час УЗД у третьому триместрі вагітності, переважно у вигляді безехогенного або нерівномірно ехогенного, добре відмежованого вузла, іноді імітуючи ізольований від плаценти інфаркт. Природний перебіг захворювання невідомий, враховуючи нечисленність випадків і відсутність протоколу лікування. Серед зареєстрованих випадків не було жодного випадку хорангіокарциноми з ознаками поширення пухлини під час пологів. Це свідчить про доброякісний клінічний перебіг. Однак хорангіокарцинома рідко може мати злоякісний перебіг, як це продемонстровано в одному з випадків, описаних в літературі [15]. З цієї причини ми рекомендуємо ретельне обстеження та подальше спостереження як матерів, так і немовлят.
5. Висновки
У минулому гістологічна ідентичність хорангіокарциноми ставилася під сумнів. У цьому систематичному огляді ми спробували визначити гістологічну та клінічну сутність цієї патології. Її клінічний перебіг, у більшості випадків доброякісний, ймовірно, призвів до недооцінки її реальної частоти. Лише глибші знання гістології та обізнаність щодо клінічного перебігу дозволять у майбутньому оцінити реальну поширеність захворювання та стратифікувати ризик ураження пацієнтів.
Посилання на джерела
- Redline, R.W. Classification of placental lesions. Am. J. Obstet. Gynecol. 2015, 213 (Suppl. S4), S21–S28.
- Carlucci, S.; Stabile, G.; Sorrentino, F.; Nappi, L.; Botta, G.; Menato, G.; Masturzo, B. The singular case of multiple chorangioma syndrome in an IVF pregnancy. Analysis of the case and review of literature. Placenta 2021, 103, 120–123.
- Soper, J.T. Gestational Trophoblastic Disease: Current Evaluation and Management. Obstet. Gynecol. 2021, 137, 355–370, Erratum in: Obstet Gynecol. 2022, 139, 149.
- Carlucci, S.; Stabile, G.; Catagini, S.; Borghi, C.; Scutiero, G.; Morano, D.; Greco, P. Fetal disseminated intravascular coagulopathy, hydrops and massive umbilical vein thrombosis consequence of a rare placental condition: Multifocal chorangiomatosis. J. Matern.-Fetal Neonatal Med. 2022, 35, 4009–4013.
- Khong, T.Y. Chorangioma with trophoblastic proliferation. Virchows Arch. 2000, 436, 167–171.
- Gallot, D.; Sapin, V.; Beaufrère, A.-M.; Boda, C.; Laurichesse-Delmas, H.; Déchelotte, P.; Lémery, D. Récurrence de chorio-angiomes multiples: à propos d’un cas. [Recurrence of multiple chorio-angiomas: A case-report]. Gynecol. Obstet. Fertil. 2003, 31, 943–947.
- Faes, T.; Pecceu, A.; Van Calenbergh, S.; Moerman, P. Chorangiocarcinoma of the placenta: A case report and clinical review. Placenta 2012, 33, 658–661.
- Guschmann, M.; Schulz-Bischof, K.; Vogel, M. Inzidentelles Chorangiokarzinom. Fallbericht, Immunhistochemie und Theorien zur möglichen Histogenese. [Incidental chorangiocarcinoma. Case report, immunohistochemistry and theories of possible histogenesis]. Pathologe 2003, 24, 124–127
- Trask, C.; Lage, J.M.; Roberts, D.J. A second case of “chorangiocarcinoma” presenting in a term asymptomatic twin pregnancy: Choriocarcinoma in situ with associated villous vascular proliferation. Int. J. Gynecol. Pathol. 1994, 13, 87–91.
- Page, M.J.; McKenzie, J.E.; Bossuyt, P.M.; Boutron, I.; Hoffmann, T.C.; Mulrow, C.D.; Shamseer, L.; Tetzlaff, J.M.; Akl, E.A.; Brennan, S.E.; et al. The PRISMA 2020 statement: An updated guideline for reporting systematic reviews. BMJ 2021, 372, n71.
- Prospero International Prospective Register of Systematic Reviews. Available online: https://www.crd.york.ac.uk/prospero/ (accessed on 10 December 2022).
- Tufanaru, C. Chapter 3: Systematic reviews of effectiveness. In Joanna Briggs Institute Reviewer’s Manual; Aromataris, E., Munn, Z., Eds.; The Joanna Briggs Institute: Adelaide, Australia, 2017.
- Jauniaux, E.; Zucker, M.; Meuris, S.; Verhest, A.; Wilkin, P.; Hustin, J. Chorangiocarcinoma: An unusual tumour of the placenta. The missing link? Placenta 1988, 9, 607–613.
- Ariel, I.; Boldes, R.; Weintraub, A.; Reinus, C.; Beller, U.; Arbel, R. Chorangiocarcinoma: A case report and review of the literature. Int. J. Gynecol. Pathol. 2009, 28, 267–271.
- Huang, B.; Zhang, Y.-P.; Yuan, D.-F.; Yang, R.; Wang, C.; Wu, R.-F. Chorangiocarcinoma: A case report and clinical review. Int. J. Clin. Exp. Med. 2015, 8, 16798–16802.
- García-Molina, F.; Heredia-Oliva, L.; Castaño, M.D.; Andrada-Becerra, E. Corangiocarcinoma. A propósito de un caso. Rev. Española De Patol. 2016, 50, 229–233.
- Sagar, N.; Tanwar, P.; Khurana, N.; Kashyap, P. Placental Chorangiocarcinoma: Case Report with Literature Review of a Rare Entity. Placental Chorangiocarcinoma: Case Report with Literature Review of a Rare Entity. Turk Patoloji Derg. 2022, 38, 292–296.
- Benirschke, K.; Kaufmann, P.; Baergen, R.N. Pathology of the Human Placenta; Springer: New York, NY, USA, 2005.
- Ogino, S.; Redline, R.W. Villous capillary lesions of the placenta: Distinctions between chorangioma, chorangiomatosis, and chorangiosis. Hum Pathol. 2000, 31, 945–954.
- Majlessi, H.F.; Wagner, K.M.; Brooks, J.J. Atypical cellular chorangioma of the placenta. Int. J. Gynecol. Pathol. 1983, 1, 403–408.
- Mesia, A.F.; Mo, B.P.; Ylagan, L.R. Atypical cellular chorangioma. Arch. Pathol. Lab. Med. 1999, 123, 536–538.
- Vellone, V.G.; Calamaro, P.; Vignale, C.; Novaro, G.; Penna, L.; Fulcheri, E. Atypical Cellular Chorangioma: A Potential Diagnostic Pitfall With Worrisome Aspects but a Favorable Prognosis. Int. J. Surg. Pathol. 2015, 23, 364–368.
- Mao, T.-L.; Seidman, J.D.; Kurman, R.J.; Shih, I.-M. Cyclin E and p16 immunoreactivity in epithelioid trophoblastic tumor—An aid in differential diagnosis. Am. J. Surg. Pathol. 2006, 30, 1105–1110.
- Benirschke, K.; Burton, G.J.; Baergen, R.N. Pathology of the Human Placenta, 6th ed.; Springer: Berlin/Heidelberg, Germany, 2012.
- Kurman, R.J.; Ellenson, L.H.; Ronnett, B.M. Blaustein’s Pathology of the Female Genital Tract, 7th ed.; Springer: Berlin/Heidelberg, Germany, 2019.
- Di Massa, G.; Stabile, G.; Romano, F.; Balduit, A.; Mangogna, A.; Belmonte, B.; Canu, P.; Bertucci, E.; Ricci, G.; Salviato, T. CD133 Expression in Placenta Chorioangioma Presenting as a Giant Asymptomatic Mass. Medicina 2021, 57, 162.
- Mao, T.L.; Kurman, R.J.; Jeng, Y.M.; Huang, W.; Shih, I.M. HSD3B1 as a novel trophoblast-associated marker that assists in the differential diagnosis of trophoblastic tumors and tumorlike lesions. Am. J. Surg. Pathol. 2008, 32, 236–242.