Автори: Jérôme Baranger, Olivier Villemain, Matthias Wagner, Mariella Vargas-Gutierrez, Mike Seed, Olivier Baud, Birgit Ertl-Wagner, Julien Aguetg
Вступ
Церебральний кровотік у новонароджених може бути порушений через різні клінічні стани. Недоношеність, перинатальна асфіксія і різні вроджені вади серця – часті, але не вичерпні приклади.
Порушення церебральної перфузії може привести до порушень нейрокогнітивного розвитку і подальшої інвалідності, яка може досягати зрілого віку, що робить його серйозною проблемою для громадської охорони здоров’я. Розвиток методів неонатальної візуалізації перфузії може дуже вплинути на перинатальну медицину, оскільки дозволить своєчасно і точно діагностувати церебральні ситуації підвищеного ризику.
В даний час існують різні принципово різні технології для візуалізації та кількісної оцінки перфузії мозку. Для магнітно-резонансної томографії (МРТ) вони включають методи перфузії з контрастним посиленням, включаючи Т1-зважені методи контрастування з динамічним контрастом і динамічною сприйнятливістю, а також ASL-МРТ і IVIM. Ультразвукові методи включають оцінку прекраніальних артерій за допомогою звичайного ультразвуку і, останнім часом, оцінку повної перфузії головного мозку за допомогою надшвидкої ультразвукової візуалізації (UUI). Додаткові методи візуалізації перфузії включають звичайну однофотонну емісійну комп’ютерну томографію (SPECT), методи позитронно-емісійної томографії (PET), перфузійну комп’ютерну томографію і спектроскопію в ближньому інфрачервоному діапазоні.
Методи з посиленим контрастуванням вимагають внутрішньовенного (IV) доступу і введення екзогенної контрастної речовини. Для КТ використовується контраст на основі йоду, і пов’язані ризики включають нефротоксичність, спричинену контрастом, в основному при порушенні функції нирок і алергічні реакції різного ступеня тяжкості. Для МРТ використовується контраст на основі гадолінію, і крім рідкісних і часто легких алергічних реакцій існує рідкісний ризик нефрогенного системного фіброзу. У недавніх дослідженнях описуються відкладення гадолінію в головному мозку, значення яких ще не повністю вивчено (Young et al., 2018). Таким чином, існує потреба в неінвазивних методах візуалізації перфузії, які не включають іонізуюче випромінювання, особливо у вразливої популяції новонароджених. З недавньою появою UUI, що забезпечує високу просторову роздільну і часову здатність для доплерівської візуалізації, став можливий кількісний аналіз аж до мікросудинного рівня біля ліжка пацієнта (Demene et al., 2019).
3. Методи візуалізації для оцінки церебрального кровообігу у новонароджених
3.1. Магнітно-резонансна томографія (МРТ)
Існують різні методи перфузії МРТ, засновані на різних імпульсних послідовностях. У цих методах використовуються екзогенні або ендогенні контрастні речовини для оцінки як регіонарної, так і глобальної церебральної перфузії.
3.1.1. МРТ-перфузія з контрастуванням динамічної сприйнятливості
Перфузія контрастом з динамічної сприйнятливістю заснована на викликаній сприйнятливості до втрати сигналу, що спостерігається на звичайних T2-зважених (T2w) або градієнтних ехо-T2-зважених (T2 * w) зображеннях під час першого проходу екзогенного внутрішньовенно введеної парамагнітної контрастної речовини на основі гадолінію.
Гемодинамічні зміни оцінюються як на глобальному, так і на регіональному рівні і виражаються як середній час проходження, час до піку і об’єм церебральної крові (CBV), які, в свою чергу, використовуються для розрахунку церебрального кровообігу. Можна отримати кольорові карти цих кількісних вимірювань (зобр. 1). Застосування цього методу до новонароджених виявилося важким на різних рівнях, і існує лише кілька досліджень на цю тему.
Зображення 1: Перфузія на МРТ з динамічним контрастом сприйнятливості. Панелі A і B показують карти перфузії з церебральним кровотоком зліва і церебральним об’ємом крові праворуч від кожної панелі на двох різних рівнях, щоб проілюструвати виражену гіперперфузію в потиличних частках (A), базальних гангліях (B) і моторній корі (A і B). Відображає картину пошкодження базальних гангліїв. Зображення адаптовано і використано з дозволу Wintermark et al.
3.1.2. МРТ-перфузія з динамічним контрастуванням
Перфузія з динамічним контрастуванням заснована на ефекті контрастної речовини на основі гадолінію, що полягає в скороченні часу релаксації T1, що призводить до збільшення сигналу. Шляхом введення болюса контрастної речовини на основі гадолінію, картину посилення в області можна вивчити шляхом отримання вихідних зображень без контрасту з подальшою швидкою послідовністю повторних T1-зважених зображень (T1w).
Регіональне накопичення контрастної речовини на основі гадолінію в кровоносних судинах, а також фракція контрастної речовини на основі гадолінію, яка дифундує в позасудинний позаклітинний простір, призведе до збільшення сигналу через укорочення T1. Перфузійна МРТ з динамічним контрастуванням оцінює властивості перфузії тканин на мікросудинному рівні.
За допомогою фармакокінетичного моделювання можна виміряти параметри, що відображають проникність капілярів, регіонарний об’єм крові і регіонарний кровотік. Використання МРТ з динамічним контрастуванням в першу чергу описано для візуалізації пухлин та периферичної судинної системи.
3.1.3. Фазово-контрастна МРТ
Фазово-контрастна МРТ дозволяє отримувати кількісні зображення рухомих рідин на основі принципу, що спіни, рухомі вздовж градієнта магнітного поля, розвивають фазовий зсув, пропорційний їх швидкості. Шляхом аналізу інформації про фазу в поперечному перерізі судини інтересу можна обчислити швидкість для кожного вокселя і отримати фазово-контрастне зображення (зобр. 2). Потім програмне забезпечення постобробки дозволяє кількісно оцінити цю швидкість і побудувати криву потоку, наприклад для повного серцевого циклу (Lotz et al., 2002).
При застосуванні цього принципу на рівні екстракраніальних, прецеребральних артерій, включаючи внутрішні сонні артерії і хребетні артерії, можна достовірно оцінити загальний церебральний кровотік (Spilled et al., 2002).
Об’єм мозку вимірюється шляхом сегментації ізотропних тривимірних послідовностей з високим просторовим дозволом (Prsa et al., 2014 року, Werner et al., 2010). Потім розраховують середній загальний кровотік шляхом ділення загального кровотоку на об’єм мозку. Стосовно недоношених і доношених новонароджених було показано, що загальний церебральний кровотік, який вимірюється за допомогою МРТ з фазовим контрастом, в значній мірі корелює з постконцептуальним віком і масою тіла, що підтверджує корисність такого неінвазивного методу для вимірювання загального церебрального кровотоку у новонародженого (Benders et al ., 2011). Однак цей метод дає тільки оцінку середнього глобального церебрального кровотоку і не дає інформації про регіональний церебральний кровотік.
Зображення 2: Фазоконтрастна МРТ. Сагітальне двомірне фазово-контрастне зображення (A) для ілюстрації розташування осьового двомірного фазово-контрастного зображення, що показує інтенсивність сигналу в площині потоку всередині внутрішніх сонних артерій (B: 1 і 2) і базилярної артерії (B: 3). Зображення адаптовано і використано з дозволу Benders et al.
3.1.4. Маркування артеріального спина (ASL) МРТ
У той час як методи контрасту з динамічною сприйнятливістю і МРТ-перфузії з динамічним контрастуванням вимагають введення екзогенного контрастного агента, мічення артеріального спіна використовує власний ендогенний контрастний агент, молекули води в крові.
Перед процесом маркування створюється зображення для намагнічування фону в мозку. Потім вода артеріальної крові маркується шляхом вибіркового інвертування намагніченості водних спінів артеріальної крові, що циркулюють в головному мозку на рівні шиї, і відображаються на рівні мозку після короткого часу проходження (зобр. 3). Віднімання двох зображень дає зображення, зважене по перфузії (Ferre et al., 2013). Кількісна оцінка кровотоку (в одиницях мл / 100 г тканини головного мозку / хв) за допомогою ASL заснована на математичних моделях з використанням усереднених за часом інтенсивностей сигналів в фоновій намагніченості і зображеннях з мітками спіна артерій (Олсоп і ін., 2015-го, Варела та ін .., 2015).
Зображення 3: МРТ ASL. A: Намагнічення водяних спінів артеріальної крові в прецеребральних артеріях інвертується шляхом застосування радіочастотного імпульсу (зліва, пунктирна рамка) з подальшою короткою затримкою, протягом якої спіни досягають мозкового кровообігу, де виходить «позначене» зображення. Попереднє намагнічування фону фіксується в тому ж полі зору (ліва пунктирна рамка). Віднімання двох зображень генерує зважене по перфузії зображення (PWI). Кількісна оцінка церебрального кровотоку (в одиницях мл / 100 г тканини мозку / хв) за допомогою ASL заснована на математичних моделях, що використовують усереднені за часом інтенсивності сигналів в фоновій намагніченості і зображеннях з мітками спінів в артеріях. B: зображення перфузії ASL, що представляють церебральний кровотік у трьох немовлят, що народилися в гестаційному віці 25 тижнів (верхній ряд), гестаційному віці 31 тиждень (середній ряд) і відсканованому гестаційному віці 40 тижнів (нижній ряд). Перфузія в центральній борозні збільшується з терміном вагітності (середній ряд) і більш рівномірно поширюється у доношених новонароджених (нижній ряд). Зображення адаптовано і використано з дозволу De Vis et al.
Вага мозку оцінюється на основі сегментації отриманих анатомічних тривимірних послідовностей (Ferre et al., 2013). Можна вивчати як регіональну, так і глобальну церебральну перфузію. Існує кілька методів маркування, з яких псевдонепреривне маркування виявилося більш точним у новонароджених, забезпечуючи чудову якість зображення за рахунок підвищення ефективності маркування і відношення сигнал / шум (SNR) в порівнянні з іншими методами (Олсоп і ін., 2015-го, Boudes et al., 2014 року, Wu et al., 2011).
Оскільки він дозволяє уникнути внутрішньовенного введення екзогенної контрастної речовини і іонізуючого випромінювання, ASL є привабливим методом візуалізації перфузії головного мозку у новонароджених (Miranda et al., 2006). Коли артефакти руху при прийомі їжі і сну заважають оцінці, послідовність може бути повторена (Антонов і ін. 2017, Віндрам і ін., 2012). Кілька досліджень продемонстрували можливість застосування ASL у новонароджених і немовлят. Референсні значення були встановлені у здорових людей у віці від 6 місяців до 15 років (Carsin-Vu et al., 2018).
3.1.5. Інтравоксельний некогерентний рух (IVIM) МРТ
МРТ з дифузійним зважуванням оцінює випадковий рух окремих молекул води в тканині. Кожна молекула має теплову енергію, яка викликає рух, що приводить до зіткнень з іншими молекулами і, як наслідок, зміни їх напрямку руху. У магнітному полі з застосованими кодуючими імпульсами градієнта спостерігається ослаблення сигналу, вторинне по відношенню до дифузності, яка збільшується зі ступенем кодування градієнта поля, зазвичай відомого як значення b в дифузійно-зваженій МРТ (Le Bihan, 2019).
Вперше описано Le Bihan et al. У поєднанні з концепцією дифузії 1986 року (Le Bihan et al., 1986) колективний рух молекул води в мережі випадково орієнтованих капілярів рівний кровотоку і називається «псевдодифузією» (Le Bihan, 2019). Псевдодифузія, виведена з рівняння Стокса-Ейнштейна, виражається у вигляді коефіцієнта, що залежить від середньої довжини сегмента капіляра і середньої швидкості всередині нього.
І дифузія, і псевдодифузія вносять свій внесок в загасання сигналу, що призводить до біекспоненціальної кривої загасання сигналу, враховуючи в десять разів швидше загасання сигналу псевдодифузіі при низьких значеннях b. Це відхилення називається ефектом IVIM. Отримані дані про загасання сигналу потім обробляються за допомогою математичних алгоритмів, які виходять за рамки даного огляду. Ле Биха і Тернер показали, як параметри IVIM можуть бути пов’язані зі звичайними параметрами перфузії на основі двох важливих змінних: довжини сегмента капіляра і загальної довжини капіляра (Le Bihan and Turner, 1992). З огляду на те, що ці дві довжини постійні для даної тканини, відносну перфузію або кровотік можна оцінити за рівняннм D * fIVIM, де D – псевдодифузія, а fIVIM – фракція крові (зобр. 4).
Зображення 4: Інтравоксельна перфузія на МРТ з не когерентним рухом (IVIM). Параметри IVIM fIVIM (A), D * (B) і D *. FIVIM (C) відображають гіперперфузію в обох лобових частках, переважно справа. Спад інтенсивності сигналу як функція від b з відповідною біекспоненціальною відповідністю представлений для області, що цікавить в межах гіперперфузійної правої лобної ділянки (D) і в межах лівої тім’яної контрольної ділянки (E). Зображення адаптовано і використано з дозволу Federau et al.
На сьогоднішній день мікросудинна перфузія вивчається в основному при візуалізації пухлин як на глобальному, так і на регіональному рівні (Stieb et al., 2016).
МРТ перфузія на основі IVIM надає інформацію як про тканинну мікроциркуляцію, так і про кровотік в рамках однієї послідовності і не вимагає введення контрастної речовини, що робить цю концепцію привабливою для візуалізації церебрального кровотоку новонароджених.
3.2. Ультразвукове дослідження
Ультрасонографія головного мозку новонародженого використовує природні анатомічні вікна через передні і, по можливості, задні джерельця, тонку скроневу кістку і соскоподібну частину скроневої кістки. Завдяки своїй широкій доступності, відсутності впливу іонізуючого випромінювання і відсутності необхідності в седативних засобах, УЗД дозволяє проводити оцінку стану головного мозку новонароджених біля ліжка хворого. Однак для досягнення прийнятної відтворюваності потрібна відповідність стандартизованим протоколом візуалізації, знання обладнання і призначений для користувача досвід (Dudink et al., 2020). Існує кілька підходів до оцінки церебральної перфузії.
3.2.1. Звичайний допплер
Так званий УЗ-доплер використовує ефект Доплера, який визначається зсувом частоти звукової хвилі через відбивач, тобто клітини крові, що рухається до об’єкта або від об’єкта, тобто датчика. Зокрема, спектральна доплерівська (або імпульсно-хвильова доплерівська) ультрасонографія використовує аналіз Фур’є для усереднення цих частот за певний період часу, перетворюючи їх в швидкості і відображає спектр частот у вигляді хвилі.
Загальний церебральний кровотік оцінювався з використанням об’єму внутрішньосудинного кровотоку, розрахованого за допомогою скоригованих за кутом усереднених за часом швидкостей і площею поперечного перерізу судин всередині екстракраніальних внутрішніх сонних і хребетних артерій (Ehehalt et al., 2005).
Точність цього підходу залежить від точного вимірювання малих діаметрів просвіту (менше 2 мм для хребетних артерій), вибору оптимального кута дослідження і правильної оцінки усередненої за часом швидкості, оскільки навіть невеликі помилки призводять до значних змін. Отримана інформація про прецеребральний кровотік інформує тільки в глобальному внутрішньоцеребральному масштабі і не може демонструвати регіональні зміни.
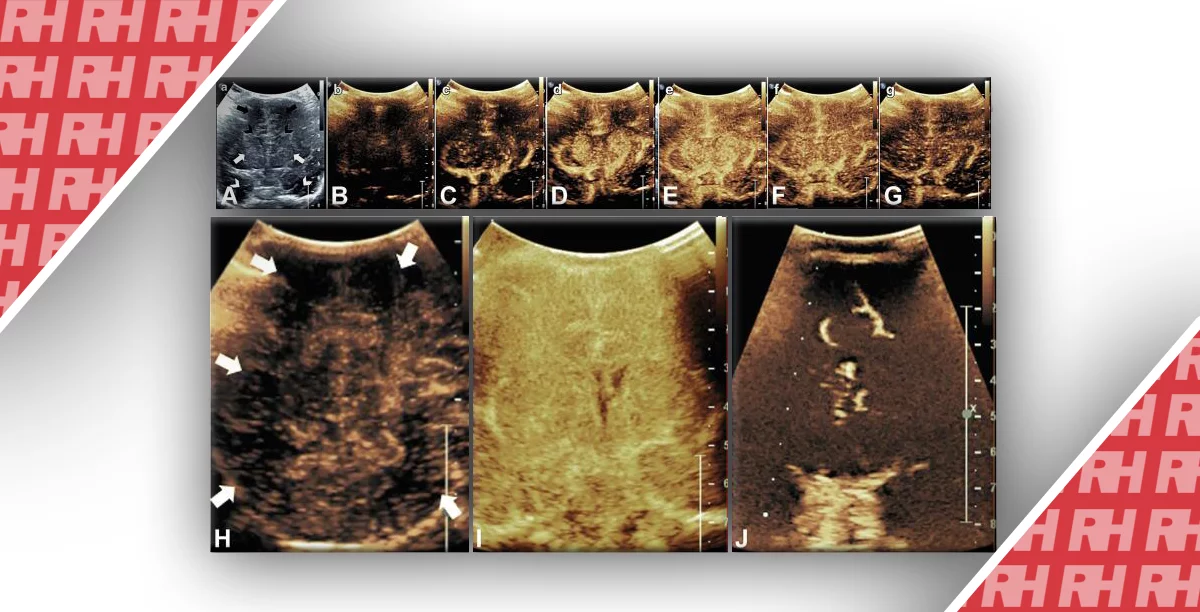
Інші поширені інструменти ультразвукового доплера включають кольоровий доплер і енергетичний доплер. У той час як кольоровий доплер виявляє недостатню чутливість до повільного кровотоку, енергетичний доплер пропорційний об’єму церебрального кровотоку (Rubin et al., 1995) і більш чутливий до мікросудинного кровотоку. Його можна використовувати для вивчення регіональної церебральної перфузії у новонароджених в корковій або глибокій структурі, такій як базальні ганглії (Heck et al., 2012) (зобр. 5). Вищезгаданий пропорційний закон між об’ємом церебрального кровотоку і енергетичним доплером залежить від декількох параметрів, включаючи загасання сигналу, а також геометрію і висоту ультразвукового променя. Отже, в межах даного пікселя кажуть, що енергетичний доплер є фракційним об’ємом рухомої крові і представлений в відносних одиницях (% або дБ). Отже, енергетичний доплер більше підходить для відносних вимірювань між областями або тимчасовими точками, ніж для кількісних вимірювань церебрального кровотоку.
Зображення 5: Звичайне ультразвукове доплерівське дослідження. Картування потоку за допомогою енергетичного доплера накладено на корональної вид в B-режимі базальних гангліїв і передніх рогів бічних шлуночків, включаючи середні мозкові артерії. Регіональна васкуляризація вимірюється під час постобробки шляхом підрахунку кількості і сили кольорових пікселів в попередньо обраної області. Зображення адаптовано і використано з дозволу Heck et al.
3.2.2. Динамічний вимір тканинної перфузії
Динамічний вимір тканинної перфузії кількісно визначає середню інтенсивність перфузії (виражену в см / с) в обраній області інтересу на основі відеозапису кольорового доплера, знятого протягом як мінімум одного серцевого циклу (Scholbach 2009, Scholbach, 2008) (зобр. 6).
Цей метод недавно був застосований для ретроспективного вивчення перфузії базальних гангліїв у невеликій популяції немовлят, які отримували терапевтичну гіпотермію всього тіла з приводу гіпоксично-ішемічної енцефалопатії (ГІЕ) (Faingold et al., 2016). Як і у випадку з іншими традиційними ультразвуковими методами, динамічне вимірювання тканинної перфузії вимагає стандартизованого підходу до обраних областей інтересу і дозволяє тільки регіональний аналіз кількісної оцінки середньої інтенсивності перфузії. Порівняння з іншими, більш широко використовуваними кількісними параметрами, такими як церебральна перфузія, є складним завданням, оскільки динамічний вимір тканинної перфузії не враховує об’єм тканини.
Зображення 6: Динамічний вимір тканинної перфузії. Область, що нас цікавить, вибирається в межах базальних гангліїв на кольоровому доплерівському ультразвуковому режимі, отриманому протягом як мінімум одного серцевого циклу, для кількісної оцінки середньої інтенсивності перфузії (в см / с), показаної на кривій інтенсивності внизу у одноденного пацієнта. Діагностована гіпоксично-ішемічна енцефалопатія. Зображення адаптовано і використано з дозволу Faingold et al.