Авторы: Jérôme Baranger, Olivier Villemain, Matthias Wagner, Mariella Vargas-Gutierrez, Mike Seed, Olivier Baud, Birgit Ertl-Wagner, Julien Aguetg
3.2.3. Ультразвук с контрастным усилением (CEUS)
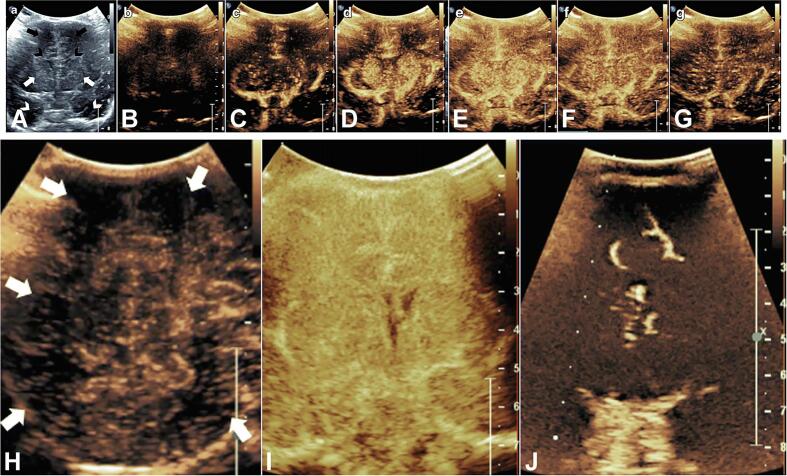
CEUS направлен на повышение внутрисосудистой эхогенности путем введения контрастного вещества для ультразвука: газовых микропузырьков, заключенных в фосфолипидную мембрану, которые сжимаются и расширяются нелинейным образом под воздействием ультразвукового луча. Результирующий усиленный эхо-сигнал создает внутрисосудистый контраст, в принципе похожий на изображение поперечного сечения с использованием внутрисосудистых контрастных агентов (рис. 7).
Рисунок 7: Ультразвук с контрастным усилением (CEUS). A: Средне-корональное изображение в b-режиме, показывающее двусторонние лобные доли (черные стрелки), лобные рога боковых желудочков (черные шевроны), базальные ганглии (белые стрелки) и височные доли (белые шевроны). B-G: Статические изображения динамического вливания микропузырьков на среднекорональных изображениях здорового новорожденного. H: Задний теменно-затылочный вид новорожденного с гипоксически-ишемическим повреждением, показывающий диффузную гипоперфузию с множеством участков с малым количеством микропузырьков (белые стрелки), отражающие нарушения перфузии. I: Корональный вид через базальные ганглии у новорожденного с диффузным гипоксически-ишемическим повреждением в период сразу после травмы, демонстрирующий диффузную гиперперфузию. J: Коронарное изображение базальных ганглиев у младенца после продолжительной остановки сердца, демонстрирующее диффузную гипоперфузию. Изображение адаптировано и использовано с разрешения Hwang.
Использование CEUS у новорожденных было ограничено. Хотя до 2016 года это считалось противопоказанием для пациентов с сердечным шунтом, контрастные вещества для ультразвуковых исследований за прошедшие годы доказали свою безопасность и эффективность (Appis et al., 2015). Использование контрастных агентов для УЗИ по-прежнему не рекомендовано для ультразвукового исследования головного мозга и требует согласия родителей. CEUS может быть лучше МРТ с точки зрения необходимой инфраструктуры, доставки контрастного вещества и затрат. Однако в настоящее время имеется мало данных, подтверждающих рутинное использование ультразвукового контраста для визуализации головного мозга новорожденных (Hwang, 2019).
3.2.4. Сверхбыстрая ультразвуковая визуализация (UUI)
За последние два десятилетия в ультразвуковой визуализации произошел крупный прорыв с появлением новых технологий, таких как UUI. Хотя лежащая в основе акустическая физика такая же, как и в обычном ультразвуке, ранее описанном в этой работе, прогресс в электронике и вычислительной технике позволил использовать плоские или расходящиеся волны.
Эти несфокусированные волны позволяют реконструировать изображение с помощью одного излучения. Следовательно, модальность может достигать частоты кадров до 10 000 изображений в секунду. За счет объединения нескольких волн разной ориентации пространственное разрешение эквивалентно обычному ультразвуку (до 50 мкм) (Tanter and Fink, 2014).
Сочетание этой высокой частоты кадров и высокого пространственно-временного разрешения позволяет использовать передовые стратегии обработки сигналов для изображения потоков крови в крупных артериях, а также более медленных потоков в микрососудах (со скоростью до 1 мм / с), что приводит к сверхбыстрому допплеровскому сканированию.
Этот метод особенно хорошо подходит для новорожденных, так как ультразвук может проникать глубоко в мозг (до 8 см) через родничок и проводиться у постели больного. Как и в случае с обычным ультразвуком, UUI не инвазивен и не требует ионизирующего излучения. Посредством усреднения сверхбыстрых изображений Power Doppler в течение одного сердечного цикла, карты васкуляризации мозга с высоким разрешением были получены Демене и др. С использованием линейного датчика (рис. 8, A, B, C). Секторные изображения были получены с использованием датчика с фазированной решеткой некоторыми авторами этой работы (JB, OV, JA) в больнице для больных детей, Торонто, Канада (рис. 8D).
Рисунок 8: Сверхбыстрая ультразвуковая визуализация (UUI). Трансфонтанеллярные сверхбыстрые доплеровские изображения мозга новорожденного в разных ракурсах. A: Слева направо, коронарный, наклонный парасагиттальный и парасагиттальный виды. Цветовая шкала отображает CBV с использованием функции ультразвукового допплера. B: слева направо, сагиттальные, парасагиттальные и трансвисочные осевые виды. Изображения Power-Doppler включают информацию о направлении (красный: поток к датчику, синий: поток от датчика). Видимые структуры включают периклозальную артерию, вены ниже желудочков головного мозга, корковые проникающие артериолы и венулы, а также виллизиев круг. C: Сосудистые зоны интереса, отображенные в сагиттальной, аксиальной и парасагиттальной проекциях. (A, B и C). D: Секторное сверхбыстрое допплеровское изображение, полученное в корональной проекции.
В рамках одного и того же сбора данных также можно количественно оценить кровоток в любой интересующей области с точки зрения CBV и скорости потока. Как и в обычном доплеровском режиме, измерения CBV выражаются в относительных единицах. Таким образом, сверхбыстрый допплер объединяет традиционный цветной допплер и импульсно-волновой допплер в единую модальность.
Анализируя изменения потока во время сердечного цикла, можно оценить и нанести на карту сосудистое сопротивление каждого сосуда(рис. 8C). Первые клинические применения выявили потенциал этого метода в изучении перфузии головного мозга новорожденных во время гипотермии у новорожденных. Анализ изменений кровотока во время сердечного цикла также позволяет дифференцировать артериальный и венозный кровоток на основе их разного сопротивления.
Сверхбыстрая допплерография – многообещающий метод прикроватного мониторинга. При повторном получении изображений перфузии головного мозга также можно наблюдать нервно-сосудистую связь. Первое применение этого так называемого функционального ультразвукового метода позволило по-новому взглянуть на сложную подкорковую и корковую гемодинамику во время эпилептиформных припадков.
Наблюдаемые спонтанные колебания CBV также оказываются разными в таламической и корковой областях у недоношенных и родившихся в контрольной группе новорожденных.
3.3. Компьютерная томография (КТ)
КТ-перфузия – это динамическое получение последовательных КТ-срезов после внутривенного введения болюса йодированного контрастного вещества (Proisy et al., 2016).
Режим непрерывного сканирования (режим кино) используется для отслеживания прохождения болюса контраста через сосудистую сеть головного мозга, в то время как усиление контраста ткани изображается кривой затухания с временным разрешением. КТ-перфузия может обеспечить точную оценку регионального мозгового кровотока (CBF), объема (CBV) и среднего времени прохождения (Krishnan et al., 2017). Карты CBF, CBV и среднего времени прохождения интерпретируются с помощью программного обеспечения для постобработки для визуальной оценки и количественного анализа.
У новорожденных меньший размер мозга и более высокая скорость кровотока являются биологическими препятствиями, которые препятствуют осуществлению перфузии КТ в этой возрастной группе. Кроме того, перфузия при КТ у детей затруднена из-за более высокой частоты артефактов движения, использования небольших внутривенных катетеров, которые ограничивают скорость инъекции и увеличивают время инъекции, и, что наиболее важно, из-за ионизирующего излучения, которое обычно требует дополнительных 1,57 – 2,96 мЗв для компьютерная томография перфузии. Анализ риска и пользы ионизирующего излучения при КТ-перфузии предполагает, что его применение у детей очень ограничено (Raybaud and Barkovich, 2012).
Очень немногие КТ-исследования перфузии включали новорожденных. Wintermark et al. Оценили использование перфузии КТ в условиях неотложной помощи (Wintermark et al., 2005) и определили возрастные вариации количественных значений перфузии при КТ у 77 детей в возрасте от 7 дней до 18 лет, включая 10 пациентов моложе 12 месяцев (рис. 9). Значения перфузии при КТ соответствовали другим методам визуализации и показали возрастные вариации с пиком перфузии в возрасте около 3 лет.
Рисунок 9: Компьютерная томография (КТ) перфузии. Размещение областей интереса (ROI) для анализа регионального объема церебральной крови и кровотока в сером (черные области интереса) и белом (белые области интереса) веществах.
3.4. Спектроскопия в ближнем инфракрасном диапазоне (NIRS)
NIRS – это неинвазивный метод визуализации, который использует различные свойства оптического поглощения биологических структур. Биологическая ткань относительно прозрачна для ближнего инфракрасного света в так называемом оптическом окне с длинами волн от 650 до 1350 нм (Smith et al., 2009). В этом же окне всасывание крови сильно зависит от концентрации оксигемоглобина и дезоксигемоглобина (Mohammadi-Nejad et al., 2018).
При излучении ближнего инфракрасного света в ткани головного мозга через неповрежденный череп фотоны могут проникать в ткани на расстояние нескольких сантиметров. Из-за многократного рассеяния часть этого света достигает кожи головы в удаленной от излучателя точке, где ее можно обнаружить (рис. 10). Следуя закону Бера-Ламберта, динамические изменения абсорбции могут быть связаны с изменениями оксигемоглобина и дезоксигемоглобина. На основе этих концентраций NIRS обеспечивает анализ локальных изменений объема крови, а также потребления кислорода.
Клинически NIRS использовался в реанимации для непрерывного неинвазивного мониторинга региональной мозговой сатурации оксигенации, что позволяет принимать диагностические и терапевтические решения (Claessens et al., 2019, Garvey and Dempsey, 2018). Одним из преимуществ использования NIRS является его простота и портативность, заключающаяся в размещении оптических датчиков или «оптодов» на коже новорожденного у постели больного, что возможно с учетом тонкой кости черепа и относительного отсутствия волос.
Рисунок 10: A – Принципы ближней инфракрасной спектроскопии (NIRS). Оптод пропускает инфракрасный свет через кожу головы и череп, ткани, которые имеют ограниченное поглощение на этих длинах волн. Приемный оптод собирает рассеянный свет. Адаптировано с разрешения Mohammadi-Nejad et al. (Mohammadi-Nejad et al., 2018). B – Динамические изменения абсорбции могут быть связаны с концентрацией окси- и дезоксигемоглобина [HbO] и [HbR], обладающих различными характеристиками абсорбции, из которых затем определяются изменение объема церебральной крови и оксиметрия. [HbT] – общая концентрация гемоглобина.
Сочетание мониторинга церебральной оксигенации с артериальным давлением – это неинвазивный метод, который непрерывно оценивает церебральную ауторегуляцию и дает возможность поддерживать стабильную церебральную перфузию и оксигенацию во время колебаний артериального давления (Claessens et al., 2019).
Недоношенные новорожденные, младенцы, перенесшие кардиохирургические операции по поводу критического врожденного порока сердца, а также дети, которым требуется экстракорпоральная мембранная оксигенация, подвержены риску приобретенного повреждения головного мозга из-за измененной гемодинамики, кровотечений и / или эмболических явлений. Непрерывный нейромониторинг изменений в гемодинамическом статусе чрезвычайно важен для этих новорожденных в попытке выявить тех, кто подвержен более высокому риску травмы головного мозга на ранней стадии.
Было показано, что NIRS является ценным инструментом для непрерывного мониторинга церебральной оксигенации, особенно для недоношенных детей (Hyttel-Sorensen et al., 2015) и для новорожденных, перенесших кардиохирургические операции (Hirsch et al., 2009).
Его временное разрешение превосходно (≈ 10 мс) по сравнению с МРТ или нуклеарной визуализацией. Он также изучается как многообещающий метод мониторинга эпилепсии (Wallois et al., 2010). Кроме того, функциональный NIRS – это развивающийся метод нейровизуализации, способный оценить нервно-сосудистую связь. Дальнейшие улучшения включают разработку матриц оптодов высокой плотности (HD) для улучшения пространственного разрешения, что привело к появлению диффузной оптической томографии HD (Singh et al., 2014).
Главный недостаток – плохое пространственное разрешение, поскольку путь света через ткань по сути неизвестен. Исследование глубоких структур также представляет проблему для NIRS из-за ограниченного проникновения.
3.5. Ядерная визуализация
Подходы ядерной медицины с использованием либо однофотонной эмиссионной томографии (ОФЭКТ), либо позитронно-эмиссионной томографии (ПЭТ) были разработаны для визуализации различных физиологических и биохимических процессов в развивающемся мозге.
В ПЭТ-сканировании используются радиоактивно меченные индикаторы с короткоживущими изотопами, испускающими позитроны, которые реагируют с электронами, выделяя высокоэнергетические гамма-лучи, обнаруживаемые ПЭТ-камерой. Скорость местного метаболизма глюкозы в головном мозге оценивается in vivo с использованием 2-дезокси-2 [18F] -фтор-D-глюкозы (FDG) (Huang et al., 1980). В отличие от этого, в ОФЭКТ используются соединения, излучающие гамма-излучение, при этом обнаружение одиночного гамма-излучения ограничивает его пространственное разрешение (5–7 мм для ОФЭКТ по сравнению с 3–4 мм для ПЭТ). Индикаторы ОФЭКТ можно использовать для оценки церебрального кровотока.
В то время как ПЭТ и ОФЭКТ использовались для измерения биохимических процессов у детей с нарушениями развития, ПЭТ также применялась к новорожденным. Новорожденных с различными типами черепно-мозговых травм, включая перинатальную гипоксию-ишемию и внутрижелудочковое кровоизлияние, оценивали с помощью ПЭТ (Doyle et al., 1983), и было показано, что низкий метаболизм глюкозы связан либо со снижением кровотока, либо с задержкой развития (Suhonen-Polvi). и др., 1993).
Было обнаружено, что результаты ПЭТ в течение первых трех недель жизни коррелируют с интегрированной по амплитуде ЭЭГ и позволяют прогнозировать исход развития нервной системы после перинатальной асфиксии (Thorngren-Jerneck et al., 2001) (рис. 11).
Рисунок 11: Позитронно-эмиссионная томография (ПЭТ). Скорость церебрального метаболизма глюкозы измеряется в подостром периоде (10-11 дней) после перинатальной асфиксии у трех детей (по одному на столбец) с разной степенью гипоксически-ишемической энцефалопатии и отображается на уровне мозжечка (верхний ряд), таламуса. (средний ряд) и сенсомоторной коры (нижний ряд). У новорожденного справа развился церебральный паралич с осложненными припадками. Новорожденный слева был здоровым при двухлетнем наблюдении. Адаптировано с разрешения Thorngren-Jerneck et al.
Как правило, роль ядерной визуализации, включая ПЭТ и ОФЭКТ, у новорожденных очень ограничена, учитывая естественное воздействие ионизирующего излучения. Несмотря на то, что она все еще считается относительно низкой, расчетный эквивалент эффективной дозы на все тело в исследованиях, проведенных Thorngren-Jerneck et al. составил 0,16–0,17 мЗв / МБк. Если принять стандартный вес новорожденного 3,5 кг (IRCP, 2002) и следовать руководящим принципам введения радиофармпрепаратов на основе веса (Treves et al., 2016), расчетная введенная активность составит 14 МБк, что приведет к эффективной дозе примерно 2,4 мЗв.
Текущие ограничения и перспективы неонатальной визуализации головного мозга
Существует несколько методов визуализации для оценки перфузии мозга. Однако при визуализации новорожденного безопасность и осуществимость ограничивают доступные варианты. Как описано в этом обзоре, компьютерная томография и ядерная визуализация имеют технические преимущества, но присущие им риски, связанные с воздействием ионизирующего излучения, ограничивают их использование у новорожденных. С другой стороны, NIRS считается безопасным и легко применяемым у постели пациента, однако имеет ограниченное применение, учитывая его местную и несовершенную оценку перфузии мозга. В свете этого, ультразвук и МРТ в настоящее время кажутся наиболее подходящими методами визуализации для соответствия ограничениям и особенностям новорожденных.