Автори: Mark W. Byrne, James Q. Hwang
КЛЮЧОВІ СЛОВА: Ультразвук, шок, пацієнти в критичному стані
Пацієнти в критичному стані в екстремальних умовах являють собою одну з найсерйозніших проблем для служб порятунку і реаніматологів. Після прибуття в відділення невідкладної допомоги (ВНД) або відділення інтенсивної терапії (ВІТ) мало що відомо про медичний анамнез пацієнта або обставини, які призвели до цієї критичної ситуації. Пацієнти в тяжкому стані найчастіше не можуть надати дані свого медичного анамнезу через важку задишку, біль або зміни свідомості. Показники вітальних функцій і фізикальний огляд критично важливі для лікування пацієнтів, однак ці результати часто неспецифічні і можуть бути схожими при різних етіологіях шоку. Такі пацієнти часто надходять з нестабільною гемодинамікою, тому загальноприйняті реанімаційні заходи повинні бути розпочаті одночасно з проведенням початкової діагностичної оцінки. Важкість стану пацієнта диктує необхідність проведення ключових терапевтичних втручань до отримання лабораторних даних або консультативних діагностичних візуальних досліджень.
В даний час існує потреба у швидкому і завжди доступному методі діагностики пацієнтів в критичному стані. В якості такого методу було запропоновано ультразвукове дослідження, яке проводиться лікарем ультразвукової діагностики безпосередньо біля ліжка нестабільного пацієнта. Сонографічна оцінка пацієнтів в критичному стані надає цінну інформацію, яка допомагає клініцисту під час початкової оцінки і стабілізації недиференційованого шоку. Ця стаття покликана продемонструвати, як прицільне ультразвукове дослідження може бути використано для швидкої оцінки фізіологічної основи шоку у конкретного пацієнта, виявлення потенційно летальних, але оборотних станів, які можуть бути не діагностовані біля ліжка пацієнта. Ультрасонографія також допомагає направити реанімаційні заходи в правильне русло, зокрема, коли це стосується об’єму циркулюючої рідини. До теперішнього часу, застосування екстреної сонографії було направлено на візуалізацію патологічних змін захворювань і забезпечення ультразвукового наведення для інвазивних процедур. Ми пропонуємо відійти від такого традиційного використання і пропонуємо направляти ультразвукову оцінку на те, щоб оцінювати фізіологічні процеси, що лежать в основі шоку у пацієнтів в критичному стані, а також стежити за динамікою їх розвитку в реальному часі у відповідь на реанімаційні заходи.
Натисніть тут, щоб прочитати початок статті
Проекція ПВК включає в себе дослідження 3 різних областей: піддіафрагмальний простір, кишеню Морисона і нижній полюс правої нирки. Кишеня Морисона являє собою потенційний простір між печінкою і правої ниркою у пацієнта в положенні на спині, яке найбільш чутливе для виявлення вільної рідини у верхній частині живота. Для огляду правого субдіафрагмального простору і нижнього полюса правої нирки датчик переміщається краніально і каудально відповідно.
Проекція ЛВК також виходить шляхом встановлення датчика в коронарній площині. Так як селезінка обмежена за розміром і розташована більше дозаду, то проекція ЛВК найкраще виводиться із задньої пахвинної лінії. У проекції ЛВК аналогічним чином досліджується 3 різних області: субдіафрагмальний простір, спленоренальний простір і нижній полюс лівої нирки. Хоча спленоренальний простір часто прирівнюється до кишені Морисона, діафрагмально-товстокишкова зв’язка часто тісно зближує селезінку і нирку, і таким чином обмежує відтік внутрішньочеревної рідини в цю зону. Отже, значна кількість вільної внутрішньочеревної рідини може накопичуватися в піддіафрагмальному просторі або в зоні нижнього полюса лівої нирки, перш ніж його можна буде візуалізувати в спленоренальному просторі (рис. 11).
Рис. 11. Вільна рідина в ЛВК. Коронарна проекція ЛВК показує вільну рідину навколо селезінки.
Щоб дослідити лівий субдіафрагмальний простір і нижній полюс лівої нирки, датчик переміщується відповідно краніально і каудально.
При огляді тазу датчик переміщується трохи вище лобкового симфізу, при цьому сечовий міхур використовується в якості акустичного вікна. Оскільки таз являє собою кільцеподібну структуру, датчик повинен бути нахилений каудально, глибоко в таз, щоб візуалізувати відповідні структури. Дослідження таза включає огляд ректо-везікального простору у чоловіків і прямокишково-маткового простору (кишеню Дугласа) у жінок. Сагітальна проекція таза виходить шляхом установки датчика в сагітальну площину по серединній лінії. Після отримання сагітальної проекції, датчик може бути повернений на 90 градусів для отримання поперечної проекції таза. У порівнянні з поперечною проекцією, сагітальна проекція може бути більш чутливою для виявлення невеликого об’єму рідини в тазу (рис. 12). Складність отримання адекватної проекції в області таза може бути пов’язана з випорожненням сечового міхура або занадто краніальним розташуванням датчика.
Рис. 12. Вільна рідина в порожнині тазу. Сагітальна проекція таза показує вільну рідину в ректовезикальному просторі, яка прилягає до газу в кишечнику і повного сечового міхура.
Підреберна проекція серця виходить шляхом розташування датчика трохи нижче мечоподібного відростка. При цій проекції ліва частка печінки використовується як акустичне вікно, а лицьова частина датчика розташовується під кутом від живота до серця. Складність отримання адекватної підреберної проекції серця може бути пов’язана із занадто каудальним розташуванням датчика або на недостатню глибину, коли ключові структури залишаються поза увагою. Якщо підреберний доступ пов’язаний з обмеженнями, слід використовувати альтернативне вікно, наприклад, в парастернальній або апікальній проекціях.
АОРТА
Гостра патологія аорти завжди повинна враховуватися у пацієнтів з недиференційованим шоком. Деякі ургентні ураження аорти, такі як аневризма і розшарування, можуть мати класичні симптоми: біль в животі або фланку, або біль в грудях з іррадіацією в спину. Однак вони можуть також проявлятися більш неспецифічно у вигляді втрати свідомості, запаморочення, неврологічних симптомів, ішемії кінцівок або зупинки серця. Патологія аорти часто не виявляється при фізикальному обстеженні, тому пацієнти можуть мати безсимптомний прояв хвороби до тих пір, поки не відбудеться розрив або розшарування. Швидке втручання є ключовим етапом, тому ультразвукове дослідження аорти у пацієнтів у ліжку може прискорити початок лікування і врятувати життя.
Для АЧА, проведене клініцистом ультразвукове дослідження є відмінним неінвазивним методом скринінгу з чутливістю від 94% до 98%. Можливість виявлення АЧА може поліпшити результати лікування пацієнтів, оскільки було доведено, що ймовірність летального результату знижується, якщо діагноз був встановлений до або незабаром після розриву аневризми. Ультразвук є відмінним інструментом для виявлення наявності АЧА, однак має обмеження з точки зору здатності оцінювати розрив. У рідкісних випадках (<4% випадків) ультразвукове дослідження може виявляти ознаки, які вказують на розрив аневризми аорти. Зазвичай це черевна гематома, проте також можуть бути виявлені і інші симптоми: уривчастість тромбу, уривчастість стінки аорти або вільна рідина в черевній порожнині.
При розшаруванні аорти смертність також може бути високою, і, коли мова йде про висхідний відділ аорти, раннє хірургічне втручання, як відомо, покращує результати лікування. Тому УЗД біля ліжка пацієнта, хоч і є субоптимальним з точки зору чутливості, може мати важливе клінічне значення, так як візуалізація клаптика інтими аорти може впливати на подальший діагностичний алгоритм і прискорити початок лікування (рис. 13).
Рис. 13. Розширене гирло аорти. Парастернальна поздовжня проекція серця, демонструє сильно розширене гирло аорти. Мобільний відшарований клапоть візуалізований в режимі реального часу.
Трансторакальна ехокардіографія показала чутливість між 59% і 83%, а специфічність між 63% і 93% для діагностики розшарування аорти. Її чутливість у виявленні розшарування висхідної аорти (де діагноз необхідно поставити ще швидше) вище в порівнянні з розшаруванням низхідної грудної аорти. Для пацієнтів, у яких візуалізується відшарований клапоть, ультразвукове дослідження у ліжку, може ідентифікувати особливості розшарування висхідної аорти, які вказують на високий ризик і загрозу розриву: виражена дилатація проксимального відділу аорти, перикардіальний випіт і аортальна недостатність.
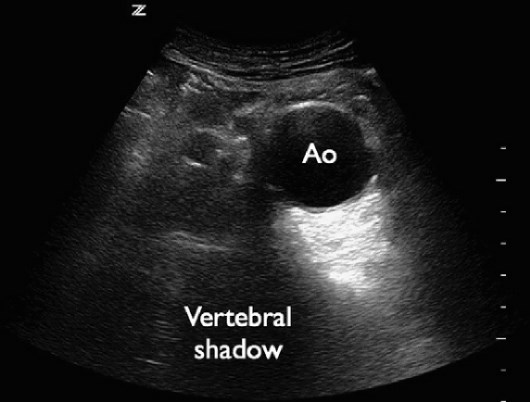
Абдомінальна аорта візуалізується як в поперечній, так і в сагітальній площинах. Для цього дослідження зазвичай використовується конвексний датчик від 2 до 5 МГц, хоча також може бути достатньо мікроконвексного або фазованого датчика. Дослідження починається в субксіфоїдальній області, при цьому тіла хребців використовуються в якості орієнтира для ідентифікації аорти. Аорта розташована спереду і зліва від тіла хребця (рис. 14).
Рис. 14. AЧA. Поперечна проекція черевної аорти з аневризмою.
Проксимальний, середній і дистальний діаметри черевної аорти вимірюються від зовнішньої стінки до зовнішньої стінки в передньо-задньому напрямку з використанням зображень, які отримані в поперечній площині. Нижче біфуркації аорти також повинні бути виміряні клубові артерії. Виконання вимірювань в поперечній (а не в сагітальній) площині зменшує ймовірність отримання позавісьової проекцій і, отже, недооцінки розміру аорти. Як тільки абдомінальна аорта візуалізується від проксимального до дистального рівня, датчик повертається на 90 градусів в сагітальну площину (рис. 15).
Рис. 15. AЧA. Сагітальна проекція черевної аорти з аневризмою.
Сагітальна проекція дозволяє спростити візуалізацію локальних випинань (мішкоподібні аневризми) і уточнити локалізацію будь-яких виявлених аномалій уздовж довгої вісі тіла. Коли зображення обмежене надмірним метеоризмом в кишечнику, дозована компресія допомагає поліпшити візуальну картину. Однак, подібні технічні обмеження дослідження можуть зустрічатися в 5-10% випадків.
Грудна аорта може бути візуалізована за допомогою комбінації декількох різних проекцій. Гирло аорти можна вивчити і виміряти в парастернальній поздовжній проекції серця. Для оцінки дуги аорти можна використовувати область супрастернальної ямки. Відділи низхідної грудної аорти можуть бути візуалізовані в віддаленому полі як в парастернальній, так і апікальній кардіологічній проекції. Абдомінальні проекції аорти також можуть бути використані для визначення поширення патологічних змін до черевної аорти (рис. 16).
Рис. 16. Розшарування черевної аорти. Сагітальна проекція черевної аорти з відшарованим клаптем.
Якщо підозрюється наявність видимого клаптя інтими, важливо підтвердити або спростувати цю знахідку в ще одній проекції. Крім того, ехокардіографію можна використовувати для оцінки ознак високого ризику розшарування аорти, таких як перикардіальний випіт і аортальна недостатність.
ЛЕГЕНІ
Традиційно вважалося, що ультразвук мало ефективний для оцінки легень. Оскільки ультразвукові хвилі відбиваються від повітря, склалася думка, що сонографія не є методом візуалізації легень або оцінки пов’язаної з ними патології. Проте, ультразвукове дослідження легень показало, що може бути цінним інструментом для діагностики різних патологічних станів, включаючи пневмоторакс, набряк легень, плевральний випіт і альвеолярну консолідацію (інфільтрацію).
ПНЕВМОТОРАКС
Ультразвукове дослідження легень широко вивчено при діагностиці пневмотораксу у пацієнтів з травмою. При цьому було продемонстровано чутливість, яка перевершувала чутливість рентгенографії грудної клітини. Пневмоторакс не є рідкісним явищем у пацієнтів в критичному стані. Він може виникати як ускладнення обструктивного захворювання легень, як при важкій астмі або загостренні хронічного обструктивного захворювання, або через надмірний тиск на альвеоли, який отримують пацієнти, що перебувають на штучній вентиляції легень з позитивним тиском. Пневмоторакс також може розвиватися ятрогенно після інвазивних процедур, таких як введення катетерів у внутрішні яремні або підключичні вени, розміщення кардіостимулятора або перикардіоцентезу.
Оцінка пневмотораксу проводиться через передню стінку грудної клітки в сагітальній проекції по середньо-ключичній лінії. Для кращої візуалізації поверхневих структур під час цього дослідження доцільним є датчик з лінійною матрицею від 5 МГц до 10 МГц, хоча також може бути досить мікроконвексного або конвексного датчика, з установкою на поверхневі структури. Зазвичай оцінюється друге-п’яте міжреберні простори, хоча для деяких цілей було запропоновано більш об’ємне охоплення грудної клітки, наприклад, для ідентифікації точки легені і оцінки розміру пневмотораксу (описано нижче). Також може бути проведена більш комплексна оцінка грудної клітки при підозрі на обмежений пневмоторакс.
Наявність або відсутність пневмотораксу визначають за допомогою оцінки плеврального дотику. Поверхня плеври візуалізується сонографічно до розсіювання ультразвукових хвиль при досягненні заповнених повітрям альвеол. За відсутності пневмотораксу, рух парієтальної і вісцеральної плеври один проти одного викликає мерехтливу або блискучу картину, яка називається ковзанням легень. Ковзання легень – це динамічна ознака, яка визначається тільки при дослідженні в реальному часі, хоча сонографія в M-режимі може використовуватися для документування легеневого ковзання на нерухомих зображеннях. Відсутність руху тканин, стінки грудної клітки, проявляється як повторювані горизонтальні лінії в ближньому полі, тоді як ковзання вісцеральної і парієтальної плеври створює зернисту картину. Обидва ці прояви на зображеннях в M-режимі порівнюються з хвилями на пляжі, і тому їх назвали ознакою «морського узбережжя» (рис. 17).
Рис. 17. Нормальна легеня в М-режимі. Сагітальна проекція грудної клітки на рівні плеврального зіткнення. Зображення з використанням M-режиму демонструє нормальну легеню: ознака «морського узбережжя».
При наявності пневмотораксу повітря відокремлює парієтальну плевру від вісцеральної, а ковзання легень на УЗД відсутнє. Плевральна поверхня проявляється як статична лінійна смуга в режимі реального часу, що не має характерної мерехтливої картини. При візуалізації з використанням M-режиму повторювані горизонтальні лінії видно по всьому екрану як в ближньому, так і в віддаленому полі, що призводить до картини, яка позначається як ознака «штрихового коду» (рис. 18).
Рис. 18. Пневмоторакс в М-режимі. Сагітальна проекція грудної стінки на рівні поверхні плеври з використанням M-режиму показує ознаку пневмотораксу: ознака «штрихового коду».
Було запропоновано, щоб розмір пневмотораксу оцінювався шляхом проведення більш ретельної сонографічної оцінки грудної стінки. Переміщення датчика від верхньої частини грудної стінки (де збирається повітря при невеликому пневмотораксі) до нижніх відділів (в яких повітря визначається тільки при великому пневмотораксі) може бути корисним при визначенні меж пневмотораксу. Точка переходу між наявністю і відсутністю ковзання легень, яка відповідає межам неповного пневмотораксу уздовж грудної стінки, була названа точкою легені і вважається патогномонічним симптомом для пневмотораксу. Точка легені є динамічною ознакою, яка визначається в зоні, де відсутність ковзання легені чергується з переривчастою картиною нормального ковзання легені, в той час, поки ультразвуковий датчик утримується нерухомим в певному місці на стінці грудної клітки. Це явище викликане тимчасовим контактом вісцеральної і парієтальної плеври, коли вдих збільшує об’єм легень і, отже, збільшує площу поверхні легень при контакті з грудною стінкою. Напружений пневмоторакс призводить до відсутності ковзання легень по всій ураженій половині грудної клітки, оскільки повне накопичення повітря відокремлює легеню від грудної стінки.
Відсутність ознаки ковзання легень не є патогномонічним для пневмотораксу і може спостерігатися при іншій патології. Незважаючи на те, що ультразвукове дослідження легень має відмінну чутливість для виявлення наявності пневмотораксу, особливо при травмі, специфічність відсутності ознаки ковзання для діагностики пневмотораксу обмежена у пацієнтів з комбінованим ураженнями. Відсутність ковзання легень, що імітує пневмоторакс, може також спостерігатися при плевральних буллах, спайках і рубцях. Крім того, відсутність ковзання легені над половиною грудної клітки може бути виявлено при односторонній інтубації головного правого або лівого бронха. При ретельній оцінці грудної стінки візуалізація ознаки ковзання легень надійно виключає пневмоторакс, особливо напружений пневмоторакс, в якості причини гіпоксії або гіпотонії. Однак слід враховувати й інші стани, при яких відсутнє ковзання легень, коли потрібна додаткова візуальна оцінка.
НАБРЯК ЛЕГЕНЬ
Незважаючи на те, що ультрасонографічні ознаки набряку легень вперше були виявлені понад десять років тому, тільки в останні роки УЗД почало впроваджуватися в клінічну практику у ВНД і ВІТ. Набряк легень є однією з найбільш частих причин під час вступу до лікарні пацієнтів з гострою задишкою. Кардіогенний шок призводить до важкого набряку легень, оскільки недостатній серцевий викид викликає застій рідини в легенях. Набряк легень на ранній стадії проявляється тим, що рідина накопичується в інтерстиційному просторі легень, яке може бути виявлено за допомогою ультразвуку у вигляді сонографічних В-ліній. Коли набряк легень прогресує, починають наповнюватися рідиною альвеоли.
Хвости комети – це різновид артефакту реверберації, який з’являється через нерівності плевральної поверхні і визначається при сонографії нормальної легені. Вони виглядають як короткі вертикальні ехогенні лінії, які простягаються від плевральної межі і зникають в межах декількох сантиметрів (рис. 19).
Рис. 19. Артефакт хвоста комети. Сагітальна проекція грудної стінки на рівні поверхні плеври показує нормальний артефакт хвоста комети.
Артефакти хвости комети рухаються разом з нормальним ковзаючим рухом легень, а їх присутність виключає наявність пневмотораксу на даному рівні на грудній клітці. Сонографічні B-лінії є вертикальними ехогенними лініями, які простягаються від поверхні плеври через поле зору без загасання (рис. 20).
Рис. 20. Сонографічні В-лінії. Сагітальна проекція грудної стінки в одному міжребер’ї демонструє сонографічні В-лінії.
При цьому дуже важливо, щоб глибина зображення була встановлена на 16-18 см для того, щоб диференціювати артефакти хвоста комети, які зникають в декількох сантиметрах від поверхні плеври, від сонографічних В-ліній, які простягаються аж до кінця екрану. Легеневий набряк призводить до появи множинних (≥3) B-ліній в межах одного міжреберного простору. В-лінії відповідають потовщеним міжчасточковим перетинкам, які набухають за рахунок позасудинної легеневої рідини. В-лінії з’являються дифузно в обох половинах грудної клітки при гострому набряку легень. Дана сонографічна ознака називається інтерстиційним синдромом (рис. 21).
Рис. 21. Набряк легень. Сагітальна проекція грудної стінки демонструє множинні сонографічні В-лінії в декількох міжреберних проміжках при набряку легень.
Коли набряк легень прогресує, окремі В-лінії можуть зливатися, і все міжребір’я стає гіперехогенним, що називається «білою» легенею (рис. 22). І навпаки, коли легеневий набряк усувається під час лікування, В-лінії, відповідно, зникають.
Рис. 22. Важкий набряк легень. Сагітальна проекція грудної стінки демонструє множинні гіперехогенні міжреберні проміжки (біла легеня). Ознаки характерні для вираженого набряку легень.
Подібно оцінці пневмотораксу, оцінка сонографічних В-ліній виконується з боку передньої грудної стінки в сагітальній проекції, як правило, у другому або третьому міжребер’ї по середньо-ключичній лінії. Дослідження може бути розширено до верхньої бічної стінки грудної клітки для поліпшення чутливості методики. Однак, у пацієнтів в критичному стані, у яких розвивається гіпоксія через сильний набряк легень, або гіпотензія через кардіогенний шок, однієї проекції через передню грудну стінку має бути достатньо. Більш варіабельні області легені (задні, при положенні пацієнта на спині, або нижні, при вертикальному положенні пацієнта) більш інтенсивно кровопостачаються, тому розсіяні В-лінії тут можуть бути звичайною знахідкою. На відміну від дослідження легень при пневмотораксі, при якому використовується високочастотний лінійний матричний датчик для фокусування на поверхневих структурах в межах плевральної поверхні, ультразвукова оцінка при набряку легень повинна виконуватися з використанням низькочастотного конвексного, мікроконвексного або фазованого датчика, з налаштуванням на глибину від 16 до 18 см. Типові лінійні датчики дають зображення в діапазоні від 3 до 6 см, тому такі артефакти, як хвіст комети і сонографічні В-лінії можуть виходити за межі далекого поля зору, що потенційно призводить до помилкової інтерпретації цих двох ознак.
Сонографічні В-лінії не є специфічними для набряку легень і можуть бути помічені при інших патологічних процесах, які уражують інтерстицій, включаючи інтерстиційні пневмонії і хронічні стани, як, наприклад, легеневий фіброз. Гострий респіраторний дистрес-синдром (ГРДС), зазвичай зустрічається у ВІТ, може також призвести до появи сонографічних В-ліній. Однак B-лінії при ГРДС чергуються з областями нормального ковзання легень, що відповідає неоднорідності ураження при цьому стані (рис. 23).
Рис. 23. ГРДС. Сагітальна проекція грудної стінки демонструє гіперехогенне міжребер’я (біла легеня), яке прилягає до легені з нормальною ехотекстурою. Ознаки характерні для ГРДС.
Крім того, часто візуалізується потовщена плевральна лінія в зонах легені, які залучені в ГРДС. Коли сонографічні В-лінії мають двосторонню і дифузну структуру, найбільш імовірним основним процесом є набряк легенів. У поєднанні з ехокардіографічними даними – низькою ФВ і повнокровною НПВ, особливо на тлі відповідної клінічної картини, наявність сонографічних B-ліній фактично діагностує набряк легенів.
АЛЬВЕОЛЯРНА КОНСОЛІДАЦІЯ (УЩІЛЬНЕННЯ)
З точки зору того, що ультразвукове дослідження не достатньо ефективне при діагностиці патології легень, вважається, що альвеолярна консолідація не визначається за допомогою ультразвуку. Незважаючи на те, що ідентифікація пневмотораксу і набряку легень залежить від інтерпретації артефактів, що виникають на поверхні плеври, альвеолярна консолідація призводить до заповнення рідиною легеневої тканини, яка добре пропускає ультразвукові хвилі. Консолідована легеня має тканиноподібну сонографічну картину, подібно паренхімі печінки, тому була названа «печінковою» легенею (рис. 24).
Рис. 24. Альвеолярна консолідація (ущільнення). Сагітальна проекція ПВК над діафрагмою показує гепатизацію легеневої тканини. Ознака альвеолярної консолідації. Зверніть увагу на гіперехогенні сонографічні повітряні бронхограми (^) і межу між ущільненими і аерованими легенями (*).
На відміну від печінки, альвеолярна консолідація часто має сонографічні повітряні бронхограми, які проявляються як точкові або лінійні гіперехогенні непрозорі зони в консолідованій легеневій тканині. Крім того, межа між консолідованою і аерованою легенею має характерний вигляд. Тканиноподібна альвеолярна консолідація межує з нерівною, зазубреною та гіперехогенною лінією, яка представляє собою розсіяні ультразвукові хвилі від аерованої легені (див. рис. 24). Хоча альвеолярна консолідація має характерну сонографічну картину, вона може бути результатом різноманітних патологічних процесів, найчастіше інфекційних, але також: механічних (бронхіальна обструкція), гідростатичних (набряк легенів) і травматичних (забої легень). Сонографічна візуалізація альвеолярної консолідації може виявитися ефективною при пошуку основної причини гіпоксії або джерела інфекції при септичному шоці, особливо з урахуванням досить низької якості рентгенограм грудної клітки, які отримані у пацієнтів в критичному стані при ГРДС на переносному рентгенографічному апараті.
ПЛЕВРАЛЬНИЙ ВИПІТ
На відміну від більш нових варіантів використання ультразвуку для органів дихання, про які говорилося вище, УЗД широко використовується для діагностики плеврального випоту. Він може бути виявлений під час спеціалізованої легеневої ультразвукової оцінки або в рамках абдомінального обстеження (піддіафрагмальна проекція ПВК і ЛВК), або під час ехокардіографії (парастернальна поздовжня проекція і апікальна проекція). Плевральний випіт – досить поширений патологічний стан у пацієнтів з важкими захворюваннями, який може бути результатом серцевої недостатності, станів об’ємного перевантаження, парапневмонічних випотів або емпієми. Великі плевральні випоти можуть викликати значні порушення дихання і гіпоксію. Однак виявлений плевральний випіт сам по собі, як правило, не може бути причиною гіпотензії у хворих в критичному стані, як може бути в разі виявлення великого гемотораксу у пацієнтів з травмою.
ІНТЕГРАЦІЯ СОНОГРАФІЧНИХ ДАНИХ ПРИ ШОЦІ
Хоча окремі результати ультразвукового дослідження можуть свідчити про певні види шоку, інтеграція комбінації результатів може більш ефективно звузити диференційний діагноз, виключивши певні патологічні стани, а в деяких випадках може остаточно встановити діагноз. Саме на основі інтеграції всіх ультразвукових даних створені такі протоколи, як протокол RUSH, який особливо ефективний для правильного визначення фізіологічної основи шоку (таблиця 2).
Таблиця 2
Загальні дані при ультразвукової оцінці пацієнтів в критичному стані за категоріями шоку
| Гіповолемічний | Дистрибутивний (перерозподільний) | Кардіогенний | Обструктивний | |
| Серце | Невелике, гіпердинамічне | Гіпердинамічне | Важке пригнічення | Випіт, розширення ПШ |
| НПВ | Колапс | Колапс | Повнокров’я | Повнокров’я |
| Живіт | Геморагічна вільна рідина | Перитонеальна вільна рідина | – | – |
| Аорта | Розшарування АЧА | – | – | – |
| Легені | Нормальне ковзання легень | Випіт, ущільнення | Випіт, В-лінії | Відсутність ковзання легень |
Щоб проілюструвати, як це працює: зниження ФВ саме по собі не обов’язково вказує на виключно кардіогенну етіологію шоку, оскільки пацієнти можуть мати в анамнезі кардіоміопатію, також зниження ФВ може розвиватися через прогресуючий сепсис. Зниження ФВ в поєднанні з повнокров’ям НПВ і дифузними двосторонніми B-лініями – набагато більш переконливі дані на користь діагнозу кардіогенного шоку. І навпаки, нормальний або гіпердинамічний ЛШ і ФВ не завжди виключають наявність кардіогенного шоку.
Гостра патологія клапанів, така як гостра аортальна або мітральна недостатність, або інфаркт міокарда правобічної локалізації, також можуть привести до кардіогенного шоку. Як вже було сказано, оцінка патології клапанів виходить за рамки більшості лікарів екстреної допомоги, однак паралельно отримані дані можуть бути корисними. Повнокровна НПВ повинна визначатися при значному правобічному інфаркті міокарда, а дифузні двосторонні В-лінії повинні виявлятися при гострій аортальній або мітральній недостатності.
При гіповолемічному шоці, ультразвукова оцінка зазвичай виявляє гіпердинамічну ФВ, НПВ, що спалася і відсутність В-ліній. Розміри ЛШ можуть здаватися незначними через зменшення внутрішньосудинного об’єму. Інші дані ультразвукового протоколу можуть виявляти специфічні причини гіповолемії, наприклад, збільшений діаметр аорти у літнього пацієнта з розривом ААА, або велику кількість вільної рідини в очеревинній порожнині у молодої пацієнтки з розривом позаматкової вагітності.
При септичних та інших формах перерозподільного шоку характерна гіпердинамічна ФВ, НПВ, що спалася і відсутність B-ліній. На більш пізніх стадіях септичного шоку може спостерігатися серцева дисфункція та зниження ФВ. Повнокровна НПВ може супроводжувати гіповолемічний і септичний шок у пацієнтів з хронічною легеневою гіпертензією або правобічною серцевою недостатністю. Незважаючи на те, що НПВ, яка спалася, вказує на внутрішньосудинне виснаження об’єму у пацієнта з гіпотензією, повнокровна НПВ не обов’язково означає, що пацієнт перевантажений за об’ємом.
При обструктивному шоці, НПВ має повнокровний вигляд. Коли причиною перешкоди є тампонада серця, рідина визначається по периферії серця, і при цьому може бути оцінена інверсія правого передсердя і/або шлуночка. При напруженому пневмотораксі відсутнє ковзання легені над ураженої зоною, як правило, по всій половині грудної клітки. У разі масивної ТЕЛА, часто спостерігається невеликий, гіпердинамічний ЛШ, трохи сплющена міжшлуночкова перегородка і значне збільшення ПШ. Незважаючи на те, що ідентифікація супутнього тромбозу глибоких вен нижньої кінцівки з використанням сонографії біля ліжка пацієнта не була раніше частиною протоколу, описаного вище, вона додатково вказує на ймовірність розвитку ТЕЛА. У деяких випадках вільно флотуючий тромб в правому відділі серця може бути виявлений під час сонографії, що вважається прямим доказом ТЕЛА.
ПОСІБНИК ПО КОРЕКЦІЇ ВНУТРІШНЬОСУДИННОГО ОБ’ЄМУ
Сонографія є неінвазивним «помічником» в проведенні реанімаційних заходів по корекції об’єму у пацієнтів з гіпотонією і шоком. Традиційні показники об’єму, такі як ЦВТ, отриманий з центрального венозного катетеру, або тиск заклинювання в легеневих капілярах (ТЗЛК), виміряний за допомогою катетеру в легеневій артерії, є інвазивними і вимагають багато часу. Як відомо, ЦВТ має обмежену прогностичну цінність для оцінки гемодинамічної відповіді на проведення інфузії, хоча зазвичай використовується в якості вимірювання попереднього навантаження в протоколі ранньої прицільної терапії септичного шоку. Введення катетера (Swan Ganz) в легеневу артерію для вимірювання ТЗЛК було колись поширене у ВІТ, в якості альтернативи оцінки тиску наповнення лівого шлуночка. Однак, проведені дослідження не показали переваг. В даний час респіраторні коливання артеріального пульсового тиску мають найкращу прогностичну цінність для оцінки гемодинамічної реакції на об’ємну інфузію у пацієнтів з гіпотензією.
Ультрасонографія була запропонована в якості швидкого, доступного засобу оцінки стану об’ємного статусу пацієнта під час поступлення і для подальшого контролю інфузії рідини під час лікування. Концепція використання ультразвукового контролю інфузії рідини для проведення реанімації була вказана в обговоренні вимірювань НПВ (див. Таблицю 1). При первинному поступленні пацієнта в шоковому стані, невеликий діаметр НПВе (<1,5 см) і повний (або майже повний) її колапс при вдиху, вказує на виснаження внутрішньосудинного об’єму і на необхідність агресивного внутрішньовенного введення рідини. У міру збільшення об’єму інфузії, НПВ поступово збільшується в діаметрі, а коливання її розміру при вдиху зменшуються. Як тільки її параметри наближаються до тих, які спостерігаються при повнокровній НПВе (> 2,5 см), при цьому відсутній (або мінімальний) колапс при вдиху, подальше введення рідини має бути більш обережним. Якщо у пацієнта зберігається гіпотензивний стан або ознаки неадекватної перфузії, необхідно починати вазопресорну або інотропну терапію. Таким чином, послідовна ультразвукова оцінка НПВ, аналогічна принципам вимірювань ЦВТ, може використовуватися для контролю відносного об’єму та адекватності введення рідини при проведенні реанімаційних заходів в реальному часі.
Повнокровна НПВ, яка визначається при первинному поступленні у пацієнта в шоковому стані, не виключає можливий позитивний ефект, від проведення інфузійної терапії. Незважаючи на те, що повнокровна НПВ може служити альтернативною ознакою об’ємного перевантаження при кардіогенному шоці, вона також спостерігається при шоці обструктивної етіології, коли введення рідини, найчастіше, надає позитивний ефект, також як і при ізольованій правобічній серцевій недостатності і хронічній легеневій гіпертензії. Тому, повнокровну НПВ не слід інтерпретувати як ізольовану ознаку, а рішення по тактиці лікування таких пацієнтів повинні прийматися в рамках всього ультразвукового обстеження, а також в контексті історії хвороби пацієнта і поточних клінічних симптомів.
Оцінка функції ЛШ може також визначати необхідну інтенсивність внутрішньовенної інфузії пацієнту при шоці. Аналогічно, при НПВ, що спалася, камері серця малих розмірів і гіпердинамічній функції ЛШ передбачається гіповолемічний або дистрибутивний шок, що в більшості випадків дозволяє безпечно проводити подальше збільшення об’єму рідини. Навпаки, знижена функція ЛШ, як ізольована знахідка, не обов’язково означає, що гіпотензія пацієнта зумовлена кардіогенним шоком, або що додаткова інфузія матиме негативний ефект. Це скоріше вказує на те, що у пацієнта буде швидше розвиватися набряк легенів, при проведенні надмірно агресивної об’ємної інфузії. Якщо у таких пацієнтів підозрюється виснаження об’єму, рекомендуються менші об’єми рідини і ретельна переоцінка параметрів після кожного наступного болюсного введення.
Відповідно до одного із запропонованих алгоритмів, протокол FALLS (Fluid Administration Limited by Lung Sonography – введення рідини під контролем сонографії легень), проведення інфузії у пацієнта з гіпотензією рекомендується до тих пір, поки не з’являться ранні сонографічні ознаки набряку легень. Вважається, що набряк легень і подальша гіпоксія, є основними обмеженнями для подальшого введення рідини у пацієнтів у критичному стані, особливо при сепсисі та інших типах перерозподільного шоку. Оскільки сонографічні В-лінії є ранньою ознакою інтерстиційного набряку, пропонується, щоб їх наявність була використана в якості кінцевої точки для корекції об’єму в ході реанімації. Якщо в цей момент у пацієнта зберігається гіпотензія, то необхідно застосовувати вазопресори або інотропні препарати. Протокол FALLS може бути особливо ефективним у пацієнтів з анамнезом правобічної серцевої недостатності, або легеневою гіпертензією з гіповолемічним або перерозподільним шоком. У цих пацієнтів НПВ може бути спочатку повнокровною, і тому не може служити в якості ефективного показника, що відображає внутрішньосудинний об’єм. Протокол FALLS також може бути ефективним для визначення можливості додаткової об’ємної інфузії у пацієнтів з кардіоміопатією в анамнезі з гіповолемічним або дистрибутивним шоком.
РЕЗЮМЕ
Ультразвукова оцінка пацієнтів в критичному стані при шоці є новий спосіб мислення в ультрасонографії, яка нещодавно була визнана ACEP «реанімаційним ультразвуковим дослідженням». Протокол RUSH служить стандартним підходом до сонографічної оцінки нестабільних пацієнтів з недиференційованим шоком. Лікарі, які надають невідкладну допомогу, тепер можуть безпосередньо візуалізувати фізіологічну основу шоку і виключати ряд загрожуючих життю, але потенційно оборотних, патологічних станів протягом декількох хвилин, не залишаючи палату пацієнта. При цьому можна звузити спектр диференціальних діагнозів, що підвищує впевненість в точності попередньої діагностики. Лікарю не потрібно починати емпіричні реанімаційні заходи наосліп, а замість цього підбирати тактику лікування до певної категорії шоку, а в деяких випадках – до конкретного діагнозу.
Деякі з нових технологій вимагають проведення остаточних досліджень до прийняття в клінічну практику, однак певні приклади показали, як ультразвук біля ліжка пацієнта може повністю позитивно змінити динаміку лікування. Більшість окремих компонентів протоколу RUSH знайомі лікарям-сонографістам і були перевірені при використанні біля ліжка хворого. Протокол просто служить структурованим підходом, який інтегрує безліч компонентів в єдине ціле. Мета проведеної клініцистом сонографії полягає не в заміні традиційних методів діагностики пацієнтів в критичному стані, а в їх доповненні. Ультрасонографія біля ліжка пацієнта є швидко доступним і неінвазивним інструментом для полегшення діагностики безлічі небезпечних для життя станів. Оскільки прицільне ультразвукове дослідження як і раніше використовується клініцистами у ВІТ, є надія, що пацієнтам вчасно поставлять точний діагноз на основі патофізіологічних проявів і швидше почнуть проводити оптимальне лікування.
У швидкій та якісній діагностиці Вам допоможе УЗД апарат General Electric Logiq E9. Рекомендуємо ознайомитись із детальними характеристиками апарату по посиланню.





















14.10.2019
Полина