Авторы: Mark W. Byrne, James Q. Hwang
КЛЮЧЕВЫЕ СЛОВА: Ультразвук, шок, пациенты в критическом состоянии
Пациенты в критическом состоянии в экстремальных условиях представляют собой одну из самых серьезных проблем для служб спасения и реаниматологов. По прибытии в отделение неотложной помощи (ОНП) или отделение интенсивной терапии (ОИТ) мало что известно о медицинском анамнезе пациента или обстоятельствах, которые привели к данной критической ситуации. Пациенты в тяжелом состоянии чаще всего не могут предоставить данные своего медицинского анамнеза из-за тяжелой одышки, боли или изменений в сознании. Показатели витальных функций и физикальный осмотр критически важны для лечения пациентов, однако эти результаты часто неспецифичны и могут практически совпадать при различных этиологиях шока. Такие пациенты часто поступают с нестабильной гемодинамикой, поэтому должны быть начаты общепринятые реанимационные мероприятия одновременно с проведением первоначальной диагностической оценки. Тяжесть состояния пациента диктует необходимость проведения ключевых терапевтических вмешательств до получения лабораторных данных или консультативных диагностических визуальных исследований.
В настоящее время существует потребность в быстром и всегда доступном методе диагностики пациентов в критическом состоянии. В качестве такого метода было предложено ультразвуковое исследование, которое проводится врачом ультразвуковой диагностики непосредственно у постели нестабильного пациента. Сонографическая оценка пациентов в критическом состоянии предоставляет ценную информацию, которая помогает клиницисту во время первоначальной оценки и стабилизации недифференцированного шока. Эта статья призвана продемонстрировать, как прицельное ультразвуковое исследование может быть использовано для быстрой оценки физиологической основы шока у конкретного пациента, выявления потенциально летальных, но обратимых состояний, которые могут быть не диагностированы у постели пациента. Ультрасонография также помогает направить реанимационные мероприятия в правильное русло, в частности, когда это касается объема циркулирующей жидкости. До настоящего времени, применение экстренной сонографии было сосредоточено на визуализации патологических изменений заболеваний и обеспечении ультразвукового наведения для инвазивных процедур. Мы предлагаем отойти от такого традиционного использования и предлагаем направлять ультразвуковую оценку на то, чтобы оценивать физиологические процессы, лежащие в основе шока у пациентов в критическом состоянии, а также следить за динамикой их развития в реальном времени в ответ на реанимационные мероприятия.
Нажмите тут, чтобы прочитать начало статьи
Проекция ПВК включает в себя исследование 3 различных областей: поддиафрагмальное пространство, карман Морисона и нижний полюс правой почки. Сумка Морисона представляет собой потенциальное пространство между печенью и правой почкой у пациента в положении на спине, которое наиболее чувствительное для обнаружения свободной жидкости в верхней части живота. Для осмотра правого субдиафрагмального пространства и нижнего полюса правой почки датчик перемещается краниально и каудально соответственно.
Проекция ЛВК также получается путем установки датчика в коронарной плоскости. Так как селезенка ограничена по размеру и расположена больше кзади, то проекция ЛВК лучше всего выводится из задней подмышечной линии. В проекции ЛВК аналогичным образом исследуется 3 различных области: субдиафрагмальное пространство, спленоренальное пространство и нижний полюс левой почки. Хотя спленоренальное пространство часто приравнивается к карману Морисона, диафрагмально-толстокишечная связка зачастую тесно сближает селезенку и почку, и таким образом ограничивает отток внутрибрюшинной жидкости в эту зону. Следовательно, значительное количество свободной внутрибрюшинной жидкости может накапливаться в поддиафрагмальном пространстве или в зоне нижнего полюса левой почки, прежде чем его можно будет визуализировать в спленоренальном пространстве (рис. 11).
Рис. 11. Свободная жидкость в ЛВК. Коронарная проекция ЛВК показывает свободную жидкость вокруг селезенки.
Чтобы исследовать левое субдиафрагмальное пространство и нижний полюс левой почки, датчик перемещается соответственно краниально и каудально.
При осмотре таза датчик помещения чуть выше лобкового симфиза, при этом мочевой пузырь используется в качестве акустического окна. Поскольку таз представляет собой кольцеобразную структуру, датчик должен быть наклонён каудально, глубоко в таз, чтобы визуализировать соответствующие структуры. Исследование таза включает осмотр ректо-везикулярного пространства у мужчин и прямокишечно-маточного пространства (карман Дугласа) у женщин. Сагиттальная проекция таза получается путем установки датчика в сагиттальную плоскость по срединной линии. После получения сагиттальной проекции, датчик затем может быть повернут на 90 град для получения поперечной проекции таза. По сравнению с поперечной проекцией, сагиттальная проекция может быть более чувствительной для обнаружения небольшого объема жидкости в тазу (рис. 12). Сложность получения адекватной проекции в области таза может быть связана с опорожнением мочевого пузыря или слишком краниальным положением датчика.
Рис. 12. Свободная жидкость в полости таза. Сагиттальная проекция таза показывает свободную жидкость в ректовезикальном пространстве, которая прилегает к газу в кишечнике и полному мочевому пузырю.
Подреберная проекция сердца получается путем установки датчика чуть ниже мечевидного отростка. При этой проекции левая доля печени использует как акустическое окно а лицевая часть датчика располагается под углом от живота к сердцу. Сложность получения адекватной подреберной проекции сердца может быть связана со слишком каудальным расположением датчика или недостаточной глубиной, когда ключевые структуры остаются вне поля зрения. Если подреберный доступ связан с ограничениями, следует использовать альтернативное окно, например, в парастернальной или апикальной проекциях.
АОРТА
Острая патология аорты всегда должна учитываться у пациентов с недифференцированным шоком. Некоторые ургентные поражения аорты, такие как аневризма и расслоение, могут иметь классические симптомы: боль в животе или фланке, или боль в груди с иррадиацией в спину. Однако они могут также проявляться более неспецифично в виде потери сознания, головокружения, неврологических симптомов, ишемии конечностей или остановки сердца. Патология аорты часто не обнаруживается при физикальном обследовании, поэтому пациенты могут иметь бессимптомное проявление болезни до тех пор, пока не произойдет разрыв или расслоение. Быстрое вмешательство является ключевым этапом, поэтому ультразвуковое исследование аорты у пациентов у кровати может ускорить начало лечения и спасти жизнь.
Для АБА, проведенное клиницистом ультразвуковое исследование является отличным неинвазивным методом скрининга с чувствительностью от 94% до 98%. Возможность обнаружения АБА может улучшить результаты лечения пациентов, поскольку было доказано, что вероятность летального исхода снижается, если диагноз был установлен до или вскоре после разрыва аневризмы. Ультразвук является отличным инструментом для обнаружения наличия АБА, однако имеет ограничения с точки зрения способности оценивать разрыв. В редких случаях (<4% случаев) ультразвуковое исследование может выявлять признаки, которые указывают на разрыв аневризмы аорты. Обычно это забрюшинная гематома, однако также могут быть выявлены и другие симптомы: прерывистость тромба, прерывистость стенки аорты или свободная жидкость в брюшной полости.
При расслоении аорты смертность также может быть высокой, и, когда речь идет о восходящем отделе аорты, раннее хирургическое вмешательство, как известно, улучшает результаты лечения. Поэтому УЗИ у постели пациента, хоть и является субоптимальным с точки зрения чувствительности, может иметь важное клиническое значения, так как визуализация лоскута интимы аорты может влиять на дальнейший диагностический алгоритм и ускорить начало лечения (рис. 13).
Рис. 13. расширенный корень аорты. Парастернальная продольная проекция сердца, демонстрирует сильно расширенный корень аорты. Мобильный отслоённый лоскут визуализирован в режиме реального времени.
Трансторакальная эхокардиография показала чувствительность между 59% и 83%, а специфичность между 63% и 93% для диагностики расслоения аорты. Её чувствительность в выявлении расслоения восходящей аорты (где диагноз необходимо поставить еще быстрее) выше по сравнению с расслоением нисходящей грудной аорты. Для пациентов, у которых визуализируется отслоенный лоскут, ультразвуковое исследование у постели пациента может идентифицировать особенности расслоения восходящей аорты, которые указывают на высокий риск и угрозу разрыва: выраженная дилатация проксимальной отдела аорты, перикардиальный выпот и аортальная недостаточность.
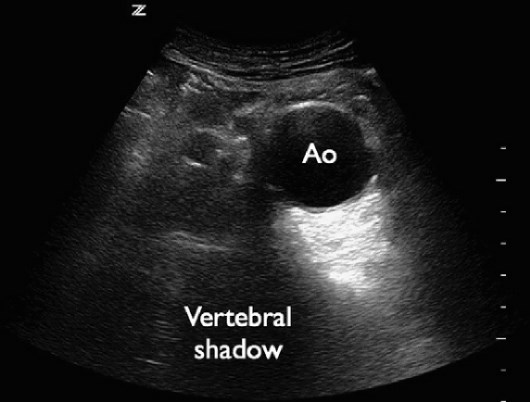
Абдоминальная аорта визуализируется как в поперечной, так и в сагиттальной плоскостях. Для этого исследования обычно используется конвексный датчик от 2 до 5 МГц, хотя также может быть достаточно микроконвексного или фазированного датчика. Исследование начинается в субксифоидальной области, при этом тела позвонков используются в качестве ориентира для идентификации аорты. Аорта расположена спереди и левее тела позвонка (рис. 14).
Рис. 14. AБA. Поперечная проекция брюшной аорты с аневризмой.
Проксимальный, средний и дистальный диаметры брюшной аорты измеряются от внешней стенки до внешней стенки в переднем заднем направлении с использованием изображений, которые получены в поперечной плоскости. Ниже бифуркации аорты также должны быть измерены подвздошные артерии. Выполнение измерений в поперечной (а не в сагиттальной) плоскости уменьшает вероятность получения внеосевых проекций и, следовательно, недооценки размера аорты. Как только абдоминальная аорта визуализирована от проксимального до дистального уровня, датчик поворачивается на 90 град в сагиттальную плоскость (рис. 15).
Рис. 15. AБA. Сагиттальная проекция брюшной аорты с аневризмой.
Сагиттальная проекция позволяет упростить визуализацию локальных выпячиваний (т. е. мешотчатых аневризм) и уточнить локализацию любых выявленных аномалий вдоль длинной оси тела. Когда изображение ограничено избыточным метеоризмом в кишечнике, дозированная компрессия помогает улучшить визуальную картину. Однако, подобные технические ограничения исследования могут встречаться в 5-10% случаев.
Грудная аорта может быть визуализирована с помощью комбинации нескольких разных проекций. Корень аорты можно изучить и измерить в парастернальной продольной проекции сердца. Для оценки дуги аорты можно использовать область супрастернальной ямки. Отделы нисходящей грудной аорты могут быть визуализированы в отдаленном поле как в парастернальной, так и апикальной кардиологической проекции. Абдоминальные проекции аорты также могут быть использованы для определения распространения патологических изменений до брюшной аорты (рис. 16).
Рис. 16. Расслоение брюшной аорты. Сагиттальная проекция брюшной аорты с отслоённым лоскутом.
Если подозревается наличие видимого лоскута интимы, важно подтвердить или опровергнуть эту находку в еще одной проекции. Кроме того, эхокардиографию можно использовать для оценки признаков высокого риска расслоенияе аорты, таких как перикардиальный выпот и аортальная недостаточность.
ЛЕГКИЕ
Традиционно считалось, что ультразвук не достаточно эффективен для оценки легких. Поскольку ультразвуковые волны отражаются от воздуха, сложилось мнение, что сонография не является методом визуализации легких или оценки связанной с ними патологии. Тем не менее, ультразвуковое исследование легких показало, что может быть ценным инструментом для диагностики различных патологических состояний, включая пневмоторакс, отек легких, плевральный выпот и альвеолярную консолидацию (инфильтрацию).
ПНЕВМОТОРАКС
Ультразвуковое исследование легких широко изучено при диагностике пневмоторакса у пациентов с травмой. При этом была продемонстрирована чувствительность, которая превосходила чувствительность рентгенографии грудной клетки. Пневмоторакс не является редким явлением у пациентов в критическом состоянии. Он может возникать как осложнение обструктивного заболевания легких, как при тяжелой астме или обострении хронического обструктивного заболевания, или из-за чрезмерного давления на альвеолы, которое испытывают пациенты на искусственной вентиляции легких с положительным давлением. Пневмоторакс также может развиваться ятрогенно после инвазивных процедур, таких как введение катетеров во внутренние яремные или подключичные вены, размещение кардиостимулятора или перикардиоцентеза.
Оценка пневмоторакса проводится через переднюю стенку грудной клетки в сагиттальной проекции по средне-ключичной линии. Для лучшей визуализации поверхностных структур во время этого исследования предпочтительным является датчик с линейной матрицей от 5 МГц до 10 МГц, хотя также может быть достаточно микроконвексного или конвексного датчика, с установкой на поверхностные структуры. Обычно оценивается второе-пятое межреберные пространства, хотя для некоторых целей был предложен более обширный охват грудной клетки, например, для идентификации точки легкого и оценки размера пневмоторакса (описано ниже). Также может быть проведена более комплексная оценка грудной клетки при подозрении на ограниченный пневмоторакс.
Наличие или отсутствие пневмоторакса определяют посредством оценки плеврального соприкосновения. Поверхность плевры визуализируется сонографически до рассеивания ультразвуковых волн при достижении заполненных воздухом альвеол. В отсутствие пневмоторакса, движение париетальной и висцеральной плевры друг против друга вызывает мерцающую или блестящую картину, которая называется сдвигом легких. Сдвиг легких – это динамический признак, который определяется только при исследовании в реальном времени, хотя сонография в M-режиме может использоваться для документирования легочного скольжения на неподвижных изображениях. Отсутствие движения ткани стенки грудной клетки проявляется как повторяющиеся горизонтальные линии в ближнем поле, тогда как скольжение висцеральной и париетальной плевры создает зернистую картину. Оба эти проявления на изображениях в M-режиме сравниваются с волнами на пляже, и поэтому их назвали признаком «морского побережья» (рис. 17).
Рис. 17. Нормальное легкое в М-режиме. Сагиттальная проекция грудной клетки на уровне плеврального соприкосновения. Изображение с использованием M-режима демонстрирует нормальное легкое: признак «морского побережья».
При наличии пневмоторакса воздух отделяет париетальную плевру от висцеральной, а сдвиг легких на УЗИ отсутствует. Плевральная поверхность проявляется как статическая линейная полоса в режиме реального времени, не имеющая характерной мерцающей картины. При визуализации с использованием M-режима повторяющиеся горизонтальные линии видны по всему экрану как в ближнем, так и в дальнем поле, что приводит к картине, которая обозначается как признак «штрихового кода» (рис. 18).
Рис. 18. Пневмоторакс в М-режиме. Сагиттальная проекция грудной стенки на уровне поверхности плевры с использованием M-режима показывает признак пневмоторакса: признак «штрихового кода».
Было предложено, чтобы размер пневмоторакса оценивался путем проведения более тщательной сонографической оценки грудной стенки. Перемещение датчика от самой верхней части грудной стенки (где собирается воздух при небольшом пневмотораксе) до нижних отделов (в которых воздух определяется только при большом пневмоторакс) может быть полезным при определении границ пневмоторакса. Точка перехода между наличием и отсутствием скольжения легких, которая соответствует границам неполного пневмоторакса вдоль грудной стенки, была названа точкой легкого и считается патогномоничным симптомом для пневмоторакса. Точка легкого является динамическим признаком, который определяется в зоне, где отсутствие скольжения легкого чередуется с прерывистой картиной нормального скольжения лёгкого, в то время, пока ультразвуковой датчик удерживается неподвижным в определенном месте на стенке грудной клетки. Это явление вызвано временным контактом висцеральной и париетальной плевры, когда вдох увеличивает объем легких и, следовательно, увеличивает площадь поверхности легких при контакте с грудной стенкой. Напряженный пневмоторакс приводит к отсутствию скольжения легких по всей пораженной половине грудной клетки, поскольку полное накопление воздуха отделяет подлежащее легкое от грудной стенки.
Отсутствие признака скольжения легких не является патогномоничным для пневмоторакса и может наблюдаться при другой патологии. Несмотря на то, что ультразвуковое исследование легких обладает отличной чувствительностью для выявления наличия пневмоторакса, особенно при травме, специфичность отсутствия признака скольжения для диагностики пневмоторакса ограничена у пациентов с комбинированным поражениями. Отсутствие скольжения легких, имитирующее пневмоторакс, может также наблюдаются при плевральных буллах, спайках и рубцах. Кроме того, отсутствие скольжения лёгкого над одной половиной грудной клетки может быть выявлено при односторонней интубации главного правого или левого бронха. При тщательной оценке грудной стенки визуализация признака скольжения легких надежно исключает пневмоторакс, особенно напряженный пневмоторакс, в качестве причины гипоксии или гипотонии. Однако следует учитывать и другие состояния, при которых отсутствует скольжение легких, когда требуется дополнительная визуальная оценка.
ОТЕК ЛЕГКИХ
Несмотря на то, что ультрасонографические признаки отека легких впервые были выявлены более десяти лет назад, только в последние годы УЗИ начало внедряться в клиническую практику в ОНП и ОИТ. Отек легких является одной из наиболее частых причин при поступлении в больницу пациентов с острой одышкой. Кардиогенный шок приводит к тяжелому отеку легких, поскольку недостаточный сердечный выброс вызывает застой жидкости в легких. Отек легких на ранней стадии проявляется тем, что жидкость накапливается в интерстициальном пространстве легких, которое может быть обнаружено с помощью ультразвука в виде сонографических В-линий. Когда отек легких прогрессирует, начинают наполняться жидкостью альвеолы.
Хвосты кометы – это разновидность артефакта реверберации, который появляется из-за неровностей плевральной поверхности и определяется при сонографии нормального легкого. Они выглядят как короткие вертикальные эхогенные линии, которые простираются от плевральной границы и исчезают в пределах нескольких сантиметров (рис. 19).
Рис. 19. Артефакт хвоста кометы. Сагиттальная проекция грудной стенки на уровне поверхности плевры показывает нормальный артефакт хвоста кометы.
Артефакты хвосты кометы движутся вместе с нормальным скользящим движением легких, а их присутствие исключает наличие пневмоторакса на данном уровне грудной клетки. Сонографические B-линии представляют собой вертикальные эхогенные линии, которые простираются от поверхности плевры полностью через дальнее поле зрения без затухания (рис. 20).
Рис. 20. Сонографические В-линии. Сагиттальная проекция грудной стенки в одном межреберье демонстрирует сонографические В-линии.
При этом очень важно, чтобы глубина изображения была установлена на 16-18 см для того, чтобы дифференцировать артефакты хвоста кометы, которые исчезают в нескольких сантиметрах от поверхности плевры, от сонографических В-линий, которые простираются вплоть до конца экрана. Легочный отек приводит к появлению множественных (≥3) B-линий в пределах одного межреберного пространства. В-линии соответствуют утолщенным междольковым перегородкам, которые набухают за счет внесосудистой легочной жидкости. В-линии появляются диффузно в обеих половинах грудной клетки при остром отеке легких. Данный сонографический признак называется интерстициальным синдромом (рис. 21).
Рис. 21. Отек легких. Сагиттальная проекция грудной стенки демонстрирует множественные сонографические В-линии в нескольких межреберных промежутках при отеке легких.
Когда отек легких прогрессирует, отдельные В-линии могут сливаться, и все межреберье становится гиперэхогенным, что называется «белым» легким (рис. 22). И наоборот, когда легочный отек устраняется во время лечения, В-линии, соответственно, исчезают.
Рис. 22. Тяжелый отек легких. Сагиттальная проекция грудной стенки демонстрирует множественные гиперэхогенные межреберные промежутки (белое легкое). Признаки характерны для выраженного отека легких.
Подобно оценке пневмоторакса, оценка сонографических В-линий выполняется со стороны передней грудной стенки в сагиттальной проекции, как правило, во втором или третьем межреберье по средне-ключичной линии. Исследование может быть расширено до верхней боковой стенки грудной клетки для улучшения чувствительности методики. Однако, у пациентов в критическом состоянии, у которых развивается гипоксия из-за сильного отека легких, или гипотензия из-за кардиогенного шока, одной проекции через переднюю грудную стенку должно быть достаточно. Более вариабельные области легкого (задние, при положении пациента на спине, или нижние, при вертикальном положении пациента) более интенсивно перфузируются кровью, поэтому рассеянные В-линии здесь могут быть обычной находкой. В отличие от исследования легких при пневмотораксе, при котором используется высокочастотный линейный матричный датчик для фокусировки на поверхностных структурах в пределах плевральной поверхности, ультразвуковая оценка при отеке легких должна выполняться с использованием низкочастотного конвексного, микроконвексного или фазированного датчика, с установкой на глубину от 16 до 18 см. Типичные линейные датчики дают изображение в диапазоне от 3 до 6 см, поэтому такие артефакты, как хвост кометы и сонографические В-линии могут выходить за пределы дальнего поля зрения, что потенциально приводит к ложной интерпретации этих двух признаков.
Сонографические В-линии не специфичны для отека легких и могут быть замечены при других патологических процессах, которые поражают интерстиций, включая интерстициальные пневмонии и хронические состояния, как, например, легочный фиброз. Острый респираторный дистресс-синдром (ОРДС), обычно встречающийся в ОИТ, может также привести к появлению сонографических В-линий. Однако B-линии при ОРДС чередуются с областями нормального скольжения легких, что соответствует неоднородности поражения при этом состоянии (рис. 23).
Рис. 23. ОРДС. Сагиттальная проекция грудной стенки демонстрирует гиперэхогенное межреберье (белое легкое), которое прилегает к легкому с нормальной эхотекстурой. Признаки характерны для ОРДС.
Кроме того, часто визуализируется утолщенная плевральная линия в зонах легкого, которые вовлечены в ОРДС. Когда сонографические В-линии имеют двустороннюю и диффузную структуру, наиболее вероятным основным процессом является отек легких. В сочетании с эхокардиографическими данными – низкой ФВ и полнокровной НПВ, особенно на фоне соответствующей клинической картины, наличие сонографических B-линий фактически диагностирует отек легких.
АЛЬВЕОЛЯРНАЯ КОНСОЛИДАЦИЯ (УПЛОТНЕНИЕ)
Исходя из убеждений, что ультразвуковое исследование не достаточно эффективно при диагностике патологии легких, считается, что альвеолярная консолидация не определяется с помощью ультразвука. Несмотря на то, что идентификация пневмоторакса и отека легких зависит от интерпретации артефактов, возникающих на поверхности плевры, альвеолярная консолидация приводит к заполнению жидкостью легочной ткани, которая хорошо пропускает ультразвуковые волны. Консолидированное легкое имеет тканеподобную сонографическую картину, подобно паренхиме печени, поэтому было названо «печеночным» легким (рис. 24).
Рис. 24. Альвеолярная консолидация (уплотнение). Сагиттальная проекция ПВК над диафрагмой показывает гепатизацию легочной ткани. Признак альвеолярной консолидации. Обратите внимание на гиперэхогенные сонографические воздушные бронхограммы (^) и границу между уплотненными и аэрированными легкими (*).
В отличие от печени, альвеолярная консолидация часто имеет сонографические воздушные бронхограммы, которые проявляются как точечные или линейные гиперэхогенные непрозрачные зоны в консолидированной легочной ткани. Кроме того, граница между консолидированным и аэрированным легким имеет характерный вид. Тканеподобная альвеолярная консолидация граничит с неровной, зазубренной и гиперэхогенной линией, которая представляет собой рассеянные ультразвуковые волны от аэрированного легкого (см. рис. 24). Хотя альвеолярная консолидация имеет характерную сонографическую картину, она может быть результатом разнообразных патологических процессов, чаще всего инфекционных, но также: механических (бронхиальная обструкция), гидростатических (отек легких) и травматических (ушибы легких). Сонографическая визуализация альвеолярной консолидации может оказаться эффективной при поиске основной причины гипоксии или источника инфекции при септическом шоке, особенно с учетом достаточно низкого качества рентгенограмм грудной клетки, которые получены у пациентов в критическом состоянии при ОРДС на переносном рентгенографическом аппарате.
ПЛЕВРАЛЬНЫЙ ВЫПОТ
В отличие от более новых вариантов использования ультразвука для органов дыхания, о которых говорилось выше, УЗИ широко используется для диагностики плеврального выпота. Он может быть обнаружен во время специализированной легочной ультразвуковой оценки или в рамках абдоминального обследования (поддиафрагмальные проекция ПВК и ЛВК ), или во время эхокардиографии (парастернальная продольная проекция и апикальная проекция). Плевральный выпот – достаточно распространенное патологическое состояние у пациентов с тяжелыми заболеваниями, которое может быть результатом сердечной недостаточности, состояний объемной перегрузки, парапневмонических выпотов или эмпиемы. Большие плевральные выпоты могут вызывать значительные нарушения дыхания и гипоксию. Однако выявленный плевральный выпот сам по себе, как правило, не может быть причиной гипотензии у больных в критическом состоянии, как может быть в случае обнаружения большого гемоторакса у пациентов с травмой.
ИНТЕГРАЦИЯ СОНОГРАФИЧЕСКИХ ДАННЫХ ПРИ ШОКЕ
Хотя отдельные результаты ультразвукового исследования могут свидетельствовать об определенных видах шока, интеграция комбинации результатов может более эффективно сузить дифференциальный диагноз, исключив определенные патологические состояния, а в некоторых случаях может окончательно установить диагноз. Именно на основе интеграции всех ультразвуковых данных созданы такие протоколы, как протокол RUSH, который особенно эффективен для правильного определения физиологической основы шока (таблица 2).
Таблица 2
Общие данные при ультразвуковой оценке пациентов в критическом состоянии по категориям шока
| Гиповолемический | Дистрибутивный (перераспределительный) | Кардиогенный | Обструктивный | |
| Сердце | Небольшое, гипердинамическое | Гипердинамическое | Тяжелое угнетение | Выпот, расширение ПЖ |
| НПВ | Коллапс | Коллапс | Полнокровие | Полнокровие |
| Живот | Геморрагическая свободная жидкость | Перитонеальная свободная жидкость | – | – |
| Аорта | Расслоение АБА | – | – | – |
| Легкие | Нормальное скольжение легких | Выпот, уплотнение | Выпот,
В-линии |
Отсутствие скольжения легких |
Чтобы проиллюстрировать, как это работает: снижение ФВ само по себе не обязательно указывает на исключительно кардиогенную этиологию шока, поскольку пациенты могут иметь в анамнезе кардиомиопатию, также снижение ФВ может развиваться из-за прогрессирующего сепсиса. Снижение ФВ в сочетании с полнокровием НПВ и диффузными двусторонними B-линиями – гораздо более убедительные данные в пользу диагноза кардиогенного шока. И наоборот, нормальный или гипердинамический ЛЖ и ФВ не всегда исключают наличие кардиогенного шока.
Острая патология клапанов, такая как острая аортальная или митральная недостаточность, или инфаркт миокарда правосторонней локализации, также могут привести к кардиогенному шоку. Как уже было сказано, оценка патологии клапанов выходит за рамки большинства врачей экстренной помощи, однако параллельно полученные данные могут быть полезными. Полнокровная НПВ должна определяться при значительном правостороннем инфаркте миокарда, а диффузные двусторонние В-линии должны выявляться при острой аортальной или митральной недостаточности.
При гиповолемическом шоке, ультразвуковая оценка обычно выявляет гипердинамическую ФВ, спавшуюся НПВ и отсутствие В-линий. Размеры ЛЖ могут казаться незначительными из-за уменьшения внутрисосудистого объема. Другие данные ультразвукового протокола могут выявлять специфические причины гиповолемии, например, увеличенный диаметр аорты у пожилого пациента с разрывом ААА, или большое количество свободной жидкости в брюшной полости у молодой пациентки с разрывом внематочной беременности.
При септических и других формах перераспределительного шока характерна гипердинамическая ФВ, спавшаяся НПВ и отсутствие B-линий. На более поздних стадиях септического шока может наблюдаться сердечная дисфункция и снижение ФВ. Полнокровная НПВ может сопутствовать гиповолемическому и септическому шоку у пациентов с хронической легочной гипертензией или правосторонней сердечной недостаточностью. Несмотря на то, что спавшаяся НПВ указывает на внутрисосудистое истощение объема у пациента с гипотензией, полнокровная НПВ не обязательно означает, что пациент перегружен по объему.
При обструктивном шоке, НПВ имеет полнокровный вид. Когда причиной препятствия является тампонада сердца, жидкость определяется по периферии сердца, и при этом может быть оценена инверсия правого предсердия и/или желудочка. При напряженном пневмотораксе отсутствует скольжение легкого над пораженной зоной, как правило, по всей половине грудной клетки. В случае массивной ТЭЛА, часто наблюдается небольшой, гипердинамический ЛЖ, уплощенная межжелудочковая перегородка и значительное увеличение ПЖ. Несмотря на то, что идентификация сопутствующего тромбоза глубоких вен нижней конечности с использованием сонографии у постели пациента не являлась ранее частью протокола, описанного выше, она дополнительно указывает на вероятность развития ТЭЛА. В некоторых случаях свободно флотирующий тромб в правом отделе сердца может быть визуализирован при сонографии, что считается прямым доказательством ТЭЛА.
РУКОВОДСТВО ПО КОРРЕКЦИИ ВНУТРИСОСУДИСТОГО ОБЪЕМА
Сонография является неинвазивным «помощником» в проведении реанимационных мероприятий по коррекции объема у пациентов с гипотонией и шоком. Традиционные показатели объема, такие как ЦВД, полученное из центрального венозного катетера, или давление заклинивания в лёгочных капиллярах (ДЗЛК), измеренное с помощью катетера в легочной артерии, являются инвазивными и требуют много времени. Как известно, ЦВД имеет ограниченную прогностическую ценность для оценки гемодинамического ответа на проведение инфузии, хотя обычно используется в качестве измерения предварительной нагрузки в протоколе ранней прицельной терапии септического шока. Введение катетера (Swan Ganz) в легочную артерию для измерения ДЗЛК было когда-то распространено в ОИТ, в качестве альтернативы оценки давления наполнения левого желудочка. Однако, проведенные исследования не показали преимуществ. В настоящее время респираторные колебания артериального пульсового давления имеют наилучшую прогностическую ценность для оценки гемодинамической реакции на объемную инфузию у пациентов с гипотензией.
Ультрасонография была предложена в качестве быстрого, доступного средства оценки состояния объемного статуса пациента при поступлении и для дальнейшего контроля инфузии жидкости во время лечения. Концепция использования ультразвукового контроля инфузии жидкости для проведения реанимации была указана в обсуждении измерений НПВ (см. Таблицу 1). При первоначальном поступлении пациента в шоковом состоянии, небольшой диаметр НПВе (< 1,5 см) и полный (или почти полный) её коллапс при вдохе, указывает на истощение внутрисосудистого объема и на необходимость агрессивного внутривенного введения жидкости. По мере увеличения объема инфузии, НПВ постепенно увеличивается в диаметре, а колебания её размера при вдохе уменьшаются. Как только ее параметры приближаются к тем, которые наблюдаются при полнокровной НПВе (> 2,5 см), при этом отсутствует (или минимальный) коллапс при вдохе, дальнейшее введение жидкости должно быть более осторожным. Если у пациента сохраняется гипотензивное состояние или признаки неадекватной перфузии, необходимо начинать вазопрессорную или инотропную терапию. Таким образом, последовательная ультразвуковая оценка НПВ, аналогичная принципам измерений ЦВД, может использоваться для контроля относительного объема и адекватности введения жидкости при проведении реанимационных мероприятий в реальном времени.
Полнокровная НПВ, которая определяется при первоначальном поступлении у пациента в шоковом состоянии, не исключает возможный положительный эффект, от проведения инфузионной терапии. Несмотря на то, что полнокровная НПВ может служить альтернативным признаком объемной перегрузки при кардиогенном шоке, она также наблюдается при шоке обструктивной этиологии, когда введение жидкости, зачастую, оказывает положительный эффект, также как и при изолированной правосторонней сердечной недостаточности и хронической легочной гипертензии. Поэтому, полнокровную НПВ не следует интерпретировать как изолированный признак, а решения по тактике лечения таких пациентов должны приниматься в рамках всего ультразвукового обследования, а также в контексте истории болезни пациента и текущих клинических симптомов.
Оценка функции ЛЖ может также определять необходимую интенсивность внутривенной инфузии пациенту при шоке. Аналогично, при спавшейся НПВ, малых размеров камеры сердца и гипердинамической функции ЛЖ предполагается гиповолемический или дистрибутивный шок, что в большинстве случаев позволяет безопасно проводить дальнейшее увеличение объема жидкости. Напротив, сниженная функция ЛЖ, в качестве изолированной находки, не обязательно означает, что гипотензия пациента обусловлена кардиогенным шоком, или что дополнительная инфузия будет иметь негативный эффект. Это скорее указывает на то, что у пациента будет быстрее развиваться отек легких, при проведении чрезмерно агрессивной объемной инфузии. Если у таких пациентов подозревается истощение объема, рекомендуются меньшие объемы жидкости и тщательная переоценка параметров после каждого последующего болюсного введения.
Согласно одному предложенному алгоритму, протокол FALLS (Fluid Administration Limited by Lung Sonography – введение жидкости под контролем сонографии легких), проведение инфузии у пациента с гипотензией рекомендуется до тех пор, пока не появятся ранние сонографические признаки отека легких. Считается, что отек легких и последующая гипоксия, являются основными ограничениями для дальнейшего введения жидкости у пациентов в критическом состоянии, особенно при сепсисе и других типах перераспределительного шока. Поскольку сонографические В-линии являются ранним признаком интерстициального отека, предлагается, чтобы их наличие было использовано в качестве конечной точки для коррекции объема в ходе реанимации. Если в этот момент у пациента сохраняется гипотензия, то необходимо применять вазопрессоры или инотропные препараты. Протокол FALLS может быть особенно эффективен у пациентов с предсуществующей правосторонней сердечной недостаточностью, или легочной гипертензией с гиповолемическим или перераспределительным шоком. У этих пациентов НПВ может быть изначально полнокровной, и поэтому не может служить в качестве эффективного показателя, отражающего внутрисосудистый объем. Протокол FALLS также может быть эффективным для определения возможности дополнительной объемной инфузии у пациентов с предсуществующей кардиомиопатией с гиповолемическим или дистрибутивным шоком.
РЕЗЮМЕ
Ультразвуковая оценка пациентов в критическом состоянии при шоке представляет собой новый способ мышления в ультрасонографии, которая недавно была признана ACEP «реанимационным ультразвуковым исследованием». Протокол RUSH служит стандартным подходом к сонографической оценке нестабильных пациентов с недифференцированным шоком. Врачи, которые оказывают неотложную помощь, теперь могут непосредственно визуализировать физиологическую основу шока и исключать ряд угрожающих жизни, но потенциально обратимых, патологических состояний в течение нескольких минут, не покидая палату пациента. При этом можно сузить спектр дифференциальных диагнозов, что повышает уверенность в точности предварительной диагностики. Врачу не нужно начинать эмпирические реанимационные мероприятия вслепую, а вместо этого подбирать тактику лечения к определенной категории шока, а в некоторых случаях – к конкретному диагнозу.
Некоторые из новых технологий требуют проведения окончательных исследований до принятия в клиническую практику, однако отдельные примеры показали, как ультразвук у постели пациента может полностью положительно изменить динамику лечения. Большинство отдельных компонентов протокола RUSH знакомы врачам-сонографистам и были проверены при использовании у постели больного. Протокол просто служит структурированным подходом, который интегрирует множество компонентов в единое целое. Цель проведенной клиницистом сонографии заключается не в замене традиционных методов диагностики пациентов в критическом состоянии, а в их дополнении. Ультрасонография у постели пациента является быстро доступным и неинвазивным инструментом для облегчения диагностики множества опасных для жизни состояний. Поскольку прицельное ультразвуковое исследование по-прежнему используется клиницистами в ОИТ, есть надежда, что пациентам своевременно поставят точный диагноз на основе патофизиологических проявлений и быстрее начнут проводить оптимальное лечение.
В быстрой и качественной ультразвуковой диагностике Вам поможет УЗИ аппарат General Electric Logiq E9. Рекомендуем ознакомиться с детальными характеристиками аппарата по ссылке.

















14.10.2019
Полина