Автори: Mark W. Byrne, James Q. Hwang
КЛЮЧОВІ СЛОВА:
Ультразвук, шок, пацієнти в критичному стані
Пацієнти в критичному стані в екстремальних умовах являють собою одну з найсерйозніших проблем для служб порятунку і реаніматологів. Після прибуття в відділення невідкладної допомоги (ВНД) або відділення інтенсивної терапії (ВІТ) мало що відомо про медичний анамнез пацієнта або обставини, які призвели до цієї критичної ситуації. Пацієнти в тяжкому стані найчастіше не можуть надати дані свого медичного анамнезу через важку задишку, біль або зміни свідомості. Показники вітальних функцій і фізикальний огляд критично важливі для лікування пацієнтів, однак ці результати часто неспецифічні і можуть бути схожими при різних етіологіях шоку. Такі пацієнти часто надходять з нестабільною гемодинамікою, тому загальноприйняті реанімаційні заходи повинні бути розпочаті одночасно з проведенням початкової діагностичної оцінки. Важкість стану пацієнта диктує необхідність проведення ключових терапевтичних втручань до отримання лабораторних даних або консультативних діагностичних візуальних досліджень.
В даний час існує потреба у швидкому і завжди доступному методі діагностики пацієнтів в критичному стані. В якості такого методу було запропоновано ультразвукове дослідження, яке проводиться лікарем ультразвукової діагностики безпосередньо біля ліжка нестабільного пацієнта. Сонографічна оцінка пацієнтів в критичному стані надає цінну інформацію, яка допомагає клініцисту під час початкової оцінки і стабілізації недиференційованого шоку. Ця стаття покликана продемонструвати, як прицільне ультразвукове дослідження може бути використано для швидкої оцінки фізіологічної основи шоку у конкретного пацієнта, виявлення потенційно летальних, але оборотних станів, які можуть бути не діагностовані біля ліжка пацієнта. Ультрасонографія також допомагає направити реанімаційні заходи в правильне русло, зокрема, коли це стосується об’єму циркулюючої рідини. До теперішнього часу, застосування екстреної сонографії було направлено на візуалізацію патологічних змін захворювань і забезпечення ультразвукового наведення для інвазивних процедур. Ми пропонуємо відійти від такого традиційного використання і пропонуємо направляти ультразвукову оцінку на те, щоб оцінювати фізіологічні процеси, що лежать в основі шоку у пацієнтів в критичному стані, а також стежити за динамікою їх розвитку в реальному часі у відповідь на реанімаційні заходи.
ОБМЕЖЕННЯ В ПОТОЧНІЙ ПРАКТИЦІ
Надходження пацієнта в стаціонар відбувається за стандартною схемою. Після того, як пацієнт доставлений в ВНД або ВІТ, він оглядається лікарем, який призначає додаткові методи діагностики, наприклад: рентгенографію, комп’ютерну томографію (КТ), ультрасонографію або ехокардіографію. Діагностичні дослідження проводяться медичним техніком, як правило, тільки після того, як пацієнт переміщається за межі ВІТ в радіологічне, судинне відділення або кабінет ехокардіографії. Отримані зображення відправляють по мережі і згодом вони інтерпретуються радіологом або кардіологом. Висновки експертів потім передаються лікарю, який використовує цю інформацію для прийняття клінічних рішень щодо лікування пацієнта.
Хоча ця послідовність подій може задовільно працювати для пацієнтів в амбулаторних умовах і клінічно стабільних пацієнтів у ВНД або ВІТ, у пацієнтів в критичному стані цей алгоритм може привести до значних затримок у лікуванні. Для гемодинамічно нестабільних пацієнтів терапію необхідно починати негайно при поступленні, а план лікування не може бути відкладений, в очікуванні проведення та інтерпретації додаткових досліджень. Пацієнти у ВНД та ВІТ часто нестабільні, щоб залишати зону реанімації, де їх життєві функції контролюються приладами, тому консультативні дослідження повинні виконуватися на місці з використанням рухомих пристроїв, будь то рентгенографія, ультрасонографія або ехокардіографія. Багато з цих консультативних послуг можуть бути недоступні в вечірні та нічні години. Однак, пацієнти в критичному стані поступають до лікарні, незалежно від часу доби.
Прицільне ультразвукове дослідження спрямоване на поліпшення якості допомоги пацієнтам шляхом діагностики станів на ранній стадії, особливо коли ці стани потенційно смертельні, а результат лікування залежить від часу його початку. Використання ультразвуку для оцінки пацієнтів з гострою травмою і для ультразвукового наведення при невідкладних процедурах було обгрунтовано в літературі, і в даний час прийнято в медичній практиці. Американський коледж хірургів включив ургентну сонографію при травмі – Focused Assessment with Sonography in Trauma (FAST) в свій розширений протокол навчальних тренувальних курсів для фахівців (лікарів) в наданні допомоги постраждалим при травмі – Advanced Trauma Life Support (ATLS). Агентство досліджень і оцінки якості медичного обслуговування – Agency for Healthcare Research and Quality (AHRQ) включило в рекомендації судинний доступ під ультразвуковим контролем, як один з найбезпечніших методів для пацієнтів. Інші прицільні ультразвукові дослідження були схвалені для застосування біля ліжка хворого, включаючи дослідження аорти, для виключення її аневризми і обмежену ехокардіографію. Американське товариство ехокардіографії – American Society of Echocardiography (ASE) в консенсусі з Американським коледжем лікарів невідкладної допомоги – American College of Emergency Physicians (ACEP) нещодавно визнали ефективність спеціалізованого ультразвукового дослідження серця – focused cardiac ultrasound (FOCUS) в ургентних ситуаціях. Для органів, які традиційно вважалися непідвладними ультразвуковому дослідженню, такі як легені, розробляються техніки дослідження, ефективність яких збільшується, і вони завойовують все більшу популярність. Крім того, методи дослідження, раніше розроблені в інших спеціальностях, наприклад, вимір об’єму нижньої порожнистої вени (НПВ) інтегруються в спеціалізовані ультразвукові методики у ВНД або ВІТ.
КАТЕГОРІЇ ШОКУ
Шок визначається як стан недостатньої перфузії тканин організму. Низький тиск крові (гіпотонія) характерний симптом, хоча і не завжди присутній у пацієнтів з шоком. Існує 4 основних категорії шоку: кардіогенний, гіповолемічний, дистрибутивний (перерозподільний) і обструктивний (рис. 1).
| ШОК | |||
| Гіповолемічний | Дистрибутивний (перерозподільний) | Кардіогенний |
Обструктивний |
| Кровотеча | Сепсис |
Недостатність нагнітаючої функції серця |
Тампонада |
| Дегідратація | Анафілаксія | Недостатність клапанів | Пневмоторакс |
| Нейрогенний шок | Аритмія | Масивна емболія легеневої артерії | |
Рис. 1. Категорії шоку. Категорії шоку, які найбільше «підходять» для проведення ультразвукової діагностики для встановлення діагнозу біля ліжка хворого, виділені жирним шрифтом.
Кардіогенний шок часто виникає через недостатність лівого шлуночка (ЛШ), однак, також розвивається в результаті аритмій, наприклад, при шлуночковій тахікардії, гострій клапанній недостатності, наприклад, при недостатності задньої стулки мітрального клапана на тлі нижньо-діафрагмального інфаркту міокарда, або недостатності правого шлуночка (ПШ) в результаті правостороннього інфаркту. Гіповолемічний шок, стан вираженого зниження внутрішньосудинного об’єму, може бути наслідком цілого ряду причин. Прихована кровотеча, як, наприклад, шлунково-кишкова кровотеча або розрив аневризми черевного відділу аорти (AЧA), а також сильне зневоднення, наприклад, при гіперосмолярній некетоацидотичній комі, є найбільш частими причинами розвитку шоку. Дистрибутивний (перерозподільний) шок є результатом вазодилятації або втрати внутрішньосудинної рідини. Найчастіше це пов’язано з інфекційними (септичними) або запальними (третій простір) причинами. У меншій мірі, дистрибутивний шок також може бути анафілактичної і нейрогенної етіології. Обструктивний шок виникає в результаті механічної обструкції, яка перешкоджає венозному притоку і/або серцевому викиду. Це зустрічається при серцевій тампонаді, напруженому пневмотораксі і при масивній тромбоемболії легеневої артерії (ТЕЛА).
Деякі клінічні прояви шоку і гіпотонії легко класифікуються на основі анамнезу та фізикального обстеження. У літнього пацієнта зі скаргами на кашель, тахіпное, лихоманку і з ознаками гіпоксії і гіпотонії, можна попередньо встановлювати діагноз дистрибутивного/септичного шоку на тлі пневмонії, навіть до отримання даних додаткових обстежень. При цьому лікар, часто, буде починати терапію до підтвердження діагнозу. З іншого боку, досить важко віддиференціювати глибокий гіповолемічний шок в результаті розриву АЧА від дистрибутивного шоку у хворого з прогресуючим уросепсисом, пацієнти не завжди мають класичні клінічні прояви, а ознаки і симптоми можуть бути оманливими. Крім того, пацієнти можуть мати схожу етіологію розвитку шокового стану (дистрибутивний/септичний шок), який посилює важку кардіоміопатію. Саме в цих випадках недиференційованого шоку, як нам здається, найбільш важливим є ультразвукова оцінка фізіологічних змін і виключення небезпечних для життя станів.
УЛЬТРАЗВУКОВЕ ДОСЛІДЖЕННЯ ПАЦІЄНТІВ ПРИ ШОЦІ
Структурований протокол ультразвукового дослідження, який включає оцінку серця, НПВ, живота, аорти і легень, може надавати цінну інформацію для визначення різних категорій шоку, описаних вище. Аналогічно FAST протоколу при травмі, такий протокол ультразвукового дослідження служить в якості стандартизованого підходу, який легко запам’ятовується і зручний для використання в ситуаціях з високим психологічним напруженням. Він дозволяє створити систематизовану логічну структуру, яка полегшує диференційну діагностику шоку у пацієнта з гіпотензією, а в деяких випадках може виявляти конкретну причину захворювання у даного пацієнта. Така тактика дає підстави клініцисту приймати більш обґрунтовані рішення при первинному відновленні дефіциту рідини і подальшої корекції внутрішньосудинного об’єму. Однак, на відміну від протоколу FAST, ультразвукова оцінка хворого в критичному стані технічно і теоретично більш складна, що пов’язано з важкістю більшості пацієнтів і великим спектром диференційних діагнозів, які необхідно враховувати. Протокол FAST служить для ідентифікації вільної рідини в ключових відділах організму, а також тампонади серця, що вказує на травматичне джерело крововиливу. Ультразвукове дослідження у пацієнтів в критичному стані включає аналогічну оцінку, але значно розширює методи, що застосовуються, і оцінює конкретні органи.
Дані ультразвукового дослідження на будь-якій стадії патологічного процесу за часом завжди збігаються зі ступенем тяжкості основного захворювання пацієнта. З огляду на запущену стадію хвороби і граничні значення фізіологічних функцій у пацієнтів в стані шоку, результати ультразвукового дослідження, як правило, очевидні і досить легко розпізнаються фахівцем. Наприклад, стан пацієнта при підозрі на масивну ТЕЛА, як правило, надто нестабільний, щоб він міг покинути зону реанімації для підтвердження діагнозу на КТ, або дочекатися переносної консультативної ехокардіографії до проведення ключових терапевтичних заходів. Ідентифікація значної дилатації ПШ під час ультразвукової оцінки біля ліжка хворого в поєднанні з попередніми клінічними даними може служити досить переконливим доказом, який дозволяє в деяких випадках починати тромболізис. З іншого боку, у стабільних пацієнтів слід проводити комплексне ехокардіографічне обстеження для більш точної оцінки ступеня дисфункції ПШ – важливого прогностичного фактора при лікуванні ТЕЛА. Хоча додаткова консультативна візуальна діагностика завжди грає важливу роль у всебічній оцінці і диференціальній діагностиці особливостей перебігу хвороби, прицільне ультразвукове дослідження у пацієнта в критичному стані необхідно для виявлення граничних патофізіологічних параметрів для більш ефективного надання невідкладної медичної допомоги.
ОГЛЯД УЛЬТРАЗВУКОВИХ ПРОТОКОЛІВ
Ультразвуковий алгоритм для оцінки пацієнтів в критичному стані з недиференційованою гіпотензією був вперше запропонований Rose і колегами в 2001 році, який був названий ультразвуковим протоколом UHP (Undifferentiated Hypotensive Patient). В протокол було включено 3 раніше перевірених ультразвукових дослідження для виявлення оборотних причин гіпотонії. Відносно простий за обсягом, він складався з дослідження проекції гепаторенального (кишені Морисона) простору для оцінки гемоперитонеума, субксіфоїдальної кардіальної проекції для визначення перикардіального випоту і поперечної проекції аорти, для виключення АЧА. У 2004 році Jones з колегами розширили цей ультразвуковий протокол і назвали його прицільним ультразвуковим дослідженням. Новий протокол включав додаткові абдомінальні (сагітальні і поперечні тазові) і серцеві (парастернальні поздовжні, апікальні 4-камерні) проекції, а також дослідження НПВ для оцінки об’єму. Прицільне УЗД, яке проводилося негайно при поступленні пацієнтів, порівнювалося зі стандартним діагностичним підходом за 15 хвилин до ультразвукового дослідження. Негайне прицільне ультразвукове дослідження привело до звуження спектра диференційних діагнозів на ранній стадії лікування пацієнтів, а попередній діагноз в більшості випадків був більш точним.
З тих пір було запропоновано інші протоколи та інша термінологія для алгоритму ультразвукової оцінки пацієнта при шоці. Протокол FATE (Focus Assessed Transtoracic Echocardiogram), який виконується не кардіологами в умовах палати інтенсивної терапії, був запропонований для оцінки ключових показників гемодинаміки у хворих в критичному стані. Протокол CAUSE (Cardiac Arrest Ultra-Sound Exam) показав ефективність ультразвуку для швидкого виявлення оборотних причин неаритмогенної зупинки серця: важка гіповолемія (наприклад, при розриві АЧА), тампонада серця, напружений пневмоторакс і масивна ТЕЛА. Аналогічним чином, протокол FEEL (Focused Echocardiography Evaluation in Life Support) був запропонований в якості швидкого і прицільного ехокардіографічного протоколу, який повинен використовуватися для проведення периреанімаційної допомоги. Протокол ACES (Abdominal and Cardiac Evaluation with Sonography in Shock) продемонстрував, як інтеграція окремих даних ультразвукового дослідження пацієнта полегшує визначення категорії шоку.
Останнім часом були запропоновані більш докладні протоколи під назвою протокол RUSH (Rapid Ultrasound in Shock and Hypotension). Perera і колеги описали ретельну ультразвукову оцінку, розділену на 3 категорії: насосна функція (сфокусована ехокардіографія на перикардіальному випоті, загальній скоротливості ЛШ і співвідношенні ПШ/ЛШ, як маркер для масивної ТЕЛА), резервуарна функція (визначення об’єму НПВ, виявлення вільної рідини у перитонеальній і плевральній порожнині), а також судини (грудна аорта – виявлення ознак розшарування, черевна аорта – виявлення АЧА і вен нижніх кінцівок – виявлення тромбозу глибоких вен). У своєму описі протоколу RUSH Weingart і колеги запропонували мнемонічне правило «HI-MAP», щоб полегшити запам’ятовування послідовності ультразвукових дій, що відповідають серцю (heart), НПВ (IVC), кишені Морисона (абдомінальне обстеження для визначення вільної рідини), аорті і легеням (pulmonary) (рис.2). HI-MAP служить корисним правилом для швидкого отримання основних ультразвукових даних у пацієнтів в критичному стані при шоці або екстремальних ситуаціях.
Рис. 2. Протокол RUSH. 1 – серце; 2 – НПВ; 3 – живіт; 4 – аорта; 5 – легені.
Пропоновані ультразвукові алгоритми не обов’язково повинні бути чітко виконані до кінця у всіх пацієнтів. Дослідження серця і НПВ необхідно проводити всім пацієнтам в критичному стані. Інші компоненти обстеження можуть проводитися в залежності від специфіки клінічних проявів пацієнта. Наприклад, гіпотонія у літнього пацієнта з болем у нижній частині спини або фланку вказує на можливий розрив АЧА, і тому вкрай важливо, проводити ультразвукове дослідження черевної аорти для оцінки наявності або відсутності цієї патології. Для порівняння, гіпотонія у молодої пацієнтки з болем в нижній частині спини або фланку з більшою ймовірністю вказує на розрив ектопічної вагітності, при цьому ультразвукове дослідження черевної порожнини і таза для ідентифікації вільної рідини в поєднанні з тестом сечі на вагітність набуває важливого значення для цієї пацієнтки.
Інтерпретація результатів ультразвукового дослідження може бути адекватно виконана тільки в клінічному контексті анамнезу хвороби пацієнта і поточних клінічних проявів. Для ілюстрації: біль в нижній частині спини або фланку і вільна рідина в животі у молодої пацієнтки з гіпотензією вказує на позаматкову вагітність, що майже є незаперечним, якщо тест сечі на вагітність є позитивним. Навпаки, наявність перитонеальної вільної рідини у пацієнта з гіпотензією будь-якого віку з раніше діагностованим цирозом може бути випадковою знахідкою і, тому, її не слід розглядати як етіологію шоку у даного пацієнта. Таким чином, ці протоколи забезпечують теоретичні основи для прицільного ультразвукового дослідження, які можуть бути застосовані до пацієнта в критичному стані, але в той же час воно має бути адаптованим (як з точки зору окремо виконуваних компонентів, так і з точки зору інтерпретації результатів) конкретно до кожного пацієнта.
ОБМЕЖЕННЯ УЛЬТРАЗВУКОВОЇ ВІЗУАЛІЗАЦІЇ
Мета клінічного ультразвукового дослідження не полягає в заміні додаткових консультативних методів візуалізації. Ультразвукова техніка призначена для використання в сфокусованих завданнях, які відповідають на конкретні клінічні питання прямо біля ліжка хворого. З огляду на те, що прицільне ультразвукове дослідження може бути надзвичайно ефективним при обстеженні пацієнта, лікар-діагност повинен також знати про можливі обмеження. Наприклад, оцінка клапанної дисфункції виходить за рамки більшості лікарів екстреної допомоги, за винятком тих, які отримали додаткове спеціалізоване навчання. Лікарі-діагности можуть виконувати прицільну ехокардіографію для оцінки нормальної, зниженої або значно зниженої систолічної функції при оцінці кардіогенного шоку, але при цьому кардіогенна патологія також може бути викликана гострою клапанною недостатністю. Для виключення цього діагнозу потрібна комплексна ехокардіографія, яка виконується і інтерпретується вузькими спеціалістами.
Обмеження прицільного ультразвукового дослідження розглядаються в кожному з наступних розділів, в яких детально описані окремі компоненти пропонованого ультразвукового протоколу. Дуже важливо, щоб лікарі ультразвукової діагностики знали про ці обмеження при прийнятті рішень по тактиці лікування пацієнтів на підставі результатів ультразвукового дослідження.
КОМПОНЕНТИ УЛЬТРАЗВУКОВОГО ПРОТОКОЛУ CARDIAC
Ультразвукова оцінка пацієнта при шоці починається з ехокардіографії. Прицільна ехокардіографія – це відповідальний діагностичний тест першої лінії, який допомагає прискорити діагностичну оцінку та початок проведення реанімаційних заходів біля ліжка пацієнта. Цінність методики полягає в її здатності надавати клініцистам анатомічну і фізіологічну інформацію в режимі реального часу, а також в можливості повторного огляду після проведених заходів для оцінки клінічної відповіді. При ультразвуковому дослідженні серця біля ліжка шокового хворого проводиться цілеспрямована оцінка причини шоку: порушення насосної функції (кардіогенний шок), неадекватне переднавантаження (гіповолемічний або дистрибутивний шок) або механічна обструкція (обструктивний шок). І ASE і ACEP схвалюють такі клінічні параметри для фокусного ультразвукового дослідження серця (focused cardiac ultrasound – FOCUS): перикардіальний випіт, загальна серцева функція, відносний розмір камери і об’ємний статус. УЗД у пацієнта в критичному стані починається з оцінки кожного з цих параметрів.
Серце відображається в декількох різних проекціях, а дані, отримані на одній проекції, повинні бути підтверджені або спростовані на інший. Для ультразвукового дослідження серця використовується датчик з частотною матрицею від 2 до 5 МГц з малим профілем, який легше розташувати між ребрами при спробі досягти акустичного вікна для серця. Існує чотири основні проекції для оцінки серцевої діяльності: парастернальна поздовжня проекція, парастернальна поперечна проекція, апікальна 4-камерна і підреберна. При можливості, пацієнт повинен бути повернений в положення на лівий бік, так як така позиція наближає серце до передньої грудної стінки і покращує візуалізацію. Парастернальна проекція виходить шляхом розміщення датчика зліва від грудини з плавним переміщенням його через стінку грудної клітки між другим і п’ятим міжребер’ям до отримання найкращого можливого зображення. Як тільки буде отримана парастернальна поздовжня проекція, датчик може бути повернутий на 90 градусів для отримання парастернальної поперечної проекції. Апікальна 4-камерна проекція виходить шляхом приміщення датчика нижче лівого соска у чоловіків або під лівою груддю у жінок і повороту лицьової поверхні датчика в бік основи серця. Підреберна проекція виходить шляхом розміщення датчика трохи нижче мечоподібного відростка, при використанні лівої частки печінки в якості акустичного вікна, а лицьова поверхня датчика спрямована від живота до серця.
ГЛОБАЛЬНА ФУНКЦІЯ СЕРЦЯ
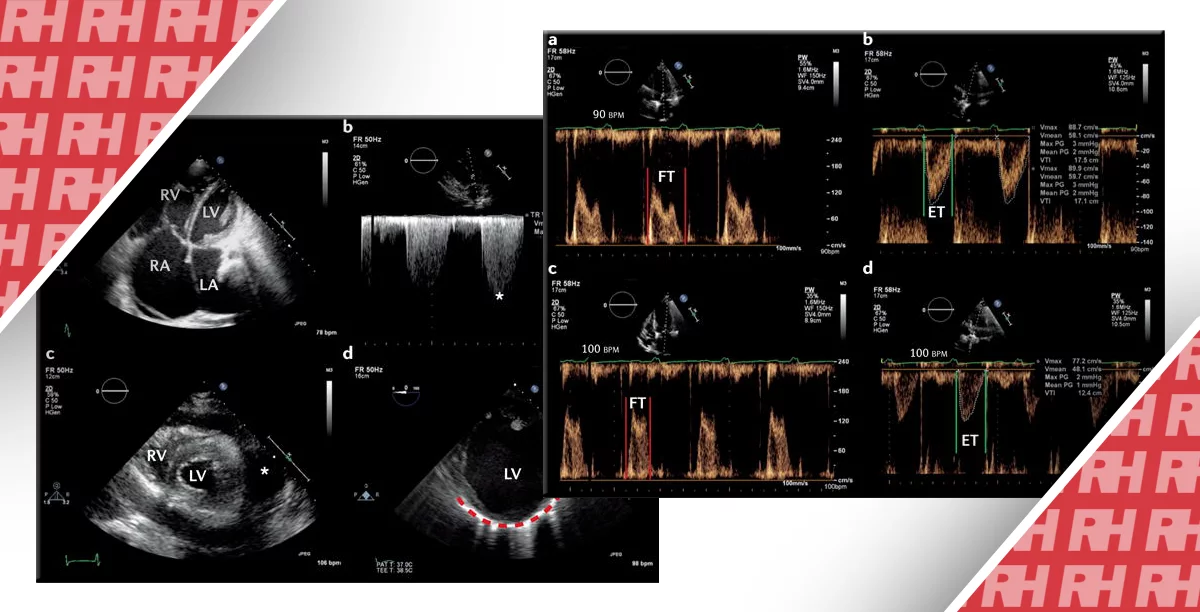
Визначення глобальної функції ЛШ є фундаментальним для ультразвукової діагностики пацієнтів в критичному стані і, як було показано, є прогностичним маркером клінічного результату для різних патологічних станів. Оцінка систолічної функції відбувається на основі якісної оцінки в кількох проекціях екскурсії ендокардіальних меж і потовщення міокарда. Функція ЛШ може бути об’єднана в наступні категорії: виражене зниження (фракція викиду [ФВ] <30%), помірно знижена (ФВ – 30% -55%) і нормальна (ФВ> 55%). ФВ, що перевищує 70%, вважається також гіпердинамічною, яка може проявлятися облітерацією порожнини шлуночка під час систоли. У пацієнтів в критичному стані гіпердинамічна ФВ зазвичай відображає недозаповнений ЛШ, що може розвиватися в результаті значної гіповолемії, обструктивного процесу (класична масивна ТЕЛА) або важкої периферичної вазодилатації, як у випадку перерозподільного/септичного шоку. Було показано, що у пацієнтів без травматичного анамнезу з недиференційованою симптоматичною гіпотензією показник ФВ, що перевищує 55%, є передвісником септичного шоку.
Хоча існує безліч кількісних показників функції ЛШ (з використанням М-режиму, двовимірної або доплерівської візуалізації), які можуть бути обмежені припущеннями щодо форми ЛШ, наявністю великих аномалій руху стінок або навичками діагноста. В кінцевому підсумку, оцінка функції ЛШ зазвичай виконується суб’єктивно, при цьому дані візуальної оцінки досвідчених експертів подібні або рівні кількісним обчисленням. Після проведення цілеспрямованого навчання і тренінгу, фахівці невідкладної допомоги продемонстрували хороші навички в диференціації нормальної і зниженої систолічної функції ЛШ (рис. 3).
Рис. 3. Дилятаційна кардіоміопатія. Парастернальна поздовжня проекція серця демонструє розширений ЛШ в результаті хронічного зниження ФВ. Ao – корінь аорти, LA – ліве передсердя, LV – лівий шлуночок; RV – правий шлуночок.
Дослідження показали, що лікарі інтенсивної терапії можуть бути навчені точно визначати функцію ЛШ у пацієнтів в стані гіпотензії. Лікарі некардіологічного профілю, як правило, мають проблеми з визначенням пацієнтів з помірно зниженою ФВ. Проведена клініцистом ехокардіографія допомагає ефективно диференціювати нормальну або сильно знижену функцію ЛШ. Тому мета ехокардіографії біля ліжка пацієнта не визначати тонкі відмінності ФВ, а виявляти граничні стани дисфункції ЛШ для виявлення фізіологічної основи шоку у пацієнтів в критичному стані.
ПЕРИКАРДІАЛЬНИЙ ВИПІТ
Перикардіальний випіт не є чимось незвичайним у пацієнтів із задишкою або гіпотонією. Пацієнти з перикардіальним випотом можуть мати неспецифічні симптоми, такі як кашель, задишка при навантаженні і стомлюваність, а результати фізикального обстеження в рівній мірі неспецифічні. Дослідження показали, що ехокардіографія біля ліжка пацієнта дозволяє виявляти наявність перикардіального випоту і, відповідно, позитивно впливати на тактику лікування пацієнтів. Перикардіальний випіт визначається наявністю рідини (зазвичай анехогенної) між епікардом і перикардом. Цей стан викликано різними порушеннями (інфекцією, злоякісними новоутвореннями, захворюваннями сполучної тканини, нирковою недостатністю, травмою), а також може розвиватися після кардіохірургічних операцій та інвазивних втручань на серці (встановлення кардіостимулятора, катетеризація серця). Як об’єм, так і швидкість накопичення рідини є визначальними факторами з точки зору клінічного і гемодинамічного впливу. Кілька досліджень показали, що ехокардіографія в рамках екстреної медичної допомоги має чутливість для виявлення перикардіальної рідини близьку до 100%. У зв’язку з тим, що великий плевральний випіт може бути невірно тлумачений як перикардіальний випіт, низхідна грудна аорта може бути використана для диференційної діагностики. Плевральний випіт розташований ззаду або збоку від низхідної грудної аорти, тоді як перикардіальний випіт проходить спереду або медіально (рис. 4).
Рис. 4. Перикардіальний і плевральний випіт. Парастернальна поздовжня проекція серця демонструє перикардіальний і плевральний випіт.
В діагностиці плеврального випоту у пацієнтів в критичному стані є неуточненими питання про серцеву тампонаду. У той час як багато експертів стверджують, що серцева тампонада є в значній мірі клінічним діагнозом, ехокардіографія може виявляти ознаки, що свідчать про претампонаду або ранню тампонаду. Ехокардіографічною ознакою для визначення тампонади серця є інверсія вільної стінки ПШ під час діастоли шлуночків. Додаткові ознаки включають інверсію ПП під час шлуночкової систоли (найбільш поширена і найбільш рання ознака), збільшення респіраторної варіації швидкостей припливу при доплерографії (ехокардіографічний еквівалент парадоксального пульсу) і розширення НПВ зі зменшеною респіраторною варіацією. У пацієнтів з травмою було встановлено, що ехокардіографія ефективна при ранній діагностиці серцевої тампонади і скороченні часу до оперативного втручання або торакотомії. Економія часу при ультразвуковому дослідженні біля ліжка хворого підвищує ефективність ідентифікації та лікування перикардіального випоту у пацієнтів в критичному стані. Крім того, для пацієнтів з гемодинамічними порушеннями, яким показано введення перикардіального дренажу, ультразвук можна використовувати для визначення найкращого доступу при перикардіоцентезі, а потім для наведення і контролю при його виконанні. Було показано, що перикардіоцентез під ультразвуковим контролем підвищує частоту успішних спроб і знижує ризик ускладнень, таких як пункція міокарда, пошкодження коронарних судин, пневмоторакс, ушкодження органів черевної порожнини і травми діафрагми.
ЗБІЛЬШЕННЯ ПРАВОГО ШЛУНОЧКА
Можливість діагностики правобічної серцевої недостатності може виявитися важливою для життя при оцінці хворих з недиференційованим шоком. Пацієнти з дисфункцією правих відділів серця лікуються інакше, ніж пацієнти з лівобічною серцевою недостатністю, при цьому терапія може бути досить складною. Стан пацієнтів з гіпотензією і правобічною серцевою недостатністю може погіршуватися при агресивному введенні рідини. Замість цього ключовим фактором лікування є зменшення перевантаження ПШ рідиною або тиском. Систолічна функція ПШ може бути якісно оцінена по аналогії з ЛШ (шляхом оцінки ендокардіальної межової екскурсії та потовщення міокарда), при цьому розширення правого шлуночка часто використовується як показник дисфункції. Нормальний ПШ тонкостінний і чутливий до змін навантаження; отже, невеликі зміни тиску призводять до великих змін в об’ємі шлуночка. Збільшення ПШ є фізіологічною відповіддю на надлишковий тиск або об’ємне перевантаження. Нормальне співвідношення між розмірами ПШ і ЛШ (виміряне на верхівках атріовентрикулярних клапанів в апікальній чотирикамерній проекції) становить 0,6. Коли ПШ дорівнює за розміром ЛШ, дилатація ПШ оцінюється як помірна; коли ПШ більший, ніж ЛШ, дилатація ПШ оцінюється як тяжка.
Так само, як і серцева тампонада при виявленні випоту перикарда, так само і ТЕЛА можлива при збільшенні правого шлуночка. Хоча відповідна клінічна картина і може свідчити про наявність ТЕЛА, точності однієї тільки ехокардіографії (навіть якщо вона є комплексною) мало для встановлення діагнозу. Слід також враховувати інші причини збільшення правого шлуночка: інфаркт міокарда, легеневу гіпертензію і хронічну обструктивну хворобу легень. На додаток до збільшення ПШ, при ехокардіографії у пацієнтів з масивною ТЕЛА може також визначатися гіпердинамічний ЛШ з недостатнім наповненням (рис. 5).
Рис. 5. Збільшення правого шлуночка. На парастернальній поздовжній проекції серця показано значне розширення правого шлуночка і невеликий, незаповнений ЛШ.
ЛШ, який, як правило, має циркулярний вигляд в парастернальній поперечній проекції, може мати D-подібну форму через сплощення міжшлуночкової перетинки в результаті збільшення тиску ПШ. У деяких випадках ехокардіографія може виявляти венозний тромб в ПП, який може потрапити в мале коло. Хоча і не часто, за даними літератури в межах від 3% до 18% всіх гострих випадків ТЕЛА, венозна тромбоемболія може розглядатися як пряма ознака ТЕЛА. Спочатку було встановлено, що симптом Маконнела (чітка локальна картина дисфункції ПШ з акінезією середньої частини вільної стінки, але з нормальним рухом на верхівці для діагностики гострої ТЕЛА, має специфічність 94%. Проте подальші дослідження не підтвердили ці дані, а деякі фахівці припускають, що апікальна скоротливість ПШ при цьому не зберігається, а ознака Маконнела є більше візуальною ілюзією, через зв’язок верхівок ПШ і ЛШ.
НИЖНЯ ПОРОЖНИСТА ВЕНА
Визначення стану внутрішньосудинного об’єму може бути ускладнене у хворих в стані шоку. Пацієнт з септичним шоком і гіпотонією все ще може мати недостатній внутрішньосудинний об’єм, незважаючи на внутрішньовенне введення протягом декількох годин кількох літрів рідини. Для пацієнта додаткове введення об’єму рідини найчастіше корисніше, ніж передчасне введення вазопресорів для збільшення артеріального тиску, що може мати несприятливі наслідки для перфузії життєво важливих органів. Крім того, пацієнт з попередньою кардіоміопатією може мати знижений об’єм в зв’язку з септичним шоком. Збільшення об’єму циркулюючої рідини у подібних пацієнтів проводиться дуже обережно, так як надмірна інфузія рідини може швидко привести до перевантаження об’ємом і раптового набряку легенів. Як ємнісний резервуар НПВ може вміщати різну кількість крові, а її розмір коливається в залежності від внутрішньосудинного об’єму пацієнта. Відповідно, ультразвукові вимірювання НПВ можуть використовуватися в якості сонографічної оцінки стану об’єму циркулюючої рідини.
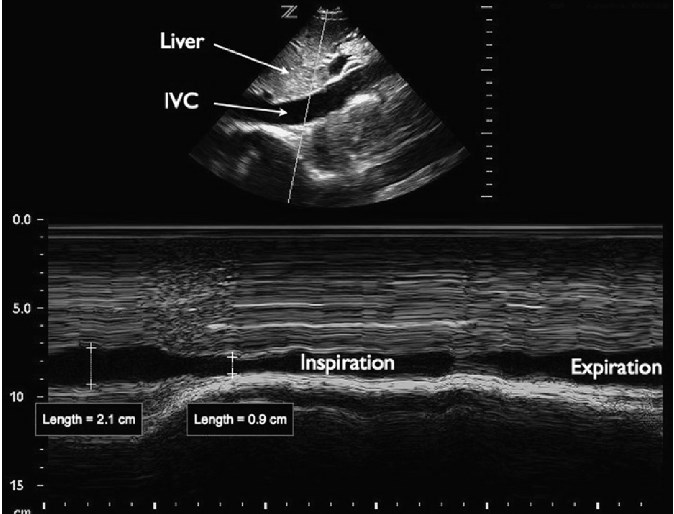
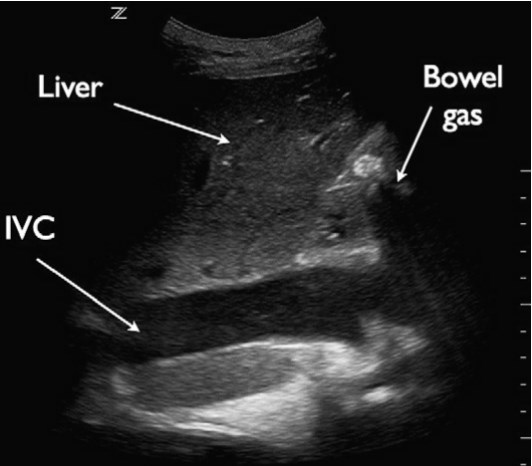
НПВ візуалізується через передню черевну стінку в поздовжній проекції з використанням підреберного доступу, при цьому датчик позиціонується справа від середньої лінії. Для цього дослідження часто використовується конвексний датчик з частотою від 2 до 5 МГц, хоча також можна використовувати мікроконвексний або фазований датчик. При огляді НПВ оцінюється як діаметр судини, так і зміни в різні респіраторні фази. Діаметр НПВ вимірюється від внутрішньої стінки до внутрішньої стінки в передньо-задньому напрямку, або більш каудально від злиття НПВ з печінковими венами, або на 2 – 3 см каудально від атріокавального з’єднання (рис. 6).
Рис. 6. НПВ. На підреберній поздовжній проекції серця показана НПВ (IVC) з вимірюванням діаметра.
НПВ має динамічний діаметр, який змінюється в залежності від фази дихального циклу. У пацієнта із спонтаним диханням негативний внутрішньоплевральний тиск при вдиху виштовхує кров з черевного відділу НПВ в грудну клітку. В результаті діаметр НПВ найбільший під час видиху (НПВе) і проявляє різну ступінь звуження під час вдиху (НПВi). Для визначення ступеня звуження НПВ пацієнта додатково попросять «пошмигати» носом або вдихнути з силою (так званий нюхальний тест – sniff test), звичайно, коли він може виконувати команди. Відсоткову частку звуження діаметра НПВ під час вдиху було названо кавальним індексом: (НПВе – НПВi)/НПВе). Візуалізація відносного розміру НПВ під час дихальних циклів може бути полегшена за допомогою ультразвукового дослідження в M-режимі (рис. 7).
Рис. 7. НПВ в М-режимі. На підреберній поздовжній проекції серця показана НПВ, яка відображається в M-режимі під час вдиху.
У багатьох дослідженнях оцінювали кореляцію діаметра НПВ і кавального індексу до внутрішньосудинного об’єму, який часто оцінюється за даними вимірювань центрального венозного тиску (ЦВТ) – показник рівня обсягу, який часто використовується, однак є недосконалим. Було показано, що абсолютний діаметр НПВ зменшується у відповідь на зниження внутрішньосудинного об’єму та це може використовуватися для спостереження за відносним об’ємом циркулюючої крові, подібно вимірюванням ЦВТ. Проте, значна варіація вихідного діаметра НПВ від індивідуума до індивідуума обмежує значимість ізольованих вимірювань діаметра НПВ. Для порівняння, зміна діаметра НПВ при диханні має краще прогностичне значення для оцінки тиску наповнення правого шлуночка, ніж статичні вимірювання НПВ. Звуження НПВ більше 50% при вдиху (кавальний індекс> 0,5) прогнозує ЦВТ менше 10 мм рт. ст. Навпаки, звуження НПВ менше 50% (кавальний індекс <0,5) прогнозує ЦВТ більше 10 мм рт. ст.
Таблиці, що зіставляють вимірювання НПВ з різними діапазонами ЦВТ (0-5, 5-10, 10-15 та 15- 20 мм рт. ст.) зазвичай включаються в підручники з даної теми, хоча дані, що підтримують такий точний взаємозв’язок, мало підтверджені. Хоча індивідуальний діаметр НПВ і кавальний індекс іноді не зовсім точно відповідають конкретним числовим значенням ЦВТ, вони можуть ефективніше використовуватися для прогнозування граничних значень гіповолемії і перевантаження об’ємом (табл. 1).
Таблиця 1. Результати вимірювань НПВ при пограничних рівнях зменшення об’єму і об’ємного перевантаження.
| Стан об’єму | Діаметр (см) | Вдих | ЦВТ (мм Нg) |
| Зменшення об’єму | •1,5 | Повний колапс | •5 |
| Об’ємне перевантаження (ймовірне) | •2,5 | Колапс відсутній | •20 |
Невелика (<1,5 см) НПВ, з повним (або майже повним) колапсом на вдиху, вказує на те, що пацієнт з шоком і гіпотензією має значне зниження внутрішньосудинного об’єму (рис. 8).
Рис. 8. Спала НПВ. На підреберній поздовжній проекції показана НПВ, практично з повним колапсом на вдиху при значному зниженні внутрішньосудинного об’єму.
Такі пацієнти, найімовірніше, матимуть перевагу при агресивному заповненні об’єму циркуляції. Велика (• 2,5 см) НПВ, що не показує ознак (або мінімальні) змін діаметра при вдиху, так звана повнокровна НПВ, спостерігається у пацієнтів з ознаками об’ємного перевантаження (рис. 9). Однак при багатьох інших станах (описаних нижче) може спостерігатися повнокровна НПВ, яка не обов’язково відображає стан внутрішньосудинного об’ємного перевантаження.
Рис. 9. Повнокровна НПВ. На підреберній поздовжній проекції показана НПВ, зі збільшеним діаметром при об’ємному перевантаженні.
Незважаючи на те, що спала НПВ передбачає проведення наповнення внутрішньосудинного об’єму, не слід вважати, що при повнокровній НПВ завжди необхідно припиняти подальшу інфузію.
Підвищений тиск правого передсердя (і, отже, збільшений ЦВТ) визначається при ізольованій правобічній серцевій недостатності і хронічній легеневій гіпертензії. У цих пацієнтів може спостерігатися повнокровна НПВ, хоча при цьому тиск наповнення лівого шлуночка може бути субоптимальним, незважаючи на підвищений тиск в правих відділах. Ультразвукова оцінка НПВ для визначення ефективного внутрішньосудинного об’єму в цих клінічних умовах менш ефективна, при цьому повнокровна НПВ не виключає того, що додаткове об’ємне навантаження збільшить серцевий викид.
Повнокровна НПВ може бути ключовим моментом у визначенні кардіогенного або обструктивного видів шоку. Недостатність ПШ і/або повне перевантаження внутрішньосудинного русла супроводжують недостатність ЛШ при хронічних кардіоміопатіях. Кров повертається з правого відділу серця і заповнює НПВ, як ємнісну судину, в результаті чого розвивається повнокров’я НПВ. Повнокровна НПВ також спостерігається при гострих обструктивних процесах, які перешкоджають венозному притоку до серця, наприклад, серцева тампонада, напружений пневмоторакс і масивна ТЕЛА. У цих випадках повнокровна НПВ відображає порушення наповнення серця, а не внутрішньосудинне об’ємне перевантаження. Фактично, пацієнти з обструктивним шоком, який викликаний серцевою тампонадою або напруженим пневмотораксом, виграють від агресивного об’ємного вливання рідини до тих пір, поки не можуть бути проведені етіотропні методи лікування, які усувають обструкцію (наприклад, перикардіоцентез або декомпресія грудної клітини). Слід проявляти обережність при введенні рідини у пацієнтів з масивною ТЕЛА, оскільки надмірна інфузія може збільшити напруження стінки ПШ і посилити ішемію.
Коли пацієнтам проводиться механічна вентиляція легень з позитивним тиском на видиху, респіраторні зміни діаметра НПВ змінюються на протилежні значення. Так як під час вдиху виникає позитивний тиск, кров витісняється з грудної клітини в екстраторакальний відділ порожнистої вени, і в результаті НПВ злегка розтягується. Ненаповнена НПВ більш податлива і збільшується під час вдиху більше, ніж відносно добре заповнена НПВ. Процентне співвідношення розширення діаметра НПВ під час вдиху у пацієнтів, яким проводиться вентиляція з позитивним тиском, було назване індексом розтягнення: (НПВi – НПВe)/НПВ. Індекс розтягнення добре вивчений у ВІТ, де пацієнти часто потребують механічної вентиляції. Граничне значення 18% поділяє пацієнтів на дві групи: на тих, у кого збільшується серцевий викид у відповідь на подальшу інфузію, і на тих, у кого не збільшується. Так як величина 18% являє собою дискретне порогове значення, то пацієнти з більшою ймовірністю будуть виявляти або не проявляти реакцію на введення рідини, в залежності від того, чим більше відрізняється індекс розтягнення від цього порогового значення.
ЧЕРЕВНА ПОРОЖНИНА
Протокол FAST – це, мабуть, класичний приклад клінічного застосування ультразвукового дослідження. З початку 1970-х років ретельно досліджується ефективність УЗД для виявлення гемоперитонеуму у пацієнтів травмою і в умовах реанімації. Було показано, що FAST протокол зменшує час розпізнавання травми черевної порожнини і оперативного втручання, а також знижує лікарняні витрати на використання ресурсів. У зв’язку з цими перевагами, FAST протокол тепер включений в протокол ATLS Американського коледжу хірургів і в посібник Східної асоціації по хірургії травми (EAST) для лікування тупої травми черевної порожнини. Аналогічним чином Американський коледж радіології рекомендує використовувати ультразвукове дослідження для оцінки вільного або локалізованого внутрішньочеревного рідинного скупчення.
Спочатку FAST протокол застосовувався тільки до пацієнтів з травмою, проте його використання розширилося і включає тепер також пацієнтів в критичному стані (шоці). Можливо, найкращим прикладом використання FAST протоколу у пацієнтів без травми є діагностика гемоперітонеума у пацієнток з підозрою на позаматкову вагітність. Наявність внутрішньочеревної рідини у вагітної пацієнтки без чітких ознак внутрішньоутробної вагітності є непрямим, але дуже переконливим доказом позаматкової вагітності. Дослідження гепаторенального простору (кишені Морисона) в правому верхньому квадранті (ПВК) вважається стандартною практикою при ультразвуковій оцінці пацієнтки з вагітністю в першому триместрі з болем в животі або вагінальною кровотечею. Гемоперитонеум, вторинний по відношенню до різних етіологічних причин, таким як розрив артеріальної аневризми, розрив селезінки або ятрогенна травма, також може бути виявлений за допомогою FAST протоколу.
FAST протокол складається з 4 стандартних проекцій (ПВК, лівий верхній квадрант [ЛВК], тазова і підреберна серцева проекція) для ідентифікації рідини в черевній порожнині і в перикардіальному мішку. Для цього дослідження зазвичай використовується конвексний датчик від 2 до 5 МГц, хоча також може бути достатньо мікроконвексного або фазованого датчика. Ультразвукове дослідження здатне виявляти вже 100 мл вільної рідини в перитонеальній порожнині, при цьому скупчення рідини в діапазоні від 250 до 500 мл (об’єм, який вказує на значну кровотечу при гемоперітонеумі) або вище, може надійно бути виявленим під час проведення FAST протоколу. Локалізація рідини залежить від положення пацієнта, а також від джерела кровотечі. В останні роки дослідження продемонстрували цінність включення в дослідження грудної клітини, для оцінки гемотораксу і пневмотораксу. Ця розширена версія FAST протоколу називається E-FAST і включає в себе проекції обох половин грудної клітки на рівні діафрагмально-абдомінальної межі, а також над передньою грудною стінкою (див. Розділ про легені).
Проекція ПВК виходить шляхом установки датчика в коронарній площині. При цьому печінка служить акустичним вікном, і, з огляду на її розмір, проекція ПВК може бути відображена по передньо-пахвовій, середньо-пахвовій або задньо-пахвовій лінії (рис. 10).
Рис. 10. Вільна рідина в ПВК. Коронарна проекція ПВК показує вільну рідину і ехогенний згусток в кишені Морисона.
Зацікавила стаття? Підпишіться на нашу розсилку, щоб не пропустити продовження!
У швидкій та якісній ультразвуковій діагностиці Вам допоможе УЗД апарат General Electric Logiq E9. Рекомендуємо ознайомитись з детальними характеристиками апарата по посиланню.















11.02.2019
Ольга