3-DUS досягло визнання, як діагностичний інструмент, значення якого виходить далеко за межі звичайного 2-D звукового дослідження (2-DUS) і, таким чином, заслуговує на те, щоб бути включеним в повсякденну практику. Працівники системи охорони здоров’я повинні бути проінформовані про доведену і зростаючу роль, яку відіграє 3-DUS в акушерській практиці і повинні бути впевнені при призначенні 3-DUS дослідження своїм пацієнтам.
АВТОРИ: GABRIELE TONNI, WELLINGTON P. MARTINS, HELIO GUIMARAES FILHO, EDWARD ARAUJO JUNIORY
РЕЗЮМЕ
Використання 3-D ультразвуку в акушерстві зазнало драматичного розвитку протягом останніх 20 років. З моменту перших публікацій по цій техніці в клінічній практиці, безліч методів 3-D ультрасонографії і режимів візуалізації було запропоновано і застосовано до вивчення мозку плода, обличчя і анатомії серця. До того ж, 3-D ультрасонографія поліпшила розрахунки об’єму фетальних органів і кінцівок, оцінку маси плода при народженні. І, крім того, ангіографічні картини органів плода і плаценти, були оцінені з використанням 3-D кількісної енергетичної доплерографії. У цьому огляді ми прагнемо узагальнити наявні дані про клінічну значимість цих методик і їх застосування в акушерській практиці.
Ключові слова:
Доплерографія, плід, чотиривимірне ультразвукове дослідження, HDlive, таблиця даних, Omniview, просторово-часова кореляція зображень, тривимірне ультразвукове дослідження, розрахунок об’єму.
ВСТУП
Даний огляд присвячений оцінці історичного фону, що лежить в основі ролі та клінічного значення 3-D ультразвукового дослідження (3-D ultrasound – 3-DUS). Даний огляд також показує, що 3-DUS досягло визнання, як діагностичний інструмент, значення якого виходить далеко за межі звичайного 2-D звукового дослідження (2-DUS) і, таким чином, заслуговує на те, щоб бути включеним в повсякденну практику. Працівники системи охорони здоров’я повинні бути проінформовані про доведену і зростаючу роль, яку відіграє 3-DUS в акушерській практиці і повинні бути впевнені при призначенні 3-DUS дослідження своїм пацієнтам. Тим не менш, у даний час, в органи охорони здоров’я потрібні значні інвестиції в області передових технологій для обладнання відповідним чином і комп’ютеризації сучасних акушерських ультразвукових лабораторій.
Щоб проілюструвати доведену роль 3-DUS в акушерській практиці, ми надаємо дані про його застосування в дослідженні анатомії мозку плода, обличчя, фетальної ехокардіографії, об’ємів органів і кінцівок плода та оцінці маси тіла при народженні. Ми також розглянемо 3-D енергетичну доплерографію (3-D power Doppler ultrasound – 3-D-PD). Крім того, ми представляємо кілька додатків 3-DUS, які включають в себе методи повторного розділення, на такі як: OmniView, зворотна/похила/коса проекція, просторово-часова кореляція зображення (spatiotemporal image correlation – STIC), B-потік, режим інверсії і таблиці даних, комп’ютеризований аналіз віртуального органу (VOCAL), обчислення об’ємів і недавно розроблені світлові методи.
ОСНОВИ ТА ТЕХНІЧНІ АСПЕКТИ 3-D УЛЬТРАЗВУКОВОГО ДОСЛІДЖЕННЯ
Перша система 3-DUS була описана Baba та ін. (1989). Ця система складалася з 2-D датчика, прикріпленого до механічної руки, яка проводила сканування черевної порожнини вагітної. За допомогою цього сканування, збиралися дані з декількох 2-D площин і відправлялися на комп’ютер для 3-D реконструкції зображення. Великими недоліками цієї системи були тривалий час, необхідний для виконання сканування і низька якість зображення, що обмежувало його застосування в клінічній практиці (Baba та ін. 1989).
На початку 1990-х років, група національного Університету Ченг Кунга в Тайвані представила першу візуалізацію обличчя, мозочка і шийного відділу хребта плода з використанням конвексного об’ємного датчика на УЗД-апараті Combison 330 (Kretztechnik, Zipf, Австрія), який був першим 3-DUS обладнанням, яке використовувалося в клінічній практиці (Kuo та ін. 1992). Nelson та Pretorius (1992) були одними з перших, хто візуалізував поверхні і хребта плода (Steiner та ін. 1995), Merz та ін. (1995) візуалізували великий ряд вроджених аномалій з використанням як 2-DUS і 3-DUS. Merz та ін. (1995) повідомили, що 3-DUS техніка покращувала пренатальне виявлення аномалій розвитку плода в 62% випадків, була еквівалентна в 36% і менш ефективна в 3% випадків у порівнянні з 2-DUS. Тривимірні УЗД зображення формуються шляхом зміни положення об’ємного датчика для отримання об’єму у вигляді серії зрізів в різних напрямках. Інтегровані датчики, як правило, поєднані зі сканером таким чином, що набір об’ємних даних відразу ж доступний під час проведення дослідження, без необхідності повторного проектування або постобробки (Nelson та Pretorius 1998).
Комп’ютерна програма створює єдиний набір 3-D даних на основі відстані і кута між отриманими 2-D ультразвуковими зображеннями. Найменша одиниця 2-DUS зображення є піксель, найменша одиниця 3-DUS зображення називається воксель. При 3-DUS дослідженні, 2-DUS зображення об’єднуються за допомогою комп’ютера і формують реальне 3-D зображення анатомії і патології. Це зображення можна переглядати, маніпулювати ним і вимірювати в трьох проекціях лікарем на тому ж або іншому комп’ютері. Також, 2-мірне зображення в поперечному перерізі може бути згенеровано в будь-якій орієнтації, без обмежень, в анатомічній зоні, яка може бути легко пов’язана з попереднім або наступним 3-D зображенням. Щоб уникнути геометричних спотворень в 3-D зображеннях, що може привести до помилки вимірювань, місце розташування і орієнтація одержуваного 2-D зображення повинні бути точно відомі. Було запропоновано чотири різних підходи 3-DUS візуалізації: механічні сканери, мануальна техніка з позиціонуванням датчика, мануальна техніка без позиціонування датчика і 2-мірний масив (Fenster і Downey 1996). Етапи проведення 3-DUS дослідження включають: отримання набору даних, 3-D візуалізацію, інтерпретацію зображення і/або оцінку об’єму і збереження об’ємних даних тривимірного ультразвукового дослідження, які можуть бути отримані з використанням лінійного, конвексного, звичайного та/або ротаційного датчиків (Nelson та Pretorius 1998). Методики відтворення 3-D ультразвукових зображень підрозділяються на мультипланарні і засновані на поверхневому і об’ємному рендерінгу.
При мультипланарному рендерінгу, 3-D воксельне зображення спочатку має бути реконструйовано. Потім програмний інтерфейс ‘‘комп’ютер-користувач’‘ дозволяє вибрати одну або кілька проекцій для формування зображення, аналогічно традиційному 2-DUS, які показуються на екран. Набори 3-D даних можуть бути збільшені, повернені або переміщені, що дозволяє отримати картинку в будь-якій площині в межах отриманого об’єму (Merz та ін. 2007). Після серії маніпуляцій, плід (або інша досліджувана структура) може бути візуалізовані в стандартній манері, що є, таким чином, відправною точкою для проведення дослідження. Це, як правило, досягається шляхом маніпулювання набором 3-D даних до отримання сагітального зображення на екрані в площині А (угорі ліворуч), поперечного зображення в площині В (справа вгорі) і коронарного зображення в площині С (нижній лівий) (Барра та ін . 2013) (рис. 1).
При поверхневому рендерінгу, алгоритм аналізує кожен воксель на 3-D зображенні і визначає, до якої структури він належить. Після того, як тканини або структури будуть класифіковані та визначено їх межі, межі поля зору представляються у вигляді лінійного каркаса або сітки, а поверхня – відображається у вигляді текстури відповідного кольору, яка представляє анатомічну будову об’єкта (Lobregt і Viergever 1995; Neveu та ін. 1994). Точна і автоматична сегментація ультразвукових даних має важливе значення для високоякісної поверхневої відповідності, а сегментація на основі нульового сигналу значно спрощує виявлення структурних особливостей. Baba та ін. (1996, 1997) візуалізували поверхні плоду в режимі реального часу за допомогою простої порогової обробки для визначення поверхні плода в амніотичній рідини.
Рис. 1. Тривимірне УЗД плоду в мультипланарному режимі в першому триместрі вагітності. Отримане зображення знаходиться вгорі. Після повороту і переміщення набору 3-D даних, можна помістити плід в стандартизованій манері, в сагітальній площині на А зображенні, в поперечній площині на B зображенні і фронтальній площині на C зображенні. При стандартизації зображення, можна розрізнити те, що плід зігнутий в праву сторону, що може заважати при вимірюванні куприково-тім’яного розміру.
Найбільш поширеною методикою при 3-DUS є техніка перетворення променів (raycasting), при якій воксельна інтенсивність поширюється вперед у напрямку до площини зображення уздовж кожного променя від задньої стінки до передньої. Кожен воксель сприяє формуванню остаточної інтенсивності зображення, що залежить від затінення і прозорості значень (Nelson і Pretorius 1998).
У режимі рендерінга, вокселі, пов’язані з амніотичною рідиною, видаляються з набору 3-D даних і з поверхні нижче амніотичної рідини, таким чином, поле зору обмежено видимими прямими і/або вигнутими лініями (Riccabona та ін. 1997). Таким чином, наявні запірні площини, які утворюють вкладений в обсязі куб, також можуть бути отримані. Поверхневий режим рендеринга може бути додатково посилений за рахунок нової HDlive техніки підсвічування (Рис. 2).
Рис. 2. (А) Мультипланарний і режим рендерінга плода першого триместру. У режимі рендеринга, поле зору, яке обмежене лініями в мультипланарному режимі, візуалізується в межах ліній без вокселей, пов’язаних з амніотичною рідиною. (B) HDlive: реалістичне зображення ембріона на 10,2 тижні вагітності з використанням трансвагінального сканування із застосуванням наступної обробки за допомогою цієї нової техніки підсвічування.
Крім того, анімовані послідовності, такі як обертання і ”кіно петля” допомагають в візуалізації об’єму, шляхом можливості обробки зображення в реальному часі або попереднього розрахунку (Nelson і Pretorius 1998).
У будь-якому випадку, для підвищення точності діагностики і запобігання помилки в діагностичній інтерпретації, особливо у випадках неконтрольованого обертання отриманого об’єму на випадковий кут недосвідченим радіологом, стандартизація використання 3-D ультразвуку була первинною клінічною проблемою і метою в процесі розробки цієї методики (Abuhamad та ін. 2007; Benacerraf та ін. 2005; Merz та ін. 2007).
Шляхом дослідження ефективності методики у вивченні анатомії головного мозку, анатомії черепа, структур серця і об’ємів органів, ми проілюструємо клінічне значення 3-D/4-D УЗД. Ми також опишемо, як дана техніка досягла високої діагностичної точності в акушерсько-гінекологічній практиці.
3-D УЛЬТРАЗВУК І ВИВЧЕННЯ ЕМБРІОНАЛЬНОЇ АНАТОМІЇ МОЗКУ: НЕЙРОСОНОГРАФІЯ
Незважаючи на те, що 2-DUS нейросонографія здійснюється у відповідності з керівними принципами Міжнародного товариства ультразвуку в акушерстві та гінекології (ISUOG) і являє собою золотий стандарт медичної допомоги (ISUOG 2007), все більше доказів з’являється про клінічну ефективність 3-DUS УЗД, яке було запропоновано в якості методу, який може подолати обмеження, пов’язані із залежністю від навичок рентгенолога (Benacerraf та ін. 2006). Ембріональна нейросонографія здійснюється шляхом установки датчика вздовж швів і тім’ячка голівки плоду (Timor-Tritsch і Monteagudo1996).
На додаток до основних черезталамічних, черезшлуночкових і трансмозочкових осьових проекцій, була рекомендована (ISUOG 2007) оцінка чотирьох коронарних проекцій (трансфронтальна, транскаудальна, трансталамічна і трансмозочкова) і дві сагітальні (средньосагітальна і парасагітальна). В останні роки, 3-DUS ефективно використовується для визначення основних структур мозку і зображення структур, які зазвичай не відображаються при 2-D трансабдомінальном осьовому підході (Chitty і Pilu 2009; Timor -Tritsch та ін. 2012). В якості альтернативи, для отримання діагностичних площин і зменшення залежності від оператора, може бути використано отримання наборів об’ємних даних, починаючи з аксіальної проекції голівки плоду і ”навігації” в автономному режимі з використанням мультипланарної реконструкції площин, що може потенційно збільшити швидкість виявлення аномалій центральної нервової системи (Rizzo та ін. 2011а). Концепція автоматизованого об’ємного ультразвукового дослідження, яка заснована на оператор незалежному пошуку діагностичних 2-D площин з 3-D об’єму, вимагає початкової, зумовленої стандартизації органоспецифічних 3-D об’ємів. Так само необхідно 180º обертання уздовж осі у в площині A, z-обертання і розміщення ”точки відліку” в середній точці міжпівкульової щілини (Abuhamad 2005). Monteagudo та ін. (2000) досліджували 34 пацієнтів з анамнезом патології головного мозку або підозрою на патологію мозку і порівнювали 2-D і 3-D трансвагінальні нейросонограми. Monteagudo та ін. (2000) прийшли до висновку, що основна відмінність між 2 DUS і 3-DUS дослідженнями полягає в тому, що осьова площина може бути отримана тільки за допомогою 3-D реконструкції набору об’ємних даних, і це є перевагою, так як осьову площину рідко можна побачити при 2-D трансвагінальній техніці. Площини, отримані в автономному режимі з 3-D об’єму, були паралельними, а не косими, або розташованими під кутом, як у випадку зі звичайною 2-D трансвагінальною нейросонографію. Нарешті, коли були зіставлені 2-DUS і 3-DUS дослідження патологічних випадків, важливою перевагою, яка забезпечувалася ”навігацією” в межах об’ємів, що генеруються 3-DUS, була можливість стежити за конкретною точкою, яка ідентифікує одну і ту ж анатомічну точку в усіх трьох ортогональних площинах, що полегшує ідентифікацію структури по середній лінії.
Vinals та ін. (2007) повідомили, що трансфронтальне отримання 3-D наборів об’ємних даних мозку є найбільш вигідним для вивчення як мозолистого тіла, так і черв’яка мозочка після 20 тижнів вагітності. Також вони повідомили, що средньосагітальну площину можна було легко отримати в усіх випадках з діагностично якісним зображенням мозолистого тіла в 93,1% і 99,0% випадках двома рентгенологами, відповідно. Bornstein та ін. (2010a) виконували аналіз в автономному режимі з використанням трансабдомінального 3-D УЗД в сірій шкалі і енергетичної доплерографії об’ємів мозку плода при дослідженні 102 послідовних нормальних плодів в строках від 20 до 23 тижнів. Miguelote та ін. (2012) порівняли можливості і відтворюваність 3-D об’ємної ультразвукової реконструкції при її використанні для вимірювання довжини мозолистого тіла у 46 нормальних плодів, досліджених за допомогою 2-DUS і 3-DUS в строках від 23 до 32 тижнів вагітності. Прямі середньосагітальні проекції були отримані або при трансабдомінальному, або трансвагінальному доступі, а 3-D реконструкції середньосагітальної проекції були отримані за допомогою 3-D мультіпланарних маніпуляцій і об’ємного контрастного зображення за допомогою техніки C-площини (VCI-C) з об’ємів, отриманих в осьових площинах. VCI-C являє собою новий підхід, який покращує контрастність і роздільну здатність тканин в порівнянні з 2-DUS. Він дає можливість проводити вимірювання, візуалізувати поля і внутрішні аспекти структур/тканин, які є більш точними (Ruano та ін. 2004а) (Рис. 3).
Рис. 3. Фетальна нейросонографія з використанням OmniView з об’ємним контрастним зображенням в C-площині (VCI-C). Жовта лінія розташована в косому напрямку через задню черепну ямку, що дозволяє провести реконструкції черв’яка мозочка у нормального плода (сканування в другому триместрі).
Visentainer та ін. (2010) встановили референтні значення для довжини мозолистого тіла і площі у плода в строках від 20 до 33 тижнів вагітності з використанням 3-DUS. Ці автори повідомляють, що середня довжина мозолистого тіла збільшується з 21,7 до 38,7 мм між 20 і 33 тижнями вагітності і середня площа мозолистого тіла збільшується з 55,2 до 142,2 мм2 між 20 і 33 тижнями вагітності. Також документально підтверджена сильна кореляція між довжиною/площею мозолистого тіла і гестаційним віком (R = 0.7 і 0.7) і біпаріетальним діаметром (R = 0,7 і 0,6).
Miguelotte та ін. (2012) повідомили, що мозолисте тіло може бути виміряне в 91% трансвагінальних досліджень, в 52% трансабдомінальних досліджень, в 92% при мультипланарній реконструкції і в 86% – при VCI реконструкції, отриманої за допомогою техніки С-площини. Oни прийшли до висновку, що ймовірність успіху щодо трансвагінального дослідження не залежить від гестаційного віку і слабо залежить від цього параметра для методів 3-D реконструкції. Correa та ін. (2006) оцінили роль трансабдомінального 3-DUS в оцінці мозку плода і вивчили його потенціал при рутинному нейросонографічному дослідженні, проведеному у 202 послідовних плодів в строки від 16 до 24 тижнів вагітності. Автори виявили, що мозолисте тіло можна було побачити у 84% пацієнтів, четвертий шлуночок у 78%, бічну борозну (сильвієву щілину) в 86%, поясну борозну в 75%, півкулі мозочка в 98%, черв’як мозочка в 92%, довгастий мозок в 97% і cavum vergae в 9%. Таламус і великі цистерни були визначені у всіх випадках. У строку 20 тижнів або більше, відзначена найкраща частота візуалізації для мозолистого тіла (97%), надмозочкових цистерн (92%) і третього шлуночка (93%).
Correa та ін. (2006) прийшли до висновку, що мультипланарні зображення, отримані при трансабдомінальному 3-DUS забезпечують простий, ефективний підхід до детальної оцінки анатомії мозку плода. Цей метод має потенціал для використання в рутинних дослідженнях плода.
При вивченні церебральних серединних структур плода у 300 послідовних нормальних вагітних жінок з низьким рівнем ризику, Tonni та ін. (2014 року) нещодавно надали докази того, що застосування нової 3-DUS реслайсінг техніки (Omniview, GE Medical System, Ципфом, Австрія) може полегшити оцінку серединних структур мозку при анатомічному скануванні в другому триместрі. Omniview є новою реслайсінг технікою для 3-DUS/4-DUS, яка дозволяє отримувати набори об’ємних даних і одночасно відображати до трьох незалежних площин будь-якого даного органу. Вона також дозволяє одночасно проводити об’ємну реконструкцію до трьох незалежних площин, шляхом розмежування ліній і кутів в будь-якому напрямку. Об’єм може бути вільно розділений шляхом установки ультразвукового устаткування для відстеження прямих ліній, вигнутих ліній, або поліліній, що вибирається в меню. Omniniew або інше комерційно доступне програмне забезпечення має потенціал для полегшення реконструкції та оцінки 3-D об’ємів, що, таким чином, компенсує обмежений досвід оператора і вимагає короткого періоду навчання в навчальних програмах (Yeo та ін. 2011a, 2011b). Tonni та ін. (2014 року) повідомили, що офф-лайн об’ємні дані мозолистого тіла і задньої черепної ямки були точно реконструйовані з сагітальній і осьової площин в 98,5% і 96% випадках, відповідно, з кореляцією 0,96 та 0,91 для середньосагітальної і осьових площин, відповідно, у випадках, пов’язаних з патологією (рис. 4).
Результати, отримані Tonni та ін. (2014 року) узгоджуються з даними Rizzo та ін. (2011b), який вперше використав цю технологію для реконструкції сагітальної і коронарної площині мозку у 106 нормальних ембріонів в строки від 18 до 24 тижнів вагітності. Були отримані середньосагітальна, парасагітальна, трансфронтальна, транскаудальна, трансталамічна і трансмозочкова площині, з показниками візуалізації для мозкових структур від 72% до 96% за допомогою сагітальних зрізів, і від 76% до 91% за допомогою коронарної проекції. Параметри узгодження між операторами були 0,93 і 0,89 для сагітальної і коронарної площин, відповідно. Rizzo та ін. (2011b) також змогли точно виявити всі дев’ять випадків церебральної патології, в тому числі: повна агенезія мозолистого тіла, погранична вентрікуломегалія і класична вада розвитку – синдром Денді-Уокера.
Рис. 4. Фетальна нейросонографія з використанням OmniView: реконструкція мозолистого тіла у нормального плода на 20 тижні вагітності.
Бразильські дослідники (Haratz та ін. 2011) оцінювали можливість виконання волюмометрії бічного шлуночка у 30 плодів в строках від 20 до 36 тижнів вагітності, отримавши ширину шлуночків від 10 до 30 мм. При порівняння вимірювань, виконаних за допомогою 3-DUS VOCAL з результатами, отриманими за допомогою магнітно-резонансної томографії (МРТ), Haratz та ін. (2011) виявили, що 3-DUS волюметрія фетального бічного шлуночка VOCAL методом добре корелює з МРТ плода з вентрікуломегалією, і що такий підхід може бути використаний як додатковий консультативний метод і засіб прогнозування. VOCAL – це комп’ютерна програма, встановлена на деяких комерційних ультразвукових машинах, яка використовуються для розрахунку об’єму і використовує полюси, які відмежовані розміткою. Кут повороту залежить від ультразвукової машини і коливається від 6º до 30º. Якщо обраний кут 6º, оператор розмежовує 30 площин; з кутом 30º різниться тільки 6 площин. Розмежування площин може бути ручним, автоматизованим або напівавтоматичним. Коли останню площину відмежовано, система реконструює орган ембріона і відображає його об’єм. Як повідомляється, цей метод був однаково здійсненним і відтвореним як in vivo, так і in vitro (Raine-Fenning і ін. 2003; Ruano і ін. 2005; Martins та ін. 2007) і добре корелював з МРТ і мультипланарними методами (Ruano та ін. 2004b). VOCAL має кілька переваг у порівнянні з мультипланарними методами, так як цей метод більш швидкий і дозволяє виконати правку в необхідній області після завершення розрахунку кінцевого об’єму (Peralta та ін. 2006) (Рис. 5).
Рис. 5. Комп’ютерний аналіз віртуального органу (VOCAL) з 30º кутом повороту, який був використаний для розрахунку об’ємів головки і тулуба плода.
Розрахунок фетального мозочка в різних етнічних групах є важливим застосуванням VOCAL для побудови діапазону нормальних значень в залежності від гестаційного віку. Такий розрахунок також поліпшив точність пренатальної діагностики гіпоплазії мозочка. Гіпоплазія мозочка може бути знайдена у плодів з синдромом Дауна, затримці внутрішньоутробного розвитку (ЗВУР) і множинних генетичних захворюваннях (Rotmensch та ін. 1997). При поздовжньому дослідженні 52 плодів при нормальній вагітності, Araujo Junior та ін. (2007а) помітили, що рівняння для об’єму фетального мозочка, яке визначив Chang та ін. (2000) для тайванського населення, не може бути застосоване до бразильського населення, тим самим підтверджуючи, що етнічна приналежність потенційно може бути фактором, який може сприяти створенню відмінностей в об’ємах ембріонального органу. Rutten та ін. (2009) спостерігали хорошу внутрішньо- і міждослідницьку надійність при розрахунку об’єму мозочка, використовуючи як мультипланарні, так і VOCAL методи, як це зробили Araujo Junior та ін. (2014а) при розрахунку об’єму великої цистерни плода з використанням VOCAL при 30º в стандартній аксиальній площині поперечного діаметру мозочка.
Крім того, коли використовується 3-DUS технологія, то об’ємні дані можуть бути збережені, стиснуті, а потім відправлені в віддалену точку для проведення консультацій експертами для подальшого аналізу, що дозволяє провести більш точну оцінку (Bornstein і ін. 2010b; Rizzo та ін. 2011c; Salman та ін. 2011). Зовсім недавно, Passos та ін. (2014) встановили діапазони нормальних значень для довжини і площі великої цистерни плода по 3-DUS в мультипланарному режимі при 224 нормальних вагітностях в строках від 17 до 30 тижнів. Автори виявили, що середня довжина і площа великої цистерни плода коливалася від 0,50 ± 0,10 до 0,79 ± 0,18 см та від 0,95 ± 0,18 до 3,09 ± 0,62 см2, відповідно.
Дослідження раннього розвитку мозку (7-12 тижнів вагітності) на 3-DUS з використанням інверсійного режиму рендерінга було описано Kim та ін. (2008). Інверсійний режим рендерінга є методом, який аналізує рідкі структури і інвертує сірошкальні вокселі, тобто, спочатку анехогенні структури, такі як камери серця, судини і шлунок, сечовий міхур і ниркові миски стають ехогенними, в той час як структури, які, як правило, ехогенні (наприклад, кістки) стають анехогенними (Goncalves та ін. 2004a; Lee і ін. 2005). Інверсійний режим рендерінга дозволяє проводити реконструкції камер серця, аорти та протокових дуг, аномальних венозних з’єднань і септальних дефектів (Espinoza і ін. 2005; Goncalves та ін. 2004a.). Kim та ін. (2008) рекомендують не використовувати цей метод до 6 тижнів через обмежену кількість церебральної рідини, не після 12 тижнів, так як хоріоїдне сплетіння важко виділити після цього строку. Останнім часом, в роботах Rolo та ін. (2011), розвиток борозен мозку і звивин у плода оцінювали за допомогою 2-DUS і 3-DUS і антенатального МРТ. Це дослідження підтвердило те, що хоча МРТ вважається найбільш точним методом для виявлення аномалій звивин і борозен плода (Ghai і ін. 2006; Malinger та ін. 2007), 3-DUS покращує візуалізацію борозен і звивин у порівнянні з 2-DUS. Rolo та ін. (2011) повідомили про те, що режим рендерінга 3-DUS може бути ефективним в постановці остаточного діагнозу аномального розвитку кори і диференціальної діагностики. У порівнянні з МРТ, 3-DUS є більш швидким і економічно рентабельним способом, як правило, цей метод легко доступний і може бути реальною альтернативою, особливо при підозрі на фетальні аномалії кори мозку, які не можуть бути оцінені за допомогою МРТ.
У таблиці 1 наведені найбільш важливі статті про фетальну нейросонографію, проведену за допомогою 3-DUS.
Таблиця 1. Автори дослідження, досліджувана популяція, гестаційний вік, пренатальна ультразвукова техніка та клінічні результати в разі 3-D нейросонографії плода
| Автори дослідження | Досліджувана популяція | Гестаційний вік (тижні) | Пренатальна ультразвукова техніка | Клінічні результати |
| Monteagudo та ін. (2000) | 34 плодів з патологією мозку | 3-D TVUS нейросонографія проти 2-D TVUS | Осьова площина тільки з 3-D реконструкції; площини були паралельними (не косими або кутовими); контрольна точка вказує на той же анатомічний орієнтир у всіх трьох взаємно перпендикулярних площинах, коли ‘‘навігація’‘ здійснюється в межах об’єму | |
| Correa та ін. (2006) | 202 здорових плодів | 16-24 | 3-D TA нейросонографія | CC виявлений у 88%; сільвіева борозна у 86%; поясна борозна у 87%; черв’як мозочка у 92%; півкулі мозочка у 98%; довгастий мозок у 97% |
| Vinals та ін. (2007) | 60 здорових плодів | 20-33 | Візуалізація церебральних серединних структур за допомогою 2-D в порівнянні з мультипланарною 3-D, і VCI-C площина проти трансфронтальної площини | Серединна площина в 88% мультипланарної, 82% в VCI-C і 87% в трансфронтальної площини; CC і черв’як мозочка в 3-D серединних площинах мали сильну кореляцію; первинні і вторинні борозни черв’яка мозочка виявлені в 13% -26% при мультипланарній, 18% -35% в VCI-C і 52% -79% в трансфронтальній площині |
| Bornstein та ін. (2010a) | 102 здорових плодів | 20-23 | TA 3-D в сірій шкалі и енергетична доплерографія | 93% -99% середньосагітальна візуалізація CC |
| Rizzo та ін. (2011b) | 106 здорових плодів | 18-24 | 3-D нейросонографія з використанням OmniView reslicing техніки в середньосагітальній, парасагітальній, транскаудальній, черезталамічній, трансмозочковій площинах | Частоти візуалізації структур головного мозку: 72% -96% при використанні сагітальної площини, 76% -91% при використанні коронарної площини
Частота міждослідницького узгодження від 0,93 і 0,89 для сагітальної і коронарної площин, відповідно Дев’ять випадків патології мозку було правильно визначено |
| Visentainer та ін. (2010) | 70 здорових плодів | 20-33 | Референсний діапазон довжини і площі CC | Довжина і площа CC збільшилася від 21,7 до 38,7 мм і від 55,2 до 142,2 мм 2, відповідно, від 20 до 33 тижнів. Сильна кореляція між довжиною і площею CC і гестаційним віком (R2 = 0,7 і 0,7, відповідно) і біпаріетальним діаметром (R2 = 0,7 і 0,6, відповідно) |
| Miguelotte та ін. (2012) | 46 здорових плодів | 23-32 | Вимірювання CC за допомогою 2-DUS TA/TV проти 3-DUS з реконструкцією середньосагітальної площини проти VCI-C в осьових площинах | CC виміряно в 52% і 91% за допомогою TA і TV US проти 86% за допомогою VCI-C і 92% при мультипланарному методі |
| Haratz (2011) | 30 плодів зі збільшенням бічного шлуночка | 20-36 | Вимірювання волюмометрії бічного шлуночка з використанням VOCAl проти МРТ | Гарне узгодження волюмометрії бічного шлуночка з використанням VOCAl і МРТ; ICC = 0,928 (95% ДІ: 0,876; 0,958); Діаграма Blта-Altman підтвердила високу кореляцію (середні відмінності: ± 1,62 см3, стандартне відхилення: ± 68,41 |
| Araujo Junior та ін. (2014a) | 224 здорових плодів | 17-29 | Вимірювання волюмометрії CM з використанням VOCAl з 30º кутом повороту | CM об’єм варіював від 0,73 ± 0,25 см3 до 3,79 ± 1,10 см3, від 17 до 29 тижнів відповідно. Спостерігалася кореляція між об’ємом великої цистерни плода і гестаційним віком (R2 = 0,67).
Спостерігалася гарна надійність і внутрішньодослідницьке узгодження з ICC = 0.92 (95% ДІ: -49.7; 48.4) |
| Tonni та ін. (2014) | 300 плодів | 19-23 | 3-D нейросонографія анатомії головного мозку по середній лінії з використанням OmniView reslicing техніки в середньо сагітальній і черезмозоковій площинах | CC і черв’як мозочка в 98,5% і 96% випадків в сагітальній і осьових площинах, відповідно. П’ять патологічних випадків точно визначені з узгодженням від 0,96 і 0,91 для середньосагітальної і осьової площин, відповідно |
CC – мозолисте тіло; CI – довірчий інтервал; CM – велика цистерна; МРТ – магнітно-резонансна томографія; ICC – між дослідницький коефіцієнт кореляції; TA – трансабдомінальний; TV – трансвагінальний; US – ультрасонографія; VCI-C – об’єм контрастна візуалізація С-площини; VOCAL – комп’ютерний аналіз віртуального органу.
3-DUS В ДІАГНОСТИЦІ НЕЗАРОЩЕННЯ ГУБИ ТА НЕЗАРОЩЕННЯ ГУБИ/РОЗЩЕПЛЕННЯ ПІДНЕБІННЯ
Хоча незарощення обличчя плода може бути діагностоване пренатально при 2-DUS, впровадження в практику 3-DUS разом з розвитком нових програмних додатків призвело до нового розуміння пренатального ультразвукового дослідження піднебіння плода. В даний час існує все більше доказів того, що 3-DUS може поліпшити пренатальну візуалізацію обличчя плода і виявлення незарощення обличчя (Tonni та ін. 2005), особливо якщо 3-DUS виконується в якості прицільного дослідження для підтвердження передбачуваного діагнозу розщелини, згідно з отриманими даними при 2-DUS (Martinez Ten та ін. 2009). Було розроблено ряд методів візуалізації піднебіння плода. До них відносяться: методика ”перевернутого обличчя” (flipped-face) (Platt та ін., 2006), методика ” зворотної проекції обличчя ” (reverse-face) (Campbell і Lees 2003), методика Faure ( Faure та ін., 2007), ”кут атаки” (Pilu і Segata 2007), методика ”косої проекції обличчя” (oblique face) (Martinez Ten та ін. 2009) та ретроназальний трикутник (Sepulveda та ін. 2010 ). Останній метод застосовується для візуалізації піднебіння плода при скануванні в першому триместрі вагітності. Faure та ін. (2007), проте, не отримали зображення з незарощенням обличчя. Martinez-Ten та ін. (2009) вивчили 60 плодів в строках від 20 до 33 тижнів вагітності, з яких 10 мали заячу губу і вовчу пащу, спочатку виявлені за допомогою звичайного 2-DUS УЗД при скануванні в другому триместрі вагітності. Ці автори повідомили, що методика косої проекції була найкращою методикою при патології піднебіння (100%), в той час як методики flipped-face і reverse-face дозволили правильно діагностувати цю область в 71% і 86% випадків відповідно. При цьому, як і раніше залишається діагностична проблема ураження м’якого піднебіння, яке регулярно визначається тільки у 14% плодів з дефектами піднебіння, при використанні або методики flipped-face, або методу oblique face.
Campbell і Lees (2003) виявили, що хоча за допомогою допологової 2-DUS високої роздільної здатності можна легко діагностувати розщелини губи і альвеолярного відростка, 3-DUS може підвищити чутливість дослідження, коли спершу обличчя плоду розглядається у фронтальній площині, а потім вторинне піднебіння досліджується з допомогою ‘‘reverse-face’‘ техніки після вторинного повороту на 180º. ‘‘Reverse-face’‘ техніка – легка і швидка у виконанні, так як вимагає всього 2-3 хв. для отримання фронтальної картини обличчя з повною візуалізацією піднебіння. ‘‘Reverse-face’‘ техніка може потенційно забезпечувати безперешкодний огляд області піднебіння, порожнини носа і орбіт і, таким чином, пропонує унікальну діагностичну інформацію про стан вторинного піднебіння. Tonni та ін. (2005) визначили, що оптимальний строк для УЗД-скринінгу у виявленні розщелини обличчя коливається від 18 до 23 тижнів вагітності, що відповідає пропонованому стандартному періоду для сканування на наявність аномалій у другому триместрі.
Було виявлено, що тривимірне УЗД дозволяє отримати більш точну візуалізацію первинного і вторинного піднебіння плоду, що дозволяє диференціювати положення і ступінь розщелини, особливо в тих випадках, коли 2-DUS обмежується тільки акустичним затіненням (Martinez Ten та ін. 2009 року; Tonni та ін. 2005). Wang та ін. (2007) повідомили, що 2-DUS плюс 3-DUS значно покращують пренатальну діагностику розщеплення піднебіння (з 22,2% до 88,9%), в порівнянні з одним тільки 2-DUS.
Незважаючи на широке використання ультразвуку, небагато інформації відомо про вплив поверхневого ультразвукового зображення аномалій обличчя плода на батьків. Батькам, чия дитина досліджувалась за допомогою 3-D УЗД на предмет аномалій губи та піднебіння під час вагітності, після народження дитини було проведено анкетування. Результати показали, що 3-DUS не тільки поліпшило точність діагностики розщелини губи і піднебіння, а й призвело до глибшого розуміння і прийняття вад розвитку, ніж при 2-DUS. 3-DUS робить позитивний вплив і підтримує батьків, що передбачає його регулярне використання в випадках ізольованих аномалій губи та піднебіння плода (Escalon та ін. 2010). Крім того, Tonni і Lituania (2012) представили докази того, що методи 3-DUS реконструкції, такі як OmniView або інше доступне програмне забезпечення можуть бути використані для вивчення твердого та м’якого піднебіння плода. Однак, необхідні подальші перспективні дослідження послідовних пацієнтів для того, щоб визначити, чи збільшиться ефективність пренатальної діагностики розщелин обличчя при рутинному застосуванні цього сучасного, що реконструює шари, програмного забезпечення, особливо у випадках ізольованої розщелини піднебіння (Рис. 6, 7).
Рис. 6. Фетальна нейросонографія. Об’єм фетального мозочка був розрахований на 20 тижні вагітності з використанням розширеної візуалізації комп’ютерного аналізу віртуального органу (XI VOCAL) 10 послідовних площин.
Рис. 7. Оцінка обличчя і піднебіння плода, з використанням OmniView у нормального плода при скануванні в другому триместрі вагітності.
Крім того, Tonni і Grisolia (2013) недавно повідомили про те, що м’яке піднебіння і язичок найкраще можуть бути реконструйовані за допомогою 3-DUS рендерінга в поверхневому режимі, з подальшою пост-обробкою з використанням HDlive, нової світлової техніки для проектування поверхонь, в яких рентгенолог встановлює різні світлові параметри для отримання ефектів глибини, шляхом освітлення і затемнення зображень (Kagan та ін. 2011). За допомогою цієї програми стає більш доступною візуалізація внутрішньоутробного розвитку різних структур і, таким чином, лікар може контролювати нормальний і порушений гестаційний розвиток плода в розширеній формі (Hata 2013; Hata та ін. 2012a) (Рис. 8.).
Рис. 8. Візуалізація твердого та м’якого піднебіння нормального плода при томографічній ультрасонографії – сканування в другому триместрі вагітності. (I – міжпіднебінний шов; m – верхньощелепний відросток; ph – глотка; р -тверде піднебіння, рр – крилоподібний відросток; pns – задня носова ость; поперечна задня ость; t – язик).
Tonni та ін. (2013) повідомили про високу точність OmniView в реконструкції ретроназального трикутника у 100 плодів низького і 50 – високого ризику в першому триместрі вагітності. Автори повідомили, що оптимальні набори об’ємних даних були отримані в 98% випадків, а ретроназальной трикутник був реконструйований в 96% випадків за допомогою аналізу в автономному режимі. Вторинне піднебіння було успішно оцінено в 93% випадків. Аномалії ретроназального трикутника були виявлені в двох випадках летальної анеуплоїдії в коронарній площині з частотою хибнопозитивних результатів 1,3%.
У таблиці 2 наведені найбільш важливі дані по оцінці розщелини губи і розщелини губи/піднебіння плода при використанні 3-DUS.
Таблиця 2. Автори дослідження, досліджувана популяція, гестаційний вік, пренатальна ультразвукова техніка та клінічні результати в разі виявлення орофасціального розщеплення
| Автори дослідження | Досліджувана популяція | Гестаційний вік (тижні) | Пренатальна ультразвукова техніка | Клінічні результати |
| Campbell та ін. (2005) | 8 плодів з підозрою на розщеплення обличчя | 3-DUS ‘‘reverse face’‘ техніка | Оцінка губи плода і альвеолярного гребеня за допомогою 3-D поверхневого рендерінга у фронтальній площині і ротацією обличчя на 180º по вертикальній осі, для оцінки вторинного піднебіння | |
| Tonni та ін. (2005) | 1856 вагітностей низького ризику | 19–23 | 3-DUS | Фетальний профіль візуалізований у 100%, 87% при первинному огляді з використанням 3-DUOS; виявлено 2 випадки CL/CLP |
| Platt та ін. (2006) | 50 здорових плодів | 33 | 3-DUS ‘‘flipped face’‘ техніка | Оцінка обличчя плода в положенні плода на спині; дослідження статичного 3-D об’єму, 90º обертання; площини дослідження розташовані в порядку від підборіддя до носа; об’ємні проекції потім прокручуються від підборіддя до носа, для оцінки безперервності будови нижньої губи, нижньої щелепи, альвеолярного гребеня, язика, верхньої губи, верхньої щелепи, твердого та м’якого піднебіння; частота візуалізації 100% |
| Pilu и Segata (2007) | 15 здорових плодів, 1 плід з CLP | 19–28
33 |
3-DUS дослідження під кутом | Щоб уникнути акустичного затінення від альвеолярного відростка, вторинне піднебіння досліджується під кутом 45º в сагітальній площині; 3-DUS використовується для реконструкції аксиальної і коронарної
площин |
| Martinez-Ten та ін. (2009) | 50 здорових плодів,
10 плодів з CLP |
20–33 | Техніка косої проекції обличчя в порівнянні з техніками ‘‘reverse face’‘ та ‘‘flipped face’‘ | Спочатку, обличчя відображається в середньосагітальній площині; осьовій площині для включення піднебіння і потім перпендикулярно до цієї поверхні; при цьому профіль відображається в краніально-каудальному напрямку; коронарна площина прокручується і повертається через всю довжину і ширину піднебіння, отриманого в косій проекції обличчя, коректність визначення нормального піднебіння – 86% випадків; розщелини за участю твердого піднебіння – в 100% випадків; розщелини м’якого піднебіння виявлені лише в 14% з 7 випадків, при цьому розщелини вторинного піднебіння, яке було прийнято за нормальне, отримані в 26% з використанням техніки косої проекції обличчя |
| Tonni та Lituania (2012) | – | Другий и третій триместр | ‘‘Omniview’‘ об’ємна реконструкція | Ілюстроване есе, яке відображає клінічне значення переформатування наборів об’ємних 3-DUS даних у випадках орофаціального розщеплення |
3-DUS = 3D ультразвукове дослідження; CL = заяча губа; CLP = розщелина губи і піднебіння
РОЛЬ 3-DUS У ВИВЧЕННІ ЧЕРЕПНИХ ШВІВ ТА ТІМ’ЯЧКА
Незважаючи на величезний прогрес, який був досягнутий в пренатальній діагностиці за допомогою 2-DUS протягом останніх декількох десятиліть, візуалізація швів і тім’ячка залишається складним завданням. Оскільки ідентифікація краніосиностозів може мати важливе значення для пренатального скринінгу в випадках сімейного анамнезу синдрому, пов’язаного з краніосиностозом, правильна пренатальна діагностика має важливе значення. У дослідженні, проведеному Dikkeboom та ін. (2004) 120 плодів в чотирьох різних гестаційних строках вагітності, і поверхневий режим, і максимальний режим виявилися однаково ефективними у виявленні швів і тім’ячка плода протягом всієї вагітності. Найбільш важким було відображення стрілоподібного шва і заднього тім’ячка, в той час як лобовий шов і переднє тім’ячко були найкраще видно при сагітальному скануванні. Заднє тім’ячко часто не визначається ні в одному з режимів сканування. Однак, при включенні 3-DUS при скануванні задньої частини голови, можуть бути візуалізовані чіткіше заднє тім’ячко, лямбдоподібний шов і, можливо, навіть стрілоподібний шов. Крім того, при порівнянні точності 2-DUS і 3-DUS у вивченні черепних швів і тім’ячка на 15-16 тижнях вагітності, Ginath та ін. (2004) стверджують, що 3-DUS, є більш ефективним засобом, ніж 2-DUS для відображення стрілоподібного шва (50 [100%] проти 35 [70%], р≤0,001) (Рис. 9).
Рис. 9. Максимальний режим поверхневого рендерінга у візуалізації черепних швів і тім’ячка у нормального плода при скануванні в першому триместрі вагітності.
3-DUS ТА ФЕТАЛЬНА ЕХОКАРДІОГРАФІЯ
Пренатальне виявлення вроджених вад серця (ВВС), як і раніше, являє собою одне з найскладніших завдань для сонографії під час звичайного сканування в другому або третьому триместрі. Однією з головних труднощів у вивченні серця плоду за допомогою звичайного 2-DUS є візуалізація і інтерпретації шляхів відтоку головних артерій. RADIUS дослідження показало, що лікарі в центрах нижче четвертого рівня були нездатні виявити ВВС в популяції 15 000 жінок з низьким рівнем ризику (Crane та ін. 1994). Проблема може бути описана наступним чином: хоча чотирикамерний вид використовується протягом багатьох років в якості первинного скринінгового зображення для виявлення ВВС, включення правого і лівого шляхів відтоку збільшує частоту виявлення вад розвитку серця від 30% до 80%-90%. Nelson та ін. (1996) і Deng і Rodeck (1996) були одними з перших, хто розробили новий метод стробіювання для 3-DUS і 4-DUS реконструкції для клінічно значущих зображень серця, заснованих на звичайному 2-DUS в реальному часі. При цьому визначалися частота серцевих скорочень плода і певні часові точки серцевого циклу, які потім використовувалися для синхронізації даних зображення для перепроєціювання в об’єм у відповідній фазі серцевого циклу. Ці автори виявили, що перегрупування цих фазованих 3-D зображень в циклічну послідовність дозволяє виявляти динамічні і просторові співвідношення між камерами, міокардом, клапанами і великими судинами. Тривимірне УЗД дозволяє лікарю отримати об’єм даних, яким можна маніпулювати уздовж х- і у-осей з використанням опорних точок з чотирикамерної проекції, п’ятикамерної проекції і трьохсудинної проекції на рівні біфуркації легеневої артерії, а також трьохсудинної проекції на рівні поперечної дуги аорти і трахеї (DeVore та ін. 2004; Yagel та ін. 2001). Це може бути досягнуто за допомогою 3-D багатоплощинної візуалізації серця плоду, статичним 3-D (без руху серця) або методом STIC. STIC є програмним додатком, яке дозволяє отримувати набори даних об’ємів серця і судин плода, при цьому зображення можна переглядати або в багатоплощинному режимі або в режимі рендерінга. STIC пропонує кілька потенційних переваг, в першу чергу, це можливість вивчення анатомії і функції серця протягом одного серцевого циклу і видалення артефактів руху в фетальному серці, що швидко б’ється (Deng і Rodeck 2006; Deng та ін. 2000). Meyer-Wittkopf та ін. (2001) зібрали стробійовані 3-D об’ємні дані для перевірки можливості 3-D ручної техніки в ехокардіографічній оцінці шлуночкової волюмометрії у 29 здорових плодів і 22 плодів з ВВС, і виявили, що як у плодів з ВВС, так і плодів без ВВС, мало місце експоненціальне зростання серцевих об’ємів під час вагітності. Wang та ін. (2002) повідомили, що серед основних кардіологічних проекцій у 23 нормальних плодів в передній позиції, 3-DUS покращувало візуалізацію кровотоку по легеневій артерії, що забезпечувало надійною альтернативною методикою для клінічного застосування в порівнянні з 2-DUS. Крім того, 3-DUS в режимі реального часу є ефективним методом візуалізації динамічних 3-D поверхонь і реконструкції поперечних проекцій, і надає додаткову інформацію, особливо при використанні субкостального/субксіфоідального доступу (Deng та ін., 2000., 2002а).
Просторово-часова кореляція зображень може бути реалізована за допомогою мінімального режиму проектування, алгоритму рендерінга, який дозволяє візуалізувати судини і порожнинні анатомічні структури, які розташовані в різних площинах сканування. Мінімальний режим проектування полегшує візуалізацію нормальних і аномальних судинних анастомозів з серцем плода на рівні трьохсудинної проекції. Ця методика виявилася ефективною в пренатальній діагностиці конотрункальних аномалій і в оцінці просторових відносин аномальних судинних анастомозів в верхньому середостінні (Espinoza та ін. 2004).
Крім того, отримання діагностичних площин за допомогою STIC в меншій мірі залежить від досвіду оператора; при цьому потрібно менше часу для виконання дослідження; аналіз може бути виконаний після того, як пацієнт вже пішов; структури можуть бути оцінені з використанням режиму рендерінга; може бути оцінена як морфологія, так і функціональна складова (Bennasar та ін. 2010a, 2010b; DeVore та ін. 2003; Goncalves та ін.2003; Vinals та ін. 2003). Нарешті, об’ємні зображення можуть бути відправлені через Інтернет в медичні центри, які спеціалізуються на фетальній ехокардіографії (Vinals та ін., 2005) (Рис. 10-12).
Рис. 10. Фетальна ехокардіографія з використанням просторово-часової кореляції зображення (spatiotemporal image correlation – STIC) з HD потоком, який показує Situs Solitus (анатомічне розташування структур), чотирьохкамерна проекція і артеріальний кровотік. ат – аорта; arco – протокова дуга; adx – праве передсердя; asx – ліве передсердя; ivc – нижня порожниста вена; р – легенева артерія; st – шлунок; vdx – правий шлуночок; vp – легенева вена; vsx – лівий шлуночок.
Рис. 11. Фетальна ехокардіографія з використанням просторово-часової кореляції зображення (STIC). Чотирикамерна проекція з легеневими венами, які впадають у ліве передсердя і візуалізуються у верхній панелі. Те ж зображення після пост-обробки за допомогою HDlive. DAо – низхідна аорта; LV – лівий шлуночок; RV – правий шлуночок; VP – легенева вена.
Рис. 12. Фетальна ехокардіографія з використанням STIC (просторово-часової кореляції зображення). Чотирикамерна проекція і великий артеріальний тракт показані за допомогою пост-обробки HDlive. DAо – низхідна аорта; LV – лівий шлуночок; RV – правий шлуночок; VP – легеневі вени.
Об’ємні дані реєструються в 3-D статичному режимі або з використанням чотирьох вимірювань для спостереження за 3-D скороченням серця протягом одного повного серцевого циклу. Діагностична потужність 4-D ехокардіографії випливає не тільки з поліпшених реконструйованих зображень в поперечній проекції 4-D наборів даних, які практично вільні від артефактів руху, але також і з генеруванням 3-D/4-D зображень, що нагадують картину, яку бачать хірурги під час операції (Deng і Rodeck 2004). При реконструкції стандартних чотирьох і п’ятикамерних проекцій, а також трьохсудинної і проекції на рівні трахеї з кольорових даних STIC, Chaoui та ін. (2004) отримали діагностичну точність 88,5% у здорових плодів і – 88,8% плодів з патологією. Проте, спостерігалися і несприятливі вікна/кути візуалізації об’ємів у плодів, досліджуваних після 29 тижнів вагітності. 3-DUS в режимі реального часу мав високу чутливість для виявлення ВВС (93%) і низьку специфічність (45%), з високим рівнем ‘‘невизначених’‘ результатів і хибно-позитивних артефактів між чотирма дослідниками при використанні одного об’єму сканування (Sklansky та ін. 1999, 2005). При використанні відновленого зображення, сонографіст може оцінити внутрішньосерцеву анатомію на різних глибинах і може відтворити зліпки кровотоку через камери і великі судини (Deng та ін. 2002b; DeVore 2005). Кольорова STIC доплерографія дозволяє відображати об’ємні дані досліджуваного серця плоду в якості кінопетлі протягом одного серцевого циклу. Крім того, кольорова STIC доплерографія може спростити візуалізацію кровоносних судин і поліпшити ефективність оцінки місця розташування і ступеня дефекту міжшлуночкової перегородки, а також провести 3-D оцінку регургітаційних і венозних потоків на рівні овального отвору (Goncalves та ін. 2004c). Обмеження цього додатка можуть включати в себе неможливість використання на початку або наприкінці вагітності через низьку дискримінацію сигналів. Крім того, сигнали, що поширюються перпендикулярно досліджуваним структурам, не відображаються в кольоровому доплерівському сигналі, чого слід уникати під час дослідження об’ємів (Chaoui та ін. 2004).
Goncalves та ін. (2004b) були першими, хто продемонстрував можливості 4-D в сірій шкалі і енергетичної STIC доплерографії в рутинній візуалізації аномального розташування кровоносних судин у плодів з транспозицією магістральних артерій, з отриманням об’ємних зображень, які вимагають тільки чіткої візуалізації апікальної чотирикамерної проекції при 2-D ультразвуковому дослідженні від 7,5 до 15 с. Yagel та ін. (2005) підтвердили точність 4-D кольорового доплерівського ультразвукового дослідження з використанням STIC в оцінці дефектів міжшлуночкової перегородки плода. Goncalves та ін. (2005b) встановили клінічну ефективність STIC 4-D даних і схиляються до необхідності проведення відповідної підготовки для дослідження узгодження між двома незалежними дослідниками і відтворюваності методу STIC для відображення стандартних кардіологічних проекцій кровоносних судин лівого і правого шлуночків шляхом аналізу 20 наборів об’ємних даних задовільної якості. Acar та ін. (2005) вивчили 60 плодів в строках від 22 до 34 тижнів гестації з використанням датчика на основі як Biplane, так і Live 3-D візуалізації. У 16 плодів, серце плоду мало морфологічні аномалії (гіпоплазія лівого шлуночка у 4, тетрада Фалло у 2, аномалія Ебштейна у 2, рабдоміома у 2, гіпоплазія правого шлуночка серця у 1) або дисфункції міокарда (5 плодів). 3-D ехокардіографія в режимі реального часу виконувалися серцевим датчиком 2-4 МГц. Acar та ін. (2005) прийшли до висновку, що 3-D ехокардіографія в режимі реального часу є доступним і нетрудомістким методом, що дозволяє провести мультипланарне сканування, що дає нову 3-D картину внутрішньої структури серця плоду. Віртуальні ‘‘зліпки’‘ серця плоду з використанням Live 3-D об’ємних наборів даних, оброблених за допомогою напівавтоматичної програми, дозволили провести чітку візуалізацію послідовних з’єднань і просторових відносин структур в 84% випадків (McDonald та ін. 2005). Крім того, віртуальний ‘‘зліпок’‘ всього серця забезпечує більш простими даними для детальної мультипланарної оцінки, ніж звичайна поверхнева 3-D візуалізація (Deng і Rodeck 2006).
Тим не менш, до цих пір існують обмеження щодо точного кардіального стробіювання при STIC, що обумовлено в основному варіацією частоти серцевих скорочень плода під час отримання об’ємних даних (7-15 с) (Deng та ін. 2003). Насправді, необхідність стробіювання визначається шляхом прямого об’ємного сканування; пряме об’ємне сканування відноситься до будь-якого об’єму сканування, в якому досліджуваний об’єм сканується з достатнім масштабом, об’ємною частотою зображення (тобто часовою роздільною здатністю) і просторовою роздільною здатністю (Deng і Rodeck 2006).
DeVore і Polanko (2005) повідомили, що судинні структури серця плоду (чотирьохкамерна, п’ятикамерна, трьохсудинна проекції і проекція трахеї) можуть бути ідентифіковані з використанням TUI – tomographic ultrasound imaging (томографической ультразвукової візуалізації) у плодів між 13 і 40 тижнями вагітності. Плоди з тетрадою Фало, транспозицією магістральних судин і стенозом легеневої артерії – всі мають ознаки аномальної серцевої анатомії при TUI. TUI це програмний додаток пост-обробки, який дозволяє будь-який отриманий 3-D набір об’ємних даних (отриманий або в сірій шкалі, або під час кольорової доплерографії або STIC) автоматично представити у вигляді зрізів і відобразити у вигляді декількох зображень на екрані (DeVore та ін. 2005; Espinoza та ін. 2006; Goncalves та ін. 2006). За допомогою програми TUI, 3-D об’єм можна розділити на дев’ять зображень, а відстані між зрізами (0,5-10 см) можуть бути обрані відповідно вимог дослідження. Використовуючи 4-D УЗД з STIC технікою, кольорову доплерографію і офлайновий аналіз TUI стандартизованої початкової площини (чотирьохкамерна проекція, починаючи від простого 2-D орієнтира серця), Turan та ін. (2009) реконструював чотирикамерну проекцію; серцеву вісь, розмір і симетрію; шлуночкові клапани; магістральні артерії і низхідну аорту в 89,7%-99,1% випадків в строках від 11 до 13 тижнів вагітності. Чотиривимірна ехокардіографія плода з STIC може бути використана з VOCAL (з 15º-30º кутами повороту) і режимом інверсії для оцінки функції серця плода. За допомогою цієї програми, середній ударний об’єм був визначений в діапазоні від 0,78 см3 в середині вагітності, до 5,5 см3 в строк пологів, у той час як фракція викиду залишалася досить стабільною протягом всієї вагітності (Messing та ін. 2007), а також правий і лівий серцевий ударний об’єм і серцевий викид збільшувалися з гестаційним віком, із середніми значеннями 0,02 мл, 0,01 мл, 2,39 мл/хв і 1,80 мл/хв в строках 12 тижнів; 0,30 мл, 0,32 мл, 43,46 мл/хв і 46,72 мл/хв в строках 20 тижнів; 2,07 мл, 2,67 мл, 284,71 мл/хв, і 365,99 мл/хв в строках 34 тижнів, відповідно (Molina та ін., 2008). При цьому спостерігалося експоненціальне збільшення ударного об’єму і серцевого викиду, в той час як фракція викиду залишалася майже незмінною (Simioni та ін. 2011). Для порівняння 2-DUS і 3-DUS ехокардіографії, Tonni та ін. (2009) оцінювали можливість включення об’ємної 3-D реконструкції серцевої анатомії і доплероангіографії магістральних судин при рутинному скануванні вагітності в другому триместрі в популяції з низьким рівнем ризику. Tonni та ін. (2009) виявили, що візуалізація легеневих вен, венозної протоки і нижньої порожнистої вени значно покращилася за допомогою 3-DUS в порівнянні з 2-DUS. Автори прийшли до висновку, що ехокардіографічне обстеження з використанням 3-DUS може бути включено в стандартний протокол сканування в другому триместрі вагітності. Інший висновок був зроблений Wanitpongpan та ін. (2008), який зазначив, що використання STIC загальним акушером для оцінки фетальних серцевих структур на 17- 21 тижнях вагітності має граничну клінічну ефективність у порівнянні з 2-D скануванням фетальним ехокардіографістом, що передбачає необхідність технічного вдосконалення операторів дослідження для того, щоб розширити використання 3-DUS в програмі скринінгу серця плоду. Xiong та ін. (2012a, 2012b) виявили, що якість зображення 3-D ехокардіограми в режимі реального часу аналогічна зображенням, отриманим за допомогою STIC в сагітальній проекції і перевершує отримані за допомогою STIC в чотирикамерній проекції. При цьому 3-D ехокардіографія в режимі реального часу не має артефактів руху, що має потенціал для збільшення частоти виявлення фетальних дефектів міжшлуночкової перегородки.
Незважаючи на це, STIC і VOCAL можуть бути використані для розрахунку серцевого об’єму. Uittenbogaard та ін. (2010a, 2010b), Herberg та ін. (2011) і Hamill та ін. (2011) повідомили, що візуалізація структур серця плоду і волюмометрії, з використанням STIC і VOCAL, є надійним і точним методом для розрахунку об’ємів 30 мл і більше, як в природних умовах, так і в експерименті. Незважаючи на те, що необхідно дотримуватися обережності в настройках при розрахунку структур серця як для дітей, так і дорослих, Rolo та ін. (2013) повідомили про середню площу трикуспідального і мітрального клапанів в діапазоні від 0,19 до 0,20 см2 в строках 18 тижнів, і від 0,93 до 1,06 см2 в строках 33 тижнів вагітності, відповідно. Крім того, було виявлено, що референсний інтервал для міжшлуночкової перегородки плода корелює з гестаційний віком (r = 0,81), і збільшується з 0,47 см2 при 18 тижневому строку до 2,42 см2 в строках 33 тижнів вагітності відповідно (Nardozza та ін. 2013). Зовсім недавно Araujo Junior та ін. (2014b) повідомили, що 4-D ехокардіографія плода в режимі рендерінга дозволяє візуалізувати віртуальні площини і міжшлуночкову перегородку і кільце атріовентрикулярного клапана.
При застосуванні режиму інверсії або B-потоку при 4-D рендерінгу магістральних артерій серця ми отримуємо ‘‘цифрові зліпки’‘, які відображають просторові співвідношення і зв’язки між великими артеріями і камерами шлуночків. Ці деталі не можуть бути візуалізовані за допомогою звичайного 2-DUS (Goncalves та ін.2005a; Hata та ін.2008.). Крім того, було виявлено, що в режимі B-потоку, екстракардіальні судини, такі як аорта, легенева артерія, артеріальна протока, нижня порожниста вена і венозна протока можуть бути виявлені на реконструйованих зображеннях. Чотиривимірна ехокардіографія в режимі B-потоку і STIC визначає ‘‘цифрові зліпки’‘ кардіальних ділянок магістральних артерій і вен, що впадають в серце, що дозволяє оцінити екстракардіальную гемодинаміку плода в другому і третьому триместрах вагітності (Hongmei та ін. 2012; Zhang та ін.2010). В-потік відображає кровотік в сірій шкалі, і так як це не доплеровській метод, ніякі швидкості не вимірюються. У режимі В-потоку передаються широкосмугові імпульси з цифровим кодуванням, а потім відбиваються від рухомих клітин крові. Відбиті ехо-сигнали декодуються і фільтруються для підвищення чутливості, для того щоб виявити сигнал переміщення, а кров відрізнити від навколишньої тканини. Найкорисніший діагностичний аспект 4-D ехокардіографії в режимі B-потоку є його здатність розрізняти гриниці між циркулюючої кров’ю і стінкою судини з високою точністю (Deane 2000). Volpe та ін. (2010) повідомили, що 4-DUS в режимі B-потоку і STIC полегшує візуалізацію і детальне вивчення анатомічних особливостей дуги аорти, в тому числі візуалізацію судин шиї, таким чином, надаючи додаткову інформацію в порівнянні з 2-DUS.
При виготовленні матричних датчиків, використовується лазер для різання п’єзоелектричного кристала на безліч однакових за розміром квадратних елементів, які утворюють елемент матриці. Ці елементи розташовані на верхівці датчика таким чином, що вони знаходяться в тісному контакті з поверхнею тіла для легкої передачі і прийому ультразвукових імпульсів. Кожен окремий елемент може генерувати ультразвуковий промінь в будь-якому напрямку. Визначаючи відповідним чином ультразвуковий промінь для кожного окремого елемента, можна створити пірамідальної форми об’ємний ультразвуковий промінь з кутом розкриття між 6º і 100º. З недавніх пір став доступним матричний датчик, який дозволяє одночасно візуалізувати об’єкти в двох площинах, орієнтованих в різних напрямках, з однаковим ступенем роздільної здатності. Зображення відображаються на екрані, розділеному на дві частини: початкова площина знаходиться в лівій стороні, в той час як на правій стороні знаходиться одна з альтернативних площин сканування, які оператор може візуалізувати з використанням іншої орієнтації ультразвукового променя в просторі (осьові площини, сагітальні площині або ротація) (Рис. 13а, б.)
Рис. 13. (А) Фетальна ехокардіографія з використанням матричного датчика: стандартна чотирьохкамерна проекція і магістральні артерії візуалізовані за допомогою методики хPLANE. Зверніть увагу, вертикальна лінія перетинає правий шлуночок, тристулковий клапан, міжшлуночкову перегородку, мітральний клапан і лівий шлуночок відповідно. (В) Чотиривимірна сонограмма показує чотирикамерну проекцію.
Live 3-D твердоматрична УЗД технологія забезпечує роздільну здатність в реальному масштабі часу близько 25 Гц (об’єм/с) (Deng і Rodeck 2006; Deng і ін .. 2002а, 2003; Sklansky і ін, 1999). Ехокардіографічні обстеження 151 плодів, в тому числі 4 з підозрою на ВВС, були проведені Xiong та ін. (2009) з використанням матричного датчика за допомогою live xPLANE техніки. Серце плода було визуализировано в чотирикамерній проекції, з розташуванням хребта плода на 6 годинах і верхівкою на 12 годинах. Після того, як опорна лінія на первинній площині зображення (чотирикамерній проекції) переміщається, допоміжна площина зображення, яка перетинає опорну лінію, відображається на правій стороні екрану. За замовчуванням, допоміжна площина обертається на + 90º по відношенню до базової площини. Міжшлуночкова перегородка була успішно візуалізована в 150 (99,3%) випадках з використанням live xPLANE техніки, в тому числі 82 (54,3%) плодів в задній позиції і 68 (45,7%) плодів – в передній. Міжшлуночкова перегородка була візуалізована у всіх плодів з ВВС (Xiong та ін. 2009).
Yuan та ін. (2011) визначили доступність і надійність хPLANE техніки в режимі реального часу для оцінки одночасно чотирикамерної проекції і проекції магістральних судин лівого шлуночка у 145 плодів між 11 і 37 тижнями вагітності, в тому числі 29 плодів з ВВС. Чотирикамерну проекцію оцінювали з трьох позицій: підреберної (верхівка на 3 або 9 годинах), верхівкової (верхівка на 12 або 6 годинах) і проміжної – між підреберною і верхівковою позиціями. При використанні функції обертання з урахуванням чотирикамерної проекції в якості базової площини, проекція магістральних судин лівого шлуночка одночасно відображається на вторинній площині зображення і успішно візуалізується в 95,1% випадків після 14 тижнів вагітності (Yuan та ін. 2011). Xiong та ін. (2013) описав порівняно простий метод візуалізації проток і дуги аорти з використанням live xPlane техніки. Оцінка протокової дуги в виявленні конотрункальних аномалій за допомогою live xPlane була проведена у 200 плодів, з яких 152 були нормальними, 27 мали конотрункальні аномалії і 21 мали ознаки інших ВВС. Аномальний вигляд протокової дуги був отриманий в 92,6% плодів з конотрункальними аномаліями в порівнянні з плодами без ВВС (23,8%).
Крім того, використання 4-D ехокардіографії і телемедицини можуть бути корисні при офф-лайн аналізі наборів об’ємних даних фетального серця за допомогою дистанційної консультації в теоретичних центрах медичної допомоги (Yagel та ін. 2011). Об’ємні об’єкти можуть бути вивчені і проаналізовані з використанням секційних площин в середньому протягом 11,0 хв (діапазон: 2.5-30.0 хв) і з середнім довірчим балом 4.0 (діапазон: 1,0-5,0) між експертами (Adriaanse і ін .2012.).
Зовсім недавно, Yeo і Romero (2013) розробили фетальну інтелектуальну навігаційну ехокардіографію (fetal intelligent navigation echocardiography – FINE) – метод для швидкого, простого і автоматичного обстеження серця плода з використанням діагностичних площин згідно з даними практичного посібника Американського інституту ультразвуку в медицині (AIUM 2011). Після того, як сім анатомічних структур серця плоду будуть розпізнані, система автоматично повертається, поєднує дані, розділяє на площини і визначає масштаб об’ємних даних для одночасного відображення дев’яти серцевих діагностичних площин в одному шаблоні. Однак, складна анатомія серця плоду може потребувати додаткового дослідження даної діагностичної площині, для чого розроблена нова техніка (VIS-Assistance). Це програмне забезпечення дозволяє проводити оператор-незалежне сонографічне наведення і досліджувати навколишні структури в необхідній діагностичній площині серця; воно також забезпечує автоматичне маркування діагностичних площин, частин плода і краніального і каудального кінців. Час, необхідний для спостереження всіх дев’яти VIS-Assistance відеозаписів – 15 хв 27с.
FINE метод був протестований на 51 наборах об’ємних даних нормального серця плода (19.5-39.3 тижнів вагітності) і в 4 випадках доведеного ВВС (коарктація аорти, тетрада Фало, транспозиція магістральних судин і легенева атрезія з неушкодженою міжшлуночковою перегородкою) відповідно. Проте, навіть з огляду на той факт, що FINE метод був в змозі виявити ознаки аномальної анатомії серця у всіх чотирьох випадках з патологією, Yeo і Romero (2013) рекомендують використовувати FINE метод як допоміжний засіб для обстеження плода в популяціях з низьким рівнем ризику, але не для діагностики специфічних ВВС. У таблиці 3 наведені найбільш важливі статті по фетальній ехокардіографії за допомогою 3-DUS/4-DUS.
Таблиця 3. Автори дослідження, досліджувана популяція, гестаційний вік, пренатальна ультразвукова техніка та клінічні результати в разі внутрішньоутробної 3-D/4-D ехокардіографії
| Автори дослідження | Досліджувана популяція | Гестаційний вік (тижні) | Пренатальна ультразвукова техніка | Клінічні результати |
| Chaoui та ін. (2004) | 34 здорових і 27 плодів з вродженою патологією серця | 18–35 |
STIC з кольоровою доплерографією | Чотирикамерний, п’ятикамерний і трьохсудинний вигляд і трахея можуть бути отримані у 31/35 здорових і 24/27 плодів з вродженою патологією серця |
| Messing та ін. (2007) | 100 здорових і 6 плодів з вродженою патологією серця | 20+5–40 | STIC с VOCAL (15º) та режимом інверсії | ЛШКД коливався від середнього значення 0,53 см3 в середині вагітності до середнього значення 3,96 см3 в строк пологів; ЛШКС коливався від середнього значення 0,17 см3 в середині вагітності до 1,56 см3 в строк пологів; ПШКД коливався від середнього значення 0,68 см3 в середині вагітності до середнього значення 5,44 см3 в строк пологів; ПШКС коливався від середнього значення 0,26 см3 в середині вагітності до 2,29 см3 в строк пологів |
| Molina та ін. (2008) | 140 здорових плодів | 12–34 | STIC з VOCAL (30º) | Ударний об’єм лівого і правого шлуночка збільшувався в геометричній прогресії зі строком вагітності, з відповідним середнім значенням 0,02 мл, 0,01 мл, 2,39 мл/хв і 1,80 мл/хв при 12 тижневому строці, до 0,30 мл, 0,32 мл , 43,46 мл/хв і 46,72 мл/хв при 20 тижневому строці і 2,07 мл, 2,67 мл, 284.71 мл/хв і 365,99 мл/хв в 34 тижні |
| Turan S та ін. (2009) | 107 вагітностей з низьким рівнем ризику | 11–13+6 |
(1) Чотирикамерний вид;
(2) STIC з кольоровою доплерографією; (3) TUI; (4) фетальна анатомія серця |
Мінімум три 3-D об’єма одержані для кожного пацієнта, трансабдомінально в 91,6%; артефакти руху плода вимагають отримання більш трьох об’ємів в 20%; середній час для TUI офф-лайн аналізу було 100 с (діапазон: 60-240 с); індивідуальні анатомічні особливості ідентифікувалися в 89,7%-99,1%; візуалізація всіх структур в одній площині спостерігалася у 91 пацієнтів (85%) |
| Simioni та ін. (2011) | 265 здорових плодів | 20–34+6 |
STIC з VOCAL (30º) | Ударний об’єм лівого і правого шлуночка та серцевий викид експоненціально збільшувалися з строком вагітності і фракція викиду залишалася досить стабільною протягом вагітності; середнє значення ударного об’єму лівого і правого шлуночка збільшилася з 0,211 і 0,220 мл в 20 тижнів, до 1,925 і 2,043 мл, відповідно, в 34 тижні; середнє значення серцевого викиду лівого і правого шлуночка збільшувалася з 30,25 і 31,52 мл/хв в строках 20 тижнів, до 268.49 і 287.80 мл/хв, відповідно, в 34 тижні; фракція викиду як лівого, так і правого шлуночка лишалася незмінною на рівні близько 0,63 зі збільшенням гестаційного віку |
| Espinoza та ін. (2010) | 90 здорових плодів і з вродженою патологією серця | 18–26 | Дані 7 центрів в оцінці серцево-судинної патології з використанням STIC | В цілому, середня (діапазон) чутливість, специфічність, позитивні і негативні прогностичні значення і хибно-позитивні і негативні частоти для ідентифікації плодів з серцево-судинною патологією були 93% (77% -100%), 96% (84% -100% ), 96% (83% -100%), 93% (79% – 100%), 4,8% (2,7% -25%) і 6,8% (5% -22%), відповідно. Найбільш частою патологією були конотрункальні аномалії (36%); відмінна міжцентрова кореляція (к = 0.97) |
| Yeo та ін. (2011b) | 50 здорових плодів | 15+3–40 | Чотирикамерний вигляд і ”swing technique” (FAST)) ехографія для візуалізації стандартних діагностичних площин при фетальній ехокардіографії з набору даних об’ємів, отримані при STIC і оброблені за OmniView | Протокова дуга, легенева артерія, три судини і трахея і п’ятикамерна площина, проекція довгої осі аорти і чотирьохкамерна картина були отримані в 100% випадків (за винятком трьохсудинної картини і трахеї, яка була відзначена в 98%); ” Swing technique ” була здатна генерувати трьохсудинну проекцію і трахею, п’ятикамерні картини і/або проекцію довгої осі аорти, чотирикамерний вигляд і шлунок в 100% звичайних випадків |
| Yeo та ін. (2011a) | 50 здорових плодів | 15+3–40+4 | Техніка STAR: Три лінії перетину через чотири камери серця, містять STIC набори даних об’ємів, встановлених для відображення серцевого кровотоку.
1 лінія: шлуночкова перегородка навпроти обох великих судин (легеневої артерії спереду від аорти) 2 лінія: легенева артерія з продовженням в поздовжню проекцію протокової дуги 3 лінія: довга вісь аорти, яка виходить з лівого шлуночка |
Техніка STAR була здатна генерувати площини, у всіх 50 звичайних випадках; у випадках патології, STAR методика дозволяє ідентифікувати дефект міжшлуночкової перегородки, аномалії великих судин і відображати картини, які відхиляються від того, що очікується від обстеження при нормальному серці |
| Rolo та ін. (2013) | 328 здорових плодів | 18–33+6 | STIC у режимі рендерінгу | Середні площі трикуспідального і мітрального клапанів варіювали від 0,19 ± 0,08 і 0,20 ± 0,10 см2 в 18 тижнів гестації, до 0.93 ± 0.31 і 1.06 ± 0.39 см2 в 33 тижні, відповідно |
| Nardozza та ін. (2013) | 328 здорових плодів | 18–33+6 | STIC у режимі рендерінгу | Площа міжшлуночкової перегородки показала кореляцію з гестаційним віком (r = 0,81); збільшення середнього значення від 0,47 ± 0,10 см2 в 18 тижнів, до 2,42 ± 1,13 см2 в 33 тижні вагітності |
ЛШКД (ПШКД) = лівий (правий) шлуночок на кінець діастоли; ЛШКС (ПШКС) = лівий (правий) шлуночок на кінець систоли; STIC = просторово-часова кореляція зображення; STAR = простий прицільний артеріальний рендерінг; TUI = томографічне ультразвукове дослідження, VOCAL = комп’ютеризований аналіз віртуального органу.
3-DUS В ОЦІНКИ ОБ’ЄМУ ОРГАНІВ ПЛОДА І ВАГИ ПРИ НАРОДЖЕННІ
Оцінка органів плода була одним з перших свідчень застосування 3-DUS в акушерстві. Цей додаток був вперше описаний в середині 1995 року в статті, опублікованій групою на кафедрі акушерства та гінекології національного університету медицини Ченг Кунга, Тайнань, Тайвань (Chang та ін. 1997a, 1997c). Оскільки органи плода мають неправильну форму, використання формули для еліпсоїда (довжина * ширина * висота * 0,523) – єдино можливий варіант для 2-DUS, що призводить до значних помилок при розрахунку 3-D об’ємів таких органів. Формула для еліпсоїда (довжина * ширина * висота * 0,523), традиційно використовується при звичайному УЗД в акушерстві та гінекології для оцінки об’ємів декількох структур, таких як матка і яєчники (які є структурами правильної форми) (Leonhardt та ін. 2014 року). Однак, у випадках коли повинен бути розрахований об’єм неправильної структури, точність 2-DUS нижче, ніж у 3-DUS, згідно з даними лабораторних досліджень (Riccabona та ін. 1996). При дослідженні в природних умовах, Araujo Junior та ін. (2007b) провели оцінку об’єму фетальних легень у 51 нормального плода в строках від 20 до 35 тижнів вагітності шляхом порівняння 3-D (VOCAL) і 2-D (еліпсоїд: довжина * ширина * висота * 0,523) методів. Ці автори спостерігали, що розрахунок з використанням 2-DUS завищує об’єми легень у порівнянні з розрахунковими даними за допомогою 3-D VOCAL техніки. Включення нового постійного значення для 2-D методики розрахунку об’єму (об’єм правої фетальної легені: довжина * ширина * висота * 0,152, об’єм лівої фетальної легені: довжина * ширина * висота * 0.167) призвело до суттєвого множинного погодженням між 2-D і 3 D методиками розрахунку об’єму (Araujo Junior та ін.2008.). Незважаючи на це, основною метою цих досліджень було визначити нову константу для включення в 2-D ультразвукову формулу для підвищення її точності, так як 3 DUS був дорогим і обмеженим методом в той час (Chang та ін., 1997a, 1997c). У цих піонерських дослідженнях, автори використовували мультипланарний режим, який був першим методом, розробленим для оцінки об’ємів органів плода. Мультипланарний режим дозволяє оцінити об’єм цієї структури, заснований на трьох ортогональних площинах (осьовій, коронарній і сагітальній), які представляють собою 3-D зображення. Після вибору площини, зовнішня поверхня структури окреслюється і визначається її площа, одночасно курсор переміщається в іншій площині для нового обчислення площі. Інтервал між зрізами вибирається оператором і, як правило, знаходиться в діапазоні від 1,0 до 3,0 мм. Після того, як вимірювання проведені, програма обчислює області і видає об’єм автоматично. У порівнянні з мультипланарним режимом, VOCAl дозволяє проаналізувати структури шляхом обертання навколо заданої осі, при цьому послідовні площини відображаються на екрані. Межі структури поділяються курсором, при цьому структури відмежовуються по їх зовнішній поверхні за допомогою ручного або сферичного режимів. Кут повороту вибирається оператором і може бути 6º, 9º, 15º або 30º (ультразвукове обладнання GE) або 12º, 18º або 30º (ультразвукове обладнання Samsung). Якщо обраний кут повороту 6º, буде визначено 30 послідовних площин, в той час як, якщо обраний кут повороту 30º, буде визначено лише 6 послідовних площин. Після того як процес ротації закінчується, програма автоматично обчислює об’єм з 3-D візуалізацією структури, що відображається на екрані. Мультипланарний і/або VOCAl режими були використані для оцінки різних ембріональних структур, таких як: легені (Kalache та ін. 2003), плацента (Nowak та ін. 2008), плодові оболонки (Nardozza та ін. 2010b) і мозочок (Rutten і ін . 2009). Основні переваги VOCAL над мультипланарною технікою є: більш короткий час, необхідний для виконання процедури (Ruano та ін. 2006b), необхідність в незначній корекції площі зовнішньої поверхні в кінці процесу розрахунку об’єму (Peralta та ін. 2006). Chang та ін. (2002c) було необхідно від 10 до 15 хв для того, щоб обчислити об’єм руки плода, використовуючи мультипланарний режим з інтервалом 3,0 мм між зрізами. Основною перевагою мультипланарного методу є можливість його застосування у всіх типах 3-DUS обладнання з моменту випуску першого покоління (COMBISON 530, Kretztechnik, Ципфом, Австрія) (Chang та ін., 1997b).
VOCAL методика була використана для оцінки об’єму плода в першому триместрі вагітності (Araujo Junior та ін.2008; Barra та ін.2013; Martins 2008; Martins та ін.2009.), а також для розрахунку об’ємів різних органів плода, таких як: мозочок, мозок, легені, серце, надниркові залози і нирки (Araujo Junior та ін.2007a, 2007b, 2007c, 2008, Chang та ін.2002a, 2003c; Roelfsema та ін. 2004; Werneck Britto та ін. 2009). Зовсім недавно був представлений новий метод для оцінки об’ємів органів плода в 3 DUS обладнанні виробництва Samsung (Сеул, Корея), а саме, комп’ютерний аналіз віртуального органу (XI VOCAl). Цей метод полягає в розмежуванні від 5 до 20 послідовних площинних зон на екрані (багатозрізова картина). Коли оператор розмежовує останню зону, система автоматично обчислює об’єм і перебудовує структуру (Guimaraes Filho та ін., 2007а). XI VOCAl був застосований для оцінки не тільки об’єму серця плоду (Barreto та ін.2012.), але і для плодових оболонок, жовточного мішка, ембріона і плаценти (Araujo Junior та ін.2010; Cheong та ін.2010; Nardozza та ін. 2010b; Araujo Junior і ін, 2011c). При цьому була встановлена хороша відтворюваність в лабораторних умовах (Barreto та ін.2010) (Рис. 14).
Рис. 14. Енергетична доплерографія плаценти з використанням методу ‘‘судинної біопсії’‘. Відмітки розташовані на рівні базальної і хоріонічної пластинок плаценти. Програма автоматично розраховує значення судинних індексів.
Тривимірне УЗД вважається більш точним, ніж 2-DUS при розрахунку об’єму легень (Riccabona та ін., 1996). Це має велике значення в пренатальній діагностиці легеневої гіпоплазії, стану, пов’язаного з високими показниками захворюваності та смертності новонароджених. Легенева гіпоплазія має частоту від 11 до 14 випадків на 10000 народжених живими в загальній популяції (Laudy і Wladimiroff 2000) і характеризується скороченням числа легеневих клітин, бронхіального дерева і альвеол, з подальшим зменшенням розмірів і ваги легень (Lauria і ін. 1995).
Фетальна волюметрія легень була проведена за допомогою як мультипланарного, так і VOCAL методів, в нормальних умовах і умовах високого ризику розвитку легеневої гіпоплазії (Gerards та ін. 2006; Ruano і ін. 2006b), незважаючи на те, що VOCAl має деяку перевагу в порівнянні з мультипланарним методом. Вона полягає в здатності включати невеликі порції легень, розташовані нижче купола діафрагми і можливості зміни контуру уздовж кожної площини (Peralta та ін. 2006). Крім того, VOCAl метод був більш точний, ніж мультипланарна техніка при розрахунку об’єму легень у плодів з вродженою діафрагмальною грижею (Ruano та ін. 2006b). При використанні VOCAl з 30º обертанням, Peralta та ін. (2006), а потім Werneck Britto та ін. (2009) виявили, що середній об’єм легенів плода збільшується з гестаційним віком від 0,6 до 4.6-6.3 мл в 12 тижнів, до 20.5-30 мл на 32 тижні, і від 9-12.5 см3 при 24 тижневому віці, до 22-31.8 см3 при 32 тижнях вагітності. Крім того, Ruano та ін. (2009) повідомили про те, що співвідношення спостерігаємого/очікуваного загального об’єму легень плоду, при вимірюванні за допомогою 3-DUS, було найточнішим предиктором легеневої гіпоплазії і легеневої гіпертензії і, таким чином, перинатальної смертності.
Ембріональні вади розвитку нирок часто виявляються при ультразвукових дослідженнях під час рутинного пренатального сканування, при цьому оцінка об’єму нирок плода також може допомогти в прогнозуванні порушення функції нирок і сприяти поліпшенню допологового ведення і/або післяпологового лікування. Yu та ін. (2000) оцінювали об’єм нирки плода з використанням мультипланарного методу при 152 нормальних вагітностях в строках від 20 до 40 тижнів гестації. Середній об’єм нирки плода коливався від 1.49-1.8 мл в 20 тижнів, до 1.63- 1,8 мл в 40 тижнів. При розрахунку об’єму нирок плода з використанням VOCAL з 30º кутом повороту, Tedesco та ін. (2009) визначили, що середній об’єм коливався від 4,5 см3 в 24 тижні, до 12,1 см3 на 34 тижні, причому без будь-яких статистично значущих відмінностей між двома нирками.
Ті ж результати (від 4,0 см3 в 20 тижнів, до 44,9 см3 в 40 тижнів) були повідомлені Yoshizaki та ін. (2013). Chang та ін. (2003) спостерігали той факт, що об’єм печінки плода при оцінці за даними 2-DUS (краніокаудальний * переднезадній і латеролатеральний * 0,42) був значно менше, ніж об’єм, визначений за допомогою 3-DUS (мультипланарний метод) . Крім того, вимірювання об’єму печінки плода, отримані за допомогою 3-DUS, були більш відтворюваними, ніж отримані з допомогою 2-DUS. За допомогою поліноміальної регресії була визначена нова константа – 0,55, таким чином, об’єм печінки плода, отриманий за допомогою 2-DUS, аналогічний отриманому за допомогою 3-DUS. Константа 0,42 визначалася Gimondo і співавт. (1995) у 327 плодів в строках від 20 до 40 тижнів вагітності з використанням 2-DUS.
Boito та ін. (2003) оцінювали об’єм печінки плода за допомогою мультипланарного методу і його відношення до пупочного венозного кровотоку і рівню материнського глікозильованого гемоглобіну (HbA1c), при вагітності, ускладненій цукровим діабетом I типу. Дані по 32 плодам матерів з цукровим діабетом були зіставлені з даними в контрольній групі. Boito та ін. (2003) спостерігали статистично значущу відмінність в об’ємі фетальної печінки між плодами матерів з цукровим діабетом і контрольної групи (в середньому: 45,9 мл проти 38,3 мл, відповідно). Dos Santos Rizzi та ін. (2010) визначили діапазон нормальних величин для об’єму фетальної печінки, використовуючи 3-DUS з новим мультипланарним методом. Ці автори завершили поздовжнє дослідження, яке включало 250 вимірювань об’єму печінки плода, зроблені під час 53 нормальних вагітностей в строках від 27 до 38 тижнів. Середній об’єм печінки плода коливався від 43,5 см3 в 27 тижнів, до 130,5 см3 в 38 тижнів. Дана нова мультипланарна методика мала хорошу внутрішньо- і міждослідницьку надійність.
Аномалії розвитку плода є однією з основних проблем громадської охорони здоров’я в усьому світі, яка має суттєвий вплив як на промислово розвинені країни, так і країни, що розвиваються. У 2004 році Всесвітня організація охорони здоров’я (ВООЗ) оцінила, що з 130 мільйонів дітей, народжених за рік, близько 20 мільйонів мають недостатню вагу. З 4 мільйонів смертей новонароджених, які відбуваються щороку, 60%-80% мають низьку вагу тіла при народженні; ці діти частіше вмирають, мають перинатальну травму, мають ознаки поганого неонатального розвитку, розвитку інфекції і ознаки когнітивного дефіциту (Lawn та ін. 2005). Двомірна ультрасонографія використовується для оцінки ваги плоду у мільйонів вагітних жінок щороку. На відміну від маси тіла при народженні, яка вимірюється прямим шляхом, розрахунок маси плода є неточним, оскільки цей вимір залежить від майстерності оператора в отриманні двох або більше вимірювань плода, які потім використовуються для розрахунку ваги. Цей процес може займати багато часу і коштів в акушерській практиці. Один систематичний огляд 11 різних методів оцінки ваги плоду прийшов до висновку, що великі випадкові помилки є важливою перешкодою для впевненого використання оцінки ваги плоду в клінічній практиці, так як 95% довірчий інтервал перевищує 14% фактичної ваги при народженні в опублікованих дослідженнях (Dudley 2005) .
Альтернативним підходом для кількісної оцінки м’яких тканин (жирової і м’язової тканини) може бути оцінка об’єму кінцівки плоду, з використанням 3-DUS (Khoury та ін. 2009). В кінці 1990-х років, Chang та ін. (1997b) оцінювали точність оцінки об’єму стегна плода за допомогою 3-DUS при використанні мультипланарного методу для прогнозування маси плоду при народженні у 100 тайванських жінок з одноплідною вагітністю, для яких пологи повинні були пройти протягом найближчих 48 годин. Ці автори виявили, що формула, заснована на розрахунку об’єму стегна плода, була ефективнішою 2-DUS формули в прогнозуванні ваги при народженні. Однак, мультипланарний режим забирає багато часу (10-15 хв) і має акустичні тіні поблизу суглобів по краях кінцівок, що ускладнює практичне використання цього методу в повсякденній акушерській практиці. Chang та ін. (2002c) також вперше описав референсний діапазон для об’єму кінцівки плода за допомогою 3-DUS в перехресному дослідженні 206 тайванських жінок з одноплідною вагітністю в строках від 20 до 40 тижнів. Фетальний об’єм верхньої кінцівки вимірювали за допомогою мультипланарного методу (3,0 мм інтервал між площинами), при цьому був отриманий середній об’єм від 6,31 мл на 20 тижні, до 74,63 мл на 40 тижні. Використовуючи цей метод, Chang та ін. (2003b) повідомив, що середній об’єм стегна плода коливався від 8.99 мл в 20 тижнів, до 128.89 мл в 40 тижнів. Точна оцінка маси плода при народженні грає ключову роль в плануванні оптимальної акушерсько-перинатальної допомоги при роботі з недоношеними, затримкою внутрішньоутробного розвитку і/або прискореним ростом плода. Song та ін. (2000) розробив модифікований мультипланарний підхід, заснований на використанні трьох стандартних площин (поздовжня через середню точку стегнової кістки і через дві інші точки на відстані 4 мм від його проксимального і дистального кінців). Автори виявили, що при цьому методі витрачалося менше часу (2 хв) і він перевершував 2-DUS в прогнозуванні маси тіла плода при народженні. Lee та ін. (2001) запропонував термін фракційний об’єм кінцівки, який визначається як 50% від об’єму центральної частини кінцівки, плеча і/або стегна, яка містить найбільшу кількість м’яких тканин. Автори також оцінювали точність цієї нової моделі в прогнозуванні ваги при народженні у 100 одноплідних вагітностей з передбачуваним строком пологів в межах 4 днів. Lee та ін. (2001) повідомили, що формула, заснована на окружності живота і фракційного об’єму стегна була точнішою (в межах 5% від фактичної ваги) в прогнозуванні ваги при народженні, ніж підхід, запропонований Hadlock та ін. (1985).
Schild та ін. (2008) використовували як 2-DUS, так і 3-DUS вимірювання для прогнозування маси тіла при народженні плода вагою ≤ 1600 г у випадках 150 одноплідних вагітностей з передбачуваним строком пологів в межах 7 днів. Органами, які піддавалися 3-DUS оцінці і вимірювалися в мультіпланарному режимі, були стегно і живіт. Модель, заснована на біпарієтальному діаметрі, окружності голови, окружності живота, довжині стегнової кістки і об’ємі стегна і живота, виявилася кращою методики, заснованої виключно на 2-DUS вимірах біпарієтального діаметра, окружності голови, окружності живота та довжини стегнової кістки, як описано раніше (Campbell та Wilkin 1975; Salomon та ін. 2011). 3-DUS вимірювання проводилися таким же чином, як і вимірювання 2 DUS, але коригування по ортогональних осях проводилося відповідно до Lima та ін. (2012).
Nardozza та ін. (2010c) не вдалося виявити статистично значущі відмінності між 2 DUS і 3-DUS розрахунками з використанням трьох різних моделей, заснованих на 3-D об’ємі стегна плода, 3-D об’ємі плеча або і того і іншого, після вивчення 81 бразильських одноплідних вагітностей з передбачуваним строком пологів в межах 48 годин. Проте, при одночасному 2 DUS і 3-DUS проведенні вимірювань, була отримана точніша вага плода при народженні, в порівнянні з вимірами тільки за допомогою 2-DUS ультразвукової методики (Nardozza та ін. 2010a). Крім того, Beninni та ін. (2010) повідомили, що VOCAl з 30º кутом повороту і мультипланарний режим з 3,0-мм інтервалами зрізів мають високу ефективність при оцінці маси плода при народженні, а обидві формули, згенеровані на основі цих методів, можуть бути використані як взаємозамінні.
При використанні 2-DUS для стандартної біометрії плода і 3-DUS для фракційного об’єму стегна, Yang та ін. (2011) прогнозували 69,5% і 95,3% від ваги при народженні в межах 5% і 10% від фактичної ваги при народженні, відповідно. Lee та ін. (2009b) повідомили, що середній фракційний об’єм плеча варіював від 1,9 мл в строках 18 тижнів, до 48,8 мл на 42 тижні, в той час як середній фракційний об’єм стегна коливався від 3,4 мл на 18 тижні, до 115,8 мл на 42 тижні вагітності. Таким же чином, Yang та ін. (2011) прогнозували 69,5% і 95,3% від ваги при народженні в межах 5% і 10% від фактичної ваги при народженні, відповідно.
Використовуючи недавно розроблену методику, засновану на XI VOCAL, Cavalcante та ін. (2011) виявили, що об’єм плеча плода в бразильській популяції коливався від 4,59 см3 в 20 тижнів, до 53,87 см3 в 40 тижнів. У клінічній серії 425 здорових вагітностей, Araujo Junior та ін. (2011а) визначили діапазон еталонних значень для об’єму стегна плода (від 8,0 см3 в 20 тижнів, до 122,1 см3 в 40 тижнів).
Nardozza та ін. (2012) порівняли мультипланарну (5,0-мм інтервал зрізів) і XI VOCAl (5º, 10º, 15º і 20º кут ротації) методики в оцінці об’ємів кінцівок плода у 40 нормальних плодів в строках від 20 до 40 тижнів вагітності, але не виявили будь-яких статистично значущих відмінностей.
У таблицях 4 і 5 узагальнені найбільш важливі статті, що стосуються оцінки внутрішньоутробного об’єму органів і оцінки маси тіла плода при народженні, при використанні 3-DUS.
Таблиця 4. Автори дослідження, досліджувана популяція, гестаційний вік, пренатальна ультразвукова техніка та клінічні результати в разі визначення об’ємів органів плода при 3-DUS
| Автори дослідження | Досліджувана популяція | Гестаційний вік (тижні) | Пренатальна ультразвукова техніка | Клінічні результати |
| Chang та ін. (1997c) | 50 здорових плодів | 20–30 | Фетальний об’єм серця з використанням мультипланарного методу з 1,0-мм інтервалом | Фетальний об’єм серця був вище при 2-DUS, ніж при 3-DUS; отримана нова константа (0,45) для включення в 2-D еліпсоїдну формулу |
| Chang та ін. (1997c) | 55 здорових плодів | 20–31 | Фетальний об’єм печінки з використанням мультипланарного методу з 2,0-мм інтервалом | Фетальний об’єм печінки був менше при 2-DUS, ніж при 3-DUS; отримана нова константа (0,55), для включення в 2-D еліпсоїдну формулу |
| Yu та ін. (2000) | 152 здорових плодів | 20–40 | Фетальний об’єм нирок з використанням мультипланарного методу з 1,0-мм інтервалом | Середній фетальний об’єм правих нирок варіювався від 1,49 мл при 20 тижневому строку до 1,63 мл на 40 тижневому строку; середній фетальний об’єм лівих нирок варіювався від 1,8 при 20 тижневому строку до 17,1 мл при 40 тижневому строку |
| Peralta та ін. (2006) | 650 здорових плодів | 12–30 | Фетальний об’єм серця і легенів з використанням методу VOCAL з 30º | Середнє ліве і праве фетальні легеневі об’єми збільшувалися з гестаційним віком з 0,6 і 0,6 мл на 12 тижні до 4,6 і 6,3 мл на 20 тижні, 20,5 і 30,0 мл на 32 тижні; об’єм серця плоду збільшувався з гестаційним віком, із середніми значеннями 3,09 мл в 20 тижнів, 9,18 мл в 26 тижнів і 24,89 мл в 34 тижні |
| Araujo J unior та ін. (2007a) | 52 здорових плодів | 20–32 | Фетальний об’єм мозочка з використанням методу VOCAL з 30º | Рівняння для об’єму мозочка плода визначено Chang та ін. (2000) в тайванській популяції не може бути застосоване до іншої популяції |
| Werneck Brito та ін. (2009) | 61 здорових плодів | 24–32 | Фетальний об’єм легенів з використанням методу VOCAL з 30º | Середній об’єм правої легені плоду коливався від 12,5 см3 при 24 тижневому строку до 31,8 см3 при 32 тижневій вагітності; об’єм лівої легені плоду коливався від 9,2 см3 при 24 тижневому строку до 22,0 см3 при 32 тижнях вагітності |
| Tedesco та ін. (2009) | 57 здорових плодів | 24–34 | Фетальний об’єм нирок з використанням методу VOCAL з 30º | Середнє значення об’єму правої нирки плода коливається від 4,5 см3 при 24 тижневому строку до 12,1 см3 на 34 тижнях вагітності; не було суттєвої різниці між обома об’ємами нирок плода. |
| Barreto та ін. (2012) | 303 здорових плодів | 20–34 | Фетальний об’єм серця з використанням методу XI VOCAL в 10 площинах | Фетальний об’єм серця збільшується з гестаційним віком, із середніми значеннями 3,09 мл при 20 тижневому строку, 9,18 мл при 26 тижневому строку і 24,89 мл при 34 тижневому строку |
| Yoshisaki та ін. (2013) | 213 здорових плодів | 20–40 | Фетальний об’єм нирок з використанням методу VOCAL з 30º | Середній об’єм правої нирки плода коливається від 4,0 см3 при 20 тижневому строку, до 44,9 см3 при 40 тижневому; середній об’єм лівої нирки плода коливається від 4,2 см3 при 20 тижневому строку, до 44,3 см3 при 40 тижневому |
2-DUS (3-DUS) = 2-D (3-D), ультразвукове дослідження; VOCAL = комп’ютеризований аналіз віртуального органу; XI VOCAL = розширений комп’ютеризований аналіз віртуального органу.
Таблиця 5. Автори дослідження, досліджувана популяція, гестаційний вік, пренатальна ультразвукова техніка та клінічні результати в разі визначення об’ємів кінцівок плода при 3-DUS
| Автори дослідження | Досліджувана популяція | Гестаційний вік (тижні) | Пренатальна ультразвукова техніка | Клінічні результати |
| Liang та ін.(1997) | 105 одноплідних тайванських вагітностей | 48 годин до пологів | Фетальний об’єм верхньої частини руки з використанням мультипланарного методу з 3,0-мм інтервалом | Визначено нову формулу з використанням фетального об’єму верхньої частини руки, яка краща, ніж 2-DUS формула в прогнозуванні ваги при народженні |
| Chang та ін. (1997b |
100 одноплідних тайванських
вагітностей |
48 годин до пологів | Фетальний об’єм стегна з використанням мультипланарного методу з 3,0-мм інтервалом | Визначено нову формулу з використанням фетального об’єму стегна, яка краща, ніж 2-DUS формула в прогнозуванні ваги при народженні |
| Song та ін. (2000) |
84 одноплідних вагітностей в Кореї | 48 годин до пологів | Фетальний об’єм стегна з використанням модифікованого мультипланарного методу з 4,0-мм інтервалом | Формула фетального об’єму стегна з використанням модифікованого мультипланарного методу, краща, ніж 2-DUS формула в прогнозуванні ваги при народженні і займає менше часу (2 хв) |
| Lee та ін. (2001) |
100 одноплідних Американських вагітностей | 4 доби до пологів | Фетальний фракційний об’єм стегна (50% від об’єму центральної частині кінцівки, в якому міститься найбільша кількість м’яких тканин) | Кращий прогноз ваги при народженні, отриманий за допомогою формули, пов’язаної з окружністю черевної порожнини і фракційного об’єму стегна; Ця нова модель була зрівняна з формулою Hadlock і співавт. (1985) у 30 плодів і прогнозувала вагу при народженні більш точно, ніж формула Hadlock і співавт. 20/30 плодів в межах 5% від реальної ваги |
| Nardozza та ін. (2010c) |
81 одноплідних вагітностей в Бразилії | 48 годин до пологів | Фетальні об’єми стегна і верхньої частини руки з використанням мультипланарного методу з 5,0-мм інтервалом | Формула фетального об’єму стегна, верхньої частини руки плода і обох кінцівок не відрізнялися від 2-DUS формули |
| Araujo J unior та ін. (2011a) |
425 здорових плодів | 20-40 | Фетальний об’єм стегна з використанням XI VOCAL методу в 10 площинах | Середній об’єм стегна плода коливався від 8,0 см3 при 20 тижневому строку до 122,1 см3 при 40 тижневому строку |
| Cavalcante та ін. (2011) | 425 здорових плодів | 20-40 | Фетальний об’єм верхньої частини руки з використанням XI VOCAL методу в 10 площинах | Середній об’єм верхньої частини руки плода коливався від 4,59 см3 при 20 тижневому строку до 53,87 см3 при 40 тижневому строку |
| Lee та ін. (2009b) |
303 здорових плода | 18-42 | Фетальні фракційні об’єми стегна і верхньої частини руки (50% від об’єму центральної частини кінцівки, в якому міститься найбільша кількість м’яких тканин) | Середній фракційний об’єм верхньої частини руки плода коливався від 41,9 см3 на 18 тижневому строку до 48,8 мл на 42 тижневому строку; середній фракційний об’єм стегна плода складав від 3,4 см3 на 18 тижневому строку до 115,8 см3 на 42 тижневому строку |
| Lee та ін. (2009a) | 87 одноплідних вагітностей в Америці | 4 доби до пологів | Фетальний фракційний об’єм стегна і верхньої частини руки (50% від об’єму центральної частини кінцівки, в якому міститься найбільша кількість м’яких тканин) | Фетальний фракційний об’єм стегна мав найбільшу кореляцію з пренатальним показником процентного вмісту жирової тканини в організмі серед усіх однопараметричних моделей, і цей параметр в поодинці пояснює 46,1% варіабельність процентного вмісту жирової тканини в організмі |
2-D = 2-D ультразвукове дослідження; XI VOCAL = розширений комп’ютеризований аналіз віртуального органу.
ТРИВИМІРНА ЕНЕРГЕТИЧНА ДОПЛЕРОГРАФІЯ
З тих пір, як ця методика була вперше описана більш ніж десять років тому, кількісний 3-D-PD (Power Doppler) викликав великий інтерес серед дослідників (Pairleitner та ін. 1999) з-за свого потенціалу для оцінки кровотоку/кровопостачання цілого органу або тканини (Martins та ін. 2010), з огляду на неінвазивність, відносну простоту, легку переносимість техніки, і яка виключає використання контрасту і експозицію радіації (Miyague та ін. 2013a). При 3-D-PD дослідженні кількість червоних вокселей та їх інтенсивність пов’язані з числом рухомих клітин. Таким чином, пропонований кількісний метод може бути використаний як інструмент для оцінки перфузії. Кількісна оцінка 3-D-PD сигналів в певній досліджуваній області здійснюється за допомогою трьох індексів: індекс васкуляризації (VI) – співвідношення кольорових вокселей до всіх вокселів в заданому об’ємі, індекс текучості (FI) – середня інтенсивність забарвлення всіх червоних вокселей у вже згадуваному об’ємі і індекс васкуляризації потоку (VFI) – комбінація з двох індексів, яка обчислюється як (VI * FI)/100. Крім теоретичного потенціалу, була виявлена кореляція між цими показниками і істинною перфузією, як в лабораторних, так і природних умовах (Jones та ін.2009, 2010; Morel. та ін. 2010 року; Raine-Fenning 2008а та ін.). Незважаючи на великий науковий інтерес до цих показників, про що свідчать понад 200 статей, опублікованих в області акушерства та гінекології (Alcazar 2008; Martins 2010; Martins і Raine-Fenning 2010; Martins та ін.2007, 2010.), їх використання в цілому не прийнято в клінічній практиці через серйозні обмеженя (Martins та ін.2011; Nтаi та ін.2014; Nastri та ін.2013.). Найбільш важливими з цих обмежень є їх сильна залежність від ослаблення (Miyague та ін. 2014), налаштування машини (Martins та ін. 2010; Raine-Fenning та ін. 2008b) і об’єму вибірки (Kudla та Alcazar 2010). Через ці обмеження, потрібна повна стандартизація методу, чого майже неможливо досягти через велику кільксть параметрів, що вимагають безпомилкового коригування. Більш того, ці показники сильно залежать від ослаблення (Jones та ін.2009; Miyague та ін.2014; Raine-Fenning та ін.2008a), що обмежує можливість порівняння між пацієнтами. Крім того, існують серйозні сумніви про відтворюваність дослідження, особливо в разі, коли не може бути оцінений весь орган, а лише досліджується окремий елемент (наприклад, плацента в третьому триместрі вагітності) (Martins і Nastri 2011; Martins та ін.2010, 2012). Цю мінливість можна пояснити декількома факторами, включаючи мінливість в русі, вибір досліджуваної області і навіть фазою серцевого циклу при проведенні 3-D-PD (Miyague та ін. 2013b). Цей підхід зазнає удосконалення по відношенню до 3-D-PD, особливо у випадку з волюметричним індексом пульсації (Kudla та Alcazar 2012; Martins та ін.2013; Welsh та ін.2012b) і фракційним об’ємом крові (Soares та ін.2013.; Welsh та ін.2012a). Вважається, що такі вдосконалення допоможуть подолати обмеження вихідних 3-D-PD показників. Проте, ці показники все ще не готові до використання в клінічній практиці. Існує доказ того, що порушення, виявлені при пупковій доплерографії, характеризують патологічні зміни судин ворсинок плаценти тільки на пізніх стадіях порушення функції плаценти (Fok та ін. 1990; Trudinger та ін. 1987). Тому, зниження інтраплацентарного кровотоку може передувати збільшення пупкового опору на кілька тижнів, і виявлення цього стану може викликати побоювання (Jaffe і Woods, 1996; Yagel ін., 1999). З цих причин, розробка нових методів скринінгу плацентарної недостатності на більш ранній стадії представляє великий інтерес (Guimaraes Filhoта ін. 2008).
Деякі дослідження показали, що аналіз інтраплацентарного потоку за допомогою 3-D-PD може являти собою новий інструмент для раннього виявлення ризику розвитку певних станів, таких як: затримка внутрішньоутробного розвитку, прееклампсія і плацентарна недостатність (Costa та ін.2010; Guimaraes Filho і ін .2010; Guiot та ін.2008; Negrini та ін.2011). Багато з цих досліджень, однак, були проведені під час другого і третього триместрів вагітності (de Almeida Pimenta та ін.2014; de Paula та ін.2009; Mihu та ін.2012; Odibo та ін.2011; Tuuli та ін.2010) і показали вплив технічних обмежень, згаданих раніше, в тому числі розбіжність результатів відтворюваності досліджень (Guimaraes Filho та ін.2011; Lai та ін.2010 ;. Merce і ін, 2004) (Рис. 13).
На відміну від більш пізніх етапів вагітності, 3-D-PD в кінці першого триместру вагітності (11-14 тижнів) має перевагу в візуалізації всієї плаценти, тим самим забезпечуючи повну оцінку судинного дерева, що теоретично забезпечує більш точний аналіз інформації про васкуляризацію і кровотік (Araujo Junior та ін.2011b; Odeh та ін.2011; Rizzo та ін.2007, 2009а, 2009b; Yigiter та ін. 2011). Крім того, відомо, що проведення профілактики прееклампсії слід починати якомога раніше, що ще більше підкреслює важливість плацентарної 3-D-PD до 16 тижня вагітності (Bujold та ін. 2010). Кілька недавніх досліджень, проведених в кінці першого триместру, виявили зниження плацентарних 3-D-PD показників (Bozkurt та ін.2010; Odeh та ін.2011; Rizzo та ін.2009b; Yigiter та ін.2011.) и обмеження матково-плацентарного циркуляторного простору (Dar та ін. 2010 року; Hafner та ін. 2010.) у жінок, у яких пізніше розвинулася прееклампсія (Dar та др.2010; Hafner та ін.2010; Odeh та ін.2011) і/або затримка внутрішньоутробного розвитку (Bozkurt та ін. 2010 Rizzo та ін.2009b; Yigiter та ін.2011). Крім того, відтворюваність дослідження була підтверджена в першому триместрі вагітності з хорошими показниками для 3-D-PD на цій стадії гестації (Huster та ін. 2010; Jones та ін. 2010.).
Існують повідомлення про використання судинних індексів, отриманих за допомогою 3-D-PD для оцінки мозку плода (Bartha та ін.2009; Chang та ін.2003e; Hata та ін.2012b; Hsu та ін.2013; Nardozza та ін. 2009), легень (Ruano та ін.2006a, 2012), печінки (Chang та ін.2003d) і нирок (Bernardes та ін.2011;. Chang та ін.2003f). Було проведено кілька досліджень 3-D-PD техніки в оцінці васкуляризації головного мозку. Кореляція 3-D показників з гестаційним віком дала суперечливі результати (Bartha та ін.2009; Chang 2003e та ін; Hata та ін.2012b; Nardozza та ін.2009). Bartha та ін. (2009) провели аналіз мозкового кровообігу плода за допомогою 3-D-PD у 100 здорових вагітних жінок і 25 жінок із затримкою внутрішньоутробного розвитку плода. Автори відзначають, що плоди з затримкою внутрішньоутробного розвитку мали значно більш високі значення цих показників у порівнянні з нормальними плодами. Крім того, вони виявили, що центральна гемодинаміка плодів з затримкою внутрішньоутробного розвитку частіше діагностувалася за допомогою 3-DPD показників, ніж за допомогою індексу пульсації середньої мозкової артерії. Необхідні подальші дослідження для більш повної оцінки ефективності 3-D-PD в дослідженні циркуляторних змін в головному мозку плода. Ruano та ін. (2006а) оцінили потенціал 3-D-PD для прогнозування неонатальних результатів і легеневої гіпертензії у плодів з вродженою діафрагмальною грижею. Вони відзначили, що 3-D індекси були статистично нижчими у випадках вродженої діафрагмальної грижі. У таких випадках, показники VI і VFI були значно нижчими у плодів, які померли, ніж у тих, які вижили, і також були нижчими у плодів з діагностованою постнатальною легеневою гіпертензією. Інше дослідження показало, що з кількох аналізованих параметрів, параметр VI легені, контралатеральної грижі, був найкращим предиктором виживаності плода (Ruano та ін. 2012). Необхідне проведення подальших досліджень для оцінки обґрунтованості і доцільності застосування 3-D-PD для дослідження змін фетальної легеневої васкуляризації. Що стосується оцінки фетальної васкуляризації печінки і нирок при 3-D-PD, виявлено позитивну лінійну кореляцію між трьома індексами (VI, FI і VFI) і гестаційним віком в обох органах (Chang та ін. 2003d, 2003f). Вивчення плодів, з підозрою на обструкцію сечових шляхів, показало, що ниркова васкуляризація (VI і VFI) була значно нижчою у плодів, у яких розвинулася ниркова недостатність (Bernardes та ін. 2011).
У таблиці 6 наведені найбільш важливі статті по 3-D-PD в першому триместрі вагітності.
Таблиця 6. Автори дослідження, досліджувана популяція, гестаційний вік, пренатальна ультразвукова техніка та клінічні результати основних статей, в яких оцінювалось плацентарне кровопостачання в першому триместрі за допомогою 3-D енергетичної доплерографії
| Автори дослідження | Досліджувана популяція | Гестаційний вік (тижні) | Пренатальна ультразвукова техніка | Клінічні результати |
| Rizzo та ін. (2007) | 100 здорових вагітностей | 11–13+6 |
Плацентарні індекси (VI, FI, VFI) розраховувалися за допомогою VOCAL гістограми (вся плацента) | Представлені дані про нормальні діапазони плацентарних судинних індексів між 11 + 0 і 13 + 6 тижнів гестації, які можуть бути корисні в майбутньому для дослідження плацентарної васкуляризації |
| Rizzo та ін. (2009a) | 84 вагітностей с ▼PAPP-A | 11–13+6 | Плацентарні індекси (VI, FI, VFI) розраховувалися за допомогою VOCAL гістограми (вся плацента) | Низький рівень в сироватці материнської крові PAPP-A ≤ 0,4 (багаторазове середнє значення) пов’язаний зі зміненими показниками 3-D-PD; ці зміни пов’язані з подальшим розвитком IUGR і несприятливих наслідків вагітності |
| Dar та ін. (2010) | 277 здорових вагітностей | 10+4 – 13+6 | Плацентарні індекси (VI, FI, VFI) розраховувалися за допомогою VOCAL гістограми (сферична біопсія) | Пацієнти, у яких розвивається пре еклампсія, мають більш низькі показники 3-D-PD з їх матково-плацентарного циркулюючого простору під час першого триместру; прогнозування прееклампсії було на рівні 78,9%, 77,6% і 79,6% для VI, FI, і VFI, відповідно |
| Odeh та ін. (2011) | 308 здорових вагітностей | 10+6 – 13+6 | Плацентарні індекси (VI, FI, VFI) розраховувалися за допомогою VOCAL гістограми (вся плацента) | VI значно нижчий при гіпертонії, індукованою вагітностю, яка розвивається (7,86 ± 3,92 проти 12,02 ± 7,09) в групі здорових, р = 0,035; VI може мати деякий потенціал у виявленні гіпертонії, індукованою вагітностю |
3-D-PD = 3-D енергетична доплерографія; FI = індекс потоку; IUGR = внутрішньоутробна затримка росту; PAPP-A = плазмовий протеїн А вагітних; VFI = індекс васкулярної перфузії; VI = індекс васкуляризації; VOCAL = комп’ютеризований аналіз віртуального органу.
ВИСНОВКИ
Після глибокого аналізу медичної літератури по 3-DUS і 4-DUS в акушерстві та вивчення питання про можливості 3-DUS техніки в наданні додаткової діагностичної інформації до даних 2-DUS дослідження, Goncalves та ін. (2005a) і Kurjak та ін. (2007 ) прийшли до висновку, що: ”тривимірне ультразвукове дослідження дає додаткову діагностичну інформацію для діагностики аномалій обличчя, оцінки дефектів нервової трубки і вад розвитку скелета. Необхідні додаткові дослідження для того, щоб визначити клінічну роль 3-DUS/4-DUS в діагностиці вроджених вад серця та аномалій центральної нервової системи.”
Безперечним фактом є те, що 3-DUS значніше підсилює зв’язок батьків з їхньою дитиною, в порівнянні з 2-DUS. 3-DUS займає менше часу, дозволяє здійснювати точне відновлення анатомії плода і одночасно візуалізувати картинку в сагітальній, аксіальній і коронарній площинах, в порівнянні з 2-DUS. Крім того, 3-DUS/4-DUS дає можливість будувати проекції, які важко отримати при 2-DUS, що, таким чином, надає сонографістам велику гнучкість в їх спробах визначити виразність, розташування і ступінь аномалій. Крім того, 3-DUS/4-DUS техніка надає важливі нові технічні можливості, що може бути використано в клінічних програмах підготовки сонографістів, які в свою чергу можуть вільно здійснювати ‘‘навігацію’‘ в межах об’єму, а сам об’єм, за необхідності, може бути розділений на шари у всіх трьох ортогональних площинах. Нещодавно розроблене програмне забезпечення має інтелектуальну систему навігації і дослідження необхідних діагностичних площин (‘‘віртуальний’‘ сонографіст).Нарешті, збережені об’ємні дані і відеокліпи можуть бути стиснуті і розміщені на спеціальному веб-сайті через інтернет, або відправлені на віддалений вузол для обробки і аналізу експертною групою за допомогою телемедицини. З огляду на все вище викладене, ми переконані, що технологічні досягнення в області 3-DUS/4-DUS внесли великий вклад в широке використання і доступність таких методів. Вони також встановили, що 3-DUS/4-DUS можна використовувати в акушерській практиці як рутинну діагностичну процедуру. Для проведення досліджень рекомендуємо використовувати апарат від компании GE Voluson E8.



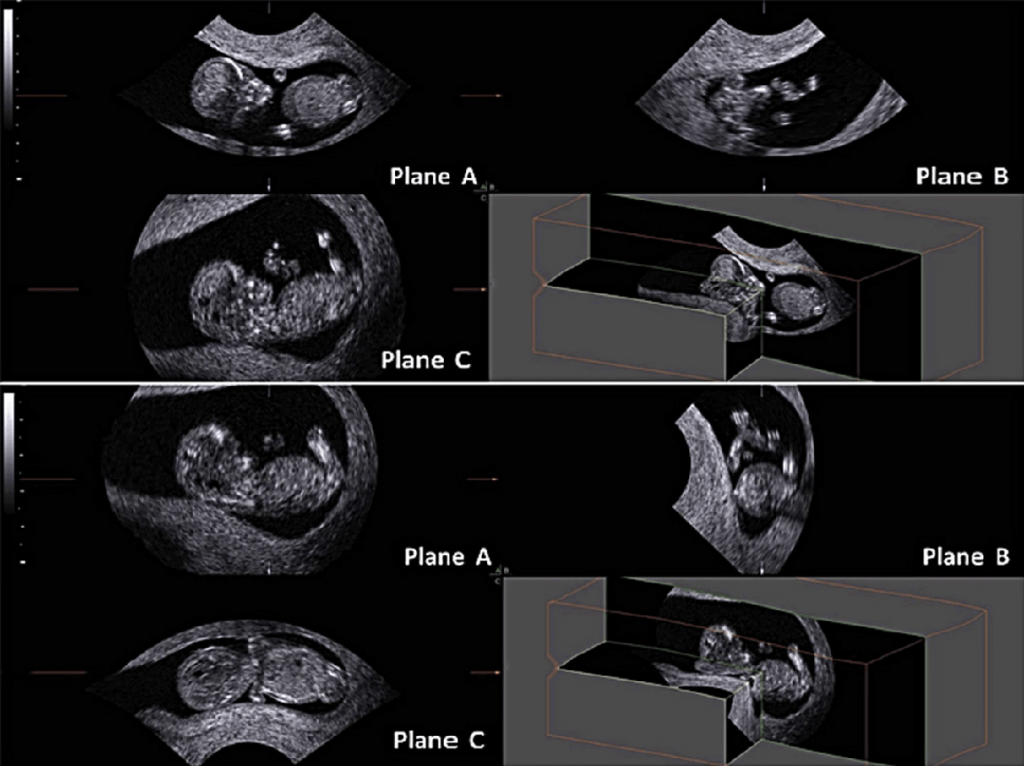
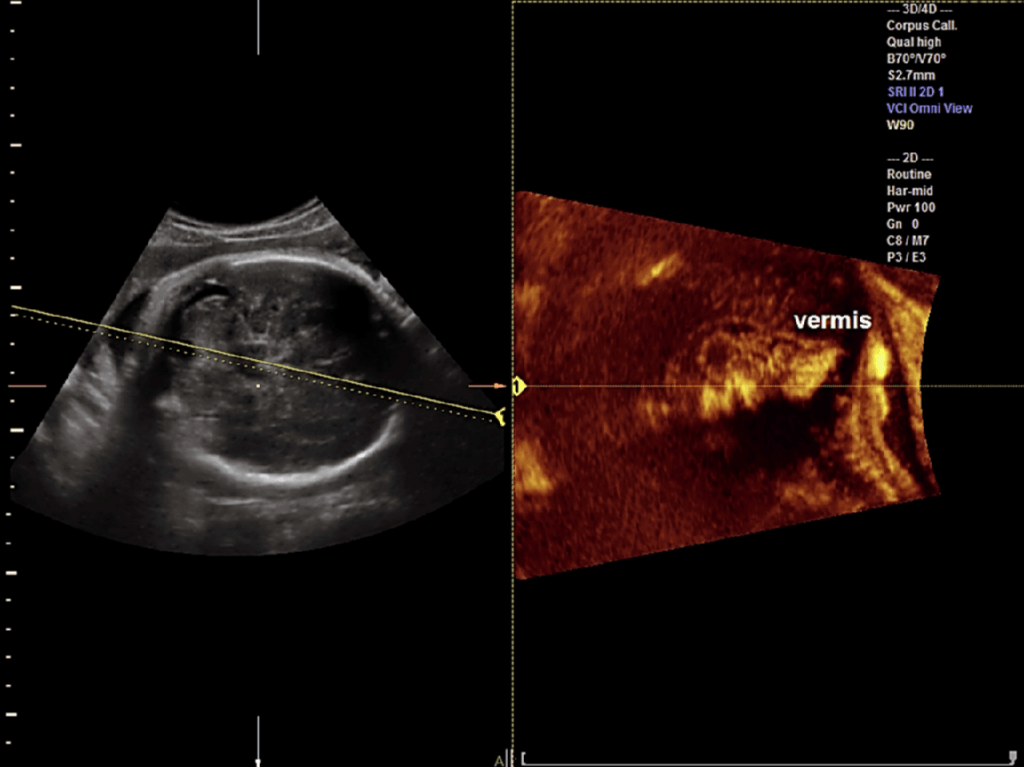
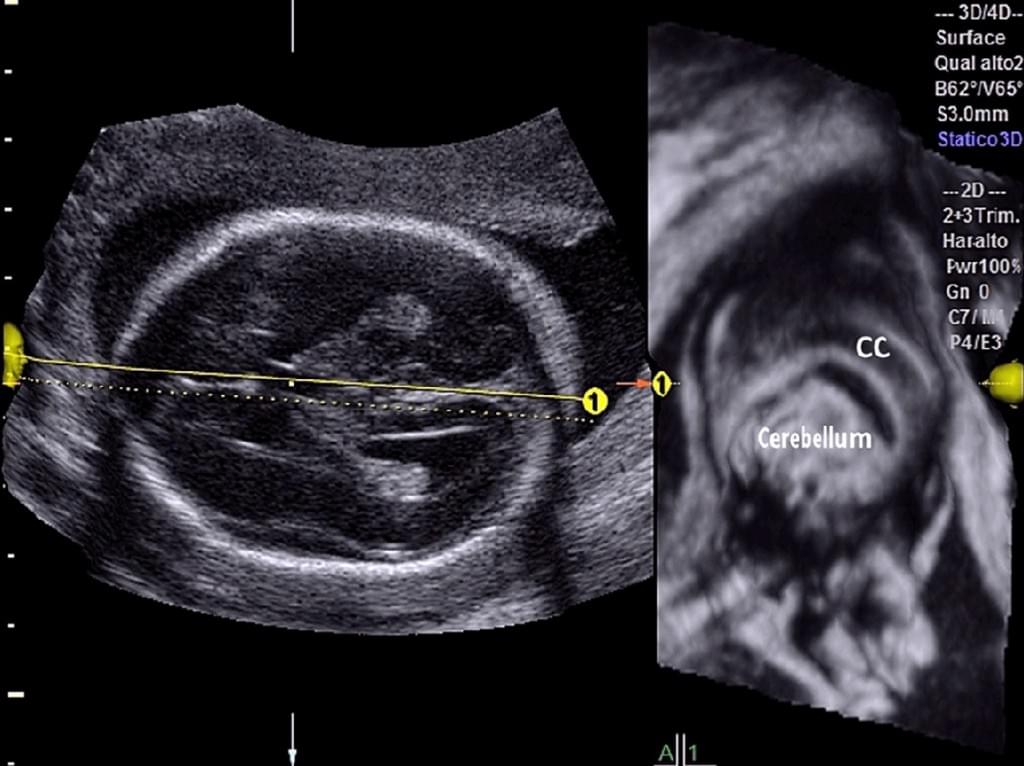
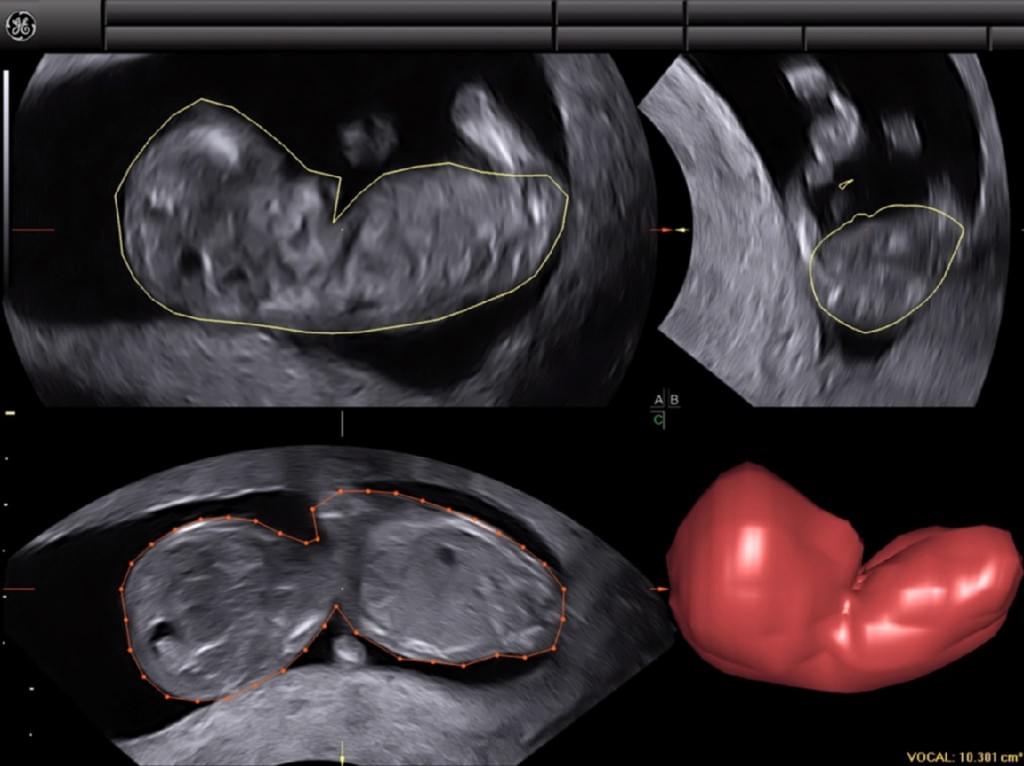
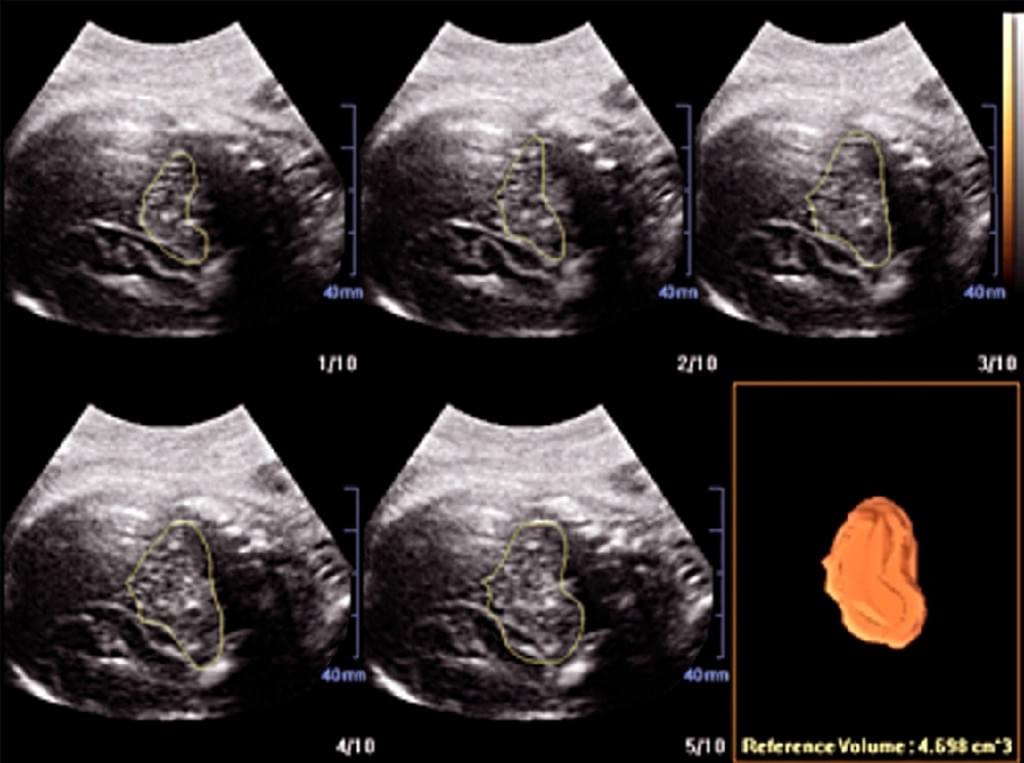
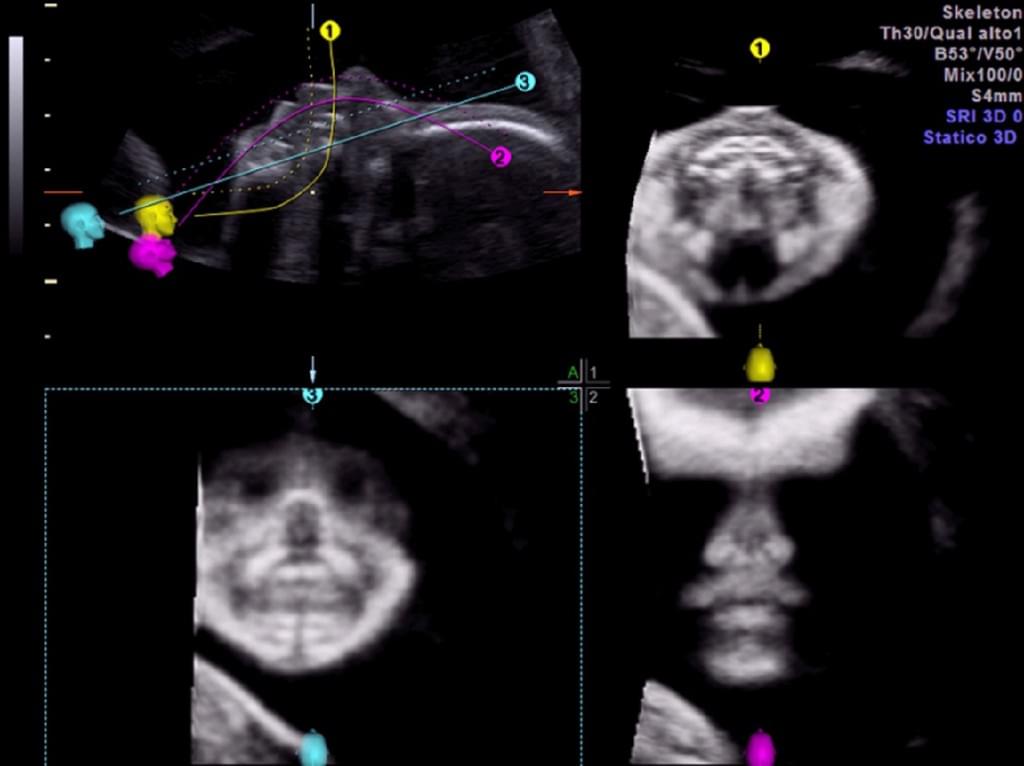
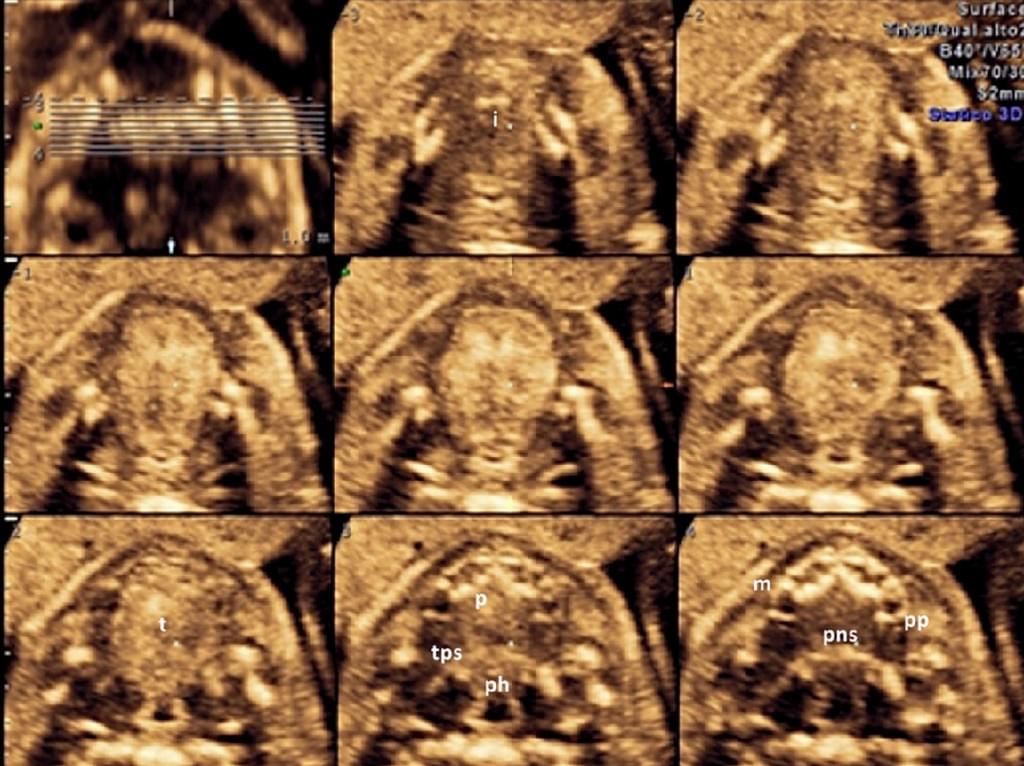
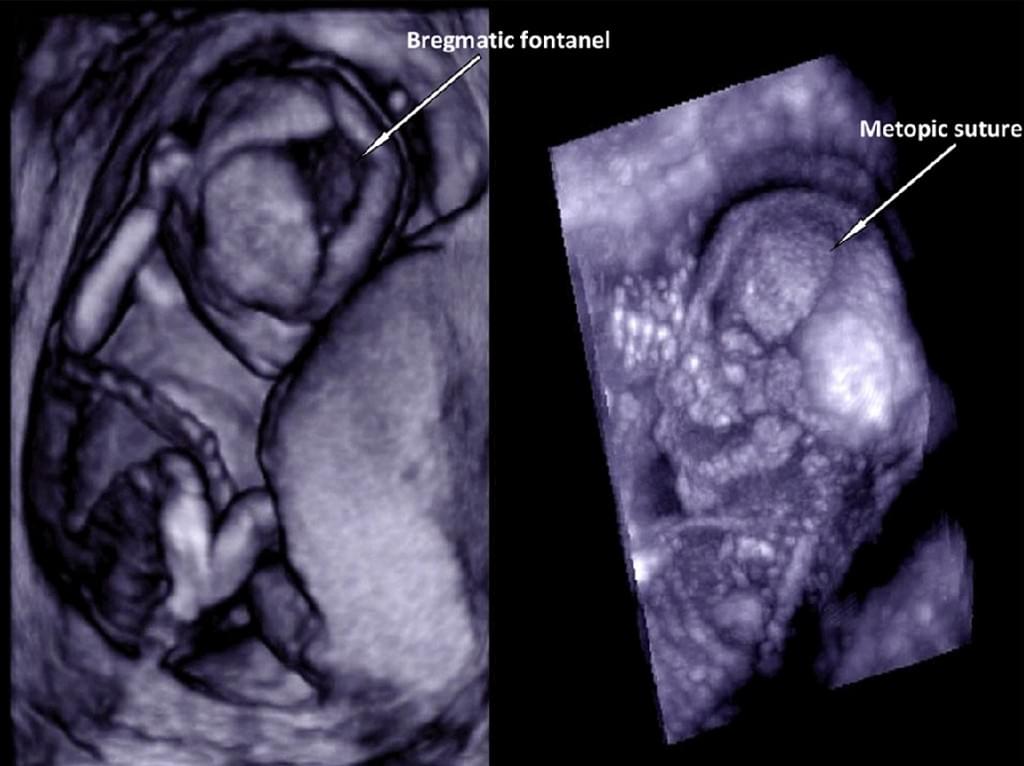
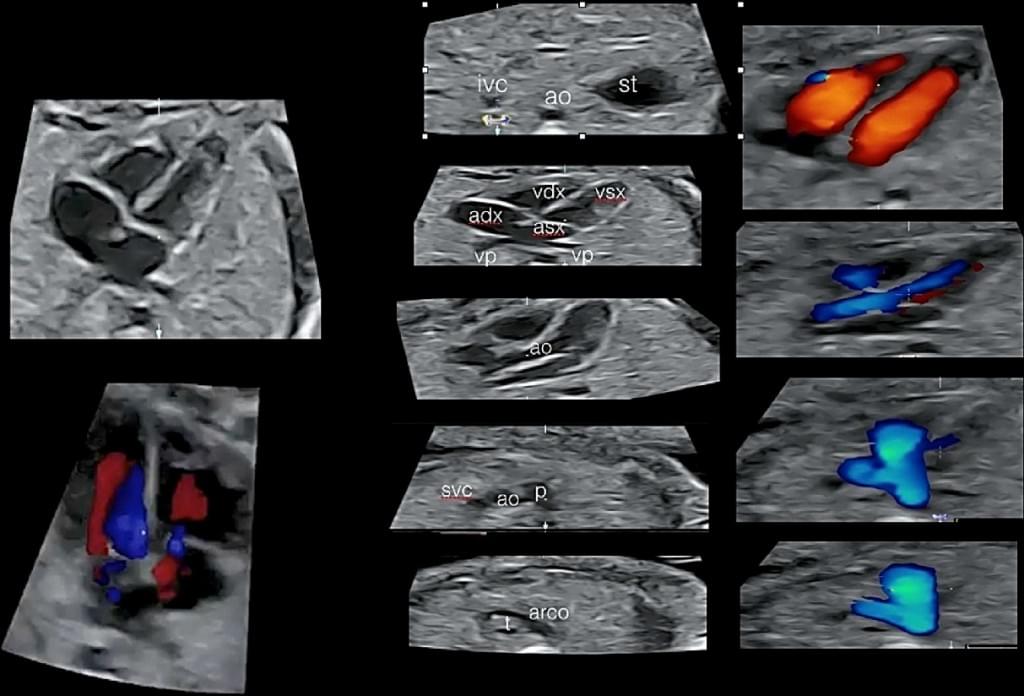
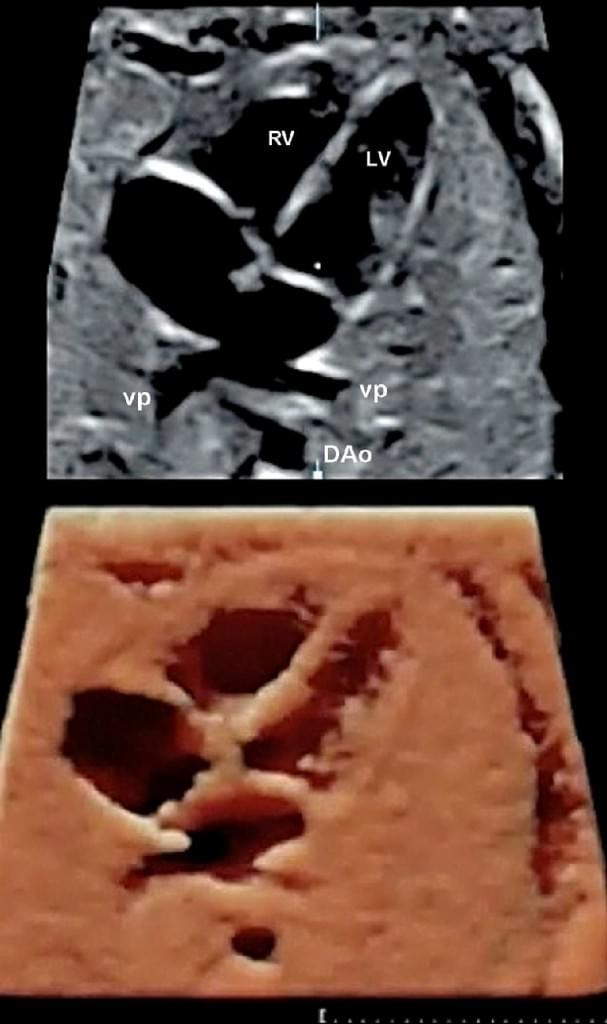
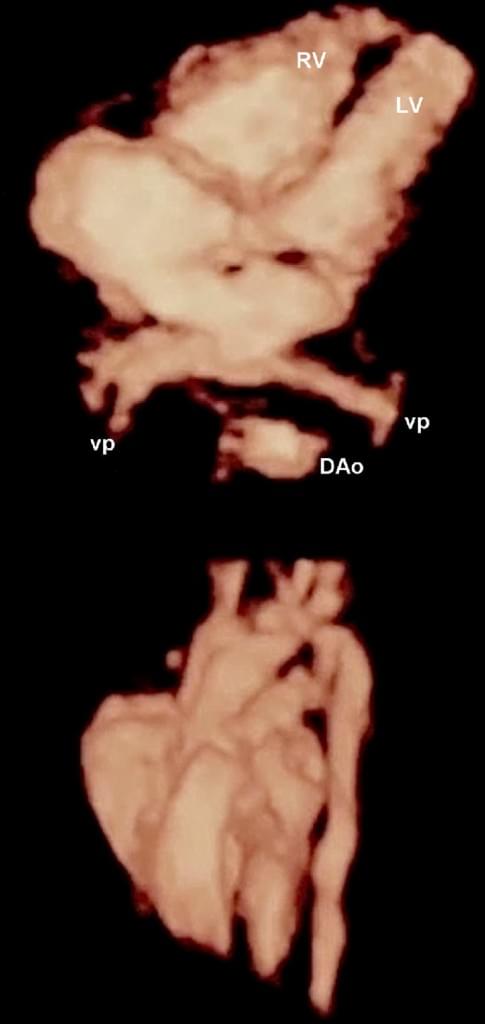
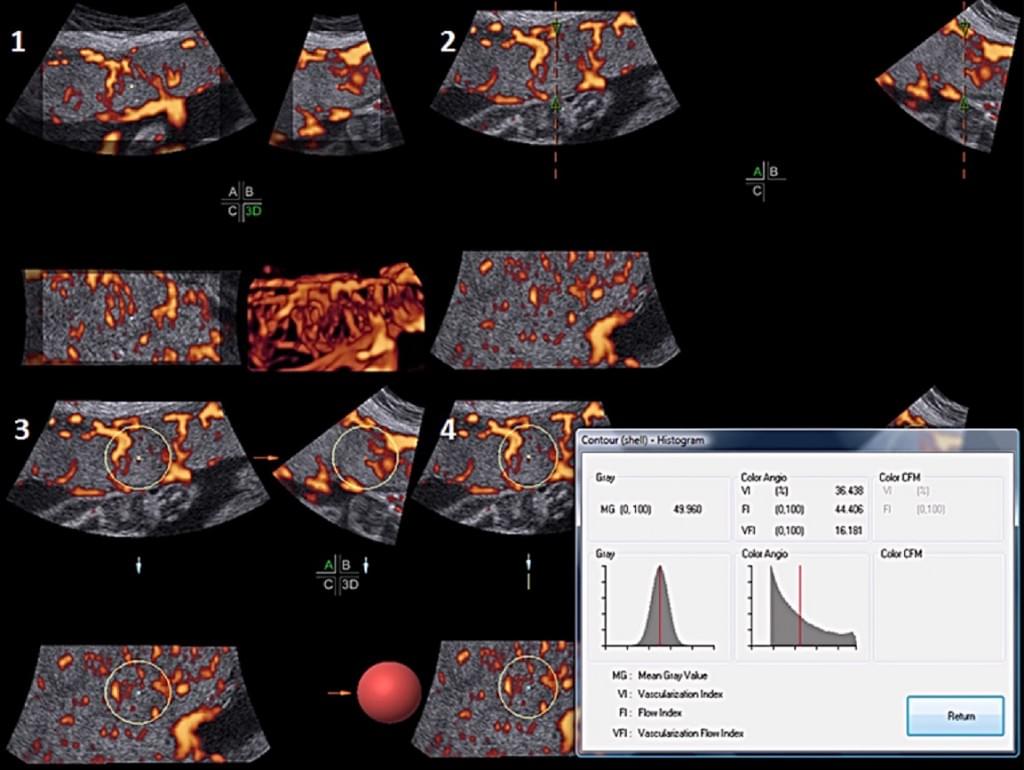


14.10.2019
Дмитро Романович