3-DUS достигло признания, как диагностический инструмент, значение которого выходит далеко за пределы обычного 2-D звукового исследования (2-DUS) и, таким образом, заслуживает того, чтобы быть включенным в повседневную практику. Работники системы здравоохранения должны быть проинформированы о доказанной и возрастающей роли, которую играет 3-DUS в акушерской практике и должны быть уверены при назначении 3-DUS исследования своим пациентам.
АВТОРЫ: GABRIELE TONNI, WELLINGTON P. MARTINS, HELIO GUIMARAES FILHO, EDWARD ARAUJO JUNIORY
РЕЗЮМЕ
Использование 3-D ультразвука в акушерстве претерпело драматическое развитие в течение последних 20 лет. С момента первых публикаций по данной технике в клинической практике, множество методов 3-D ультрасонографии и режимов визуализации было предложено и применено к изучению мозга плода, лица и анатомии сердца. К тому же, 3-D ультрасонография улучшила расчеты объема фетальных органов и конечностей, оценку массы плода при рождении.
И, кроме того, ангиографические картины органов плода и плаценты, были оценены с использованием 3-D количественной энергетической допплерографии. В этом обзоре мы стремимся обобщить имеющиеся данные о клинической значимости этих методик и их применение в акушерской практике.
Ключевые слова:
Доплерография, плод, четырехмерное ультразвуковое исследование, HDlive, таблица данных, Omniview, пространственно-временная корреляция изображений, трехмерное ультразвуковое исследование, расчет объема.
ВВЕДЕНИЕ
Настоящий обзор посвящен оценке исторического фона, лежащего в основе роли и клиническое значение 3-D ультразвукового исследования (3-D ultrasound – 3-DUS). Данный обзор также показывает, что 3-DUS достигло признания, как диагностический инструмент, значение которого выходит далеко за пределы обычного 2-D звукового исследования (2-DUS) и, таким образом, заслуживает того, чтобы быть включенным в повседневную практику. Работники системы здравоохранения должны быть проинформированы о доказанной и возрастающей роли, которую играет 3-DUS в акушерской практике и должны быть уверены при назначении 3-DUS исследования своим пациентам. Тем не менее, в настоящее время, в органы здравоохранения требуются значительные инвестиции в области передовых технологий для оборудования соответствующим образом и компьютеризации современных акушерских ультразвуковых лабораторий.
Чтобы проиллюстрировать доказанную роль 3-DUS в акушерской практике, мы предоставляем данные о его применении в исследовании анатомии мозга плода, лица, фетальной эхокардиографии, объемов органов и конечностей плода и оценке массы тела при рождении. Мы также рассмотрим 3-D энергетическую доплерографию (3-D power Doppler ultrasound – 3-D-PD). Кроме того, мы представляем несколько приложений 3-DUS, которые включают в себя методы повторного разделения, на такие как: OmniView, обратная/наклонная/косая проекция, пространственно-временная корреляция изображения (spatiotemporal image correlation – STIC), B-поток, режим инверсии и таблицы данных, компьютеризированный анализ виртуального органа (VOCAL), вычисление объемов и недавно разработанные световые методы.
ОСНОВЫ И ТЕХНИЧЕСКИЕ АСПЕКТЫ 3-D УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ
Первая система 3-DUS была описана Baba и др. (1989). Эта система состояла из 2-D датчика, прикрепленного к механической руке, которая проводила сканирования брюшной полости беременной. С помощью этого сканирования, собирались данные из нескольких 2-D плоскостей и отправлялись на компьютер для 3-D реконструкции изображения. Большими недостатками этой система являлись длительное время, необходимое для выполнения сканирование и низкое качество изображения, что ограничивало его применение в клинической практике (Baba и др. 1989).
В начале 1990-х годов, группа национального Университета Ченг Кунга в Тайване представила первую визуализацию лица, мозжечка и шейного отдела позвоночника плода с использованием конвексного объемного датчика на УЗИ-аппарате Combison 330 (Kretztechnik, Zipf, Австрия), который был первым 3-DUS оборудованием, которое использовалось в клинической практике (Kuo и др. 1992). Nelson и Pretorius (1992) были одними из первых, кто визуализировал поверхности и позвоночника плода (Steiner и др. 1995), Merz и др. (1995) визуализировали обширный ряд врожденных аномалий с использованием как 2-DUS и 3-DUS. Merz и др. (1995) сообщили, что 3-DUS техника улучшала пренатальное выявление аномалий развития плода в 62% случаев, была эквивалентна в 36% и менее эффективна в 3% случаев по сравнению с 2-DUS. Трехмерные УЗИ изображения формируются путем изменения положения объемного датчика для получения объема в виде серии срезов в разных направлениях. Интегрированные датчики, как правило, совмещены со сканером таким образом, что набор объемных данных сразу же доступен во время проведения исследования, без необходимости повторного проецирования или постобработки (Nelson и Pretorius 1998).
Компьютерная программа создает единый набор 3-D данных на основе расстояния и угла между полученными 2-D ультразвуковыми изображениями. Наименьшая единица 2-DUS изображения является пиксель, наименьшая единица 3-DUS изображения называется воксель. При 3-DUS исследовании, 2-DUS изображения объединяются с помощью компьютера и формируют реальное 3-D изображение анатомии и патологии. Это изображение можно затем просматривать, манипулировать им и измерять в трех проекциях лечащим врачом на том же или другом компьютере. Также, 2-мерное изображение в поперечном сечении может быть сгенерировано в любой ориентации, без ограничений, в анатомической зоне, которая может быть легко связана с предыдущим или последующим 3-D изображением. Чтобы избежать геометрических искажений в 3-D изображениях, что может привести к ошибке измерений, местоположение и ориентация получаемого 2-D изображения должны быть точно известны. Было предложено четыре различных подхода 3-DUS визуализации: механические сканеры, мануальная техника с позиционированием датчика, мануальная техника без позиционирования датчика и 2-мерный массив (Fenster и Downey 1996). Этапы проведения 3-DUS исследования включают: получение набора данных, 3-D визуализацию, интерпретацию изображения и/или оценку объема и сохранение объемных данных трехмерного ультразвукового исследования, которые могут быть получены с использованием линейного, конвексного, обычного и/или ротационного датчиков (Nelson и Pretorius 1998). Методики воспроизведения 3-D ультразвуковых изображений подразделяются на мультипланарные и основанные на поверхностном и объемном рендеринге.
При мультипланарном рендеринге, 3-D воксельное изображение сначала должно быть реконструировано. Затем программный интерфейс ‘‘компьютер-пользователь’‘ позволяет выбрать одну или несколько проекций для формирования изображения, аналогично традиционному 2-DUS, которые отображаются одновременно на экран. Наборы 3-D данных могут быть увеличены, повернуты или перемещены, что позволяет получить картинку в любой плоскости в пределах полученного объема (Merz и др. 2007). После серии манипуляций, плод (или другая исследуемая структура) может быть визуализирован в стандартной манере, что является, тем самым, отправной точкой для проведения исследования. Это, как правило, достигается путем манипулирования набором 3-D данных до получения сагиттального изображения на экране в плоскости А (вверху слева), поперечного изображения в плоскости В (справа вверху) и коронарного изображения в плоскости С (нижний левый) (Барра и др. 2013) (рис. 1).
При поверхностном рендеринге, алгоритм анализирует каждый воксель на 3-D изображении и определяет, к какой структуре он принадлежит. После того, как ткани или структуры будут классифицированы и определены их границы, границы поля зрения представляются в виде линейного каркаса или сетки, а поверхность – отображается в виде текстуры соответствующего цвета, которая представляет анатомическое строение объекта (Lobregt и Viergever 1995; Neveu и др. 1994). Точная и автоматическая сегментация ультразвуковых данных имеет важное значение для высококачественного поверхностного соответствия, а сегментация на основе нулевого сигнала значительно упрощает извлечение структурных особенностей. Baba и др. (1996, 1997) визуализировали поверхности плода в режиме реального времени с помощью простой пороговой обработки для определения поверхности плода в амниотической жидкости.
Рис. 1. Трехмерное УЗИ плода в мультипланарном режиме в первом триместре беременности. Полученное изображение находится вверху. После поворота и перемещения набора 3-D данных, можно поместить плод в стандартизованной манере, в сагиттальной плоскости на А изображении, в поперечной плоскости на B изображении и фронтальной плоскости на C изображении. При стандартизации изображения, можно различить то, что плод согнут в правую сторону, что может мешать при измерении копчиково-теменного размера.
Наиболее распространенной методикой при 3-DUS является техника преобразования лучей (raycasting), при которой воксельная интенсивность распространяется вперед по направлению к плоскости изображения вдоль каждого луча от задней стенки к передней. Каждый воксель способствует формированию окончательной интенсивности изображения, что зависит от затенения и прозрачности значений (Nelson и Pretorius 1998).
В режиме рендеринга, воксели, связанные с амниотической жидкостью, удаляются из набора 3-D данных и с поверхности ниже амниотической жидкости, таким образом, поле зрения ограничено видимыми прямыми и/или изогнутыми линиями (Riccabona и др. 1997). Таким образом, отсекающие плоскости, которые образуют вложенный в объеме куб, также могут быть получены. Поверхностный режим рендеринга может быть дополнительно усилен за счет новой HDlive техники подсвечивания (рис. 2).
Рис. 2. (а) Мультипланарный и режим рендеринга плода первого триместра. В режиме рендеринга, поле зрения, которое ограничено линиями в мультипланарном режиме, визуализируется в пределах линий без вокселей, связанных с амниотической жидкостю. (b) HDlive: реалистичное изображение эмбриона на 10,2 неделе беременности с использованием трансвагинального сканирования с применением последующей обработки с помощью этой новой техники подсвечивания.
Кроме того, анимированные последовательности, такие как вращение и ”кино петля” помогают в визуализации объема, путем возможности обработки изображения в реальном времени или предварительного расчета (Nelson и Pretorius 1998).
В любом случае, для повышения точности диагностики и предотвращения ошибки в диагностической интерпретации, особенно в случаях неконтролируемого вращения полученного объема на случайный угол неопытным радиологом, стандартизация использования 3-D ультразвука была первичной клинической проблемой и целью в процессе разработки этой методики (Abuhamad и др.2007; Benacerraf и др. 2005; Merz и др. 2007).
Путем исследования эффективности методики в изучении анатомии головного мозга, анатомии черепа, структур сердца и объемов органов, мы проиллюстрируем клиническое значение 3-D/4-D УЗИ. Мы также опишем, как данная техника достигла высокой диагностической точности в акушерско-гинекологической практике.
3-D УЛЬТРАЗВУК И ИЗУЧЕНИЕ ЭМБРИОНАЛЬНОЙ АНАТОМИИ МОЗГА: НЕЙРОСОНОГРАФИЯ
Несмотря на то, что 2-DUS нейросонография осуществляется в соответствии с руководящими принципами Международного общества ультразвука в акушерстве и гинекологии (ISUOG) и представляет собой золотой стандарт медицинской помощи (ISUOG 2007), все больше доказательств появляется о клинической эффективности 3-DUS УЗИ, которое было предложено в качестве метода, который может преодолеть ограничения, связанные с зависимостью от навыков рентгенолога (Benacerraf и др. 2006). Эмбриональная нейросонография осуществляется путем установки датчика вдоль швов и родничков головки плода (Timor-Tritsch и Monteagudo1996).
В дополнение к основным чрезталамической, чрезжелудочковой и трансмозжечковой осевым проекциям, была рекомендована (ISUOG 2007) оценка четырех коронарных проекций (трансфронтальная, транскаудальная, трансталамическая и трансмозжечковая) и две сагиттальных (среднесагиттальная и парасагиттальная). В последние годы, 3-DUS эффективно используется для определения основных структур мозга и изображения структур, которые обычно не отображаются при 2-D трансабдоминальном осевом подходе (Chitty и Pilu 2009; Timor -Tritsch и др. 2012). В качестве альтернативы, для получения диагностических плоскостей и уменьшения зависимости от оператора, может быть использовано получение наборов объемных данных начиная с аксиальной проекции головки плода и ”навигации” в автономном режиме с использованием мультипланарной реконструкции плоскостей, что может потенциально увеличить скорость обнаружения аномалий центральной нервной системы (Rizzo и др. 2011а). Концепция автоматизированного объемного ультразвукового исследования, которая основана на оператор независимом поиске диагностических 2-D плоскостей из 3-D объема, требует начальной, предопределенной стандартизации органоспецифических 3-D объемов. Так же необходимо 180º вращение вдоль оси у в плоскости A, z-вращение и размещение ”точки отсчета” в средней точке межполушарной щели (Abuhamad 2005). Monteagudo и др. (2000) исследовали 34 пациентов с анамнезом патологии головного мозга или подозрением на патологию мозга и сравнивали 2-D и 3-D трансвагинальные нейросонограммы. Monteagudo и др. (2000) пришли к выводу, что основное различие между 2- DUS и 3-DUS исследованиями заключается в том, что осевая плоскость может быть получена только с помощью 3-D реконструкции набора объемных данных, и это является преимуществом, так как осевую плоскость редко можно увидеть при 2-D трансвагинальной технике. Плоскости, полученные в автономном режиме из 3-D объема, были параллельными, а не косыми, или расположенными под углом, как в случае с обычной 2-D трансвагинальной нейросонографией. Наконец, когда были сопоставлены 2-DUS и 3-DUS исследования патологических случаев, важным преимуществом, которое обеспечивалось ”навигацией” внутри объемов, генерируемых 3-DUS, была возможность следить за конкретной точкой, которая идентифицирует одну и ту же анатомическую точку во всех трех ортогональных плоскостях, что облегчает идентификацию структуры по средней линии.
Vinals и др. (2007) сообщили, что трансфронтальное получение 3-D наборов объемных данных мозга является наиболее выгодным для изучения как мозолистого тела, так и червя мозжечка после 20 недель беременности. Также они сообщили, что среднесагиттальную плоскость можно было легко получить во всех случаях с диагностически качественным изображением мозолистого тела в 93,1% и 99,0% случаях двумя рентгенологами, соответственно. Bornstein и др. (2010a) выполняли анализ в автономном режиме с использованием трансабдоминального 3-D УЗИ в серой шкале и энергетической доплерографии объемов мозга плода при исследовании 102 последовательных нормальных плодов в сроке от 20 до 23 недель. Miguelote и др. (2012) сравнили возможности и воспроизводимость 3-D объемной ультразвуковой реконструкции при ее использовании для измерения длины мозолистого тела у 46 нормальных плодов, исследованных с помощью 2-DUS и 3-DUS в сроке от 23 до 32 недель беременности. Прямые среднесагиттальные проекции были получены либо при трансабдоминальном, либо трансвагинальном доступе, а 3-D реконструкция среднесагиттальных проекций были получены с помощью 3-D мультипланарных манипуляций и объемного контрастного изображения с помощью техники C-плоскости (VCI-C) из объемов, полученных в осевых плоскостях. VCI-C представляет собой новый подход, который улучшает контрастность и разрешение ткани по сравнению с 2-DUS. Он дает возможность проводить измерения, визуализировать поля и внутренние аспекты структур/тканей, которые являются более точными (Ruano и др. 2004а) (Рис. 3).
Рис. 3. Фетальная нейросонография с использованием OmniView с объемным контрастным изображением в C-плоскости (VCI-C). Желтая линия расположена в косом направлении через заднюю черепную ямку, что позволяет провести реконструкции червя мозжечка у нормального плода (сканирование во втором триместре).
Visentainer и др. (2010) установили референтные значения для длины мозолистого тела и площади у плода в сроке от 20 до 33 недель беременности с использованием 3-DUS. Эти авторы сообщают, что средняя длина мозолистого тела увеличивается с 21,7 до 38,7 мм между 20 и 33 неделями беременности и средняя площадь мозолистого тела увеличивается с 55,2 до 142,2 мм2 между 20 и 33 неделями беременности. Также документально подтверждена сильная корреляция между длиной/площадью мозолистого тела и гестационным возрастом (R = 0.7 и 0.7) и бипариетальным диаметром (R = 0,7 и 0,6).
Miguelotte и др. (2012) сообщили, что мозолистое тело может быть измерено в 91% трансвагинальных исследований, в 52% трансабдоминальных исследований, в 92% при мультипланарной реконструкции и в 86% – при VCI реконструкции, полученной с помощью техники С-плоскости. Oни пришли к выводу, что вероятность успеха в отношении трансвагинального исследования не зависит от гестационного возраста и слабо зависит от этого параметра для методов 3-D реконструкции. Correa и др. (2006) оценили роль трансабдоминального 3-DUS в оценке мозга плода и изучили его потенциал при рутинном нейросонографическом исследовании, проведенном у 202 последовательных плодов в сроке от 16 до 24 недель беременности. Авторы обнаружили, что мозолистое тело можно было увидеть у 84% пациентов, четвертый желудочек у 78%, боковую борозду (Сильвиеву щель) в 86%, поясную борозду в 75%, полушария мозжечка в 98%, червь мозжечка в 92%, продолговатый мозг в 97% и cavum vergae в 9%. Таламус и большие цистерны были определены во всех случаях. В сроке 20 недель или более, отмечена лучшая частота визуализации для мозолистого тела (97%), надмозжечковых цистерн (92%) и третьего желудочка (93%).
Correa и др. (2006) пришли к выводу, что мультипланарные изображения, полученные при трансабдоминальном 3-DUS обеспечивают простой, эффективный подход к детальной оценке анатомии мозга плода. Этот метод имеет потенциал для использования в рутинных исследованиях плода.
При изучении церебральных срединных структур плода у 300 последовательных нормальных беременных женщин с низким уровнем риска, Tonni и др. (2014) недавно предоставили доказательства того, что применение новой 3-DUS реслайсинг техники (Omniview, GE Medical System, Ципф, Австрия) может облегчить оценку срединных структур мозга при анатомическом сканировании во втором триместре. Omniview является новой реслайсинг техникой для 3-DUS/4-DUS, которая позволяет получать наборы объемных данных и одновременно отображать до трех независимых плоскостей любого данного органа. Она также позволяет одновременно проводить объемную реконструкцию до трех независимых плоскостей, путем разграничения линий и углов в любом направлении. Объем может быть свободно разделен путем установки ультразвукового оборудования для отслеживания прямых линий, изогнутых линий, или полилиний, что выбирается в меню. Omniniew или другое коммерчески доступное программное обеспечение имеет потенциал для облегчения реконструкции и оценки 3-D объемов, что, таким образом, компенсирует ограниченный опыт оператора и требует короткого периода обучения в учебных программах (Yeo и др. 2011a, 2011b). Tonni и др. (2014) сообщили, что офф-лайн объемные данные мозолистого тела и задней черепной ямки были точно реконструированы из сагиттальной и осевой плоскостей в 98,5% и 96% случаях, соответственно, с корреляцией 0,96 и 0,91 для среднесагиттальных и осевых плоскостей, соответственно, в случаях, связанных с патологией (рис. 4).
Результаты, полученные Tonni и др. (2014) согласуются с данными Rizzo и др. (2011b), который впервые использовал эту технологию для реконструкции сагиттальной и коронарной плоскости мозга у 106 нормальных эмбрионов в сроке от 18 до 24 недель беременности. Были получены среднесагиттальная, парасагиттальная, трансфронтальная, транскаудальная, трансталамическая и трансмозжечковая плоскости, с показателями визуализации для мозговых структур от 72% до 96% с помощью сагиттальных срезов, и от 76% до 91% с помощью коронарной проекции. Параметры согласования между операторами были 0,93 и 0,89 для сагиттальной и коронарной плоскостей, соответственно. Rizzo и др. (2011b) также смогли точно обнаружить все девять случаев церебральной патологии, в том числе: полная агенезия мозолистого тела, пограничная вентрикуломегалия и классический порок развития – синдром Денди-Уокера.
Рис. 4. Фетальная нейросонография с использованием OmniView: реконструкция мозолистого тела у нормального плода на 20 неделе беременности.
Бразильские исследователи (Haratz и др. 2011) оценивали возможность выполнения волюмометрии бокового желудочка у 30 плодов в сроке от 20 до 36 недель беременности, получив ширину желудочков от 10 до 30 мм. При сравнения измерений, выполненных с помощью 3-DUS VOCAL с результатами, полученными с помощью магнитно-резонансной томографии (МРТ), Haratz и др. (2011) обнаружили, что 3-DUS волюметрия фетального бокового желудочка VOCAL методом хорошо коррелирует с МРТ плода с вентрикуломегалией, и что такой подход может быть использован в качестве дополнительного консультативного метода и средства прогнозирования. VOCAL – это компьютерная программа, установленная на некоторых коммерческих ультразвуковых машинах, которая используются для расчета объема и использует полюсы, которые отграничены разметкой. Угол поворота зависит от ультразвуковой машины и колеблется от 6º до 30º. Если выбран угол 6º, оператор разграничивает 30 плоскостей; с углом 30º различается только 6 плоскостей. Размежевание плоскостей может быть ручным, автоматизированным или полуавтоматическим. Когда последняя плоскость отграничена, система реконструирует орган эмбриона и отображает его объем. Как сообщается, этот метод был одинаково выполнимым и воспроизводимым как in vivo, так и in vitro (Raine-Fenning и др. 2003;Ruano и др. 2005; Martins и др. 2007) и хорошо коррелировал с МРТ и мультипланарную методами (Ruano и др. 2004b). VOCAL имеет несколько преимуществ по сравнению с мультипланарными методами, так как этот метод более быстрый и позволяет выполнить правку в необходимой области после завершения расчета конечного объема (Peralta и др. 2006) (Рис. 5).
Рис. 5. Компьютерный анализ виртуального органа (VOCAL) с 30º углом поворота, который был использован для расчета объемов головки и туловища плода.
Расчет фетального мозжечка в различных этнических группах является важным применением VOCAL для построения диапазона нормальных значений в зависимости от гестационного возраста. Такой расчет также улучшил точность пренатальной диагностики гипоплазии мозжечка. Гипоплазия мозжечка может быть найдена у плодов с синдромом Дауна, задержке внутриутробного развития (ЗВУР) и множественных генетических заболеваниях (Rotmensch и др. 1997). При продольном исследовании 52 плодов при нормальной беременности, Araujo Junior и др. (2007а) заметили, что уравнение для объема фетального мозжечка, определенное Chang и др. (2000) для тайваньского населения, не может быть применено к бразильскому населению, тем самым подтверждая, что этническая принадлежность потенциально может быть предрасполагающим фактором, который может способствовать созданию различий в объемах эмбрионального органа. Rutten и др. (2009) наблюдали хорошую внутри- и межнаблюдательную надежность при расчете объема мозжечка, используя как мультипланарный, так и VOCAL методы, как это сделали Araujo Junior и др. (2014а) при расчете объема большой цистерны плода с использованием VOCAL при 30º в стандартной аксиальной плоскости поперечного диаметра мозжечка.
Кроме того, когда используется 3-DUS технология, то объемные данные могут быть сохранены, сжаты, а затем отправлены в удаленную точку для проведения консультаций экспертами для последующего анализа, что позволяет провести более точную оценку (Bornstein и др. 2010b; Rizzo и др. 2011c; Salman и др. 2011). Совсем недавно, Passos и др. (2014) установили диапазоны нормальных значений для длины и площади большой цистерны плода по 3-DUS в мультипланарном режиме при 224 нормальных беременностях в сроке от 17 до 30 недель. Авторы обнаружили, что средняя длина и площадь большой цистерны плода колебалась от 0,50±0,10 до 0,79±0,18 см и от 0,95±0,18 до 3,09±0,62 см2, соответственно.
Исследование раннего развития мозга (7-12 недель беременности) на 3-DUS с использованием инверсионного режима рендеринга было описан Kim и др. (2008). Инверсионный режим рендеринга представляет собой метод, который анализирует жидкие структуры и инвертирует серошкальные воксели, то есть, первоначально анэхогенные структуры, такие как камеры сердца, сосуды и желудок, мочевой пузырь и почечные лоханки становятся эхогенными, в то время как структуры, которые, как правило, эхогенные (например, кости) становятся анэхогенными (Goncalves и др. 2004a; Lee и др. 2005). Инверсионный режим рендеринга позволяет проводить реконструкции камер сердца, аорты и протоковых дуг, аномальных венозных соединений и септальных дефектов (Espinoza и др.2005; Goncalves и др. 2004a.). Kim и др. (2008) рекомендуют не использовать этот метод до 6 недель из-за ограниченного количества церебральной жидкости, не после 12 недель, так как хориоидное сплетение трудно выделить после этого срока. В последнее время, в работах Rolo и др. (2011), развитие борозд мозга и извилин у плода оценивали с помощью 2-DUS и 3-DUS и антенатального МРТ. Это исследование подтвердило то, что хотя МРТ считается наиболее точным методом для выявления аномалий извилин и борозд плода (Ghai и другие. 2006; Malinger и др. 2007), 3-DUS улучшает визуализацию борозд и извилин по сравнению с 2-DUS. Rolo и др. (2011) сообщили о том, что режим рендеринга 3-DUS может быть эффективным в постановке окончательного диагноза аномального развития коры и дифференциальной диагностике. По сравнению с МРТ, 3-DUS является более быстрым и экономически рентабельным способом, как правило, этот метод легко доступный и может являться реальной альтернативой, особенно при подозрении на фетальные аномалии коры мозга, которые не могут быть оценены с помощью МРТ.
В таблице 1 приведены наиболее важные статьи о фетальной нейросонографии, проведенной с помощью 3-DUS.
Таблица 1. Авторы исследования, исследуемая популяция, гестационный возраст, пренатальная ультразвуковая техника и клинические результаты в случае 3-D нейросонографии плода
|
Авторы исследования |
Исследуемая популяция |
Гестационный возраст (недели) |
Пренатальная ультразвуковая техника |
Клинические результаты |
|
Monteagudo и др. (2000) |
34 плодов с патологией мозга |
3-D TVUS нейросонография против 2-D TVUS |
Осевая плоскость только из 3-D реконструкции; плоскости были параллельными (не косыми или угловыми); контрольная точка указывает на тот же анатомический ориентир во всех трех взаимно перпендикулярных плоскостях, когда ‘‘навигация’‘ осуществляется в пределах объема |
|
|
Correa и др. (2006) |
202 здоровых плодов |
16-24 |
3-D TA нейросонография |
CC обнаружен у 88%; Сильвиева борозда у 86%; поясная борозда у 87%; червь мозжечка у 92%; полушария мозжечка у 98%; продолговатый мозг у 97% |
|
Vinals и др. (2007) |
60 здоровых плодов |
20-33 |
Визуализация церебральных срединных структур с помощью 2-D по сравнению с мультипланарной 3-D, и VCI-C плоскость против трансфронтальной плоскости |
Срединная плоскость в 88% мультипланарной, 82% в VCI-C и 87% в трансфронтальной плоскости; CC и червь мозжечка в 3-D срединных плоскостях имели сильную корреляцию; первичные и вторичные борозды червя мозжечка обнаружены в 13% -26% при мультипланарной, 18% -35% в VCI-C и 52% -79% в трансфронтальной плоскости |
|
Bornstein и др. (2010a) |
102 здоровых плодов |
20-23 |
TA 3-D в серой шкале и энергетическая доплерография |
93% -99% среднесагиттальная визуализация CC |
|
Rizzo и др. (2011b) |
106 здоровых плодов |
18-24 |
3 -D нейросонография с использованием OmniView reslicing техники в среднесагиттальной, парасагиттальной, транскаудальной, чрезталамической, трансмозжечковой плоскости |
Частоты визуализации структур головного мозга : 72% -96% при использовании сагиттальной плоскости, 76% -91% при использовании корональной плоскости Частота межнаблюдательного согласования от 0,93 и 0,89 для сагиттальной и коронарной плоскостей, соответственно Девять случаев патологии мозга было правильно определено |
|
Visentainer и др. (2010) |
70 здоровых плодов |
20-33 |
Референсный диапазон длины и площади CC |
Длина и площадь CC увеличилась от 21,7 до 38,7 мм и от 55,2 до 142,2 мм2, соответственно, от 20 до 33 недели. Сильная корреляция между длиной и площадью CC и гестационным возрастом (R2 = 0,7 и 0,7, соответственно) и бипариетального диаметра (R2 = 0,7 и 0,6, соответственно) |
|
Miguelotte и др. (2012) |
46 здоровых плодов |
23-32 |
Измерения CC с помощью 2-DUS TA/TV против 3-DUS с реконструкцией среднесагиттальной плоскости против VCI-C в осевых плоскостях |
CC измерен в 52 % и 91% с помощью TA и TV US против 86% с помощью VCI-C и 92% при мультипланарном методе |
|
Haratz (2011) |
30 плодов с увеличением бокового желудочка |
20-36 |
Измерения волюмометрии бокового желудочка с использованием VOCAl против МРТ |
Хорошее согласование волюмометрии бокового желудочка с использованием VOCAl и МРТ; ICC = 0,928 (95% ДИ: 0,876; 0,958); Диаграмма Blи–Altman подтвердила высокую корреляцию (средние различия: ±1,62 см3, стандартное отклонение: ±68,41 |
|
Araujo Junior и др. (2014a) |
224 здоровых плодов |
17-29 |
Измерение волюмометрии CM с использованием VOCAl с 30º углом поворота |
CM объем варьировал от 0,73 ± 0,25 см3 до 3,79 ± 1,10 см3, от 17 до 29 недель соответственно. Наблюдалась корреляция между объемом большой цистерны плода и гестационным возрастом (R2 = 0,67). Наблюдалась хорошая надежность и внутриисследовательское согласование с ICC = 0.92 (95% ДИ: -49.7; 48.4) |
|
Tonni и др. (2014) |
300 плодов |
19-23 |
3-D нейросонография анатомии головного мозга по средней линии с использованием OmniView reslicing техники в среднесагиттальной и чрезмозжечковой плоскостях |
CC и червь мозжечка в 98,5% и 96% случаев в сагиттальной и осевых плоскостях, соответственно. Пять патологических случаев точно определены с согласованием от 0,96 и 0,91 для среднесагиттальной и осевой плоскостей, соответственно |
CC – мозолистое тело; CI – доверительный интервал; CM – большая цистерна; МРТ – магнитно-резонансная томография; ICC – межисследовательский коэффициент корреляции; TA – трансабдоминальный; TV – трансвагинальный; US – ультрасонография; VCI-C – объем контрастная визуализация С-плоскости; VOCAL – компьютерный анализ виртуального органа.
3-DUS В ДИАГНОСТИКЕ НЕЗАРАЩЕНИЯ ГУБЫ И НЕЗАРАЩЕНИЯ ГУБЫ/РАСЩЕПЛЁННОЕ НЁБО
Хотя незаращение лица плода может быть диагностирован пренатально при 2-DUS, внедрение в практику 3-DUS вместе с развитием новых программных приложений привело к новому пониманию пренатального ультразвукового исследования неба плода. В настоящее время существует все больше доказательств того, что 3-DUS может улучшить пренатальную визуализацию лица плода и выявление незаращение лица (Tonni и др. 2005), особенно если 3-DUS выполняется в качестве прицельного исследования для подтверждения предполагаемого диагноза расщелины, согласно полученным данным при 2-DUS (Martinez Ten и др. 2009). Было разработано ряд методов визуализации нёба плода. К ним относятся: методика ”перевернутого лица”(flipped-face) (Platt и др., 2006 г.), методика ”обратной проекции лица” (reverse-face) (Campbell и Lees 2003), методика Faure (Faure и др., 2007), ”угол атаки” (Pilu и Segata 2007), методика ”косой проекции лица” (oblique face) (Martinez Ten и др. 2009) и ретроназальный треугольник (Sepulveda и др. 2010). Последний метод применяется для визуализации нёба плода при сканировании в первом триместре беременности. Faure и др. (2007), однако, не получили изображения с незаращением лица. Martinez-Ten и др. (2009) изучили 60 плодов в сроке от 20 до 33 недель беременности, из которых 10 имели заячью губу и волчью пасть, первоначально обнаруженные с помощью обычного 2-DUS УЗИ при сканировании во втором триместре беременности. Эти авторы сообщили, что методика косой проекции была лучшей методикой при патологии нёба (100%), в то время как методики flipped-face и reverse-face позволили правильно диагностировать эту область в 71% и 86% случаев соответственно. При этом по-прежнему остается диагностическая проблема поражения мягкого неба, которое регулярно определяется только у 14% плодов с дефектами неба, при использовании либо методики flipped-face, либо метода oblique face.
Campbell и Lees (2003) обнаружили, что хотя с помощью дородовой 2-DUS высокого разрешения можно легко диагностировать расщелины губы и альвеолярного отростка, 3-DUS может повысить чувствительность исследования, когда сперва лицо плода рассматривается во фронтальной плоскости, а затем вторичное нёбо исследуется с помощью ‘‘reverse-face’‘ техники после вторичного поворота на 180º. ‘‘Reverse-face’‘ техника – легкая и быстрая в выполнении, так как требует всего 2-3 мин для получения фронтальной картины лица с полной визуализацией неба. ‘‘Reverse-face’‘ техника может потенциально обеспечивать беспрепятственный обзор области неба, полости носа и орбит и, таким образом, предлагает уникальную диагностическую информацию о состоянии вторичного неба. Tonni и др. (2005) определили, что лучший срок для УЗИ-скрининга в выявлении расщелин лица колеблется от 18 до 23 недель беременности, что соответствует предлагаемому стандартному периоду для сканирования на наличие аномалий во втором триместре.
Было обнаружено, что трехмерное УЗИ позволяет получить более точную визуализацию первичного и вторичного неба плода, что позволяет дифференцировать положение и степень расщелины, особенно в тех случаях, когда 2-DUS ограничивается только акустическим затенением (Martinez Ten и др. 2009; Tonni и др. 2005). Wang и др. (2007) сообщили, что 2-DUS плюс 3-DUS значительно улучшают пренатальную диагностику расщепления нёба (с 22,2% до 88,9%), по сравнению с одним только 2-DUS.
Несмотря на широкое использование ультразвука, немного известно о влиянии поверхностного ультразвукового изображения аномалий лица плода на родителей. Родителям, чей ребенок исследовался с помощью 3-D УЗИ на предмет аномалий губы и нёба во время беременности, после рождения ребенка было проведено анкетирование. Результаты показали, что 3-DUS не только улучшило точность диагностики расщелины губы и неба, но и привело к более глубокому пониманию и принятию пороков развития, чем при 2-DUS. 3-DUS оказывает положительное влияние и поддерживает родителей, что предполагает его регулярное использование в случаях изолированных аномалий губы и нёба плода (Escalon и др. 2010). Кроме того, Tonni и Lituania (2012) представили доказательства того, что методы 3-DUS реконструкции, такие как OmniView или другое доступное программное обеспечение могут быть использованы для изучения твердого и мягкого неба плода. Однако, необходимы дальнейшие перспективные исследования последовательных пациентов для того, чтобы определить, увеличится ли эффективность пренатальной диагностики расщелин лица при рутинном применение этого современного, реконструирующего слои, программного обеспечения, особенно в случаях изолированной расщелины неба (Рис. 6, 7).
Рис. 6. Фетальная нейросонография. Объем фетального мозжечка был рассчитан на 20 неделе беременности с использованием расширенной визуализации компьютерного анализа виртуального органа (XI VOCAL) 10 последовательных плоскостей.
Рис. 7. Оценка лица и неба плода, с использованием OmniView у нормального плода при сканировании во втором триместре беременности.
Кроме того, Tonni и Grisolia (2013) недавно сообщили о том, что мягкое нёбо и язычок лучше всего могут быть реконструированы с помощью 3-DUS рендеринга в поверхностном режиме, с последующей пост-обработкой с использованием HDlive, новой световой техникой для проектирования поверхностей, в которых рентгенолог устанавливает различные световые параметры для получения эффектов глубины, путем осветления и затемнения изображений (Kagan и др. 2011). С помощью этого приложения становится более доступной визуализация внутриутробного развития различных структур и, таким образом, врач может контролировать нормальное и нарушенное гестационное развитие плода в расширенной форме (Hata 2013; Hata и др. 2012a) (Рис. 8.).
Рис. 8. Визуализация твердого и мягкого нёба нормального плода при томографической ультрасонографии – сканирование во втором триместре беременности. (i – межнебный шов; m – верхнечелюстной отросток; ph – глотка; р -твердое небо, рр – крыловидный отросток; pns – задняя носовая ость; поперечная задняя ость; t – язык).
Tonni и др. (2013) сообщили о высокой точности OmniView в реконструкции ретроназального треугольника у 100 плодов низкого и 50 – высокого риска в первом триместре беременности. Авторы сообщили, что оптимальные наборы объемных данных были получены в 98% случаев, а ретроназальный треугольник был реконструирован в 96% случаев с помощью анализа в автономном режиме. Вторичное нёбо было успешно оценено в 93% случаев. Аномалии ретроназального треугольника были обнаружены в двух случаях летальной анеуплоидии в коронарной плоскости с частотой ложнопозитивных результатов 1,3%.
В таблице 2 приведены наиболее важные данные по оценке расщелины губы и расщелины губы/неба плода при использовании 3-DUS.
Таблица 2. Авторы исследования, исследуемая популяция, гестационный возраст, пренатальная ультразвуковая техника и клинические результаты в случае обнаружения орофасциального расщепления
|
Авторы исследования |
Исследуемая популяция |
гестационный возраст (недели) |
Пренатальная ультразвуковая техника |
Клинические результаты |
|
Campbell и др. (2005) |
8 плодов с подозрением на расщепление лица |
3-DUS ‘‘reverse face’‘ техника |
Оценка губы плода и альвеолярного гребня с помощью 3-D поверхностного рендеринга во фронтальной плоскости и ротацией лица на 180º по вертикальной оси, для оценки вторичного нёба |
|
|
Tonni и др. (2005) |
1856 беременностей низкого риска |
19–23 |
3-DUS |
Фетальный профиль визуализирован в 100%, 87% при первичном осмотре с использованием 3-DUOS; обнаружено 2 случая CL/CLP |
|
Platt и др. (2006) |
50 здоровых плодов |
33 |
3-DUS ‘‘flipped face’‘ техника |
Оценка лица плода в положении плода на спине; исследование статического 3-D объема, 90º вращение; плоскости исследования расположены в порядке от подбородка до носа; объемные проекции затем прокручиваются от подбородка до носа, для оценки непрерывности строения нижней губы, нижней челюсти, альвеолярного гребня, языка, верхней губы, верхней челюсти, твердого и мягкого нёба; частота визуализации 100% |
|
Pilu и Segata (2007) |
15 здоровых плодов,1 плод с CLP |
19–28 33 |
3-DUS исследование под углом |
Чтобы избежать акустического затенения от альвеолярного отростка, вторичное нёбо исследуется под углом 45º в сагиттальной плоскости; 3-DUS используется для реконструкции аксиальной и коронарной плоскостей |
|
Martinez-Ten и др. (2009) |
50 здоровых плодов, 10 плодов с CLP |
20–33 |
Техника косой проекции лица в сравнении с техниками ‘‘reverse face’‘ и ‘‘flipped face’‘ |
Вначале, лицо отображается в среднесагиттальной плоскости; осевой плоскости для включения неба и затем перпендикулярно к этой поверхности; при этом профиль отображается в краниально-каудальном направлении; коронарная плоскость прокручивается и поворачивается через всю длину и ширину неба, полученного в косой проекции лица, корректность определения нормального нёба – 86% случаев; расщелины с участием твердого неба – в 100% случаев; расщелины мягкого неба выявлены лишь в 14% из 7 случаев, при этом расщелины вторичного неба, которое было принято за нормальное, получены в 26% с использованием техники косой проекции лица |
|
Tonni и Lituania (2012) |
– |
Второй и третий триместр |
‘‘Omniview’‘ объемная реконструкция |
Иллюстрированное эссе, которое отражает клиническое значение переформатирования наборов объемных 3-DUS данных в случаях орофациального расщепления |
3-DUS = 3-D ультразвуковое исследование; CL = заячья губа; CLP = расщелина губы и нёба
РОЛЬ 3-DUS В ИЗУЧЕНИИ ЧЕРЕПНЫХ ШВОВ И РОДНИЧКОВ
Несмотря на огромный прогресс, который был достигнут в пренатальной диагностике с помощью 2-DUS в течение последних нескольких десятилетий, визуализация швов и родничков остается сложной задачей. Поскольку идентификация краниосиностозов может иметь важное значение для пренатального скрининга в случаях семейного анамнеза синдрома, связанного с краниосиностозом, правильная пренатальная диагностика имеет важное значение. В исследовании, проведенном Dikkeboom и др. (2004) 120 плодов в четырех разных гестационных сроках беременности, и поверхностный режим, и максимальный режим оказались одинаково эффективными в выявлении швов и родничков плода на протяжении всей беременности. Наиболее трудным было отображение стреловидного шва и заднего родничка, в то время как лобный шов и передний родничок были лучше всего видны при сагиттальном сканировании. Задний родничок часто не определяется ни в одном из режимов сканирования. Однако при включении 3-DUS сканирования задней части головы, могут быть визуализированы более четко задний родничок, ламбдовидный шов и, возможно, даже стреловидный шов. Кроме того, при сравнении точности 2-DUS и 3-DUS в изучении черепных швов и родничков на 15-16 неделях беременности, Ginath и др. (2004) утверждают, что 3-DUS, является более эффективным методом, чем 2-DUS для отображения стреловидного шва (50 [100%] против 35 [70%], р≤0,001) (Рис. 9).
Рис. 9. Максимальный режим поверхностного рендеринга в визуализации черепных швов и родничков у нормального плода при сканировании в первом триместре беременности.
3-DUS И ФЕТАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
Пренатальное выявления врожденных пороков сердца (ВПС) по-прежнему представляет собой одну из самых сложных задач для сонографии во время обычного сканирования во втором или третьем триместре. Одной из главных трудностей в изучении сердца плода с помощью обычного 2-DUS является визуализация и интерпретации путей оттока главных артерий. RADIUS исследование показало, что врачи в центрах ниже четвертого уровня были неспособны обнаружить ВПС в популяции 15 000 женщин с низким уровнем риска (Crane и др. 1994). Проблема может быть описана следующим образом: хотя четырехкамерный вид используется в течение многих лет в качестве первичного скринингового изображения для обнаружения ВПС, включение правого и левого путей оттока увеличивает частоту обнаружения пороков развития сердца от 30% до 80%-90%. Nelson и др. (1996) и Deng и Rodeck (1996) были одними из первых, кто разработали новый метод стробирования для 3-DUS и 4-DUS реконструкции для клинически значимых изображений сердца, основанных на обычном 2-DUS в реальном времени. При этом определялись частота сердечных сокращений плода и определенные временные точки сердечного цикла, которые затем использовались для синхронизации данных изображения для перепроецирования в объем в соответствующей фазе сердечного цикла. Эти авторы обнаружили, что перегруппировка этих фазированных 3-D изображений в циклическую последовательность позволяет выявлять динамические и пространственные соотношения между камерами, миокардом, клапанами и крупными сосудами. Трехмерное УЗИ позволяет врачу получить объем данных, которым можно манипулировать вдоль х- и у- оси с использованием опорных точек с четырехкамерной проекции, пятикамерной проекции и трехсосудистой проекции на уровне бифуркации легочной артерии, а также трехсосудистой проекции на уровне поперечной дуги аорты и трахеи (DeVore и др. 2004; Yagel и др. 2001). Это может быть достигнуто с помощью 3-D многоплоскостной визуализации сердца плода, статическим 3-D (без движения сердца) или методом STIC. STIC представляет собой программное приложение, которое позволяет получать наборы данных объемов сердца и сосудов плода, при этом изображения можно просматривать либо в многоплоскостном режиме или в режиме рендеринга. STIC предлагает несколько потенциальных преимуществ, в первую очередь, это возможность исследование анатомии и функции сердца в течение одного сердечного цикла и удаления артефактов движения в быстро бьющемся сердце плода (Deng и Rodeck 2006; Deng и др. 2000). Meyer-Wittkopf и др. (2001) собрали стробированные 3-D объемные данные для проверки возможности 3-D ручной техники в эхокардиографической оценки желудочковой волюмометрии у 29 здоровых плодов и 22 плодов с ВПС и обнаружили, что как у плодов с ВПС, так и плодов без ВПС, имел место экспоненциальный рост сердечных объемов во время беременности. Wang и др. (2002) сообщили, что среди основных кардиальных проекций у 23 нормальных плодов в передней позиции, 3-DUS улучшало визуализацию кровотока по легочной артерии, что обеспечивало надежной альтернативной методикой для клинического применения в сравнении с 2-DUS. Кроме того, 3-DUS в режиме реального времени является эффективным методом визуализации динамических 3-D поверхностей и реконструкции поперечных проекций, и предоставляет дополнительную информацию, особенно при использовании субкостального/субксифоидального доступа (Deng и др., 2000, 2002а).
Пространственно-временная корреляция изображений может быть реализована с помощью минимального режима проецирования, алгоритма рендеринга, который позволяет визуализировать сосуды и полостные анатомические структуры, которые расположены в разных плоскостях сканирования. Минимальный режим проецирования облегчает визуализацию нормальных и аномальных сосудистых анастомозов с сердцем плода на уровне трехсосудистой проекции. Эта методика оказалась эффективной в пренатальной диагностике конотрункальных аномалий и в оценке пространственных отношений аномальных сосудистых анастомозов в верхнем средостении (Espinoza и др. 2004).
Кроме того, получение диагностических плоскостей с помощью STIC в меньшей степени зависит от опыта оператора; при этом требуется меньше времени для выполнения исследования; анализ может быть выполнен после того пациент уже ушел; структуры могут быть оценены с использованием режима рендеринга; может быть оценена как морфология, так и функциональная составляющая (Bennasar и др. 2010a, 2010b; DeVore и др. 2003; Goncalves и др.2003; Vinals и др. 2003). Наконец, объемные изображения могут быть отправлены через Интернет в медицинские центры, которые специализируются на фетальной эхокардиографии (Vinals и др., 2005) (Рис. 10-12).
Рис. 10. Фетальная эхокардиография с использованием пространственно-временной корреляции изображения (spatiotemporal image correlation – STIC) с HD потоком, который показывает Situs Solitus (анатомическое расположение структур), четырехкамерная проекция и артериальный кровоток. ао – аорта; arco – протоковая дуга; adx – правое предсердие; asx – левое предсердие; ivc – нижняя полая вена; р – легочная артерия; st – желудок; vdx – правый желудочек; vp – легочная вена; vsx – левый желудочек.
Рис. 11. Фетальная эхокардиография с использованием пространственно-временной корреляции изображения (STIC). Четырехкамерная проекция с легочными венами, которые впадают в левое предсердие и визуализируются в верхней панели. То же изображение после постобработки с помощью HDlive. DAо – нисходящая аорта; LV – левый желудочек; RV – правый желудочек; VP – легочная вена.
Рис. 12. Фетальная эхокардиография с использованием STIC (пространственно-временной корреляции изображения). Четырехкамерная проекция и крупный артериальный тракт показаны с помощью постобработки HDlive. DAо – нисходящая аорта; LV – левый желудочек; RV – правый желудочек; VP – легочные вены.
Объемные данные регистрируются в 3-D статическом режиме или с использованием четырех измерений для наблюдения за 3-D сокращением сердца в течение одного полного сердечного цикла. Диагностическая мощность 4-D эхокардиографии вытекает не только из улучшенных реконструированных изображений в поперечной проекции 4-D наборов данных, которые практически свободны от артефактов движения, но также и с генерированием 3-D/4-D изображений, напоминающих картину, которую видят хирурги во время операции (Deng и Rodeck 2004). При реконструкции стандартных четырех и пятикамерных проекций, а также трехсосудистой и проекции на уровне трахеи из цветных данных STIC, Chaoui и др. (2004) получили диагностическую точность 88,5% у здоровых плодов и – 88,8% плодов с патологией. Тем не менее, наблюдались и неблагоприятные окна/углы визуализации объемов у плодов, исследуемых после 29 недель беременности. 3-DUS в режиме реального времени имел высокую чувствительность для обнаружения ВПС (93%) и низкую специфичность (45%), с высоким уровнем ‘‘неопределенных’‘ результатов и ложно-положительных артефактов между четырьмя исследователями при использовании одного объема сканирования (Sklansky и др. 1999, 2005). При использовании восстановленного изображения, сонографист может оценить внутрисердечную анатомию на разных глубинах и может воссоздать слепки кровотока через камеры и крупные сосуды (Deng и др. 2002b; DeVore 2005). Цветная STIC доплерография позволяет отображать объемные данные исследуемого сердца плода в качестве кинопетли в течение одного сердечного цикла. Кроме того, цветная STIC доплерография может упростить визуализацию кровеносных сосудов и улучшить эффективность оценки местоположения и степени дефекта межжелудочковой перегородки, а также провести 3-D оценку регургитационных и венозных потоков на уровне овального отверстия (Goncalves и др. 2004c). Ограничения этого приложения могут включать в себя невозможность использования в начале или конце беременности из-за низкой дискриминации сигналов. Кроме того, сигналы, распространяющиеся перпендикулярно исследуемым структурам, не отображаются в цветном доплеровском сигнале, чего следует избегать во время исследования объемов (Chaoui и др. 2004).
Goncalves и др. (2004b) были первыми, кто продемонстрировал возможности 4-D в серой шкале и энергетической STIC доплерографии в рутинной визуализации аномального расположения кровеносных сосудов у плодов с транспозиции магистральных артерий, с получением объемных изображений, которые требуют только четкой визуализации апикальной четырехкамерной проекции при 2-D ультразвуковом исследовании от 7,5 до 15 с. Yagel и др. (2005) подтвердили точность 4-D цветного допплеровского ультразвукового исследования с использованием STIC в оценке дефектов межжелудочковой перегородки плода. Goncalves и др. (2005b) установили клиническую эффективность STIC 4-D данных и склоняются к необходимости проведения соответствующей подготовки для исследования согласования между двумя независимыми исследователями и воспроизводимости метода STIC для отображения стандартных кардиологических проекций кровеносных сосудов левого и правого желудочков путем анализа 20 наборов объемных данных удовлетворительного качества. Acar и др. (2005) изучили 60 плодов в сроке от 22 до 34 недель гестации с использованием датчика на основе как Biplane, так и Live 3-D визуализации. У 16 плодов, сердце плода имело морфологические аномалии (гипоплазия левого желудочка у 4, тетрада Фалло у 2, аномалия Эбштейна у 2, рабдомиома у 2, гипоплазия правого желудочка сердца у 1) или дисфункции миокарда (5 плодов). 3-D эхокардиография в режиме реального времени выполнялись сердечным датчиком 2-4 МГц. Acar и др. (2005) пришли к выводу, что 3-D эхокардиография в режиме реального времени является доступным и нетрудоёмким методом, позволяющим провести мультипланарное сканирование, что дает новую 3-D картину внутренней структуры сердца плода. Виртуальные ‘‘слепки’‘ сердца плода с использованием Live 3-D объемных наборов данных, обработанных с помощью полуавтоматической программы, позволили провести четкую визуализацию последовательных соединений и пространственных отношений структур в 84% случаев (McDonald и др. 2005). Кроме того, виртуальный ‘‘слепок’‘ всего сердца обеспечивает более простыми данными для детальной мультипланарной оценки, чем обычная поверхностная 3-D визуализация (Deng и Rodeck 2006).
Тем не менее, до сих пор существуют ограничения в отношении точного кардиального стробирования при STIC, что обусловлено в основном вариацией частоты сердечных сокращений плода во время получения объемных данных (7-15 с) (Deng и др. 2003). На самом деле, необходимость стробирования определяется путем прямого объемного сканирования; прямое объемное сканирование относится к любому объему сканирования, в котором исследуемый объем сканируется с достаточным масштабом, объемной частотой изображения (то есть временным разрешением) и пространственным разрешением (Deng и Rodeck 2006).
DeVore и Polanko (2005) сообщили, что сосудистые структуры сердца плода (четырехкамерная, пятикамерная, трехсосудистая проекции и проекция трахеи) могут быть идентифицированы с использованием TUI – tomographic ultrasound imaging (томографической ультразвуковой визуализации) у плодов между 13 и 40 неделями беременности. Плоды с тетрадой Фалло, транспозицией магистральных сосудов и стенозом легочной артерии – все имеют признаки аномальной сердечной анатомии при TUI. TUI представляет собой программное приложение пост-обработки, которое позволяет любой полученный 3-D набор объемных данных (полученный либо в серой шкале, либо цветной доплерографии или STIC) автоматически представить в виде срезов и отобразить в виде нескольких изображений на экране (DeVore и др. 2005; Espinoza и др. 2006; Goncalves и др. 2006). С помощью приложения TUI, 3-D объем можно разделить на девять изображений, а расстояние между срезами (0,5-10 см) могут быть выбраны в соответствии требованиями исследования. Используя 4-D УЗИ с STIC техникой, цветную допплерографию и оффлайновый анализ TUI стандартизированной начальной плоскости (четырехкамерная проекция, начиная от простого 2-D ориентира сердца), Turan и др. (2009) реконструировал четырехкамерную проекцию; сердечную ось, размер и симметрию; желудочковые клапаны; магистральные артерии и нисходящую аорту в 89,7%-99,1% случаев в сроке от 11 до 13 недель беременности. Четырехмерная эхокардиография плода с STIC может быть использована с VOCAL (с 15º-30º углами поворота) и режимом инверсии для оценки функции сердца плода. С помощью этого приложения, средний ударный объем был определен в диапазоне от 0,78 см3 в середине беременности, до 5,5 см3 в срок родов, в то время как фракция выброса оставалась достаточно стабильной в течение беременности (Messing и др. 2007), а также правый и левый сердечный ударный объем и сердечный выброс увеличивались с гестационным возрастом, со средними значениями 0,02 мл, 0,01 мл, 2,39 мл/мин и 1,80 мл/мин в сроке 12 недель; 0,30 мл, 0,32 мл, 43,46 мл/мин и 46,72 мл/мин в сроке 20 недель; 2,07 мл, 2,67 мл, 284,71 мл/мин, и 365,99 мл/мин в сроке 34 недель, соответственно (Molina и др., 2008). При этом наблюдалось экспоненциальное увеличение ударного объема и сердечного выброса, в то время как фракция выброса оставалась практически постоянной (Simioni и др. 2011). Для сравнения 2-DUS и 3-DUS эхокардиографии, Tonni и др. (2009) оценивали возможность включения объемной 3-D реконструкции сердечной анатомии и доплероангиографии магистральных сосудов при рутинном сканировании беременности во втором триместре в популяции с низким уровнем риска. Tonni и др. (2009) выявили, что визуализация легочных вен, венозного протока и нижней полой вены значительно улучшилась с помощью 3-DUS по сравнению с 2-DUS. Авторы пришли к выводу, что эхокардиографическое обследование с использованием 3-DUS может быть включено в стандартный протокол сканирования во втором триместре беременности. Другой вывод был сделан Wanitpongpan и др. (2008), который отметил, что использование STIC общим акушером для оценки фетальных сердечных структур на 17- 21 неделях беременности имеет предельную клиническую эффективность по сравнению с 2-D сканированием фетальным эхокардиографистом, что предполагает необходимость технического усовершенствования операторов исследования для того, чтобы расширить использование 3-DUS в программе скрининга сердца плода. Xiong и др. (2012a, 2012b) обнаружили, что качество изображения 3-D эхокардиограмм в режиме реального времени аналогично изображениям, полученным с помощью STIC в сагиттальной проекции и превосходит полученные с помощью STIC в четырехкамерной проекции. При этом 3-D эхокардиография в режиме реального времени не имеет артефактов движения, что имеет потенциал для увеличения частоты обнаружения фетальных дефектов межжелудочковой перегородки.
Несмотря на это, STIC и VOCAL могут быть использованы для расчета сердечного объема. Uittenbogaard и др. (2010a, 2010b), Herberg и др. (2011) и Hamill и др. (2011) сообщили, что визуализация структур сердца плода и волюмометрия, с использованием STIC и VOCAL, является надежным и точным методом для расчета объемов 30 мл и больше, как в естественных условиях, так и в эксперименте. Несмотря на то, что необходимо соблюдать осторожность в настройках при расчете структур сердца как для детей, так и взрослых, Rolo и др. (2013) сообщили о средней площади трикуспидального и митрального клапанов в диапазоне от 0,19 до 0,20 см2 в сроке 18 недель, и от 0,93 до 1,06 см2 в сроке 33 недель беременности, соответственно. Кроме того, было обнаружено, что референсный интервал для межжелудочковой перегородки плода коррелирует с гестационным возраста (r = 0,81), и увеличивается с 0,47 см2 при 18 недельного сроке до 2,42 см2 в сроке 33 недель беременности соответственно (Nardozza и др. 2013 ). Совсем недавно Araujo Junior и др. (2014b) сообщили, что 4-D эхокардиография плода в режиме рендеринга позволяет визуализировать виртуальные плоскости межпредсердной и межжелудочковой перегородки и кольцо атриовентрикулярного клапана.
При применении режима инверсии или B-потока при 4-D рендеринге магистральных артерий сердца мы получаем ‘‘цифровые слепки’‘, которые отражают пространственные соотношения и связи между крупными артериями и камерами желудочков. Эти детали не могут быть визуализированы с помощью обычного 2-DUS (Goncalves и др.2005a; Hata и др.2008.). Кроме того, было обнаружено, что в режиме B-потока, экстракардиальные сосуды, такие как аорта, легочная артерия, артериальный проток, нижняя полая вена и венозный проток могут быть обнаружены на реконструированных изображениях. Четырехмерная эхокардиография в режиме B-потока и STIC определяет ‘‘цифровые слепки’‘ кардиальных участков магистральных артерий и вен, впадающих в сердце, что позволяет оценить екстракардиальную гемодинамику плода во втором и третьем триместрах беременности (Hongmei и др. 2012; Zhang и др.2010). В-поток отображает кровоток в серой шкале, и так как это не доплеровский метод, никакие скорости не измеряются. В режиме В-потока передаются широкополосные импульсы с цифровым кодированием, а затем отражаются от движущихся клеток крови. Отраженные эхо-сигналы декодируются и фильтруются для повышения чувствительности, для того чтобы обнаружить сигнал перемещения, а кровь отличить от окружающей ткани. Самый полезный диагностический аспект 4-D эхокардиографии в режиме B-потока является его способность различать границу между циркулирующей кровью и стенкой сосуда с высокой точностью (Deane 2000). Volpe и др. (2010) сообщили, что 4-DUS в режиме B-потока и STIC облегчает визуализацию и детальное изучение анатомических особенностей дуги аорты, в том числе визуализацию сосудов шеи, таким образом, предоставляя дополнительную информацию в сравнении с 2-DUS.
При изготовлении матричных датчиков, используется лазер для резки пьезоэлектрического кристалла на множество одинаковых по размеру квадратных элементов, которые образуют элемент матрицы. Эти элементы расположены на верхушке датчика таким образом, что они находятся в тесном контакте с поверхностью тела для легкой передачи и приема ультразвуковых импульсов. Каждый отдельный элемент может генерировать ультразвуковой луч в любом направлении. Определяя соответствующим образом ультразвуковой луч для каждого отдельного элемента, можно создать пирамидальной формы объемный ультразвуковой луч с углом раскрытия между 6º и 100º. С недавних пор стал доступным матричный датчик, который позволяет одновременно визуализировать объекты в двух плоскостях, ориентированных в разных направлениях, с одинаковой степенью разрешения. Изображения отображаются на экране, разделенном на две части: исходная плоскость находится в левой стороне, в то время как на правой стороне находится одна из альтернативных плоскостей сканирования, которые оператор может визуализировать с использованием другой ориентации ультразвукового луча в пространстве (осевые плоскости, сагиттальные плоскости или вращение) (Рис. 13а, б.)
Рис. 13. (А) Фетальная эхокардиография с использованием матричного датчика: стандартная четырехкамерная проекция и магистральные артерии визуализированы с помощью методики хPLANE. Обратите внимание, вертикальная линия пересекает правый желудочек, трехстворчатый клапан, межжелудочковую перегородку, митральный клапан и левый желудочек соответственно. (В) Четырехмерная сонограмма показывает четырехкамерную проекцию.
Live 3-D твердоматричная УЗИ технология обеспечивает разрешение в реальном масштабе времени около 25 Гц (объем/с) (Deng и Rodeck 2006; Deng и др.. 2002а, 2003; Sklansky и др, 1999). Эхокардиографические обследования 151 плодов, в том числе 4 с подозрением на ВПС, были проведены Xiong и др. (2009) с использованием матричного датчика с помощью live xPLANE техники. Сердце плода было визуализировано в четырехкамерной проекции, с расположением позвоночника плода на 6 часах и верхушкой на 12 часах. После того, как опорная линия на первичной плоскости изображения (четырехкамерной проекции) перемещается, вспомогательная плоскость изображения, которая пересекает опорную линию, отображается на правой стороне экрана. По умолчанию, вспомогательная плоскость вращается на +90º по отношению к базовой плоскости. Межжелудочковая перегородка была успешно визуализирована в 150 (99,3%) случаях с использованием live xPLANE техники, в том числе 82 (54,3%) плодов в задней позиции и 68 (45,7%) плодов – в передней. Межжелудочковая перегородка была визуализирована у всех плодов с ВПС (Xiong и др. 2009).
Yuan и др. (2011) определили доступность и надежность хPLANE техники в режиме реального времени для оценки одновременно четырехкамерной проекции и проекции магистральных сосудов левого желудочка у 145 плодов между 11 и 37 неделями беременности, в том числе 29 плодов с ВПС. Четырехкамерную проекцию оценивали из трех позиций: подреберной (верхушка на 3 или 9 часах), верхушечной (верхушка на 12 или 6 часах) и промежуточной – между подреберной и верхушечной позициями. При использовании функции вращения с учетом четырехкамерной проекции в качестве базовой плоскости, проекция магистральных сосудов левого желудочка одновременно отображается на вторичной плоскости изображения и успешно визуализируется в 95,1% случаев после 14 недель беременности (Yuan и др. 2011). Xiong и др. (2013) описал сравнительно простой метод визуализации протоков и дуги аорты с использованием live xPlane техники. Оценка протоковой дуги в обнаружении конотрункальных аномалий с помощью live xPlane была проведена у 200 плодов, из которых 152 были нормальными, 27 имели конотрункальные аномалии и 21 имели признаки других ВПС. Аномальный вид протоковой дуги был получен в 92,6% плодов с конотрункальными аномалиями в сравнении с плодами без ВПС (23,8%).
Кроме того, использование 4-D эхокардиографии и телемедицины могут быть полезны при офф-лайн анализе наборов объемных данных фетального сердца с помощью дистанционной консультации в третичных центрах медицинской помощи (Yagel и др. 2011). Объемные объекты могут быть изучены и проанализированы с использованием секционных плоскостей в среднем в течение 11,0 мин (диапазон: 2.5-30.0 мин) и со средним доверительным балом 4.0 (диапазон: 1,0-5,0) между экспертами (Adriaanse и др.2012.).
Совсем недавно, Yeo и Romero (2013) разработали фетальную интеллектуальную навигационную эхокардиографию (fetal intelligent navigation echocardiography – FINE) – метод для быстрого, простого и автоматического обследования сердца плода с использованием диагностических плоскостей согласно данным практического руководства Американского института ультразвука в медицине (AIUM 2011). После того, как семь анатомических структур сердца плода будут распознаны, система автоматически поворачивается, совмещает данные, разделяет на плоскости и определяет масштаб объемных данных для одновременного отображения девяти сердечных диагностических плоскостей в одном шаблоне. Однако, сложная анатомии сердца плода может потребовать дополнительного исследования данной диагностической плоскости, для чего разработана новая техника (VIS-Assistance). Это программное обеспечение позволяет проводить оператор-независимое сонографическое наведение и исследовать окружающие структуры в необходимой диагностической плоскости сердца; оно также обеспечивает автоматическую маркировку диагностических плоскостей, частей плода и краниального и каудального концов. Время, необходимое для наблюдения всех девяти VIS-Assistance видеозаписей – 15 мин 27с.
FINE метод был протестирован на 51 наборах объемных данных нормального сердца плода (19.5-39.3 недель беременности) и в 4 случаях доказанного ВПС (коарктация аорты, тетрада Фалло, транспозиция магистральных сосудов и легочная атрезия с неповрежденной межжелудочковой перегородкой) соответственно. Тем не менее, даже учитывая тот факт, что FINE метод был в состоянии выявить признаки аномальной анатомии сердца во всех четырех случаях с патологией, Yeo и Romero (2013) рекомендуют использовать FINE метод в качестве вспомогательного средства для обследования плода в популяциях с низким уровнем риска, но не для диагностики специфических ВПС. В таблице 3 приведены наиболее важные статьи по фетальной эхокардиографии с помощью 3-DUS/4-DUS.
Таблица 3. Авторы исследования, исследуемая популяция, гестационный возраст, пренатальная ультразвуковая техника и клинические результаты в случае внутриутробной 3-D/4-D эхокардиографии
|
Авторы исследования |
Исследуемая популяция |
Гестационный возраст (недели) |
Пренатальная ультразвуковая техника |
Клинические результаты |
|
Chaoui и др. (2004) |
34 здоровых и 27 плодов с врожденной патологией сердца |
18–35 |
STIC с цветной доплерографией |
Четырехкамерный, пятикамерный и трехсосудистый вид и трахея могут быть получены у 31/35 здоровых и 24/27 плодов с врожденной патологией сердца |
|
Messing и др. (2007) |
100 здоровых и 6 плодов с врожденной патологией сердца |
20+5–40 |
STIC с VOCAL (15º) и режимом инверсии |
ЛЖКД колебалась от среднего значения 0,53 см3 в середине беременности до среднего значения 3,96 см3 в срок родов; ЛЖКС колебалась от среднего значения 0,17 см3 в середине беременности до 1,56 см3 в срок родов; ПЖКД колебалась от среднего значения 0,68 см3 в середине беременности до среднего значения 5,44 см3 в срок родов; ПЖКС колебалась от среднего значения 0,26 см3 в середине беременности до 2,29 см3 в срок родов |
|
Molina и др. (2008) |
140 здоровых плодов |
12–34 |
STIC с VOCAL (30º) |
Ударный объем левого и правого желудочка увеличивался в геометрической прогрессии со сроком беременности, с соответствующим средним значением 0,02 мл, 0,01 мл, 2,39 мл/мин и 1,80 мл/мин при 12 недельном сроке, до 0,30 мл, 0,32 мл, 43,46 мл/мин и 46,72 мл/мин при 20 недельном сроке и 2,07 мл, 2,67 мл, 284.71 мл/мин и 365,99 мл/мин в 34 недели |
|
Turan S и др. (2009) |
107 беременностей с низким уровнем риска |
11–13+6 |
(1) Четырехкамерный вид; (2) STIC с цветной допплерографией; (3) TUI; (4) фетальная анатомия сердца |
Минимум три 3-D объема полученны для каждого пациента, трансабдоминально в 91,6%; артефакты движения плода требуют получения более трех объемов в 20%; среднее время для TUI офф-лайн анализа было 100 с (диапазон: 60-240 с); индивидуальные анатомические особенности идентифицировались в 89,7% -99,1%; визуализация всех структур в одной плоскости наблюдалась у 91 пациентов (85%) |
|
Simioni и др. (2011) |
265 здоровых плодов |
20–34+6 |
STIC с VOCAL (30º) |
Ударный объем левого и правого желудочка и сердечный выброс экспоненциально увеличивались со сроком беременности и фракция выброса оставалась достаточно стабильной в течение беременности; среднее значение ударного объема левого и правого желудочка увеличилась с 0,211 и 0,220 мл в 20 недель, до 1,925 и 2,043 мл, соответственно, в 34 недели; среднее значение сердечного выброса левого и правого желудочка увеличивалось с 30,25 и 31,52 мл / мин в сроке 20 недель, до 268.49 и 287.80 мл / мин, соответственно, в 34 недели; фракция выброса как левого, так и правого желудочка оставалась постоянной на уровне около 0,63 с увеличением гестационного возраста |
|
Espinoza и др. (2010) |
90 здоровых плодов и с врожденной патологией сердца |
18–26 |
Данные 7 центров в оценке сердечно-сосудистой патологии с использованием STIC |
В целом, средняя (диапазон) чувствительность, специфичность, положительные и отрицательные прогностические значения и ложно- позитивные и негативные частоты для идентификации плодов с сердечно-сосудистой патологией были 93% (77% -100%), 96% (84% -100%), 96% (83% -100%), 93% (79% – 100%), 4,8% (2,7% -25%) и 6,8% (5% -22%), соответственно. Наиболее частой патологией были конотрункальные аномалии (36%); отличная межцентровая корреляция (к = 0.97) |
|
Yeo и др. (2011b) |
50 здоровых плодов |
15+3–40 |
Четырехкамерный вид и ‘‘swing technique’’ (FAST)) эхография для визуализации стандартных диагностических плоскостей при фетальной эхокардиографии из набора данных объемов, полученные при STIC и обработаные с OmniView |
Протоковая дуга, легочная артерия, три сосуда и трахея и пятикамерная плоскость, проекция длинной оси аорты и четырехкамерная картина были получены в 100% случаев (за исключением трехсосудистой картины и трахеи, которая был отмечена в 98%); ‘‘swing technique’’ была способна генерировать трехсосудистую проекцию и трахею, пятикамерные картины и / или проекцию длинной оси аорты, четырехкамерный вид и желудок в 100% обычных случаев |
|
Yeo и др. (2011a) |
50 здоровых плодов |
15+3–40+4 |
Техника STAR: Три линии сечения через четыре камеры сердца, содержат STIC наборы данных объемов, установленных для отображения сердечного кровотока. 1 линия: желудочковая перегородка напротив обоих больших сосудов (легочной артерии спереди от аорты) 2 линия: легочная артерия с продолжением в продольную проекцию протоковой дуги 3 линия: длинная ось аорты, которая выходит из левого желудочка |
Техника STAR была способна генерировать плоскости, во всех 50 обычных случаях; в случаях патологии, STAR методика позволяет идентифицировать дефект межжелудочковой перегородки, аномалии больших сосудов и отображать картины, которые отклоняются от того, что ожидается от обследования при нормальном сердце |
|
Rolo и др. (2013) |
328 здоровых плодов |
18–33+6 |
STIC в режиме рендеринга |
Средние площади трикуспидального и митрального клапанов варьировали от 0,19 ± 0,08 и 0,20 ± 0,10 см2 в 18 недель гестации, до 0.93±0.31 и 1.06±0.39 см2 в 33 недели, соответственно |
|
Nardozza и др. (2013) |
328 здоровых плодов |
18–33+6 |
STIC в режиме рендеринга |
Площадь межжелудочковой перегородки показала корреляцию с гестационным возрастом (r = 0,81); увеличение среднего значения от 0,47 ± 0,10 см2 в 18 недель, до 2,42 ± 1,13 см2 в 33 недели беременности |
ЛЖКД (ПЖКД) = левый (правый) желудочек на конец диастолы; ЛЖКС (ПЖКС) = левый (правый) желудочек на конец систолы; STIC = пространственно-временная корреляция изображения; STAR = простой прицельный артериальный рендеринг; TUI = томографическое ультразвуковое исследование, VOCAL = компьютеризированный анализ виртуального органа.
3-DUS В ОЦЕНКЕ ОБЪЁМА ОРГАНОВ ПЛОДА И ВЕСА ПРИ РОЖДЕНИИ
Оценка органов плода была одним из первых показаний применения 3-DUS в акушерстве. Это приложение было впервые описано в середине 1995 года в статье, опубликованной группой на кафедре акушерства и гинекологии национального университета медицины Ченг Кунга, Тайнань, Тайвань (Chang и др. 1997a, 1997c). Поскольку органы плода имеют неправильную форму, использование формулы для эллипсоида (длина * ширина * высота * 0,523) – единственно возможный вариант для 2-DUS, что приводит к значительным ошибкам при расчете 3-D объемов таких органов. Формула для эллипсоида (длина * ширина * высота * 0,523), традиционно используется при обычном УЗИ в акушерстве и гинекологии для оценки объемов нескольких структур, таких как матка и яичники (которые являются структурами правильной формы) (Leonhardt и др. 2014). Однако, в случаях когда должен быть рассчитан объем неправильной структуры, точность 2-DUS ниже, чем у 3-DUS, согласно данным лабораторных исследований (Riccabona и др. 1996). При исследовании в естественных условиях, Araujo Junior и др. (2007b) провели оценку объема фетальных легких у 51 нормального плода в сроке от 20 до 35 недель беременности путем сравнения 3-D (VOCAL) и 2-D (эллипсоид: длина * ширина * высота * 0,523) методов. Эти авторы наблюдали, что расчет с использованием 2-DUS завышает объемы легких по сравнению с расчётными данными с помощью 3-D VOCAL техники. Включение нового постоянного значения для 2-D методики расчета объема (объем правого фетального легкого: длина * ширина * высота * 0,152, объем левого фетального легкого: длина * ширина * высота * 0.167) привело к существенному множественному согласованию между 2-D и 3-D методиками расчета объема (Araujo Junior и др.2008.). Несмотря на это, основной целью этих исследований было определить новую константу для включения в 2-D ультразвуковую формулу для повышения ее точности, так как 3- DUS был дорогим и ограниченным методом в то время (Chang и др., 1997a, 1997c). В этих пионерских исследованиях, авторы использовали мультипланарный режим, который был первым методом, разработанным для оценки объемов органов плода. Мультипланарный режим позволяет оценить объем данной структуры, основанный на трех ортогональных плоскостях (осевой, коронарной и сагиттальной), которые представляют собой 3-D изображение. После выбора плоскости, внешняя поверхность структуры очерчивается и определяется ее площадь, в то же время одновременно курсор перемещается в другой плоскости для нового вычисления площади. Интервал между срезами выбирается оператором и, как правило, находится в диапазоне от 1,0 до 3,0 мм. После того, как измерения проведены, программа вычисляет области и выдает объем автоматически. По сравнению с мультипланарным режимом, VOCAl позволяет проанализировать структуры путем вращения вокруг заданной оси, при этом последовательные плоскости отображаются на экране. Границы структуры разделяются курсором, при этом структуры отграничиваются по их внешней поверхности с помощью ручного или сферического режимов. Угол поворота выбирается оператором и может быть 6º, 9º, 15º или 30º (ультразвуковое оборудование GE) или 12º, 18º или 30º (ультразвуковое оборудование Samsung). Если выбран угол поворота 6º, будет определено 30 последовательных плоскостей, в то время как, если выбран угол поворота 30º, будет определено только 6 последовательных плоскостей. После того как процесс вращения заканчивается, программа автоматически вычисляет объем с 3-D визуализацией структуры, которая отображается на экране. Мультипланарный и/или VOCAl режимы были использованы для оценки различных эмбриональных структур, таких как: легкие (Kalache и др. 2003), плацента (Nowak и др. 2008), плодные оболочки (Nardozza и др. 2010b) и мозжечок (Rutten и др. 2009). Основные преимущества VOCAL над мультипланарной техникой являются: более короткое время, необходимое для выполнения процедуры (Ruano и др. 2006b), необходимость в незначительной коррекции площади внешней поверхности в конце процесса расчета объема (Peralta и др. 2006). Chang и др. (2002c) было необходимо от 10 до 15 мин для того, чтобы вычислить объем руки плода, используя мультипланарной режим с интервалом 3,0 мм между срезами. Основным преимуществом мультипланарного метода является возможность его применение во всех типах 3-DUS оборудования с момента выпуска первого поколения (COMBISON 530, Kretztechnik, Ципф, Австрия) (Chang и др., 1997b).
VOCAL методика была использована для оценки объема плода в первом триместре беременности (Araujo Junior и др.2008; Barra и др.2013; Martins 2008; Martins и др.2009.), а также для расчета объемов различных органов плода, таких как: мозжечок, мозг, легкие, сердце, надпочечники и почки (Araujo Junior и др.2007a, 2007b, 2007c, 2008, Chang и др.2002a, 2003c; Roelfsema и др.2004; Werneck Britto и др.2009). Совсем недавно был представлен новый метод для оценки объемов органов плода в 3- DUS оборудовании производства Samsung (Сеул, Корея), а именно, компьютерный анализ виртуального органа (XI VOCAl). Этот метод заключается в разграничении от 5 до 20 последовательных плоскостных зон на экране (многосрезовая картина). Когда оператор разграничивает последнюю зону, система автоматически вычисляет объем и перестраивает структуру (Guimaraes Filho и др., 2007а). XI VOCAl был применен для оценки не только объема сердца плода (Barreto и др.2012.), но и для плодных оболочек, желточного мешка, эмбриона и плаценты (Araujo Junior и др.2010; Cheong и др.2010; Nardozza и др.2010b; Araujo Junior и др, 2011c). При этом была установлено хорошая воспроизводимость в лабораторных условиях (Barreto и др.2010) (Рис. 14).
Рис. 14. Энергетическая доплерография плаценты с использованием метода ‘‘сосудистой биопсии’‘. Отметки расположены на уровне базальной и хорионической пластинок плаценты. Программа автоматически рассчитывает значения сосудистых индексов.
Трехмерное УЗИ считается более точным, чем 2-DUS при расчете объема легких (Riccabona и др., 1996). Это имеет большое значение в пренатальной диагностике легочной гипоплазии, состояния, связанного с высокими показателями заболеваемости и смертности новорожденных. Легочная гипоплазия имеет частоту от 11 до 14 случаев на 10000 родившихся живыми в общей популяции (Laudy и Wladimiroff 2000) и характеризуется сокращением числа легочных клеток, бронхиального дерева и альвеол, с последующим уменьшением размеров и веса легких (Lauria и др.. 1995).
Фетальная волюметрия легких было проведена при помощи как мультипланарного, так и VOCAL методов, в нормальных условиях и условиях высокого риска развития легочной гипоплазии (Gerards и др.2006; Ruano и др, 2006b), несмотря на то, что VOCAl имеет некоторое преимущество по сравнению с мультипланарным методом. Оно заключается в способности включать небольшие порции легких, расположенные ниже купола диафрагмы и возможности изменения контура вдоль каждой плоскости (Peralta и др., 2006). Кроме того, VOCAl метод был более точен, чем мультипланарная техника при расчете объема легких у плодов с врожденной диафрагмальной грыжей (Ruano и др. 2006b). При использование VOCAl с 30º вращением, Peralta и др. (2006), а затем Werneck Britto и др. (2009) обнаружили, что средний объем легких плода увеличивается с гестационным возрастом от 0,6 до 4.6-6.3 мл в 12 недель, до 20.5-30 мл на 32 неделе, и от 9-12.5 см3 при 24 недельном возрасте, до 22-31.8 см3 при 32 неделях беременности. Кроме того, Ruano и др. (2009) сообщили о том, что соотношение наблюдаемого/ожидаемого общего объема легких плода, при измерении с помощью 3-DUS, было самым точным предиктором легочной гипоплазии и легочной гипертензии и, таким образом, перинатальной смертности.
Эмбриональные пороки развития почек часто обнаруживаются при ультразвуковых исследованиях во время рутинного пренатального сканирования, при этом оценка объема почек плода также может помочь в прогнозировании нарушения функции почек и способствовать улучшению дородового ведения и/или послеродового лечения. Yu и др. (2000) оценивали объем почки плода с использованием мультипланарного метода при 152 нормальных беременностях в сроке от 20 до 40 недель гестации. Средний объем почки плода колебался от 1.49-1.8 мл в 20 недель, до 1.63- 1,8 мл в 40 недель. При расчете объема почек плода с использованием VOCAL с 30º углом поворота, Tedesco и др. (2009) определили, что средний объем колебался от 4,5 см3 в 24 недели, до 12,1 см3 на 34 неделе, причем без каких-либо статистически значимых различий между двумя почками.
Те же результаты (от 4,0 см3 в 20 недель, до 44,9 см3 в 40 недель) были сообщены Yoshizaki и др. (2013). Chang и др. (2003) наблюдали тот факт, что объем печени плода при оценке по данным 2-DUS (краниокаудальный * переднезадний и латеролатеральный * 0,42) был значительно меньше, чем объем, определенной с помощью 3-DUS (мультипланарный метод). Кроме того, измерения объема печени плода, полученные с помощью 3-DUS, были более воспроизводимыми, чем полученные с помощью 2-DUS. С помощью полиномиальной регрессии была определена новая константа – 0,55, таким образом, объем печени плода, полученный с помощью 2-DUS, аналогичен полученному с помощью 3-DUS. Константа 0,42 определялась Gimondo и соавт. (1995) у 327 плодов в сроке от 20 до 40 недель беременности с использованием 2-DUS.
Boito и др. (2003) оценивали объем печени плода с помощью мультипланарного метода и его отношение к пупочному венозному кровотоку и уровню материнского гликозилированного гемоглобина (HbA1c), при беременности, осложненной сахарным диабетом I типа. Данные по 32 плодам матерей с сахарным диабетом были сопоставлены с данными в контрольной группе. Boito и др. (2003) наблюдали статистически значимое различие в объеме фетальной печени между плодами матерей с сахарным диабетом и контрольной группой (в среднем: 45,9 мл против 38,3 мл, соответственно). Dos Santos Rizzi и др. (2010) определили диапазон нормальных величин для объема фетальной печени, используя 3-DUS с новым мультипланарным методом. Эти авторы завершили продольное исследование, которое включало 250 измерений объема печени плода, сделанные во время 53 нормальных беременностей в сроке от 27 до 38 недель. Средний объем печени плода колебался от 43,5 см3 в 27 недель, до 130,5 см3 в 38 недель. Данная новая мультипланарная методика имела хорошую внутри- и межисследовательскую надежность.
Аномалии развития плода являются одной из основных проблем общественного здравоохранения во всем мире, которая оказывает существенное влияние как на промышленно развитые страны, так и развивающиеся. В 2004 году Всемирная организация здравоохранения (ВОЗ) оценила что из 130 миллионов детей, рожденных за год, около 20 миллионов имеют недостаточный вес. Из 4 миллионов смертей новорожденных, которые происходят каждый год, 60%-80% имеют низкую массу тела при рождении; эти дети чаще умирают, имеют перинатальную травму, имеют признаки плохого неонатального развития, развития инфекции и признаки когнитивного дефицита (Lawn и др. 2005). Двухмерная ультрасонография используется для оценки веса плода у миллионов беременных женщин каждый год. В отличие от массы тела при рождении, которая измеряется прямым путем, расчет массы плода является неточным, так как это измерение зависит от мастерства оператора в получении двух или более измерений плода, которые затем используются для расчета веса. Этот процесс может занимать много времени и средств в акушерской практике. Один систематический обзор 11 различных методов оценки веса плода пришел к выводу, что большие случайные ошибки являются важным препятствием для уверенного использования оценки веса плода в клинической практике, так как 95% доверительный интервал превышает 14% фактического веса при рождении в опубликованных исследованиях (Dudley 2005).
Альтернативным подходом для количественной оценки мягких тканей (жировой и мышечной ткани) может быть оценка объема конечности плода, с использованием 3-DUS (Khoury и др. 2009). В конце 1990-х годов, Chang и др. (1997b) оценивали точность оценки объема бедра плода с помощью 3-DUS при использовании мультипланарного метода для прогнозирования массы плода при рождении у 100 тайваньских женщин с одноплодной беременностью, для которых роды должны были пройти в течение ближайших 48 часов. Эти авторы обнаружили, что формула, основанная на расчете объема бедра плода, была эффективнее 2-DUS формулы в прогнозировании веса при рождении. Однако, мультипланарный режим отнимает много времени (10-15 мин) и имеет акустические тени вблизи суставов по краям конечностей, что затрудняет практическое использование этого метода в повседневной акушерской практике. Chang и др. (2002c) также впервые описал референсный диапазон для объема конечности плода с помощью 3-DUS в перекрестном исследовании 206 тайваньских женщин с одноплодной беременностью в сроке от 20 до 40 недель. Фетальный объем верхней конечности измеряли с помощью мультипланарного метода (3,0 мм интервал между плоскостями), при этом получен средний объем от 6,31 мл на 20 неделе, до 74,63 мл на 40 неделе. Используя этот метод, Chang и др. (2003b) сообщил, что средний объем бедра плода колебался от 8.99 мл в 20 недель, до 128.89 мл в 40 недель. Точная оценка массы плода при рождении играет ключевую роль в планировании оптимальной акушерско-перинатальной помощи при работе с недоношенными, задержкой внутриутробного развития и/или ускоренным ростом плода. Song и др. (2000) разработал модифицированный мультипланарный подход, основанный на использовании трех стандартных плоскостей (продольная через среднюю точку бедренной кости и через две другие точки на расстоянии 4 мм от его проксимального и дистального концов). Авторы обнаружили, что при этом методе затрачивалось меньше времени (2 мин) и он превосходил 2-DUS в прогнозировании массы тела плода при рождении. Lee и др. (2001) предложил термин фракционный объем конечности, который определяется как 50% от объема центральной части конечности, плеча и/или бедра, которая содержит наибольшее количество мягких тканей. Авторы также оценивали точность этой новой модели в прогнозировании веса при рождении у 100 одноплодных беременностей с предполагаемым сроком родов в пределах 4 дней. Lee и др. (2001) сообщили, что формула, основанная на окружности живота и фракционного объема бедра была более точной (в пределах 5% от фактического веса) в прогнозировании веса при рождении, чем подход, предложенный Hadlock и др. (1985).
Schild и др. (2008) использовали как 2-DUS, так и 3- DUS измерения для прогнозирования массы тела при рождении плода весом ≤ 1600 г в случаях 150 одноплодных беременностей с предполагаемым сроком родов в пределах 7 дней. Органами, которые подвергались 3- DUS оценке и измерялись в мультипланарных режиме, были бедро и живот. Модель, основанная на бипариетальном диаметре, окружности головы, окружности живота, длине бедренной кости и объемах бедра и живота, оказалась лучше методики, основанной исключительно на 2-DUS измерениях бипариетального диаметра, окружности головы, окружности живота и длины бедренной кости, как описано ранее (Campbell и Wilkin 1975; Salomon и др.2011). 3-DUS измерения проводились таким же образом, как и измерения 2- DUS, но корректировка по ортогональным осям проводилась в соответствии с Lima и др. (2012).
Nardozza и др. (2010c) не удалось обнаружить статистически значимые различия между 2- DUS и 3-DUS расчетами с использованием трех различных моделей, основанных на 3-D объеме бедра плода, 3-D объеме плеча или и того и другого, после изучения 81 бразильских одноплодных беременностей с предполагаемым сроком родов в пределах 48 часов. Тем не менее, при одновременном 2- DUS и 3-DUS проведении измерений, была получена более точная масса плода при рождении, по сравнению с измерений только с помощью 2-DUS ультразвуковой методике (Nardozza и др. 2010a). Кроме того, Beninni и др. (2010) сообщили, что VOCAl с 30º углом поворота и мультипланарный режим с 3,0-мм интервалов срезов имеют высокую эффективность при оценке массы плода при рождении, а обе формулы, сгенерированные на основе этих методов, могут быть использованы как взаимозаменяемые.
При использовании 2-DUS для стандартной биометрии плода и 3-DUS для фракционного объема бедра, Yang и др. (2011) прогнозировали 69,5% и 95,3% от веса при рождении в пределах 5% и 10% от фактического веса при рождении, соответственно. Lee и др. (2009b) сообщили, что средний фракционный объем плеча варьировал от 1,9 мл в сроке 18 недель, до 48,8 мл на 42 неделе, в то время как средний фракционный объем бедра колебался от 3,4 мл на 18 неделе, до 115,8 мл на 42 неделе беременности. Таким же образом, Yang и др. (2011) прогнозировали 69,5% и 95,3% от веса при рождении в пределах 5% и 10% от фактического веса при рождении, соответственно.
Используя недавно разработанную методику, основанную на XI VOCAL, Cavalcante и др. (2011) обнаружили, что объем плеча плода в бразильской популяции колебался от 4,59 см3 в 20 недель, до 53,87 см3 в 40 недель. В клинической серии 425 здоровых беременностей, Araujo Junior и др. (2011а) определили диапазон эталонных значений для объема бедра плода (от 8,0 см3 в 20 недель, до 122.1 см3 в 40 недель).
Nardozza и др. (2012) сравнили мультипланарную (5,0-мм интервал срезов) и XI VOCAl (5º, 10º, 15º и 20º ротация) методики в оценке объемов конечностей плода у 40 нормальных плодов в сроке от 20 до 40 недель беременности, но не выявили каких-либо статистически значимых различий.
В таблицах 4 и 5 обобщены наиболее важные статьи, касающиеся оценки внутриутробного объема органов и оценки массы тела плода при рождении, при использовании 3-DUS.
Таблица 4. Авторы исследования, исследуемая популяция, гестационный возраст, пренатальная ультразвуковая техника и клинические результаты в случае определения объемов органов плода при 3-DUS
|
Авторы исследования |
Исследуемая популяция |
Гестационный возраст (недели) |
Пренатальная ультразвуковая техника |
Клинические результаты |
|
Chang и др. (1997c) |
50 здоровых плодов |
20–30 |
Фетальный объем сердца с использованием мультипланарного метода с 1,0-мм интервалом |
Фетальный объем сердца был выше при 2-DUS, чем при 3-DUS; получена новая константа (0,45) для включения в 2-D эллипсоидную формулу |
|
Chang и др. (1997c) |
55 здоровых плодов |
20–31 |
Фетальный объем печени с использованием мультипланарного метода с 2,0-мм интервалом |
Фетальный объем печени был меньше при 2-DUS, чем при 3-DUS; получена новая константа (0,55), для включения в 2-D эллипсоидную формулу |
|
Yu и др. (2000) |
152 здоровых плодов |
20–40 |
Фетальный объем почек с использованием мультипланарного метода с 1,0-мм интервалом |
Средний фетальный объем правых почек варьировался от 1,49 мл при 20 недельном сроке до 1,63 мл на 40 недельном сроке; средний фетальный объем левых почек варьировался от 1,8 при 20 недельном сроке до 17,1 мл при 40 недельном сроке |
|
Peralta и др. (2006) |
650 здоровых плодов |
12–30 |
Фетальный объем сердца и легких с использованием метода VOCAL с 30º |
Среднее левое и правое фетальные легочные объемы увеличивались с гестационным возрастом с 0,6 и 0,6 мл на 12 неделе до 4,6 и 6,3 мл на 20 неделе, 20,5 и 30,0 мл на 32 неделе; объем сердца плода увеличивался с гестационным возрастом, со средними значениями 3,09 мл в 20 недель, 9,18 мл в 26 недель и 24,89 мл в 34 недели |
|
Araujo J unior и др. (2007a) |
52 здоровых плодов |
20–32 |
Фетальный объем мозжечка с использованием метода VOCAL с 30º |
Уравнение для объема мозжечка плода определено Chang и др. (2000) в тайваньской популяции не может быть применено к другой популяции |
|
Werneck Brito и др. (2009) |
61 здоровых плодов |
24–32 |
Фетальный объем легких с использованием метода VOCAL с 30º |
Средний объем правого легкого плода колебалась от 12,5 см3 при 24 недельном сроке до 31,8 см3 при 32 недельной беременности; объем левого легкого плода колебался от 9,2 см3 при 24 недельном сроке до 22,0 см3 при 32 неделях беременности |
|
Tedesco и др. (2009) |
57 здоровых плодов |
24–34 |
Фетальный объем почек с использованием метода VOCAL с 30º |
Среднее значение объем правой почки плода колеблется от 4,5 см3 при 24 недельном сроке до 12,1 см3 на 34 неделях беременности; не было существенной разницы между обоими объемами почек плода. |
|
Barreto и др. (2012) |
303 здоровых плодов |
20–34 |
Фетальный объем сердца с использованием метода XI VOCAL в 10 плоскостях |
Фетальный объем сердца увеличивается с гестационным возрастом, со средними значениями 3,09 мл при 20 недельном сроке, 9,18 мл при 26 недельном сроке и 24,89 мл при 34 недельном сроке |
|
Yoshisaki и др. (2013) |
213 здоровых плодов |
20–40 |
Фетальный объем почек с использованием метода VOCAL с 30º |
Средний объем правой почки плода колеблется от 4,0 см3 при 20 недельном сроке, до 44,9 см3 при 40 недельном; средний объем левой почки плода колеблется от 4,2 см3 при 20 недельном сроке, до 44,3 см3 при 40 недельном |
2-DUS (3-DUS) = 2-D (3-D), ультразвуковое исследование; VOCAL = компьютеризированный анализ виртуального органа; XI VOCAL = расширенный компьютеризированный анализ виртуального органа.
Таблица 5. Авторы исследования, исследуемая популяция, гестационный возраст, пренатальная ультразвуковая техника и клинические результаты в случае определения объемов конечностей плода при 3-DUS.
|
Авторы исследования |
Исследуемая популяция |
Гестационный возраст (недели) |
Пренатальная ультразвуковая техника |
Клинические результаты |
|
Liang и др.(1997) |
105 одноплодных Тайванских беременностей |
48 часов перед родами |
Фетальный объем верхней части руки с использованием мультипланарного метода с 3,0-мм интервалом |
Определена новая формула с использованием фетального объема верхней части руки, которая лучше, чем 2-DUS формула в прогнозировании веса при рождении |
|
Chang и др. (1997b |
100 одноплодных тайванських беременностей |
48 часов перед родами |
Фетальный объем бедра с использованием мультипланарного метода с 3,0-мм интервалом |
Определена новая формула с использованием фетального объема бедра, которая лучше, чем 2-DUS формула в прогнозировании веса при рождении |
|
Song и др. (2000) |
84 одноплодных беременностей в Корее |
48 часов перед родами |
Фетальный объем бедра с использованием модифицированного мультипланарного метода с 4,0-мм интервалом |
Формула фетального объема бедра с использованием модифицированного мультипланарного метода, лучше, чем 2-DUS формула в прогнозировании веса при рождении и занимает меньше времени (2 мин) |
|
Lee и др. (2001) |
100 одноплодных Американскихбеременностей |
4 дня до родов |
Фетальный фракционный объем бедра (50% от объема центральной части конечности, в котором содержится наибольшее количество мягких тканей) |
Лучший прогноз веса при рождении, полученный с помощью формулы, связанной с окружностью брюшной полости и фракционного объема бедра; Эта новая модель была сравнена с формулой Hadlock и соавт. (1985) у 30 плодов и предсказывал вес при рождении более точно, чем формула Hadlock и соавт. 20/30 плодов в пределах 5% от реального веса |
|
Nardozza и др. (2010c) |
81 одноплодных беременностей в Бразилии |
48 часов перед родами |
Фетальный объемы бедра и верхней части руки с использованием мультипланарного метода с 5,0-мм интервалом |
Формула фетального объема бедра, верхней части руки плода и обеих конечностей не отличались от 2-DUS формулы |
|
Araujo J unior |
425 здоровых плодов |
20-40 |
Фетальный объем бедра с использованием XI VOCAL метода в 10 плоскостях |
Средний объем бедра плода колебалась от 8,0 см3 при 20 недельном сроке до 122,1 см3 при 40 недельном сроке |
|
Cavalcante и др. (2011) |
425 здоровых плодов |
20-40 |
Фетальный объем верхней части руки с использованием XI VOCAL метода в 10 плоскостях |
Средний объем верхней части руки плода колебался от 4,59 см3 при 20 недельном сроке до 53,87 см3 при 40 недельном сроке |
|
Lee и др. (2009b) |
303 здоровых плода |
18-42 |
Фетальные фракционные объемы бедра и верхней части руки (50% от объема центральной части конечности, в котором содержится наибольшее количество мягких тканей) |
Средний фракционный объем верхней части руки плода колебался от 41,9 см3 на 18 недельном сроке до 48,8 мл на 42 недельном сроке; средний фракционный объем бедра плода составлял от 3,4 см3 на 18 недельном сроке до 115,8 см3 на 42 недельном сроке |
|
Lee и др. (2009a) |
87 одноплодных беременностей в Америке |
4 дня до родов |
Фетальный фракционный объем бедра и верхней части руки (50% от объема центральной части конечности, в котором содержится наибольшее количество мягких тканей) |
Фетальный фракционный объем бедра имел наибольшую корреляцию с пренатальным показателем процентного содержания жировой ткани в организме среди всех однопараметрических моделей, и этот параметр в одиночку объясняет 46,1% вариабельности процентного содержания жировой ткани в организме |
2-DUS = 2-D ультразвуковое исследование; XI VOCAL = расширенный компьютеризированный анализ виртуального органа.
ТРЕХМЕРНАЯ ЭНЕРГЕТИЧЕСКАЯ ДОПЛЕРОГРАФИЯ
С тех пор, как эта методика была впервые описана более чем десять лет назад, количественный 3-D-PD (Power Doppler) вызвал большой интерес среди исследователей (Pairleitner и др. 1999) из-за своего потенциала для оценки кровотока/кровоснабжения целого органа или ткани (Martins и др. 2010), учитывая неинвазивность, относительную простоту, легкую переносимость техники, и которая исключает использование контраста и экспозицию радиации (Miyague и др. 2013a). При 3-D-PD исследовании количество красных вокселей и их интенсивность связаны с числом подвижных клеток. Таким образом, предлагаемый количественный метод может быть использован в качестве инструмента для оценки перфузии. Количественная оценка 3-D-PD сигналов в определенной исследуемой области осуществляется с помощью трех индексов: индекс васкуляризации (VI) – соотношение цветных вокселей ко всем вокселям в заданном объеме, индекс текучести (FI) – средняя интенсивность окраски всех красных вокселей в анализируемом объеме и индекс васкуляризации потока (VFI) – комбинация из двух индексов, которая вычисляется как (VI * FI)/100. Кроме теоретического потенциала, была обнаружена корреляция между этими показателями и истинной перфузией, как в лабораторных, так и естественных условиях (Jones и др. 2009, 2010; Morel. и др. 2010; Raine-Fenning 2008а и др.). Несмотря на большой научный интерес к этим показателям, о чем свидетельствуют более 200 статей, опубликованных в области акушерства и гинекологии (Alcazar 2008; Martins 2010; Martins и Raine-Fenning 2010; Martins и др.2007, 2010.), их использование в целом не принято в клинической практике из-за серьезных ограничений (Martins и др.2011; Nиi и др.2014; Nastri и др.2013.). Наиболее важными из этих ограничений является их сильная зависимость от ослабления (Miyague и др.2014.), настройки машины (Martins и др. 2010; Raine-Fenning и др. 2008b) и объема выборки (Kudla и Alcazar 2010). Из-за этих ограничений, требуется полная стандартизация метода, чего почти невозможно достичь из-за большого числа параметров, требующих безошибочной корректировки. Более того, эти показатели сильно зависят от ослабления (Jones и др.2009; Miyague и др.2014; Raine-Fenning и др.2008a), что ограничивает возможность сравнения между пациентами. Кроме того, существуют серьезные сомнения о воспроизводимости исследования, особенно в случае, когда не может быть оценен весь орган, а только исследуется отдельный элемент (например, плацента в третьем триместре беременности) (Martins и Nastri 2011; Martins и др.2010, 2012). Такую изменчивость можно объяснить несколькими факторами, включая изменчивость в движении, выбор исследуемой области и даже фазой сердечного цикла при проведении 3-D-PD (Miyague и др. 2013b). Этот подход претерпевает усовершенствование по отношению к 3-D-PD, особенно в случае с волюметрическим индексом пульсации (Kudla и Alcazar 2012; Martins и др.2013; Welsh и др.2012b) и фракционным объемом крови (Soares и др.2013. ; Welsh и др.2012a). Считается, что такие усовершенствования помогут преодолеть ограничения исходных 3-D-PD показателей. Тем не менее, эти показатели все еще не готовы к использованию в клинической практике. Существует доказательства того, что нарушения, выявленные при пупочной доплерографии, характеризуют патологические изменения сосудов ворсинок плаценты только на поздних стадиях нарушения функции плаценты (Fok и др. 1990; Trudinger и др. 1987). Поэтому, снижению интраплацентарного кровотока может предшествовать увеличение пупочного сопротивление на несколько недель, и обнаружение этого состояния может вызывать опасения (Jaffe и Woods, 1996; Yagel др., 1999). По этим причинам, разработка новых методов скрининга плацентарной недостаточности на более ранней стадии представляет большой интерес (Guimaraes Filhoи др. 2008).
Некоторые исследования показали, что анализ интраплацентарного потока с помощью 3-D-PD может представлять собой новый инструмент для раннего выявления риска развития определенных состояний, таких как: задержка внутриутробного развития, преэклампсия и плацентарная недостаточность (Costa и др.2010; Guimaraes Filho и др.2010; Guiot и др.2008; Negrini и др.2011). Многие из этих исследований, однако, были проведены во время второго и третьего триместров беременности (de Almeida Pimenta и др.2014; de Paula и др.2009; Mihu и др.2012; Odibo и др.2011; Tuuli и др.2010 ) и показали влияние технических ограничений, упомянутых ранее, в том числе расхождение результатов воспроизводимости исследований (Guimaraes Filho и др.2011; Lai и др.2010;. Merce и др, 2004) (Рис. 13).
В отличие от более поздних этапов беременности, 3-D-PD в конце первого триместра беременности (11-14 недель) имеет преимущество в визуализации всей плаценты, тем самым обеспечивая полную оценку сосудистого дерева, что теоретически обеспечивает более точный анализ информации о васкуляризации и кровотоке (Araujo Junior и др.2011b; Odeh и др.2011; Rizzo и др.2007, 2009а, 2009b; Yigiter и др.2011). Кроме того, известно, что проведение профилактики преэклампсии следует начинать как можно раньше, что еще больше подчеркивает важность плацентарной 3-D-PD до 16 недели беременности (Bujold и др. 2010). Несколько недавних исследований, проведенных в конце первого триместра, выявили снижение плацентарных 3-D-PD показателей (Bozkurt и др.2010; Odeh и др.2011; Rizzo и др.2009b; Yigiter и др.2011.) и ограничение маточно-плацентарного циркуляторного пространства (Dar и др. 2010; Hafner и др. 2010.) у женщин, у которых позже развилась преэклампсия (Dar и др.2010; Hafner и др.2010; Odeh и др.2011) и/или задержка внутриутробного развития (Bozkurt и др. 2010, Rizzo и др.2009b; Yigiter и др.2011). Кроме того, воспроизводимость исследования была подтверждена в первом триместре беременности с хорошими показателями для 3-D-PD на этой стадии гестации (Huster и др. 2010; Jones и др. 2010.).
Существуют сообщения об использовании сосудистых индексов, полученных с помощью 3-D-PD для оценки мозга плода (Bartha и др.2009; Chang и др.2003e; Hata и др.2012b; Hsu и др.2013; Nardozza и др. 2009), легких (Ruano и др.2006a, 2012), печени (Chang и др.2003d) и почек (Bernardes и др.2011;. Chang и др.2003f). Было проведено несколько исследований 3-D-PD техники в оценке васкуляризации головного мозга. Корреляция 3-D показателей с гестационным возрастом дала противоречивые результаты (Bartha и др.2009; Chang 2003e и др; Hata и др.2012b; Nardozza и др.2009). Bartha и др. (2009) провели анализ мозгового кровообращения плода с помощью 3-D-PD у 100 здоровых беременных женщин и 25 женщин с задержкой внутриутробного развития плода. Авторы отмечают, что плоды с задержкой внутриутробного развития имели значительно более высокие значения этих показателей по сравнению с нормальными плодами. Кроме того, они обнаружили, что центральная гемодинамика плодов с задержкой внутриутробного развития чаще диагностировалась с помощью 3-DPD показателей, чем при помощи индекса пульсации средней мозговой артерии. Необходимы дальнейшие исследования для более полной оценки эффективности 3-D-PD в исследовании циркуляторных изменений в головном мозге плода. Ruano и др. (2006а) оценили потенциал 3-D-PD для прогнозирования неонатальных исходов и легочной гипертензии у плодов с врожденной диафрагмальной грыжей. Они отметили, что 3-D индексы были статистически ниже в случаях врожденной диафрагмальной грыжи. В таких случаях, показатели VI и VFI были значительно ниже у плодов, которые умерли, чем у тех, которые выжили, и также были ниже у плодов с диагностированной постнатальной легочной гипертензией. Другое исследование показало, что из нескольких анализируемых параметров, параметр VI легкого, контралатерального грыже, был лучшим предиктором выживаемости плода (Ruano и др. 2012). Необходимо проведение дальнейших исследований для оценки обоснованности и целесообразности применения 3-D-PD для исследования изменений фетальной легочной васкуляризации. Что касается оценки фетальной васкуляризации печени и почек при 3-D-PD, выявлена положительная линейная корреляция между тремя индексами (VI, FI и VFI) и гестационным возрастом в обоих органах (Chang и др. 2003d, 2003f). Изучение плодов, с подозрением на обструкцию мочевых путей, показало, что почечная васкуляризации (VI и VFI) была значительно ниже у плодов, у которых развилась почечная недостаточность (Bernardes и др. 2011).
В таблице 6 приведены наиболее важные статьи по 3-D-PD в первом триместре беременности.
Таблица 6. Авторы исследования, исследуемая популяция, гестационный возраст, пренатальная ультразвуковая техника и клинические результаты основных статей, в которых оценивалось плацентарное кровоснабжение в первом триместре с помощью 3-D энергетической доплерографии
|
Авторы исследования |
Исследуемая популяция |
Гестационный возраст (недели) |
Пренатальная ультразвуковая техника |
Клинические результаты |
|
Rizzo и др. (2007) |
100 здоровых беременностей |
11–13+6 |
Плацентарные индексы (VI, FI, VFI) рассчитывались с помощью VOCAL гистограммы (вся плацента) |
Представлены данные о нормальных диапазонах плацентарных сосудистых индексов между 11 + 0 и 13 + 6 недель гестации, которые могут быть полезны в будущем для исследования плацентарной васкуляризации |
|
Rizzo и др. (2009a) |
84 беременностей с ▼PAPP-A |
11–13+6 |
Плацентарные индексы (VI, FI, VFI) рассчитывались с помощью VOCAL гистограммы (вся плацента) |
Низкий уровень в сыворотке материнской крови PAPP-A ≤ 0,4 (многократное среднее значение) связан с измененными показателями 3-D-PD; Эти изменения связанны с последующим развитием IUGR и неблагоприятных исходов беременности |
|
Dar и др. (2010) |
277 здоровых беременностей |
10+4 – 13+6 |
Плацентарные индексы (VI, FI, VFI) рассчитывались с помощью VOCAL гистограммы (сферическая биопсия) |
Пациенты, у которых развивается преэклампсия, имеют более низкие показатели 3-D-PD из их маточно-плацентарного циркулирующего пространства во время первого триместра; прогнозирование преэклампсии было на уровне 78,9%, 77,6% и 79,6% для VI, FI, и VFI, соответственно |
|
Odeh и др. (2011) |
308 здоровых беременностей |
10+6 – 13+6 |
Плацентарные индексы (VI, FI, VFI) рассчитывались с помощью VOCAL гистограммы (вся плацента) |
VI значительно ниже при гипертонии, индуцированной беременности, которая развивается (7,86 ± 3,92 против 12,02 ± 7,09) в группе здоровых, р = 0,035; VI может иметь некоторый потенциал в выявлении гипертонии, индуцированной беременности |
3-D-PD = 3-D энергетическая допплерография; FI = индекс потока; IUGR = внутриутробное ограничение роста; PAPP-A = плазменный протеин А беременных; VFI = индекс васкулярной перфузии; VI = индекс васкуляризации; VOCAL = компьютеризированный анализ виртуального органа.
ВЫВОДЫ
После глубокого анализа медицинской литературы по 3-DUS и 4-DUS в акушерстве и изучения вопроса о возможностях 3-DUS техники в предоставлении дополнительной диагностической информации к данным 2-DUS исследования, Goncalves и др. (2005a) и Kurjak и др. (2007) пришли к выводу, что: ”трехмерное ультразвуковое исследование дает дополнительную диагностическую информацию для диагностики аномалий лица, оценки дефектов нервной трубки и пороков развития скелета. Необходимы дополнительные исследования для того, чтобы определить клиническую роль 3-DUS/4-DUS в диагностике врожденных пороков сердца и аномалий центральной нервной системы.”
Бесспорным фактом является то, что 3-DUS значительнее усиливает связь родителей с их ребенком, по сравнению с 2-DUS. 3-DUS занимает меньше времени, позволяет осуществлять точное восстановление анатомии плода и одновременно визуализировать картинку в сагиттальной, аксиальной и коронарной плоскостях, по сравнению с 2-DUS. Кроме того, 3-DUS/4-DUS дает возможность строить проекции, которые трудно получить при 2-DUS, что, таким образом, предоставляет сонографистам большую гибкость в их попытках определить выраженность, расположение и степень аномалий. Кроме того, 3-DUS/4-DUS техника предоставляет важные новые технические возможности, что может быть использовано в клинических программах подготовки сонографистов, которые в свою очередь могут свободно осуществлять ‘‘навигацию’‘ в пределах объема, а сам объем, по необходимости, может быть разделен на слои во всех трех ортогональных плоскостях. Недавно разработанное программное обеспечение имеет интеллектуальную систему навигации и исследования интересующих диагностических плоскостей (‘‘виртуальный’‘ сонографист).
Наконец, сохраненные объемные данные и видеоклипы могут быть сжаты и размещены на специальном веб-сайте через интернет, или отправлены на удаленный узел для обработки и анализа экспертной группой с помощью телемедицины. Учитывая все выше изложенное, мы убеждены, что технологические достижения в области 3-DUS/4-DUS внесли большой вклад в широкое использование и доступность таких методов. Они также установили, что 3-DUS/4-DUS можно использовать в акушерской практике в качестве рутинной диагностической процедуры. Для проведения исследований рекомендуем использовать аппарат от компании GE Voluson E8.


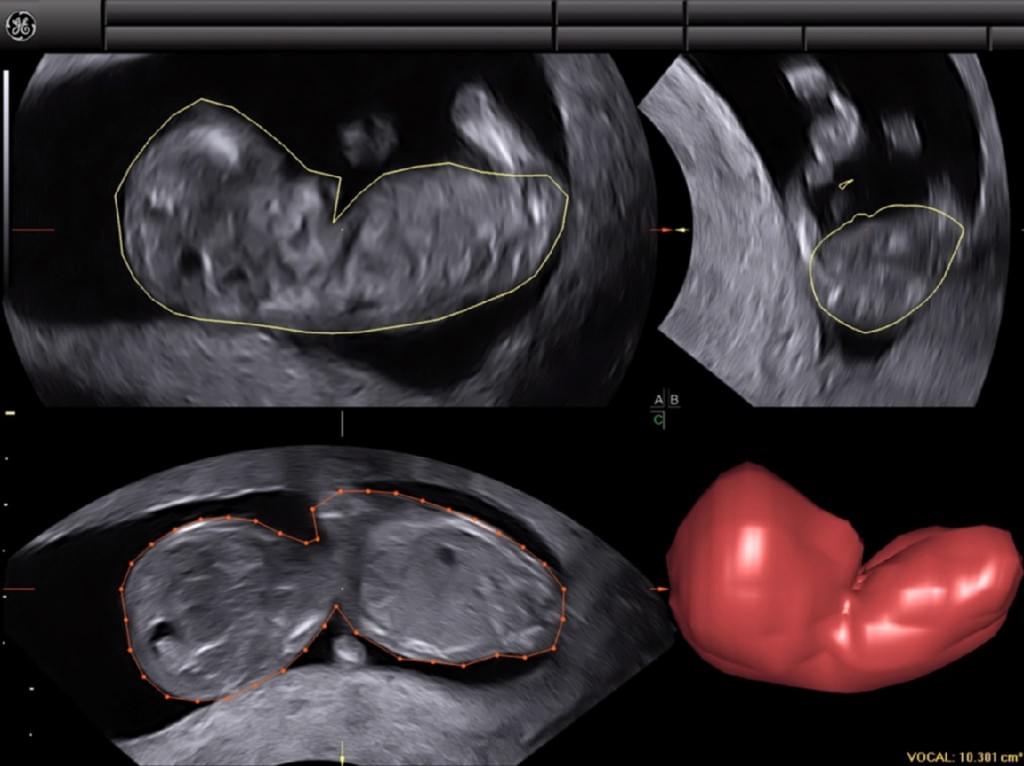
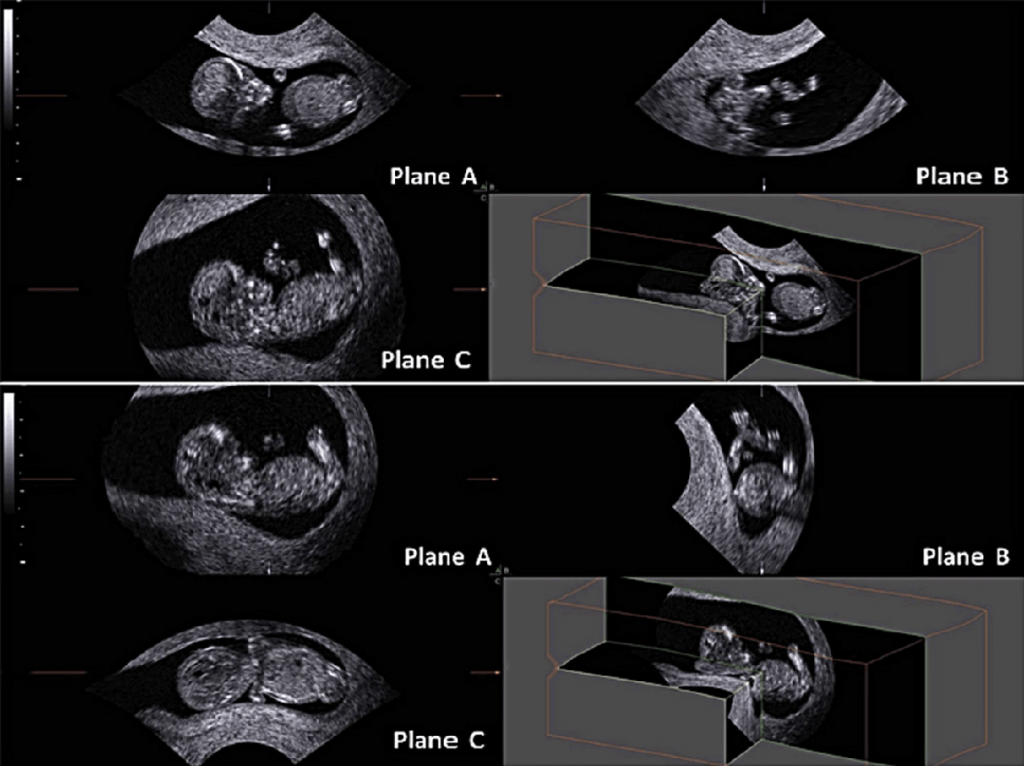
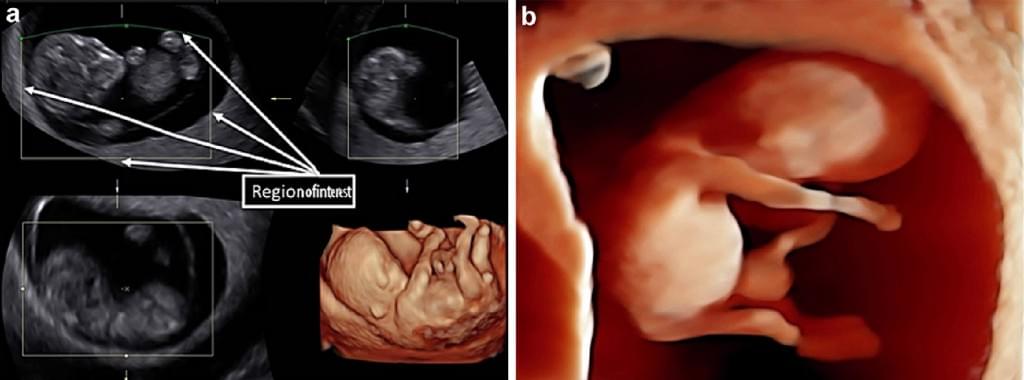
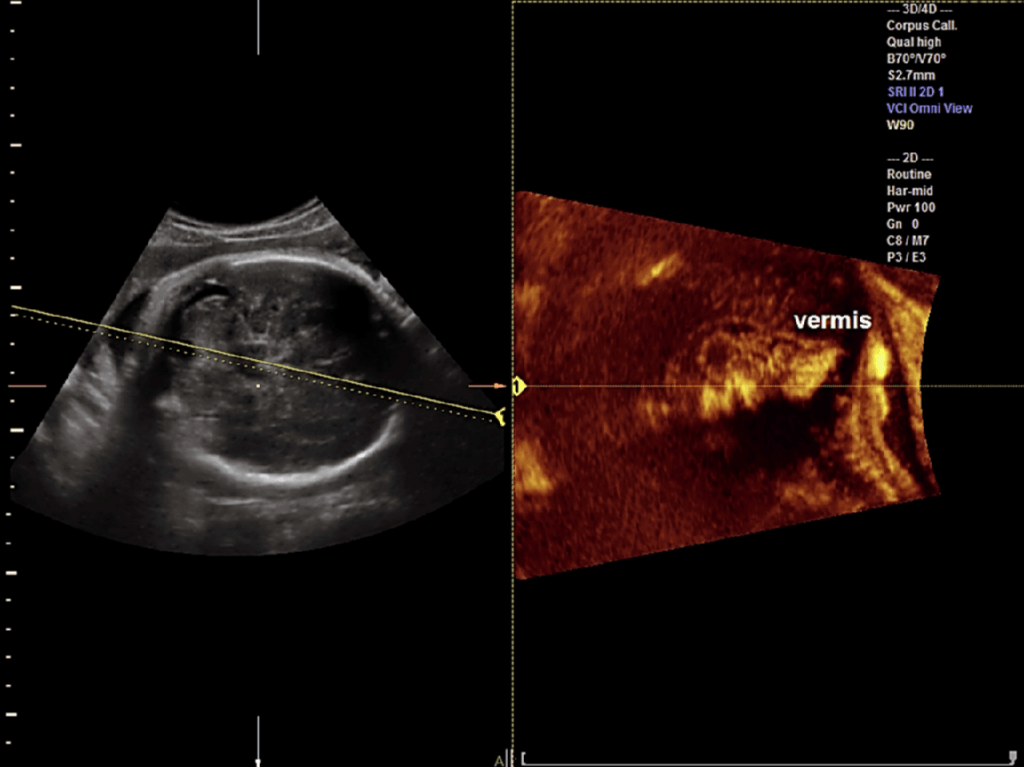
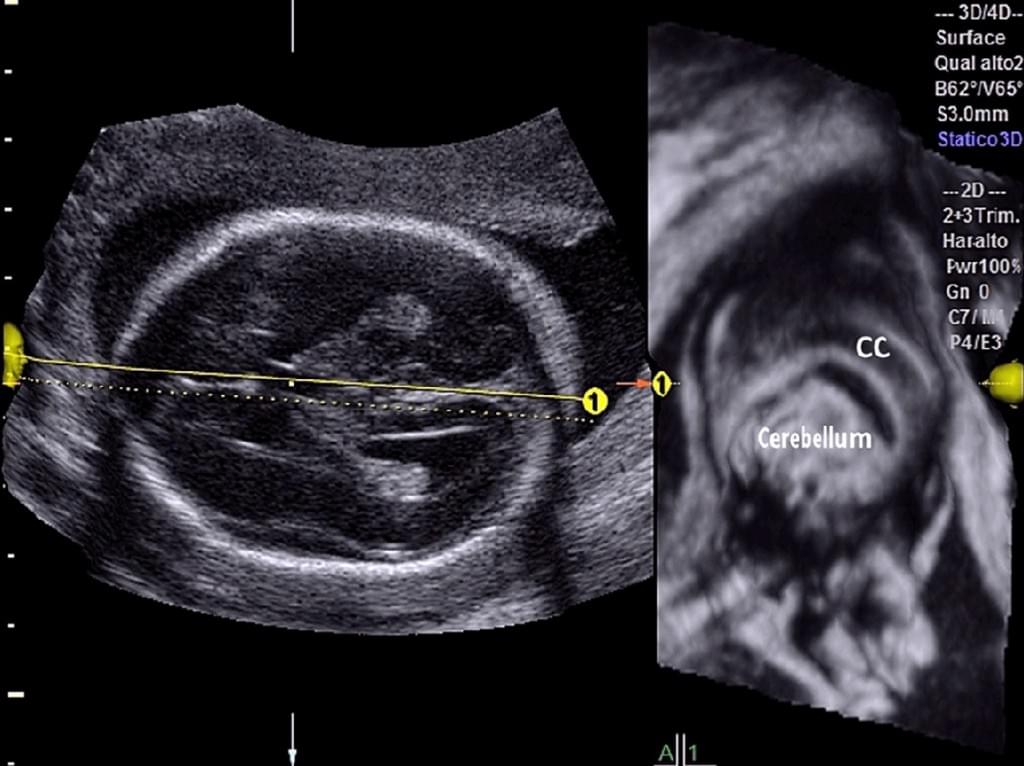
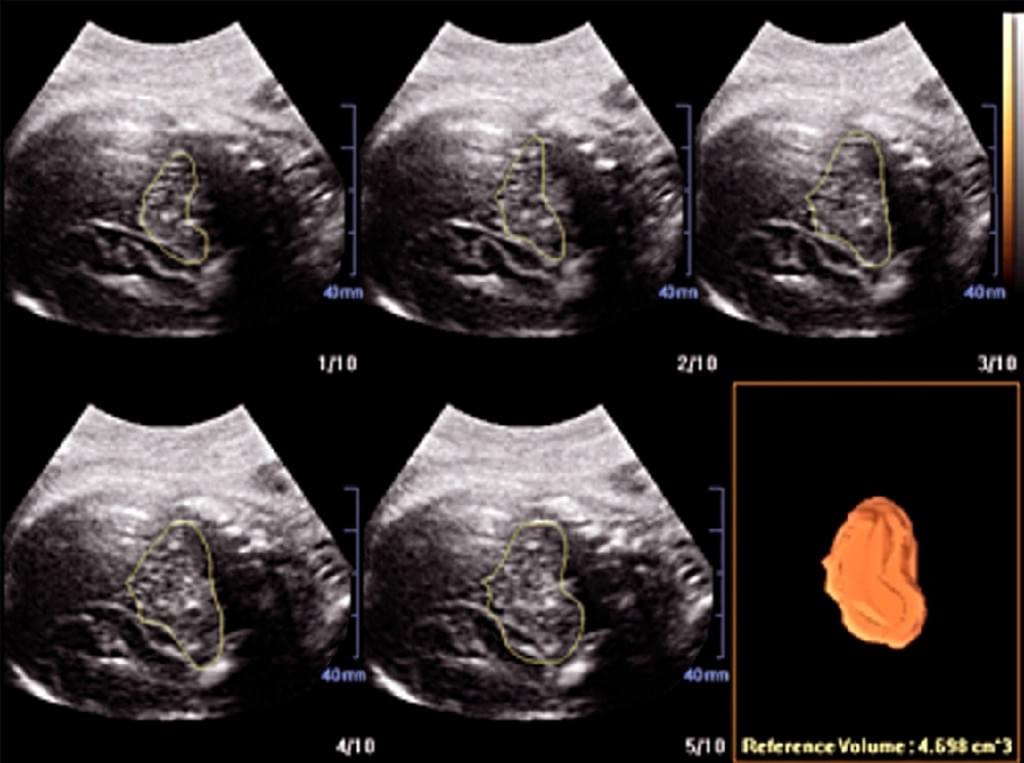
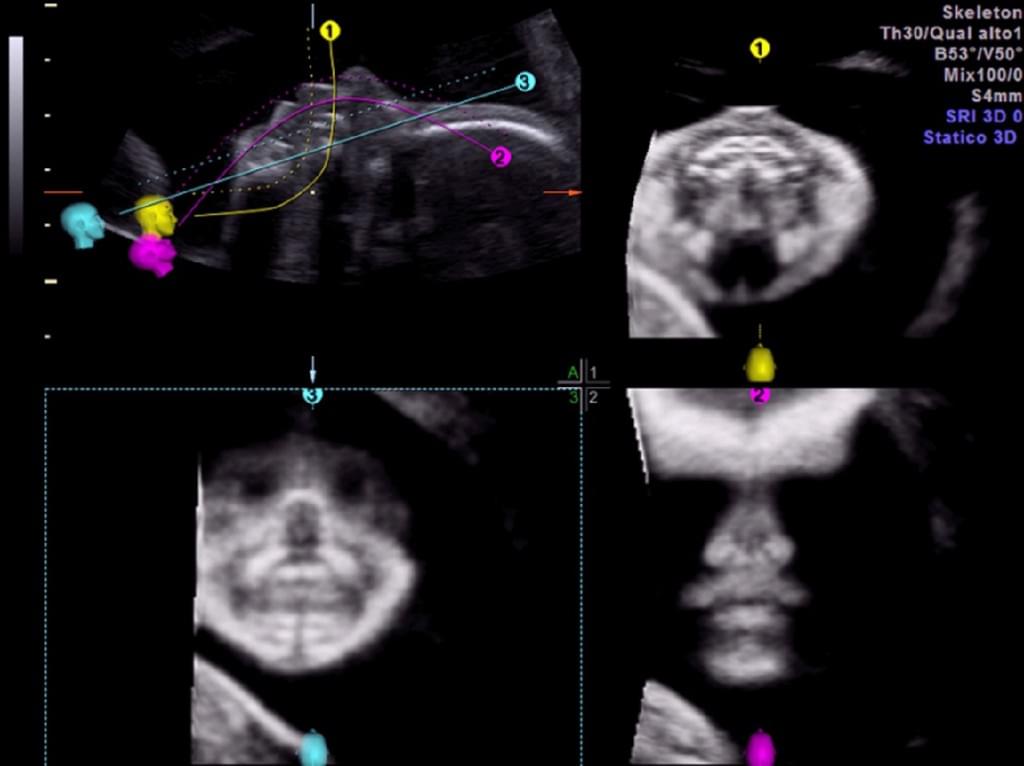
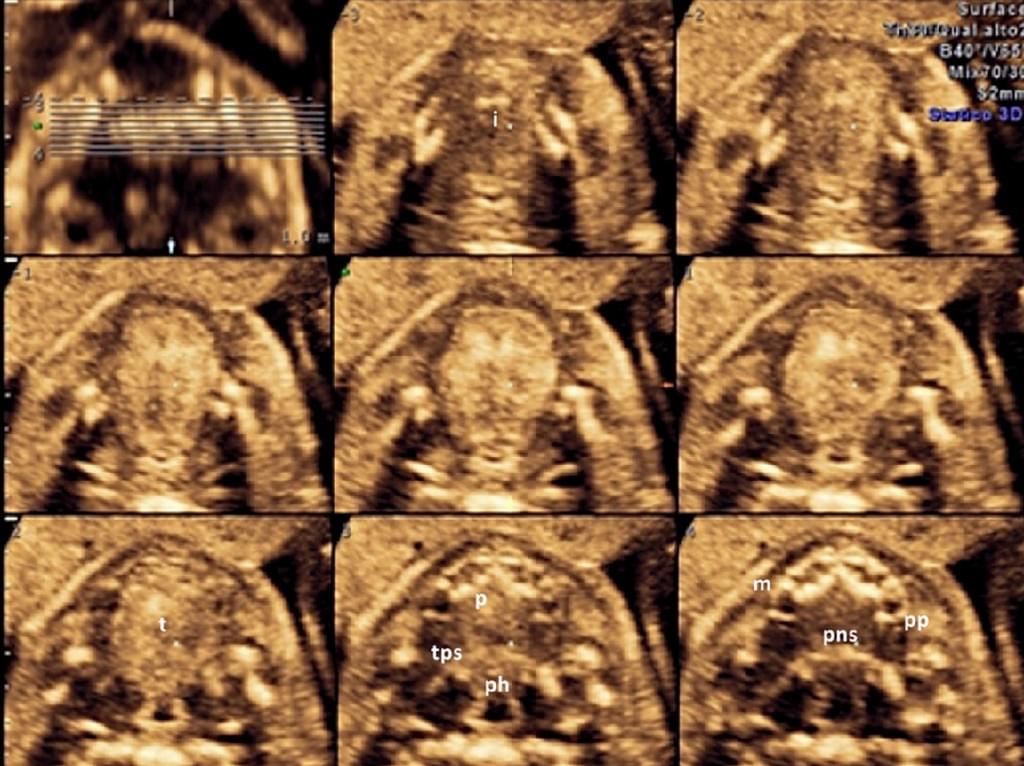
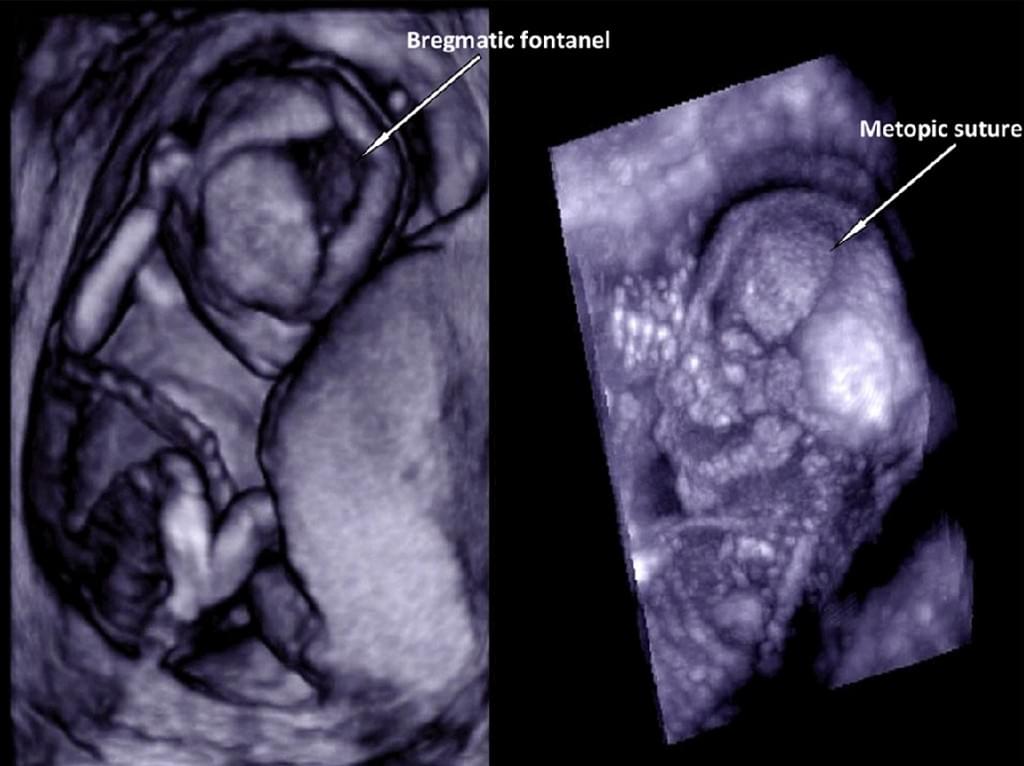
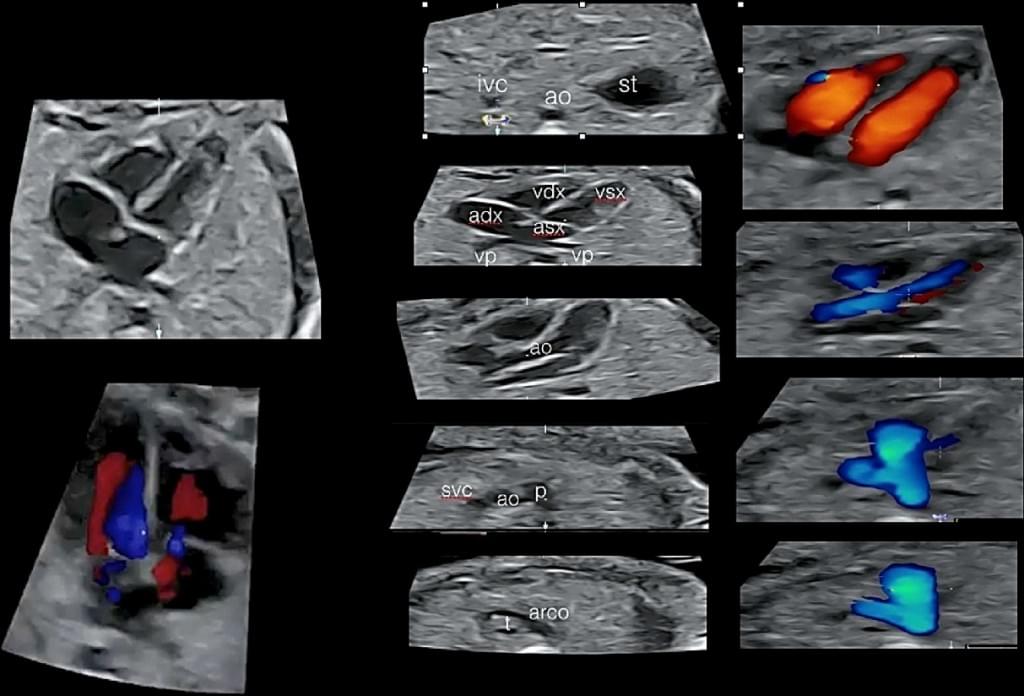
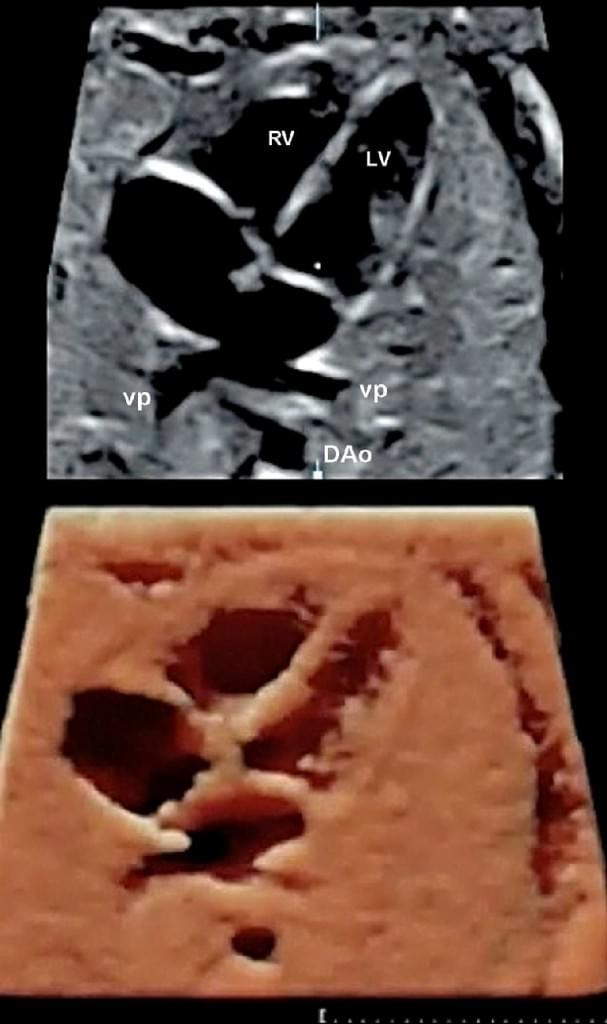
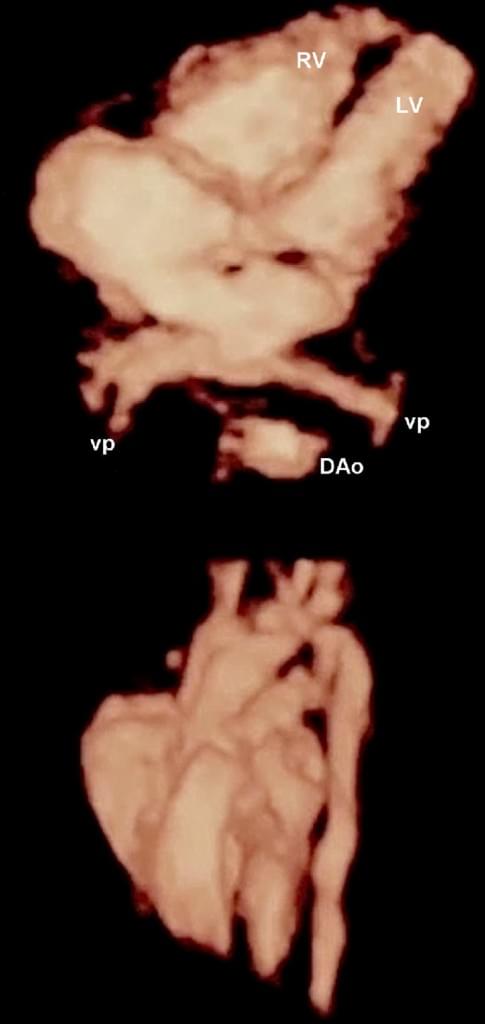
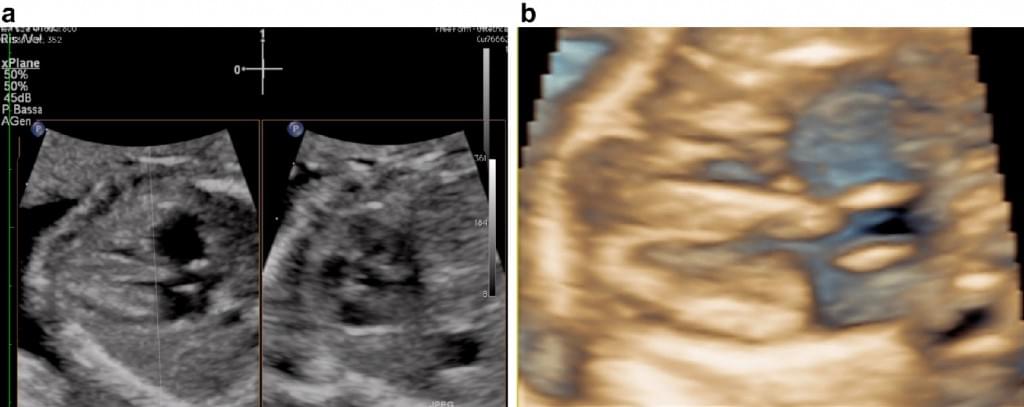
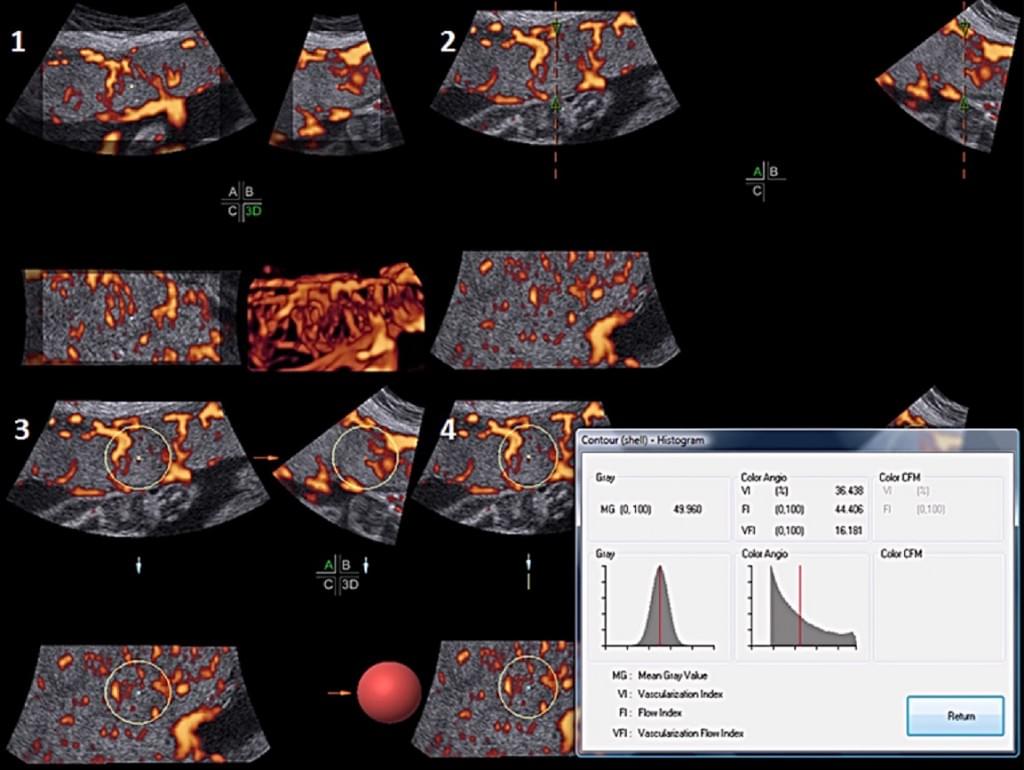


14.10.2019
Дмитро Романович