Автори: Gregor S. Zimmermann, Alexander A. Fingerle, Bernhard Renger, Karl-Ludwig Laugwitz, Hubert Hautmann, Andreas Sauter, Felix Meurer, Florian Tilman Gassert, Jannis Bodden, Christina Müller-Leisse, Martin Renz, Ernst J. Rummeny, Marcus R. Makowski, Konstantin Willer, Wolfgang Noichl, Fabio De Marco, Manuela Frank, Theresa Urban, Rafael C. Schick, Julia Herzen, Thomas Koehler, Bernhard Haller, Daniela Pfeiffer & Franz Pfeiffer
Анотація
Передумови
Спірометрія та звичайна рентгенографія грудної клітки мають обмеження в дослідженні ранньої емфіземи, тоді як комп’ютерна томографія, еталонний метод візуалізації в цьому контексті, не є частиною рутинного догляду за пацієнтами через вищу дозу опромінення. У цій роботі ми дослідили новий низькодозовий метод візуалізації – рентгенографію грудної клітки в темному полі – для оцінки емфіземи у пацієнтів з дефіцитом альфа-1-антитрипсину.
Методи
Використовуючи хвильові властивості рентгенівських променів для формування контрасту, рентгенографія грудної клітки на темному полі візуалізує структурну цілісність альвеол, представлену затемненням над легенями на зображенні з темним полем. Ми обстежили чотирьох пацієнтів з дефіцитом альфа-1-антитрипсину за допомогою нового прототипу рентгенівського апарату в темному полі та одночасного проведення звичайної рентгенографії грудної клітки. Ступінь порушення легеневої функції оцінювали за допомогою вимірювання функції легень, а регіональний розподіл емфіземи порівнювали з даними КТ у одного пацієнта.
Результати
Ми показали, що рентгенографія грудної клітки в темному полі візуалізує ступінь емфіземи легень, відображаючи тяжкість та регіональні відмінності. Ділянки з низьким затемненням в темному полі корелюють з емфізематозними змінами, виявленими за допомогою комп’ютерної томографії з порогом -950 одиниць Хаунсфілда. Параметри дихальних шляхів, отримані за допомогою плетизмографії всього тіла, та дифузійна здатність легень за один вдих по відношенню до монооксиду вуглецю продемонстрували типові зміни при прогресуючій емфіземі.
Висновки
Рентгенографія грудної клітки в темному полі безпосередньо візуалізує тяжкість і регіональний розподіл емфіземи легень порівняно зі звичайною рентгенографією грудної клітки у пацієнтів з дефіцитом альфа-1-антитрипсину. Завдяки наднизькій дозі опромінення порівняно з комп’ютерною томографією, темнопольна рентгенографія грудної клітки може бути корисною для довготривалого спостереження за цими пацієнтами.
Основні тези
- Рентгенографія грудної клітки в темному полі (РГК) візуалізує тяжкість легеневої емфіземи при дефіциті альфа-1-антитрипсину.
- РГК на темному полі візуалізує регіональний розподіл емфіземи при низьких дозах опромінення.
- РГК на темному полі надає додаткову інформацію про ультраструктуру легень.
- РГК на темному полі може доповнювати звичайну РГК та комп’ютерну томографію грудної клітки.
Передумови
Дефіцит альфа-1-антитрипсину (ААТД) є одним з найпоширеніших генетичних порушень при респіраторних захворюваннях. Це аутосомно-рецесивне захворювання пов’язане з підвищеним ризиком розвитку емфіземи легень та захворювань печінки [1].
Внаслідок генетично обумовленої дисфункції антитрипсину виникає обструктивне захворювання легень, яке характеризується емфіземою з незворотнім руйнуванням стінок альвеол і розширенням дистальних повітряних просторів, що призводить до прогресуючої втрати функції легень з обмеженням толерантності до фізичного навантаження, якості життя та тривалості життя [1]. Класичним фенотипом у пацієнтів з ААТД є базальна панлобулярна емфізема [1]. Багато хворих залишаються недіагностованими, або точний діагноз затримується на багато років. У багатьох випадках діагноз ААТД не встановлюється до стадії, коли емфізема вже прогресує і відбувається незворотна втрата легеневої функції. Стратифіковані заходи скринінгу цього захворювання ще не встановлені в більшості країн.
Звичайна рентгенографія органів грудної клітки (РГК) має обмежене застосування як інструмент скринінгу емфіземи, оскільки можна спостерігати лише непрямі ознаки емфіземи, які зазвичай з’являються лише на пізніх стадіях захворювання. Раннє виявлення, оцінка регіонального поширення та кількісна оцінка емфіземи не можуть бути досягнуті за допомогою звичайної рентгенографії грудної клітки [2,3,4]. Тому комп’ютерна томографія (КТ) протягом багатьох років стала еталонним стандартом для візуалізації емфіземи. На КТ-сканах емфізема характеризується аномально низьким ослабленням легеневої паренхіми, а її локальний розподіл можна оцінити візуально або за допомогою денситометрії [5,6,7].
Різні програмні додатки пропонують кількісну оцінку емфіземи на основі КТ грудної клітки за допомогою порогового методу [6, 8, 9]. Ця кількісна оцінка на основі КТ може бути використана у пацієнтів з ААТД як поздовжній параметр [10]. Однак, порівняно зі звичайною РГК, КТ піддає пацієнта значно більшій дозі опромінення (зазвичай 2-7 мЗв для проведення КТ грудної клітки порівняно з менш ніж 0,05 мЗв для РГК в загальному). Таким чином, КТ в даний час підходить лише як процедура візуалізації, що базується на оцінці ризику, і не підходить як загальний метод скринінгу населення [11, 12]. Отже, існує висока потреба в чутливій технології візуалізації, яка б дозволила раннє виявлення та довготривале спостереження емфіземи, не піддаючи пацієнтів високій дозі опромінення, що виникає при КТ.
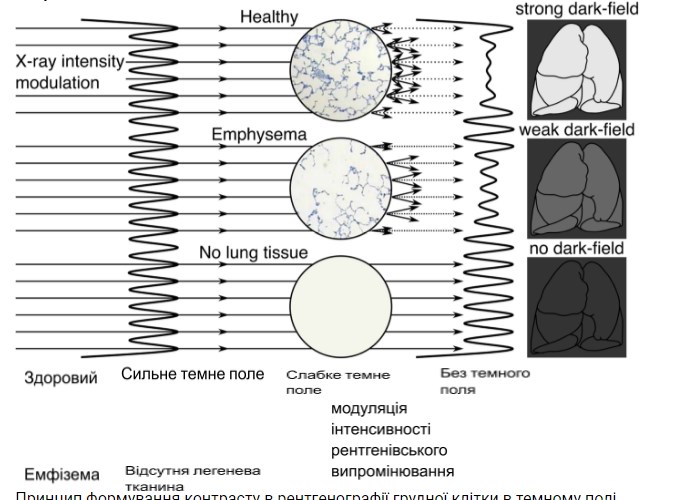
За останнє десятиліття була розроблена нова технологія рентгенівської візуалізації – рентгенографія в темному полі, яка надає інформацію про мікроструктурну цілісність легень [13, 14]. Прокладаючи шлях до клінічного застосування, основний принцип базується на триградусному інтерферометрі для рентгенівських променів, представленому Пфайффером та ін. [15], що дозволяє використовувати звичайні джерела рентгенівського випромінювання [15]. У звичайній рентгенівській або комп’ютерній томографії контрастність зображення ґрунтується виключно на ослабленні рентгенівського променя при проходженні через об’єкт. Однак рентгенівська візуалізація в темному полі використовує хвильові властивості рентгенівських променів для формування контрасту шляхом візуалізації малокутового розсіювання, що відбувається на межі розділу, наприклад, між повітрям і тканиною в легеневих альвеолах або між кісткою і кістковим мозком у трабекулярній кістці. Зі збільшенням кількості меж розділу відбувається більше малокутового розсіювання, що призводить до більш високого сигналу в темному полі. Принцип формування контрасту при рентгенографії грудної клітки в темному полі зображений на зобр. 1.
Зобр. 1
Принцип формування контрасту в рентгенографії грудної клітки в темному полі. Решітчастий інтерферометр генерує тонку модуляцію інтенсивності (перпендикулярну до напрямку променя) на фронті рентгенівської хвилі, що поширюється. Проникаючи в області з мікроскопічними поверхнями розділу між матеріалами з різними показниками заломлення, ця картина інтенсивності спотворюється в результаті багаторазового заломлення. Інтенсивність сигналу темного поля кодується у зменшенні амплітуди зображення (межова контрастність). Здорова легенева паренхіма, що складається з багатьох притаманних їй поверхонь розділу (повітря і тканина), індукує сильне малокутове розсіювання, що призводить до появи чіткого сигналу темного поля. Навпаки, емфізематозні ділянки, де дихальна поверхня зменшена або вже повністю зникла, мають меншу активність розсіювання або взагалі не розсіюють, що призводить до зменшення або нульового сигналу в темному полі.
Інтактна легенева паренхіма складається з численних меж між повітрям і м’якими тканинами, таким чином представляючи собою мікроструктуру з різним показником заломлення. Це може викликати сильне малокутове розсіювання, що призводить до помітного зменшення амплітуди зображення на темнопольній рентгенограмі. Це призводить до яскравого зображення легень на кінцевому зображенні. Ефізематозна тканина, навпаки, забезпечує меншу дихальну поверхню, оскільки характеризується патологічною деградацією стінок альвеол. Це відповідає меншій кількості меж між повітрям і м’якими тканинами, що призводить до зниження сигналу темного поля в уражених ділянках. Продовжуючи цю послідовність зменшення кількості меж аж до повної їх відсутності, у відповідних об’єктах не може виникнути малокутового розсіювання, що призводить до нульового сигналу на темнопольному зображенні [16,17,18,19,20].
У численних моделях легеневих захворювань на малих тваринах було доведено, що рентгенографія в темному полі надає додаткову, діагностично значущу інформацію про мікроструктурні зміни легень [16,17,18]. Альвеолярна деструкція, характерна для емфіземи легень, призводить до зменшення малокутового розсіювання. Недавні дослідження продемонстрували, що діагностика, стадіювання та картування локального поширення емфіземи можливе за допомогою рентгенографії в темному полі у дрібних тварин [4, 14, 21, 22]. Крім того, технологія була протестована на великих тваринах і трупах людей [19, 23, 24] і, нарешті, вперше застосована до пацієнтів [20].
Метою нашого дослідження було оцінити рентгенографію органів грудної клітки в темному полі для оцінки наявності та розповсюдження емфіземи у пацієнтів з ААТД порівняно зі звичайною РГК та, за наявності, комп’ютерною томографією. Були розглянуті дози опромінення для різних методів візуалізації. Для вимірювання параметрів функції легень використовували плетизмографію всього тіла.
Методи
Підбір пацієнтів
У нашому надрегіональному амбулаторному відділенні для пацієнтів з ААТД ми регулярно проводимо аугментаційну терапію інгібітором α-1-антипротеїнази у пацієнтів, які не палять, з генотипом PiZZ або PiZ0 та зниженою функцією легень, згідно з висновком ATS/ERS [1, 25]. Для спостереження ми періодично контролюємо об’єми легень за допомогою тестування функції легень. За клінічними показаннями проводиться звичайний РГК. Щоб розглянути можливість зменшення об’єму легень, проводиться детальна оцінка за допомогою КТ, якщо пацієнт є відповідним кандидатом.
Набір пацієнтів у пульмонологічній амбулаторії був частиною більшого, поточного, першого у світі дослідження у відділенні радіології, яке оцінювало РГК у темному полі для раннього виявлення емфіземи у пацієнтів з хронічним обструктивним захворюванням легень (ХОЗЛ), включаючи пацієнтів з підтвердженим ХОЗЛ за даними спірометрії та пацієнтів без ХОЗЛ для порівняння. Щоб оцінити, чи можна візуалізувати зміни легеневої паренхіми при цьому рідкісному захворюванні легень, були також включені пацієнти з ААТД. Дані пацієнтів з AATD були об’єднані з дослідження.
Дослідження було схвалено інституційною комісією з етики та Федеральним відомством з радіаційного захисту. Всі учасники дали письмову інформовану згоду.
Критерії включення та виключення
Ми включали дорослих пацієнтів з підтвердженим ААТД і пацієнтів без ААТД з клінічно показаним РГК. Ми виключали пацієнтів з будь-якими іншими додатковими легеневими захворюваннями, окрім ААТД-асоційованої емфіземи, вагітних та пацієнтів, які не були здатні дати згоду на участь у дослідженні. Через розмір прототипу решітчастого інтерферометра досліджували лише обмежене видиме поле. Тому пацієнти із зростом більше 182 см або індексом маси тіла більше 30 були виключені.
План дослідження
Пацієнтам, включеним у це попереднє дослідження, виконували рентгенографію в темному полі в задньо-передній і бічній проекціях, на вдиху і видиху. Звичайна РГК
виконувалась у задньо-передній та бічній проекціях на вдиху. Проведено плетизмографію всього тіла. Одному пацієнту з ААТД та одному здоровому пацієнту було проведено КТ з клінічних міркувань для виключення інфільтратів або злоякісних утворень. Додатково пацієнту з ААТД була проведена КТ для отримання інформації щодо розподілу емфіземи при плануванні ендоскопічного зменшення об’єму легень. Результати чотирьох пацієнтів з ААТД порівнювали з результатами, отриманими у пацієнта без ААТД та інших легеневих захворювань як референтні (див. розділ “Набір пацієнтів“).
Рентгенографія в темному полі
При візуалізації в темному полі на основі решітки на фронт рентгенівської хвилі накладається високочастотна модуляція інтенсивності, зазвичай розміром у кілька мікрон. Якщо цей фронт хвилі проникає в об’єкт з високими коливаннями показника заломлення в мікронному масштабі, амплітуда цієї картини зменшується через багаторазове малокутове розсіювання. Величина цього зменшення відповідає інтенсивності сигналу темного поля [22]. Зобр.1 схематично ілюструє основний принцип роботи. Середнє значення картини інтенсивності кодує умовний сигнал ослаблення, який можна реконструювати на додаток до сигналу темного поля з того ж набору даних. Таким чином, два ідеально зареєстрованих зображення, що представляють різні фізичні принципи взаємодії, отримуються в одному зчитуванні. Детальна інформація про техніку сканування і зчитування була описана раніше нашою групою [26]. Клінічний прототип системи, розроблений власними силами, був використаний для отримання рентгенографічних зображень грудної клітки в темному полі у пацієнтів з ААТД та одного пацієнта без обструктивних захворювань легень [20]. Система базується на поєднанні триграткового рентгенівського інтерферометра і стандартних медичних рентгенівських компонентів, таких як генератор високої напруги (Velara, Philips Healthcare, Нідерланди), джерело (MRC 200 0508 ROT GS, Philips Healthcare, Нідерланди), коліматор (MTR 302, Ralco, Мілан, Італія) і плоский детектор (Pixium FE 4343 F, Trixell, Муаран, Франція). Перед скануванням область, що підлягала скануванню, була відрегульована відповідно до розмірів пацієнта. Як і під час звичайної КТ, пацієнт стояв вертикально, і йому рекомендували затримати дихання на час отримання зображення. Процедура отримання зображення ґрунтується на скануванні, при якому активна ділянка розміром приблизно 42 × 6,5 см2 сканується по всій грудній клітці пацієнта приблизно за 7 с.
Традиційна рентгенівська та комп’ютерна томографія
Затухаючі рентгенограми були отримані за допомогою комерційної рентгенографічної системи (DigitalDiagnost, Philips Medical Systems, Гамбург, Німеччина) з напругою на трубці 125 кВп. Двом пацієнтам було проведено КТ грудної клітки з контрастуванням (IQon Spectral CT, Royal Philips, Амстердам, Нідерланди) за клінічними показаннями. Напруга на трубці становила 120 кВп, використовувалася автоматична кутова модуляція струму трубки. Зображення реконструювали з товщиною зрізу 0,9 мм, ядром високої роздільної здатності та рівнем придушення шуму 6 (iDose 6, Royal Philips, Амстердам, Нідерланди).
Тест легеневої функції(ТЛФ)
Всі учасники пройшли стандартизоване дослідження функції легень у нашому центрі відповідно до рекомендацій Європейського респіраторного товариства [27, 28]. ТЛФ складалася з поєднання спірометрії з плетизмографією всього тіла (MasterScreen Body, Jaeger, Вюрцбург, Німеччина). За необхідності додавали вимірювання дифузійної здатності монооксиду вуглецю (ДЗОВ) (MS-PFT, Jaeger, Wuerzburg, Німеччина).
Оцінка зображень
На рентгенограмах у темному полі та звичайних рентгенограмах легені були розділені на шість ділянок: верхня, середня та нижня зони правої та лівої легені (RLUZ, RLMZ, RLLZ, LLUZ, LLMZ, LLLZ відповідно). [24]. На зображеннях у темному полі потужність легеневого сигналу, як маркер цілісності альвеол, візуально оцінювали для кожної зони окремо за 6-бальною шкалою в консенсус-читанні (G.S.Z., A.A.F.): 0 (відсутній), 1 (дуже низький), 2 (низький), 3 (помірний), 4 (високий) і 5 (дуже високий). До цієї оцінки були включені бокові та задньо-передні темнопольні знімки на видиху. Звичайні рентгенограми оцінювали щодо наявності ознак гіперінфляції та судинних змін, пов’язаних з емфіземою, за 2-бальною шкалою: 0 (відсутні) та 1 (наявні). Ступінь емфіземи на клінічно показаній КТ одного пацієнта візуалізували на коронарному зображенні за допомогою порогової щільності легень -950 HU, використовуючи програмне забезпечення конкретного виробника (IntelliSpace Portal, Royal Philips, Амстердам, Нідерланди). Зчитування проводилося відповідно до стандартизованого протоколу шляхом консенсусного зчитування. Через невеликий розмір вибірки багаторазові зчитування не проводилися.
Результати
Характеристики пацієнтів
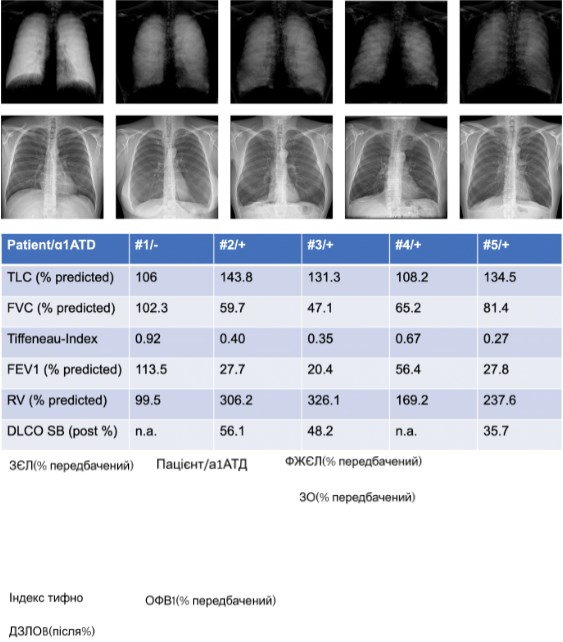
Ми включили чотирьох пацієнтів з клінічними показаннями для торакальної візуалізації з нашого надрегіонального амбулаторного відділення для пацієнтів з AATD. Досліджувана когорта була частиною більшого дослідження, в якому оцінювали рентгенографію в темному полі у пацієнтів з ХОЗЛ [20]. Усі пацієнти з ААТД з цієї дослідницької групи були включені в дану роботу. Характеристики пацієнтів представлені в таблиці 1.
Таблиця 1 Характеристика здорового пацієнта (№1) та чотирьох пацієнтів (№2-5) з дефіцитом альфа-1-антитрипсину (ААТД)
|
Характеристики пацієнтів |
#1 |
#2 |
#3 |
#4 |
#5 |
|
Стать |
Чоловік |
Жінка |
Чоловік |
Чоловік |
Чоловік |
|
Вік (роки) |
33 |
41 |
48 |
73 |
55 |
|
Підтип ААТД |
– |
PiZZ |
PiZZ |
Pi00 |
PiZZ |
|
Куріння (уп/рік, кинув) |
Активне |
16, 2017 |
18, 2014 |
Ніколи |
13, 2009 |
|
Мед. Лік. (рік початку) |
– |
2018 |
2005 |
2014 |
2010 |
|
Тривалість терапії |
– |
2 |
15 |
6 |
10 |
|
Тест оцінки ХОЗЛ |
– |
26 |
9 |
17 |
19 |
|
ГІОЛ |
– |
4D |
4A |
2B |
4B |
- Препарати та тривалість терапії відносяться до терапії альфа-1-антитрипсином., ГІОЛ Глобальна ініціатива з хронічного обструктивного захворювання легень, PiZZ Гомозиготні Z-алелі протеїнази, Pi00 Гомозиготні алелі 0
Тест легеневої функції
Усі пацієнти з ААТД мали обструктивну функцію легень. Середній об’єм форсованого видиху за 1 с (ОФВ1) становив 33,1% від прогнозованого (чотири значення у №2 27,7%, у №3 20,4%, у №4 56,4% та у №5 27,8%). Середнє значення індексу Тіффно-Пінеллі (ОФВ1/ФЖЄЛ) становило 0,42 (чотири значення в №2 – 0,40, в №3 – 0,35, в №4 – 0,67 та в №5 – 0,37). Середня форсована життєва ємність легень (ФЖЄЛ) становила 63,4% від прогнозованої (чотири значення у №2 59,7%, у №3 47,1%, у №4 65,2% та у №5 81,4%). Середня загальна життєва ємність легень становила 129,5% від прогнозованої (чотири значення у №2 143,8%, у №3 131,3%, у №4 108,2% та у №5 134,5%). DCLO було отримано у трьох пацієнтів: середній показник становив 46,7% від прогнозованого (три значення у №2 56,1%, у №3 48,2% та у №5 35,7%).
Рентгенографія в темному полі
Пацієнт №1 з нормальним станом легень показав високий рівень сигналу (4 бали) у верхніх відділах легень і дуже високий (5 балів) у середніх і нижніх відділах легень. У пацієнта №2 рівень сигналу був оцінений як помірний (3 бали) у верхніх і середніх зонах легень і низький (2 бали) в нижніх зонах легень. Пацієнти №3 та №4 продемонстрували низький рівень сигналу в усіх зонах легень. У пацієнта №5 рівень сигналу був низьким у верхніх і середніх зонах легень і дуже низьким у нижніх зонах (показано на зобр. 2).
Зобр. 2
Кореляція темнопольної рентгенограми грудної клітки (верхній ряд) та звичайної РГК (нижній ряд) здорового пацієнта (№1) та чотирьох пацієнтів (№2-5) з дефіцитом альфа-1-антитрипсину (ААТД) з параметрами дихання, отриманими за допомогою плетизмографії всього тіла. ЗЄЛ – загальна ємність легень; ФЖЄЛ – форсована життєва ємність легень; ОФВ1 – об’єм форсованого видиху за 1 с; ЗО – залишковий об’єм; ДЗЛОB – дифузійна здатність легень за один вдих для оксиду вуглецю; % прогнозовано, порівняно з референтними значеннями; Після % після введення бронходилататора, порівняно з референтними значеннями.
Традиційна РГК та КТ
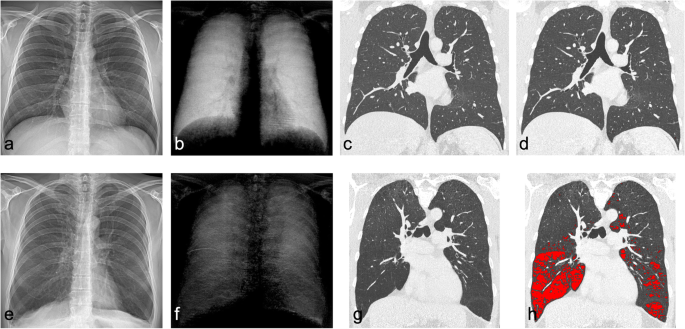
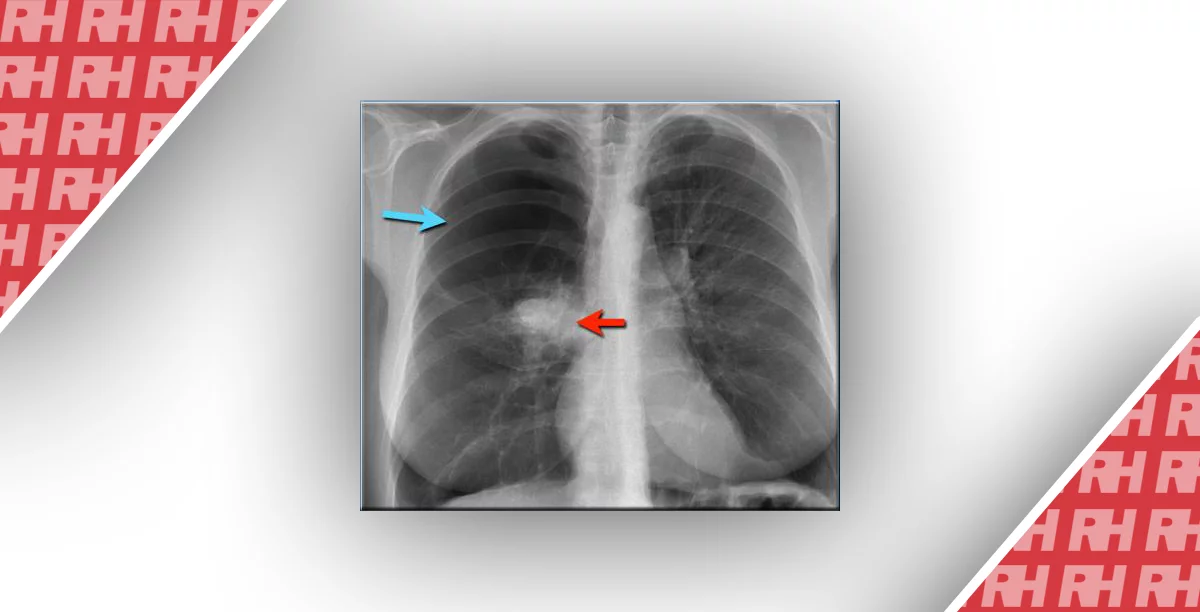
У всіх пацієнтів (№2-5) з ААТД були виявлені вторинні ознаки емфіземи на звичайних РГК, такі як широко розставлені ребра і сплощені права й ліва напівдіафрагми. Емфізематозні ділянки, що визначалися низькими значеннями легеневої щільності (нижче -950 HU), демонстрували дуже низький рівень сигналу на відповідному темнопольному зображенні (показано на зобр. 3).
Звичайна (а) та темнопольна рентгенограма грудної клітки (b) здорової людини та пацієнта (№5) з дефіцитом альфа1-антитрипсину (ААТД) (d, е). Для обох пацієнтів були застосовані однакові налаштування вікна/рівня для звичайних зображень та зображень у темному полі відповідно. Сигнал темного поля помітно знижений у легенях пацієнта з ААТД (f), особливо в нижніх зонах, тоді як здорові легені демонструють сильний гомогенний сигнал у всіх зонах. Відповідне зображення коронарної комп’ютерної томографії (КТ) (g) виявляє деструкцію паренхіми легень, підкреслену емфізематозним накладанням (червоний колір) з використанням порогу -950 одиниць Хаунсфілда (h) порівняно зі знімками здорового пацієнта (c, d). Звичайна рентгенограма грудної клітки не може візуалізувати ступінь паренхіматозного захворювання у пацієнта з ААТД (e), демонструючи аналогічну передачу зображення у здорового пацієнта (a). Лише вторинні ознаки, такі як сплощення діафрагми, збільшення об’єму легень або розширення костофренічних кутів, вказують на емфізему (d). У той час як на зображенні в темному полі спостерігається загальне зниження сигналу в темному полі по всій ділянці легені, на відміну від нормальної легені, КТ виявляє дефекти лише в нижніх ділянках, які відповідають сильнішому прояву зниження сигналу на рентгенограмі в темному полі.
Доза рентгенівського випромінювання
Середня ефективна доза задньо-передньої рентгенографії в темному полі становила 0,049 мЗв, 0,032 мЗв, 0,047 мЗв та 0,025 мЗв для пацієнтів з №2 по №5.
Обговорення
У цьому першому клінічному попередньому дослідженні РГК у темному полі у пацієнтів з ААТД, ми показали, що зображення у темному полі дозволяє візуалізувати ступінь тяжкості та регіональний розподіл емфіземи легень, тоді як звичайна РГК не була корисною для стадіювання емфіземи через її відомі недоліки. Це пілотне дослідження мало на меті продемонструвати потенційну можливість застосування візуалізації у темному полі. Зображення у темному полі показало помітне зниження сигналу легеневої паренхіми у пацієнтів з ААТД з прогресуючою емфіземою, порівняно з ледь помітними ознаками при проведенні РГК (зобр. 2). І навпаки, звичайна РГК виявила вторинні ознаки емфіземи у наших пацієнтів. Однак ці вторинні ознаки відображають лише вираження гіперінфляції і не є прямими ознаками емфіземи. Згідно з анатомічним визначенням емфіземи як втрати інтактних альвеол, РГК у темному полі візуалізувала емфізему за рахунок зниження рівня сигналу темного поля в цих ділянках у наших пацієнтів.
В одного пацієнта дуже низький сигнал темного поля в нижніх відділах легень співпав з виявленням емфіземи на КТ, що базується на пороговому значенні щільності легень (зобр. 3). Крім того, на зображенні у темному полі було виявлено загальне зниження сигналу темного поля по всій ділянці легень, яке важко було ідентифікувати за допомогою КТ-денситометрії. Однак, порівняно з КТ, яка застосовується для кількісної оцінки та визначення типу емфіземи, РГК у темному полі може надати аналогічну інформацію за меншу дозу опромінення. Доза опромінення при РГК у темному полі для референтної особи становить 0,035 мЗв, що значно нижче, ніж при КТ із середньою дозою опромінення 2-7 мЗв [11, 12, 20]. Більше того, в області візуалізації емфіземи РГК у темному полі може полегшити ранню діагностику і дозволити проводити скринінгові дослідження.
Наші результати узгоджуються з попередніми публікаціями в дослідженнях на тваринах та організмі людини. У мишей ранні стадії емфіземи були виявлені за допомогою рентгенівської томографії в темному полі, що корелювало з гістологічними змінами, в той час як звичайна рентгенографія не могла виявити ранніх стадій емфіземи [29]. Як було показано в різних дослідженнях на невеликих моделях тварин, цей метод надає додаткову діагностично важливу інформацію про макро- і мікроструктурну архітектуру легеневої паренхіми, візуалізуючи запальні, фіброзні або пухлинні зміни значно краще, ніж звичайна візуалізація у мишей. [14, 16,17,18, 30]. Крім того, неонатальні пошкодження можна візуалізувати на тваринній моделі за допомогою рентгенівської візуалізації в темному полі [31]. Після подальших доклінічних досліджень на живих свинях [19, 23, 32] і трупах людей [24, 33, 34] ця методика нещодавно була вперше успішно застосована до пацієнтів [20]. Це наочно демонструє можливість застосування методу з дотриманням клінічних обмежень, таких як поле зору, час сканування і доза опромінення.
Основною проблемою раннього виявлення емфіземи легень є те, що емфізематозні зміни успішно візуалізуються за допомогою КТ у великій групі курців навіть без спірометричних порушень [35, 36]. Ступінь емфіземи, що візуалізується за допомогою КТ, корелює з прогнозом пацієнтів з емфіземою [35, 36]. Однак навіть низькодозова КТ грудної клітки вимагає значно більшого променевого навантаження, ніж РГК. Таким чином, необхідна методика візуалізації, яка б дозволила раннє виявлення емфіземи у пацієнтів з групи ризику без високого променевого навантаження КТ. У попередніх дослідженнях було описано кореляцію ДЗЛОB, як маркера газообмінної поверхні легень, зі зниженим сигналом темного поля [20]. У нашому дослідженні ми виявили, що, незважаючи на однаковий ступінь обструкції, рівень сигналу в темному полі був вищим у пацієнта № 2, ніж у пацієнта № 5, що свідчить про зв’язок з ДЗЛОB, який був вищим у пацієнта № 2.
Враховуючи, що емфізема внаслідок ААТД зазвичай виявляється на пізній стадії з прогресуючим ураженням легень, існує нагальна потреба в додаткових методах ранньої діагностики [1, 37], тим більше, що існує можливість зменшити прогресування захворювання у цих пацієнтів шляхом заміни лікування інгібітором альфа1-протеїнази. [10, 38]. Оскільки РГК не підходить для раннього виявлення структурних змін легень, рентгенографія в темному полі, завдяки дуже низькому променевому навантаженню, яке приблизно вдвічі перевищує променеве навантаження звичайної рентгенографії, та її структурній інформації, може особливо добре підходити для цієї мети.
Основними обмеженнями нашого дослідження є дизайн одноцентрового дослідження та невеликий розмір вибірки. Оскільки на сьогоднішній день існує лише один прототип РГК у темному полі для використання на людях, ми включили пацієнтів з ААТД у нашій спеціалізованій амбулаторії, щоб отримати перше уявлення про те, чи може РГК у темному полі виявити ступінь тяжкості та регіональний розподіл емфіземи у цих пацієнтів. Для підтвердження цього на більших колективах необхідні подальші дослідження. У більшому поточному дослідженні у пацієнтів з нормальною функцією легень та емфіземою внаслідок ХОЗЛ без ААТД потужність сигналу в темному полі показала вищу позитивну кореляцію з дифузійною здатністю, як маркером інтактної альвеолярної поверхні, ніж кількісна оцінка емфіземи на основі КТ. [20].
Іншим обмеженням є прогресуюча емфізема у включених в наше дослідження пацієнтів з ААТД, що не є репрезентативним для ранніх стадій емфіземи. Нещодавно були опубліковані результати пацієнтів з ранніми стадіями емфіземи, які демонструють кореляцію рівня сигналу темного поля і ДЗЛОB [20]. Таким чином, знижений сигнал РГК у темному полі може вказувати на те, що структурне пошкодження вже існує, незважаючи на нормальну РГК. Це може ініціювати подальші діагностичні кроки, такі як пневмологічне обстеження на ранній стадії.
Додатковим обмеженням є новизна рентгенографії в темному полі як методу клінічної візуалізації та недостатній досвід і підготовка лікарів-радіологів, які читають зображення. Однак наші радіологи мають кількарічний досвід досліджень у сфері читання зображень у темному полі, отриманих під час досліджень на тваринах та людях.
Як висновок, ці попередні результати вказують на те, що РГК у темному полі можлива і може досліджувати основну мікроструктуру легень у пацієнтів з ААТД, яка залишається недоступною за допомогою сучасних методів медичної візуалізації при низьких дозах опромінення. Це може додати додаткову інформацію про ступінь тяжкості та регіональний розподіл емфіземи легень у пацієнтів з ААТД. Впровадження рентгенівської візуалізації в темному полі в клінічну практику може докорінно змінити діагностику легеневих захворювань за допомогою наднизьких доз опромінення порівняно з КТ.
Наявність даних та матеріалів
Всі дані, отримані або проаналізовані під час цього дослідження, включені в цю опубліковану статтю.
Абревіатури
ААТД: Дефіцит альфа-1-антитрипсину
ХОЗЛ: Хронічне обструктивне захворювання легень
РГК: Рентген грудної клітки
ОФВ1: Об’єм форсованого видиху за одну секунду
ЖЄЛ: Життєва ємність легень
ОХ: Одиниці Хаунсфільда
ДФЛ: Дослідження функції легень
Посилання
- Miravitlles M, Dirksen A, Ferrarotti I, et al (2017) European Respiratory Society statement: diagnosis and treatment of pulmonary disease in alpha1-antitrypsin deficiency. Eur Respir J 50:1700610. https://doi.org/10.1183/13993003.00610-2017
- Muller NL, Coxson H (2002) Chronic obstructive pulmonary disease. 4: imaging the lungs in patients with chronic obstructive pulmonary disease. Thorax 57:982–985. https://doi.org/10.1136/thorax.57.11.982
Article CAS PubMed PubMed Central Google Scholar
- Washko GR (2010) Diagnostic imaging in COPD. Semin Respir Crit Care Med 31:276–285. https://doi.org/10.1055/s-0030-1254068
Article PubMed PubMed Central Google Scholar
- Meinel FG, Schwab F, Schleede S, et al (2013) Diagnosing and mapping pulmonary emphysema on X-ray projection images: incremental value of grating-based X-ray dark-field imaging. PLoS One 8:e59526. https://doi.org/10.1371/journal.pone.0059526
- Cavigli E, Camiciottoli G, Diciotti S, et al (2009) Whole-lung densitometry versus visual assessment of emphysema. Eur Radiol 19:1686–1692. https://doi.org/10.1007/s00330-009-1320-y
- Stoel BC, Stolk J, Bakker ME, Parr DG (2019) Regional lung densities in alpha-1 antitrypsin deficiency compared to predicted values. Respir Res 20:45. https://doi.org/10.1186/s12931-019-1012-3
Article PubMed PubMed Central Google Scholar
- Konietzke P, Jobst B, Wagner WL, et al (2018) Similarities in the computed tomography appearance in alpha1-antitrypsin deficiency and smoking-related chronic obstructive pulmonary disease in a smoking collective. Respiration 96:231–239. https://doi.org/10.1159/000489177
- Stoel BC, Stolk J (2004) Optimization and standardization of lung densitometry in the assessment of pulmonary emphysema. Invest Radiol 39:681–688. https://doi.org/10.1097/00004424-200411000-00006
Article PubMed Google Scholar
- Parr DG, Dirksen A, Piitulainen E, Deng C, Wencker M, Stockley RA (2009) Exploring the optimum approach to the use of CT densitometry in a randomised placebo-controlled study of augmentation therapy in alpha 1-antitrypsin deficiency. Respir Res 10:75. https://doi.org/10.1186/1465-9921-10-75
Article CAS PubMed PubMed Central Google Scholar
- McElvaney NG, Burdon J, Holmes M, et al (2017) Long-term efficacy and safety of alpha1 proteinase inhibitor treatment for emphysema caused by severe alpha1 antitrypsin deficiency: an open-label extension trial (RAPID-OLE). Lancet Respir Med 5:51–60. https://doi.org/10.1016/S2213-2600(16)30430-1
- Mettler FA Jr, Huda W, Yoshizumi TT, Mahesh M (2008) Effective doses in radiology and diagnostic nuclear medicine: a catalog. Radiology 248:254–263. https://doi.org/10.1148/radiol.2481071451
Article PubMed Google Scholar
- Larke FJ, Kruger RL, Cagnon CH, et al (2011) Estimated radiation dose associated with low-dose chest CT of average-size participants in the National Lung Screening Trial. AJR Am J Roentgenol 197:1165–1169. https://doi.org/10.2214/AJR.11.6533
- Bech M, Tapfer A, Velroyen A, et al (2013) In-vivo dark-field and phase-contrast x-ray imaging. Sci Rep 3:3209. https://doi.org/10.1038/srep03209
- Yaroshenko A, Meinel FG, Bech M, et al (2013) Pulmonary emphysema diagnosis with a preclinical small-animal X-ray dark-field scatter-contrast scanner. Radiology 269:427–433. https://doi.org/10.1148/radiol.13122413
- Pfeiffer F, Bech M, Bunk O, et al (2008) Hard-X-ray dark-field imaging using a grating interferometer. Nat Mater 7:134–137. https://doi.org/10.1038/nmat2096
- Yaroshenko A, Hellbach K, Yildirim AO, et al (2015) Improved in vivo assessment of pulmonary fibrosis in mice using x-ray dark-field radiography. Sci Rep 5:17492. https://doi.org/10.1038/srep17492
- Hellbach K, Yaroshenko A, Willer K, et al (2016) Facilitated diagnosis of pneumothoraces in newborn mice using x-ray dark-field radiography. Invest Radiol 51:597–601. https://doi.org/10.1097/RLI.0000000000000285
- Hellbach K, Meinel FG, Conlon TM, et al (2018) X-ray dark-field imaging to depict acute lung inflammation in mice. Sci Rep 8:2096. https://doi.org/10.1038/s41598-018-20193-8
- Hellbach K, Baehr A, De Marco F et al (2018) Depiction of pneumothoraces in a large animal model using x-ray dark-field radiography. Sci Rep 8:2602. https://doi.org/10.1038/s41598-018-20985-y
Article CAS PubMed PubMed Central Google Scholar
- Willer K, Fingerle AA, Noichl W, et al (2021) X-ray dark-field chest imaging for detection and quantification of emphysema in patients with chronic obstructive pulmonary disease: a diagnostic accuracy study. Lancet Digit Health 3:e733–e744. https://doi.org/10.1016/S2589-7500(21)00146-1
- Schleede S, Meinel FG, Bech M, et al (2012) Emphysema diagnosis using X-ray dark-field imaging at a laser-driven compact synchrotron light source. Proc Natl Acad Sci U S A 109:17880–17885. https://doi.org/10.1073/pnas.1206684109
- Meinel FG, Yaroshenko A, Hellbach K, et al (2014) Improved diagnosis of pulmonary emphysema using in vivo dark-field radiography. Invest Radiol 49:653–658. https://doi.org/10.1097/RLI.0000000000000067
- Gromann LB, De Marco F, Willer K et al (2017) In-vivo x-ray dark-field chest radiography of a pig. Sci Rep 7:4807. https://doi.org/10.1038/s41598-017-05101-w
Article CAS PubMed PubMed Central Google Scholar
- Fingerle AA, De Marco F, Andrejewski J et al (2019) Imaging features in post-mortem x-ray dark-field chest radiographs and correlation with conventional x-ray and CT. Eur Radiol Exp 3:25. https://doi.org/10.1186/s41747-019-0104-7
Article PubMed PubMed Central Google Scholar
- American Thoracic Society, European Respiratory Society (2003) American Thoracic Society/European Respiratory Society statement: standards for the diagnosis and management of individuals with alpha-1 antitrypsin deficiency. Am J Respir Crit Care Med 168:818–900. https://doi.org/10.1164/rccm.168.7.818
- Gassert FT, Urban T, Frank M et al (2021) X-ray dark-field chest imaging: qualitative and quantitative results in healthy humans. Radiology 301:389–395. https://doi.org/10.1148/radiol.2021210963
Article PubMed Google Scholar
- Coates AL, Peslin R, Rodenstein D, Stocks J (1997) Measurement of lung volumes by plethysmography. Eur Respir J 10:1415–1427. https://doi.org/10.1183/09031936.97.10061415
Article CAS PubMed Google Scholar
- Wanger J, Clausen JL, Coates A, et al (2005) Standardisation of the measurement of lung volumes. Eur Respir J 26:511–522. https://doi.org/10.1183/09031936.05.00035005
- Hellbach K, Yaroshenko A, Meinel FG, et al (2015) In vivo dark-field radiography for early diagnosis and staging of pulmonary emphysema. Invest Radiol 50:430–435. https://doi.org/10.1097/RLI.0000000000000147
- Scherer K, Yaroshenko A, Bolukbas DA et al (2017) X-ray dark-field radiography – in-vivo diagnosis of lung cancer in mice. Sci Rep 7:402. https://doi.org/10.1038/s41598-017-00489-x
Article CAS PubMed PubMed Central Google Scholar
- Yaroshenko A, Pritzke T, Koschlig M, et al (2016) Visualization of neonatal lung injury associated with mechanical ventilation using x-ray dark-field radiography. Sci Rep 6:24269. https://doi.org/10.1038/srep24269
- De Marco F, Willer K, Gromann LB et al (2019) Contrast-to-noise ratios and thickness-normalized, ventilation-dependent signal levels in dark-field and conventional in vivo thorax radiographs of two pigs. PLoS One 14:e0217858. https://doi.org/10.1371/journal.pone.0217858
Article CAS PubMed PubMed Central Google Scholar
- Willer K, Fingerle AA, Gromann LB, et al (2018) X-ray dark-field imaging of the human lung-a feasibility study on a deceased body. PLoS One 13:e0204565. https://doi.org/10.1371/journal.pone.0204565
- Sauter AP, Andrejewski J, De Marco F et al (2019) Optimization of tube voltage in X-ray dark-field chest radiography. Sci Rep 9:8699. https://doi.org/10.1038/s41598-019-45256-2
Article CAS PubMed PubMed Central Google Scholar
- Lynch DA, Moore CM, Wilson C, et al (2018) CT-based visual classification of emphysema: association with mortality in the COPDGene study. Radiology 288:859–866. https://doi.org/10.1148/radiol.2018172294
- Regan EA, Lynch DA, Curran-Everett D, et al (2015) Clinical and radiologic disease in smokers with normal spirometry. JAMA Intern Med 175:1539–1549. https://doi.org/10.1001/jamainternmed.2015.2735
- McElvaney NG (2015) Diagnosing alpha1-antitrypsin deficiency: how to improve the current algorithm. Eur Respir Rev 24:52–57. https://doi.org/10.1183/09059180.10010814
Article PubMed Google Scholar
- Ma S, Lin YY, Cantor JO et al (2016) The effect of alpha-1 proteinase inhibitor on biomarkers of elastin degradation in alpha-1 antitrypsin deficiency: an analysis of the RAPID/RAPID extension trials. Chronic Obstr Pulm Dis 4:34–44.