Комітет з клінічних стандартів
Міжнародне товариство ультразвуку в акушерстві та гінекології (МТУАГ) – це наукова організація, яка сприяє розвитку належної клінічної практики, а також високоякісному навчанню та дослідженням, пов’язаним з діагностичною візуалізацією у сфері охорони здоров’я жінок. Комітет клінічних стандартів МТУАГ (ККС) має повноваження розробляти Практичні Настанови та Консенсусні Заяви як освітні рекомендації, які надають практикуючим лікарям заснований на консенсусі підхід до діагностичної візуалізації, що базується на думці експертів. Вони призначені для відображення того, що МТУАГ вважає найкращою практикою на момент їх видання. Хоча МТУАГ докладає всіх зусиль, щоб забезпечити точність Настанов на момент їх видання, ні Товариство, ні будь-хто з його співробітників або членів не несе відповідальності за наслідки будь-яких неточних або оманливих даних, думок або заяв, виданих ККС. Документи ККС МТУАГ не призначені для встановлення правового стандарту надання медичної допомоги, оскільки на інтерпретацію доказів, що лежать в основі Настанов, можуть впливати індивідуальні обставини, місцеві протоколи та наявні ресурси. Затверджені Настанови можуть вільно розповсюджуватися з дозволу МТУАГ (info@isuog.org).
ВСТУП
Ефективний скринінг серця плода повинен максимально виявляти структурні аномалії та (відповідно до наявного досвіду та ресурсів) порушення функції та ритму в рамках рутинного пренатального догляду. Цей документ містить рекомендації щодо низькоризикового ультразвукового скринінгу серця плода під час другого триместру вагітності, оновлені порівняно з раніше опублікованими Настановами 1. Також розглядається практична реалізація скринінгу серця наприкінці першого триместру та на початку другого триместру, коли це технічно можливо. Ці Настанови заохочують використання кольорової доплерографії та вводять нові розділи, присвячені забезпеченню якості та використанню контрольного списку. Медичні працівники також можуть використовувати ці Настанови для виявлення вагітностей з ризиком генетичних аномалій 2 та надання своєчасних рекомендацій для консультування пацієнток, акушерського менеджменту та мультидисциплінарної допомоги. Випадки з підозрою на аномалії серця та/або з підвищеним ризиком потребують проведення ехокардіографії плода 3–6.
Вроджені вади серця (ВВС) мають поширеність 8,2 на 1000 живонароджених і є основною причиною дитячої захворюваності та смертності 7. Пренатальна діагностика може покращити результати пологів до втручання 8, особливо для певних типів ураження серця 9–15. Пренатальна обізнаність про ВВС та навчання батьків дозволяють підготуватися до народження новонародженого, який потребуватиме спеціалізованого догляду та послуг. Вплив пренатальної діагностики також може мати відношення до довгострокових результатів неврологічного розвитку 16,17 , і це максимізує можливості для сім’ї. Однак показники пренатальної діагностики широко варіюють у різних географічних регіонах і для різних типів ВВС, причому менше половини серцевих аномалій виявляють до народження 7,18,19. Певні відмінності можна пояснити різницею у кваліфікації лікарів, частотою використання датчиків, особливостями будови тіла пацієнта, наявністю рубців на животі, терміном вагітності, об’ємом навколоплідних вод та положенням плода 20–23. Безперервне навчання медичних працівників на основі зворотного зв’язку, низький поріг для направлення на ехокардіографію, використання стандартизованих протоколів УЗД та легкий доступ до спеціалістів з вивчення серця плода можуть покращити ефективність скринінгової програми 14,24–26.
ЗАГАЛЬНІ ПОЛОЖЕННЯ
Незважаючи на добре задокументовану корисність чотирикамерного зрізу та зображення вихідного тракту, слід пам’ятати про потенційні діагностичні пастки, які можуть перешкоджати своєчасному виявленню ВВС 27–29. Частоту виявлення можна оптимізувати шляхом проведення ретельного скринінгового обстеження серця, усвідомлення того, що чотирикамерне та трьохсудинне зображення вимагають набагато більше, ніж простого підрахунку серцевих структур, розуміння того, що деякі ураження не виявляються до пізніх термінів вагітності, а також усвідомлення того, що певні типи аномалій (наприклад, транспозиція магістральних судин, коарктація аорти) можуть бути невидимими лише на чотирикамерному зрізі. Доповнення чотирикамерного зрізу знімками вихідних трактів та магістральних судин при скринінговому обстеженні серця відіграло важливу роль у покращенні виявлення ВВС 24,30,31.
Термін вагітності
Скринінгове кардіологічне обстеження оптимально проводити між 18 і 22 тижнями вагітності . Скринінг у 20-22 тижні з меншою ймовірністю потребує додаткового сканування для завершення цієї оцінки порівняно зі скринінгом у 18-20 тижнів, хоча багато пацієнтів хотіли б знати про основні вади якомога раніше під час вагітності 32. Багато анатомічних структур можна успішно візуалізувати після 22 тижнів, а деякі серйозні вади серця можуть бути виявлені наприкінці першого та на початку другого триместрів, особливо якщо підвищена товщина просвічуваної тканини пуповини викликає підозру або якщо під час більш ранніх сканувань робилися спроби візуалізувати серце плода 33–39.
Технічні фактори
Ультразвуковий датчик
Більш високочастотні датчики підвищують ймовірність виявлення малопомітних дефектів за рахунок зменшення акустичного проникнення. Найвища можлива частота датчика повинна використовуватися для всіх досліджень, визнаючи компроміс між проникненням і роздільною здатністю. Тканинна гармонійна візуалізація забезпечує покращене зображення, особливо у пацієнтів зі збільшеною товщиною черевної стінки та під час третього триместру вагітності 40.
Параметри візуалізації
Поперечний переріз зображення у відтінках сірого є основою надійного сканування серця плода. Налаштування системи повинні бути спрямовані на високу частоту кадрів, підвищену контрастність і високу роздільну здатність. Також слід використовувати низьку персистентність, єдину акустичну фокальну зону і відносно вузьке поле зображення, які зазвичай включені в кардіологічні пресети. Сучасні ультразвукові системи також мають розширені можливості постобробки зображень, що сприяє покращенню відображення зображень .
Масштабування, циклічне відтворення та зберігання зображень
Зображення слід збільшувати до тих пір, поки серце не заповнить принаймні третину або половину екрану. Функцію циклічної петлі слід використовувати для оцінки нормальних структур серця в реальному часі, наприклад, для підтвердження руху стулок серцевого клапана протягом серцевого циклу. Збільшення зображення та використання кінематографічної петлі також може допомогти у виявленні аномалій . Для структур і видів, зазначених у цій Настанові, ми рекомендуємо архівувати стоп-кадри і відеокліпи, а також враховувати місцеві/національні стандарти. Обстеження слід записувати таким чином, щоб забезпечити можливість подальшого перегляду для перевірки його діагностичної адекватності, з відповідною ідентифікацією пацієнта та маркуванням латералізації та орієнтації зображення, коли це доцільно .
КАРДІОЛОГІЧНЕ ОБСТЕЖЕННЯ
Скринінгове кардіологічне обстеження повинно включати визначення положення плода та огляд чотирьох камер, вихідного тракту та магістральних судин 30,31,41–49. Ця оцінка підвищує частоту виявлення основних вад серця, ніж при використанні лише чотирикамерного зрізу 24,30,31,50,51. Включення зображень вихідного тракту та магістральних судин дозволяє виявити такі аномалії, як тетрада Фалло, транспозиція магістральних судин, двостулковий правий шлуночок та загальний артеріальний стовбур 44–47,52–57. Цей стандартизований робочий процес також може виявити аномалії півмісяцевих клапанів, такі як аортальний та легеневий стеноз, які можуть прогресувати в міру розвитку вагітності 58,59.
Розміщення і чотирикамерний зріз
Сонографічна методика
Для оцінки серцевої позиції необхідно спочатку визначити латеральність плода, тобто визначити правий та лівий бік плода, виходячи з положення плода в матці, перш ніж переконатися, що і шлунок, і серце знаходяться з лівого боку плода 48,60–62. У другому триместрі серце розташовується в горизонтальній площині в грудній клітці, утримуючись на місці печінкою плода, яка поширюється на лівий бік черевної стінки плода 63,64. Поперечне сканування з краніальним рухом датчика від живота плода до грудної клітки дозволяє візуалізувати черевну порожнину і чотирикамерний зріз (Зобр. 1 і 2).
Зображення 1 Техніка сканування серця плода в послідовних площинах. (I) Спочатку візуалізується аксіальний вигляд верхньої частини живота. (II) Переміщенням і нахилом датчика в краніальному напрямку отримують знімок чотирьох камер через аксіальну площину сканування, що проходить через грудну клітку плода. Подальше переміщення датчика від чотирикамерного зрізу у напрямку до голови плода дозволяє послідовно отримати знімок вихідного тракту та магістральних судин: (III) знімок вихідного тракту лівого шлуночка; (IV) знімок вихідного тракту правого шлуночка та варіанти знімку трьох судин; та (V) знімок трьох судин та трахеї.
Зображення 2 П’ять аксіальних знімків для оптимального скринінгу серця плода, що відповідають площинам, показаним на Зображенні 1. На схемі показані трахея, серце і магістральні судини, печінка і шлунок, з п’ятьма площинами інсоляції, позначеними багатокутниками, що відповідають знімкам у відтінках сірого, як зазначено. (I) Найбільш каудальна площина, що показує шлунок плода (St), поперечний переріз низхідної аорти (dAo) і нижньої порожнистої вени (IVC), хребет (Sp) і печінку (Li). (II) Чотирикамерний зріз серця плода, що показує правий і лівий шлуночки (RV, LV) та передсердя (RA, LA), овальний отвір (FO) та легеневі вени (PV) праворуч і ліворуч від dAo. (III) Вигляд вихідного тракту лівого шлуночка, що показує проксимальну висхідну аорту (Ао), LV, RV, LA і RA, а також поперечний переріз dAo. (IV) Дещо більший краніальний знімок (вигляд вихідного тракту правого шлуночка), що показує головну легеневу артерію (MPA) і біфуркацію на праву (RPA) і ліву (LPA) легеневі артерії, а також поперечні перерізи Ao і dAo. (V) трьохсудинно-трахеальний знімок, що показує верхню порожнисту вену (SVC), MPA, артеріальну протоку (DA), поперечну дугу аорти (від проксимального відділу Ao до dAo) і трахею (Tr). L, ліворуч, R, праворуч.
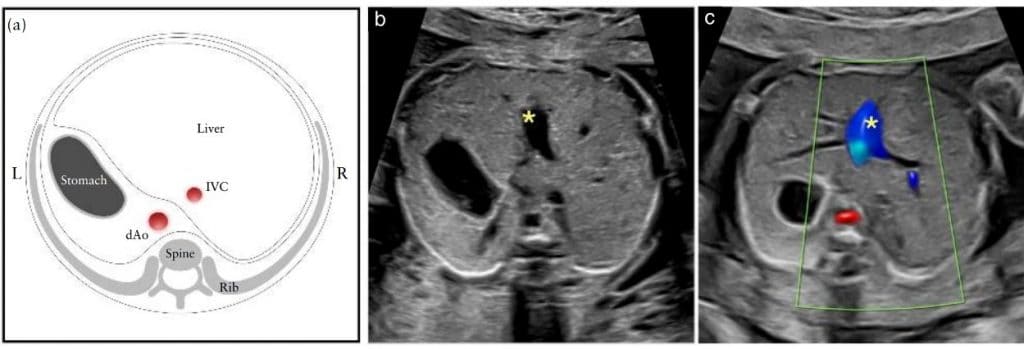
Зображення 3 Схематична діаграма (а) та відповідні градації сірого (б) і кольорові доплерівські (в) ультразвукові знімки аксіальної проекції верхньої частини живота плода. (а) Абдомінальне розміщення визначається на поперечному знімку живота плода. Після визначення латерального положення плода з позиції плода в матці, шлунок повинен бути ідентифікований з лівого боку плода, а низхідна аорта (dAo) та нижня порожниста вена (IVC) – з лівого та правого боку хребта, відповідно. (b,c) Короткий сегмент пупкової вени (∗) видно в центрі печінки. L, ліворуч, R, праворуч.
Розміщення
Розташування органів черевної порожнини отримано на рівні стандартного вимірювання окружності живота, живіт видно зліва. Крім того, поперечні перерізи низхідної аорти та нижньої порожнистої вени видно з лівого та правого боку хребта відповідно (Зображення 3). Ідентифікація нормального розміщення органів черевної порожнини є сурогатом нормального розміщення передсердь (situs solitus, тобто праве передсердя праворуч, а ліве – ліворуч).
Чотирикамерний зріз
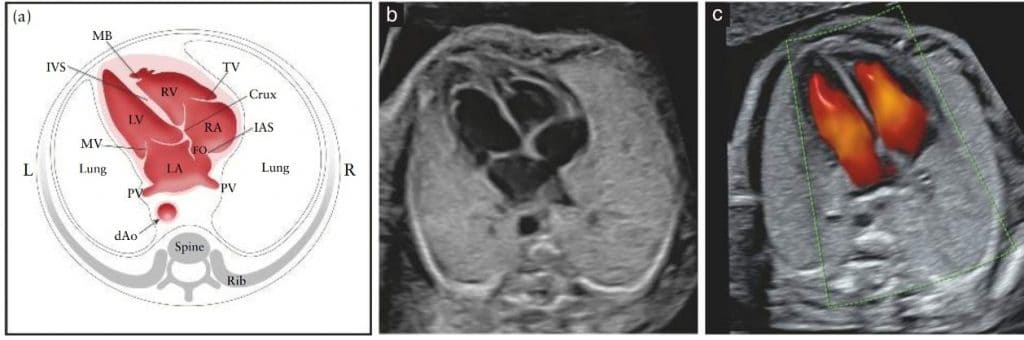
Оцінка чотирикамерного зрізу передбачає ретельну оцінку конкретних критеріїв. Основні елементи для огляду чотирьох камер показані в Таблиці 1 і на Зображеннях 4 і 5. Нормальне серце зазвичай не перевищує третини площі грудної клітки. Невелика кількість перикардіальної рідини зазвичай спостерігається протягом другого та третього триместрів (≤ 2 мм в товщину, в кінці систоли) і є нормальним явищем 65. При деяких видах дослідження можна також виявити невеликий гіпоехогенний обідок навколо серця плода, тому слід бути обережним, щоб не сплутати його з перикардіальним випотом 66.
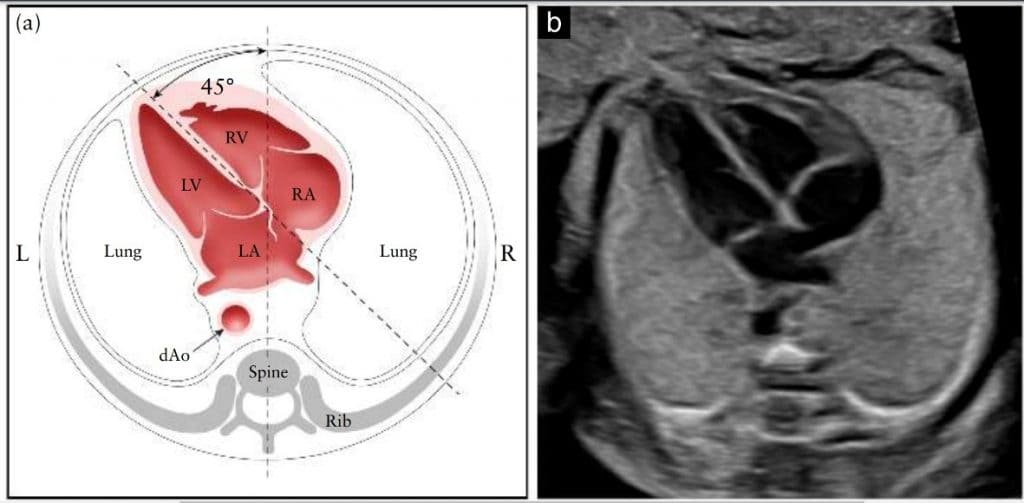
Серце розташоване переважно в лівій частині грудної клітки, і його довга вісь в нормі спрямована вліво приблизно на 45 ± 20◦ (2 СВ) 67 відносно передньо-задньої осі грудної клітки (Зображення 4). Особливу увагу слід приділяти осі та положенню серця, які можна легко оцінити, навіть якщо чотирикамерний зріз візуалізується незадовільно 68. Аномалії розташування органів слід запідозрити, якщо серце та/або шлунок плода не виявляються з лівого боку. Аномальна серцева вісь збільшує ризик серцевої вади, особливо з залученням трактів виходу 69. Ця знахідка також може бути пов’язана з хромосомною аномалією. Аномальне зміщення серця з його нормальної передньої лівої позиції може бути спричинене діафрагмальною грижею або об’ємним ураженням, наприклад, вродженою вадою легеневих дихальних шляхів.
Таблиця 1 Оцінка латерального положення плода / Розміщення та чотирикамерний зріз плода
*Нормальне розміщення органів черевної порожнини: передбачає нормальне положення камер передсердь (тобто нормальне положення).
Аномалії положення також можуть бути вторинними через гіпоплазію або агенезію легень плода 70. Зсув осі вліво також може виникати при гастрошизисі та омфалоцеле плода.
Необхідно підтвердити нормальну частоту серцевих скорочень і регулярний ритм. Нормальна частота коливається від 120 до 160 ударів за хвилину (уд./хв). Пропущені (або позачергові) удари є найпоширенішим порушенням ритму. Часто вони є доброякісними і зникають спонтанно. У популяціях з низьким ризиком вони не пов’язані з підвищеним ризиком структурних вад серця плода 71,72. Однак часті епізоди (більше ніж кожні три-п’ять ударів) або стійко нерегулярний серцевий ритм (> 1-2 тижнів) є показанням для подальшого обстеження 5,6,71,73–75. Брадикардія, часто пов’язана з тиском датчика на живіт, спостерігається тимчасово у нормальних плодів у другому триместрі. Стійка брадикардія (≤ 110 уд/хв) у добре розвиненого плода вимагає своєчасного обстеження фетальним кардіологом 76,77. Можливі причини включають часті блоковані передсердні позачергові скорочення, атріовентрикулярну блокаду та синусову брадикардію 78,79. Повторне уповільнення серцебиття протягом третього триместру може бути спричинене гіпоксією плода. Легка транзиторна тахікардія (160-180 уд/хв) може виникати як нормальний варіант під час ворушіння плода. Однак стійка тахікардія (≥ 180 уд./хв)78,80 потребує подальшого обстеження для виявлення більш серйозних тахіаритмій або гіпоксії плода.
Зображення 4 Визначення положення та осі серця, як показано на схематичній діаграмі (а) та відповідному напівтоновому ультразвуковому зображенні (b). Уявна лінія, проведена від хребта ззаду до грудини спереду, ділить грудну клітку на дві рівні частини, ліву (L) і праву (R). Нормальне серце плода лежить переважно зліва, верхівка серця спрямована вліво під кутом 45 ± 20◦ по відношенню до передньо-задньої осі грудної клітки. dAo, низхідна аорта; LA, ліве передсердя; LV, лівий шлуночок; RA, праве передсердя; RV, правий шлуночок.
Зображення 5 Схематичний малюнок (а) та відповідні напівтонові (b) і кольорові доплерівські (с) ультразвукові знімки в чотирикамерному зрізі. Ключовими елементами нормальної чотирикамерної картини у другому триместрі є площа серця, що не перевищує третини площі грудної клітки, право- та лівобічні структури приблизно однакові (за розміром камер та товщиною стінок), відкрите овальне вікно (FO) з клапаном у лівому передсерді (LA), внутрішнє серцеве перехрестя з нормальним зміщенням обох атріовентрикулярних клапанів та інтактна міжшлуночкова перегородка (IVS). В (а) і (b) морфологічно правий шлуночок (RV) ідентифікується за наявністю септомаргінальної трабекули (MB) і трикуспідального клапана (TV), зі передньою стулкою, вставленою в перегородку більш апікально порівняно зі стулкою мітрального клапана (MV) (нормальний зсув). Легеневі вени (PV) також входять у LA. На кольоровій доплерограмі (с) під час діастоли видно два окремі притоки крові до шлуночків. dAo, низхідна аорта; IAS, міжпередсердна перегородка; L, ліворуч; LV, лівий шлуночок; R, праворуч; RA, праве передсердя.
Обидві камери передсердь в нормі мають однаковий розмір, а стулка овального отвору рухається в межах лівого передсердя. Нижній край міжпередсердної перетинки, який називають первинною перетинкою, повинен бути присутнім і є частиною внутрішньосерцевого перехрестя – місця, де нижня частина міжпередсердної перетинки з’єднується з верхньою частиною міжшлуночкової перетинки, і де знаходяться атріовентрикулярні клапани. Легеневі вени часто можна побачити при вході в ліве передсердя і, коли це технічно можливо, рекомендується візуалізація принаймні однієї з цих вен у В-режимі. Хоча кольоровий потік може полегшити їх візуалізацію, це не слід вважати обов’язковим. При використанні кольорового доплерівського ультразвуку слід відображати його разом із знімком у В-режимі, щоб уникнути хибнонегативних результатів 81.
Септомаргінальна трабекула, чіткий м’язовий пучок, який перетинає порожнину правого шлуночка, видно біля верхівки і допомагає ідентифікувати морфологічно правий шлуночок. Верхівка лівого шлуночка виглядає гладкою і утворює верхівку серця. Обидва шлуночки повинні виглядати однаковими за розміром і не мати ознак потовщення стінок. Хоча легка диспропорція шлуночків може виникати як нормальний варіант у третьому триместрі вагітності, асиметрія правого та лівого шлуночків при багатоводді вимагає подальшого обстеження 82; коарктація аорти, синдром гіпоплазії лівих відділів серця, що розвивається, та аномальний легеневий венозний дренаж можуть бути важливими причинами цієї диспропорції 83–85.
Міжшлуночкову перегородку слід ретельно оглянути на наявність дефектів серцевої стінки від верхівки до внутрішньосерцевого перехрестя і, якщо можливо, слід провести обстеження, яке починається з задньої частини перегородки і рухається у напрямку до вихідних трактів. Дефекти перегородки може бути важко виявити. Перегородку найкраще видно, коли кут інсоляції перпендикулярний до неї. Коли ультразвуковий промінь прямо паралельний стінці шлуночка, можна помилково запідозрити дефект біля серцевини через акустичний артефакт “випадіння”. Невеликі дефекти перегородки (1-2 мм) може бути дуже важко підтвердити, якщо система ультразвукової візуалізації не може забезпечити достатній рівень бічної роздільної здатності, особливо при несприятливому розмірі та положенні плода. Однак у більшості випадків вони мають обмежене клінічне значення і можуть навіть спонтанно закриватися в матці 86,87.
Два окремі атріовентрикулярні клапани (правосторонній, трикуспідальний; лівосторонній, мітральний) повинні відкриватися окремо і вільно. Стулка тристулкового клапана входить в перетинку ближче до верхівки, ніж стулка мітрального клапана (тобто нормальне зміщення). Аномальне розташування атріовентрикулярних клапанів може бути ключовою сонографічною ознакою серцевих аномалій, таких як дефект міжшлуночкової перетинки.
Зріз вихідного тракту, трьохсудинний та трьохсудинно-трахеальний зрізи
Візуалізація лівого (ВТЛШ) та правого (ВТПШ) вихідних трактів шлуночків, а також трьохсудинне (3СЗ) та трьохсудинно-трахеальне (3СТЗ) зображення тепер вважаються невід’ємною частиною скринінгового кардіологічного обстеження плода. Важливо встановити нормальний стан двох магістральних судин, включаючи з’єднання з правильним шлуночком, їх розмір і положення відносно один одного, а також нормальний вигляд і відкриття півмісяцевих клапанів. У великому акушерському ультразвуковому дослідженні у понад 18 000 плодів 88 вивчалася практика включення чотирикамерного зрізу і, коли це технічно можливо, оцінка вихідних трактів до рутинного 30-хвилинного ультразвукового дослідження у другому триместрі вагітності. Більшість (93%) досліджень, які включали адекватний чотирикамерний зріз, також були пов’язані із задовільною оцінкою трактів виходу. Частота невізуалізації становила 4,2% для ВТЛШ, 1,6% для ВТПШ і 1,3% для обох трактів виходу.
Дослідження шлуночкових вихідних трактів і судин вимагає, як мінімум, встановлення того, що магістральні судини приблизно однакові за розміром. Будь-яка значна розбіжність у їх розмірах повинна призвести до подальшого обстеження. Оскільки вони виходять з відповідних шлуночків, слід підтвердити три фактори. Перший – при нормальному ВТЛШ перша магістральна судина виходить з лівого шлуночка, а її передня стінка є суцільною з міжшлуночковою перетинкою. Вона не роздвоюється, що вказує на те, що це аорта. Другий – при нормальному ВТПШ магістральна судина, яка виходить з лівого шлуночка, роздвоюється, що вказує на те, що це легенева артерія. Третій – обидві магістральні судини повинні перетинати одна одну (нормальний “перехрест”).
На додаток до зображення трактів виходу, слід використовувати тісно пов’язані зображення 3CЗ та 3СТЗ, щоб допомогти виявити аномалії, що стосуються трактів виходу 52,54,56,89, дуги аорти 45,54,56,90 та системних вен 91, включаючи персистентну ліву верхню порожнисту вену 92–94 та аномалії тимуса 95–97. Аномалії, які можуть бути виявлені, включають транспозицію магістральних судин, тетраду Фалло, а також аортальний та легеневий стеноз. Більш краніальна і кутова 3СТЗ дозволяє більш детально оцінити положення дуги аорти і артеріальної протоки та їх відношення до трахеї 55. Це особливо корисно для виявлення аномалій дуги аорти, таких як коарктація аорти, судинні кільця та аберантна права підключична артерія 98.
Сонографічна методика
Виконання поперечного сканування з краніальним рухом датчика від чотирикамерного зрізу до верхньої частини грудної клітки дозволяє послідовно оцінити серцеві структури і отримати зображення, необхідні для встановлення нормальності відтоку крові та судин: зображення ВТЛШ і ВТПШ, 3СЗ і 3СТЗ 99 (Зображення 1 і 2). При ідеальному обстеженні ці зображення можна отримати з відносною легкістю. При несприятливому положенні плода може знадобитися додатковий час обстеження або повторне обстеження.
Як правило, зображення вихідного тракту та магістральних судин отримують паралельним рухом датчика в напрямку голови плода (техніка розгортки), що супроводжується невеликими змінами кута інсоляції, починаючи з чотирикамерного зрізу, для візуалізації нормального перехрещення аорти та головної легеневої артерії в місці їхнього відтоку. Також можна побачити деталі біфуркації легеневої артерії. В якості альтернативи описаний варіант методу оцінки вихідних трактів у плода: ротаційна техніка 43. Вона починається з чотирикамерного зрізу серця, при цьому датчик спочатку обертається в напрямку правого плеча плода. Ця методика, яка легше виконується, коли міжшлуночкова перетинка перпендикулярна до ультразвукового променя, може вимагати дещо більших навичок, але оптимізує візуалізацію ВТЛШ, особливо вихідної частини перетинки, яка є продовженням передньої стінки аорти. Вона також дозволяє візуалізувати висхідну частину аорти. В обох методиках після отримання зображення ВТЛШ датчик повертають під кутом краніально до тих пір, поки не буде видно легеневу артерію в напрямку, майже перпендикулярному до напрямку аорти. Відносні співвідношення ВТПШ і ВТЛШ найкраще демонструвати за допомогою відеокліпів, а не стоп-кадрів.
3СЗ і 3СТЗ є додатковими зображеннями аорти і легеневої артерії і показують їх взаємовідношення з верхньою порожнистою веною і трахеєю. Ці зображення можна отримати шляхом подальшого руху датчика краніально до плода від ВТПШ, що супроводжується невеликими змінами кута інсоляції для отримання найкращої роздільної здатності для різних структур на кожному зображенні. На цьому рівні можна візуалізувати дугу протоки а також дугу аорти 52–55.
Зріз вихідного тракту лівого шлуночка (ВТЛШ)
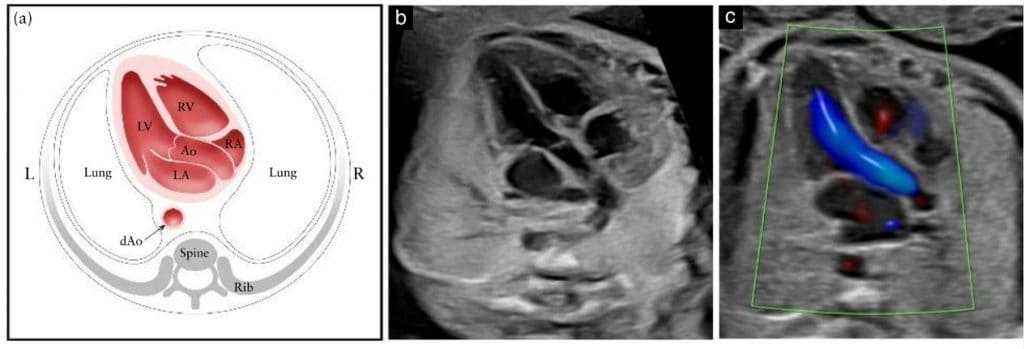
ВТЛШ зображення підтверджує наявність магістральної судини, що бере початок з морфологічного лівого шлуночка (Зображення 6) та з центру серця. Між міжшлуночковою перетинкою і передньою стінкою цієї судини повинна бути задокументована безперервність, щоб продемонструвати цілісність інфундибулярної перегородки. Однак лише наявність судин голови та шиї, що відходять від неї, підтверджує, що ця судина є аортою. Аортальний клапан повинен вільно рухатися і не повинен бути потовщеним. Можна простежити аорту до її дуги, від якої відходять три артерії в шию. Однак сагітальні зображення дуги аорти і протоки та оцінка судин шиї наразі не вважаються частиною рутинного скринінгового кардіологічного обстеження. ВТЛШ зріз допомагає виявити дефекти вихідної міжшлуночкової перегородки та конусно-стовбурові аномалії, а також аномалії аортального клапана, які не видно на чотирикамерному зрізі.
Зріз вихідного тракту правого шлуночка (ВТПШ), трьохсудинний (3СЗ) та трьохсудинно-трахеальний (3СТЗ) зрізи
Опис взаємозв’язків між різними структурами у зрізі ВТПШ, 3СЗ і 3СТЗ (Зображення 7–9) є точним засобом опису багатьох серцевих вад. Хоча спочатку вони були описані як специфічні нерухомі зрізи, зараз визнано, що вигляд в аксіальній площині ВТПШ, гілок легеневих артерій, а також дуг протоки та аорти являє собою континуум “зрізів”, які можуть дещо відрізнятися в залежності від положення датчика, лежання плода і точної площини, зафіксованої в нерухомому кадрі (Зображення 8). Така оцінка, ймовірно, буде більш надійною під час сканування в реальному часі або при перегляді кіноплівки, а не лише на основі серії нерухомих зрізів 6.
Візуалізація ВТПШ підтверджує наявність магістральної судини, легеневої артерії, яка бере початок від морфологічного правого шлуночка (Зображення 7 і 8) і розгалужується після короткого ходу. Легеневий клапан повинен вільно рухатися і не повинен бути потовщеним. Нормальна легенева артерія проходить ліворуч від задньої частини висхідної аорти, яку видно на поперечному зрізі. Зазвичай вона трохи більша за висхідну аорту під час внутрішньоутробного життя і перетинає висхідну аорту спереду і краніально до ВТЛШ майже під прямим кутом. На цьому рівні праворуч від аорти видно верхню порожнисту вену.
3СЗ і 3СТЗ спочатку були описані як доповнення до чотирикамерного зрізу з метою підвищення чутливості скринінгового кардіологічного обстеження. Yoo та співавт. 52 описали 3СЗ для оцінки легеневої артерії, висхідної аорти і верхньої порожнистої вени та їх відносних розмірів і взаємозв’язків (Зображення 8). Це передбачає оцінку кількості, розміру, розташування та співвідношення судин. Зліва направо показані легенева артерія, аорта та права верхня порожниста вена. Легенева артерія є передньою судиною, а верхня порожниста вена – задньою. Їх відносні діаметри повинні зменшуватися зліва направо. Поширені аномалії, пов’язані з на перший погляд нормальним чотирикамерним зрізом, такі як повна транспозиція магістральних судин, тетрада Фалло, подвійний відходження судин від правого шлуночка, і загальний артеріальний стовбур, а також атрезія легеневої артерії з дефектом міжшлуночкової перегородки, як правило, будуть аномальними при 3СЗ 100,101.
Зображення 6 Схематичне зображення (а) та відповідні напівтонові (b) і кольорові доплерівські (с) ультразвукові зображення вихідного тракту лівого шлуночка, отримані з апікального підходу. На цьому знімку видно судину, з’єднану з лівим шлуночком (LV). Важливо продемонструвати послідовність між міжшлуночковою перетинкою та передньою стінкою цієї судини, яка в нормальному серці плода відповідає проксимальному відділу висхідної аорти (Ао). Аортальний клапан не повинен бути потовщеним і повинен вільно відкриватися. (c) Кольоровий доплерівський знімок під час систоли демонструє ламінарний потік через Ао та вздовж безперервного перегородково-аортального сполучення. dAo – низхідна аорта; L – ліворуч; LA – ліве передсердя; R – праворуч; RA – праве передсердя; RV – правий шлуночок.
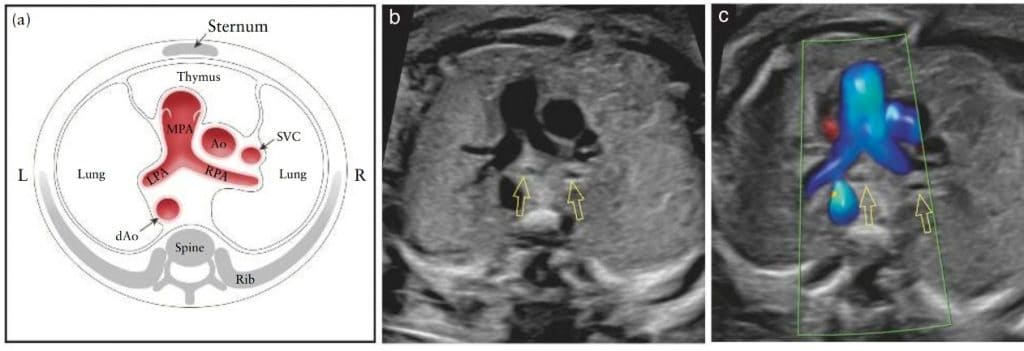
Зображення 7 Схематичне зображення (а) та відповідні напівтонові (b) і кольорові доплерівські (с) ультразвукові знімки вихідного тракту правого шлуночка, які є близькими до трьохсудинного зрізу. Цей вид демонструє не лише головну легеневу артерію (MPA), з’єднану з правим шлуночком, але й висхідну аорту (Ao) та верхню порожнисту вену (SVC). Легеневий клапан не повинен бути потовщеним і повинен вільно відкриватися. Можна побачити роздвоєння MPA на обидві легеневі гілки (ліву (LPA) та праву (RPA) легеневі артерії). Важливо звернути увагу на правильне положення та співвідношення трьох судин, а також на їхній відносний розмір. MPA, зліва, є найбільшою з трьох і передньою, тоді як SVC є найменшою і задньою. На (b) і (c) видно бронхіальні гілки (відкриті стрілки). На (c) кольорова доплерографія демонструє основну МPA під час систоли, з її біфуркацією на LPA і RPA. Зверніть увагу, між судинами та передньою грудною стінкою можна ідентифікувати гіпоехогенну ділянку тимуса. dAo – низхідна аорта; L – ліворуч; R – праворуч.
Зображення 8 Варіанти вигляду вихідного тракту правого шлуночка та трьохсудинного зрізу. На (а) видно правий шлуночок (RV) з легеневим клапаном (PV) і головною легеневою артерією (MPA), а також висхідну аорту (Ao) і верхню порожнисту вену (SVC). На (b), у дещо більшій краніальній площині видно біфуркацію MPA на ліву (LPA) та праву (RPA) легеневі артерії. На (c), у ще більш краніальній площині, видно, що MPA неперервно зливається з артеріальною протокою (DA), яка формує дугу протоки. На зображенні (d) DA візуалізується разом з PV, тоді як на зображенні (e) DA видно в більш краніальній площині, без PV, а також починає проглядатися тимус (Th). Трахея також починає проглядатися там, де в нижніх площинах (с) візуалізувалися бронхи. На (f), трьохсудинно-трахеальному зрізі видно дуги аорти і протоки зліва від трахеї, а також Th спереду магістральних судин. dAo, низхідна аорта.
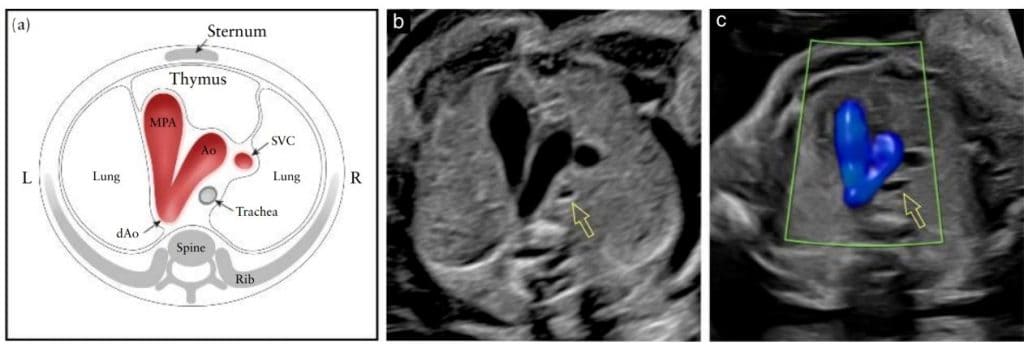
Зображення 9 Схематичне зображення (а) та відповідні сірі (b) і кольорові доплерівські (с) ультразвукові трьохсудинно-трахеальні зрізи. У нормальному серці плода дуга аорти (Ао) та дуга протоки, яка простягається від головної легеневої артерії (МРА) до низхідної аорти (dAo), розташовані зліва від трахеї, у V-подібній конфігурації. На (b) і (c) показано взаємовідношення Ао з трахеєю (відкрита стрілка). На (с) кольорова доплерографія під час систоли демонструє антеградний потік в дузі протоки та Ao. Зверніть увагу, між судинами та передньою грудною стінкою можна ідентифікувати гіпоехогенну ділянку тимуса. L, ліворуч; R, праворуч; SVC, верхня порожниста вена.
Пізніше Yagel та співавт. 55 описали 3СТЗ, краніальний зріз по відношенню до 3СЗ, в якому візуалізується дуга аорти (“зріз дуги аорти”) і підкреслюється її взаємозв’язок з трахеєю (Зображення 9). На цьому зображенні в дещо нахиленій поперечній площині видно головну легеневу артерію в безпосередньому сполученні з артеріальною протокою. Нормальна дуга аорти розташована праворуч від головної легеневої артерії/дуги протоки. Трахею можна ідентифікувати як гіперехогенне кільце, що оточує невеликий простір, заповнений рідиною. Нормальна артеріальна протока та дуга аорти проходять ліворуч від трахеї і утворюють гострий кут (V-подібна форма). У цій площині також видно нормальну праву верхню порожнисту вену та тимус. Дуга аорти є більш краніальною, тому для одночасної візуалізації обох дуг може знадобитися певне налаштування датчика від істинної осьової площини. 3СТЗ, ймовірно, дозволить виявити такі ураження, як коарктація аорти, права дуга аорти та подвійна дуга аорти.
Аномалії, діагностовані за допомогою 3СЗ та 3СТЗ, можуть надати інформацію для консультування та лікування (наприклад, показання до пренатального тестування на мікроделецію 22q11), вплинути на планування місця пологів (наприклад, при повній транспозиції магістральних судин) та негайного післяпологового догляду (наприклад, потреба в інфузії простагландинів), а також дозволити передбачити потенційні проблеми з дихальними шляхами внаслідок судинної компресії 102.
КОЛЬОРОВЕ ПОТОКОВЕ ДОПЛЕРІВСЬКЕ УЛЬТРАЗВУКОВЕ ДОСЛІДЖЕННЯ
Хоча використання кольорової доплерографії не вважається обов’язковим у цих Настановах, ознайомлення з її застосуванням та включення до рутинного скринінгу заохочується 103. Відображення кольорового потоку є невід’ємною частиною ехокардіограми плода, і його роль у діагностиці ВВС не може бути недооціненою. Воно може бути включене під час рутинного скринінгу, якщо оператор відчуває себе компетентним у його використанні. У нормальному серці плода кольорове картування потоку продемонструє антеградний потік через атріовентрикулярний і півмісяцевий клапани та магістральні судини. Це також може полегшити візуалізацію різних серцевих структур. Наприклад, візуалізація потоку в аорті та дузі аорти допомагає виявити “V-подібний знак”, а також виділити аномалії кровотоку, такі як регургітація атріовентрикулярного клапана та реверс потоку в артеріальній протоці та дузі аорти. Це також може бути цінним інструментом в оцінці анатомії серця у пацієнтів з ожирінням 104,105 і може сприяти подальшому підвищенню частоти виявлення серйозних ВВС у вагітних з низьким ризиком 47,106.
Оптимальні налаштування кольорового доплера включають використання вузького кольорового поля, розташованого лише над областю, що становить інтерес для оцінки, а не охоплює весь двовимірний об’єм знімка серця. Обмеження кольорового поля певною областю інтересу оптимізує частоту кадрів і якість кольорового знімка, що дозволить відображати потік через клапани і судини без перешкод або затримки знімків в реальному часі. Під час рутинного скринінгу в другому триместрі шкала швидкості кольорового потоку повинна бути встановлена на рівні 50-70 см/с для внутрішньосерцевих структур і судин. Це налаштування та низька стійкість потоку кольору зазвичай включені в кардіологічні пресети. Однак, при дослідженні венозних структур шкала швидкості повинна бути встановлена нижче (приблизно 15-25 см/с).
ЕХОКАРДІОГРАФІЯ ПЛОДА
Плоди, у яких під час рутинного ультразвукового скринінгу серця виявлено або запідозрено аномалію, є кандидатами на проведення ехокардіографії плода 5,6 . Для плодів зі значними факторами ризику ВВС, тобто коли їх ризик вище, ніж у загальній популяції, ехокардіографія плода також показана на додаток до рутинного кардіологічного скринінгу, що залежить від таких факторів, як місцеві ресурси, клінічні умови, наявність спеціаліста та результати скринінгу. Однак, значну частку пацієнтів з ВВС, виявленою пренатально, складають пацієнти без будь-яких факторів ризику або екстракардіальних аномалій, що зумовлює важливість якісного скринінгу та своєчасного скерування до спеціаліста, якщо це свідчить про наявність патології.
Практикуючі лікарі повинні бути ознайомлені з поширеними причинами скерування на комплексну оцінку стану серця за допомогою ехокардіографії плода 5,6,107. Хоча точна оцінка ризику виходить за рамки цієї Настанови, невичерпний перелік поширених станів плода та пацієнтки, пов’язаних з підвищеним ризиком ВВС, наведено в Таблиці 2 6. Наприклад, товщина комірного просвіту ≥ 3,5 мм у терміні вагітності 11-14 тижнів є показанням для проведення детального кардіологічного обстеження 108–110 , навіть якщо в подальшому цей показник знаходиться в межах нормального діапазону.
Таблиця 2 Загальні показання до проведення ехокардіографії плода
*Наприклад, омфалоцеле, вроджена діафрагмальна грижа, підозра на атрезію стравоходу/шлунково-кишкову непрохідність 124. †Якщо дозволяють ресурси (двійні також спостерігаються фетальними спеціалістами). АПФ – ангіотензинперетворюючий фермент; анти-Ro/SSA – антиген-А, пов’язаний із синдромом Шегрена; ІМТ – індекс маси тіла; ВВС – вроджені вади серця; HbA1c – гемоглобін A1c; ІЦІС – інтрацитоплазматична ін’єкція сперматозоїдів; ЕКЗ – екстракорпоральне запліднення; СІЗЗС – селективний інгібітор зворотного захоплення серотоніну; ЄПA – єдина пупкова артерія.
Ехокардіографію плода найкраще проводити підготовленим фахівцем, який знайомий з пренатальною діагностикою ВВС, а також з постнатальним перебігом, лікуванням та прогнозом 3. Мета – провести комплексну оцінку серця плода і, якщо виявлено аномалію, проконсультувати батьків щодо діагнозу, довгострокових наслідків і результату, а також обговорити варіанти лікування. Пренатальне консультування після виявлення ВВС повинно також враховувати високу поширеність психологічного дистресу у матерів 111 , пов’язаного з виявленням ВВС у плода.
ГАРАНТІЯ ЯКОСТІ
При оцінці якості важливо перевірити різні аспекти скринінгового кардіологічного дослідження, щоб забезпечити повноту інформації, включаючи якість знімків, отримання стандартних площин огляду, належну інтерпретацію рекомендованих ракурсів сканування та повну документацію 112,113.
Хороші технічні показники залежать від оптимальних налаштувань УЗД, включаючи використання кардіологічних пресетів і відповідного збільшення. Це покращує якість зображення і полегшує здатність оператора чітко розпізнавати анатомічні орієнтири в різних рекомендованих площинах сканування. Якщо використовується кольорова доплерівська ультрасонографія, слід оптимізувати налаштування і встановити шкалу швидкостей відповідно до структур, що візуалізуються. Одне ретроспективне дослідження невдалого пренатального виявлення ВВС продемонструвало, що недотримання технічних критеріїв спричинило близько 50% пропущених аномалій 23. Однак, нездатність оператора розпізнати аномальну анатомію серця на технічно відповідному зображенні була причиною ще 31% пропущених випадків.
Постійна оцінка якості є надзвичайно важливою для акушерського ультразвуку та скринінгу серця плода. Політика аудиту, заснована на заздалегідь визначених критеріях якості для інтерпретації та оцінки нерухомих знімків або відеороликів, є важливим інструментом, використання якого заохочується і може зменшити кількість помилок пренатальної діагностики, таким чином покращуючи своєчасне виявлення ВВС 114–117. МТУАГ заохочує кожну практику візуалізації щорічно переглядати локальні показники виявлення та точності діагностики ВВС і, за необхідності, проводити подальше навчання.
РАННІЙ СКРИНІНГ СЕРЦЯ ПЛОДА
Доведено, що скринінг ВВС у першому триместрі вагітності є ефективним у популяціях з низьким ризиком 118. Однак він не є рутинним і не вважається обов’язковим. У країнах або центрах, де це можливо, ранній скринінг можна проводити під час сканування товщини комірного простору. Мінімальні вимоги до раннього скринінгу включають візуалізацію серця в грудній клітці та встановлення регулярного ритму 39. Слід мати на увазі, що через малий розмір серця плода на ранніх термінах гестації частота успішної візуалізації серцевих структур при детальному анатомічному дослідженні значно вища після 12+3 тижнів гестації 36,119,120.
Зображення 10 Дослідження серця на ранніх термінах вагітності повинно зосереджуватися на цих обраних площинах, як і в другому триместрі: (а) демонстрація осі серця (каліпер), (б) вигляд живота з демонстрацією живота зліва, (в) чотирикамерний зріз (напівтон), (г) чотирикамерний зріз (кольорова доплерографія) під час діастоли та (д) трьохсудинно-трахеальний зріз (кольорова доплерографія) під час систоли.
Хоча можна використовувати трансвагінальні датчики, рекомендована методика включає використання високочастотних трансабдомінальних датчиків завдяки їхній вищій роздільній здатності, а також використання кольорового та/або високоякісного енергетичного доплера (відображення двонаправленого потоку) на додаток до знімку в напівтонах. Кольорова та енергетична доплерографія повинна бути налаштована на пріоритет кольорового сигналу над напівтоном для покращення візуалізації кровотоку через дрібні структури в серці плода в першому триместрі. З міркувань безпеки доплер слід використовувати в першу чергу для скринінгу чотирикамерного зрізу та 3СТЗ. Остання заява з безпеки МТУАГ передбачає, що різні методи доплера можуть використовуватися в рутинному режимі в терміні від 11 + 0 до 13 + 6 тижнів за певних клінічних показань, включаючи скринінг аномалій серця. Тим не менш, важливо стежити за тепловим індексом, який повинен бути ≤ 1,0, а час експозиції повинен бути якомога коротшим (зазвичай не довшим за 5-10 хв) 121.
Наступні компоненти рекомендуються як частина детального раннього кардіологічного скринінгового обстеження 39 (Зображення 10)
(1) Оцінка положення плода, що визначається на напівтонових знімках, для встановлення нормального положення шлунка та серця, які повинні знаходитись з лівого боку плода. Також важливо оцінити серцеву вісь, оскільки вона є корисним маркером ВВС 122.
(2) Чотирикамерний зріз, що відображається за допомогою напівтонового і кольорового знімків та/або двонаправленої доплерографії. В ідеалі хребет візуалізується ззаду для адекватної демонстрації бівентрикулярного наповнення.
(3) 3СТЗ, що відображається за допомогою кольорового та/або двонаправленого доплерівського ультразвуку, для демонстрації лівосторонньої дуги аорти та протоки.
Візуалізація лівого та правого вихідних трактів на такому ранньому терміні вагітності часто є проблемою і схильна до хибнонегативного та хибнопозитивного діагнозу. Отже, якщо ранній скринінг серця виконується під час сканування товщини комірного простору, він повинен ґрунтуватися, головним чином, на визначенні положення плода та отриманні чотирикамерного зрізу і 3СТЗ 123. Якщо при цьому скануванні виникає підозра на ВВС, пацієнта слід скерувати на ранню ехокардіографію плода.
ПОСИЛАННЯ НА ДЖЕРЕЛА
- Carvalho JS, Allan LD, Chaoui R, Copel JA, DeVore GR, Hecher K, Lee W, Munoz H, Paladini D, Tutschek B, Yagel S. ISUOG Practice Guidelines (updated): sonographic screening examination of the fetal heart. Ultrasound Obstet Gynecol 2013; 41: 348–359.
- De Groote K, Vanhie E, Roets E, Ramaekers P, De Wilde H, Panzer J, Vandekerckhove K, Bove T, Francois K, Van Herck K, De Wolf D. Outcome after prenatal and postnatal diagnosis of complex congenital heart defects and the influence of genetic anomalies. Prenat Diagn 2017; 37: 983–991.
- Lee W, Allan L, Carvalho JS, Chaoui R, Copel J, Devore G, Hecher K, Munoz H, Nelson T, Paladini D, Yagel S. ISUOG consensus statement: what constitutes a fetal echocardiogram? Ultrasound Obstet Gynecol 2008; 32: 239–242.
- Rychik J, Ayres N, Cuneo B, Gotteiner N, Hornberger L, Spevak PJ, Van DV. American Society of Echocardiography guidelines and standards for performance of the fetal echocardiogram. J Am Soc Echocardiogr 2004; 17: 803–810.
- Donofrio MT, Moon-Grady AJ, Hornberger LK, Copel JA, Sklansky MS, Abuhamad A, Cuneo BF, Huhta JC, Jonas RA, Krishnan A, Lacey S, Lee W, Michelfelder EC, Rempel GR, Silverman NH, Spray TL, Strasburger JF, Tworetzky W, Rychik J. Diagnosis and Treatment of Fetal Cardiac Disease: A Scientific Statement From the American Heart Association. Circulation 2014; 129: 2183–2242.
- AIUM Practice Parameter for the Performance of Fetal Echocardiography. J Ultrasound Med 2020; 39: E5–E16.
- Liu Y, Chen S, Zuhlke L, Black GC, Choy MK, Li N, Keavney BD. Global birth prevalence of congenital heart defects 1970–2017: updated systematic review and meta-analysis of 260 studies. Int J Epidemiol 2019; 48: 455–463.
- Holland BJ, Myers JA, Woods CR, Jr. Prenatal diagnosis of critical congenital heart disease reduces risk of death from cardiovascular compromise prior to planned neonatal cardiac surgery: a meta-analysis. Ultrasound Obstet Gynecol 2015; 45: 631–638.
- Tworetzky W, McElhinney DB, Reddy VM, Brook MM, Hanley FL, Silverman NH. Improved surgical outcome after fetal diagnosis of hypoplastic left heart syndrome. Circulation 2001; 103: 1269–1273.
- Franklin O, Burch M, Manning N, Sleeman K, Gould S, Archer N. Prenatal diagnosis of coarctation of the aorta improves survival and reduces morbidity. Heart 2002; 87: 67–69.
- Blyth M, Howe D, Gnanapragasam J, Wellesley D. The hidden mortality of transposition of the great arteries and survival advantage provided by prenatal diagnosis. BJOG 2008; 115: 1096–1100.
- Kipps AK, Feuille C, Azakie A, Hoffman JI, Tabbutt S, Brook MM, Moon-Grady AJ. Prenatal diagnosis of hypoplastic left heart syndrome in current era. Am J Cardiol 2011; 108: 421–427.
- van Velzen CL, Haak MC, Reijnders G, Rijlaarsdam ME, Bax CJ, Pajkrt E, Hruda J, Galindo-Garre F, Bilardo CM, de Groot CJ, Blom NA, Clur SA. Prenatal detection of transposition of the great arteries reduces mortality and morbidity. Ultrasound Obstet Gynecol 2015; 45: 320–325.
- van Velzen CL, Clur SA, Rijlaarsdam ME, Bax CJ, Pajkrt E, Heymans MW, Bekker MN, Hruda J, de Groot CJ, Blom NA, Haak MC. Prenatal detection of congenital heart disease—results of a national screening programme. BJOG 2016; 123: 400–407.
- Bonnet D, Coltri A, Butera G, Fermont L, Le Bidois J, Kachaner J, Sidi D. Detection of transposition of the great arteries in fetuses reduces neonatal morbidity and mortality. Circulation 1999; 99: 916–918.
- Peyvandi S, De Santiago V, Chakkarapani E, Chau V, Campbell A, Poskitt KJ, Xu D, Barkovich AJ, Miller S, McQuillen P. Association of Prenatal Diagnosis of Critical Congenital Heart Disease With Postnatal Brain Development and the Risk of Brain Injury. JAMA Pediatr 2016; 170: e154450.
- Khoshnood B, Lelong N, Houyel L, Bonnet D, Ballon M, Jouannic JM, Goffinet F, EPICARD Study group. Impact of prenatal diagnosis on survival of newborns with four congenital heart defects: a prospective, population-based cohort study in France (the EPICARD Study). BMJ Open 2017; 7: e018285.
- Dolk H, Loane M, Garne E, European Surveillance of Congenital Anomalies Working Group. Congenital heart defects in Europe: prevalence and perinatal mortality, 2000 to 2005. Circulation 2011; 123: 841–849.
- Quartermain MD, Pasquali SK, Hill KD, Goldberg DJ, Huhta JC, Jacobs JP, Jacobs ML, Kim S, Ungerleider RM. Variation in Prenatal Diagnosis of Congenital Heart Disease in Infants. Pediatrics 2015; 136: e378–385.
- Sharland GK, Allan LD. Screening for congenital heart disease prenatally. Results of a 2 1/2-year study in the South East Thames Region. BJOG 1992; 99: 220–225.
- DeVore GR, Medearis AL, Bear MB, Horenstein J, Platt LD. Fetal echocardiography: factors that influence imaging of the fetal heart during the second trimester of pregnancy. J Ultrasound Med 1993; 12: 659–663.
- Tegnander E, Williams W, Johansen OJ, Blaas HG, Eik-Nes SH. Prenatal detection of heart defects in a non-selected population of 30,149 fetuses—detection rates and outcome. Ultrasound Obstet Gynecol 2006; 27: 252–265.
- van Nisselrooij AEL, Teunissen AKK, Clur SA, Rozendaal L, Pajkrt E, Linskens IH, Rammeloo L, van Lith JMM, Blom NA, Haak MC. Why are congenital heart defects being missed? Ultrasound Obstet Gynecol 2020; 55: 747–757.
- Carvalho JS, Mavrides E, Shinebourne EA, Campbell S, Thilaganathan B. Improving the effectiveness of routine prenatal screening for major congenital heart defects. Heart 2002; 88: 387–391.
- Cuneo BF, Olson CA, Haxel C, Howley L, Gagnon A, Benson DW, Kaizer AM, Thomas JF. Risk Stratification of Fetal Cardiac Anomalies in an Underserved Population Using Telecardiology. Obstet Gynecol 2019; 134: 1096–1103.
- Hautala J, Gissler M, Ritvanen A, Tekay A, Pitkanen-Argillander O, Stefanovic V, Sarkola T, Helle E, Pihkala J, Patila T, Mattila IP, Jokinen E, Rasanen J, Ojala T. The implementation of a nationwide anomaly screening programme improves prenatal detection of major cardiac defects: an 11-year national population-based cohort study. BJOG 2019; 126: 864–873.
- Tegnander E, Eik-Nes SH, Johansen OJ, Linker DT. Prenatal detection of heart defects at the routine fetal examination at 18 weeks in a non-selected population. Ultrasound Obstet Gynecol 1995; 5: 372–380.
- Chaoui R. The four-chamber view: four reasons why it seems to fail in screening for cardiac abnormalities and suggestions to improve detection rate. Ultrasound Obstet Gynecol 2003; 22: 3–10.
- Tegnander E, Eik-Nes SH, Linker DT. Incorporating the four-chamber view of the fetal heart into the second-trimester routine fetal examination. Ultrasound Obstet Gynecol 1994; 4: 24–28.
- Kirk JS, Riggs TW, Comstock CH, Lee W, Yang SS, Weinhouse E. Prenatal screening for cardiac anomalies: the value of routine addition of the aortic root to the four-chamber view. Obstet Gynecol 1994; 84: 427–431.
- Achiron R, Glaser J, Gelernter I, Hegesh J, Yagel S. Extended fetal echocardiographic examination for detecting cardiac malformations in low risk pregnancies. BMJ 1992; 304: 671–674.
- Schwarzler P, Senat MV, Holden D, Bernard JP, Masroor T, Ville Y. Feasibility of the second-trimester fetal ultrasound examination in an unselected population at 18, 20 or 22 weeks of pregnancy: a randomized trial. Ultrasound Obstet Gynecol 1999; 14: 92–97.
- Achiron R, Rotstein Z, Lipitz S, Mashiach S, Hegesh J. First-trimester diagnosis of fetal congenital heart disease by transvaginal ultrasonography. Obstet Gynecol 1994; 84: 69–72.
- Yagel S, Weissman A, Rotstein Z, Manor M, Hegesh J, Anteby E, Lipitz S, Achiron R. Congenital heart defects: natural course and in utero development. Circulation 1997; 96: 550–555.
- Rustico MA, Benettoni A, D’Ottavio G, Fischer-Tamaro L, Conoscenti GC, Meir Y, Natale R, Bussani R, Mandruzzato GP. Early screening for fetal cardiac anomalies by transvaginal echocardiography in an unselected population: the role of operator experience. Ultrasound Obstet Gynecol 2000; 16: 614–619.
- Carvalho JS. Fetal heart scanning in the first trimester. Prenat Diagn 2004; 24: 1060–1067.
- Carvalho JS, Moscoso G, Tekay A, Campbell S, Thilaganathan B, Shinebourne EA. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart 2004; 90: 921–926.
- Huggon IC, Ghi T, Cook AC, Zosmer N, Allan LD, Nicolaides KH. Fetal cardiac abnormalities identified prior to 14 weeks’ gestation. Ultrasound Obstet Gynecol 2002; 20: 22–29.
- International Society of Ultrasound in Obstetrics and Gynecology; Bilardo CM, Chaoui R, Hyett JA, Kagan KO, Karim JN, Papageorghiou AT, Poon LC, Salomon LJ, Syngelaki A, Nicolaides KH. ISUOG Practice Guidelines (updated): performance of 11–14-week ultrasound scan. Ultrasound Obstet Gynecol 2023; 61: 127–143.
- Paladini D, Vassallo M, Tartaglione A, Lapadula C, Martinelli P. The role of tissue harmonic imaging in fetal echocardiography. Ultrasound Obstet Gynecol 2004; 23: 159–164.
- Allan LD, Crawford DC, Chita SK, Tynan MJ. Prenatal screening for congenital heart disease. Br Med J (Clin Res Ed) 1986; 292: 1717–1719.
- Copel JA, Pilu G, Green J, Hobbins JC, Kleinman CS. Fetal echocardiographic screening for congenital heart disease: the importance of the four-chamber view. Am J Obstet Gynecol 1987; 157: 648–655.
- DeVore GR. The aortic and pulmonary outflow tract screening examination in the human fetus. J Ultrasound Med 1992; 11: 345–348.
- Achiron R, Rotstein Z, Heggesh J, Bronshtein M, Zimand S, Lipitz S, Yagel S. Anomalies of the fetal aortic arch: a novel sonographic approach to in-utero diagnosis. Ultrasound Obstet Gynecol 2002; 20: 553–557.
- Yoo SJ, Min JY, Lee YH, Roman K, Jaeggi E, Smallhorn J. Fetal sonographic diagnosis of aortic arch anomalies. Ultrasound Obstet Gynecol 2003; 22: 535–546.
- Barboza JM, Dajani NK, Glenn LG, Angtuaco TL. Prenatal diagnosis of congenital cardiac anomalies: a practical approach using two basic views. Radiographics 2002; 22: 1125–1137; discussion 1137–1138.
- Del BA, Russo S, Lacerenza N, Rinaldi M, Rinaldi G, Nappi L, Greco P. Four chamber view plus three-vessel and trachea view for a complete evaluation of the fetal heart during the second trimester. J Perinat Med 2006; 34: 309–312.
- Carvalho JS, Doya E, Freeman J, Clough A. Identification of fetal laterality and visceral situs should be part of routine fetal anomaly scans. In World Congress of Pediatric Cardiology and Cardiac Surgery. Momma K, Imai Y (eds). Futura Pub. Co.: Honolulu, Hawaii, 1997; 117.
- Salomon LJ, Alfirevic Z, Berghella V, Bilardo CM, Chalouhi GE, Da Silva Costa F, Hernandez-Andrade E, Malinger G, Munoz H, Paladini D, Prefumo F, Sotiriadis A, Toi A, Lee W. ISUOG Practice Guidelines (updated): performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol 2022; 59: 840–856.
- Bromley B, Estroff JA, Sanders SP, Parad R, Roberts D, Frigoletto FD, Jr., Benacerraf BR. Fetal echocardiography: accuracy and limitations in a population at high and low risk for heart defects. Am J Obstet Gynecol 1992; 166: 1473–1481.
- Stumpflen I, Stumpflen A, Wimmer M, Bernaschek G. Effect of detailed fetal echocardiography as part of routine prenatal ultrasonographic screening on detection of congenital heart disease. Lancet 1996; 348: 854–857.
- Yoo SJ, Lee YH, Kim ES, Ryu HM, Kim MY, Choi HK, Cho KS, Kim A. Three-vessel view of the fetal upper mediastinum: an easy means of detecting abnormalities of the ventricular outflow tracts and great arteries during obstetric screening. Ultrasound Obstet Gynecol 1997; 9: 173–182.
- Yoo SJ, Lee YH, Cho KS. Abnormal three-vessel view on sonography: a clue to the diagnosis of congenital heart disease in the fetus. AJR Am J Roentgenol 1999; 172: 825–830.
- Vinals F, Heredia F, Giuliano A. The role of the three vessels and trachea view (3VT) in the diagnosis of congenital heart defects. Ultrasound Obstet Gynecol 2003; 22: 358–367.
- Yagel S, Arbel R, Anteby EY, Raveh D, Achiron R. The three vessels and trachea view (3VT) in fetal cardiac scanning. Ultrasound Obstet Gynecol 2002; 20: 340–345.
- Tongsong T, Tongprasert F, Srisupundit K, Luewan S. The complete three-vessel view in prenatal detection of congenital heart defects. Prenat Diagn 2010; 30: 23–29.
- Berg C, Gembruch U, Geipel A. Outflow tract views in two-dimensional fetal echocardiography – part ii. Ultraschall Med 2009; 30: 230–251.
- Freud LR, Moon-Grady A, Escobar-Diaz MC, Gotteiner NL, Young LT, McElhinney DB, Tworetzky W. Low rate of prenatal diagnosis among neonates with critical aortic stenosis: insight into the natural history in utero. Ultrasound Obstet Gynecol 2015; 45: 326–332.
- Yamamoto Y, Hornberger LK. Progression of outflow tract obstruction in the fetus. Early Hum Dev 2012; 88: 279–285.
- Bronshtein M, Gover A, Zimmer EZ. Sonographic definition of the fetal situs. Obstet Gynecol 2002; 99: 1129–1130.
- Carvalho JS, Kyle PM. Images in cardiovascular medicine. Situs inversus with complete transposition in the fetus: diagnostic antenatal sequential segmental analysis. Circulation 1997; 96: 4432–4433.
- Cordes TM, O’Leary PW, Seward JB, Hagler DJ. Distinguishing right from left: a standardized technique for fetal echocardiography. J Am Soc Echocardiogr 1994; 7: 47–53.
- Allan LD, Tynan MJ, Campbell S, Wilkinson JL, Anderson RH. Echocardiographic and anatomical correlates in the fetus. Br Heart J 1980; 44: 444–451.
- Cook AC, Yates RW, Anderson RH. Normal and abnormal fetal cardiac anatomy. Prenat Diagn 2004; 24: 1032–1048.
- Yoo SJ, Min JY, Lee YH. Normal pericardial fluid in the fetus: color and spectral Doppler analysis. Ultrasound Obstet Gynecol 2001; 18: 248–252.
- Brown DL, Cartier MS, Emerson DS, Shanklin DR, Smith WC, Felker RE. The peripheral hypoechoic rim of the fetal heart. J Ultrasound Med 1989; 8: 603–608.
- Comstock CH. Normal fetal heart axis and position. Obstet Gynecol 1987; 70: 255–259.
- Smith RS, Comstock CH, Kirk JS, Lee W. Ultrasonographic left cardiac axis deviation: a marker for fetal anomalies. Obstet Gynecol 1995; 85: 187–191.
- Shipp TD, Bromley B, Hornberger LK, Nadel A, Benacerraf BR. Levorotation of the fetal cardiac axis: a clue for the presence of congenital heart disease. Obstet Gynecol 1995; 85: 97–102.
- Abdullah MM, Lacro RV, Smallhorn J, Chitayat D, van der Velde ME, Yoo SJ, Oman-Ganes L, Hornberger LK. Fetal cardiac dextroposition in the absence of an intrathoracic mass: sign of significant right lung hypoplasia. J Ultrasound Med 2000; 19: 669–676.
- Copel JA, Liang RI, Demasio K, Ozeren S, Kleinman CS. The clinical significance of the irregular fetal heart rhythm. Am J Obstet Gynecol 2000; 182: 813–817.
- Bet BB, de Vries JM, Limpens J, van Wely M, van Leeuwen E, Clur SA, Pajkrt E. Implications of fetal premature atrial contractions: systematic review. Ultrasound Obstet Gynecol 2022; 60: 721–730.
- Simpson JL, Yates RW, Sharland GK. Irregular heart rate in the fetus: not always benign. Cardiol Young 1996; 6: 28–31.
- Cuneo BF, Strasburger JF, Wakai RT, Ovadia M. Conduction system disease in fetuses evaluated for irregular cardiac rhythm. Fetal Diagn Ther 2006; 21: 307–313.
- Carvalho JS. Risk stratification for irregular fetal heart rhythm: practical approach to management. Ultrasound Obstet Gynecol 2022; 60: 717–720.
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 106: Intrapartum fetal heart rate monitoring: nomenclature, interpretation, and general management principles. Obstet Gynecol 2009; 114: 192–202.
- Carvalho JS. Primary bradycardia: keys and pitfalls in diagnosis. Ultrasound Obstet Gynecol 2014; 44: 125–130.
- Carvalho JS. Fetal dysrhythmias. Best Pract Res Clin Obstet Gynaecol 2019; 58: 28–41.
- Mitchell JL, Cuneo BF, Etheridge SP, Horigome H, Weng HY, Benson DW. Fetal heart rate predictors of long QT syndrome. Circulation 2012; 126: 2688–2695.
- Srinivasan S, Strasburger J. Overview of fetal arrhythmias. Curr Opin Pediatr 2008; 20: 522–531.
- Hazelzet T, Durand I, David N. [Total isolated anomalous pulmonary venous return: Are there any clues for prenatal screening?]. Gynecol Obstet Fertil 2015; 43: 541–548.
- Kirk JS, Comstock CH, Lee W, Smith RS, Riggs TW, Weinhouse E. Fetal cardiac asymmetry: a marker for congenital heart disease. Obstet Gynecol 1999; 93: 189–192.
- Sharland GK, Chan KY, Allan LD. Coarctation of the aorta: difficulties in prenatal diagnosis. Br Heart J 1994; 71: 70–75.
- Hornberger LK, Sanders SP, Rein AJ, Spevak PJ, Parness IA, Colan SD. Left heart obstructive lesions and left ventricular growth in the midtrimester fetus. A longitudinal study. Circulation 1995; 92: 1531–1538.
- Paladini D, Pistorio A, Wu LH, Meccariello G, Lei T, Tuo G, Donarini G, Marasini M, Xie HN. Prenatal diagnosis of total and partial anomalous pulmonary venous connection: multicenter cohort study and meta-analysis. Ultrasound Obstet Gynecol 2018; 52: 24–34.
- Paladini D, Palmieri S, Lamberti A, Teodoro A, Martinelli P, Nappi C. Characterization and natural history of ventricular septal defects in the fetus. Ultrasound Obstet Gynecol 2000; 16: 118–122.
- Axt-Fliedner R, Schwarze A, Smrcek J, Germer U, Krapp M, Gembruch U. Isolated ventricular septal defects detected by color Doppler imaging: evolution during fetal and first year of postnatal life. Ultrasound Obstet Gynecol 2006; 27: 266–273.
- Vettraino IM, Lee W, Bronsteen RA, Comstock CH. Sonographic evaluation of the ventricular cardiac outflow tracts. J Ultrasound Med 2005; 24: 566.
- Everwijn SMP, van Nisselrooij AEL, Rozendaal L, Clur SB, Pajkrt E, Hruda J, Linskens IH, van Lith JM, Blom NA, Haak MC. The effect of the introduction of the three-vessel view on the detection rate of transposition of the great arteries and tetralogy of Fallot. Prenat Diagn 2018; 38: 951–957.
- Bravo C, Gamez F, Perez R, Alvarez T, De Leon-Luis J. Fetal Aortic Arch Anomalies: Key Sonographic Views for Their Differential Diagnosis and Clinical Implications Using the Cardiovascular System Sonographic Evaluation Protocol. J Ultrasound Med 2016; 35: 237–251.
- Karl K, Sinkovskaya E, Abuhamad A, Chaoui R. Intrathymic and other anomalous courses of the left brachiocephalic vein in the fetus. Ultrasound Obstet Gynecol 2016; 48: 464–469.
- Galindo A, Gutierrez-Larraya F, Escribano D, Arbues J, Velasco JM. Clinical significance of persistent left superior vena cava diagnosed in fetal life. Ultrasound Obstet Gynecol 2007; 30: 152–161.
- Durand I, Hazelzet T, Gillibert A, Parrod C, David N, El Youssef F, Brehin AC, Barre E. Outcomes following prenatal diagnosis of isolated persistent left superior vena cava. Arch Cardiovasc Dis 2022; 115: 335–347.
- Lopes KRM, Bartsota M, Doughty V, Carvalho JS. Single left superior vena cava: antenatal diagnosis, associated anomalies and outcomes. Ultrasound Obstet Gynecol 2022; 60: 640–645.
- Chaoui R, Heling KS, Lopez AS, Thiel G, Karl K. The thymic-thoracic ratio in fetal heart defects: a simple way to identify fetuses at high risk for microdeletion 22q11. Ultrasound Obstet Gynecol 2011; 37: 397–403.
- Paladini D. How to identify the thymus in the fetus: the thy-box. Ultrasound Obstet Gynecol 2011; 37: 488–492.
- Karl K, Heling KS, Sarut Lopez A, Thiel G, Chaoui R. Thymic-thoracic ratio in fetuses with trisomy 21, 18 or 13. Ultrasound Obstet Gynecol 2012; 40: 412–417.
- Anton T, Sklansky MS, Perez M, Pretorius DH. The Fetal 3-Vessel Views: An Illustrative Case-Based Tutorial. J Ultrasound Med 2019; 38: 3335–3347.
- Yagel S, Cohen SM, Achiron R. Examination of the fetal heart by five short-axis views: a proposed screening method for comprehensive cardiac evaluation. Ultrasound Obstet Gynecol 2001; 17: 367–369.
- Sun HY, Proudfoot JA, McCandless RT. Prenatal detection of critical cardiac outflow tract anomalies remains suboptimal despite revised obstetrical imaging guidelines. Congenit Heart Dis 2018; 13: 748–756.
- Sklansky MS, Berman DP, Pruetz JD, Chang RK. Prenatal screening for major congenital heart disease: superiority of outflow tracts over the 4-chamber view. J Ultrasound Med 2009; 28: 889–899.
- Jain S, Kleiner B, Moon-Grady A, Hornberger LK. Prenatal diagnosis of vascular rings. J Ultrasound Med 2010; 29: 287–294.
- Chaoui R, McEwing R. Three cross-sectional planes for fetal color Doppler echocardiography. Ultrasound Obstet Gynecol 2003; 21: 81–93.
- Paladini D. Sonography in obese and overweight pregnant women: clinical, medicolegal and technical issues. Ultrasound Obstet Gynecol 2009; 33: 720–729.
- Sklansky M, Afshar Y, Anton T, DeVore GR, Platt L, Satou G. Guidance for fetal cardiac imaging in patients with degraded acoustic windows. Ultrasound Obstet Gynecol 2022; 59: 709–712.
- Nadel AS. Addition of color Doppler to the routine obstetric sonographic survey aids in the detection of pulmonic stenosis. Fetal Diagn Ther 2010; 28: 175–179.
- Small M, Copel JA. Indications for fetal echocardiography. Pediatr Cardiol 2004; 25: 210–222.
- Mavrides E, Cobian-Sanchez F, Tekay A, Moscoso G, Campbell S, Thilaganathan B, Carvalho JS. Limitations of using first-trimester nuchal translucency measurement in routine screening for major congenital heart defects. Ultrasound Obstet Gynecol 2001; 17: 106–110.
- Ghi T, Huggon IC, Zosmer N, Nicolaides KH. Incidence of major structural cardiac defects associated with increased nuchal translucency but normal karyotype. Ultrasound Obstet Gynecol 2001; 18: 610–614.
- Hyett JA, Perdu M, Sharland GK, Snijders RS, Nicolaides KH. Increased nuchal translucency at 10–14 weeks of gestation as a marker for major cardiac defects. Ultrasound Obstet Gynecol 1997; 10: 242–246.
- Rychik J, Donaghue DD, Levy S, Fajardo C, Combs J, Zhang X, Szwast A, Diamond GS. Maternal psychological stress after prenatal diagnosis of congenital heart disease. J Pediatr 2013; 162: 302–307.e1.
- Cabana MD, Rand CS, Powe NR, Wu AW, Wilson MH, Abboud PA, Rubin HR. Why don’t physicians follow clinical practice guidelines? A framework for improvement. JAMA 1999; 282: 1458–1465.
- Sklansky M, DeVore GR. Fetal Cardiac Screening: What Are We (and Our Guidelines) Doing Wrong? J Ultrasound Med 2016; 35: 679–681.
- Salomon LJ, Winer N, Bernard JP, Ville Y. A score-based method for quality control of fetal images at routine second-trimester ultrasound examination. Prenat Diagn 2008; 28: 822–827.
- Sairam S, Awadh AM, Cook K, Papageorghiou AT, Carvalho JS. Impact of audit of routine second-trimester cardiac images using a novel image-scoring method. Ultrasound Obstet Gynecol 2009; 33: 545–551.
- Quarello E, Lafouge A, Fries N, Salomon LJ, CFEF. Basic heart examination: feasibility study of first-trimester systematic simplified fetal echocardiography. Ultrasound Obstet Gynecol 2017; 49: 224–230.
- Letourneau KM, Horne D, Soni RN, McDonald KR, Karlicki FC, Fransoo RR. Advancing Prenatal Detection of Congenital Heart Disease: A Novel Screening Protocol Improves Early Diagnosis of Complex Congenital Heart Disease. J Ultrasound Med 2018; 37: 1073–1079.
- Volpe P, Ubaldo P, Volpe N, Campobasso G, De Robertis V, Tempesta A, Volpe G, Rembouskos G. Fetal cardiac evaluation at 11–14 weeks by experienced obstetricians in a low-risk population. Prenat Diagn 2011; 31: 1054–1061.
- Smrcek JM, Berg C, Geipel A, Fimmers R, Diedrich K, Gembruch U. Early fetal echocardiography: heart biometry and visualization of cardiac structures between 10 and 15 weeks’ gestation. J Ultrasound Med 2006; 25: 173–182.
- Yagel S, Cohen SM, Porat S, Daum H, Lipschuetz M, Amsalem H, Messing B, Valsky DV. Detailed transabdominal fetal anatomic scanning in the late first trimester versus the early second trimester of pregnancy. J Ultrasound Med 2015; 34: 143–149.
- Salvesen K, Abramowicz J, Ter Haar G, Miloro P, Sinkovskaya E, Dall’Asta A, Marsal K, Lees C, Board of the International Society of Ultrasound in Obstetrics and Gynecology. ISUOG statement on the safe use of Doppler for fetal ultrasound examination in the first 13 + 6 weeks of pregnancy (updated). Ultrasound Obstet Gynecol 2021; 57: 1020.
- Sinkovskaya ES, Chaoui R, Karl K, Andreeva E, Zhuchenko L, Abuhamad AZ. Fetal cardiac axis and congenital heart defects in early gestation. Obstet Gynecol 2015; 125: 453–460.
- Wiechec M, Knafel A, Nocun A. Prenatal detection of congenital heart defects at the 11- to 13-week scan using a simple color Doppler protocol including the 4-chamber and 3-vessel and trachea views. J Ultrasound Med 2015; 34: 585–594.
- Ghimire LV, Chou FS, Moon-Grady AJ. Risk of congenital heart disease is increased among newborns with non-cardiac congenital anomalies: survey-based analysis using 2016 Kids’ Inpatient Database. Ultrasound Obstet Gynecol 2021; 57: 841–842.