Комитет по клиническим стандартам
Международное общество ультразвука в акушерстве и гинекологии (МОУАГ) – это научная организация, которая способствует развитию надлежащей клинической практики, а также высококачественному обучению и исследованиям, связанным с диагностической визуализацией в сфере охраны здоровья женщин. Комитет клинических стандартов МОУАГ (ККС) имеет полномочия разрабатывать Практические Руководства и Консенсусные Заявления как образовательные рекомендации, которые предоставляют практикующим врачам основанный на консенсусе подход к диагностической визуализации, основанный на мнении экспертов. Они предназначены для отражения того, что МОУАГ считает лучшей практикой на момент их издания. Хотя МОУАГ прилагает все усилия, чтобы обеспечить точность Руководств на момент их издания, ни Общество, ни кто-либо из его сотрудников или членов не несет ответственности за последствия любых неточных или ложных данных, мнений или заявлений, изданных ККС. Документы КУС МОУАГ не предназначены для установления правового стандарта оказания медицинской помощи, поскольку на интерпретацию доказательств, лежащих в основе Руководства, могут влиять индивидуальные обстоятельства, местные протоколы и имеющиеся ресурсы. Утвержденные Руководства могут свободно распространяться с разрешения МОУАГ (info@isuog.org).
ВСТУПЛЕНИЕ
Эффективный скрининг сердца плода должен максимально выявлять структурные аномалии и (в соответствии с имеющимся опытом и ресурсами) нарушения функции и ритма в рамках рутинного пренатального ухода. Этот документ содержит рекомендации по низкорисковому ультразвуковому скринингу сердца плода во время второго триместра беременности, обновленные по сравнению с ранее опубликованными Руководствами 1. Также рассматривается практическая реализация скрининга сердца в конце первого триместра и в начале второго триместра, когда это технически возможно. Эти Руководства поощряют использование цветной допплерографии и вводят новые разделы, посвященные обеспечению качества и использованию контрольного списка. Медицинские работники также могут использовать эти Руководства для выявления беременностей с риском генетических аномалий 2 и предоставления своевременных рекомендаций для консультирования пациенток, акушерского менеджмента и мультидисциплинарной помощи. Случаи с подозрением на аномалии сердца и/или с повышенным риском требуют проведения эхокардиографии плода 3–6.
Врожденные пороки сердца (ВПС) имеют распространенность 8,2 на 1000 живорожденных и являются основной причиной детской заболеваемости и смертности 7. Пренатальная диагностика может улучшить результаты родов до вмешательства 8, особенно для определенных типов поражения сердца 9–15. Пренатальная осведомленность о ВПС и обучение родителей позволяют подготовиться к рождению новорожденного, который будет нуждаться в специализированном уходе и услугах. Влияние пренатальной диагностики также может иметь отношение к долгосрочным результатам неврологического развития 16,17 , и это максимизирует возможности для семьи. Однако показатели пренатальной диагностики широко варьируют в разных географических регионах и для разных типов ВПС, причем менее половины сердечных аномалий выявляют до рождения 7,18,19. Определенные различия можно объяснить разницей в квалификации врачей, частотой использования датчиков, особенностями строения тела пациента, наличием рубцов на животе, сроком беременности, объемом околоплодных вод и положением плода 20–23. Непрерывное обучение медицинских работников на основе обратной связи, низкий порог для направления на эхокардиографию, использование стандартизированных протоколов УЗИ и легкий доступ к специалистам по изучению сердца плода могут улучшить эффективность скрининговой программы 14,24–26.
ОБЩИЕ ПОЛОЖЕНИЯ
Несмотря на хорошо задокументированную полезность четырехкамерного среза и изображения выходного тракта, следует помнить о потенциальных диагностических ловушках, которые могут препятствовать своевременному выявлению ВПС 27–29. Частоту выявления можно оптимизировать путем проведения тщательного скринингового обследования сердца, осознания того, что четырехкамерное и трехсосудистый срез требуют гораздо больше, чем простого подсчета сердечных структур, понимание того, что некоторые поражения не проявляются до поздних сроков беременности, а также осознание того, что определенные типы аномалий (например, транспозиция магистральных сосудов, коарктация аорты) могут быть невидимыми только на четырехкамерном срезе. Дополнение четырехкамерного среза снимками выходных трактов и магистральных сосудов при скрининговом обследовании сердца сыграло важную роль в улучшении выявления ВПС 24,30,31.
Срок беременности
Скрининговое кардиологическое обследование оптимально проводить между 18 и 22 неделями беременности. Скрининг в 20-22 недели с меньшей вероятностью требует дополнительного сканирования для завершения этой оценки по сравнению со скринингом в 18-20 недель, хотя многие пациенты хотели бы знать об основных пороках как можно раньше во время беременности 32. Многие анатомические структуры можно успешно визуализировать после 22 недель, а некоторые серьезные пороки сердца могут быть обнаружены в конце первого и в начале второго триместров, особенно если повышенная толщина просвечиваемой ткани пуповины вызывает подозрение или если во время более ранних сканирований предпринимались попытки визуализировать сердце плода 33–39.
Технические факторы
Ультразвуковой датчик
Более высокочастотные датчики повышают вероятность обнаружения малозаметных дефектов за счет уменьшения акустического проникновения. Самая высокая возможная частота датчика должна использоваться для всех исследований, признавая компромисс между проникновением и разрешением. Тканевая гармоничная визуализация обеспечивает улучшенное изображение, особенно у пациентов с увеличенной толщиной брюшной стенки и во время третьего триместра беременности 40.
Параметры визуализации
Поперечное сечение изображения в оттенках серого является основой надежного сканирования сердца плода. Настройки системы должны быть направлены на высокую частоту кадров, повышенную контрастность и высокое разрешение. Также следует использовать низкую персистентность, единую акустическую фокальную зону и относительно узкое поле изображения, которые обычно включены в кардиологические пресеты. Современные ультразвуковые системы также имеют расширенные возможности постобработки изображений, что способствует улучшению отображения изображений.
Масштабирование, циклическое воспроизведение и хранение изображений
Изображение следует увеличивать до тех пор, пока сердце не заполнит по крайней мере треть или половину экрана. Функцию циклической петли следует использовать для оценки нормальных структур сердца в реальном времени, например, для подтверждения движения створок сердечного клапана в течение сердечного цикла. Увеличение изображения и использование кинематографической петли также может помочь в обнаружении аномалий. Для структур и видов, указанных в этом Руководстве, мы рекомендуем архивировать стоп-кадры и видеоклипы, а также учитывать местные/национальные стандарты. Обследование следует записывать таким образом, чтобы обеспечить возможность последующего просмотра для проверки его диагностической адекватности, с соответствующей идентификацией пациента и маркировкой латерализации и ориентации изображения, когда это целесообразно.
КАРДИОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Скрининговое кардиологическое обследование должно включать определение положения плода и осмотр четырех камер, выходного тракта и магистральных сосудов 30,31,41–49. Эта оценка повышает частоту выявления основных пороков сердца, чем при использовании только четырехкамерного среза 24,30,31,50,51. Включение изображений выходного тракта и магистральных сосудов позволяет выявить такие аномалии, как тетрада Фалло, транспозиция магистральных сосудов, двустворчатый правый желудочек и общий артериальный ствол 44–47,52–57. Этот стандартизированный рабочий процесс также может выявить аномалии полулунных клапанов, такие как аортальный и легочный стеноз, которые могут прогрессировать по мере развития беременности 58,59.
Размещение и четырехкамерный срез
Сонографическая методика
Для оценки сердечной позиции необходимо сначала определить латеральность плода, то есть определить правую и левую сторону плода, исходя из положения плода в матке, прежде чем убедиться, что и желудок, и сердце находятся с левой стороны плода 48,60–62. Во втором триместре сердце располагается в горизонтальной плоскости в грудной клетке, удерживаясь на месте печенью плода, которая распространяется на левую сторону брюшной стенки плода 63,64. Поперечное сканирование с краниальным движением датчика от живота плода к грудной клетке позволяет визуализировать брюшную полость и четырехкамерный срез (Рис. 1 и 2).
Рисунок 1 Техника сканирования сердца плода в последовательных плоскостях. (I) Сначала визуализируется аксиальный вид верхней части живота. (II) Перемещением и наклоном датчика в краниальном направлении получают снимок четырех камер через аксиальную плоскость сканирования, проходящую через грудную клетку плода. Дальнейшее перемещение датчика от четырехкамерного среза по направлению к голове плода позволяет последовательно получить снимок выходного тракта и крупных сосудов: (III) снимок выходного тракта левого желудочка; (IV) снимок выходного тракта правого желудочка и варианты снимка трех сосудов; и (V) снимок трех сосудов и трахеи.
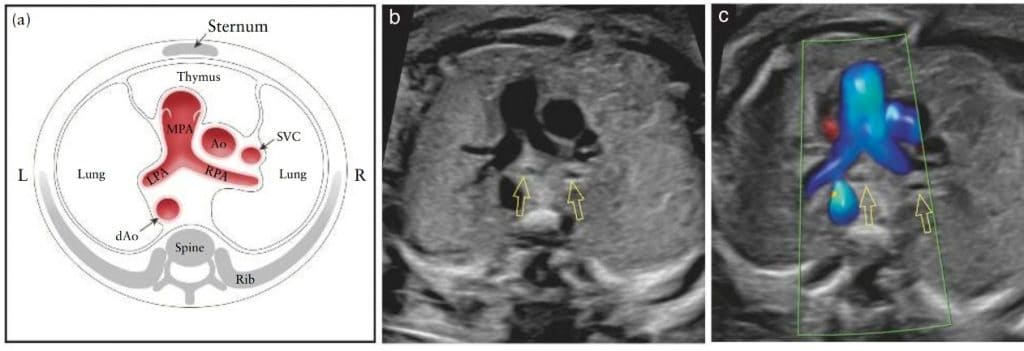
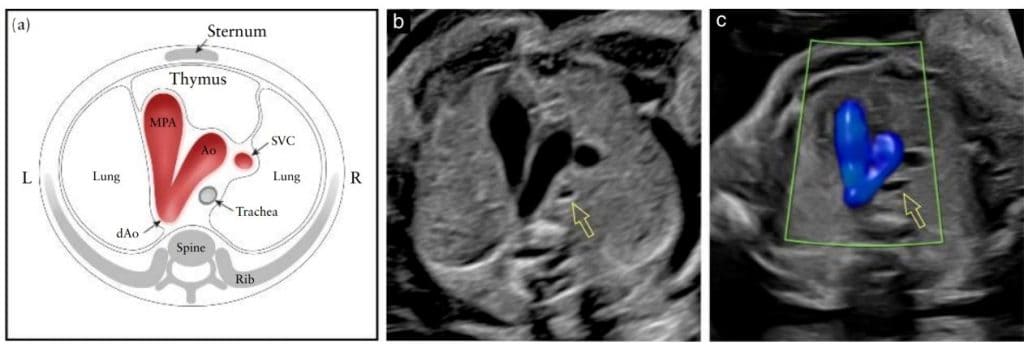
Рисунок 2 Пять аксиальных снимков для оптимального скрининга сердца плода, соответствующие плоскостям, показанным на Рисунке 1. На схеме показаны трахея, сердце и магистральные сосуды, печень и желудок, с пятью плоскостями инсоляции, обозначенными многоугольниками, соответствующими снимкам в оттенках серого, как указано. (I) Наиболее каудальная плоскость, показывающая желудок плода (St), поперечное сечение нисходящей аорты (dAo) и нижней полой вены (IVC), позвоночник (Sp) и печень (Li). (II) Четырехкамерный срез сердца плода, показывающий правый и левый желудочки (RV, LV) и предсердия (RA, LA), овальное отверстие (FO) и легочные вены (PV) справа и слева от dAo. (III) Вид выходного тракта левого желудочка, показывающий проксимальную восходящую аорту (Ао), LV, RV, LA и RA, а также поперечное сечение dAo. (IV) Несколько больший краниальный снимок (вид выходного тракта правого желудочка), показывающий главную легочную артерию (MPA) и бифуркацию на правую (RPA) и левую (LPA) легочные артерии, а также поперечные сечения Ao и dAo. (V) трехсосудисто-трахеальный снимок, показывающий верхнюю полую вену (SVC), MPA, артериальный проток (DA), поперечную дугу аорты (от проксимального отдела Ao до dAo) и трахею (Tr). L, слева, R, справа.
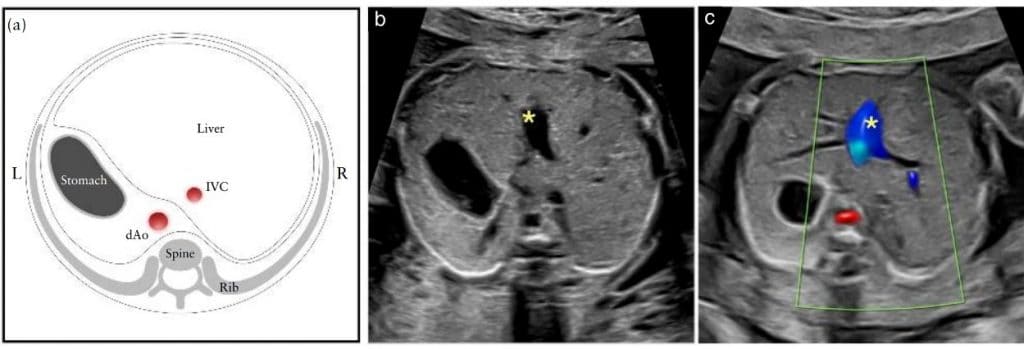
Рисунок 3 Схематическая диаграмма (а) и соответствующие градации серого (б) и цветные допплеровские (в) ультразвуковые снимки аксиальной проекции верхней части живота плода. (а) Абдоминальное размещение определяется на поперечном снимке живота плода. После определения латерального положения плода с позиции плода в матке, желудок должен быть идентифицирован с левой стороны плода, а нисходящая аорта (dAo) и нижняя полая вена (IVC) – с левой и правой стороны позвоночника, соответственно. (b,c) Короткий сегмент пупочной вены (∗) видно в центре печени. L, слева, R, справа.
Размещение
Расположение органов брюшной полости получено на уровне стандартного измерения окружности живота, живот виден слева. Кроме того, поперечные сечения нисходящей аорты и нижней полой вены видны с левой и правой стороны позвоночника соответственно (Рисунок 3). Идентификация нормального размещения органов брюшной полости является суррогатом нормального размещения предсердий (situs solitus, то есть правое предсердие справа, а левое – слева).
Четырехкамерный срез
Оценка четырехкамерного среза предполагает тщательную оценку конкретных критериев. Основные элементы для осмотра четырех камер показаны в Таблице 1 и на Рисунках 4 и 5. Нормальное сердце обычно не превышает трети площади грудной клетки. Небольшое количество перикардиальной жидкости обычно наблюдается в течение второго и третьего триместров (≤ 2 мм в толщину, в конце систолы) и является нормальным явлением 65. При некоторых видах исследования можно также обнаружить небольшой гипоэхогенный ободок вокруг сердца плода, поэтому следует быть осторожным, чтобы не спутать его с перикардиальным выпотом 66.
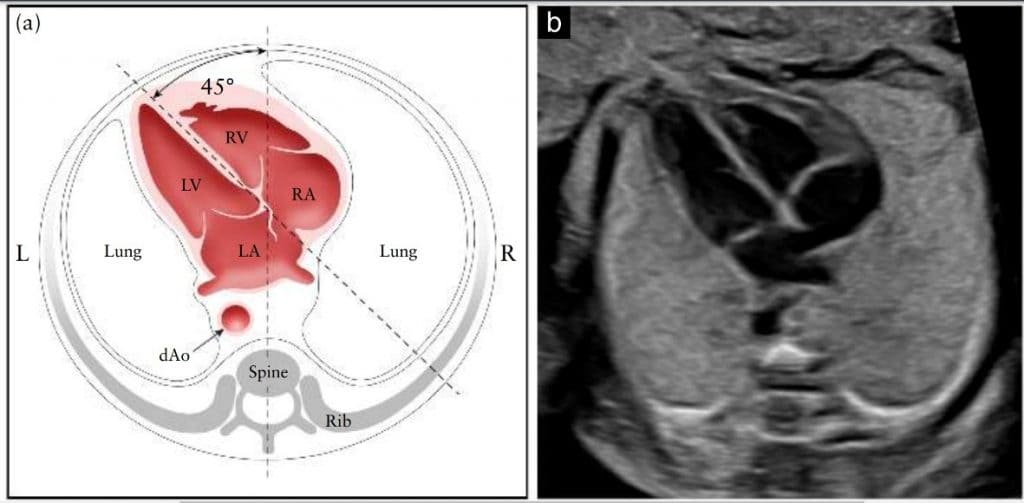
Сердце расположено преимущественно в левой части грудной клетки, и его длинная ось в норме направлена влево примерно на 45 ± 20◦ (2 СО) 67 относительно передне-задней оси грудной клетки (Зображення 4). Особое внимание следует уделять оси и положению сердца, которые можно легко оценить, даже если четырехкамерный срез визуализируется неудовлетворительно 68. Аномалии расположения органов следует заподозрить, если сердце и/или желудок плода не обнаруживаются с левой стороны. Аномальная сердечная ось увеличивает риск сердечного порока, особенно с вовлечением трактов выхода 69. Эта находка также может быть связана с хромосомной аномалией. Аномальное смещение сердца с его нормальной передней левой позиции может быть вызвано диафрагмальной грыжей или объемным поражением, например, врожденным пороком легочных дыхательных путей.
Таблица 1 Оценка латерального положения плода / Размещение и четырехкамерный срез плода
*Нормальное размещение органов брюшной полости: предусматривает нормальное положение камер предсердий (то есть нормальное положение).
Аномалии положения также могут быть вторичными из-за гипоплазии или агенезии легких плода 70. Смещение оси влево также может возникать при гастрошизисе и омфалоцеле плода.
Необходимо подтвердить нормальную частоту сердечных сокращений и регулярный ритм. Нормальная частота колеблется от 120 до 160 ударов в минуту (уд./мин). Пропущенные (или внеочередные) удары являются самым распространенным нарушением ритма. Часто они являются доброкачественными и исчезают спонтанно. В популяциях с низким риском они не связаны с повышенным риском структурных пороков сердца плода 71,72. Однако частые эпизоды (более чем каждые три-пять ударов) или стойко нерегулярный сердечный ритм (> 1-2 недель) являются показанием для дальнейшего обследования 5,6,71,73–75. Брадикардия, часто связанная с давлением датчика на живот, наблюдается временно у нормальных плодов во втором триместре. Устойчивая брадикардия (≤ 110 уд/мин) у хорошо развитого плода требует своевременного обследования фетальным кардиологом 76,77. Возможные причины включают частые блокированные предсердные внеочередные сокращения, атриовентрикулярную блокаду и синусовую брадикардию 78,79. Повторное замедление сердцебиения в течение третьего триместра может быть вызвано гипоксией плода. Легкая транзиторная тахикардия (160-180 уд/мин) может возникать как нормальный вариант во время шевеления плода. Однако стойкая тахикардия (≥ 180 уд/мин)78,80 требует дальнейшего обследования для выявления более серьезных тахиаритмий или гипоксии плода.
Рисунок 4 Определение положения и оси сердца, как показано на схематической диаграмме (а) и соответствующем полутоновом ультразвуковом изображении (b). Воображаемая линия, проведенная от позвоночника сзади до грудины спереди, делит грудную клетку на две равные части, левую (L) и правую (R). Нормальное сердце плода лежит преимущественно слева, верхушка сердца направлена влево под углом 45 ± 20◦ по отношению к передне-задней оси грудной клетки. dAo, нисходящая аорта; LA, левое предсердие; LV, левый желудочек; RA, правое предсердие; RV, правый желудочек.
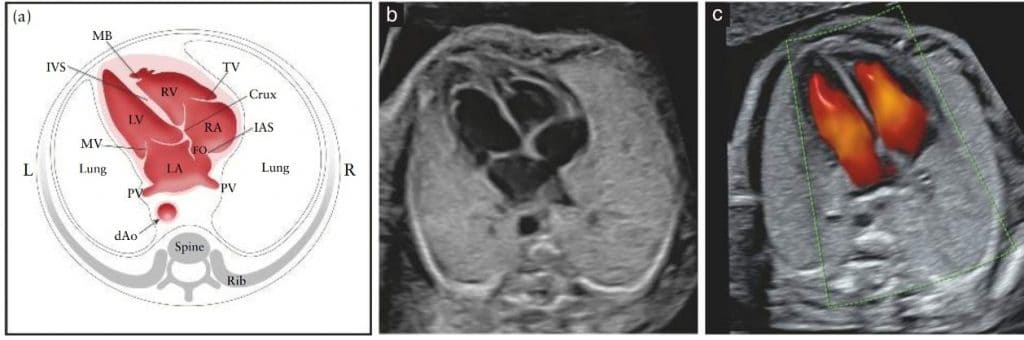
Рисунок 5 Схематический рисунок (а) и соответствующие полутоновые (b) и цветные допплеровские (с) ультразвуковые снимки в четырехкамерном срезе. Ключевыми элементами нормальной четырехкамерной картины во втором триместре являются площадь сердца, не превышающая трети площади грудной клетки, право- и левосторонние структуры примерно одинаковые (по размеру камер и толщине стенок), открытое овальное окно (FO) с клапаном в левом предсердии (LA), внутренний сердечный перекресток с нормальным смещением обоих атриовентрикулярных клапанов и интактная межжелудочковая перегородка (IVS). В (а) и (b) морфологически правый желудочек (RV) идентифицируется по наличию септомаргинальной трабекулы (MB) и трикуспидального клапана (TV), с передней створкой, вставленной в перегородку более апикально по сравнению со створкой митрального клапана (MV) (нормальное смещение). Легочные вены (PV) также входят в LA. На цветной допплерограмме (с) во время диастолы видны два отдельных притока крови к желудочкам. dAo, нисходящая аорта; IAS, межпредсердная перегородка; L, слева; LV, левый желудочек; R, справа; RA, правое предсердие.
Обе камеры предсердий в норме имеют одинаковый размер, а створка овального отверстия движется в пределах левого предсердия. Нижний край межпредсердной перегородки, называемый первичной перегородкой, должен присутствовать и является частью внутрисердечного перекреста – места, где нижняя часть межпредсердной перегородки соединяется с верхней частью межжелудочковой перегородки, и где находятся атриовентрикулярные клапаны. Легочные вены часто можно увидеть при входе в левое предсердие и, когда это технически возможно, рекомендуется визуализация по крайней мере одной из этих вен в В-режиме. Хотя цветной поток может облегчить их визуализацию, это не следует считать обязательным. При использовании цветного допплеровского ультразвука следует отображать его вместе со снимком в В-режиме, чтобы избежать ложноотрицательных результатов 81.
Септомаргинальная трабекула, четкий мышечный пучок, который пересекает полость правого желудочка, виден у верхушки и помогает идентифицировать морфологически правый желудочек. Верхушка левого желудочка выглядит гладкой и образует верхушку сердца. Оба желудочка должны выглядеть одинаковыми по размеру и не иметь признаков утолщения стенок. Хотя легкая диспропорция желудочков может возникать как нормальный вариант в третьем триместре беременности, асимметрия правого и левого желудочков при многоводии требует дальнейшего обследования 82; коарктация аорты, развивающийся синдром гипоплазии левых отделов сердца и аномальный легочный венозный дренаж могут быть важными причинами этой диспропорции 83–85.
Межжелудочковую перегородку следует тщательно осмотреть на наличие дефектов сердечной стенки от верхушки до внутрисердечного перекреста и, если возможно, следует провести обследование, которое начинается с задней части перегородки и движется по направлению к выходным трактам. Дефекты перегородки может быть трудно обнаружить. Перегородку лучше всего видно, когда угол инсоляции перпендикулярен к ней. Когда ультразвуковой луч прямо параллельно стенке желудочка, можно ошибочно заподозрить дефект возле сердцевины из-за акустического артефакта “выпадения”. Небольшие дефекты перегородки (1-2 мм) может быть очень трудно подтвердить, если система ультразвуковой визуализации не может обеспечить достаточный уровень бокового разрешения, особенно при неблагоприятном размере и положении плода. Однако в большинстве случаев они имеют ограниченное клиническое значение и могут даже спонтанно закрываться в матке 86,87.
Два отдельных атриовентрикулярных клапана (правосторонний, трикуспидальный; левосторонний, митральный) должны открываться отдельно и свободно. Створка трехстворчатого клапана входит в перепонку ближе к верхушке, чем створка митрального клапана (то есть нормальное смещение). Аномальное расположение атриовентрикулярных клапанов может быть ключевым сонографическим признаком сердечных аномалий, таких как дефект межжелудочковой перегородки.
Срез выходного тракта, трехсосудистый и трехсосудисто-трахеальный срезы
Визуализация левого (ВТЛЖ) и правого (ВТПЖ) выходных трактов желудочков, а также трехсосудистого (3СС) и трехсосудисто-трахеального (3СТС) срезов теперь считаются неотъемлемой частью скринингового кардиологического обследования плода. Важно установить нормальное состояние двух крупных артерий, включая соединение с правильным желудочком, их размер и положение относительно друг друга, а также нормальный вид и открытие полулунных клапанов. В большом акушерском ультразвуковом исследовании у более 18 000 плодов 88 изучалась практика включения четырехкамерного среза и, когда это технически возможно, оценка выходных трактов до рутинного 30-минутного ультразвукового исследования во втором триместре беременности. Большинство (93%) исследований, которые включали адекватный четырехкамерный срез, также были связаны с удовлетворительной оценкой трактов выхода. Частота невизуализации составляла 4,2% для ВТЛЖ, 1,6% для ВТПЖ и 1,3% для обоих трактов выхода.
Исследование желудочковых выходных трактов и сосудов требует, как минимум, установления того, что магистральные сосуды приблизительно одинаковы по размеру. Любое значительное расхождение в их размерах должно привести к дальнейшему обследованию. Поскольку они выходят из соответствующих желудочков, следует подтвердить три фактора. Первый – при нормальном ВТЛЖ первый магистральный сосуд выходит из левого желудочка, а ее передняя стенка является сплошной с межжелудочковой перепонкой. Она не раздваивается, что указывает на то, что это аорта. Второй – при нормальном ВТПЖ магистральный сосуд, который выходит из левого желудочка, раздваивается, что указывает на то, что это легочная артерия. Третий – оба магистральные сосуды должны пересекать друг друга (нормальный “перекрест”).
В дополнение к изображению трактов выхода, следует использовать тесно связанные срезы 3СС и 3СТС, чтобы помочь выявить аномалии, касающиеся трактов выхода 52,54,56,89, дуги аорты 45,54,56,90 и системных вен 91, включая персистирующую левую верхнюю полую вену 92–94 и аномалии тимуса 95–97. Аномалии, которые могут быть обнаружены, включают транспозицию магистральных сосудов, тетраду Фалло, а также аортальный и легочный стеноз. Более краниальная и угловая 3СТС позволяет более детально оценить положение дуги аорты и артериального протока и их отношение к трахее 55. Это особенно полезно для выявления аномалий дуги аорты, таких как коарктация аорты, сосудистые кольца и аберрантная правая подключичная артерия 98.
Сонографическая методика
Выполнение поперечного сканирования с краниальным движением датчика от четырехкамерного среза к верхней части грудной клетки позволяет последовательно оценить сердечные структуры и получить изображения, необходимые для установления нормальности оттока крови и сосудов: изображения ВТЛЖ и ВТПЖ, 3СС и 3СТС 99 (Рисунки 1 и 2). При идеальном обследовании эти изображения можно получить с относительной легкостью. При неблагоприятном положении плода может потребоваться дополнительное время обследования или повторное обследование.
Как правило, изображение выходного тракта и магистральных сосудов получают параллельным движением датчика в направлении головы плода (техника развертки), что сопровождается небольшими изменениями угла инсоляции, начиная с четырехкамерного среза, для визуализации нормального перекрещивания аорты и главной легочной артерии в месте их оттока. Также можно увидеть детали бифуркации легочной артерии. В качестве альтернативы описан вариант метода оценки выходных трактов у плода: ротационная техника 43. Она начинается с четырехкамерного среза сердца, при этом датчик сначала вращается в направлении правого плеча плода. Эта методика, которая легче выполняется, когда межжелудочковая перегородка перпендикулярна к ультразвуковому лучу, может потребовать несколько больших навыков, но оптимизирует визуализацию ВТЛЖ, особенно выходной части перегородки, которая является продолжением передней стенки аорты. Она также позволяет визуализировать восходящую часть аорты. В обеих методиках после получения изображения ВТЛЖ датчик поворачивают под углом краниально до тех пор, пока не будет видна легочная артерия в направлении, почти перпендикулярном к направлению аорты. Относительные соотношения ВТПЖ и ВТЛЖ лучше всего демонстрировать с помощью видеоклипов, а не стоп-кадров.
3СС и 3СТС являются дополнительными изображениями аорты и легочной артерии и показывают их взаимоотношения с верхней полой веной и трахеей. Эти изображения можно получить путем дальнейшего движения датчика краниально к плоду от ВТПЖ, что сопровождается небольшими изменениями угла инсоляции для получения наилучшего разрешения для различных структур на каждом изображении. На этом уровне можно визуализировать дугу протока а также дугу аорты 52–55.
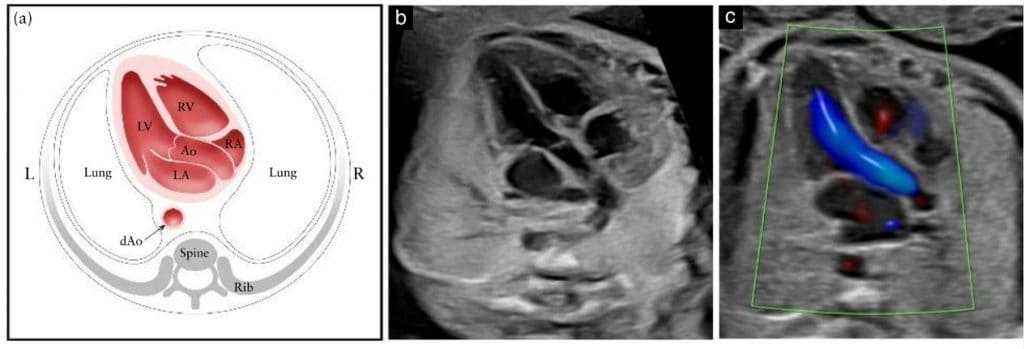
Срез выходного тракта левого желудочка (ВТЛЖ)
ВТЛЖ изображение подтверждает наличие магистрального сосуда, берущего начало из морфологического левого желудочка (Рисунок 6) и из центра сердца. Между межжелудочковой перегородкой и передней стенкой этого сосуда должна быть задокументирована непрерывность, чтобы продемонстрировать целостность инфундибулярной перегородки. Однако только наличие сосудов головы и шеи, отходящих от нее, подтверждает, что этот сосуд является аортой. Аортальный клапан должен свободно двигаться и не должен быть утолщенным. Можно проследить аорту до ее дуги, от которой отходят три артерии в шею. Однако сагиттальные изображения дуги аорты и протока и оценка сосудов шеи в настоящее время не считаются частью рутинного скринингового кардиологического обследования. ВТЛЖ срез помогает выявить дефекты выходной межжелудочковой перегородки и конусно-стволовые аномалии, а также аномалии аортального клапана, которые не видны на четырехкамерном срезе.
Срез выходного тракта правого желудочка (ВТПЖ), трехсосудистый (3СС) и трехсосудисто-трахеальный (3СТС) срезы
Описание взаимосвязей между различными структурами в срезе ВТПЖ, 3СС и 3СТС (Рисунки 7–9) являются точным средством описания многих сердечных пороков. Хотя первоначально они были описаны как специфические неподвижные срезы, сейчас признано, что вид в аксиальной плоскости ВТПЖ, ветвей легочных артерий, а также дуг протока и аорты представляет собой континуум “срезов”, которые могут несколько отличаться в зависимости от положения датчика, лежания плода и точной плоскости, зафиксированной в неподвижном кадре (Рисунок 8). Такая оценка, вероятно, будет более надежной при сканировании в реальном времени или при просмотре кинопленки, а не только на основе серии неподвижных срезов 6.
Визуализация ВТПЖ подтверждает наличие магистрального сосуда, легочной артерии, которая берет начало от морфологического правого желудочка (Рисунок 7 и 8) и разветвляется после короткого хода. Легочный клапан должен свободно двигаться и не должен быть утолщенным. Нормальная легочная артерия проходит слева от задней части восходящей аорты, которая видна на поперечном срезе. Обычно она немного больше восходящей аорты во время внутриутробной жизни и пересекает восходящую аорту спереди и краниально к ВТЛЖ почти под прямым углом. На этом уровне справа от аорты видна верхняя полая вена.
3СС и 3СТС первоначально были описаны как дополнение к четырехкамерному срезу с целью повышения чувствительности скринингового кардиологического обследования. Yoo и соавт. 52 описали 3СС для оценки легочной артерии, восходящей аорты и верхней полой вены и их относительных размеров и взаимосвязей (Рисунок 8). Это предусматривает оценку количества, размера, расположения и соотношения сосудов. Слева направо показаны легочная артерия, аорта и правая верхняя полая вена. Легочная артерия является передним сосудом, а верхняя полая вена – задним. Их относительные диаметры должны уменьшаться слева направо. Распространенные аномалии, связанные с на первый взгляд нормальным четырехкамерным срезом, такие как полная транспозиция магистральных сосудов, тетрада Фалло, двойное отхождение сосудов от правого желудочка, и общий артериальный ствол, а также атрезия легочной артерии с дефектом межжелудочковой перегородки, как правило, будут аномальными при 3СС 100,101.
Рисунок 6 Схематический рисунок (а) и соответствующие полутоновые (b) и цветные допплеровские (с) ультразвуковые срезы выходного тракта левого желудочка, полученные с апикального подхода. На этом снимке видно сосуд, соединенный с левым желудочком (LV). Важно продемонстрировать последовательность между межжелудочковой перегородкой и передней стенкой этого сосуда, которая в нормальном сердце плода соответствует проксимальному отделу восходящей аорты (Ао). Аортальный клапан не должен быть утолщенным и должен свободно открываться. (c) Цветной допплеровский снимок во время систолы демонстрирует ламинарный поток через Ао и вдоль непрерывного перегородочно-аортального соединения. dAo – нисходящая аорта; L – слева; LA – левое предсердие; R – справа; RA – правое предсердие; RV – правый желудочек.
Рисунок 7 Схематический рисунок (а) и соответствующие полутоновые (b) и цветные допплеровские (с) ультразвуковые снимки выходного тракта правого желудочка, которые являются близкими к трехсосудистому срезу. Этот вид демонстрирует не только главную легочную артерию (MPA), соединенную с правым желудочком, но и восходящую аорту (Ao) и верхнюю полую вену (SVC). Легочный клапан не должен быть утолщенным и должен свободно открываться. Можно увидеть раздвоение MPA на обе легочные ветви (левую (LPA) и правую (RPA) легочные артерии). Важно обратить внимание на правильное положение и соотношение трех сосудов, а также на их относительный размер. MPA, слева, является самым большим из трех и передним, тогда как SVC является наименьшим и задним. На (b) и (c) видны бронхиальные ветви (открытые стрелки). На (c) цветная допплерография демонстрирует основную МРА во время систолы, с ее бифуркацией на LPA и RPA. Обратите внимание, между сосудами и передней грудной стенкой можно идентифицировать гипоэхогенную область тимуса. dAo – нисходящая аорта; L – слева; R – справа.
Рисунок 8 Варианты вида выходного тракта правого желудочка и трехсосудистого среза. На (а) видно правый желудочек (RV) с легочным клапаном (PV) и главной легочной артерией (MPA), а также восходящую аорту (Ao) и верхнюю полую вену (SVC). На (b), в несколько большей краниальной плоскости видно бифуркацию MPA на левую (LPA) и правую (RPA) легочные артерии. На (c), в еще более краниальной плоскости, видно, что MPA непрерывно сливается с артериальным протоком (DA), который формирует дугу протока. На рисунке (d) DA визуализируется вместе с PV, тогда как на рисунке (e) DA видно в более краниальной плоскости, без PV, а также начинает просматриваться тимус (Th). Трахея также начинает просматриваться там, где в нижних плоскостях (с) визуализировались бронхи. На (f), трехсосудисто-трахеальном срезе видны дуги аорты и протоки слева от трахеи, а также Th спереди магистральных сосудов. dAo, нисходящая аорта.
Рисунок 9 Схематический рисунок (а) и соответствующие серые (b) и цветные допплеровские (с) ультразвуковые трехсосудисто-трахеальные срезы. В нормальном сердце плода дуга аорты (Ао) и дуга протока, которая простирается от главной легочной артерии (МРА) до нисходящей аорты (dAo), расположены слева от трахеи, в V-образной конфигурации. На (b) и (c) показано взаимоотношение Ао с трахеей (открытая стрелка). На (с) цветная допплерография во время систолы демонстрирует антеградный поток в дуге протока и Ao. Обратите внимание, между сосудами и передней грудной стенкой можно идентифицировать гипоэхогенный участок тимуса. L, слева; R, справа; SVC, верхняя полая вена.
Позже Yagel и соавт. 55 описали 3СТС, краниальный срез по отношению к 3СС, в котором визуализируется дуга аорты (“срез дуги аорты”) и подчеркивается ее взаимосвязь с трахеей (Рисунок 9). На этом рисунке в несколько наклоненной поперечной плоскости видно главную легочную артерию в непосредственном соединении с артериальным протоком. Нормальная дуга аорты расположена справа от главной легочной артерии/дуги протока. Трахею можно идентифицировать как гиперэхогенное кольцо, окружающее небольшое пространство, заполненное жидкостью. Нормальный артериальный проток и дуга аорты проходят слева от трахеи и образуют острый угол (V-образная форма). В этой плоскости также видно нормальную правую верхнюю полую вену и тимус. Дуга аорты является более краниальной, поэтому для одновременной визуализации обеих дуг может потребоваться определенная настройка датчика от истинной осевой плоскости. 3СТС, вероятно, позволит выявить такие поражения, как коарктация аорты, правая дуга аорты и двойная дуга аорты.
Аномалии, диагностированные с помощью 3СС и 3СТС, могут предоставить информацию для консультирования и лечения (например, показания к пренатальному тестированию на микроделецию 22q11), повлиять на планирование места родов (например, при полной транспозиции магистральных сосудов) и немедленного послеродового ухода (например, потребность в инфузии простагландинов), а также позволить предусмотреть потенциальные проблемы с дыхательными путями вследствие сосудистой компрессии 102.
ЦВЕТНОЕ ПОТОКОВОЕ ДОППЛЕРОВСКОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Хотя использование цветной допплерографии не считается обязательным в этих Руководствах, ознакомление с ее применением и включение в рутинный скрининг поощряется 103. Отображение цветного потока является неотъемлемой частью эхокардиограммы плода, и его роль в диагностике ВПС не может быть недооценена. Оно может быть включено во время рутинного скрининга, если оператор чувствует себя компетентным в его использовании. В нормальном сердце плода цветное картирование потока продемонстрирует антеградный поток через атриовентрикулярный и полулунный клапаны и магистральные сосуды. Это также может облегчить визуализацию различных сердечных структур. Например, визуализация потока в аорте и дуге аорты помогает выявить “V-образный знак”, а также выделить аномалии кровотока, такие как регургитация атриовентрикулярного клапана и реверс потока в артериальном протоке и дуге аорты. Это также может быть ценным инструментом в оценке анатомии сердца у пациентов с ожирением 104,105 и может способствовать дальнейшему повышению частоты выявления серьезных ВПС у беременных с низким риском 47,106.
Оптимальные настройки цветного допплера включают использование узкого цветного поля, расположенного только над областью, представляющей интерес для оценки, а не охватывающего весь двумерный объем снимка сердца. Ограничение цветного поля определенной областью интереса оптимизирует частоту кадров и качество цветного снимка, что позволит отображать поток через клапаны и сосуды без помех или задержки снимков в реальном времени. Во время рутинного скрининга во втором триместре шкала скорости цветного потока должна быть установлена на уровне 50-70 см/с для внутрисердечных структур и сосудов. Эта настройка и низкая устойчивость потока цвета обычно включены в кардиологические пресеты. Однако, при исследовании венозных структур шкала скорости должна быть установлена ниже (примерно 15-25 см/с).
ЭХОКАРДИОГРАФИЯ ПЛОДА
Плоды, у которых во время рутинного ультразвукового скрининга сердца обнаружена или заподозрена аномалия, являются кандидатами на проведение эхокардиографии плода 5,6. Для плодов со значительными факторами риска ВПС, то есть когда их риск выше, чем в общей популяции, эхокардиография плода также показана в дополнение к рутинному кардиологическому скринингу, что зависит от таких факторов, как местные ресурсы, клинические условия, наличие специалиста и результаты скрининга. Однако, значительную долю пациентов с ВПС, выявленной пренатально, составляют пациенты без каких-либо факторов риска или экстракардиальных аномалий, что обусловливает важность качественного скрининга и своевременного направления к специалисту, если это свидетельствует о наличии патологии.
Практикующие врачи должны быть ознакомлены с распространенными причинами направления на комплексную оценку состояния сердца с помощью эхокардиографии плода 5,6,107. Хотя точная оценка риска выходит за рамки этого Руководства, неисчерпывающий перечень распространенных состояний плода и пациентки, связанных с повышенным риском ВПС, приведен в Таблице 2 6. Например, толщина воротникового просвета ≥ 3,5 мм в сроке беременности 11-14 недель является показанием для проведения детального кардиологического обследования 108–110, даже если в дальнейшем этот показатель находится в пределах нормального диапазона.
Таблица 2 Общие показания к проведению эхокардиографии плода
*Например, омфалоцеле, врожденная диафрагмальная грыжа, подозрение на атрезию пищевода/желудочно-кишечную непроходимость 124. †Если позволяют ресурсы (двойни также наблюдаются фетальными специалистами). АПФ – ангиотензинпревращающий фермент; анти-Ro/SSA – антиген-А, связанный с синдромом Шегрена; ИМТ – индекс массы тела; ВПС – врожденные пороки сердца; HbA1c – гемоглобин A1c; ИЦИС – интрацитоплазматическая инъекция сперматозоидов; ЭКО – экстракорпоральное оплодотворение; СИОЗС – селективный ингибитор обратного захвата серотонина; ЕПА – единая пупочная артерия.
Эхокардиографию плода лучше всего проводить подготовленным специалистом, который знаком с пренатальной диагностикой ВПС, а также с постнатальным течением, лечением и прогнозом 3. Цель – провести комплексную оценку сердца плода и, если обнаружена аномалия, проконсультировать родителей относительно диагноза, долгосрочных последствий и исхода, а также обсудить варианты лечения. Пренатальное консультирование после выявления ВПС должно также учитывать высокую распространенность психологического дистресса у матерей 111 , связанного с выявлением ВПС у плода.
ГАРАНТИЯ КАЧЕСТВА
При оценке качества важно проверить различные аспекты скринингового кардиологического исследования, чтобы обеспечить полноту информации, включая качество снимков, получение стандартных плоскостей обзора, надлежащую интерпретацию рекомендованных ракурсов сканирования и полную документацию 112,113.
Хорошие технические показатели зависят от оптимальных настроек УЗИ, включая использование кардиологических пресетов и соответствующего увеличения. Это улучшает качество изображения и облегчает способность оператора четко распознавать анатомические ориентиры в различных рекомендуемых плоскостях сканирования. Если используется цветная допплеровская ультрасонография, следует оптимизировать настройки и установить шкалу скоростей в соответствии с визуализируемыми структурами. Одно ретроспективное исследование неудачного пренатального выявления ВПС продемонстрировало, что несоблюдение технических критериев повлекло около 50% пропущенных аномалий 23. Однако, неспособность оператора распознать аномальную анатомию сердца на технически соответствующем изображении была причиной еще 31% пропущенных случаев.
Постоянная оценка качества является чрезвычайно важной для акушерского ультразвука и скрининга сердца плода. Политика аудита, основанная на заранее определенных критериях качества для интерпретации и оценки неподвижных снимков или видеороликов, является важным инструментом, использование которого поощряется и может уменьшить количество ошибок пренатальной диагностики, таким образом улучшая своевременное выявление ВПС 114–117. МОУАГ поощряет каждую практику визуализации ежегодно пересматривать локальные показатели выявления и точности диагностики ВВС и, при необходимости, проводить дальнейшее обучение.
РАННИЙ СКРИНИНГ СЕРДЦА ПЛОДА
Доказано, что скрининг ВПС в первом триместре беременности является эффективным в популяциях с низким риском 118. Однако он не является рутинным и не считается обязательным. В странах или центрах, где это возможно, ранний скрининг можно проводить во время сканирования толщины воротникового пространства. Минимальные требования к раннему скринингу включают визуализацию сердца в грудной клетке и установление регулярного ритма 39. Следует иметь в виду, что из-за малого размера сердца плода на ранних сроках гестации частота успешной визуализации сердечных структур при детальном анатомическом исследовании значительно выше после 12+3 недель гестации 36,119,120.
Рисунок 10 Исследование сердца на ранних сроках беременности должно сосредотачиваться на этих выбранных плоскостях, как и во втором триместре: (а) демонстрация оси сердца (калипер), (б) вид живота с демонстрацией живота слева, (в) четырехкамерный срез (полутон), (г) четырехкамерный срез (цветная допплерография) во время диастолы и (д) трехсосудисто-трахеальный срез (цветная допплерография) во время систолы.
Хотя можно использовать трансвагинальные датчики, рекомендуемая методика включает использование высокочастотных трансабдоминальных датчиков благодаря их более высокому разрешению, а также использование цветного и/или высококачественного энергетического допплера (отображение двунаправленного потока) в дополнение к снимку в полутонах. Цветная и энергетическая допплерография должна быть настроена на приоритет цветного сигнала над полутоном для улучшения визуализации кровотока через мелкие структуры в сердце плода в первом триместре. Из соображений безопасности допплер следует использовать в первую очередь для скрининга четырехкамерного среза и 3СТС. Последнее заявление по безопасности МОУАГ предусматривает, что различные методы допплера могут использоваться в рутинном режиме в сроке от 11 + 0 до 13 + 6 недель при определенных клинических показаниях, включая скрининг аномалий сердца. Тем не менее, важно следить за тепловым индексом, который должен быть ≤ 1,0, а время экспозиции должно быть как можно короче (обычно не дольше 5-10 мин) 121.
Следующие компоненты рекомендуются как часть детального раннего кардиологического скринингового обследования 39 (Рисунок 10).
(1) Оценка положения плода, определяемая на полутоновых снимках, для установления нормального положения желудка и сердца, которые должны находиться с левой стороны плода. Также важно оценить сердечную ось, поскольку она является полезным маркером ВПС 122.
(2) Четырехкамерный срез, отображаемый с помощью полутонового и цветного снимков и/или двунаправленной допплерографии. В идеале позвоночник визуализируется сзади для адекватной демонстрации бивентрикулярного наполнения.
(3) 3СТС, отображаемая с помощью цветного и/или двунаправленного допплеровского ультразвука, для демонстрации левосторонней дуги аорты и протока.
Визуализация левого и правого выходных трактов на таком раннем сроке беременности часто является проблемой и склонна к ложноотрицательному и ложноположительному диагнозу. Следовательно, если ранний скрининг сердца выполняется во время сканирования толщины воротникового пространства, он должен основываться, главным образом, на определении положения плода и получении четырехкамерного среза и 3СТС 123. Если при этом сканировании возникает подозрение на ВПС, пациента следует направить на раннюю эхокардиографию плода.
ССЫЛКИ НА ИСТОЧНИКИ
- Carvalho JS, Allan LD, Chaoui R, Copel JA, DeVore GR, Hecher K, Lee W, Munoz H, Paladini D, Tutschek B, Yagel S. ISUOG Practice Guidelines (updated): sonographic screening examination of the fetal heart. Ultrasound Obstet Gynecol 2013; 41: 348–359.
- De Groote K, Vanhie E, Roets E, Ramaekers P, De Wilde H, Panzer J, Vandekerckhove K, Bove T, Francois K, Van Herck K, De Wolf D. Outcome after prenatal and postnatal diagnosis of complex congenital heart defects and the influence of genetic anomalies. Prenat Diagn 2017; 37: 983–991.
- Lee W, Allan L, Carvalho JS, Chaoui R, Copel J, Devore G, Hecher K, Munoz H, Nelson T, Paladini D, Yagel S. ISUOG consensus statement: what constitutes a fetal echocardiogram? Ultrasound Obstet Gynecol 2008; 32: 239–242.
- Rychik J, Ayres N, Cuneo B, Gotteiner N, Hornberger L, Spevak PJ, Van DV. American Society of Echocardiography guidelines and standards for performance of the fetal echocardiogram. J Am Soc Echocardiogr 2004; 17: 803–810.
- Donofrio MT, Moon-Grady AJ, Hornberger LK, Copel JA, Sklansky MS, Abuhamad A, Cuneo BF, Huhta JC, Jonas RA, Krishnan A, Lacey S, Lee W, Michelfelder EC, Rempel GR, Silverman NH, Spray TL, Strasburger JF, Tworetzky W, Rychik J. Diagnosis and Treatment of Fetal Cardiac Disease: A Scientific Statement From the American Heart Association. Circulation 2014; 129: 2183–2242.
- AIUM Practice Parameter for the Performance of Fetal Echocardiography. J Ultrasound Med 2020; 39: E5–E16.
- Liu Y, Chen S, Zuhlke L, Black GC, Choy MK, Li N, Keavney BD. Global birth prevalence of congenital heart defects 1970–2017: updated systematic review and meta-analysis of 260 studies. Int J Epidemiol 2019; 48: 455–463.
- Holland BJ, Myers JA, Woods CR, Jr. Prenatal diagnosis of critical congenital heart disease reduces risk of death from cardiovascular compromise prior to planned neonatal cardiac surgery: a meta-analysis. Ultrasound Obstet Gynecol 2015; 45: 631–638.
- Tworetzky W, McElhinney DB, Reddy VM, Brook MM, Hanley FL, Silverman NH. Improved surgical outcome after fetal diagnosis of hypoplastic left heart syndrome. Circulation 2001; 103: 1269–1273.
- Franklin O, Burch M, Manning N, Sleeman K, Gould S, Archer N. Prenatal diagnosis of coarctation of the aorta improves survival and reduces morbidity. Heart 2002; 87: 67–69.
- Blyth M, Howe D, Gnanapragasam J, Wellesley D. The hidden mortality of transposition of the great arteries and survival advantage provided by prenatal diagnosis. BJOG 2008; 115: 1096–1100.
- Kipps AK, Feuille C, Azakie A, Hoffman JI, Tabbutt S, Brook MM, Moon-Grady AJ. Prenatal diagnosis of hypoplastic left heart syndrome in current era. Am J Cardiol 2011; 108: 421–427.
- van Velzen CL, Haak MC, Reijnders G, Rijlaarsdam ME, Bax CJ, Pajkrt E, Hruda J, Galindo-Garre F, Bilardo CM, de Groot CJ, Blom NA, Clur SA. Prenatal detection of transposition of the great arteries reduces mortality and morbidity. Ultrasound Obstet Gynecol 2015; 45: 320–325.
- van Velzen CL, Clur SA, Rijlaarsdam ME, Bax CJ, Pajkrt E, Heymans MW, Bekker MN, Hruda J, de Groot CJ, Blom NA, Haak MC. Prenatal detection of congenital heart disease—results of a national screening programme. BJOG 2016; 123: 400–407.
- Bonnet D, Coltri A, Butera G, Fermont L, Le Bidois J, Kachaner J, Sidi D. Detection of transposition of the great arteries in fetuses reduces neonatal morbidity and mortality. Circulation 1999; 99: 916–918.
- Peyvandi S, De Santiago V, Chakkarapani E, Chau V, Campbell A, Poskitt KJ, Xu D, Barkovich AJ, Miller S, McQuillen P. Association of Prenatal Diagnosis of Critical Congenital Heart Disease With Postnatal Brain Development and the Risk of Brain Injury. JAMA Pediatr 2016; 170: e154450.
- Khoshnood B, Lelong N, Houyel L, Bonnet D, Ballon M, Jouannic JM, Goffinet F, EPICARD Study group. Impact of prenatal diagnosis on survival of newborns with four congenital heart defects: a prospective, population-based cohort study in France (the EPICARD Study). BMJ Open 2017; 7: e018285.
- Dolk H, Loane M, Garne E, European Surveillance of Congenital Anomalies Working Group. Congenital heart defects in Europe: prevalence and perinatal mortality, 2000 to 2005. Circulation 2011; 123: 841–849.
- Quartermain MD, Pasquali SK, Hill KD, Goldberg DJ, Huhta JC, Jacobs JP, Jacobs ML, Kim S, Ungerleider RM. Variation in Prenatal Diagnosis of Congenital Heart Disease in Infants. Pediatrics 2015; 136: e378–385.
- Sharland GK, Allan LD. Screening for congenital heart disease prenatally. Results of a 2 1/2-year study in the South East Thames Region. BJOG 1992; 99: 220–225.
- DeVore GR, Medearis AL, Bear MB, Horenstein J, Platt LD. Fetal echocardiography: factors that influence imaging of the fetal heart during the second trimester of pregnancy. J Ultrasound Med 1993; 12: 659–663.
- Tegnander E, Williams W, Johansen OJ, Blaas HG, Eik-Nes SH. Prenatal detection of heart defects in a non-selected population of 30,149 fetuses—detection rates and outcome. Ultrasound Obstet Gynecol 2006; 27: 252–265.
- van Nisselrooij AEL, Teunissen AKK, Clur SA, Rozendaal L, Pajkrt E, Linskens IH, Rammeloo L, van Lith JMM, Blom NA, Haak MC. Why are congenital heart defects being missed? Ultrasound Obstet Gynecol 2020; 55: 747–757.
- Carvalho JS, Mavrides E, Shinebourne EA, Campbell S, Thilaganathan B. Improving the effectiveness of routine prenatal screening for major congenital heart defects. Heart 2002; 88: 387–391.
- Cuneo BF, Olson CA, Haxel C, Howley L, Gagnon A, Benson DW, Kaizer AM, Thomas JF. Risk Stratification of Fetal Cardiac Anomalies in an Underserved Population Using Telecardiology. Obstet Gynecol 2019; 134: 1096–1103.
- Hautala J, Gissler M, Ritvanen A, Tekay A, Pitkanen-Argillander O, Stefanovic V, Sarkola T, Helle E, Pihkala J, Patila T, Mattila IP, Jokinen E, Rasanen J, Ojala T. The implementation of a nationwide anomaly screening programme improves prenatal detection of major cardiac defects: an 11-year national population-based cohort study. BJOG 2019; 126: 864–873.
- Tegnander E, Eik-Nes SH, Johansen OJ, Linker DT. Prenatal detection of heart defects at the routine fetal examination at 18 weeks in a non-selected population. Ultrasound Obstet Gynecol 1995; 5: 372–380.
- Chaoui R. The four-chamber view: four reasons why it seems to fail in screening for cardiac abnormalities and suggestions to improve detection rate. Ultrasound Obstet Gynecol 2003; 22: 3–10.
- Tegnander E, Eik-Nes SH, Linker DT. Incorporating the four-chamber view of the fetal heart into the second-trimester routine fetal examination. Ultrasound Obstet Gynecol 1994; 4: 24–28.
- Kirk JS, Riggs TW, Comstock CH, Lee W, Yang SS, Weinhouse E. Prenatal screening for cardiac anomalies: the value of routine addition of the aortic root to the four-chamber view. Obstet Gynecol 1994; 84: 427–431.
- Achiron R, Glaser J, Gelernter I, Hegesh J, Yagel S. Extended fetal echocardiographic examination for detecting cardiac malformations in low risk pregnancies. BMJ 1992; 304: 671–674.
- Schwarzler P, Senat MV, Holden D, Bernard JP, Masroor T, Ville Y. Feasibility of the second-trimester fetal ultrasound examination in an unselected population at 18, 20 or 22 weeks of pregnancy: a randomized trial. Ultrasound Obstet Gynecol 1999; 14: 92–97.
- Achiron R, Rotstein Z, Lipitz S, Mashiach S, Hegesh J. First-trimester diagnosis of fetal congenital heart disease by transvaginal ultrasonography. Obstet Gynecol 1994; 84: 69–72.
- Yagel S, Weissman A, Rotstein Z, Manor M, Hegesh J, Anteby E, Lipitz S, Achiron R. Congenital heart defects: natural course and in utero development. Circulation 1997; 96: 550–555.
- Rustico MA, Benettoni A, D’Ottavio G, Fischer-Tamaro L, Conoscenti GC, Meir Y, Natale R, Bussani R, Mandruzzato GP. Early screening for fetal cardiac anomalies by transvaginal echocardiography in an unselected population: the role of operator experience. Ultrasound Obstet Gynecol 2000; 16: 614–619.
- Carvalho JS. Fetal heart scanning in the first trimester. Prenat Diagn 2004; 24: 1060–1067.
- Carvalho JS, Moscoso G, Tekay A, Campbell S, Thilaganathan B, Shinebourne EA. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart 2004; 90: 921–926.
- Huggon IC, Ghi T, Cook AC, Zosmer N, Allan LD, Nicolaides KH. Fetal cardiac abnormalities identified prior to 14 weeks’ gestation. Ultrasound Obstet Gynecol 2002; 20: 22–29.
- International Society of Ultrasound in Obstetrics and Gynecology; Bilardo CM, Chaoui R, Hyett JA, Kagan KO, Karim JN, Papageorghiou AT, Poon LC, Salomon LJ, Syngelaki A, Nicolaides KH. ISUOG Practice Guidelines (updated): performance of 11–14-week ultrasound scan. Ultrasound Obstet Gynecol 2023; 61: 127–143.
- Paladini D, Vassallo M, Tartaglione A, Lapadula C, Martinelli P. The role of tissue harmonic imaging in fetal echocardiography. Ultrasound Obstet Gynecol 2004; 23: 159–164.
- Allan LD, Crawford DC, Chita SK, Tynan MJ. Prenatal screening for congenital heart disease. Br Med J (Clin Res Ed) 1986; 292: 1717–1719.
- Copel JA, Pilu G, Green J, Hobbins JC, Kleinman CS. Fetal echocardiographic screening for congenital heart disease: the importance of the four-chamber view. Am J Obstet Gynecol 1987; 157: 648–655.
- DeVore GR. The aortic and pulmonary outflow tract screening examination in the human fetus. J Ultrasound Med 1992; 11: 345–348.
- Achiron R, Rotstein Z, Heggesh J, Bronshtein M, Zimand S, Lipitz S, Yagel S. Anomalies of the fetal aortic arch: a novel sonographic approach to in-utero diagnosis. Ultrasound Obstet Gynecol 2002; 20: 553–557.
- Yoo SJ, Min JY, Lee YH, Roman K, Jaeggi E, Smallhorn J. Fetal sonographic diagnosis of aortic arch anomalies. Ultrasound Obstet Gynecol 2003; 22: 535–546.
- Barboza JM, Dajani NK, Glenn LG, Angtuaco TL. Prenatal diagnosis of congenital cardiac anomalies: a practical approach using two basic views. Radiographics 2002; 22: 1125–1137; discussion 1137–1138.
- Del BA, Russo S, Lacerenza N, Rinaldi M, Rinaldi G, Nappi L, Greco P. Four chamber view plus three-vessel and trachea view for a complete evaluation of the fetal heart during the second trimester. J Perinat Med 2006; 34: 309–312.
- Carvalho JS, Doya E, Freeman J, Clough A. Identification of fetal laterality and visceral situs should be part of routine fetal anomaly scans. In World Congress of Pediatric Cardiology and Cardiac Surgery. Momma K, Imai Y (eds). Futura Pub. Co.: Honolulu, Hawaii, 1997; 117.
- Salomon LJ, Alfirevic Z, Berghella V, Bilardo CM, Chalouhi GE, Da Silva Costa F, Hernandez-Andrade E, Malinger G, Munoz H, Paladini D, Prefumo F, Sotiriadis A, Toi A, Lee W. ISUOG Practice Guidelines (updated): performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol 2022; 59: 840–856.
- Bromley B, Estroff JA, Sanders SP, Parad R, Roberts D, Frigoletto FD, Jr., Benacerraf BR. Fetal echocardiography: accuracy and limitations in a population at high and low risk for heart defects. Am J Obstet Gynecol 1992; 166: 1473–1481.
- Stumpflen I, Stumpflen A, Wimmer M, Bernaschek G. Effect of detailed fetal echocardiography as part of routine prenatal ultrasonographic screening on detection of congenital heart disease. Lancet 1996; 348: 854–857.
- Yoo SJ, Lee YH, Kim ES, Ryu HM, Kim MY, Choi HK, Cho KS, Kim A. Three-vessel view of the fetal upper mediastinum: an easy means of detecting abnormalities of the ventricular outflow tracts and great arteries during obstetric screening. Ultrasound Obstet Gynecol 1997; 9: 173–182.
- Yoo SJ, Lee YH, Cho KS. Abnormal three-vessel view on sonography: a clue to the diagnosis of congenital heart disease in the fetus. AJR Am J Roentgenol 1999; 172: 825–830.
- Vinals F, Heredia F, Giuliano A. The role of the three vessels and trachea view (3VT) in the diagnosis of congenital heart defects. Ultrasound Obstet Gynecol 2003; 22: 358–367.
- Yagel S, Arbel R, Anteby EY, Raveh D, Achiron R. The three vessels and trachea view (3VT) in fetal cardiac scanning. Ultrasound Obstet Gynecol 2002; 20: 340–345.
- Tongsong T, Tongprasert F, Srisupundit K, Luewan S. The complete three-vessel view in prenatal detection of congenital heart defects. Prenat Diagn 2010; 30: 23–29.
- Berg C, Gembruch U, Geipel A. Outflow tract views in two-dimensional fetal echocardiography – part ii. Ultraschall Med 2009; 30: 230–251.
- Freud LR, Moon-Grady A, Escobar-Diaz MC, Gotteiner NL, Young LT, McElhinney DB, Tworetzky W. Low rate of prenatal diagnosis among neonates with critical aortic stenosis: insight into the natural history in utero. Ultrasound Obstet Gynecol 2015; 45: 326–332.
- Yamamoto Y, Hornberger LK. Progression of outflow tract obstruction in the fetus. Early Hum Dev 2012; 88: 279–285.
- Bronshtein M, Gover A, Zimmer EZ. Sonographic definition of the fetal situs. Obstet Gynecol 2002; 99: 1129–1130.
- Carvalho JS, Kyle PM. Images in cardiovascular medicine. Situs inversus with complete transposition in the fetus: diagnostic antenatal sequential segmental analysis. Circulation 1997; 96: 4432–4433.
- Cordes TM, O’Leary PW, Seward JB, Hagler DJ. Distinguishing right from left: a standardized technique for fetal echocardiography. J Am Soc Echocardiogr 1994; 7: 47–53.
- Allan LD, Tynan MJ, Campbell S, Wilkinson JL, Anderson RH. Echocardiographic and anatomical correlates in the fetus. Br Heart J 1980; 44: 444–451.
- Cook AC, Yates RW, Anderson RH. Normal and abnormal fetal cardiac anatomy. Prenat Diagn 2004; 24: 1032–1048.
- Yoo SJ, Min JY, Lee YH. Normal pericardial fluid in the fetus: color and spectral Doppler analysis. Ultrasound Obstet Gynecol 2001; 18: 248–252.
- Brown DL, Cartier MS, Emerson DS, Shanklin DR, Smith WC, Felker RE. The peripheral hypoechoic rim of the fetal heart. J Ultrasound Med 1989; 8: 603–608.
- Comstock CH. Normal fetal heart axis and position. Obstet Gynecol 1987; 70: 255–259.
- Smith RS, Comstock CH, Kirk JS, Lee W. Ultrasonographic left cardiac axis deviation: a marker for fetal anomalies. Obstet Gynecol 1995; 85: 187–191.
- Shipp TD, Bromley B, Hornberger LK, Nadel A, Benacerraf BR. Levorotation of the fetal cardiac axis: a clue for the presence of congenital heart disease. Obstet Gynecol 1995; 85: 97–102.
- Abdullah MM, Lacro RV, Smallhorn J, Chitayat D, van der Velde ME, Yoo SJ, Oman-Ganes L, Hornberger LK. Fetal cardiac dextroposition in the absence of an intrathoracic mass: sign of significant right lung hypoplasia. J Ultrasound Med 2000; 19: 669–676.
- Copel JA, Liang RI, Demasio K, Ozeren S, Kleinman CS. The clinical significance of the irregular fetal heart rhythm. Am J Obstet Gynecol 2000; 182: 813–817.
- Bet BB, de Vries JM, Limpens J, van Wely M, van Leeuwen E, Clur SA, Pajkrt E. Implications of fetal premature atrial contractions: systematic review. Ultrasound Obstet Gynecol 2022; 60: 721–730.
- Simpson JL, Yates RW, Sharland GK. Irregular heart rate in the fetus: not always benign. Cardiol Young 1996; 6: 28–31.
- Cuneo BF, Strasburger JF, Wakai RT, Ovadia M. Conduction system disease in fetuses evaluated for irregular cardiac rhythm. Fetal Diagn Ther 2006; 21: 307–313.
- Carvalho JS. Risk stratification for irregular fetal heart rhythm: practical approach to management. Ultrasound Obstet Gynecol 2022; 60: 717–720.
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 106: Intrapartum fetal heart rate monitoring: nomenclature, interpretation, and general management principles. Obstet Gynecol 2009; 114: 192–202.
- Carvalho JS. Primary bradycardia: keys and pitfalls in diagnosis. Ultrasound Obstet Gynecol 2014; 44: 125–130.
- Carvalho JS. Fetal dysrhythmias. Best Pract Res Clin Obstet Gynaecol 2019; 58: 28–41.
- Mitchell JL, Cuneo BF, Etheridge SP, Horigome H, Weng HY, Benson DW. Fetal heart rate predictors of long QT syndrome. Circulation 2012; 126: 2688–2695.
- Srinivasan S, Strasburger J. Overview of fetal arrhythmias. Curr Opin Pediatr 2008; 20: 522–531.
- Hazelzet T, Durand I, David N. [Total isolated anomalous pulmonary venous return: Are there any clues for prenatal screening?]. Gynecol Obstet Fertil 2015; 43: 541–548.
- Kirk JS, Comstock CH, Lee W, Smith RS, Riggs TW, Weinhouse E. Fetal cardiac asymmetry: a marker for congenital heart disease. Obstet Gynecol 1999; 93: 189–192.
- Sharland GK, Chan KY, Allan LD. Coarctation of the aorta: difficulties in prenatal diagnosis. Br Heart J 1994; 71: 70–75.
- Hornberger LK, Sanders SP, Rein AJ, Spevak PJ, Parness IA, Colan SD. Left heart obstructive lesions and left ventricular growth in the midtrimester fetus. A longitudinal study. Circulation 1995; 92: 1531–1538.
- Paladini D, Pistorio A, Wu LH, Meccariello G, Lei T, Tuo G, Donarini G, Marasini M, Xie HN. Prenatal diagnosis of total and partial anomalous pulmonary venous connection: multicenter cohort study and meta-analysis. Ultrasound Obstet Gynecol 2018; 52: 24–34.
- Paladini D, Palmieri S, Lamberti A, Teodoro A, Martinelli P, Nappi C. Characterization and natural history of ventricular septal defects in the fetus. Ultrasound Obstet Gynecol 2000; 16: 118–122.
- Axt-Fliedner R, Schwarze A, Smrcek J, Germer U, Krapp M, Gembruch U. Isolated ventricular septal defects detected by color Doppler imaging: evolution during fetal and first year of postnatal life. Ultrasound Obstet Gynecol 2006; 27: 266–273.
- Vettraino IM, Lee W, Bronsteen RA, Comstock CH. Sonographic evaluation of the ventricular cardiac outflow tracts. J Ultrasound Med 2005; 24: 566.
- Everwijn SMP, van Nisselrooij AEL, Rozendaal L, Clur SB, Pajkrt E, Hruda J, Linskens IH, van Lith JM, Blom NA, Haak MC. The effect of the introduction of the three-vessel view on the detection rate of transposition of the great arteries and tetralogy of Fallot. Prenat Diagn 2018; 38: 951–957.
- Bravo C, Gamez F, Perez R, Alvarez T, De Leon-Luis J. Fetal Aortic Arch Anomalies: Key Sonographic Views for Their Differential Diagnosis and Clinical Implications Using the Cardiovascular System Sonographic Evaluation Protocol. J Ultrasound Med 2016; 35: 237–251.
- Karl K, Sinkovskaya E, Abuhamad A, Chaoui R. Intrathymic and other anomalous courses of the left brachiocephalic vein in the fetus. Ultrasound Obstet Gynecol 2016; 48: 464–469.
- Galindo A, Gutierrez-Larraya F, Escribano D, Arbues J, Velasco JM. Clinical significance of persistent left superior vena cava diagnosed in fetal life. Ultrasound Obstet Gynecol 2007; 30: 152–161.
- Durand I, Hazelzet T, Gillibert A, Parrod C, David N, El Youssef F, Brehin AC, Barre E. Outcomes following prenatal diagnosis of isolated persistent left superior vena cava. Arch Cardiovasc Dis 2022; 115: 335–347.
- Lopes KRM, Bartsota M, Doughty V, Carvalho JS. Single left superior vena cava: antenatal diagnosis, associated anomalies and outcomes. Ultrasound Obstet Gynecol 2022; 60: 640–645.
- Chaoui R, Heling KS, Lopez AS, Thiel G, Karl K. The thymic-thoracic ratio in fetal heart defects: a simple way to identify fetuses at high risk for microdeletion 22q11. Ultrasound Obstet Gynecol 2011; 37: 397–403.
- Paladini D. How to identify the thymus in the fetus: the thy-box. Ultrasound Obstet Gynecol 2011; 37: 488–492.
- Karl K, Heling KS, Sarut Lopez A, Thiel G, Chaoui R. Thymic-thoracic ratio in fetuses with trisomy 21, 18 or 13. Ultrasound Obstet Gynecol 2012; 40: 412–417.
- Anton T, Sklansky MS, Perez M, Pretorius DH. The Fetal 3-Vessel Views: An Illustrative Case-Based Tutorial. J Ultrasound Med 2019; 38: 3335–3347.
- Yagel S, Cohen SM, Achiron R. Examination of the fetal heart by five short-axis views: a proposed screening method for comprehensive cardiac evaluation. Ultrasound Obstet Gynecol 2001; 17: 367–369.
- Sun HY, Proudfoot JA, McCandless RT. Prenatal detection of critical cardiac outflow tract anomalies remains suboptimal despite revised obstetrical imaging guidelines. Congenit Heart Dis 2018; 13: 748–756.
- Sklansky MS, Berman DP, Pruetz JD, Chang RK. Prenatal screening for major congenital heart disease: superiority of outflow tracts over the 4-chamber view. J Ultrasound Med 2009; 28: 889–899.
- Jain S, Kleiner B, Moon-Grady A, Hornberger LK. Prenatal diagnosis of vascular rings. J Ultrasound Med 2010; 29: 287–294.
- Chaoui R, McEwing R. Three cross-sectional planes for fetal color Doppler echocardiography. Ultrasound Obstet Gynecol 2003; 21: 81–93.
- Paladini D. Sonography in obese and overweight pregnant women: clinical, medicolegal and technical issues. Ultrasound Obstet Gynecol 2009; 33: 720–729.
- Sklansky M, Afshar Y, Anton T, DeVore GR, Platt L, Satou G. Guidance for fetal cardiac imaging in patients with degraded acoustic windows. Ultrasound Obstet Gynecol 2022; 59: 709–712.
- Nadel AS. Addition of color Doppler to the routine obstetric sonographic survey aids in the detection of pulmonic stenosis. Fetal Diagn Ther 2010; 28: 175–179.
- Small M, Copel JA. Indications for fetal echocardiography. Pediatr Cardiol 2004; 25: 210–222.
- Mavrides E, Cobian-Sanchez F, Tekay A, Moscoso G, Campbell S, Thilaganathan B, Carvalho JS. Limitations of using first-trimester nuchal translucency measurement in routine screening for major congenital heart defects. Ultrasound Obstet Gynecol 2001; 17: 106–110.
- Ghi T, Huggon IC, Zosmer N, Nicolaides KH. Incidence of major structural cardiac defects associated with increased nuchal translucency but normal karyotype. Ultrasound Obstet Gynecol 2001; 18: 610–614.
- Hyett JA, Perdu M, Sharland GK, Snijders RS, Nicolaides KH. Increased nuchal translucency at 10–14 weeks of gestation as a marker for major cardiac defects. Ultrasound Obstet Gynecol 1997; 10: 242–246.
- Rychik J, Donaghue DD, Levy S, Fajardo C, Combs J, Zhang X, Szwast A, Diamond GS. Maternal psychological stress after prenatal diagnosis of congenital heart disease. J Pediatr 2013; 162: 302–307.e1.
- Cabana MD, Rand CS, Powe NR, Wu AW, Wilson MH, Abboud PA, Rubin HR. Why don’t physicians follow clinical practice guidelines? A framework for improvement. JAMA 1999; 282: 1458–1465.
- Sklansky M, DeVore GR. Fetal Cardiac Screening: What Are We (and Our Guidelines) Doing Wrong? J Ultrasound Med 2016; 35: 679–681.
- Salomon LJ, Winer N, Bernard JP, Ville Y. A score-based method for quality control of fetal images at routine second-trimester ultrasound examination. Prenat Diagn 2008; 28: 822–827.
- Sairam S, Awadh AM, Cook K, Papageorghiou AT, Carvalho JS. Impact of audit of routine second-trimester cardiac images using a novel image-scoring method. Ultrasound Obstet Gynecol 2009; 33: 545–551.
- Quarello E, Lafouge A, Fries N, Salomon LJ, CFEF. Basic heart examination: feasibility study of first-trimester systematic simplified fetal echocardiography. Ultrasound Obstet Gynecol 2017; 49: 224–230.
- Letourneau KM, Horne D, Soni RN, McDonald KR, Karlicki FC, Fransoo RR. Advancing Prenatal Detection of Congenital Heart Disease: A Novel Screening Protocol Improves Early Diagnosis of Complex Congenital Heart Disease. J Ultrasound Med 2018; 37: 1073–1079.
- Volpe P, Ubaldo P, Volpe N, Campobasso G, De Robertis V, Tempesta A, Volpe G, Rembouskos G. Fetal cardiac evaluation at 11–14 weeks by experienced obstetricians in a low-risk population. Prenat Diagn 2011; 31: 1054–1061.
- Smrcek JM, Berg C, Geipel A, Fimmers R, Diedrich K, Gembruch U. Early fetal echocardiography: heart biometry and visualization of cardiac structures between 10 and 15 weeks’ gestation. J Ultrasound Med 2006; 25: 173–182.
- Yagel S, Cohen SM, Porat S, Daum H, Lipschuetz M, Amsalem H, Messing B, Valsky DV. Detailed transabdominal fetal anatomic scanning in the late first trimester versus the early second trimester of pregnancy. J Ultrasound Med 2015; 34: 143–149.
- Salvesen K, Abramowicz J, Ter Haar G, Miloro P, Sinkovskaya E, Dall’Asta A, Marsal K, Lees C, Board of the International Society of Ultrasound in Obstetrics and Gynecology. ISUOG statement on the safe use of Doppler for fetal ultrasound examination in the first 13 + 6 weeks of pregnancy (updated). Ultrasound Obstet Gynecol 2021; 57: 1020.
- Sinkovskaya ES, Chaoui R, Karl K, Andreeva E, Zhuchenko L, Abuhamad AZ. Fetal cardiac axis and congenital heart defects in early gestation. Obstet Gynecol 2015; 125: 453–460.
- Wiechec M, Knafel A, Nocun A. Prenatal detection of congenital heart defects at the 11- to 13-week scan using a simple color Doppler protocol including the 4-chamber and 3-vessel and trachea views. J Ultrasound Med 2015; 34: 585–594.
- Ghimire LV, Chou FS, Moon-Grady AJ. Risk of congenital heart disease is increased among newborns with non-cardiac congenital anomalies: survey-based analysis using 2016 Kids’ Inpatient Database. Ultrasound Obstet Gynecol 2021; 57: 841–842.