Резюме
На відміну від прогресуючого фіброзу печінки, практичні правила ранньої неінвазивної діагностики цирозу печінки при НАЖХП залишаються недостатньо визначеними. У цій статті ми повідомляємо про розробку та валідацію поетапного діагностичного алгоритму у 1568 пацієнтів з НАЖХП та біопсією печінки з чотирьох незалежних когорт. Алгоритм дослідження, використовуючи спочатку тести на основі еластографії Agile3+ і Agile4, а потім спеціалізовані аналізи крові FibroMeterV3G і CirrhoMeterV3G, забезпечує стратифікацію на чотири групи, остання з яких збагачена цирозом печінки (71% поширеності у валідаційному наборі). Також отримано графік прогнозування ризику, що дозволяє оцінити індивідуальну імовірність розвитку цирозу печінки. Прогнозований ризик демонструє відмінне калібрування у валідаційному наборі, а середня різниця з ідеальним прогнозом становить лише -2,9%. Ці інструменти покращують персоналізовану неінвазивну діагностику цирозу печінки при НАЖХП.
Вступ
Прогноз для пацієнтів з неалкогольною жировою хворобою печінки (НАЖХП), найпоширенішою причиною хронічних захворювань печінки у всьому світі, тісно пов’язаний зі стадією фіброзу печінки 1,2. Наразі існує декілька неінвазивних стратегій, в основному з використанням аналізів крові та еластографії, для виявлення підгрупи пацієнтів з групи ризику в клінічній практиці 3. Запропоновано алгоритми, що поєднують неінвазивні тести, не тільки для підвищення точності діагностики, але й для визначення оптимальної послідовності їх використання для виявлення пацієнтів, які потребують скерування до гепатолога 4,5. У своїх останніх рекомендаціях 2021 року Європейська асоціація з вивчення печінки (ЄАВП) запропонувала трирівневий алгоритм діагностики прогресуючого фіброзу печінки при НАЖХП з використанням спочатку простого аналізу крові FIB4, потім вимірювання жорсткості печінки за допомогою вібраційно контрольованої транзієнтної еластографії (ВКТЕ) і, нарешті, запатентованих аналізів крові 6. Оскільки він дозволяє діагностувати прогресуючий фіброз печінки без біопсії печінки, коли всі три діагностичні лінії узгоджуються, цей алгоритм є інноваційним і являє собою значний прогрес у лікуванні пацієнтів з НАЖХП.
Виявлення пацієнтів з цирозом печінки неінвазивним шляхом, на відміну від прогресуючого фіброзу, є основним пріоритетом в області НАЖХП, оскільки такі пацієнти потребують особливого клінічного ведення, включаючи скринінг на гепатоцелюлярну карциному, варикозне розширення вен стравоходу і саркопенію, як це рекомендовано більшістю міжнародних рекомендацій 7,8,9. Крім того, для пацієнтів з циротичним НАСГ 10 проводяться специфічні терапевтичні дослідження, що робить необхідним ретельний відбір кандидатів для цих досліджень. Зараз доступні нові неінвазивні тести, спеціально розроблені для діагностики цирозу. Agile4 поєднує результати ВКТЕ з рутинними параметрами оцінки печінки (сироваткові трансамінази, тромбоцити, стать і діабет) у формулі, присвяченій цирозу 11. CirrhoMeterV3G (CMV3G) був розроблений для визначення цирозу печінки з використанням тих самих біомаркерів, що й у спеціалізованому аналізі крові FibroMeterV3G (FMV3G)12. Ці тести, призначені для діагностики цирозу, дають можливість удосконалити рекомендовані на сьогодні алгоритми неінвазивної діагностики прогресуючого фіброзу печінки. Дійсно, розраховані одночасно з тестами, що використовуються в цих алгоритмах, без необхідності використання додаткових біомаркерів, вони можуть сприяти дискримінації нової групи, що включає пацієнтів з цирозом печінки.
У цій роботі ми використовували найефективніші неінвазивні тести, доступні в даний час фахівцям з печінки, для розробки та валідації точного діагнозу цирозу печінки у пацієнтів з НАЖХП, який переведений в категорію “цироз печінки” в рекомендованих в даний час діагностичних алгоритмах.
Результати
Пацієнти
З 1757 пацієнтів, які були спочатку доступні, 1568 були включені в дослідження. Їхні характеристики наведені в таблиці 1. Середній вік становив 57,6 років, 59,1% пацієнтів були чоловіками, середній ІМТ – 31,6 кг/м2, 51,3% мали цукровий діабет 2 типу. Середня довжина біоптату становила 25 мм, а 91,6% біоптатів були довжиною не менше 15 мм. Поширеність прогресуючого фіброзу печінки F34 становила 38,3%, а цирозу – 12,1%.
Таблиця 1 Характеристики пацієнтів
|
|
Всього(n = 1568) |
Набір деривацій (n = 872) |
Набір валідацій (n = 696) |
p |
Вік (років) |
57.6 [48.6;64.9] |
57.0 [48.0;64.0] |
58.4 [49.4;65.7] |
0.020 |
Чоловіча стать (%) |
59.1 |
56.4 |
62.5 |
0.015 |
ІМТ (кг/м2) |
31.6 [28.3;36.3] |
31.9 [28.1;36.8] |
31.6 [28.5;36.0] |
0.776 |
ЦД2(%) |
51.3 |
52.5 |
49.9 |
0.309 |
Довжина біоптату (мм) |
25 [20;33] |
24 [18;30] |
30 [22;35] |
1.1e−19 |
Оцінка активності НАЖХП |
4 [3;5] |
5[3;6] |
4 [3;5] |
1.1e−9 |
Стадія фіброзу (%): |
|
|
|
0.015 |
– F0 |
12.1 |
12.4 |
11.6 |
|
– F1 |
22.6 |
23.4 |
21.6 |
|
– F2 |
27.1 |
24.2 |
30.7 |
|
– F3 |
26.2 |
26.1 |
26.3 |
|
– F4 |
12.1 |
13.9 |
9.8 |
|
Фіброз F34 (%) |
38.3 |
40.0 |
36.1 |
0.117 |
Цироз F4 (%) |
12.1 |
13.9 |
9.8 |
0.015 |
АсАТ (МО/л) |
39 [29;55] |
39 [30;56] |
38 [28;54] |
0.137 |
АлАТ (МО/л) |
55 [36;79] |
54 [35;79] |
56 [37;82] |
0.244 |
Гамма-ГТ (МО/л) |
72 [40;139] |
71 [41;141] |
73 [40;133] |
0.759 |
Білірубін (мкмоль/л) |
10 [7;13] |
10 [7;13] |
10 [7;14] |
0.715 |
Альбумін (г/л) |
43.4 [41.0;46.0] |
43.4 [41.1;46.0] |
43.9 [41.0;46.0] |
0.569 |
Тромбоцити (Г/л) |
222 [181;265] |
224 [183;266] |
218 [179;261] |
0.163 |
Протромбіновий час (%) |
95 [88;101] |
93 [86;100] |
97 [90;103] |
1.9e−11 |
Оцінка фіброзу при НАЖХП |
−0.801 [−1.936;0.279] |
−0.800 [−1.974;0.300] |
−0.801 [−1.885;0.218] |
0.704 |
FIB4 |
1.36 [0.92;2.04] |
1.34 [0.91;2.07] |
1.37 [0.93;2.00] |
0.915 |
FibroMeterV3G |
0.48 [0.28;0.73] |
0.47 [0.28;0.74] |
0.48 [0.28;0.70] |
0.219 |
CirrhoMeterV3G |
0.02 [0.01;0.10] |
0.02 [0.01;0.10] |
0.02 [0.01;0.09] |
0.105 |
ВКТЕ (кПа) |
8.7 [6.1;13.2] |
8.5 [6.1;12.5] |
8.8 [6.1;13.9] |
0.213 |
Agile3+ |
0.43 [0.14;0.77] |
0.43 [0.13;0.77] |
0.43 [0.14;0.76] |
0.826 |
Agile4 |
0.04 [0.01;0.17] |
0.05 [0.01;0.19] |
0.04 [0.01;0.16] |
0.869 |
-
АлАТ Аланінамінотрансфераза, АсАТ Аспартатамінотрансфераза, ІМТ Індекс маси тіла, НАЖХП Неалкогольна жирова хвороба печінки, ЦД2 Цукровий діабет 2 типу, ВКТЕ Вібраційно контрольована транзієнтна еластографія.
-
Неперервні змінні виражалися як медіана з першим і третім квартилями і порівнювалися за допомогою тесту Манна-Уітні або тесту Краскела-Уолліса, коли це було доцільно. Категоріальні змінні виражалися у відсотках і порівнювалися за допомогою критерію хі-квадрат або Фішера, коли це було доречно. Всі статистичні тести були двосторонніми.
Точність неінвазивних тестів
Наші результати підтвердили дуже добрі та відмінні області під робочою характеристикою приймача (AUROC) неінвазивних тестів для діагностики цирозу печінки з результатами, що досягають 0,90 для найкращих тестів (Табл. 2). Як для прогресуючого фіброзу, так і для цирозу, оцінка фіброзу за NAFLFD була найменш точним тестом на фіброз, а тести на основі еластографії показали кращі результати, ніж тести на фіброз крові (Табл. 2).
Таблиця 2 AUROC неінвазивних тестів на прогресуючий фіброз та цироз печінки
| Ціль діагностики | Тест на фіброз | Всього (n = 1568) | Набір деривацій (n = 872) | Набір валідацій (n = 696) | p |
| Розширений | ОФН | 0.743 (0.718–0.767) | 0.750 (0.718–0.783) | 0.733 (0.695–0.770) | 0.505 |
| Фіброз | FIB4 | 0.779 (0.756–0.802) | 0.791 (0.761–0.821) | 0.763 (0.727–0.799) | 0.232 |
| F34 | FibroMeterV3G | 0.792 (0.769–0.815) | 0.789 (0.758–0.820) | 0.795 (0.761–0.830) | 0.797 |
| CirrhoMeterV3G | 0.758 (0.732–0.783) | 0.760 (0.727–0.793) | 0.753 (0.715–0.792) | 0.790 | |
| ВКТЕ | 0.820 (0.799–0.841) | 0.816 (0.787–0.845) | 0.829 (0.798–0.860) | 0.553 | |
| Agile3+ | 0.852 (0.832–0.871) | 0.846 (0.820–0.872) | 0.860 (0.831–0.888) | 0.464 | |
| Agile 4 | 0.838 (0.841–0.879) | 0.832 (0.804–0.860) | 0.845 (0.815–0.875) | 0.526 | |
| Цироз | ОФН | 0.767 (0.734–0.801) | 0.766 (0.723–0.809) | 0.774 (0.723–0.826) | 0.814 |
| F4 | FIB4 | 0.816 (0.785–0.848) | 0.818 (0.781–0.856) | 0.814 (0.758–0.870) | 0.908 |
| FibroMeterV3G | 0.820 (0.789–0.851) | 0.813 (0.774–0.853) | 0.832 (0.783–0.880) | 0.553 | |
| CirrhoMeterV3G | 0.812 (0.778–0.846) | 0.801 (0.756–0.846) | 0.830 (0.778–0.881) | 0.403 | |
| ВКТЕ | 0.870 (0.845–0.895) | 0.859 (0.825–0.893) | 0.900 (0.870–0.931) | 0.079 | |
| Agile3+ | 0.893 (0.871–0.915) | 0.875 (0.844–0.905) | 0.925 (0.898–0.952) | 0.019 | |
| Agile 4 | 0.893 (0.869–0.917) | 0.875 (0.841–0.908) | 0.925 (0.897–0.953) | 0.023 |
- ОФН Оцінка фіброзу НАЖХП, ВКТЕ Вібраційно контрольована транзиторна еластографія.
- AUROC порівнювали за допомогою двостороннього тесту Делонга.
Ми оцінили точність порогів виключення/включення для тестів, призначених для діагностики цирозу печінки, а також для тестів, спрямованих на діагностику прогресуючого фіброзу. Діагностична точність цих порогових значень була узгодженою між дериваційним та валідаційним наборами. Для виключення цирозу печінки низький поріг F34 виявився кращим, ніж низький поріг F4, з дво-триразовим зменшенням кількості хибнонегативних результатів, що призвело до підвищення чутливості до > 95%. З іншого боку, високий поріг F4 виявився кращим, ніж високий поріг F34 для визначення цирозу печінки, з 2-6-кратним зменшенням кількості хибнопозитивних результатів і вищою специфічністю, яка досягла > 92%. У сукупності ці результати свідчать про те, що поєднання низького порогу F34 з високим порогом F4 є найкращим підходом для виключення та підтвердження цирозу печінки.
Комплементарність тестів на фіброз
Тести на фіброз з кожної відповідної пари, FMV3G/CMV3G та Agile3+/Agile4, включають однакові змінні, хоча один тест призначений для діагностики прогресуючого фіброзу печінки (FMV3G, Agile3+), а інший – для діагностики цирозу (CMV3G, Agile4). Тому ми оцінили взаємодоповнюваність тестів кожної з цих двох пар. Agile3+ і Agile4 дуже добре корелювали, а зв’язок між цими двома тестами мав експоненціальну форму. Таким чином, шляхом перехресного зв’язку трьох інтервалів, визначених пороговими значеннями F34 Agile3+, з трьома інтервалами, визначеними пороговими значеннями F4 Agile4, ми побачили, що Agile4 стратифікує ризик розвитку цирозу в межах вищого інтервалу Agile3+ (Зобр. 1а). Дійсно, у пацієнтів з Agile3+ ≥0,679 поширеність цирозу печінки була ще вищою, коли Agile4 становив > 0,474. Це спонукало нас розробити класифікацію Agile3 + /4, що включає чотири групи зі зростаючою поширеністю прогресуючого фіброзу та цирозу печінки (Зобр. 1b): (i) Agile3 + <0,451; (ii) Agile3+ між 0,451 і 0,678; (iii) Agile3 + ≥ 0,679 з Agile4 ≤ 0,474; і (iv) Agile3 + ≥0,679 з Agile4 > 0,474. Аналогічні результати були отримані для FMV3G та CMV3G, причому CMV3G також стратифікує ризик цирозу в межах вищого інтервалу FMV3G (Зобр. 1c), що призводить до виділення чотирьох груп за класифікацією FM/CM (Зобр. 1d): (i) FMV3G < 0,31; (ii) FMV3G між 0,31 і 0,76; (iii) FMV3G > 0,76 з CMV3G ≤ 0,40; і (iv) FMV3G > 0,76 з CMV3G > 0,40.
Зображення 1: Класифікації Agile3+/4 та FibroMeterV3G/CirrhoMeterV3G (FM/CM) у дериваційному наборіa Стадії фіброзу як функція підгруп, визначених пороговими значеннями F34 Agile3+ та F4 Agile4. b Стадії фіброзу як функція чотирьох груп класифікації Agile3 + /4. Чотири групи класифікації Agile3 + /4 є результатом перетину результатів Agile3+ і Agile4 наступним чином: (i) Agile3+ < 0,451; (ii) Agile3+ між 0,451-0,678; (iii) Agile3+ ≥ 0,679 при Agile4 ≤ 0,474; і (iv) Agile3+ ≥ 0,679 при Agile4 > 0,474. c Стадії фіброзу як функція підгруп, визначених пороговими значеннями F34 FibroMeterV3G (FMV3G) та F4 CirrhoMeterV3G (CMV3G). d Стадія фіброзу як функція чотирьох груп за класифікацією FM/CM. Чотири групи класифікації FM/CM є результатом перетину результатів FMV3G та CMV3G наступним чином: (i) FMV3G < 0,31; (ii) FMV3G між 0,31-0,76; (iii) FMV3G > 0,76 при CMV3G ≤ 0,40; і (iv) FMV3G > 0,76 при CMV3G > 0,40. Вихідні дані надаються у вигляді файлу Source Data.
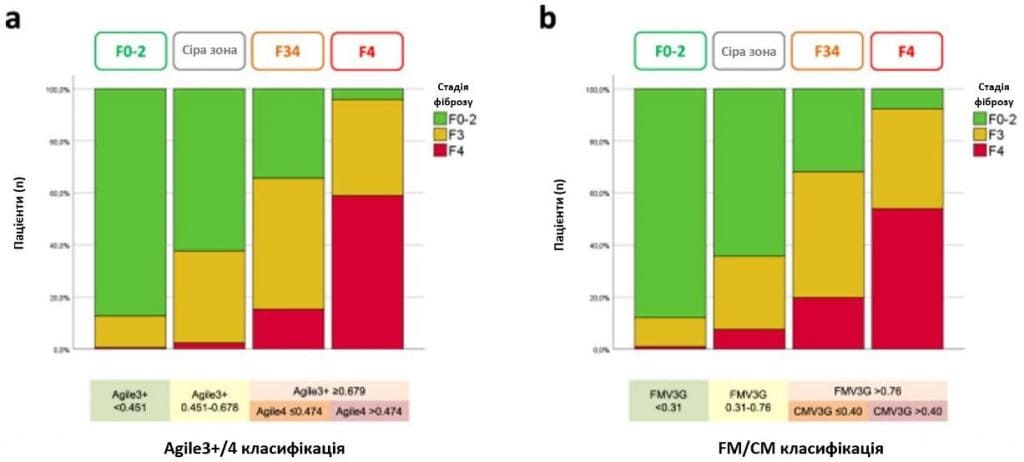
У вибірці валідації поширеність цирозу печінки становила менше 1% у першій групі за класифікаціями Agile3+/4 та FM/CM (Зобр. 2а, b). У четвертій групі поширеність цирозу становила 59% для класифікації Agile3 + /4 і 54% для класифікації FM/CM.
Зображення 2: Класифікації Agile3+/4 та FibroMeterV3G/CirrhoMeterV3G (FM/CM) у валідаційному наборі.Стадії фіброзу в залежності від чотирьох груп класифікації Agile3+/4 (а) та чотирьох груп класифікації FM/CM (б) у валідаційному наборі. Вихідні дані надаються у вигляді файлу Source Data.
Алгоритм дослідження
На основі попередніх результатів ми обрали найкращого кандидата серед простих аналізів крові (FIB4), спеціалізованих аналізів крові (комбінація FMV3G/CMV3G) та тестів на основі еластографії (комбінація Agile3 + /4). Багатофакторний аналіз, що включав ці три кандидати, показав, що комбінації Agile3 + /Agile4 та FMV3G/CMV3G є незалежними предикторами цирозу печінки без суттєвого впливу FIB4. Останні рекомендації ЄАВП пропонують використовувати спеціалізовані аналізи крові для підтвердження діагнозу фіброзу печінки, встановленого за допомогою ВКТЕ 6. Тому ми оцінили, чи допомагає класифікація FM/CM (на основі спеціалізованих аналізів крові) уточнити діагноз фіброзу печінки, встановлений за допомогою класифікації Agile3+/4 на основі еластографії. Поширеність стадій фіброзу в 16 отриманих підгрупах дозволила нам остаточно стратифікувати пацієнтів за чотирма діагнозами (Зобр. 3а): F0-2; Необхідна біопсія печінки (сіра зона); Поглиблений фіброз F34; Цироз F4. На Зобр. 3b (дериваційний набір) та Зобр. 3c (валідаційний набір) показано стадії фіброзу в залежності від цих чотирьох груп. У валідаційному наборі 71% пацієнтів з групи F4 мали підтверджений цироз за результатами біопсії печінки. Серед пацієнтів з цирозом печінки 47% були в групі F4, 43% – в групі F34, 7% – в групі біопсії, і лише 3% були помилково класифіковані в групі F0-2. Алгоритм дослідження поставив правильний діагноз 86% пацієнтів і вимагав проведення біопсії печінки лише у 20% пацієнтів. Важливо, що 88% неправильно класифікованих пацієнтів у валідаційному наборі мали лише одну стадію фіброзу. Всі ці результати були надійними і не відрізнялися між дериваційним і валідаційним набором.
Зображення 3: Алгоритм дослідження.a Опис алгоритму. Послідовність використання неінвазивних тестів є такою ж, як і нещодавно рекомендована Європейською асоціацією з вивчення печінки: спочатку ВКТЕ, а потім спеціалізований аналіз крові 6. Спеціалізований аналіз крові виконується після ВКТЕ лише за умови Agile3+ ≥0,451 для підтвердження діагнозу при підозрі на прогресуючий фіброз/цироз печінки. Алгоритм дослідження стратифікує пацієнтів на чотири діагностичні групи: F0-2 (відсутність/легкий фіброз), Біопсія (тобто невизначений діагноз з необхідністю проведення біопсії печінки), F34 (прогресуючий фіброз) і F4 (цироз). b Стадії фіброзу як функція чотирьох груп, визначених алгоритмом дослідження в наборі для виведення. c Стадії фіброзу як функція чотирьох груп, визначених алгоритмом дослідження в наборі для валідації. CMV3G: CirrhoMeterV3G; FMV3G: FibroMeterV3G; FM/CM класифікація: Класифікація FibroMeterV3G/CirrhoMeterV3G; ВКТЕ: вібраційно контрольована перехідна еластографія. Вихідні дані надаються у вигляді файлу Source Data.
У порівнянні з ЄАВП, класифікація Agile3 + /4 і алгоритм дослідження включали більше пацієнтів в категорію “F0-2”, зберігаючи при цьому високу точність діагностики в цій категорії 85-90%. Алгоритм дослідження перевершив класифікацію Agile3 + /4 за кількістю пацієнтів, правильно віднесених до категорій F34 і F4 (тобто позитивне прогностичне значення), а також у всій популяції. Нарешті, порівняно з нині рекомендованим шляхом ЄАВП, алгоритм дослідження підтримував високу діагностичну точність у валідаційному наборі (відповідно 86,1% проти 85,9%, p = 1,000), забезпечуючи при цьому категорію цирозу печінки F4 без використання додаткових біомаркерів.
Далі ми зосередилися на точності досліджуваного алгоритму бінарної діагностики цирозу печінки порівняно з класифікацією Agile3 + /4. Для цього аналізу ми розглядали категорії F0-2 і сіру зону цих алгоритмів як зону виключення цирозу, категорію F34 – як невизначену зону цирозу (без дискримінації між пацієнтами F4 і F3), а категорію F4 – як зону включення. Порівняно з класифікацією Agile3 + /4 у валідаційному наборі, алгоритм дослідження забезпечив 20% підвищення точності діагностики в зоні дії правил (позитивне прогностичне значення з 58,9% до 71,1%) і, відповідно, меншу кількість хибнопозитивних результатів щодо цирозу печінки.
Фіброз печінки, виміряний за допомогою морфометрії біоптатів з Анжерського центру, добре корелював зі стадіями фіброзу, особливо з площею фіброзу (Rs = 0,548) і ще більше з площею портального фіброзу (Rs = 0,711). Площа фіброзу і площа портального фіброзу поступово збільшувалися в усіх чотирьох групах нашого алгоритму дослідження, причому різниця була значущою між усіма парами сусідніх груп.
Діаграми прогнозування ризиків
В рамках дериваційного набору було розроблено дві діаграми прогнозування ризику: одна для діагностики цирозу, а інша – для прогресуючого фіброзу печінки. Ці діаграми були представлені за допомогою контурних графіків, що показують спільний вплив Agile3+/Agile4 та FMV3G/CMV3G на ризик розвитку цирозу (Зобр. 4а) та ризик розвитку прогресуючого фіброзу печінки (Зобр. 4b). Наприклад, для пацієнта з Agile3+ на рівні 0,85, Agile4 на рівні 0,68, FMV3G на рівні 0,91 і CMV3G на рівні 0,40 прогнозований ризик прогресуючого фіброзу печінки становить > 90% (Зобр. 4б), а ризик цирозу – 60-80% (Зобр. 4а).
Зображення 4: Діаграми прогнозування ризиків.Діаграми ризику для прогнозування цирозу печінки (а) та прогресуючого фіброзу (б). Коли Agile3+ >0,678, перейдіть до шкали Agile4; коли FibroMeterV3G >0,76, перейдіть до шкали CirrhoMeterV3G.
На Зобр. 5а показано калібрувальний графік діаграми ризику цирозу печінки у валідаційному наборі. Калібрування між прогнозованим ризиком за діаграмою та спостережуваною поширеністю цирозу було відмінним. Середня різниця між прогнозованим ризиком за допомогою графіка ризику цирозу печінки (суцільна чорна лінія) та ідеальним прогнозом (пунктирна синя лінія) становила лише -2,9% (крайні значення: -5% та -2%). Ми також оцінили поширеність цирозу печінки в 7 групах, виділених за допомогою діаграми ризику цирозу. Як і очікувалося, після аналізу калібрувального графіка спостережувана поширеність цирозу дуже добре збігалася з прогнозованою поширеністю в кожній групі (Зобр. 5c), що демонструє релевантність діаграми ризику цирозу для клінічної практики. Наша таблиця прогнозування ризику покращила прогнозування цирозу порівняно з Agile4 або CMV3G, причому високі результати цих тестів були пов’язані з переоцінкою ймовірності розвитку цирозу на 25%.
Зображення 5: Калібрування прогнозованого ризику за діаграмами ризиків дослідження у валідаційному наборіа Калібрувальний графік прогнозованого ризику розвитку цирозу печінки за діаграмою ризику, представленою на Зобр. 4а. Синя пунктирна лінія відображає ідеальний прогноз (прогнозований ризик розвитку цирозу = спостережувана поширеність цирозу). Чорна суцільна лінія відображає спостережувану поширеність цирозу як функцію прогнозованого ризику за діаграмою ризику цирозу. b Калібрувальний графік прогнозованого ризику прогресуючого фіброзу за діаграмою ризику, представлений на Зобр. 4b. c Пацієнти були розподілені на 7 груп, окреслених діаграмою ризику цирозу печінки, і спостережувана поширеність цирозу представлена для кожної з цих 7 груп. d Пацієнти були розподілені на 10 груп, окреслених діаграмою ризику прогресуючого фіброзу, і спостережувана поширеність прогресуючого фіброзу представлена для кожної з цих 10 груп. Вихідні дані надаються у вигляді файлу Source Data.
Такий самий аналіз був проведений для прогресуючого фіброзу у валідаційному наборі. Калібрування між прогнозом графіка ризику прогресуючого фіброзу і спостережуваною поширеністю прогресуючого фіброзу було відмінним (Зобр. 5b). Середня різниця між прогнозованим ризиком і ідеальним прогнозом становила лише -2,7% (крайні значення: -5% і +2%). Спостережувана поширеність прогресуючого фіброзу в 10 групах, виділених за допомогою діаграми ризику прогресуючого фіброзу, дуже добре збігалася з прогнозованою поширеністю (Зобр. 5d).
Нарешті, морфометричний аналіз показав, що площа фіброзу прогресивно збільшувалася з ризиком цирозу печінки та ризиком прогресуючого фіброзу, як і передбачалося нашими діаграмами ризиків.
Обговорення
Попередні дослідження неінвазивної діагностики цирозу печінки при НАЖХП були зосереджені на точності окремих тестів, без вивчення тестів у комбінації 13,14. Більше того, нещодавнє дослідження показало, що неінвазивні тести є точними у виключенні цирозу, але вони набагато менш точні у підтвердженні діагнозу 15. Нещодавно були випробувані інноваційні методи комбінації біомаркерів за допомогою машинного навчання, але, порівняно з наявними в клінічній практиці тестами на фіброз, вони суттєво не підвищили AUROC для цирозу і не покращили здатність підтверджувати цироз з поганим позитивним прогностичним значенням між 40 і 60% 16. Ми пропонуємо підхід, який поєднує неінвазивні тести на фіброз для точного визначення наявності або відсутності цирозу печінки в клінічній практиці, а також інноваційні схеми прогнозування ризику, що дозволяють персоналізовано оцінити індивідуальну ймовірність прогресуючого фіброзу печінки та цирозу печінки.
Наше дослідження підкреслює інтерес до поєднання одних і тих самих наборів біомаркерів у різних рівняннях, розроблених для конкретних діагностичних цілей. У цьому контексті тести на основі еластографії Agile3+ та Agile4 включають результати ВКТЕ з простими маркерами крові та клінічними параметрами, причому перший тест призначений для діагностики прогресуючого фіброзу печінки, а другий – для цирозу печінки. Ми виявили, що цироз краще виключати, використовуючи поріг виключення тесту на прогресуючий фіброз (Agile3+), і краще підтверджувати, використовуючи поріг включення тесту на цироз (Agile4). Такі ж результати були отримані за допомогою спеціалізованих аналізів крові FMV3G (призначений для виявлення прогресуючого фіброзу) і CMV3G (призначений для виявлення цирозу печінки). Ці результати спонукали нас запропонувати класифікацію фіброзу Agile3+/4 та FM/CM. Порівняно з окремими тестами, ці дві класифікації дозволили стратифікувати пацієнтів на чотири групи з низькою частотою необхідної біопсії печінки, в той час як синергетична перевага комбінованих тестів з дуже низькою частотою цирозу в першій групі виключення і останньою групою, збагаченою на цироз печінки, була забезпечена.
Накопичені докази в галузі діагностики фіброзу печінки показують, що послідовне поєднання неінвазивних тестів, особливо з різних модальностей (біопсія та еластографія), підвищує точність діагностики. Відповідно до цих даних, ми виявили, що поєднання Agile3+/4 на основі еластографії та класифікації FM/CM на основі крові покращило здатність підтверджувати діагноз цирозу печінки з 71% поширеністю в останній групі (Зобр. 3c). Алгоритм нашого дослідження (Зобр. 3а) не вимагає додаткових вимірювань до тих, що використовуються в останніх рекомендаціях EASL 6. Адже, окрім ВКТЕ, Agile3+ та Agile4 включають лише загальні маркери крові (сироваткові трансамінази, тромбоцити). По-друге, спеціалізований аналіз крові не потрібен, якщо діагноз Agile3+/4 за класифікацією F0-2. По-третє, спеціалізовані аналізи крові, необхідні після класифікації Agile3 +/4, включають FibroMeter (рекомендований ЄАВП після обстеження ВКТЕ) та CirrhoMeter (розраховується на основі тих самих змінних, що й FibroMeter). Зрештою, наш алгоритм дослідження можна розглядати як удосконалення і розширення алгоритму ЄАВП, використовуючи ті ж параметри і послідовність тестів на фіброз, але забезпечуючи більш точну і достовірну діагностику фіброзу печінки.
Незважаючи на всі ці значні покращення, 43% пацієнтів з F4 з валідаційного набору були включені в групу F34 нашого алгоритму дослідження, і тому не могли бути диференційовані від пацієнтів з F3. Така підгрупа пацієнтів з цирозом, який важко діагностувати, була очікуваною, оскільки жоден тест на фіброз не міг чітко розмежувати пацієнтів з цирозом і без цирозу печінки. Оскільки ймовірність цирозу печінки прогресивно зростала з отриманням результатів кожного тесту на фіброз, ми перейшли від класичного підходу, що полягає в послідовному використанні тестів на фіброз, інтерпретованих з діагностичними порогами, і наданні остаточної напівкількісної класифікації (Зобр. 3а), до більш кількісного підходу, що полягає в персоналізованій оцінці індивідуальної ймовірності цирозу печінки на основі результатів тестів на фіброз (Зобр. 4а). Розроблені нами таблиці прогнозування ризику мають ту перевагу, що дозволяють лікарю вибрати свій рівень вимог, який може змінюватися залежно від клінічної ситуації. Наприклад, для виключення цирозу печінки у пацієнта лікар повинен мати дуже низький ризик. З іншого боку, щоб включити пацієнта в клінічне дослідження, лікар повинен мати прийнятний рівень невдач скринінгу, наприклад, 30% (тобто ймовірність цирозу печінки 70%). Така варіативність вибору неможлива в послідовному алгоритмі з фіксованими пороговими значеннями тестів, що підкреслює високий інтерес наших графіків прогнозування ризику для клінічної практики. Нарешті, цей підхід, заснований на оцінці ризику, відповідає персоналізованій медицині, що розвивається в інших медичних спеціальностях, наприклад, прогнозуванню серцево-судинного ризику 17.
Стадіювання, яке проводить патологоанатом, є широко використовуваним методом гістологічної оцінки фіброзу печінки, але морфометрія забезпечує більш кількісну, чутливу і відтворювану оцінку 18. Морфометрія має перевагу в тому, що вона дозволяє виділити значні ефекти, які не були виявлені при стадіюванні фіброзу в клінічних дослідженнях 19. Більше того, лонгітюдні дослідження продемонстрували, що площа фіброзу, виміряна за допомогою морфометрії, є кращим прогностичним маркером, ніж стадія фіброзу при хронічних захворюваннях печінки 20,21. Використовуючи цей точний метод, ми виявили, що наш алгоритм дослідження дискримінує чотири групи зі значною різницею в обсязі фіброзу печінки. Більше того, площа фіброзу прогресивно зростала з підвищенням ризику, оціненого за допомогою наших карт прогнозування, що підтверджує актуальність такого імовірнісного підходу для клінічної практики. Дві переваги кількісної шкали, наданої нашими картами прогнозування ризику, полягають у тому, що вони дозволять чітко окреслити популяцію з ризиком ускладнень, пов’язаних з печінкою, а також точно оцінити поріг рентабельності спеціалізованого менеджменту. Наразі необхідні подальші лонгітюдні дослідження, щоб оцінити прогностичну значущість стратифікації тяжкості захворювання та економічну ефективність лікування з використанням наших нових інструментів.
Сильними сторонами нашої роботи є дуже велика кількість включених пацієнтів (n = 1568); наявність декількох тестів на фіброз (простих і спеціалізованих), що використовують різні методи (біологічні, еластографія) і спрямовані на різні діагностичні цілі (прогресуючий фіброз печінки, цироз); багатоцентровий дизайн фази 3 з незалежними наборами для виведення і валідації, що забезпечує найвищий рівень доказовості відповідно до рекомендацій TRIPOD 22; надійність розроблених інструментів, точність яких, що спостерігалася в дериваційному наборі, була підтверджена в валідаційному наборі на кожному етапі їх розробки; і, нарешті, можливість підтвердити наші результати за допомогою морфометрії печінки, кількісного методу вимірювання фіброзу печінки, який є більш чутливим, ніж класичне напівкількісне визначення стадії на біопсії печінки. Деякі характеристики пацієнтів відрізнялися між дериваційною та валідаційною наборами, що відображає різницю в практиці набору пацієнтів у різних центрах. Тим не менш, отримані нами результати суттєво не відрізнялися між двома наборами, що свідчить про надійність результатів нашого дослідження.
Ми визнаємо, що наше дослідження має певні обмеження. ПФП є точним неінвазивним тестом, який також пропонується в рекомендованих алгоритмах неінвазивної діагностики фіброзу печінки при НАЖХП 6,23. На жаль, ПФП не був доступний і не міг бути протестований у нашому дослідженні. Необхідна подальша робота, щоб оцінити інтерес ПФП в комбінаціях тестів для діагностики цирозу печінки. Окрім аналізів крові та еластографії, в клінічній практиці доступні інші прилади для неінвазивної оцінки цирозу, такі як доплерографія, але ці дані не були доступні в нашому дослідженні. Необхідно оцінити, чи допомагає доплерографія уточнити діагноз цирозу печінки у пацієнтів, класифікованих за алгоритмом нашого дослідження як F34. У британській когорті проводилося консенсусне читання біоптатів печінки (PB, VP), але гістологічне читання у французьких центрах виконувалося місцевим патологоанатомом (SM, BL, NS). Тим не менш, всі ці патологоанатоми були експертами, що спеціалізуються на гепатології, з досвідом роботи не менше 20 років. Попередні дослідження показали, що відтворюваність між спостерігачами для визначення стадії фіброзу є набагато кращою, навіть відмінною, коли вона виконується експертами 24,25,26. Алгоритм нашого дослідження і графіки прогнозування ризику були розроблені на основі наборів даних, що надходять з центрів третинної медичної допомоги, і тому добре підходять для використання в контексті клінік, що спеціалізуються на лікуванні печінки. Зі зростанням обізнаності про захворювання та подальшим широким застосуванням неінвазивних тестів можна очікувати, що наші інструменти будуть поширюватися в умовах, де поширеність цирозу печінки нижча, наприклад, у діабетологічних клініках. Необхідна подальша робота, щоб оцінити їх у такому контексті використання, а також визначити, чи потрібно їх перекалібровувати для цих умов.
Отже, неінвазивна діагностика цирозу печінки залишається незадоволеною потребою при НАЖХП. Розроблений і валідований нами послідовний алгоритм і таблиці прогнозування ризику є значним прогресом для ведення пацієнтів у клінічній практиці. Оскільки в них використовуються ті ж самі тести на фіброз і послідовність їх проведення, ці інструменти є розширенням і вдосконаленням чинних рекомендацій.
Методи
Пацієнти
У цьому дослідженні було використано чотири когорти дорослих пацієнтів з неалкогольною жировою хворобою печінки (НАЖХП), біопсію печінки та вібраційно контрольовану транзиторну еластографію (ВКТЕ). Три з них були локальними і незалежними когортами з трьох французьких університетських лікарень (Анже, n = 579; Бордо, n = 525; і Ґренобль, n = 117), які раніше були опубліковані у пос. 27 і оновлені для цієї роботи. Четверта когорта (n = 347) була отримана з багатоцентрового дослідження, проведеного в 7 центрах печінки у Великобританії 28. Всі чотири когорти отримали схвалення від етичних комітетів: CPP Ouest II Angers (CB2010-01) для когорти Анже; CPP Sud-Ouest et Outre Mer III для когорти Бордо; ARS Rhone Alpes (AC-2014-2094) для когорти Ґренобля; та Комітет з етики досліджень Північного Уельсу (13/WA/0385) для когорти Великобританії. Схвалення IRB для когорт охоплювало роботу, виконану тут. Всі пацієнти дали письмову інформовану згоду перед включенням.
Пацієнтам, включеним у дослідження, була проведена біопсія печінки в рамках дослідження НАЖХП після виключення супутніх препаратів, що викликають стеатоз (таких як кортикостероїди, тамоксифен, аміодарон або метотрексат), надмірного вживання алкоголю (> 30 г/добу у чоловіків або > 20 г/добу у жінок), хронічної інфекції гепатиту В або С, або ознак інших супутніх хронічних захворювань печінки. Пацієнтів не включали, якщо вони мали в наявності або в анамнезі ускладнення, пов’язані з печінкою (асцит, варикозна кровотеча, жовтяниця, енцефалопатія, гепатоцелюлярна карцинома). Критеріями виключення з дослідження були довжина біоптату печінки < 10 мм, невдача ВКТЕ та відсутність маркерів крові для розрахунку тестів на фіброз. Усі пацієнти були госпіталізовані з гепатологічних клінік, і жодна з біопсій не була виконана під час баріатричної операції.
Дані з чотирьох когорт були об’єднані у файлі Excel (Excel v2303, Microsoft, Редмонд, штат Вашингтон, США). Три французькі когорти не брали участі в розробці тестів на фіброз, які оцінювалися в цьому дослідженні, тоді як британська когорта була частиною багатоцентрового набору, в якому були розроблені тести на фіброз Agile3+ і Agile4. Крім того, дані морфометрії (площа фіброзу) були доступні лише для пацієнтів, включених в дослідження з центру Анже. Тому ми вирішили об’єднати когорти Великобританії та Бордо в якості дериваційного набору для нашого дослідження, а когорти Анже та Ґренобля – в якості валідаційного набору. Такий дизайн дозволив отримати (i) валідаційний набір, яка не включала жодного пацієнта, використаного для отримання різних оцінюваних тестів на фіброз; (ii) дизайн фази 3 відповідно до рекомендацій TRIPOD 22; (iii) добре збалансовані дериваційні (n = 872) і валідаційні (n = 696) набори; і (iv) використання морфометрії як додаткового методу оцінки в валідаційному наборі.
Гістологічне дослідження печінки
Патологоанатомічні дослідження проводилися в кожному з трьох французьких центрів одним і тим же старшим експертом, який спеціалізувався на гепатології (SM, BLB, NS) і був сліпим до даних пацієнта. Ми та інші дослідники продемонстрували відмінну відтворюваність результатів оцінки фіброзу печінки між спостерігачами, коли їх виконували експерти-патологоанатоми 24,25,26. У британській когорті гістологічні препарати аналізували незалежно два експерти-патологоанатоми (PB, VP), які були сліпими до читання один одного і до даних пацієнта. У разі розбіжностей вони переглядали слайди разом для досягнення консенсусу. Всі експерти, залучені до дослідження, мали щонайменше 20-річний досвід роботи в галузі гістопатології печінки. Фіброз печінки оцінювали відповідно до бальної системи NASH CRN 24, тобто F0: відсутність фіброзу; F1: перисинусоїдальний або портальний/перипортальний фіброз, F2: перисинусоїдальний і портальний/перипортальний фіброз, F3: проміжний фіброз і F4: цироз. Запущений фіброз печінки визначався як стадії фіброзу F3 + F4 (F34).
Для всіх пацієнтів, включених до когорти Анже, забарвлений пікрофуксином червоним зріз біоптату всієї печінки оцифровували у вигляді високоякісних зображень (30 000 × 30 000 пікселів, роздільна здатність 0,5 мкм/піксель). Площа всього фіброзу, площа портального фіброзу та площа перисинусоїдального фіброзу були автоматично виміряні на оцифрованому біоптаті за допомогою програмного забезпечення для морфометрії 29.
Вимірювання жорсткості печінки
Вимірювання жорсткості печінки проводили за допомогою технології ВКТЕ (апарат FibroScan; Echosens, Париж, Франція), досвідченими операторами та відповідно до рекомендацій виробника. Вимірювання проводили натщесерце, протягом трьох місяців після біопсії печінки (протягом тижня для 89% пацієнтів). Оператори були сліпі до гістологічних та біологічних результатів. Оцінки Agile3+ та Agile4 розраховували відповідно до опублікованих формул 11.
Тести на фіброз крові
Зразки крові натщесерце брали протягом тижня після біопсії печінки. Наступні тести на фіброз крові були розраховані відповідно до опублікованих або запатентованих формул: FIB4, оцінка фіброзу НАЖХП, FibroMeterV3G (FMV3G) та CirrhoMeterV3G (CMV3G) 12,30,31. CMV3G – це аналіз крові, який поєднує в собі ті ж змінні, що і FMV3G, але об’єднані у формулі з коефіцієнтами, розрахованими спеціально для діагностики цирозу печінки. Всі аналізи крові були виконані в лабораторіях дослідницьких центрів. Раніше ми вже демонстрували відмінну міжлабораторну відтворюваність тестів на фіброз крові 32. Коли діагностичні пороги були недоступні в літературі, ми розраховували їх у дериваційному наборі дослідження з подальшою валідацією у валідаційному наборі.
Статистика
Неперервні змінні виражалися як медіани з першим і третім квартилями і порівнювалися за допомогою тестів Манна-Уітні або Краскала-Уолліса. Категоріальні змінні виражалися у відсотках і порівнювалися за допомогою критерія Хі-квадрат або Фішера. Кореляції між кількісними змінними визначалися за допомогою коефіцієнта кореляції Спірмена. Наступні аналізи були виконані в дериваційному наборі та додатково підтверджені в валідаційному наборі.
Точність неінвазивних тестів для діагностики цирозу печінки
Діагностична точність 7 доступних неінвазивних тестів (оцінка фіброзу НАЖХП, FIB4, FMV3G, CMV3G, ВКТЕ, Agile3+ і Agile4) оцінювалася за допомогою площі під робочою характеристикою приймача (AUROC) і порівнювалася з тестом Делонга. Також оцінювалася точність порогів виключення (чутливість, негативна прогностична цінність) і включення (специфічність, позитивна прогностична цінність).
Доповнення між неінвазивними тестами
Потім ми оцінили взаємодоповнюваність між тестами, розробленими для прогресуючого фіброзу та цирозу печінки. Метою було оцінити, як взаємодіють тести, що включають однакові біомаркери, але призначені для різних діагностичних цілей (у нашому дослідженні: Agile3+ і Agile4, FibroMeter і CirrhoMeter), і чи дозволяє їх комбінація краще стратифікувати пацієнтів. Якщо це підтвердиться, такий підхід допоможе покращити неінвазивну діагностику на різних етапах рекомендованих алгоритмів (еластографія, спеціалізований аналіз крові).
Узгодження між неінвазивними тестами
Найкраща комбінація тестів для діагностики цирозу печінки була визначена за допомогою багатовимірної бінарної логістичної регресії, яка включала найкращих кандидатів, визначених на основі попередніх результатів. Потім була оцінена узгодженість між обраними тестами для постановки остаточного діагнозу, в результаті чого був розроблений діагностичний алгоритм, що включає категорію цирозу печінки. Нарешті, наш алгоритм дослідження було порівняно з алгоритмом, запропонованим Європейською асоціацією з вивчення печінки, щоб продемонструвати покращення, зроблені нашим методом.
Діаграми прогнозування ризиків
Нарешті ми розробили діаграму прогнозування ризику, яка показує ймовірність розвитку цирозу печінки (виражену у відсотках) на основі результатів тестів на фіброз. Ця діаграма була представлена за допомогою контурних графіків, що показують спільний вплив тестів на фіброз, попередньо відібраних за допомогою багатовимірного аналізу. Також було розроблено діаграму прогнозування ризику, яка вказує на ймовірність розвитку прогресуючого фіброзу.
Статистичний аналіз проводився за допомогою програмного забезпечення SPSS версії 25.0 (IBM, Армонк, Нью-Йорк, США) та R версії 3.6.2.
Посилання на джерела
- Sanyal, A. J. et al. Prospective Study of Outcomes in Adults with Nonalcoholic Fatty Liver Disease. N. Engl. J. Med. 385, 1559–1569 (2021).
- Taylor, R. S. et al. Association Between Fibrosis Stage and Outcomes of Patients With Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. Gastroenterology 158, 1611–1625 e1612 (2020).
- Boursier, J. & Tsochatzis, E. A. Case-finding strategies in non-alcoholic fatty liver disease. JHEP Rep. 3, 100219 (2021).
- Boursier, J. et al. New sequential combinations of non-invasive fibrosis tests provide an accurate diagnosis of advanced fibrosis in NAFLD. J. Hepatol. 71, 389–396 (2019).
- Srivastava, A. et al. Prospective evaluation of a primary care referral pathway for patients with non-alcoholic fatty liver disease. J. Hepatol. 71, 371–378 (2019).
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis − 2021 update. J. Hepatol. 75, 659–689 (2021).
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J. Hepatol. 69, 182–236 (2018).
- Heimbach, J. K. et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology 67, 358–380 (2018).
- Omata, M. et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update. Hepatol. Int. 11, 317–370 (2017).
- Anania, F. A., Dimick-Santos, L., Mehta, R., Toerner, J. & Beitz, J. Nonalcoholic Steatohepatitis: Current Thinking From the Division of Hepatology and Nutrition at the Food and Drug Administration. Hepatology 73, 2023–2027 (2021).
- Sanyal, A. J. et al. Enhanced diagnosis of advanced fibrosis and cirrhosis in individuals with NAFLD using FibroScan-based Agile scores. J. Hepatol. 78, 247–259 (2023).
- Cales, P. et al. Optimization and robustness of blood tests for liver fibrosis and cirrhosis. Clin. Biochem. 43, 1315–1322 (2010).
- Mozes, F. E. et al. Diagnostic accuracy of non-invasive tests for advanced fibrosis in patients with NAFLD: an individual patient data meta-analysis. Gut 71, 1006–1019 (2021).
- Xiao, G. et al. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fibrosis in patients with nonalcoholic fatty liver disease: A meta-analysis. Hepatology 66, 1486–1501 (2017).
- Brandman, D. et al. Comparison of clinical prediction rules for ruling out cirrhosis in nonalcoholic fatty liver disease (NAFLD). Aliment Pharm. Ther. 55, 1441–1451 (2022).
- Chang, D. et al. Machine learning models are superior to noninvasive tests in identifying clinically significant stages of NAFLD and NAFLD-related cirrhosis. Hepatology 77, 546–557 (2022).
- SCORE2 working group and ESC Cardiovascular risk collaboration. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur. Heart J. 42, 2439–2454 (2021).
- Nam, D., Chapiro, J., Paradis, V., Seraphin, T. P. & Kather, J. N. Artificial intelligence in liver diseases: Improving diagnostics, prognostics and response prediction. JHEP Rep. 4, 100443 (2022).
- Taylor-Weiner, A. et al. A Machine Learning Approach Enables Quantitative Measurement of Liver Histology and Disease Monitoring in NASH. Hepatology 74, 133–147 (2021).
- Huang, Y. et al. Image analysis of liver biopsy samples measures fibrosis and predicts clinical outcome. J. Hepatol. 61, 22–27 (2014).
- Buzzetti, E. et al. Collagen proportionate area is an independent predictor of long-term outcome in patients with non-alcoholic fatty liver disease. Aliment Pharm. Ther. 49, 1214–1222 (2019).
- Collins, G. S., Reitsma, J. B., Altman, D. G. & Moons, K. G. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): the TRIPOD statement. BMJ 350, g7594 (2015).
- Vali, Y. et al. Enhanced liver fibrosis test for the non-invasive diagnosis of fibrosis in patients with NAFLD: A systematic review and meta-analysis. J. Hepatol. 73, 252–262 (2020).
- Kleiner, D. E. et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 41, 1313–1321 (2005).
- Bedossa, P., Consortium, F.P. Utility and appropriateness of the fatty liver inhibition of progression (FLIP) algorithm and steatosis, activity, and fibrosis (SAF) score in the evaluation of biopsies of nonalcoholic fatty liver disease. Hepatology 60, 565–575 (2014).
- Boursier, J. et al. Screening for therapeutic trials and treatment indication in clinical practice: MACK-3, a new blood test for the diagnosis of fibrotic NASH. Aliment Pharm. Ther. 47, 1387–1396 (2018).
- Canivet, C. M. et al. Validation of the new 2021 EASL algorithm for the noninvasive diagnosis of advanced fibrosis in NAFLD. Hepatology 77, 920–930 (2022).
- Eddowes, P. J. et al. Accuracy of FibroScan Controlled Attenuation Parameter and Liver Stiffness Measurement in Assessing Steatosis and Fibrosis in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 156, 1717–1730 (2019).
- Sandrini, J. et al. Quantification of portal-bridging fibrosis area more accurately reflects fibrosis stage and liver stiffness than whole fibrosis or perisinusoidal fibrosis areas in chronic hepatitis C. Mod. Pathol. 27, 1035–1045 (2014).
- Shah, A. G. et al. Comparison of noninvasive markers of fibrosis in patients with nonalcoholic fatty liver disease. Clin. Gastroenterol. Hepatol. 7, 1104–1112 (2009).
- Angulo, P. et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 45, 846–854 (2007).
- Cales, P. et al. Reproducibility of blood tests of liver fibrosis in clinical practice. Clin. Biochem. 41, 10–18 (2008).