🤖 Короткий переказ від ШІ
Холангіокарцинома (ХКА) є другим за поширеністю первинним раком печінки, що характеризується несприятливим прогнозом, особливо у нерезектабельних випадках. Дослідження зосереджуються на печінковій артеріальній інфузійній хіміотерапії (ПАІХ) як ефективному методі лікування, що дозволяє доставляти високі дози хіміопрепаратів безпосередньо до пухлини.
Результати останніх досліджень свідчать про те, що комбінований підхід ПАІХ із системною хіміотерапією (СИС) покращує виживаність без прогресування та загальну виживаність порівняно із застосуванням лише СИС або ПАІХ. Проте, частота конверсії до резектабельності залишається низькою, а обмежена кількість досвідчених фахівців та брак проспективних досліджень є ключовими викликами. Для детальнішого ознайомлення з медичним обладнанням, зокрема УЗД апарати, відвідайте наш сайт.
✅ Ключові тези зі статті:
- Діагностика: Холангіокарцинома (ХКА) класифікується за анатомічною локалізацією (внутрішньопечінкова, перихілярна, дистальна) та макроскопічним характером росту.
- Лікування: Основні методи лікування включають хірургічне втручання (для ранніх стадій), системну хіміотерапію (ЦІС-ГЕМ, FOLFOX), таргетну терапію та печінкову артеріальну інфузійну хіміотерапію (ПАІХ).
- Переваги: ПАІХ дозволяє досягати вищих і більш селективних концентрацій хіміопрепаратів у пухлині, зменшуючи системну токсичність, і комбінований підхід з СИС покращує виживаність.
- Обмеження: Обмежена кількість досвідчених фахівців, брак проспективних досліджень та потенційні ускладнення (біліарний склероз, тромбози) є ключовими викликами для ПАІХ.
Останнє оновлення: 22 липня 2025 р.
Експертна перевірка: Матеріал перевірено та відредаговано експертами RH.ua
Примітка про ШІ: Цей блок створено за допомогою генеративного ШІ для швидкого ознайомлення з основними ідеями статті. Для повного розуміння теми рекомендуємо прочитати повний текст.
⚠️ Не замінює медичну консультацію
Резюме
Холангіокарцинома (ХКА) – другий за поширеністю первинний рак печінки. Незважаючи на останні досягнення в хірургічному лікуванні, прогноз залишається несприятливим: 5-річна виживаність становить менше 5%. Медіана виживання при внутрішньопечінковій ХКА становить від 18 до 30 місяців, але якщо вона вважається нерезектабельною, то зменшується до 6 місяців. Більшість пацієнтів мають захворювання, обмежене печінкою, яке вважається нерезектабельним через свою локалізацію, з інфільтрацією судинних структур або мультифокальність. Своєрідне подвійне кровопостачання дозволяє доставляти високі дози хіміотерапії за допомогою хірургічно імплантованого підшкірного насоса, через переважну артеріальну васкуляризацію пухлини, досягаючи набагато вищих і більш селективних рівнів пухлинних препаратів, ніж при системному введенні. Результати останніх досліджень свідчать про те, що адекватне та раннє лікування із застосуванням комбінованого підходу печінкової артеріальної інфузії (ПАІ) та системної хіміотерапії (СИС) асоціюється з покращенням виживаності без прогресування та загальної виживаності, ніж тільки СИС або ПАІ при лікуванні нерезектабельної вХКА. Поточні рекомендації обмежені відсутністю проспективних досліджень. Індивідуалізація хіміотерапії та режимів, заснованих на селективних мішенях при мутантній вХКА, є основним напрямком майбутніх досліджень. У цій статті ми представляємо комплексний огляд опублікованих на сьогоднішній день досліджень та досліджень, що тривають.
Ключові слова: внутрішньопечінкова холангіокарцинома; нерезектабельна; печінкова артеріальна інфузійна хіміотерапія
-
Вступ
Перший опис випадку холангіокарциноми (ХКА) датується 1840 р. Дюран-Фарделем [1]. ХКА – це епітеліальна пухлина з особливостями диференціювання холангіоцитів [2]. Вона походить з протокового епітелію жовчного дерева від каналів Герінга до основної жовчної протоки [3]. Більшість пацієнтів страждають від нерезектабельного захворювання з моменту виявлення, а смерть настає протягом 12 місяців від моменту встановлення діагнозу через наслідки кахексії, швидкого зниження працездатності, печінкової недостатності та рецидивуючого сепсису [4].
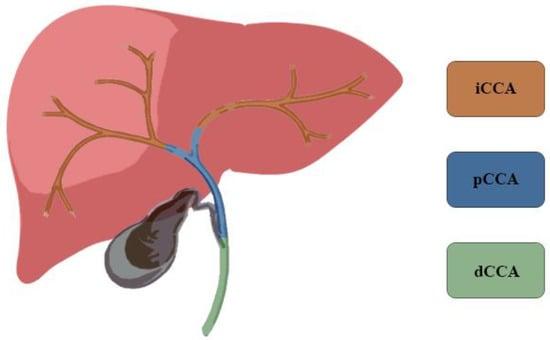
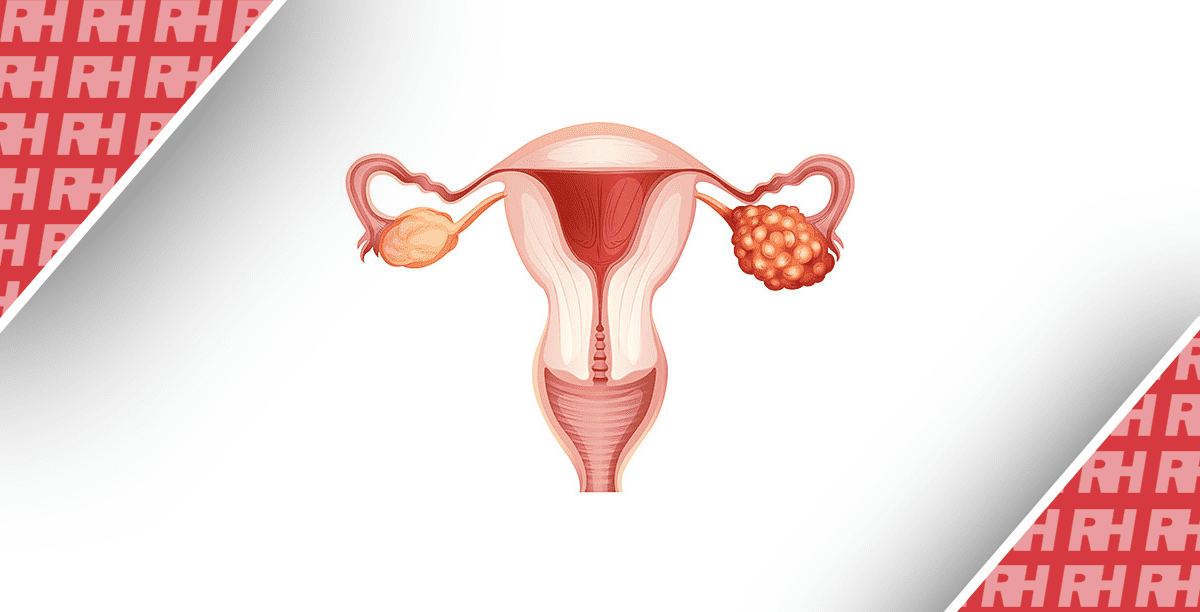
ХКА становить 3% всіх пухлин шлунково-кишкового тракту і є другим за поширеністю первинним раком печінки, на який припадає 15% всіх первинних пухлин печінки [5,6]. ХКА класифікують за анатомічною локалізацією: внутрішньопечінковий (вХКА), перехілярна або навколопечінкова (пХКА) та дистальний ХКА (дХКА) (Зображення 1). Згідно з класифікацією Японської групи з вивчення раку печінки, вХКА можна додатково класифікувати за макроскопічним характером росту: масоутворюючий (МУ вХКА), перидуктальний інфільтруючий (ПІ вХКА) та внутрішньопротоковий зростаючий (ВЗ вХКА) [3]. У великій серії пацієнтів, які страждають на рак жовчних проток, 8% мали вХКА, 50% – пХКА і 42% – дХКА [3,7,8]. Найвищий рівень захворюваності досягається на сьомому десятилітті життя і дещо частіше зустрічається у чоловіків у співвідношенні 1,5:1 [9]. Показники захворюваності характеризуються широкою географічною варіабельністю, що відображає розподіл місцевих факторів ризику на додаток до генетичних відмінностей між різними популяціями [8,10].
Зображення 1. Холангіокарциному класифікують за анатомічною локалізацією: внутрішньопечінкова (вХКА), перихілярна (пХКА) та дистальна (дХКА).
ХКА є рідкісним видом раку, але зростання захворюваності та смертності від нього задокументовано впродовж останніх кількох десятиліть у всьому світі [4,11]. У 2007 році Welzel та співавт. повідомили про щорічне зростання захворюваності на вХКА в США на 4% з 1992 по 2000 рік [12]. У 2019 році Bertuccio та співавт. витягли дані з баз даних Всесвітньої організації охорони здоров’я та Панамериканської організації охорони здоров’я для 32 країн Європи, Америки та Австралазії, продемонструвавши глобальне зростання смертності від вХКА з 1995 по 2016 рік [11]. Нещодавно Rahib та співавт. підрахували, що до 2040 року рак печінки та внутрішньопечінкових жовчних проток випередить колоректальний рак і стане третьою найпоширенішою причиною смерті від раку після раку легенів та підшлункової залози [13].
-
Доступні методи лікування
Незважаючи на нещодавні досягнення в хірургічному лікуванні цього новоутворення, прогноз залишається несприятливим – 5-річна виживаність становить менше 5%. Медіана виживання при вХКА становить від 18 до 30 місяців, але якщо пухлина вважається нерезектабельною, вона зменшується до 6 місяців. Хірургічне втручання є єдиним лікувальним методом лікування пухлин на початковій стадії [14]. Однак більшість пацієнтів мають нерезектабельну, метастатичну або місцево-поширену хворобу, і лише 25% з них підлягають резекції [15,16].
Пацієнти з пізніми стадіями холангіокарциноми не піддаються локальному або хірургічному лікуванню. Хіміотерапією першої лінії є комбінація цисплатину і гемцитабіну (ЦИС-ГЕМ). У 2010 році Valle та співавт. визначили стандартне лікування поширеної холангіокарциноми в дослідженні ЗРЖ (Запущений рак жовчовивідних шляхів)-02 фази ІІІ. Це дослідження надало конкретну підтримку ЦИС-ГЕМ порівняно з гемцитабіном як у загальній виживаності (11,7 проти 8,1 місяця; р < 0,001), так і у виживаності без прогресування (8,0 проти 5,0 місяця; р < 0,001) [17]. FOLFOX (фолінієва кислота, фурурацил та оксаліплатин) може бути рекомендований як стандарт хіміотерапії другої лінії. Клінічне дослідження ABC-06 продемонструвало покращення ОС після переходу до ЦИС-ГЕМ. Хоча відмінності в медіані ОС були помірними (5,3 проти 6,2 місяця) між досліджуваними групами, відмінності у виживаності через 6 місяців (35,5% проти 50,6%) і 12 місяців (11,4% проти 25,9%) були клінічно значущими [18].
Цільова терапія, така як інгібітори ізоцитратдегідрогенази 1 (ІДГ1) [19,20], рецептора фактора росту фібробластів (РФРФ) [21,22,23,24,25] та кінази рецептора тропоміозину (КРТ) [26,27] або Wnt [28] альтерації сигнальних шляхів наразі випробовуються у пацієнтів з вХКА [16]. Остаточні результати дослідження ClarIDHy, фази ІІІ, продемонстрували клінічну перевагу івосиденібу (низькомолекулярного таргетного інгібітора мутованої ізоцитратдегідрогенази 1, ІДГ1) порівняно з плацебо у пацієнтів з раніше лікованим ХКА та мутацією ІДГ1 за показниками виживаності без прогресування (ВР 0. 37) та медіани ЗВ (ВР 0,69) [20].
Значна частина пацієнтів з діагнозом вХКА з переважним ураженням печінки може бути придатною для лікування, спрямованого на печінку: транс-артеріальна радіоемболізація з ітрієм-90 (ТАРЕ), стереотаксична променева терапія тіла (СПТТ) та печінкова артеріальна інфузійна хіміотерапія (ПАІ) [29]. ТАРЕ є найбільш розробленим підходом, але надійні докази на його підтримку все ще скромні. Клінічне дослідження SIRCCA (селективна внутрішня променева терапія холангіокарциноми) з оцінки ТАРЕ (трансартеріальна радіоемболізація) з подальшою хіміотерапією ЦИС-ГЕМ порівняно з хіміотерапією лише ЦИС-ГЕМ в якості першої лінії лікування пацієнтів з нерезектабельною вХКА було передчасно перервано через низький рівень набору (NCT02807181). Очікуються результати проспективних досліджень (дослідження ABC-07 та EudraCT 2014-003656-31) для оцінки переваг СПТТ у поєднанні з системною хіміотерапією.
Остання клінічна настанова NCCN щодо раку гепатобіліарної системи (v. 2.2021) містить рекомендації щодо загальних критеріїв відбору пацієнтів для проведення артеріально-направленої терапії (ТАРЕ, СПТТ та ПАІХ), включаючи нерезектабельний або метастатичний вХКА, без позапечінкових захворювань. Хіміотерапія ПАІ рекомендована тільки в контексті клінічного дослідження або в третинних центрах гепато-панкреато-біліарної хірургії для пацієнтів з поширеним захворюванням, обмеженим печінкою [30].
-
Печінкова артеріальна інфузійна хіміотерапія
3.1. Обґрунтування
Більшість пацієнтів, які страждають на вХКА, мають печінково-обмежене захворювання, яке вважається нерезектабельним через свою локалізацію, з інфільтрацією судинних структур або мультифокальність [31]. Своєрідне подвійне кровопостачання печінки дозволяє доставляти високі дози хіміотерапії через переважну артеріальну васкуляризацію пухлини, зберігаючи портальний кровотік до здорової паренхіми печінки. Печінкова екстракція і метаболізм першого проходження (до 99%) обраних схем лікування зменшує системну експозицію і токсичні ефекти [32], досягаючи набагато вищих і більш селективних рівнів пухлинних препаратів, ніж при системному введенні [33]. Результати перших невеликих досліджень, проведених у 1970-х і 1980-х роках, разом з цими припущеннями призвели до широкого застосування печінкової артеріальної інфузійної хіміотерапії за допомогою хірургічно імплантованого підшкірного насоса [34,35,36].
3.2. Техніка встановлення систем
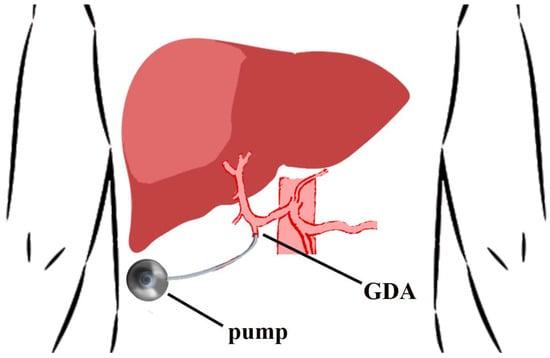
Анатомія печінкових судин повинна бути оцінена до операції за допомогою артеріальної КТ з фазовим контрастом. До третини пацієнтів мають аномальну анатомію печінкової артерії. Кінчик катетера встановлюють безпосередньо біля витоку гастродуоденальної артерії (ГДА). Кінчик катетера не повинен створювати турбулентність в печінковій артерії, щоб не впливати на довготривалу прохідність катетера і канюльованої артерії [37]. Необхідно забезпечити адекватну перфузію всієї печінкової паренхіми, не допускаючи затікання в сусідні органи. Супрапілоричні артеріальні гілки та права шлункова артерія перев’язуються для запобігання перфузії в дванадцятипалу кишку. Перфузія насосом лише печінки оцінюється шляхом болюсного введення розчину метиленового синього або флюоресцеїну (за допомогою лампи Вудса) в насос [36, 38]. Всі допоміжні/заміщені судини перев’язують [39,40], розраховуючи на перехресну печінкову перфузію. Печінкові дольові артерії не є кінцевими артеріями, і оклюзія варіантної судини не вплине на потік з контралатеральної частки печінки через колатеральні судини, які швидко розвиваються [37]. Холецистектомія виконується для уникнення холециститу, спричиненого хіміотерапією. Залежно від моделі інфузійного насоса, що використовується, позиціонування ложа виконується або в лівій нижній частині живота (стома є протипоказанням), згідно з методикою Меморіального онкологічного центру Слоуна-Кеттерінга (МОЦСК) [36], або в правій половині грудної стінки [38] (Зображення 2).
Зображення 2. Місце встановлення печінкового артеріального інфузійного хіміотерапевтичного насоса. Вістря катетера розміщують у місці початку гастродуоденальної артерії (ГДА).
Абсолютними протипоказаннями до ПАІ-хіміотерапії є: погана функція печінки, тривала системна хіміотерапія, значне пухлинне навантаження на печінку, портальна гіпертензія, тромбоз ворітної вени та оклюзія печінкової артерії [36].
Оцінка локорегіональних лімфатичних вузлів рутинно виконується за допомогою печінкової артерії, гепатодуоденальної, портокавальної та перипанкреатичної лімфаденектомії (станції 8, 12 і 13), оскільки вони забезпечують хороший доступ до печінкової артерії і визначають стадію вузла під час встановлення насоса, що дозволяє уникнути помилкової класифікації пацієнтів [36,41]. Роль рутинної лімфаденектомії при внутрішньопечінковій холангіокарциномі все ще залишається суперечливою [42]. Восьме видання AJCC [43] та Національна всеохоплююча онкологічна мережа [44] рекомендують забирати мінімум шість лімфатичних вузлів для адекватного вузлового стадіювання. Bagante та співавт. у 2017 році продемонстрували, що патологічний стан лімфатичних вузлів тісно пов’язаний з довгостроковим результатом і що радіологічне стадіювання лімфатичних вузлів може бути неточним у 40% пацієнтів [45]. У 2020 році Bartsch та співавт. підтвердили, що передопераційна візуалізація має чутливість лише 71,1% у виявленні підозрілих лімфатичних вузлів [46]. Доведено, що лімфаденектомія не має переваг для онкоспецифічної виживаності для резектабельних пацієнтів, але показала значну користь у нерезектабельних пацієнтів, полегшуючи тягар портальної пухлини та подовжуючи виживаність [47], а також даючи можливість більш персоналізованого підходу до системної терапії [48].
3.3. Ускладнення
Загальна захворюваність, пов’язана з використанням насоса, становить від 12% до 41% пацієнтів [49,50,51,52]. Ускладнення включають несправність помпи, зміщення або перевертання, інфекцію підшкірної кишені або гематому, тромбоз або зміщення катетера, ерозію катетера, артеріальний тромбоз або розшарування артерії, позапечінкову перфузію і неповну перфузію. У 2005 році в найбільшому на сьогодні ретроспективному одноцентровому дослідженні, опублікованому дослідницькою групою МОЦСК, оцінювали ускладнення і довготривалу довговічність насоса у 544 пацієнтів, пролікованих у період між 1986 і 2001 роками [52]. Ускладнення, пов’язані з використанням насоса, були зареєстровані у 22% пацієнтів, найчастіше з боку печінкової артеріальної системи (51%): артеріальний тромбоз, позапечінкова перфузія, неповна печінкова перфузія і крововиливи. Ускладнення, пов’язані з використанням помпи, вдалося усунути у 45% пацієнтів, причому ранні ускладнення (<30 днів) мали більше шансів бути усуненими, ніж пізні (70% проти 30%) [52]. Хоча післяопераційні інфекції підшкірної кишені трапляються рідко (2%), необхідно бути обережними, щоб уникнути будь-якого забруднення під час операції та кожного разу, коли насос використовується для хіміотерапевтичних інфузій після операції. Інфекції підшкірної кишені насоса важко піддаються консервативному лікуванню, тому слід розглянути можливість перевстановлення насоса [36]. Ще однією проблемою, яка може виникнути, є перевертання насоса, особливо у пацієнтів з ожирінням, у яких корисно регулярно розглядати можливість розміщення насоса в грудній стінці. Загалом, 12% пацієнтів мали ускладнення, які призвели до поломки насоса. Довготривала функціональність насоса є відмінною: частота виходу з ладу насоса через 6 місяців, 1 рік і 2 роки після встановлення становила 5%, 9% і 16% відповідно [52].
Токсичність хіміотерапії з використанням печінкового артеріального інфузійного насоса включає хімічний гепатит, гастрит, пептичну виразку і біліарний склероз (БС). Частота виникнення БС у пацієнтів, які отримували хіміотерапію на основі флоксуридину, становить від 0,9% до 26% [49,53,54,55,56,57,58,59,60,61,62]. Це клінічно значуща несприятлива подія, яка може вимагати встановлення біліарного стенту або призвести до хронічного ураження печінки [63]. У таких пацієнтів необхідно регулярно контролювати біохімічні показники, оскільки перші ознаки БС проявляються підвищенням рівня лужної фосфатази та/або загального білірубіну в сироватці крові. При підвищенні показників функції печінки хіміотерапію ПАІ слід перервати або зменшити дозу. Поширеною практикою є додавання внутрішньоартеріальних стероїдів (дексаметазон 4 мг) до хіміотерапії ПАІ для запобігання/зменшення БС.
-
Огляд літератури
Хіміотерапія ПАІ спочатку була розроблена для лікування колоректальних метастазів печінки [53,64,65], але за останні два десятиліття було опубліковано більше даних щодо лікування вХКА (табл. 1).
Таблиця 1. Короткий огляд досліджень. Хіміотерапія ПАІ +/- СИС для лікування нерезектабельного вХКА.
| Дослідження | Кількість та тип пацієнтів | Схема лікування | ВБП | ЗВ |
|---|---|---|---|---|
| Cantore та співавт., 2005 [66] | 30 РЖШ •25 вХКА •5 рак жовчного міхура |
3-тижневий цикл ПАІ
епірубіцин 50 мг/м2, ЦІС 60 мг/м2 у вигляді болюсу в 1-й день 5-ФУ 200 мг/м2 на добу шляхом безперервної інфузії з 1-го по 14-й день |
7.1 місяців (ДІ 1.6–19.1) | 13.2 місяців |
| Jarnagin та співавт., 2009 [67] | 34 ПРП •26 вХКА •8 ГКЦ |
4-тижневий цикл
ПАІ: FUDR (0,16 мг/кг × 20/швидкість потоку насоса) і ДЕКС 25 мг в 1-й день протягом 14 днів кожного циклу |
7.4 місяців | 29.5 місяців |
| Kemeny та співавт., 2011 [68] | 22 ПРП •18 вХКА •4 ГКЦ |
4-тижневий цикл
ПАІ: FUDR (0,16 мг/кг × 30/швидкість потоку насоса) і ДЕКС 25 мг в 1-й день протягом 14 днів кожного циклу СИС: бевацизумаб 5 мг/кг кожні два тижні. |
8.45 місяців (ДІ 5.53–11.05) | 31.1 місяців (ДІ 14.14–33.59) |
| Inaba та співавт., 2011 [69] | 13 вХКА | 4-тижневий цикл
ПАІ: ГЕМ 1000 мг/м2 30-хвилинна інфузія в 1-й, 8-й та 15-й дні протягом 5 циклів |
– | 389 днів (ДІ 158–620) |
| Ghiringhelli та співавт., 2013 [70] | 12 вХКА | Лікування другої лінії
2-тижневий цикл ПАІ: ГЕМ (1000 мг/м2 протягом 30 хв) подальше введенням ОКС (100 мг/м2 протягом 2 год) |
9.2 місяців (ДІ 2.1–29.4) | 20.3 місяців (ДІ 13.2–49.7) |
| Massani та співавт., 2015 [38] | 11 вХКА | 2-тижневий цикл ПАІ:1-й день: 100 мг/мкв ОКС 2-й день: 5 ФУ 7 мг/кг зі швидкістю 2 мл/год в/в протягом 48 год |
– | 17.6 місяців |
| Konstantinidis та співавт., 2016 [71]. | 104 вХКА •78 ПАІ/СИС •26 СИС |
4-тижневий цикл
ПАІ: FUDR (0,16 мг/кг × 20/швидкість потоку насоса) і ДЕКС 25 мг в 1-й день протягом 14 днів кожного циклу СИС: переважно на основі ГЕМ |
ПАІ/СИС 12 місяців СИС 7 місяців |
ПАІ/СИС 30.8 місяців СИС 18.4 місяців |
| Higaki та співавт., 2018 [72] | 12 вХКА | 42-денний цикл
ПАІ: ЦИС 65 мг/м2 2 мл/хв у 1-й день СИС: S-1 60 мг/м2 в день 1-28. |
– | 10.1 місяців (ДІ 3.6–23.2) |
| Cercek A, та співавт., 2019 [33] | 38 вХКА | 4-тижневий цикл
ПАІ: FUDR (0,12 мг/кг × 30/швидкість потоку насоса) і ДЕКС 30 мг/насос в 1-й день протягом 14 днів кожного циклу СИС: ГЕМ (800 мг/м2) з ОКС (85 мг/м2) в 1-й або 15-й день, кожні 2 тижні |
11.8 місяців (однобічний 90% ДІ, 11,1) | 25.0 місяців (95% ДІ, 20.6-не досягнуто) |
Умовні позначення в таблиці: ВБП – виживаность без прогресування; ЗВ – загальне виживання; РЖШ – рак жовчовивідних шляхів; ПРП – первинний рак печінки; вХКА – внутрішньопечінкова холангіокарцинома; ГКЦ – гепатокарцинома; ДІ – довірчий інтервал; ПАІ – печінкова артеріальна інфузія; СИС- системна; FUDR – флоксуридин; ГЕМ – гемцитабін; ЦИС- цисплатин; OКС – оксаліплатн; ДЕКС – дексаметазон; 5-ФУ – 5-фторурацил.
У 2005 році у другій фазі дослідження Cantore та співавт. за участю 30 пацієнтів з нерезектабельним вХКА (n = 25) або аденокарциномою жовчного міхура (n = 5), які отримували епірубіцин і цисплатин ПАІ у вигляді болюсу в поєднанні з системною безперервною інфузією 5-фторурацилу (5-ФУ), загальна частота відповіді становила 40%. Медіана виживаності без прогресування (ВБП) і загальної виживаності (ЗВ) становила 7,1 і 13,2 місяця відповідно, а 1- і 2-річна виживаність – 54% і 20% відповідно. Токсичність 3 ступеня спостерігалася у 11 з 30 пролікованих пацієнтів [66].
У 2009 році дослідницька група МОЦСК під керівництвом Kemeny NE і Jarnagin WR досліджувала ефективність ПАІ з флоксуридином (FUDR) і дексаметазоном у 34 пацієнтів з нерезектабельним первинним раком печінки (26 вХКА і 8 гепатокарцинома). Вони продемонстрували частоту відповіді 47,1%, медіана виживання становила 29,5 місяців, а 2-річна виживаність – 67%. Пацієнти з вХКА мали вищу частоту відповіді (53,8%) порівняно з пацієнтами з ГКЦ (25%). Виживаність без прогресування захворювання (ВБПЗ) у пацієнтів з вХКА становила 11,3 місяця. Одному пацієнту було показано резекцію, всі пацієнти в кінцевому підсумку прогресували, і майже всі в певний момент отримували системну терапію. Показники 1-, 2- і 3-річної виживаності становили 88%, 67% і 29% відповідно. У п’яти пацієнтів (14,7%) спостерігалася токсичність 3 або 4 ступеня [67]. Ця ж дослідницька група опублікувала подальші оновлені дослідження. У 2011 році було проведено дослідження, в якому 22 пацієнти (18 вХКА і 4 ГКЦ) отримували системне (в/в) введення бевацизумабу на додаток до раніше описаної схеми ПАІ. Медіана ЗВ становила 31,1 місяця (ДІ 14,14-33,59), ВБП – 8,45 місяця (ДІ 5,53-11,05), а ВБПЗ- 11,28 місяця (ДІ 7,93-15,69). Дослідження було достроково припинено через зростання біліарної токсичності; у 24% пацієнтів спостерігалося підвищення рівня білірубіну, а біліарні стенти були встановлені у 13,6% [68]. У 2016 році група МОЦСК опублікувала наступний огляд 104 пацієнтів з нерезектабельним вХКА з ураженням лише печінки, які отримували ПАІ та системну хіміотерапію (n = 78) або лише системну хіміотерапію (n = 26). Вони продемонстрували кращу частоту відповіді у пацієнтів, які отримували ПАІ та системну хіміотерапію, ніж у тих, хто отримував лише системну хіміотерапію. ВБП становила 12 проти 7 місяців для ПАІ/СИС і СИС, відповідно, хоча і не була значущою, р = 0,2. ВБП становила 30,8 проти 18,4 місяця для ПАІ/СІС та СІС відповідно. Однак продемонстрована конверсія до резектабельності (8/104) набагато нижча за показники, досягнуті при метастазах у товсту кишку [71]. У 2019 році в останньому опублікованому клінічному дослідженні другої фази взяли участь 38 пацієнтів з нерезектабельним ВПХК, які отримували хіміотерапію ПАІ FUDR у поєднанні з системним гемцитабіном та оксаліплатином. Медіана ВБП становила 11,8 місяця, медіана ЗВ – 25,0 місяця, а показник 1-річної ОС – 89,5%. Результати дослідження свідчать про те, що комбінований підхід асоціюється з подальшим покращенням виживаності без прогресування, ніж тільки СИС [33].
Дослідження фази I/II, опубліковане в 2011 році Японською дослідницькою групою з інтервенційної радіології в онкології, мало на меті встановити рекомендовану дозу (РД) ПАІ з використанням гемцитабіну (ГЕМ) для лікування вХКА та оцінити її ефективність і безпеку. РД була встановлена на рівні 1000 мг/м2. Загалом 13 пацієнтам було проведено лікування з використанням РД за допомогою черезшкірно встановленої системи катетер-порт ПАІ у вигляді 30-хвилинної інфузії в 1-й, 8-й і 15-й дні кожні 4 тижні протягом 5 циклів. Частота відповіді становила 7,7%, що нижче встановленого порогового рівня ефективності 20%. Ускладнення, пов’язані з самим ПАІ або імплантованою системою катетер-порт, виникли в 6 випадках (24%), а частота небажаних явищ 3-го ступеня або більше у всіх пролікованих пацієнтів (n = 25) становила 48%. Автори дійшли висновку, що цей протокол не мав жодних переваг над системним лікуванням [69].
У 2014 році у французькому ретроспективному дослідженні Ghiringhelli та співавт. проаналізували результати лікування 12 послідовно взятих пацієнтів з нерезектабельною вХКА, які отримували ПАІ (черезшкірно встановлену систему катетер-порт) ГЕМ (1000 мг/м2) з подальшим системним оксаліплатином (100 мг/м2) в якості другої лінії лікування. Загальна частота відповіді становила 66%, а частота контролю захворювання – 91%. Медіана ВБП становила 9,2 місяця (ДІ 5,1-29,4), а медіана ЗВ – 9,1 місяця (ДІ 13,2-49,7). У шести пацієнтів (50%) спостерігалася токсичність 3/4 ступеня [70].
У 2015 році Massani M. та співавт. опублікували ретроспективний досвід лікування лише ПАІ (фторурацилом та оксаліплатином) у 11 нерезектабельних пацієнтів з вХКА. КТ-сканування, проведене після шостого циклу терапії, показало, що у 5 з них була часткова позитивна реакція печінки, у 2 – стабільний стан, а у 4 – прогресування захворювання. Медіана ВБП становила 17,6 місяця. Трьом пацієнтам з частковою печінковою відповіддю була виконана резекція, а двоє мали більше 70% некрозу пухлини. Медіана виживаності пацієнтів із захворюванням лише печінки, які отримували системну хіміотерапію і не підлягали резекції, становила 15,3 місяця [38].
У пілотному дослідженні, опублікованому в 2018 році і проведеному в Японії в період з 2007 по 2011 рік, порівнювали 12 пацієнтів з нерезектабельною вХКА, які отримували ПАІ цисплатину плюс пероральний препарат S-1, з 16 пацієнтами, які отримували традиційну терапію (системну або локально-регіональну). Цисплатин вводили через катетер, встановлений у стегновій артерії, і вводили в печінкову артерію під ангіографічним контролем під час кожного циклу. S-1 – пероральний фторпіримідин, призначений для покращення протипухлинної активності 5-фторурацилу (5-ФУ) з метою зменшення його токсичності [73]. Усі 12 пацієнтів пройшли щонайменше 2 курси хіміотерапії. Медіана ВБП становила 10,1 місяця (ДІ 3,6-23,2). Анемія 3 ступеня виникла лише в 1 пацієнта (4,5%) [72].
Що стосується клінічних досліджень, які проводяться в даний час, то дослідження NCT01525069 є пілотним дослідженням, в якому беруть участь пацієнти з нерезектабельною вХКА, які були розподілені в три різні групи лікування: ПАІ FUDR окремо або в комбінації з оксаліплатином та/або гемцитабіном. Метою дослідження NCT03771846, яке проводить Онкологічний центр Університету Сунь Ятсена, є оцінка ефективності та безпечності ПАІ іринотекану, оксаліплатину, 5-фторурацилу та лейковорину порівняно з системною хіміотерапією гемцитабіном та оксаліплатином у пацієнтів з нерезектабельною вХКА. Французьке багатоцентрове дослідження 2 фази GEMOXIA-02 (NCT03364530) має на меті визначити об’єктивну частоту відповіді на ПАІ гемцитабіну/оксаліплатину, що призначається в якості другої лінії лікування у пацієнтів з неметастатичною нерезектабельною вХКА. HELIX ICC (NCT04251715) – це дослідження ІІ фази, метою якого є вивчення ефективності та безпечності системної індукції mFOLFIRINOX з подальшою ПАІ FUDR плюс дексаметазон, що вводиться одночасно з системним mFOLFIRI у лікуванні пацієнтів з нерезектабельною вХКА з домінуючим ураженням печінки.
-
Висновки
В опублікованих раніше дослідженнях розглядалися групи пацієнтів з різними формами первинного раку печінки, які стикалися з можливим хіміотерапевтичним ураженням жовчовивідних шляхів. Результати останніх досліджень свідчать про те, що адекватне та раннє лікування із застосуванням комбінованого підходу хіміотерапії ПАІ та СИС асоціюється з покращенням виживаності без прогресування та загальної виживаності, ніж тільки СИС або ПАІ для лікування нерезектабельного вХКА. Однак на сьогоднішній день продемонстрована частота конверсії в резектабельність набагато нижча, ніж при колоректальних метастазах у печінку. Одним з основних обмежень хіміотерапії ПАІ є обмежена кількість хірургів та онкологів, які мають досвід її застосування, за межами кількох референтних центрів лікування раку ГПБ системи у всьому світі. Сучасні рекомендації щодо застосування регіонарної терапії при нерезектабельних вХКА обмежені відсутністю проспективних досліджень. Ретельна оцінка цих стратегій у клінічних дослідженнях є вкрай необхідною. Індивідуалізація хіміотерапії та режими, засновані на селективних мішенях при мутантному вХКА, є основним напрямком майбутніх досліджень.
Посилання на джерела
- Renshaw, K. Malignant neoplasms of the extrahepatic biliary ducts. Ann. Surg. 1922, 76, 205–221.
- Rizvi, S.; Gores, G.J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology 2013, 145, 1215–1229.
- Banales, J.M.; Cardinale, V.; Carpino, G.; Marzioni, M.; Andersen, J.B.; Invernizzi, P.; Lind, G.E.; Folseraas, T.; Forbes, S.J.; Fouassier, L.; et al. Expert consensus document: Cholangiocarcinoma: Current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma (ENS-CCA). Nat. Rev. Gastroenterol. Hepatol. 2016, 13, 261–280.
- Khan, S.A.; Thomas, H.C.; Davidson, B.R.; Taylor-Robinson, S.D. Cholangiocarcinoma. Lancet 2005, 366, 1303–1314.
- Alvaro, D.; Bragazzi, M.C.; Benedetti, A.; Fabris, L.; Fava, G.; Invernizzi, P.; Marzioni, M.; Nuzzo, G.; Strazzabosco, M.; Stroffolini, T.; et al. Cholangiocarcinoma in Italy: A national survey on clinical characteristics, diagnostic modalities and treatment. Results from the ‘Cholangiocarcinoma’ committee of the Italian Association for the Study of Liver disease. Dig. Liver Dis. 2011, 43, 60–65.
- Khan, S.A.; Davidson, B.R.; Goldin, R.D.; Heaton, N.; Karani, J.; Pereira, S.P.; Rosenberg, W.M.; Tait, P.; Taylor-Robinson, S.D.; Thillainayagam, A.V.; et al. Guidelines for the diagnosis and treatment of cholangiocarcinoma: An update. Gut 2012, 61, 1657–1669.
- DeOliveira, M.L.; Cunningham, S.C.; Cameron, J.L.; Kamangar, F.; Winter, J.M.; Lillemoe, K.D.; Choti, M.A.; Yeo, C.J.; Schulick, R.D. Cholangiocarcinoma: Thirty-one-year experience with 564 patients at a single institution. Ann. Surg. 2007, 245, 755–762.
- Nakeeb, A.; Pitt, H.A.; Sohn, T.A.; Coleman, J.A.; Abrams, R.A.; Piantadosi, S.; Hruban, R.H.; Lillemoe, K.D.; Yeo, C.J.; Cameron, J.L. Cholangiocarcinoma: A spectrum of intrahepatic, perihilar, and distal tumors. Ann Surg. 1996, 224, 463–475.
- Aljiffry, M.; Walsh, M.J.; Molinari, M. Advances in diagnosis, treatment and palliation of cholangiocarcinoma: 1990–2009. World J. Gastroenterol. 2009, 15, 4240–4262.
- Ebata, T.; Kosuge, T.; Hirano, S.; Unno, M.; Yamamoto, M.; Miyazaki, M.; Kokudo, N.; Miyagawa, S.; Takada, T.; Nagino, M. Proposal to modify the International Union Against Cancer staging system for perihilar cholangiocarcinomas. Br. J. Surg. 2014, 101, 79–88.
- Bertuccio, P.; Malvezzi, M.; Carioli, G.; Hashim, D.; Boffetta, P.; El-Serag, H.B.; La Vecchia, C.; Negri, E. Global trends in mortality from intrahepatic and extrahepatic cholangiocarcinoma. J. Hepatol. 2019, 71, 104–114.
- Welzel, T.M.; Mellemkjaer, L.; Gloria, G.; Sakoda, L.C.; Hsing, A.W.; El Ghormli, L.; Olsen, J.H.; McGlynn, K.A. Risk factors for intrahepatic cholangiocarcinoma in a low-risk population: A nationwide case-control study. Int. J. Cancer 2007, 120, 638–641.
- Rahib, L.; Wehner, M.R.; Matrisian, L.M.; Nead, K.T. Estimated Projection of US Cancer Incidence and Death to 2040. JAMA Netw. Open 2021, 4, e214708.
- Sempoux, C.; Jibara, G.; Ward, S.C.; Fan, C.; Qin, L.; Roayaie, S.; Fiel, M.I.; Schwartz, M.; Thung, S.N. Intrahepatic cholangiocarcinoma: New insights in Pathology. Semin. Liver Dis. 2011, 31, 49–60.
- Mosconi, S.; Beretta, G.D.; Labianca, R.; Zampino, M.G.; Gatta, G.; Heinemann, V. Cholangiocarcinoma. Crit. Rev. Oncol. Hematol. 2009, 69, 259–270.
- Banales, J.M.; Marin, J.J.G.; Lamarca, A.; Rodrigues, P.M.; Khan, S.A.; Roberts, L.R.; Cardinale, V.; Carpino, G.; Andersen, J.B.; Braconi, C.; et al. Cholangiocarcinoma 2020: The next horizon in mechanisms and management. Nat. Rev. Gastroenterol. Hepatol. 2020, 17, 557–588.
- Valle, J.; Wasan, H.; Palmer, D.H.; Cunningham, D.; Anthoney, A.; Maraveyas, A.; Madhusudan, S.; Iveson, T.; Hughes, S.; Pereira, S.P.; et al. Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. N. Engl. J. Med. 2010, 362, 1273–1281.
- Lamarca, A.; Palmer, D.H.; Wasan, H.S.; Ross, P.J.; Ma, Y.T.; Arora, A.; Falk, S.; Gillmore, R.; Wadsley, J.; Patel, K.; et al. ABC-06|A randomised phase III, multi-centre, open-label study of active symptom control (ASC) alone or ASC with oxaliplatin / 5-FU chemotherapy (ASC+mFOLFOX) for patients (pts) with locally advanced/metastatic biliary tract cancers (ABC) previously-tr. J. Clin. Oncol. 2019, 37, 4003.
- Lowery, M.A.; Abou-Alfa, G.K.; Burris, H.A.; Janku, F.; Shroff, R.T.; Cleary, J.M.; Azad, N.S.; Goyal, L.; Maher, E.A.; Gore, L.; et al. Phase I study of AG-120, an IDH1 mutant enzyme inhibitor: Results from the cholangiocarcinoma dose escalation and expansion cohorts. J. Clin. Oncol. 2017, 35, 4015.
- Zhu, A.X.; Macarulla, T.; Javle, M.M.; Kelley, R.K.; Lubner, S.J.; Adeva, J.; Cleary, J.M.; Catenacci, D.V.T.; Borad, M.J.; Bridgewater, J.A.; et al. Final results from ClarIDHy, a global, phase III, randomized, double-blind study of ivosidenib (IVO) versus placebo (PBO) in patients (pts) with previously treated cholangiocarcinoma (CCA) and an isocitrate dehydrogenase 1 (IDH1) mutation. J. Clin. Oncol. 2021, 39, 266.
- Javle, M.; Lowery, M.; Shroff, R.T.; Weiss, K.H.; Springfeld, C.; Borad, M.J.; Ramanathan, R.K.; Goyal, L.; Sadeghi, S.; Macarulla, T.; et al. Phase II Study of BGJ398 in Patients With FGFR-Altered Advanced Cholangiocarcinoma. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2018, 36, 276–282.
- Javle, M.M.; Shroff, R.T.; Zhu, A.; Sadeghi, S.; Choo, S.; Borad, M.J.; Lowery, M.A.; El-Khoueiry, A.; Macarulla, T.; Philip, P.A.; et al. A phase 2 study of BGJ398 in patients (pts) with advanced or metastatic FGFR-altered cholangiocarcinoma (CCA) who failed or are intolerant to platinum-based chemotherapy. J. Clin. Oncol. 2016, 34, 335.
- Mazzaferro, V.; Shaib, W.; Rimassa, L.; Harris, W.; Personeni, N.; El-Rayes, B.; Tolcher, A.; Hall, T.; Wang, Y.; Schwartz, B.; et al. PD-019 ARQ 087, an oral pan- fibroblast growth factor receptor (FGFR) inhibitor, in patients (pts) with advanced and/or metastatic intrahepatic cholangiocarcinoma (вХКА). Ann. Oncol. 2016, 27, ii109.
- Tran, B.; Meric-Bernstam, F.; Arkenau, H.-T.; Bahleda, R.; Kelley, R.K.; Hierro, C.; Ahn, D.; Zhu, A.; Javle, M.; Winkler, R.; et al. Efficacy of TAS-120, an irreversible fibroblast growth factor receptor inhibitor (FGFRi), in patients with cholangiocarcinoma and FGFR pathway alterations previously treated with chemotherapy and other FGFRi’s. Ann. Oncol. 2018, 29, ix49–ix50.
- Vogel, A.; Sahai, V.; Hollebecque, A.; Vaccaro, G.; Melisi, D.; Al-Rajabi, R.; Paulson, A.S.; Borad, M.J.; Gallinson, D.; Murphy, A.G.; et al. FIGHT-202: A phase II study of pemigatinib in patients (pts) with previously treated locally advanced or metastatic cholangiocarcinoma (CCA). Ann. Oncol. 2019, 30, v876.
- Drilon, A.; Siena, S.; Ou, S.-H.I.; Patel, M.; Ahn, M.J.; Lee, J.; Bauer, T.M.; Farago, A.F.; Wheler, J.J.; Liu, S.V.; et al. Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1, and ALK Inhibitor Entrectinib: Combined Results from Two Phase I Trials (ALKA-372-001 and STARTRK-1). Cancer Discov. 2017, 7, 400–409.
- Drilon, A.; Laetsch, T.W.; Kummar, S.; DuBois, S.G.; Lassen, U.N.; Demetri, G.D.; Nathenson, M.; Doebele, R.C.; Farago, A.F.; Pappo, A.S.; et al. Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. N. Engl. J. Med. 2018, 378, 731–739.
- Ong, C.K.; Subimerb, C.; Pairojkul, C.; Wongkham, S.; Cutcutache, I.; Yu, W.; McPherson, J.R.; Allen, G.E.; Ng, C.C.; Wong, B.H.; et al. Exome sequencing of liver fluke-associated cholangiocarcinoma. Nat. Genet. 2012, 44, 690–693.
- Koay, E.J.; Odisio, B.C.; Javle, M.; Vauthey, J.-N.; Crane, C.H. Management of unresectable intrahepatic cholangiocarcinoma: How do we decide among the various liver-directed treatments? Hepatobiliary Surg. Nutr. 2017, 6, 105–116.
- Hepatobiliary Cancer. National Comprehensive Cancer Network. 2021; Hepatobiliary Cancer (Version 2.2021). Available online: https://www.nccn.org/professionals/physician_gls/pdf/hepatobiliary.pdf (accessed on 5 May 2021).
- Nathan, H.; Aloia, T.A.; Vauthey, J.N.; Abdalla, E.K.; Zhu, A.X.; Schulick, R.D.; Choti, M.A.; Pawlik, T.M. A proposed staging system for intrahepatic cholangiocarcinoma. Ann. Surg. Oncol. 2009, 16, 14–22.
- Ensminger, W.D.; Gyves, J.W. Clinical pharmacology of hepatic arterial chemotherapy. Semin. Oncol. 1983, 10, 176–182.
- Cercek, A.; Boerner, T.; Tan, B.R.; Chou, J.F.; Gönen, M.; Boucher, T.M.; Hauser, H.F.; Do, R.K.G.; Lowery, M.A.; Harding, J.J.; et al. Assessment of Hepatic Arterial Infusion of Floxuridine in Combination with Systemic Gemcitabine and Oxaliplatin in Patients with Unresectable Intrahepatic Cholangiocarcinoma: A Phase 2 Clinical Trial. JAMA Oncol. 2020, 6, 60–67.
- Johnson, L.P.; Rivkin, S.E. The implanted pump in metastatic colorectal cancer of the liver. Risk versus benefit. Am. J. Surg. 1985, 149, 595–598.
- Weiss, G.R.; Garnick, M.B.; Osteen, R.T.; Steele, G.D.J.; Wilson, R.E.; Schade, D.; Kaplan, W.D.; Boxt, L.M.; Kandarpa, K.; Mayer, R.J. Long-term hepatic arterial infusion of 5-fluorodeoxyuridine for liver metastases using an implantable infusion pump. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1983, 1, 337–344.
- Thiels, C.A.; D’Angelica, M.I. Hepatic artery infusion pumps. J. Surg. Oncol. 2020, 122, 70–77.
- Allen, P.J.; Stojadinovic, A.; Ben-Porat, L.; Gonen, M.; Kooby, D.; Blumgart, L.; Paty, P.; Fong, Y. The management of variant arterial anatomy during hepatic arterial infusion pump placement. Ann. Surg. Oncol. 2002, 9, 875–880.
- Massani, M.; Nistri, C.; Ruffolo, C.; Bonariol, R.; Pauletti, B.; Bonariol, L.; Caratozzolo, E.; Morana, G.; Bassi, N. Intrahepatic chemotherapy for unresectable cholangiocarcinoma: Review of literature and personal experience. Updates Surg. 2015, 67, 389–400.
- Cohen, A.M.; Higgins, J.; Waltman, A.C.; Athanasoulis, C.; McKusick, K. Effect of ligation of variant hepatic arterial structures on the completeness of regional chemotherapy infusion. Am. J. Surg. 1987, 153, 378–380.
- Rayner, A.A.; Kerlan, R.K.; Stagg, R.J.; Price, D.C.; Hohn, D.C. Total hepatic arterial perfusion after occlusion of variant lobar vessels: Implications for hepatic arterial chemotherapy. Surgery 1986, 99, 708–715.
- Jolissaint, J.S.; Soares, K.C.; Seier, K.P.; Kundra, R.; Gonen, M.; Shin, P.J.; Boerner, T.; Sigel, C.; Madupuri, R.; Vakiani, E.; et al. Intrahepatic Cholangiocarcinoma with Lymph Node Metastasis: Treatment-Related Outcomes and the Role of Tumor Genomics in Patient Selection. Clin. Cancer Res. Off. J. Am. Assoc. Cancer Res. 2021.
- Zhou, R.; Lu, D.; Li, W.; Tan, W.; Zhu, S.; Chen, X.; Min, J.; Shang, C.; Chen, Y. Is lymph node dissection necessary for resectable intrahepatic cholangiocarcinoma? A systematic review and meta-analysis. Int. Hepato-Pancreato-Biliary Assoc. 2019, 21, 784–792.
- Amin, M.B.; Edge, S.; Greene, F.; Byrd, D.R.; Brookland, R.K.; Washington, M.K.; Gershenwald, J.E.; Compton, C.C.; Hess, K.R.; Sullivan, D.C.; et al. AJCC Cancer Staging Manual, 8th ed.; Springer: Berlin/Heidelberg, Germany, 2017.
- Zhang, X.-F.; Chen, Q.; Kimbrough, C.W.; Beal, E.W.; Lv, Y.; Chakedis, J.; Dillhoff, M.; Schmidt, C.; Cloyd, J.; Pawlik, T.M. Lymphadenectomy for Intrahepatic Cholangiocarcinoma: Has Nodal Evaluation Been Increasingly Adopted by Surgeons over Time?A National Database Analysis. J. Gastrointest. Surg. Off. J. Soc. Surg. Aliment. Tract. 2018, 22, 668–675.
- Spolverato, G.; Bagante, F.; Weiss, M.; Alexandrescu, S.; Marques, H.P.; Aldrighetti, L.; Maithel, S.K.; Pulitano, C.; Bauer, T.W.; Shen, F.; et al. Comparative performances of the 7th and the 8th editions of the American Joint Committee on Cancer staging systems for intrahepatic cholangiocarcinoma. J. Surg. Oncol. 2017, 115, 696–703.
- Bartsch, F.; Hahn, F.; Müller, L.; Baumgart, J.; Hoppe-Lotichius, M.; Kloeckner, R.; Lang, H. Relevance of suspicious lymph nodes in preoperative imaging for resectability, recurrence and survival of intrahepatic cholangiocarcinoma. BMC Surg. 2020, 20, 75.
- Liu, J.; Zhong, M.; Feng, Y. Prognostic Factors and Treatment Strategies for Intrahepatic Cholangiocarcinoma from 2004 to 2013: Population-Based SEER Analysis. Transl. Oncol. 2019, 12, 1496–1503.
- Cloyd, J.M.; Ejaz, A.; Pawlik, T.M. The Landmark Series: Intrahepatic Cholangiocarcinoma. Ann. Surg. Oncol. 2020, 27, 2859–2865.
- Daly, J.M.; Kemeny, N.; Oderman, P.; Botet, J. Long-term hepatic arterial infusion chemotherapy. Anatomic considerations, operative technique, and treatment morbidity. Arch. Surg. 1984, 119, 936–941.
- Curley, S.A.; Chase, J.L.; Roh, M.S.; Hohn, D.C. Technical considerations and complications associated with the placement of 180 implantable hepatic arterial infusion devices. Surgery 1993, 114, 928–935.
- Heinrich, S.; Petrowsky, H.; Schwinnen, I.; Staib-Sebler, E.; Gog, C.; El-Ganainy, A.; Gutt, C.; Müller, H.H.; Lorenz, M. Technical complications of continuous intra-arterial chemotherapy with 5-fluorodeoxyuridine and 5-fluorouracil for colorectal liver metastases. Surgery 2003, 133, 40–48.
- Allen, P.J.; Nissan, A.; Picon, A.I.; Kemeny, N.; Dudrick, P.; Ben-Porat, L.; Espat, J.; Stojadinovic, A.; Cohen, A.M.; Fong, Y.; et al. Technical complications and durability of hepatic artery infusion pumps for unresectable colorectal liver metastases: An institutional experience of 544 consecutive cases. J. Am. Coll. Surg. 2005, 201, 57–65
- Kemeny, N.E.; Niedzwiecki, D.; Hollis, D.R.; Lenz, H.-J.; Warren, R.S.; Naughton, M.J.; Weeks, J.C.; Sigurdson, E.R.; Herndon, J.E., 2nd; Zhang, C.; et al. Hepatic arterial infusion versus systemic therapy for hepatic metastases from colorectal cancer: A randomized trial of efficacy, quality of life, and molecular markers (CALGB 9481). J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2006, 24, 1395–1403.
- Kemeny, M.M.; Battifora, H.; Blayney, D.W.; Cecchi, G.; Goldberg, D.A.; Leong, L.A.; Margolin, K.A.; Terz, J.J. Sclerosing cholangitis after continuous hepatic artery infusion of FUDR. Ann. Surg. 1985, 202, 176–181.
- Kemeny, N.; Daly, J.; Reichman, B.; Geller, N.; Botet, J.; Oderman, P. Intrahepatic or systemic infusion of fluorodeoxyuridine in patients with liver metastases from colorectal carcinoma. A randomized trial. Ann. Intern. Med. 1987, 107, 459–465.
- Chang, A.E.; Schneider, P.D.; Sugarbaker, P.H.; Simpson, C.; Culnane, M.; Steinberg, S.M. A prospective randomized trial of regional versus systemic continuous 5-fluorodeoxyuridine chemotherapy in the treatment of colorectal liver metastases. Ann. Surg. 1987, 206, 685–693.
- Hohn, D.C.; Stagg, R.J.; Friedman, M.A.; Hannigan, J.F.J.; Rayner, A.; Ignoffo, R.J.; Acord, P.; Lewis, B.J. A randomized trial of continuous intravenous versus hepatic intraarterial floxuridine in patients with colorectal cancer metastatic to the liver: The Northern California Oncology Group trial. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1989, 7, 1646–1654.
- Martin, J.K.J.; O’Connell, M.J.; Wieand, H.S.; Fitzgibbons, R.J.J.; Mailliard, J.A.; Rubin, J.; Nagorney, D.M.; Tschetter, L.K.; Krook, J.E. Intra-arterial floxuridine vs systemic fluorouracil for hepatic metastases from colorectal cancer. A randomized trial. Arch. Surg. 1990, 125, 1022–1027.
- Rougier, P.; Laplanche, A.; Huguier, M.; Hay, J.M.; Ollivier, J.M.; Escat, J.; Salmon, R.; Julien, M.; Roullet Audy, J.C.; Gallot, D.; et al. Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: Long-term results of a prospective randomized trial. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1992, 10, 1112–1118.
- Lorenz, M.; Müller, H.H. Randomized, multicenter trial of fluorouracil plus leucovorin administered either via hepatic arterial or intravenous infusion versus fluorodeoxyuridine administered via hepatic arterial infusion in patients with nonresectable liver metastases from color. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2000, 18, 243–254.
- Kemeny, M.M.; Adak, S.; Gray, B.; Macdonald, J.S.; Smith, T.; Lipsitz, S.; Sigurdson, E.R.; O’Dwyer, P.J.; Benson, A.B., 3rd. Combined-modality treatment for resectable metastatic colorectal carcinoma to the liver: Surgical resection of hepatic metastases in combination with continuous infusion of chemotherapy—An intergroup study. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2002, 20, 1499–1505.
- Martin, R.C.G.; Edwards, M.J.; McMasters, K.M. Morbidity of adjuvant hepatic arterial infusion pump chemotherapy in the management of colorectal cancer metastatic to the liver. Am. J. Surg. 2004, 188, 714–721.
- Ito, K.; Ito, H.; Kemeny, N.E.; Gonen, M.; Allen, P.J.; Paty, P.B.; Fong, Y.; Dematteo, R.P.; Blumgart, L.H.; Jarnagin, W.R.; et al. Biliary sclerosis after hepatic arterial infusion pump chemotherapy for patients with colorectal cancer liver metastasis: Incidence, clinical features, and risk factors. Ann. Surg. Oncol. 2012, 19, 1609–1617.
- Datta, J.; Narayan, R.R.; Kemeny, N.E.; D’Angelica, M.I. Role of Hepatic Artery Infusion Chemotherapy in Treatment of Initially Unresectable Colorectal Liver Metastases: A Review. JAMA Surg. 2019, 154, 768–776.
- Kerr, D.J.; McArdle, C.S.; Ledermann, J.; Taylor, I.; Sherlock, D.J.; Schlag, P.M.; Buckels, J.; Mayer, D.; Cain, D.; Stephens, R.J. Intrahepatic arterial versus intravenous fluorouracil and folinic acid for colorectal cancer liver metastases: A multicentre randomised trial. Lancet 2003, 361, 368–373.
- Cantore, M.; Mambrini, A.; Fiorentini, G.; Rabbi, C.; Zamagni, D.; Caudana, R.; Pennucci, C.; Sanguinetti, F.; Lombardi, M.; Nicoli, N. Phase II study of hepatic intraarterial epirubicin and cisplatin, with systemic 5-fluorouracil in patients with unresectable biliary tract tumors. Cancer 2005, 103, 1402–1407.
- Jarnagin, W.R.; Schwartz, L.H.; Gultekin, D.H.; Gönen, M.; Haviland, D.; Shia, J.; D’Angelica, M.; Fong, Y.; DeMatteo, R.; Tse, A.; et al. Regional chemotherapy for unresectable primary liver cancer: Results of a phase II clinical trial and assessment of DCE-MRI as a biomarker of survival. Ann. Oncol. 2009, 20, 1589–1595.
- Kemeny, N.E.; Schwartz, L.; Gönen, M.; Yopp, A.; Gultekin, D.; D’Angelica, M.; Fong, Y.; Haviland, D.; Gewirtz, A.N.; Allen, P.; et al. Treating primary liver cancer with hepatic arterial infusion of floxuridine and dexamethasone: Does the addition of systemic bevacizumab improve results? Oncology 2011, 80, 153–159.
- Inaba, Y.; Arai, Y.; Yamaura, H.; Sato, Y.; Najima, M.; Aramaki, T.; Sone, M.; Kumada, T.; Tanigawa, N.; Anai, H.; et al. Phase I/II study of hepatic arterial infusion chemotherapy with gemcitabine in patients with unresectable intrahepatic cholangiocarcinoma (JIVROSG-0301). Am. J. Clin. Oncol. Cancer Clin. Trials. 2011, 34, 58–62. [Google Scholar] [CrossRef]
- Ghiringhelli, F.; Lorgis, V.; Vincent, J.; Ladoire, S.; Guiu, B. Hepatic arterial infusion of gemcitabine plus oxaliplatin as second-line treatment for locally advanced intrahepatic cholangiocarcinoma: Preliminary experience. Chemotherapy 2014, 59, 354–360.
- Konstantinidis, I.T.; Koerkamp, B.G.; Do, R.K.G.; Gönen, M.; Fong, Y.; Allen, P.J.; D’Angelica, M.; Kingham, T.P.; DeMatteo, R.P.; Klimstra, D.S.; et al. Unresectable intrahepatic cholangiocarcinoma: Systemic plus hepatic arterial infusion chemotherapy is associated with longer survival in comparison with systemic chemotherapy alone. Cancer 2016, 122, 758–765.
- Higaki, T.; Aramaki, O.; Moriguchi, M.; Nakayama, H.; Midorikawa, Y.; Takayama, T. Arterial infusion of cisplatin plus S-1 against unresectable intrahepatic cholangiocarcinoma. Biosci. Trends. 2018, 12, 73–78.
- Saif, M.W.; Syrigos, K.N.; Katirtzoglou, N.A. S-1: A promising new oral fluoropyrimidine derivative. Expert. Opin. Investig. Drugs 2009, 18, 335–348.
Запитання та відповіді (FAQ)
Що таке внутрішньопечінкова холангіокарцинома (вХКА)?
- Внутрішньопечінкова холангіокарцинома (вХКА) є другим за поширеністю первинним раком печінки, що походить з епітелію жовчних проток.
Який прогноз для пацієнтів з нерезектабельною вХКА?
- Прогноз для пацієнтів з нерезектабельною вХКА залишається несприятливим. Медіана виживання може становити близько 6 місяців, що значно менше, ніж для резектабельних форм.
Чому печінкова артеріальна інфузійна хіміотерапія (ПАІХ) є ефективною при лікуванні вХКА?
- ПАІХ дозволяє доставляти високі дози хіміотерапевтичних препаратів безпосередньо до пухлини через її переважну артеріальну васкуляризацію. Це досягає вищих концентрацій препарату в пухлині порівняно із системним введенням, мінімізуючи при цьому токсичний вплив на здорові тканини печінки.
Які основні методи лікування нерезектабельної вХКА, окрім ПАІХ?
- Окрім ПАІХ, доступні методи лікування включають системну хіміотерапію (наприклад, комбінація цисплатину та гемцитабіну), таргетну терапію (наприклад, інгібітори IDH1) та, в деяких випадках, локально-регіонарні методи, такі як транс-артеріальна радіоемболізація (ТАРЕ) та стереотаксична променева терапія тіла (СПТТ).
Які можливі ускладнення, пов’язані з використанням насоса для ПАІХ?
- Можливі ускладнення включають несправність насоса, зміщення катетера, інфекцію або гематому в ділянці встановлення насоса, тромбоз печінкової артерії, позапечінкову перфузію, а також хімічний гепатит, гастрит, пептичну виразку та біліарний склероз (БС) внаслідок хіміотерапії.
Які протипоказання до проведення ПАІХ?
- Абсолютними протипоказаннями до ПАІХ є погана функція печінки, тривала системна хіміотерапія, значне пухлинне навантаження на печінку, портальна гіпертензія, тромбоз ворітної вени та оклюзія печінкової артерії.
Яка роль лімфаденектомії при лікуванні нерезектабельної вХКА?
- Лікування лімфатичних вузлів, включаючи їх резекцію, може бути важливим для правильного стадіювання та визначення прогнозу. Дослідження показують, що лімфаденектомія може приносити користь пацієнтам з нерезектабельними формами, полегшуючи тягар пухлини та покращуючи результати терапії.