Резюме
Холангиокарцинома (ХКА) – второй по распространенности первичный рак печени. Несмотря на последние достижения в хирургическом лечении, прогноз остается неблагоприятным: 5-летняя выживаемость составляет менее 5%. Медиана выживаемости при внутрипеченочной ХКА составляет от 18 до 30 месяцев, но если она считается нерезектабельной, то уменьшается до 6 месяцев. Большинство пациентов имеют заболевание, ограниченное печенью, которое считается нерезектабельным из-за своей локализации, с инфильтрацией сосудистых структур или мультифокальность. Своеобразное двойное кровоснабжение позволяет доставлять высокие дозы химиотерапии с помощью хирургически имплантированного подкожного насоса, через преимущественную артериальную васкуляризацию опухоли, достигая гораздо более высоких и более селективных уровней опухолевых препаратов, чем при системном введении. Результаты последних исследований свидетельствуют о том, что адекватное и раннее лечение с применением комбинированного подхода печеночной артериальной инфузии (ПАИ) и системной химиотерапии (СИС) ассоциируется с улучшением выживаемости без прогрессирования и общей выживаемости, чем только СИС или ПАИ при лечении нерезектабельной вХКА. Текущие рекомендации ограничены отсутствием проспективных исследований. Индивидуализация химиотерапии и режимов, основанных на селективных мишенях при мутантной вХКА, является основным направлением будущих исследований. В этой статье мы представляем комплексный обзор опубликованных на сегодняшний день исследований и продолжающихся исследований.
Ключевые слова: внутрипеченочная холангиокарцинома; нерезектабельная; печеночная артериальная инфузионная химиотерапия.
-
Вступление
Первое описание случая холангиокарциномы (ХКА) датируется 1840 г. Дюран-Фарделем [1]. ХКА – это эпителиальная опухоль с особенностями дифференцировки холангиоцитов [2]. Она происходит из протокового эпителия желчного дерева от каналов Геринга к основному желчному протоку [3]. Большинство пациентов страдают от нерезектабельного заболевания с момента обнаружения, а смерть наступает в течение 12 месяцев с момента установления диагноза из-за последствий кахексии, быстрого снижения работоспособности, печеночной недостаточности и рецидивирующего сепсиса [4].
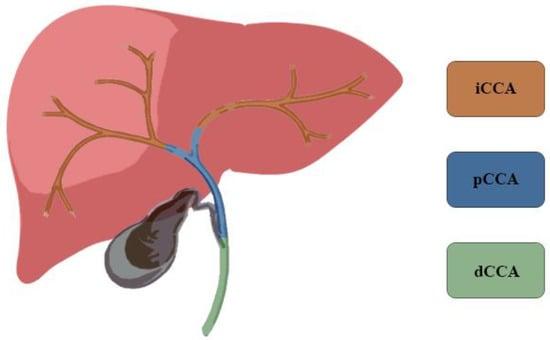
ХКА составляет 3% всех опухолей желудочно-кишечного тракта и является вторым по распространенности первичным раком печени, на который приходится 15% всех первичных опухолей печени [5,6]. ХКА классифицируют по анатомической локализации: внутрипеченочный (вХКА), перихилярная или околопеченочная (пХКА) и дистальный ХКА (дХКА) (Рисунок 1). Согласно классификации Японской группы по изучению рака печени, вХКА можно дополнительно классифицировать по макроскопическому характеру роста: массообразующий (МО вХКА), перидуктальный инфильтрирующий (ПИ вХКА) и внутрипротоковый растущий (ВР вХКА) [3]. В большой серии пациентов, страдающих раком желчных протоков, 8% имели вХКА, 50% – пХКА и 42% – дХКА [3,7,8]. Самый высокий уровень заболеваемости достигается на седьмом десятилетии жизни и несколько чаще встречается у мужчин в соотношении 1,5:1 [9]. Показатели заболеваемости характеризуются широкой географической вариабельностью, что отражает распределение местных факторов риска в дополнение к генетическим отличиям между различными популяциями [8,10].
Рисунок 1. Холангиокарциному классифицируют по анатомической локализации: внутрипеченочная (вХКА), перихилярная (пХКА) и дистальная (дХКА).
ХКА является редким видом рака, но рост заболеваемости и смертности от него задокументирован в течение последних нескольких десятилетий во всем мире [4,11]. В 2007 году Welzel и соавт. сообщили о ежегодном росте заболеваемости вХКА в США на 4% с 1992 по 2000 год [12]. В 2019 году Bertuccio и соавт. извлекли данные из баз данных Всемирной организации здравоохранения и Панамериканской организации здравоохранения для 32 стран Европы, Америки и Австралазии, продемонстрировав глобальный рост смертности от вХКА с 1995 по 2016 год [11]. Недавно Rahib и соавт. подсчитали, что к 2040 году рак печени и внутрипеченочных желчных протоков опередит колоректальный рак и станет третьей самой распространенной причиной смерти от рака после рака легких и поджелудочной железы [13].
-
Доступные методы лечения
Несмотря на недавние достижения в хирургическом лечении этого новообразования, прогноз остается неблагоприятным – 5-летняя выживаемость составляет менее 5%. Медиана выживаемости при вХКА составляет от 18 до 30 месяцев, но если опухоль считается нерезектабельной, она уменьшается до 6 месяцев. Хирургическое вмешательство является единственным лечебным методом лечения опухолей на начальной стадии [14]. Однако большинство пациентов имеют нерезектабельную, метастатическую или местно-распространенную болезнь, и только 25% из них подлежат резекции [15,16].
Пациенты с поздними стадиями холангиокарциномы не поддаются локальному или хирургическому лечению. Химиотерапией первой линии является комбинация цисплатина и гемцитабина (ЦИС-ГЕМ). В 2010 году Valle и соавт. определили стандартное лечение распространенной холангиокарциномы в исследовании ЗРЖ (Запущенный рак желчевыводящих путейr)-02 фазы ІІІ. Это исследование оказало конкретную поддержку ЦИС-ГЕМ по сравнению с гемцитабином как в общей выживаемости (11,7 против 8,1 месяца; р < 0,001), так и в выживаемости без прогрессирования (8,0 против 5,0 месяца; р < 0,001) [17]. FOLFOX (фолиниевая кислота, фурурацил и оксалиплатин) может быть рекомендован как стандарт химиотерапии второй линии. Клиническое исследование ABC-06 продемонстрировало улучшение ОВ после перехода к ЦИС-ГЕМ. Хотя различия в медиане ОВ были умеренными (5,3 против 6,2 месяца) между исследуемыми группами, различия в выживаемости через 6 месяцев (35,5% против 50,6%) и 12 месяцев (11,4% против 25,9%) были клинически значимыми [18].
Целевая терапия, такая как ингибиторы изоцитратдегидрогеназы 1 (ИДГ1) [19,20], рецептора фактора роста фибробластов (РФРФ) [21,22,23,24,25] и киназы рецептора тропомиозина (КРТ) [26,27] або Wnt [28] альтерации сигнальных путей пока испытываются у пациентов с вХКА [16]. Окончательные результаты исследования ClarIDHy, фазы III, продемонстрировали клиническое преимущество ивосидениба (низкомолекулярного таргетного ингибитора мутировавшей изоцитратдегидрогеназы 1, ИДГ1) по сравнению с плацебо у пациентов с ранее леченным ХКА и мутацией ИДГ1 по показателям выживаемости без прогрессирования (ОР 0. 37) и медианы ОВ (ОР 0,69) [20].
Значительная часть пациентов с диагнозом вХКА с преимущественным поражением печени может быть пригодной для лечения, направленного на печень: трансартериальная радиоэмболизация с итрием-90 (ТАРЭ), стереотаксическая лучевая терапия тела (СЛТТ) и печеночная артериальная инфузионная химиотерапия (ПАИ) [29]. ТАРЕ является наиболее разработанным подходом, но надежные доказательства в его поддержку все еще скромны. Клиническое исследование SIRCCA (селективная внутренняя лучевая терапия холангиокарциномы) по оценке ТАРЭ (трансартериальная радиоэмболизация) с последующей химиотерапией ЦИС-ГЕМ по сравнению с химиотерапией только ЦИС-ГЕМ в качестве первой линии лечения пациентов с нерезектабельной вХКА было преждевременно прервано из-за низкого уровня набора (NCT02807181). Ожидаются результаты проспективных исследований (исследования ABC-07 и EudraCT 2014-003656-31) для оценки преимуществ СЛТТ в сочетании с системной химиотерапией.
Последнее клиническое руководство NCCN по раку гепатобилиарной системы (v. 2.2021) содержит рекомендации по общим критериям отбора пациентов для проведения артериально-направленной терапии (ТАРЭ, СЛТТ и ПАИХ), включая нерезектабельный или метастатический вХКА, без внепеченочных заболеваний. Химиотерапия ПАИ рекомендована только в контексте клинического исследования или в третичных центрах гепато-панкреато-билиарной хирургии для пациентов с распространенным заболеванием, ограниченным печенью [30].
-
Печеночная артериальная инфузионная химиотерапия
3.1. Обоснование
Большинство пациентов, страдающих вХКА, имеют печеночно-ограниченное заболевание, которое считается нерезектабельным из-за своей локализации, с инфильтрацией сосудистых структур или мультифокальностью [31]. Своеобразное двойное кровоснабжение печени позволяет доставлять высокие дозы химиотерапии через преимущественную артериальную васкуляризацию опухоли, сохраняя портальный кровоток к здоровой паренхиме печени. Печеночная экстракция и метаболизм первого прохождения (до 99%) выбранных схем лечения уменьшает системную экспозицию и токсические эффекты [32], достигая гораздо более высоких и более селективных уровней опухолевых препаратов, чем при системном введении [33]. Результаты первых небольших исследований, проведенных в 1970-х и 1980-х годах, вместе с этими предположениями привели к широкому применению печеночной артериальной инфузионной химиотерапии с помощью хирургически имплантированного подкожного насоса [34,35,36].
3.2. Техника установки систем
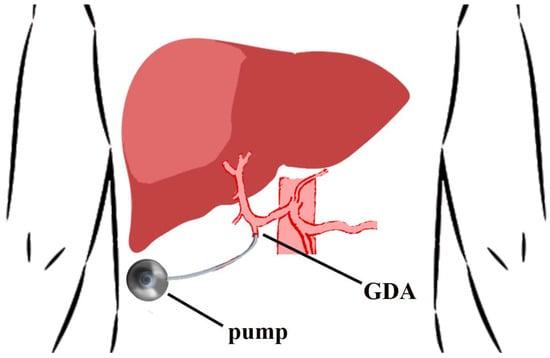
Анатомия печеночных сосудов должна быть оценена до операции с помощью артериальной КТ с фазовым контрастом. До трети пациентов имеют аномальную анатомию печеночной артерии. Кончик катетера устанавливают непосредственно возле истока гастродуоденальной артерии (ГДА). Кончик катетера не должен создавать турбулентность в печеночной артерии, чтобы не влиять на долговременную проходимость катетера и канюлированной артерии [37]. Необходимо обеспечить адекватную перфузию всей печеночной паренхимы, не допуская затекания в соседние органы. Супрапилорические артериальные ветви и правая желудочная артерия перевязываются для предотвращения перфузии в двенадцатиперстную кишку. Перфузия насосом только печени оценивается путем болюсного введения раствора метиленового синего или флюоресцеина (с помощью лампы Вудса) в насос [36,38]. Все вспомогательные/замещенные сосуды перевязывают [39,40], рассчитывая на перекрестную печеночную перфузию. Печеночные долевые артерии не являются конечными артериями, и окклюзия вариантного сосуда не повлияет на поток из контралатеральной доли печени через быстро развивающиеся коллатеральные сосуды [37]. Холецистэктомия выполняется во избежание холецистита, вызванного химиотерапией. В зависимости от модели используемого инфузионного насоса, позиционирование ложа выполняется либо в левой нижней части живота (стома является противопоказанием), согласно методике Мемориального онкологического центра Слоуна-Кеттеринга (МОЦСК) [36], либо в правой половине грудной стенки [38]. (Рисунок 2).
Рисунок 2. Место установки печеночного артериального инфузионного химиотерапевтического насоса. Острие катетера размещают в месте начала гастродуоденальной артерии (ГДА).
Абсолютными противопоказаниями к ПАИ-химиотерапии являются: плохая функция печени, длительная системная химиотерапия, значительная опухолевая нагрузка на печень, портальная гипертензия, тромбоз воротной вены и окклюзия печеночной артерии [36].
Оценка локорегиональных лимфатических узлов рутинно выполняется с помощью печеночной артерии, гепатодуоденальной, портокавальной и перипанкреатической лимфаденэктомии (станции 8, 12 и 13), поскольку они обеспечивают хороший доступ к печеночной артерии и определяют стадию узла при установке насоса, что позволяет избежать ошибочной классификации пациентов [36,41]. Роль рутинной лимфаденэктомии при внутрипеченочной холангиокарциноме все еще остается противоречивой [42]. Восьмое издание AJCC [43] и Национальная всеохватывающая онкологическая сеть [44] рекомендуют забирать минимум шесть лимфатических узлов для адекватного узлового стадирования. Bagante и соавт. в 2017 году продемонстрировали, что патологическое состояние лимфатических узлов тесно связано с долгосрочным результатом и что радиологическое стадирование лимфатических узлов может быть неточным у 40% пациентов [45]. В 2020 году Bartsch и соавт. подтвердили, что предоперационная визуализация имеет чувствительность только 71,1% в выявлении подозрительных лимфатических узлов [46]. Доказано, что лимфаденэктомия не имеет преимуществ для онкоспецифической выживаемости для резектабельных пациентов, но показала значительную пользу у нерезектабельных пациентов, облегчая бремя портальной опухоли и удлиняя выживаемость [47], а также давая возможность более персонализированного подхода к системной терапии [48].
3.3. Осложнения
Общая заболеваемость, связанная с использованием насоса, составляет от 12% до 41% пациентов [49,50,51,52]. Осложнения включают неисправность помпы, смещение или переворачивание, инфекцию подкожного кармана или гематому, тромбоз или смещение катетера, эрозию катетера, артериальный тромбоз или расслоение артерии, внепеченочную перфузию и неполную перфузию. В 2005 году в крупнейшем на сегодняшний день ретроспективном одноцентровом исследовании, опубликованном исследовательской группой МОЦСК, оценивали осложнения и долговременную долговечность насоса у 544 пациентов, пролеченных в период между 1986 и 2001 годами [52]. Осложнения, связанные с использованием насоса, были зарегистрированы у 22% пациентов, чаще всего со стороны печеночной артериальной системы (51%): артериальный тромбоз, внепеченочная перфузия, неполная печеночная перфузия и кровоизлияния. Осложнения, связанные с использованием помпы, удалось устранить у 45% пациентов, причем ранние осложнения (<30 дней) имели больше шансов быть устраненными, чем поздние (70% против 30%) [52]. Хотя послеоперационные инфекции подкожного кармана случаются редко (2%), необходимо быть осторожными, чтобы избежать любого загрязнения во время операции и каждый раз, когда насос используется для химиотерапевтических инфузий после операции. Инфекции подкожного кармана насоса трудно поддаются консервативному лечению, поэтому следует рассмотреть возможность переустановки насоса [36]. Еще одной проблемой, которая может возникнуть, является переворачивание насоса, особенно у пациентов с ожирением, у которых полезно регулярно рассматривать возможность размещения насоса в грудной стенке. В общем, 12% пациентов имели осложнения, которые привели к нефункциональности насоса. Долговременная функциональность насоса является отличной: частота выхода из строя насоса через 6 месяцев, 1 год и 2 года после установки составляла 5%, 9% и 16% соответственно [52].
Токсичность химиотерапии с использованием печеночного артериального инфузионного насоса включает химический гепатит, гастрит, пептическую язву и билиарный склероз (БС). Частота возникновения БС у пациентов, получавших химиотерапию на основе флоксуридина, составляет от 0,9% до 26%. [49,53,54,55,56,57,58,59,60,61,62]. Это клинически значимое неблагоприятное событие, которое может потребовать установки билиарного стента или привести к хроническому поражению печени [63]. У таких пациентов необходимо регулярно контролировать биохимические показатели, поскольку первые признаки БС проявляются повышением уровня щелочной фосфатазы и/или общего билирубина в сыворотке крови. При повышении показателей функции печени химиотерапию ПАИ следует прервать или уменьшить дозу. Распространенной практикой является добавление внутриартериальных стероидов (дексаметазон 4 мг) к химиотерапии ПАИ для предотвращения/уменьшения БС.
-
Обзор литературы
Химиотерапия ПАИ изначально была разработана для лечения колоректальных метастазов печени [53,64,65], но за последние два десятилетия было опубликовано больше данных по лечению вХКА (табл. 1).
Таблица 1. Краткий обзор исследований. Химиотерапия ПАИ +/- СИС для лечения нерезектабельного вХКА.
| Исследование | Количество и тип пациентов | Схема лечения | ВБП | ОВ |
|---|---|---|---|---|
| Cantore и соавт., 2005 [66] | 30 РЖП •25 вХКА •5 рак желчного пузыря |
3-недельный цикл ПАИ
эпирубицин 50 мг/м2, ЦИС 60 мг/м2 в виде болюса в 1-й день 5-ФУ 200 мг/м2 в сутки путем непрерывной инфузии с 1-го по 14-й день |
7.1 месяцев (ДИ 1.6–19.1) | 13.2 месяцев |
| Jarnagin и соавт., 2009 [67] | 34 ПРП •26 вХКА •8 ГКЦ |
4-недельный цикл
ПАИ: FUDR (0,16 мг/кг × 20/скорость потока насоса) и ДЕКС 25 мг в 1-й день в течение 14 дней каждого цикла |
7.4 месяцев | 29.5 месяцев |
| Kemeny и соавт., 2011 [68] | 22 ПРП •18 вХКА •4 ГКЦ |
4-недельный цикл
ПАИ: FUDR (0,16 мг/кг × 30/скорость потока насоса) и ДЕКС 25 мг в 1-й день в течение 14 дней каждого цикла СИС: бевацизумаб 5 мг/кг каждые две недели. |
8.45 месяцев (ДИ 5.53–11.05) | 31.1 месяцев (ДИ 14.14–33.59) |
| Inaba и соавт., 2011 [69] | 13 вХКА | 4-недельный цикл
ПАИ: ГЕМ 1000 мг/м2 30-минутная инфузия в 1-й, 8-й и 15-й дни в течение 5 циклов |
– | 389 дней (ДИ 158–620) |
| Ghiringhelli и соавт., 2013 [70] | 12 вХКА | Лечение второй линии
2-недельный цикл ПАИ: ГЕМ (1000 мг/м2 в течение 30 мин) последующее введением ОКС (100 мг/м2 в течение 2 ч) |
9.2 месяцев (ДИ 2.1–29.4) | 20.3 месяцев (ДИ 13.2–49.7) |
| Massani и соавт., 2015 [38] | 11 вХКА | 2-недельный цикл
ПАИ: 1-й день: 100 мг/мкв ОКС 2-й день: 5 ФУ 7 мг/кг со скоростью 2 мл/ч в/в в течение 48 ч. |
– | 17.6 месяцев |
| Konstantinidis и соавт., 2016 [71]. | 104 вХКА •78 ПАИ/СИС •26 СИС |
4-недельный цикл
ПАИ: FUDR (0,16 мг/кг × 20/скорость потока насоса) и ДЕКС 25 мг в 1-й день в течение 14 дней каждого цикла СИС: преимущественно на основе ГЕМ |
ПАИ/СИС 12 месяцев СИС 7 месяцев |
ПАИ/СИС 30.8 месяцев СИС 18.4 месяцев |
| Higaki и соавт., 2018 [72] | 12 вХКА | 42-дневный цикл
ПАИ: ЦИС 65 мг/м2 2 мл/мин в 1-й день СИС: S-1 60 мг/м2 в день 1-28. |
– | 10.1 месяцев (ДИ 3.6–23.2) |
| Cercek A, и соавт., 2019 [33] | 38 вХКА | 4-недельный цикл
ПАИ: FUDR (0,12 мг/кг × 30/скорость потока насоса) и ДЕКС 30 мг/насос в 1-й день в течение 14 дней каждого цикла СИС: ГЕМ (800 мг/м2) с ОКС (85 мг/м2) в 1-й или 15-й день, каждые 2 недели |
11.8 месяцев (односторонний 90% ДИ, 11,1) | 25.0 месяцев (95% ДИ, 20.6-не достигнуто) |
Условные обозначения в таблице: ВБП – выживаемость без прогрессирования; ОВ – общая выживаемость; РЖП – рак желчевыводящих путей; ПРП – первичный рак печени; вХКА – внутрипеченочная холангиокарцинома; ГКЦ – гепатокарцинома; ДИ – доверительный интервал; ПАИ – печеночная артериальная инфузия; СИС- системная; FUDR – флоксуридин; ГЕМ – гемцитабин; ЦИС- цисплатин; ОКС – оксалиплатн; ДЕКС – дексаметазон; 5-ФУ, 5-фторурацил.
В 2005 году во второй фазе исследования Cantore и соавт. с участием 30 пациентов с нерезектабельным вХКА (n = 25) или аденокарциномой желчного пузыря (n = 5), получавших эпирубицин и цисплатин ПАИ в виде болюса в сочетании с системной непрерывной инфузией 5-фторурацила (5-ФУ), общая частота ответа составила 40%. Медиана выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) составляла 7,1 и 13,2 месяца соответственно, а 1- и 2-летняя выживаемость – 54% и 20% соответственно. Токсичность 3 степени наблюдалась у 11 из 30 пролеченных пациентов [66].
В 2009 году исследовательская группа МОЦСК под руководством Kemeny NE и Jarnagin WR исследовала эффективность ПАИ с флоксуридином (FUDR) и дексаметазоном у 34 пациентов с нерезектабельным первичным раком печени (26 вХКА и 8 гепатокарцинома). Они продемонстрировали частоту ответа 47,1%, медиана выживаемости составляла 29,5 месяцев, а 2-летняя выживаемость – 67%. Пациенты с вХКА имели более высокую частоту ответа (53,8%) по сравнению с пациентами с ГКЦ (25%). Выживаемость без прогрессирования заболевания (ВБПЗ) у пациентов с вХКА составила 11,3 месяца. Одному пациенту была показана резекция, все пациенты в конечном итоге прогрессировали, и почти все в определенный момент получали системную терапию. Показатели 1-, 2- и 3-летней выживаемости составили 88%, 67% и 29% соответственно. У пяти пациентов (14,7%) наблюдалась токсичность 3 или 4 степени [67]. Эта же исследовательская группа опубликовала дальнейшие обновленные исследования. В 2011 году было проведено исследование, в котором 22 пациента (18 вХКА и 4 ГКЦ) получали системное (в/в) введение бевацизумаба в дополнение к ранее описанной схеме ПАИ. Медиана ОВсоставляла 31,1 месяца (ДИ 14,14-33,59), ВБП – 8,45 месяца (ДИ 5,53-11,05), а ВБПЗ- 11,28 месяца (ДИ 7,93-15,69). Исследование было досрочно прекращено из-за роста билиарной токсичности; у 24% пациентов наблюдалось повышение уровня билирубина, а билиарные стенты были установлены в 13,6%. [68]. В 2016 году группа МОЦСК опубликовала следующий обзор 104 пациентов с нерезектабельным вХКА с поражением только печени, получавших ПАИ и системную химиотерапию (n = 78) или только системную химиотерапию (n = 26). Они продемонстрировали лучшую частоту ответа у пациентов, получавших ПАИ и системную химиотерапию, чем у тех, кто получал только системную химиотерапию. ВБП составляла 12 против 7 месяцев для ПАИ/СИС и СИС, соответственно, хотя и не была значимой, р = 0,2. ВБП составляла 30,8 против 18,4 месяца для ПАИ/СИС и СИС соответственно. Однако продемонстрированная конверсия к резектабельности (8/104) намного ниже показателей, достигнутых при метастазах в толстую кишку [71]. В 2019 году в последнем опубликованном клиническом исследовании второй фазы приняли участие 38 пациентов с нерезектабельным вПХК, получавших химиотерапию ПАИ FUDR в сочетании с системным гемцитабином и оксалиплатином. Медиана ВБП составила 11,8 месяца, медиана ОВ- 25,0 месяца, а показатель 1-летней ОВ- 89,5%. Результаты исследования свидетельствуют о том, что комбинированный подход ассоциируется с дальнейшим улучшением выживаемости без прогрессирования, чем только СИС [33].
Исследование фазы I/II, опубликованное в 2011 году Японской исследовательской группой по интервенционной радиологии в онкологии, имело целью установить рекомендуемую дозу (РД) ПАИ с использованием гемцитабина (ГЕМ) для лечения вХКА и оценить ее эффективность и безопасность. РД была установлена на уровне 1000 мг/м2. В общем 13 пациентам было проведено лечение с использованием РД с помощью чрескожно установленной системы катетер-порт ПАИ в виде 30-минутной инфузии в 1-й, 8-й и 15-й дни каждые 4 недели в течение 5 циклов. Частота ответа составляла 7,7%, что ниже установленного порогового уровня эффективности 20%. Осложнения, связанные с самим ПАИ или имплантированной системой катетер-порт, возникли в 6 случаях (24%), а частота нежелательных явлений 3-й степени или более у всех пролеченных пациентов (n = 25) составила 48%. Авторы пришли к выводу, что этот протокол не имел никаких преимуществ над системным лечением [69].
В 2014 году во французском ретроспективном исследовании Ghiringhelli и соавт. проанализировали результаты лечения 12 последовательно взятых пациентов с нерезектабельной вХКА, которые получали ПАИ (чрескожно установленную систему катетер-порт) ГЭМ (1000 мг/м2) с последующим системным оксалиплатином (100 мг/м2) в качестве второй линии лечения. Общая частота ответа составила 66%, а частота контроля заболевания – 91%. Медиана ВБП составила 9,2 месяца (ДИ 5,1-29,4), а медиана ОВ- 9,1 месяца (ДИ 13,2-49,7). У шести пациентов (50%) наблюдалась токсичность 3/4 степени [70].
В 2015 году Massani M. и соавт. опубликовали ретроспективный опыт лечения только ПАИ (фторурацилом и оксалиплатином) у 11 нерезектабельных пациентов с вХКА. КТ-сканирование, проведенное после шестого цикла терапии, показало, что у 5 из них была частичная положительная реакция печени, у 2 – стабильное состояние, а у 4 – прогрессирование заболевания. Медиана ВБП составила 17,6 месяца. Трем пациентам с частичным печеночным ответом была выполнена резекция, а двое имели более 70% некроза опухоли. Медиана выживаемости пациентов с заболеванием только печени, получавших системную химиотерапию и не подлежали резекции, составила 15,3 месяца [38].
В пилотном исследовании, опубликованном в 2018 году и проведенном в Японии в период с 2007 по 2011 год, сравнивали 12 пациентов с нерезектабельной вХКА, получавших ПАИ цисплатина плюс пероральный препарат S-1, с 16 пациентами, получавшими традиционную терапию (системную или локально-региональную). Цисплатин вводили через катетер, установленный в бедренной артерии, и вводили в печеночную артерию под ангиографическим контролем во время каждого цикла. S-1 – пероральный фторпиримидин, предназначенный для улучшения противоопухолевой активности 5-фторурацила (5-ФУ) с целью уменьшения его токсичности [73]. Все 12 пациентов прошли по меньшей мере 2 курса химиотерапии. Медиана ВБП составила 10,1 месяца (ДИ 3,6-23,2). Анемия 3 степени возникла только у 1 пациента (4,5%) [72].
Что касается клинических исследований, которые проводятся в настоящее время, то исследование NCT01525069 является пилотным исследованием, в котором участвуют пациенты с нерезектабельной вХКА, которые были распределены в три различные группы лечения: ПАИ FUDR отдельно или в комбинации с оксалиплатином и/или гемцитабином. Целью исследования NCT03771846, которое проводит Онкологический центр Университета Сунь Ятсена, является оценка эффективности и безопасности ПАИ иринотекана, оксалиплатина, 5-фторурацила и лейковорина по сравнению с системной химиотерапией гемцитабином и оксалиплатином у пациентов с нерезектабельной вХКА. Французское многоцентровое исследование 2 фазы GEMOXIA-02 (NCT03364530) имеет целью определить объективную частоту ответа на ПАИ гемцитабина/оксалиплатина, назначаемого в качестве второй линии лечения у пациентов с неметастатической нерезектабельной вХКА. HELIX ICC (NCT04251715) – это исследование II фазы, целью которого является изучение эффективности и безопасности системной индукции mFOLFIRINOX с последующей ПАИ FUDR плюс дексаметазон, вводимой одновременно с системным mFOLFIRI в лечении пациентов с нерезектабельной вХКА с доминирующим поражением печени.
-
Выводы
В опубликованных ранее исследованиях рассматривались группы пациентов с различными формами первичного рака печени, которые сталкивались с возможным химиотерапевтическим поражением желчевыводящих путей. Результаты последних исследований свидетельствуют о том, что адекватное и раннее лечение с применением комбинированного подхода химиотерапии ПАИ и СИС ассоциируется с улучшением выживаемости без прогрессирования и общей выживаемости, чем только СИС или ПАИ для лечения нерезектабельного вХКА. Однако на сегодняшний день продемонстрированная частота конверсии в резектабельность намного ниже, чем при колоректальных метастазах в печень. Одним из основных ограничений химиотерапии ПАИ является ограниченное количество хирургов и онкологов, имеющих опыт ее применения, за пределами нескольких референтных центров лечения рака ГПБ системы во всем мире. Современные рекомендации по применению регионарной терапии при нерезектабельных вХКА ограничены отсутствием проспективных исследований. Тщательная оценка этих стратегий в клинических исследованиях является крайне необходимой. Индивидуализация химиотерапии и режимы, основанные на селективных мишенях при мутантном вХКА, являются основным направлением будущих исследований.
Ссылки на источники
- Renshaw, K. Malignant neoplasms of the extrahepatic biliary ducts. Ann. Surg. 1922, 76, 205–221.
- Rizvi, S.; Gores, G.J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology 2013, 145, 1215–1229.
- Banales, J.M.; Cardinale, V.; Carpino, G.; Marzioni, M.; Andersen, J.B.; Invernizzi, P.; Lind, G.E.; Folseraas, T.; Forbes, S.J.; Fouassier, L.; et al. Expert consensus document: Cholangiocarcinoma: Current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma (ENS-CCA). Nat. Rev. Gastroenterol. Hepatol. 2016, 13, 261–280.
- Khan, S.A.; Thomas, H.C.; Davidson, B.R.; Taylor-Robinson, S.D. Cholangiocarcinoma. Lancet 2005, 366, 1303–1314.
- Alvaro, D.; Bragazzi, M.C.; Benedetti, A.; Fabris, L.; Fava, G.; Invernizzi, P.; Marzioni, M.; Nuzzo, G.; Strazzabosco, M.; Stroffolini, T.; et al. Cholangiocarcinoma in Italy: A national survey on clinical characteristics, diagnostic modalities and treatment. Results from the ‘Cholangiocarcinoma’ committee of the Italian Association for the Study of Liver disease. Dig. Liver Dis. 2011, 43, 60–65.
- Khan, S.A.; Davidson, B.R.; Goldin, R.D.; Heaton, N.; Karani, J.; Pereira, S.P.; Rosenberg, W.M.; Tait, P.; Taylor-Robinson, S.D.; Thillainayagam, A.V.; et al. Guidelines for the diagnosis and treatment of cholangiocarcinoma: An update. Gut 2012, 61, 1657–1669.
- DeOliveira, M.L.; Cunningham, S.C.; Cameron, J.L.; Kamangar, F.; Winter, J.M.; Lillemoe, K.D.; Choti, M.A.; Yeo, C.J.; Schulick, R.D. Cholangiocarcinoma: Thirty-one-year experience with 564 patients at a single institution. Ann. Surg. 2007, 245, 755–762.
- Nakeeb, A.; Pitt, H.A.; Sohn, T.A.; Coleman, J.A.; Abrams, R.A.; Piantadosi, S.; Hruban, R.H.; Lillemoe, K.D.; Yeo, C.J.; Cameron, J.L. Cholangiocarcinoma: A spectrum of intrahepatic, perihilar, and distal tumors. Ann Surg. 1996, 224, 463–475.
- Aljiffry, M.; Walsh, M.J.; Molinari, M. Advances in diagnosis, treatment and palliation of cholangiocarcinoma: 1990–2009. World J. Gastroenterol. 2009, 15, 4240–4262.
- Ebata, T.; Kosuge, T.; Hirano, S.; Unno, M.; Yamamoto, M.; Miyazaki, M.; Kokudo, N.; Miyagawa, S.; Takada, T.; Nagino, M. Proposal to modify the International Union Against Cancer staging system for perihilar cholangiocarcinomas. Br. J. Surg. 2014, 101, 79–88.
- Bertuccio, P.; Malvezzi, M.; Carioli, G.; Hashim, D.; Boffetta, P.; El-Serag, H.B.; La Vecchia, C.; Negri, E. Global trends in mortality from intrahepatic and extrahepatic cholangiocarcinoma. J. Hepatol. 2019, 71, 104–114.
- Welzel, T.M.; Mellemkjaer, L.; Gloria, G.; Sakoda, L.C.; Hsing, A.W.; El Ghormli, L.; Olsen, J.H.; McGlynn, K.A. Risk factors for intrahepatic cholangiocarcinoma in a low-risk population: A nationwide case-control study. Int. J. Cancer 2007, 120, 638–641.
- Rahib, L.; Wehner, M.R.; Matrisian, L.M.; Nead, K.T. Estimated Projection of US Cancer Incidence and Death to 2040. JAMA Netw. Open 2021, 4, e214708.
- Sempoux, C.; Jibara, G.; Ward, S.C.; Fan, C.; Qin, L.; Roayaie, S.; Fiel, M.I.; Schwartz, M.; Thung, S.N. Intrahepatic cholangiocarcinoma: New insights in Pathology. Semin. Liver Dis. 2011, 31, 49–60.
- Mosconi, S.; Beretta, G.D.; Labianca, R.; Zampino, M.G.; Gatta, G.; Heinemann, V. Cholangiocarcinoma. Crit. Rev. Oncol. Hematol. 2009, 69, 259–270.
- Banales, J.M.; Marin, J.J.G.; Lamarca, A.; Rodrigues, P.M.; Khan, S.A.; Roberts, L.R.; Cardinale, V.; Carpino, G.; Andersen, J.B.; Braconi, C.; et al. Cholangiocarcinoma 2020: The next horizon in mechanisms and management. Nat. Rev. Gastroenterol. Hepatol. 2020, 17, 557–588.
- Valle, J.; Wasan, H.; Palmer, D.H.; Cunningham, D.; Anthoney, A.; Maraveyas, A.; Madhusudan, S.; Iveson, T.; Hughes, S.; Pereira, S.P.; et al. Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. N. Engl. J. Med. 2010, 362, 1273–1281.
- Lamarca, A.; Palmer, D.H.; Wasan, H.S.; Ross, P.J.; Ma, Y.T.; Arora, A.; Falk, S.; Gillmore, R.; Wadsley, J.; Patel, K.; et al. ABC-06|A randomised phase III, multi-centre, open-label study of active symptom control (ASC) alone or ASC with oxaliplatin / 5-FU chemotherapy (ASC+mFOLFOX) for patients (pts) with locally advanced/metastatic biliary tract cancers (ABC) previously-tr. J. Clin. Oncol. 2019, 37, 4003.
- Lowery, M.A.; Abou-Alfa, G.K.; Burris, H.A.; Janku, F.; Shroff, R.T.; Cleary, J.M.; Azad, N.S.; Goyal, L.; Maher, E.A.; Gore, L.; et al. Phase I study of AG-120, an IDH1 mutant enzyme inhibitor: Results from the cholangiocarcinoma dose escalation and expansion cohorts. J. Clin. Oncol. 2017, 35, 4015.
- Zhu, A.X.; Macarulla, T.; Javle, M.M.; Kelley, R.K.; Lubner, S.J.; Adeva, J.; Cleary, J.M.; Catenacci, D.V.T.; Borad, M.J.; Bridgewater, J.A.; et al. Final results from ClarIDHy, a global, phase III, randomized, double-blind study of ivosidenib (IVO) versus placebo (PBO) in patients (pts) with previously treated cholangiocarcinoma (CCA) and an isocitrate dehydrogenase 1 (IDH1) mutation. J. Clin. Oncol. 2021, 39, 266.
- Javle, M.; Lowery, M.; Shroff, R.T.; Weiss, K.H.; Springfeld, C.; Borad, M.J.; Ramanathan, R.K.; Goyal, L.; Sadeghi, S.; Macarulla, T.; et al. Phase II Study of BGJ398 in Patients With FGFR-Altered Advanced Cholangiocarcinoma. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2018, 36, 276–282.
- Javle, M.M.; Shroff, R.T.; Zhu, A.; Sadeghi, S.; Choo, S.; Borad, M.J.; Lowery, M.A.; El-Khoueiry, A.; Macarulla, T.; Philip, P.A.; et al. A phase 2 study of BGJ398 in patients (pts) with advanced or metastatic FGFR-altered cholangiocarcinoma (CCA) who failed or are intolerant to platinum-based chemotherapy. J. Clin. Oncol. 2016, 34, 335.
- Mazzaferro, V.; Shaib, W.; Rimassa, L.; Harris, W.; Personeni, N.; El-Rayes, B.; Tolcher, A.; Hall, T.; Wang, Y.; Schwartz, B.; et al. PD-019 ARQ 087, an oral pan- fibroblast growth factor receptor (FGFR) inhibitor, in patients (pts) with advanced and/or metastatic intrahepatic cholangiocarcinoma (вХКА). Ann. Oncol. 2016, 27, ii109.
- Tran, B.; Meric-Bernstam, F.; Arkenau, H.-T.; Bahleda, R.; Kelley, R.K.; Hierro, C.; Ahn, D.; Zhu, A.; Javle, M.; Winkler, R.; et al. Efficacy of TAS-120, an irreversible fibroblast growth factor receptor inhibitor (FGFRi), in patients with cholangiocarcinoma and FGFR pathway alterations previously treated with chemotherapy and other FGFRi’s. Ann. Oncol. 2018, 29, ix49–ix50.
- Vogel, A.; Sahai, V.; Hollebecque, A.; Vaccaro, G.; Melisi, D.; Al-Rajabi, R.; Paulson, A.S.; Borad, M.J.; Gallinson, D.; Murphy, A.G.; et al. FIGHT-202: A phase II study of pemigatinib in patients (pts) with previously treated locally advanced or metastatic cholangiocarcinoma (CCA). Ann. Oncol. 2019, 30, v876.
- Drilon, A.; Siena, S.; Ou, S.-H.I.; Patel, M.; Ahn, M.J.; Lee, J.; Bauer, T.M.; Farago, A.F.; Wheler, J.J.; Liu, S.V.; et al. Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1, and ALK Inhibitor Entrectinib: Combined Results from Two Phase I Trials (ALKA-372-001 and STARTRK-1). Cancer Discov. 2017, 7, 400–409.
- Drilon, A.; Laetsch, T.W.; Kummar, S.; DuBois, S.G.; Lassen, U.N.; Demetri, G.D.; Nathenson, M.; Doebele, R.C.; Farago, A.F.; Pappo, A.S.; et al. Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. N. Engl. J. Med. 2018, 378, 731–739.
- Ong, C.K.; Subimerb, C.; Pairojkul, C.; Wongkham, S.; Cutcutache, I.; Yu, W.; McPherson, J.R.; Allen, G.E.; Ng, C.C.; Wong, B.H.; et al. Exome sequencing of liver fluke-associated cholangiocarcinoma. Nat. Genet. 2012, 44, 690–693.
- Koay, E.J.; Odisio, B.C.; Javle, M.; Vauthey, J.-N.; Crane, C.H. Management of unresectable intrahepatic cholangiocarcinoma: How do we decide among the various liver-directed treatments? Hepatobiliary Surg. Nutr. 2017, 6, 105–116.
- Hepatobiliary Cancer. National Comprehensive Cancer Network. 2021; Hepatobiliary Cancer (Version 2.2021). Available online: https://www.nccn.org/professionals/physician_gls/pdf/hepatobiliary.pdf (accessed on 5 May 2021).
- Nathan, H.; Aloia, T.A.; Vauthey, J.N.; Abdalla, E.K.; Zhu, A.X.; Schulick, R.D.; Choti, M.A.; Pawlik, T.M. A proposed staging system for intrahepatic cholangiocarcinoma. Ann. Surg. Oncol. 2009, 16, 14–22.
- Ensminger, W.D.; Gyves, J.W. Clinical pharmacology of hepatic arterial chemotherapy. Semin. Oncol. 1983, 10, 176–182.
- Cercek, A.; Boerner, T.; Tan, B.R.; Chou, J.F.; Gönen, M.; Boucher, T.M.; Hauser, H.F.; Do, R.K.G.; Lowery, M.A.; Harding, J.J.; et al. Assessment of Hepatic Arterial Infusion of Floxuridine in Combination with Systemic Gemcitabine and Oxaliplatin in Patients with Unresectable Intrahepatic Cholangiocarcinoma: A Phase 2 Clinical Trial. JAMA Oncol. 2020, 6, 60–67.
- Johnson, L.P.; Rivkin, S.E. The implanted pump in metastatic colorectal cancer of the liver. Risk versus benefit. Am. J. Surg. 1985, 149, 595–598.
- Weiss, G.R.; Garnick, M.B.; Osteen, R.T.; Steele, G.D.J.; Wilson, R.E.; Schade, D.; Kaplan, W.D.; Boxt, L.M.; Kandarpa, K.; Mayer, R.J. Long-term hepatic arterial infusion of 5-fluorodeoxyuridine for liver metastases using an implantable infusion pump. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1983, 1, 337–344.
- Thiels, C.A.; D’Angelica, M.I. Hepatic artery infusion pumps. J. Surg. Oncol. 2020, 122, 70–77.
- Allen, P.J.; Stojadinovic, A.; Ben-Porat, L.; Gonen, M.; Kooby, D.; Blumgart, L.; Paty, P.; Fong, Y. The management of variant arterial anatomy during hepatic arterial infusion pump placement. Ann. Surg. Oncol. 2002, 9, 875–880.
- Massani, M.; Nistri, C.; Ruffolo, C.; Bonariol, R.; Pauletti, B.; Bonariol, L.; Caratozzolo, E.; Morana, G.; Bassi, N. Intrahepatic chemotherapy for unresectable cholangiocarcinoma: Review of literature and personal experience. Updates Surg. 2015, 67, 389–400.
- Cohen, A.M.; Higgins, J.; Waltman, A.C.; Athanasoulis, C.; McKusick, K. Effect of ligation of variant hepatic arterial structures on the completeness of regional chemotherapy infusion. Am. J. Surg. 1987, 153, 378–380.
- Rayner, A.A.; Kerlan, R.K.; Stagg, R.J.; Price, D.C.; Hohn, D.C. Total hepatic arterial perfusion after occlusion of variant lobar vessels: Implications for hepatic arterial chemotherapy. Surgery 1986, 99, 708–715.
- Jolissaint, J.S.; Soares, K.C.; Seier, K.P.; Kundra, R.; Gonen, M.; Shin, P.J.; Boerner, T.; Sigel, C.; Madupuri, R.; Vakiani, E.; et al. Intrahepatic Cholangiocarcinoma with Lymph Node Metastasis: Treatment-Related Outcomes and the Role of Tumor Genomics in Patient Selection. Clin. Cancer Res. Off. J. Am. Assoc. Cancer Res. 2021.
- Zhou, R.; Lu, D.; Li, W.; Tan, W.; Zhu, S.; Chen, X.; Min, J.; Shang, C.; Chen, Y. Is lymph node dissection necessary for resectable intrahepatic cholangiocarcinoma? A systematic review and meta-analysis. Int. Hepato-Pancreato-Biliary Assoc. 2019, 21, 784–792.
- Amin, M.B.; Edge, S.; Greene, F.; Byrd, D.R.; Brookland, R.K.; Washington, M.K.; Gershenwald, J.E.; Compton, C.C.; Hess, K.R.; Sullivan, D.C.; et al. AJCC Cancer Staging Manual, 8th ed.; Springer: Berlin/Heidelberg, Germany, 2017.
- Zhang, X.-F.; Chen, Q.; Kimbrough, C.W.; Beal, E.W.; Lv, Y.; Chakedis, J.; Dillhoff, M.; Schmidt, C.; Cloyd, J.; Pawlik, T.M. Lymphadenectomy for Intrahepatic Cholangiocarcinoma: Has Nodal Evaluation Been Increasingly Adopted by Surgeons over Time?A National Database Analysis. J. Gastrointest. Surg. Off. J. Soc. Surg. Aliment. Tract. 2018, 22, 668–675.
- Spolverato, G.; Bagante, F.; Weiss, M.; Alexandrescu, S.; Marques, H.P.; Aldrighetti, L.; Maithel, S.K.; Pulitano, C.; Bauer, T.W.; Shen, F.; et al. Comparative performances of the 7th and the 8th editions of the American Joint Committee on Cancer staging systems for intrahepatic cholangiocarcinoma. J. Surg. Oncol. 2017, 115, 696–703.
- Bartsch, F.; Hahn, F.; Müller, L.; Baumgart, J.; Hoppe-Lotichius, M.; Kloeckner, R.; Lang, H. Relevance of suspicious lymph nodes in preoperative imaging for resectability, recurrence and survival of intrahepatic cholangiocarcinoma. BMC Surg. 2020, 20, 75.
- Liu, J.; Zhong, M.; Feng, Y. Prognostic Factors and Treatment Strategies for Intrahepatic Cholangiocarcinoma from 2004 to 2013: Population-Based SEER Analysis. Transl. Oncol. 2019, 12, 1496–1503.
- Cloyd, J.M.; Ejaz, A.; Pawlik, T.M. The Landmark Series: Intrahepatic Cholangiocarcinoma. Ann. Surg. Oncol. 2020, 27, 2859–2865.
- Daly, J.M.; Kemeny, N.; Oderman, P.; Botet, J. Long-term hepatic arterial infusion chemotherapy. Anatomic considerations, operative technique, and treatment morbidity. Arch. Surg. 1984, 119, 936–941.
- Curley, S.A.; Chase, J.L.; Roh, M.S.; Hohn, D.C. Technical considerations and complications associated with the placement of 180 implantable hepatic arterial infusion devices. Surgery 1993, 114, 928–935.
- Heinrich, S.; Petrowsky, H.; Schwinnen, I.; Staib-Sebler, E.; Gog, C.; El-Ganainy, A.; Gutt, C.; Müller, H.H.; Lorenz, M. Technical complications of continuous intra-arterial chemotherapy with 5-fluorodeoxyuridine and 5-fluorouracil for colorectal liver metastases. Surgery 2003, 133, 40–48.
- Allen, P.J.; Nissan, A.; Picon, A.I.; Kemeny, N.; Dudrick, P.; Ben-Porat, L.; Espat, J.; Stojadinovic, A.; Cohen, A.M.; Fong, Y.; et al. Technical complications and durability of hepatic artery infusion pumps for unresectable colorectal liver metastases: An institutional experience of 544 consecutive cases. J. Am. Coll. Surg. 2005, 201, 57–65
- Kemeny, N.E.; Niedzwiecki, D.; Hollis, D.R.; Lenz, H.-J.; Warren, R.S.; Naughton, M.J.; Weeks, J.C.; Sigurdson, E.R.; Herndon, J.E., 2nd; Zhang, C.; et al. Hepatic arterial infusion versus systemic therapy for hepatic metastases from colorectal cancer: A randomized trial of efficacy, quality of life, and molecular markers (CALGB 9481). J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2006, 24, 1395–1403.
- Kemeny, M.M.; Battifora, H.; Blayney, D.W.; Cecchi, G.; Goldberg, D.A.; Leong, L.A.; Margolin, K.A.; Terz, J.J. Sclerosing cholangitis after continuous hepatic artery infusion of FUDR. Ann. Surg. 1985, 202, 176–181.
- Kemeny, N.; Daly, J.; Reichman, B.; Geller, N.; Botet, J.; Oderman, P. Intrahepatic or systemic infusion of fluorodeoxyuridine in patients with liver metastases from colorectal carcinoma. A randomized trial. Ann. Intern. Med. 1987, 107, 459–465.
- Chang, A.E.; Schneider, P.D.; Sugarbaker, P.H.; Simpson, C.; Culnane, M.; Steinberg, S.M. A prospective randomized trial of regional versus systemic continuous 5-fluorodeoxyuridine chemotherapy in the treatment of colorectal liver metastases. Ann. Surg. 1987, 206, 685–693.
- Hohn, D.C.; Stagg, R.J.; Friedman, M.A.; Hannigan, J.F.J.; Rayner, A.; Ignoffo, R.J.; Acord, P.; Lewis, B.J. A randomized trial of continuous intravenous versus hepatic intraarterial floxuridine in patients with colorectal cancer metastatic to the liver: The Northern California Oncology Group trial. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1989, 7, 1646–1654.
- Martin, J.K.J.; O’Connell, M.J.; Wieand, H.S.; Fitzgibbons, R.J.J.; Mailliard, J.A.; Rubin, J.; Nagorney, D.M.; Tschetter, L.K.; Krook, J.E. Intra-arterial floxuridine vs systemic fluorouracil for hepatic metastases from colorectal cancer. A randomized trial. Arch. Surg. 1990, 125, 1022–1027.
- Rougier, P.; Laplanche, A.; Huguier, M.; Hay, J.M.; Ollivier, J.M.; Escat, J.; Salmon, R.; Julien, M.; Roullet Audy, J.C.; Gallot, D.; et al. Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: Long-term results of a prospective randomized trial. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 1992, 10, 1112–1118.
- Lorenz, M.; Müller, H.H. Randomized, multicenter trial of fluorouracil plus leucovorin administered either via hepatic arterial or intravenous infusion versus fluorodeoxyuridine administered via hepatic arterial infusion in patients with nonresectable liver metastases from color. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2000, 18, 243–254.
- Kemeny, M.M.; Adak, S.; Gray, B.; Macdonald, J.S.; Smith, T.; Lipsitz, S.; Sigurdson, E.R.; O’Dwyer, P.J.; Benson, A.B., 3rd. Combined-modality treatment for resectable metastatic colorectal carcinoma to the liver: Surgical resection of hepatic metastases in combination with continuous infusion of chemotherapy—An intergroup study. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2002, 20, 1499–1505.
- Martin, R.C.G.; Edwards, M.J.; McMasters, K.M. Morbidity of adjuvant hepatic arterial infusion pump chemotherapy in the management of colorectal cancer metastatic to the liver. Am. J. Surg. 2004, 188, 714–721.
- Ito, K.; Ito, H.; Kemeny, N.E.; Gonen, M.; Allen, P.J.; Paty, P.B.; Fong, Y.; Dematteo, R.P.; Blumgart, L.H.; Jarnagin, W.R.; et al. Biliary sclerosis after hepatic arterial infusion pump chemotherapy for patients with colorectal cancer liver metastasis: Incidence, clinical features, and risk factors. Ann. Surg. Oncol. 2012, 19, 1609–1617.
- Datta, J.; Narayan, R.R.; Kemeny, N.E.; D’Angelica, M.I. Role of Hepatic Artery Infusion Chemotherapy in Treatment of Initially Unresectable Colorectal Liver Metastases: A Review. JAMA Surg. 2019, 154, 768–776.
- Kerr, D.J.; McArdle, C.S.; Ledermann, J.; Taylor, I.; Sherlock, D.J.; Schlag, P.M.; Buckels, J.; Mayer, D.; Cain, D.; Stephens, R.J. Intrahepatic arterial versus intravenous fluorouracil and folinic acid for colorectal cancer liver metastases: A multicentre randomised trial. Lancet 2003, 361, 368–373.
- Cantore, M.; Mambrini, A.; Fiorentini, G.; Rabbi, C.; Zamagni, D.; Caudana, R.; Pennucci, C.; Sanguinetti, F.; Lombardi, M.; Nicoli, N. Phase II study of hepatic intraarterial epirubicin and cisplatin, with systemic 5-fluorouracil in patients with unresectable biliary tract tumors. Cancer 2005, 103, 1402–1407.
- Jarnagin, W.R.; Schwartz, L.H.; Gultekin, D.H.; Gönen, M.; Haviland, D.; Shia, J.; D’Angelica, M.; Fong, Y.; DeMatteo, R.; Tse, A.; et al. Regional chemotherapy for unresectable primary liver cancer: Results of a phase II clinical trial and assessment of DCE-MRI as a biomarker of survival. Ann. Oncol. 2009, 20, 1589–1595.
- Kemeny, N.E.; Schwartz, L.; Gönen, M.; Yopp, A.; Gultekin, D.; D’Angelica, M.; Fong, Y.; Haviland, D.; Gewirtz, A.N.; Allen, P.; et al. Treating primary liver cancer with hepatic arterial infusion of floxuridine and dexamethasone: Does the addition of systemic bevacizumab improve results? Oncology 2011, 80, 153–159.
- Inaba, Y.; Arai, Y.; Yamaura, H.; Sato, Y.; Najima, M.; Aramaki, T.; Sone, M.; Kumada, T.; Tanigawa, N.; Anai, H.; et al. Phase I/II study of hepatic arterial infusion chemotherapy with gemcitabine in patients with unresectable intrahepatic cholangiocarcinoma (JIVROSG-0301). Am. J. Clin. Oncol. Cancer Clin. Trials. 2011, 34, 58–62. [Google Scholar] [CrossRef]
- Ghiringhelli, F.; Lorgis, V.; Vincent, J.; Ladoire, S.; Guiu, B. Hepatic arterial infusion of gemcitabine plus oxaliplatin as second-line treatment for locally advanced intrahepatic cholangiocarcinoma: Preliminary experience. Chemotherapy 2014, 59, 354–360.
- Konstantinidis, I.T.; Koerkamp, B.G.; Do, R.K.G.; Gönen, M.; Fong, Y.; Allen, P.J.; D’Angelica, M.; Kingham, T.P.; DeMatteo, R.P.; Klimstra, D.S.; et al. Unresectable intrahepatic cholangiocarcinoma: Systemic plus hepatic arterial infusion chemotherapy is associated with longer survival in comparison with systemic chemotherapy alone. Cancer 2016, 122, 758–765.
- Higaki, T.; Aramaki, O.; Moriguchi, M.; Nakayama, H.; Midorikawa, Y.; Takayama, T. Arterial infusion of cisplatin plus S-1 against unresectable intrahepatic cholangiocarcinoma. Biosci. Trends. 2018, 12, 73–78.
- Saif, M.W.; Syrigos, K.N.; Katirtzoglou, N.A. S-1: A promising new oral fluoropyrimidine derivative. Expert. Opin. Investig. Drugs 2009, 18, 335–348.