Резюме
Плохо дифференцированные нейроэндокринные опухоли поджелудочной железы (ПДНОЖ) – это подтип рака поджелудочной железы, включающий в себя как мелкоклеточные, так и крупноклеточные подтипы нейроэндокринной карциномы, и характеризуется как отличный с точки зрения биологии и прогноза по сравнению с более распространенной аденокарциномой поджелудочной железы. До недавнего времени данных о геномных особенностях этого типа рака было недостаточно. Мы описываем пациента мужского пола с диагнозом ПДНОЖ и обширным метастатическим поражением печени на момент установления диагноза. Геномный анализ показал патогенный вариант зародышевой линии BRCA2 с соматической потерей гетерозиготности аллеля дикого типа BRCA2. После благоприятного ответа на химиотерапию препаратами платины (и добавления иммунотерапии) пациент получил поддерживающую терапию олапарибом, что привело к дальнейшему уменьшению опухоли на контрольной визуализации (рис. 1). После семнадцати месяцев системного контроля с помощью олапариба у пациента появились симптоматические метастазы в центральной нервной системе, которые скрывали реверсивную мутацию BRCA2. Других локализаций прогрессирования заболевания не наблюдалось. В этой статье мы сообщаем об исключительном результате благодаря применению персонализированного подхода к лечению пациента с панкреатическим ПДНОЖ, основанного на комплексном геномном секвенировании.
Вступление
Нейроэндокринные опухоли поджелудочной железы (НЭО) встречаются с частотой 1,8 на 1 000 000 у женщин и 2,6 на 1 000 000 у мужчин, согласно данным программы Национального института рака по надзорной эпидемиологии и конечных результатов (SEER)1. Всемирная организация здравоохранения (ВОЗ) характеризует ПДНОЖ высоким количеством митозов (>20 митозов/2 мм2) и высоким индексом Ki-67 (обычно >55%) 2. ПДНОЖ является агрессивным раком, часто диагностируется на поздних стадиях и имеет неблагоприятный прогноз 3. В этом случае мы подчеркиваем ценность подхода точной онкологии к лечению пациентов с этим редким типом рака, что приводит к уникально благоприятному результату для этого пациента.
Результаты
Клинический случай
66-летний мужчина обратился с жалобами на усиление боли в животе, вздутие живота, тошноту и усталость. При физикальном обследовании пациент имел плохой внешний вид со склеральной иктеричностью и гепатомегалией. Лабораторные исследования продемонстрировали выраженную печеночную дисфункцию, в частности аланинаминотрансферазу 193 (<55 Ед/л), аспартатаминотрансферазу 123 (<37 Ед/л), щелочную фосфатазу 238 (<130 Ед/л), общий билирубин 5,5 (<1,2 мг/дл) и лактатдегидрогеназу 570 (130-250 Ед/л). Его прошлый анамнез был без особенностей. Семейный анамнез включает карциному неизвестной первичной локализации у матери в возрасте 60 лет, рак предстательной железы у отца в возрасте 85 лет и рак легких у брата в возрасте 68 лет. Пациента госпитализировали для ускоренного обследования и лечения.
Компьютерная томография (КТ) продемонстрировала образование в головке поджелудочной железы с инвазией в верхнюю брыжеечную вену, расширенную аортокавальную аденопатию (рис. 1А), билобарные метастазы в печень, расширение внутрипеченочных желчных протоков и не злокачественный тромб воротной вены (рис. 1Б). Было выполнено эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ), установлены стенты в общий желчный проток и поджелудочную железу. Биопсия печени продемонстрировала низкодифференцированную карциному, опухолевые клетки были положительными на цитокератин (ЦK) 7, синаптофизин и хромогранин, аберрантную потерю экспрессии белков P53 и RB и индекс пролиферации Ki67 90%, что согласуется с диагнозом карциномы поджелудочной железы происхождением ПДНОЖ, без компонента аденокарциномы (рис. 2A-C).
Рис. 1: Компьютерная томография (КТ), демонстрирующая реакцию на терапию.
КТ поджелудочной железы с контрастом. На начальном этапе до лечения на КТ видно образование головки поджелудочной железы (красная стрелка), которое прорастает в верхнюю брыжеечную вену (синяя стрелка) и закупоривает общий желчный проток (зеленая стрелка). Увеличение аортокавальных лимфоузлов (черная стрелка). Через 2 месяца химиотерапии препаратами платины КТ показывает заметное уменьшение опухоли поджелудочной железы (красная стрелка) и аортокавальных лимфоузлов (черная стрелка), а также установление металлического стента общего желчного протока (зеленая стрелка). Через 6 месяцев приема Олапариба КТ демонстрирует дальнейшее уменьшение опухоли поджелудочной железы (красная стрелка) и аортокавальных лимфоузлов (белая стрелка). Через 26 месяцев после установления диагноза КТ демонстрирует продолжающийся ответ на иПАРП в опухоли поджелудочной железы (красная стрелка) и аортокавальных лимфоузлах (белая стрелка). Б КТ печени с контрастом. На начальном этапе КТ до лечения показывает множественные белобарные метастазы в печени (красные стрелки), обычный тромб воротной вены (синие стрелки) и расширенный внутрипеченочный желчный проток (зеленая стрелка). Через 2 месяца химиотерапии препаратами платины на КТ видно рассасывание и заметное уменьшение метастазов в печени (красные стрелки), рассасывание тромба воротной вены и новую пневмобилию (зеленая стрелка) от установки металлического стента общего желчного протока (не показано). Через 6 месяцев лечения олапарибом КТ демонстрирует дальнейшее уменьшение метастазов в печени (красная стрелка). Через 26 месяцев после постановки диагноза КТ демонстрирует продолжающуюся реакцию метастазов в печени (красная стрелка) на иПАРП. *иПАРП – ингибитор поли (АДФ-рибозной) полимеразы.
Рис. 2: Гистологические результаты диагностической биопсии печени, демонстрирующие низкодифференцированную нейроэндокринную карциному.
A Гематоксилин и эозин (Г&Э), увеличение 100х, шкала: 600 мкм, Б Г&Э, увеличение 600×, шкала: 100 мкм). Неопластические клетки экспрессируют ЦК 7, хромогранин и синаптофизин, аберантную потерю экспрессии белков P53 и RB и высокий индекс мечения Ki67 (C 3,3′-диаминобензидин, увеличение 600×, шкала: 100 мкм).
Пациент начал химиотерапию цисплатином и этопозидом, которые вводили на 1-3 день каждые 21 день. В течение двух недель после первого цикла пациент почувствовал заметное симптоматическое улучшение. Улучшились функциональные печеночные пробы. Учитывая то, что пациенту диагноз поставили в возрасте 66 лет, а также семейный анамнез, включающий диагноз рака у его матери в возрасте 60 лет, он согласился пройти тестирование зародышевой линии на наличие патогенного варианта. Патогенный вариант гена BRCA2 в зародышевой линии был идентифицирован, а при соматическом секвенировании метастаза в печени выявлена потеря гетерозиготности (ПГ) аллеля дикого типа BRCA2. Повторная компьютерная томография (КТ), выполненная после трех циклов лечения, продемонстрировала значительный ответ на химиотерапию во всех очагах заболевания (рис.1А, Б). Пациент продолжил химиотерапию платиной/этопозидом в течение трех дополнительных циклов, и хотя это не является рутинной процедурой при внелегочном ПДНОЖ, но экстраполируя данные при немелкоклеточном раке легких, которые демонстрируют улучшение выживаемости при добавлении блокировки иммунных контрольных точек к химиотерапии на основе платины, пациенту был назначен атезолизумаб, добавлялся в течение трех циклов (всего шесть циклов цисплатина и этопозида, с добавлением атезолизумаба в течение последних трех циклов), после чего наблюдался дальнейший радиологический ответ как в первичной опухоли поджелудочной железы, так и в метастазах в печени.
Из-за кумулятивной токсичности, сопровождавшейся усталостью и периферической нейропатией, химиотерапия и иммунотерапия были прекращены. Ингибитор поли (АДФ-рибозной) полимеразы (иПАРП) олапариб был начат на основе мутации BRCA2, экстраполируя непосредственно данные, подтверждающие применение иПАРП в пост-платиновом поддерживающем лечении пациентов с аденокарциномой поджелудочной железы 4, раком яичников 5, раком молочной железы 6,7 и раком предстательной железы 8, имеющих патогенные варианты BRCA в зародышевой линии. Дальнейшие КТ-сканирования показали дальнейшую реакцию опухоли и постоянный контроль заболевания с помощью олапариба (рис. 1А, Б), и пациент сохранял отличное качество жизни (КЖ). Через 17 месяцев у него появилась слабость в левой верхней конечности, нарушение координации и появление случаев потери равновесия и падения. На магнитно-резонансной томографии (МРТ) было обнаружено усиление поражения правой теменной доли с окружающим вазогенным отеком, что соответствует метастазу (дополнительный рис. 1). На повторных томографиях не было выявлено прогрессирования экстракраниального заболевания. После мультидисциплинарного обсуждения пациенту выполнили резекцию этого поражения, и гистологическое исследование подтвердило наличие метастазов из ПДНОЖ. Пациент прошел послеоперационную стереотактическую лучевую терапию участка ложа опухоли. Через восемь недель после завершения облучения у пациента появились новые неврологические симптомы, а на МРТ были обнаружены дуральные метастазы в теменной области. Пациенту выполнили повторную краниотомию, после чего провели лучевую терапию, но, несмотря на эти вмешательства, прогрессирование внутричерепного заболевания продолжалось, без системного рецидива (рис. 1А, Б). Пациент умер через 26 месяцев после установления первичного диагноза.
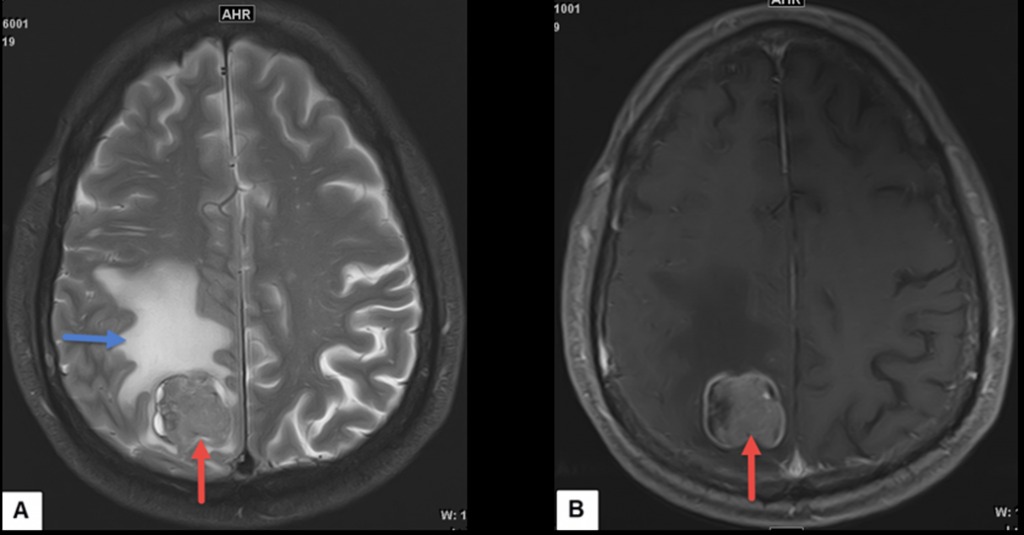
Дополнительный рисунок 1.
Магнитно-резонансная томография головного мозга. A. Т2-взвешенная последовательность показывает метастаз в правой теменной доле (красная стрелка) с выраженным окружающим отеком (синяя стрелка). B. Т1-взвешенная последовательность после контрастирования показывает выраженное увеличение метастаза (красная стрелка).
Геномный анализ
Зародышевая линия и соматическое геномное тестирование были проведены с использованием утвержденного УПМ Мемориала Слоуна Кеттеринга (Memorial Sloan Kettering Integrated Mutation Profiling of Actionable Cancer Targets, MSK-IMPACT) на начальном этапе лечения пациента до начала системной терапии. В дополнение к биаллельной потере функции BRCA2, что соответствует диагнозу ПДНОЖ, опухоль имела биаллельные изменения, затрагивающие TP53 и RB1, гомозиготную делецию CDKN1B и мутацию G12R KRAS (рис. 3). Хотя изменения KRAS и TP53 могут быть связаны с протоковой аденокарциномой поджелудочной железы, в совокупности геномный профиль, а также гистопатологические результаты (рис. 2) соответствовали настоящей высокой степени ПДНОЖ с дефицитом гомологической рекомбинации.
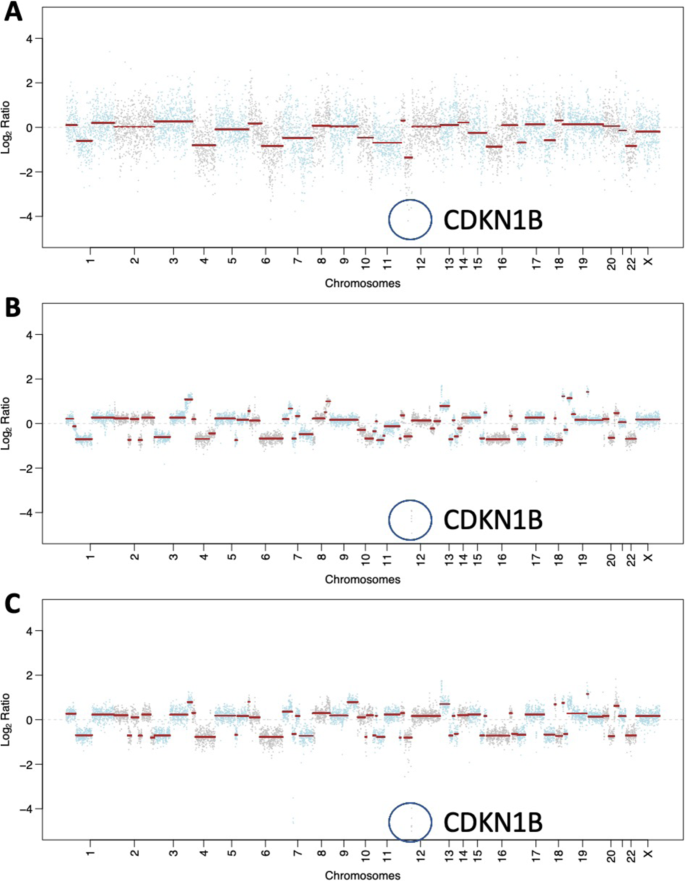
Рис. 3: Соматические мутации и изменения количества копий, полученные с помощью таргетированного панельного секвенирования MSK-IMPACT.
A График количества копий метастазов в печени до лечения. B Диаграмма количества копий метастазов в ЦНС после химиотерапии и резекции олапарибом. C Графики количества копий метастазов в ЦНС после химиотерапии, олапариба и лучевой терапии. В A-C геномный локус CDKN1B выделен синим контуром.
Комплексное секвенирование опухолей обоих резецированных метастазов в ЦНС сравнивали с результатами секвенирования базовой диагностической биопсии печени (рис. 3). Оба образца метастазов головного мозга продемонстрировали наличие структурной перестройки BRCA2, охватывающей локус патогенного изменения зародышевой линии BRCA2, которая не была идентифицирована в образце до лечения. Эта перестройка удалила стоп-кодон, вызванный патогенной мутацией зародышевой линии (рис. 4), и, вероятно, привела к восстановлению гомологической рекомбинационной репарации ДНК и резистентности к олапарибу. Хотя в двух резецированных образцах ЦНС наблюдался схожий спектр геномных изменений, было отмечено очевидное появление разных клонов, хотя эти образцы были получены с разницей лишь в 12 недель (рис. 5).
Рис. 4: Тепловая карта, демонстрирующая выявленные геномные изменения в каждом образце (метастазы в печени до лечения, метастазы в ЦНС после химиотерапии и олапариба, метастазы в ЦНС после системной терапии и лучевой терапии, как обозначено).
Тип альтерации обозначается на цветной тепловой карте с левой стороны панели, а фракция раковых клеток (т.е. доля раковых клеток, содержащих альтерацию) для каждой альтерации обозначается на тепловой карте с правой стороны панели.
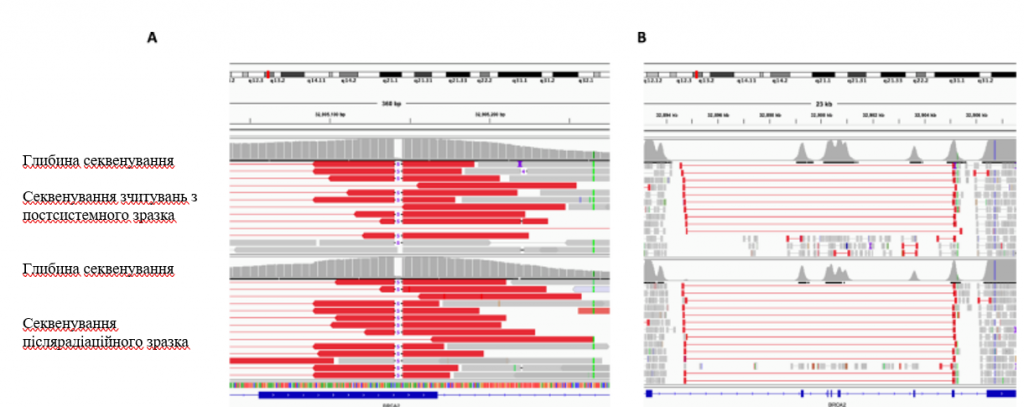
Рис. 5: Скриншот программы Integrative Genomics Viewer (IGV), демонстрирующий перекрытие между реверсионным структурным вариантом и мутацией зародышевой линии в BRCA2.
Тонкие красные линии показывают длину считываний, поддерживающих структурный вариант, а толстые красные линии показывают концы считываний, очерчивающие точки разрыва структурного варианта. Тонкие черные линии с цифрой “5” посередине демонстрируют делецию пары оснований зародышевой линии 5. Гистограммы над считываниями каждого образца показывают глубину секвенирования в этом локусе. A Скриншот IGV, демонстрирующий перекрытие между концом реверсивного структурного варианта и короткой делецией зародышевой линии в образце после системной терапии (вверху) и образце после облучения (внизу). B Скриншот IGV, показывающий область BRCA2, пораженную структурным вариантом, в образце после системной терапии (вверху) и образце после облучения (внизу).
Циркулирующая клеточная ДНК (ктДНК) была оценена во время второго рецидива внутричерепного заболевания и обнаружила изменение ATM p.L695Wfs * s, которое не обнаруживается в образцах опухоли и имеет низкую фракцию аллелей 0,28%, что соответствует клональному гемопоэзу с неопределенным потенциалом 9.
Обсуждение
Лечение ПДНОЖ первой линии традиционно следует за лечением немелкоклеточного рака легких, причем лучшие доказательства подтверждают применение цисплатина и этопозида 10,11. Диагноз ПДНОЖ предполагает неблагоприятный прогноз со средней выживаемостью 5,7 месяцев 12. Включение поддерживающей фазы терапии в парадигмы лечения является предметом исследования для различных типов рака и имеет целью поддержание и/или индукцию регрессии заболевания, при этом, как правило, позволяет деэскалацию или отмену цитотоксической терапии для уменьшения токсичности и максимального улучшения качества жизни. Важными примерами, касающимися этого случая, является лечение распространенного немелкоклеточного рака легких, где международные рекомендации включают ингибиторы иммунных контрольных точек, атезолизумаб или дурвалумаб, в сочетании с химиотерапией, с последующим поддерживающим блокированием контрольных точек без цитотоксической терапии до прогрессирования заболевания, что базируется на двух утвержденных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (УПМ) рекомендациях 13. Кроме того, исследование III фазы Pancreas Olaparib Ongoing (POLO) прояснило подход к лечению распространенной протоковой аденокарциномы поджелудочной железы (РПАП) на основе биомаркеров и ознаменовало потенциальную новую эру точной медицины для этого заболевания 4, продемонстрировав преимущество в выживании без прогрессирования над плацебо при применении поддерживающей терапии олапарибом у пациентов с мутировавшей BRCA1/2 зародышевой линией РПАП и чувствительной к препаратам платины болезнью. Преимущества наблюдались при различных типах опухолей, включая рак яичников 5, молочной железы 6,7 и предстательной железы 8, что привело к регуляторному одобрению иПАРП при этих заболеваниях.
В образцах опухоли этого пациента было обнаружено соматическую BRCA2 ПГ. Предыдущие исследования нашей группы показали, что при РПАП пациенты с биалельными изменениями, затрагивающими гомологичные гены, связанные с репарацией рекомбинационной ДНК (например, BRCA1/2), имеют наибольшую вероятность получить пользу от терапии на основе платины 14,15 и терапии иПАРП 14, при этом часто наблюдается устойчивый ответ. Пациенты с биалельным статусом, как описано в этой статье, ассоциируются с более высоким уровнем ОКМ и имеют COSMIC Signature 3, что является показателями большей геномной нестабильности, которые, вероятно, будут иметь больше шансов получить пользу от иммунотерапии 16,17 в контексте изменений BRCA2 18. Учитывая отличный ответ на химиотерапию препаратами платины и экстраполируя приведенные выше данные с целью персонализации рекомендаций по лечению, мы решили продолжить поддерживающую терапию иПАРП, что позволило достичь длительного периода системного контроля над заболеванием. Учитывая начальный драматический ответ на химиотерапию (и иммунотерапию) препаратами платины, вполне возможно, что реакции заболевания, выявленные при дальнейших визуализациях, были обусловлены только постоянным, исключительным ответом на химиотерапию, а не вторичной реакцией на олапариб. Недавняя серия исследований Symonds и соавт. 19 продемонстрировала превосходный контроль заболевания с помощью олапариба у пациента с ПДНОЖ предстательной железы de novo с потерей BRCA2, опять же, после химиотерапии препаратами платины. В нашем случае, как и в большинстве сценариев, начало лечения ПАРПи пришлось на период ответа на терапию препаратами платины, поэтому окончательное определение того, какой препарат привел к ответу и контролю заболевания, может оказаться непростой задачей.
Этот случай демонстрирует значительную пользу от результатов геномного тестирования для этого пациента. Современные международные руководства, включая руководства Национальной комплексной онкологической сети (NCCN), рекомендуют рассмотреть возможность генетического консультирования и тестирования на наследственные генетические состояния, но не рекомендуют универсальное геномное тестирование для всех пациентов с нейроэндокринными опухолями, в том числе с ПДНОЖ 17. Хотя данные, касающиеся комплексного геномного секвенирования при НОЖ поджелудочной железы, традиционно немногочисленны, ряд недавних серий исследований продемонстрировали выявление увеличения количества изменений в TP53, RB1, APC, KRAS, BRAF 18,19, потерю количества копий в ARID1A, ATM и ESR1, в дополнение к амплификациям/рост в MYC и KDM5A 19. Недавние исследования как панкреатических, так и непанкреатических НОЖ желудочно-кишечного тракта продемонстрировали наличие потенциально активных изменений 19,20. Что касается изменений BRCA, то в одной серии исследований было показано, что 25% пациентов с нейроэндокринным раком предстательной железы имели обнаруженные биаллельные изменения BRCA2 16, что подтверждает критическую необходимость рекомендовать геномное тестирование для выявления потенциально активных мишеней и применимо ко всем типам солидных опухолей. Учитывая эти данные, а также данные по мутированной BRCA аденокарциноме поджелудочной железы, которые демонстрируют прогностическое значение биалельного статуса 14, при выявлении соматических изменений BRCA мы предлагаем рассмотреть возможность как рефлекторного тестирования зародышевой линии, так и определения биалельного/моноалельного статуса. Потенциал комплексного геномного тестирования для предоставления значимых терапевтических преимуществ пациентам может быть недооценен в контексте редких типов рака, для которых было проведено недостаточное количество геномных исследований.
Хотя первоначальное обоснование применения атезолизумаба в этом случае основывалось на экстраполяции данных о выживаемости при немелкоклеточном раке легких 8, наличие мутации BRCA2 дополнительно подтвердило целесообразность его применения. В нашей предыдущей группе пациентов с РПАП и мутациями в генах, связанных с дефицитом гомологичной рекомбинации (HRd), например, BRCA 1/2, пациенты с биаллельным статусом, как описано в этой статье, были связаны с более высокой ОКМ по сравнению с пациентами с моноалельным статусом или статусом дикого типа HRd, а также демонстрировали COSMIC Signature 3, что указывает на большую геномную нестабильность, и, как предполагалось, имели большую вероятность получить положительный результат от иммунотерапии 21, 22 в контексте изменения BRCA2 23. В данном случае, из-за ограниченной области генома, которую охватывало таргетное панельное секвенирование MSK-IMPACT, количество однонуклеотидных вариантов было недостаточным для вычисления мутационных сигнатур COSMIC с заменой одного основания. Оптимальный ОКМ, при котором блокада иммунных контрольных точек приносит пользу при нейроэндокринных опухолях, остается открытым вопросом при отсутствии рандомизированных данных, однако одобрение УПМ на применение пембролизумаба при опухолях с ОКМ > 10 мутаций на мегабазу (Мутс/Мб) на основе KEYNOTE-158 включало пациентов с метастатическими нейроэндокринными опухолями 24. В случае, описанном в этой статье, наблюдался ТМБ 6,2 Mut/Mb.
Через 22 месяца после постановки диагноза у нашего пациента развилась симптоматическая внутричерепная патология, и, несмотря на все усилия с применением мультимодальных подходов, контроля над внутричерепными заболеваниями достичь не удалось. Профилактическое облучение черепа (ПОЧ) не является рутинной рекомендацией в основных международных руководствах по внелегочным нейроэндокринным карциномам, в отличие от распространенного мелкоклеточного рака легких, где ПОЧ рассматривается на основе исследования EORTC, которое продемонстрировало преимущество в выживаемости 25. Наш случай отражает проблему прогрессирования интракраниального заболевания, которая может ограничить выживаемость у пациентов с отличным системным контролем заболевания. В отсутствие рандомизированных данных наш случай поднимает вопрос о том, следует ли рассматривать ПОЧ у отдельных пациентов, у которых сохраняется системный контроль заболевания.
К развитию метастазов в ЦНС в этом случае могли привести несколько потенциальных причинных факторов, которые заслуживают внимания. Во-первых, в данном случае не было проведено базового визуализационного исследования центральной нервной системы для оценки наличия метастазов в головном мозге, поэтому возможно, что скрытые метастазы в головном мозге присутствовали на момент постановки диагноза, хотя на МРТ головного мозга через шесть месяцев после постановки диагноза не было обнаружено никаких внутричерепных аномалий. Во-вторых, наличие мутаций BRCA ассоциируется с большей распространенностью метастазов в ЦНС при раке молочной железы и яичников 26 , хотя это может объясняться несколькими потенциальными факторами, включая увеличение числа тройных негативных подтипов при раке молочной железы, обусловленном BRCA, а также благоприятное выживание в этих подгруппах. Данных о том, существует ли биологическая предрасположенность к метастазированию в ЦНС при BRCA-мутированном раке поджелудочной железы, не хватает. В-третьих, хотя в некоторых доклинических моделях иПАРП приводили к поражению ЦНС 27, другие исследования показали субоптимальную способность препаратов иПАРП – токапариба и талазопариба – проникать через гематоэнцефалический барьер 28,29. Считается, что это частично связано с наличием Р-гликопротеина (P-GP/ABCB1) и белка резистентности к раку молочной железы ( РМЖ), которые функционируют как эффлюксные насосы в гематоэнцефалическом барьере и ограничивают проникновение в ЦНС. Олапариб также является субстратом этих белков 30, и поэтому ЦНС может представлять потенциальное место нахождения в этом контексте. В-четвертых, и, возможно, наиболее лаконичный вывод для этого пациента, развитие метастаза в ЦНС после 22 месяцев устойчивого контроля заболевания лучше всего объясняется развитием обратной мутации (перестройка BRCA2: c.316 + 1367 c.717del, рис. 3 и 4).
Развитие реверсивных мутаций к таргетной терапии, в частности, в BRCA1/2, приводящих к резистентности к иПАРП, описано 31,32 , хотя, насколько нам известно, не в условиях изолированного заболевания ЦНС с постоянным отличным системным контролем 33,34,35,36,37. Преодоление резистентности к таргетной терапии остается сложной задачей. Добавление иммунотерапии к терапии иПАРП исследуется при нескольких злокачественных опухолях (NCT04548752, NCT04493060, NCT0466740), при этом наблюдается положительный эффект, как потенциальная комбинация для преодоления резистентности 38,39. Кроме того, комбинация иПАРП с ингибиторами ДНК-полимеразы θ (Polθ, также известной как POLQ) 40 и ингибиторами атаксии телеангиэктазии и Rad3-родственной (ATR) 41 может составлять стратегию преодоления резистентности, вызванной реверсивными мутациями.
В завершение мы сообщаем об уникальном случае пациента с ПДНОЖ и мутацией зародышевой линии BRCA2, которая имела впечатляющий ответ на химиотерапию на основе платины, после чего наступил период глубокого и длительного контроля заболевания с помощью иПАРП, который в конечном итоге осложнился поздним внутричерепным рецидивом из-за реверсивной мутации. Мы описываем, как широкое секвенирование опухоли выявило, что внутричерепной рецидив, вероятно, является результатом развития реверсионной мутации в условиях длительного применения иПАРП. Этот случай подчеркивает ценность прецизионной терапии, которая может привести к уникально благоприятным результатам для отдельных пациентов, и в этом отношении поддерживает рассмотрение всестороннего геномного профилирования, в том числе в лечении пациентов с редкими типами опухолей, где руководства не обязательно рекомендуют универсальное геномное тестирование. Она также еще раз подчеркивает, что при редких злокачественных опухолях, где не хватает рандомизированных данных, следует рассмотреть возможность экстраполяции парадигм лечения других злокачественных опухолей с общими геномными особенностями. Базовая визуализация ЦНС для оценки наличия внутричерепных метастазов, а ПОЧ также должны рассматриваться в контексте системного контроля заболевания при ПДНОЖ. Наконец, этот случай является прямым доказательством ценности последовательных геномных анализов во время прогрессирования заболевания на фоне таргетной терапии для оценки механизмов резистентности.
Методы
Получение согласия от пациента
Устное согласие на публикацию этого отчета было предоставлено пациентом и его семьей, что задокументировано в медицинской документации.
Этическое одобрение
Этот отчет был рассмотрен руководством Мемориала Слоуна Кеттеринга 19.10.2022 г. (Э.М. О’Рейли взял самоотвод), и работа была признана такой, что не включает исследования на людях, а следовательно, не требует надзора со стороны IRB.
Материалы
Образец метастаза печени был получен с помощью КТ-управляемой пункционной биопсии, а оба метастаза ЦНС были резекционными образцами, взятыми во время хирургического вмешательства. Все образцы опухолей были просмотрены гистопатологом с опытом работы с раком поджелудочной железы в MSK, что подтвердило наличие клеточности опухоли, достаточной для анализа с помощью окраски гематоксилином и эозином из блоков, залитых в формалин, зафиксированных в парафине (ЗФЗП). Для соматического геномного анализа всех образцов ДНК выделяли и очищали, а также проводили секвенирование опухоли и нормальное комплексное мультигенное панельное секвенирование с использованием одобренного УПМ и Департаментом здравоохранения штата Нью-Йорк метода Мемориального интегрированного мутационного профилирования раковых мишеней (MSK-IMPACT), который мы уже описывали ранее 42. Согласие пациента на проведение соматического и геномного анализа зародышевой линии было получено в соответствии с институциональным протоколом IRB 12-245. Соматические однонуклеотидные варианты (СОВ), короткие инсерции и делеции и геномные перестройки были получены из cBioPortal for Cancer Genomics 43. Были получены бинарные файлы и файлы с картированием выравнивания (БКВ), а количество изменений копий (КИК), включая потерю гетерозиготности (ПГ), было рассчитано с помощью программы FACETs 44. БКВ файлы были проверены вручную с помощью программы Integrative Genomics Viewer (IGV) 45 , чтобы показать локус BRCA2, на который повлияла мутация и перестройка зародышевой линии. Мутацию классифицировали как биалельную, если она происходила одновременно с ПГ аллеля дикого типа. Фракцию раковых клеток (ФРК) каждого изменения определяли с помощью программы ABSOLUTE (v1.0.6), при этом растворы ABSOLUTE просматривали вручную. Изменения классифицировали как клональные, если вероятность того, что изменение является клональным, составляла >0,5 или если нижний доверительный интервал (ДИ) составлял >0,9, как рассчитано с помощью ABSOLUTE 46.
Ссылки на источники
- Halfdanarson, T., Rabe, K., Rubin, J. & Petersen, G. Pancreatic neuroendocrine tumors (PNETs): incidence, prognosis and recent trend toward improved survival. Ann. Oncol. 19, 1727–1733 (2008).
- Rindi, G. et al. Overview of the 2022 who classification of neuroendocrine neoplasms. Endocr. Pathol. 33, 115–154 (2022).
- Basturk, O. et al. Poorly differentiated neuroendocrine carcinomas of the pancreas. Am. J. Surgical Pathol. 38, 437–447 (2014).
- Golan, T. et al. Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. N. Engl. J. Med. 381, 317–327 (2019).
- Moore, K. et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N. Engl. J. Med. 379, 2495–2505 (2018).
- Robson, M. et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N. Engl. J. Med. 377, 523–533 (2017).
- Litton, J. et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N. Engl. J. Med. 379, 753–763 (2018).
- Kaufman, B. et al. Olaparib monotherapy in patients with advanced cancer and a germline BRCA1/2 mutation. J. Clin. Oncol. 33, 244–250 (2015).
- Kar, S. et al. Genome-wide analyses of 200,453 individuals yield new insights into the causes and consequences of clonal hematopoiesis. Nat. Genet. 54, 1155–1166 (2022).
- Iwasa, S. et al. Cisplatin and etoposide as first-line chemotherapy for poorly differentiated neuroendocrine carcinoma of the hepatobiliary tract and pancreas. Jpn J. Clin. Oncol. 40, 313–318 (2010).
- Zhang, P. et al. Etoposide and cisplatin versus irinotecan and cisplatin as the first‐line therapy for patients with advanced, poorly differentiated gastroenteropancreatic neuroendocrine carcinoma: a randomized phase 2 study. Cancer 126, 2086–2092 (2020).
- Dasari, A., Mehta, K., Byers, L., Sorbye, H. & Yao, J. Comparative study of lung and extrapulmonary poorly differentiated neuroendocrine carcinomas: a SEER database analysis of 162,983 cases. Cancer 124, 807–815 (2017).
- Mathieu, L. et al. FDA approval summary: atezolizumab and durvalumab in combination with platinum-based chemotherapy in extensive stage small cell lung cancer. Oncologist 26, 433–438 (2021).
- Momtaz, P. et al. Pancreas cancer and BRCA: a critical subset of patients with improving therapeutic outcomes. Cancer 127, 4393–4402 (2021).
- Park, W. et al. Genomic methods identify homologous recombination deficiency in pancreas adenocarcinoma and optimize treatment selection. Clin. Cancer Res. 26, 3239–3247 (2020).
- Symonds, L. et al. BRCA2 alterations in neuroendocrine/small-cell carcinoma prostate cancer: a case series. JCO Precis. Oncol. 6, e2200091 (2022).
- Shah, M. et al. NCCN guidelines® updates: neuroendocrine and adrenal tumors. J. Natl Compr. Cancer Netw. 19, 839–868 (2022).
- Yachida, S. et al. Comprehensive genomic profiling of neuroendocrine carcinomas of the gastrointestinal system. Cancer Discov. 12, 692–711 (2022).
- Venizelos, A. et al. The molecular characteristics of high-grade gastroenteropancreatic neuroendocrine neoplasms. Endocr.-Relat. Cancer 29, 1–14 (2022).
- Wu, H. et al. Genomic characterization reveals distinct mutation landscapes and therapeutic implications in neuroendocrine carcinomas of the gastrointestinal tract. Cancer Commun. 42, 1367–1386 (2022).
- Connor, A. et al. Association of distinct mutational signatures with correlates of increased immune activity in pancreatic ductal adenocarcinoma. JAMA Oncol. 3, 774 (2017).
- Seeber, A. et al. Molecular characteristics of BRCA1/2 and PALB2 mutations in pancreatic ductal adenocarcinoma. ESMO Open 5, e000942 (2020).
- Samstein, R. et al. Mutations in BRCA1 and BRCA2 differentially affect the tumor microenvironment and response to checkpoint blockade immunotherapy. Nat. Cancer 1, 1188–1203 (2020).
- Marabelle, A. et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 keynote-158 study. Lancet Oncol. 21, 1353–1365, https://doi.org/10.1016/s1470-2045(20)30445-9 (2020).
- Slotman, B. et al. Prophylactic cranial irradiation in extensive small-cell lung cancer. N. Engl. J. Med. 357, 664–672 (2007).
- Szarszewska, M. et al. Significance of BRCA1 expression in breast and ovarian cancer patients with brain metastasis: a multicentre study. Adv. Med. Sci. 64, 235–240 (2019).
- McEllin, B. et al. PTEN loss compromises homologous recombination repair in astrocytes: implications for glioblastoma therapy with temozolomide or Poly(ADP-Ribose) polymerase inhibitors. Cancer Res. 70, 5457–5464 (2010).
- Durmus, S. et al. Breast cancer resistance protein (BCRP/ABCG2) and P-glycoprotein (P-GP/ABCB1) restrict oral availability and brain accumulation of the PARP inhibitor rucaparib (AG-014699). Pharm. Res. 32, 37–46 (2014).
- Kizilbash, S. et al. Restricted delivery of talazoparib across the blood–brain barrier limits the sensitizing effects of parp inhibition on temozolomide therapy in glioblastoma. Mol. Cancer Therapeutics 16, 2735–2746 (2017).
- Sun, K. et al. A comparative pharmacokinetic study of PARP inhibitors demonstrates favorable properties for niraparib efficacy in preclinical tumor models. Oncotarget 9, 37080–37096 (2018).
- Edwards, S. et al. Resistance to therapy caused by intragenic deletion in BRCA2. Nature 451, 1111–1115 (2008).
- Sakai, W. et al. Secondary mutations as a mechanism of cisplatin resistance in BRCA2-mutated cancers. Nature 451, 1116–1120 (2008).
- Ganesan, S. Tumor suppressor tolerance: reversion mutations in BRCA1 and BRCA2 and resistance to PARP inhibitors and platinum. JCO Precis. Oncol. 1–4 https://doi.org/10.1200/po.18.00001 (2018).
- Banda, K., Swisher, E., Wu, D., Pritchard, C. & Gadi, V. Somatic reversion of germline BRCA2 mutation confers resistance to poly(ADP-ribose) polymerase inhibitor therapy. JCO Precis. Oncol. 1–6 https://doi.org/10.1200/po.17.00044 (2018).
- Carneiro, B. et al. Acquired resistance to poly (ADP-ribose) polymerase inhibitor olaparib in BRCA2-associated prostate cancer resulting from biallelic BRCA2 reversion mutations restores both germline and somatic loss-of-function mutations. JCO Precis. Oncol. 1–8 https://doi.org/10.1200/po.17.00176 (2018).
- Cheng, H., Salipante, S., Nelson, P., Montgomery, B. & Pritchard, C. Polyclonal BRCA2 Reversion Mutations Detected in Circulating Tumor DNA After Platinum Chemotherapy in a Patient With Metastatic Prostate Cancer. JCO Precision Oncology 1–5 https://doi.org/10.1200/po.17.00169 (2018).
- Weigelt, B. et al. Diverse BRCA1 and BRCA2 Reversion Mutations in Circulating Cell-Free DNA of Therapy-Resistant Breast or Ovarian Cancer. Clin. Cancer Res. 23, 6708–6720 (2017).
- Domchek, S. et al. Olaparib and durvalumab in patients with germline BRCA-mutated metastatic breast cancer (MEDIOLA): an open-label, multicentre, phase 1/2, basket study. Lancet Oncol. 21, 1155–1164 (2020).
- Drew, Y. et al. Phase II study of olaparib + durvalumab (MEDIOLA): Updated results in germline BRCA-mutated platinum-sensitive relapsed (PSR) ovarian cancer (OC). Ann. Oncol. 30, v485–v486 (2019).
- Zatreanu, D. et al. Polθ inhibitors elicit BRCA-gene synthetic lethality and target PARP inhibitor resistance. Nat. Commun. 12, 3636 (2021).
- Kim, H. et al. Combining PARP with ATR inhibition overcomes PARP inhibitor and platinum resistance in ovarian cancer models. Nat. Commun. 11, 3726 (2020).
- Cheng, D. et al. Memorial Sloan Kettering-Integrated Mutation Profiling of Actionable Cancer Targets (MSK-IMPACT). J. Mol. Diagnostics 17, 251–264 (2015).
- Gao, J. et al. Integrative Analysis of Complex Cancer Genomics and Clinical Profiles Using the cBioPortal. Sci. Signal. 6, pl1 (2013).
- Shen, R. & Seshan, V. FACETS: allele-specific copy number and clonal heterogeneity analysis tool for high-throughput DNA sequencing. Nucleic Acids Res. 44, e131–e131 (2016).
- Robinson, J. et al. Integrative genomics viewer. Nat. Biotechnol. 29, 24–26 (2011).
- Carter, S. L. et al. Absolute quantification of somatic DNA alterations in human cancer. Nat. Biotechnol. 30, 413–421 (2012).