Авторы: P. Anfelter, A. Testa, V. Chiappa, W. Froyman, R. Fruscio, S. Guerriero, J. L. Alcazar, F. Mascillini, M. A. Pascual, M. Sibal, L. Savelli, G. F. Zannoni, D. Timmerman, E. Epstein
Содержание:
- Введение
- Методы
- Результаты
- Обсуждение
Введение
- Цель
Злокачественные опухоли желточного мешка (ОЖМ) встречаются редко, и данных об их морфологическом проявлении при ультразвуковом исследовании мало. Целью этого исследования было описать признаки злокачественных ОЖМ яичников (опухоли эндодермального синуса) с помощью полутонового и цветного допплеровского ультразвукового исследования, чтобы облегчить их предоперационную диагностику и определить, имеют ли эти опухоли особый вид.
- Основы
Эпидемиология
Опухоли яичников обычно классифицируются как эпителиальные, неэпителиальные или метастатические опухоли от другого первичного злокачественного новообразования.
Опухоли зародышевых клеток представляют собой подгруппу в неэпителиальной группе и составляют около 15–20% всех опухолей яичников. Самая распространенная опухоль среди опухолей половых клеток – это доброкачественная зрелая тератома.
Опухоли эндодермального синуса, чаще называемые ОЖМ, также являются опухолями половых клеток, но являются редкими и злокачественными. Другие опухоли половых клеток – это дисгерминома, незрелая злокачественная тератома, хориокарцинома и эмбриональная карцинома.
ОЖМ происходят из внеэмбриональных типов клеток и составляют около 1% всех злокачественных новообразований яичников. Средний возраст при обращении составляет 18-25 лет, опухоль редко бывает двусторонней, и большинство опухолей обнаруживается на ранней стадии. ОЖМ могут возникать и лечиться во время беременности.
ОЖМ яичников появляются как в чистом виде, так и как часть смешанной герминогенной опухоли. В недавней серии случаев 51% (129/251) ОЖМ были представлены в чистом виде, а остальные были смешанными.
По определению, смешанные зародышевые опухоли состоят из двух или более типов злокачественных компонентов зародышевых клеток. Наиболее распространена смесь дисгерминомы и ОЖМ; другими известными ассоциациями являются эмбриональная карцинома, хориокарцинома или незрелая тератома. Следовательно, в патологическом отчете эти случаи следует обозначать как смешанные зародышевые опухоли, описывая степень и процент всех наблюдаемых компонентов зародышевых клеток.
Микроскопия
Гистологически ОЖМ многогранна с множеством особенностей. Наиболее характерной гистологической особенностью ОЖМ является ретикулярная клубочко-подобная структура, которая заставила Шиллера описать опухоли в 1939 г. как имеющие мезонефрическое происхождение. В 1959 г. Teilum пересмотрел это описание и установил его внезародышевое происхождение из зародышевых клеток. Teilum назвал опухоли опухолями эндодермального синуса из-за их сходства с эндодермальными синусами в плаценте крысы. Позже был принят термин ОЖМ, и оба термина до сих пор широко используются.
Сходство ОЖМ с эндодермальными синусами связано с наличием структур, называемых тельцами Шиллера – Дюваля, которые состоят из выстланных центральных кровеносных сосудов слоем кубовидных или столбчатых клеток.
Тельца Шиллера – Дюваля представляют собой поперечные сечения папиллярных образований в ретикулярном лабиринте (рис. 1). Тельца Шиллера – Дюваля, если они присутствуют, являются диагностическим признаком ОЖМ, но обнаруживается, что они являются преобладающим компонентом только в 20% случаев. Когда сетчатый, клубочкообразный узор сливается, его межпапиллярные пространства могут создавать микрокистозный вид. Заметные внутриклеточные и внеклеточные капли гиалина присутствуют во всех опухолях. Гистологическое разнообразие ОЖМ иногда может затруднить их диагностику, поскольку они могут имитировать другие опухоли, такие как гепатоидная карцинома и светлоклеточная карцинома.
Рисунок 1: Гистологические срезы опухоли желточного мешка, показывающие обзор ретикулярной структуры с множественными тельцами Шиллера-Дюваля (а) и крупным планом тельца Шиллера-Дюваля (стрелка) (б).
Макроскопия
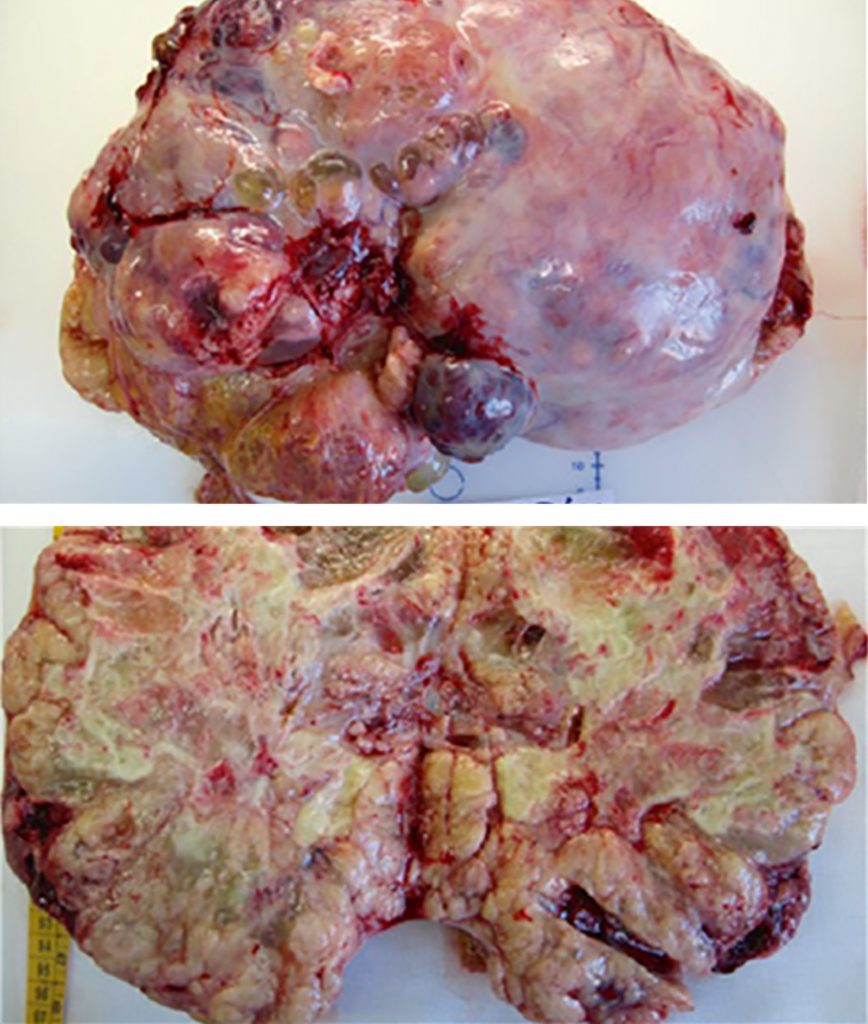
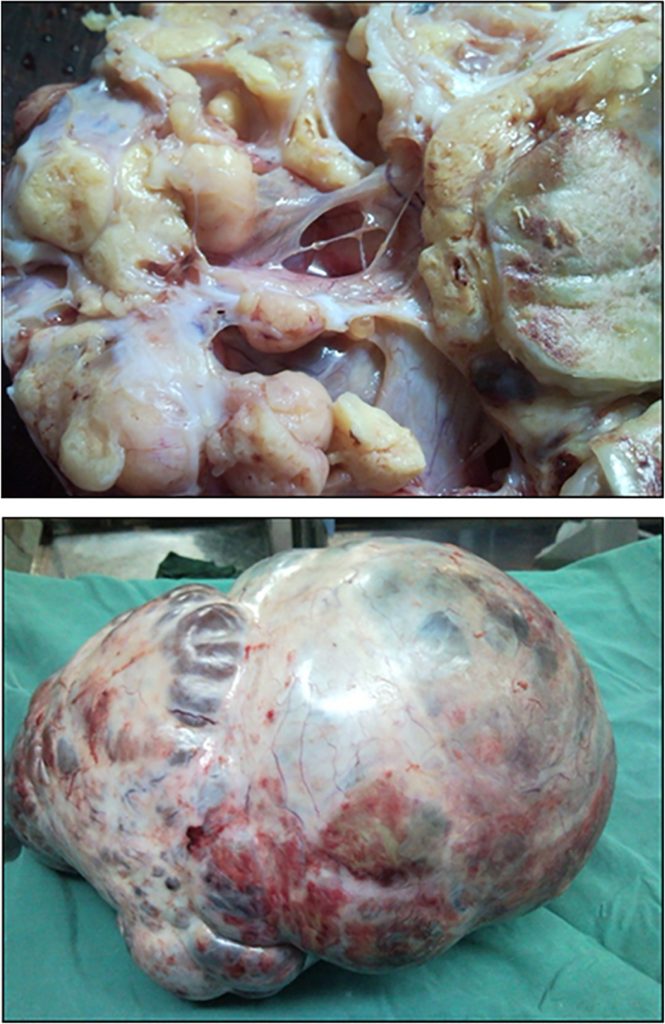
Размеры ОЖМ яичников варьируют от 5 до 50 см³. Наружная поверхность опухоли кажется гладкой и блестящей, с разрезом от желтовато-коричневого до желто-серого. ОЖМ – это в основном солидные опухоли с кистозными компонентами, и эти кистозные компоненты имеют диаметр от нескольких мм до 2 см (Рис. 2 и 3). Иногда наблюдается более крупное кистозное перерождение, состоящее из кровоизлияния и некроза.
Рисунок 2: Общий вид солидной опухоли желточного мешка яичника.
Рисунок 3: Макро вид мультилокуляной солидной опухоли желточного мешка яичника.
Клинические особенности и прогноз
Наиболее частым симптомом ОЖМ яичников является боль в животе с последующим увеличением живота. Продолжительность симптомов часто бывает короткой из-за быстрого роста. Около 10% пациентов поступают с острым животом в результате перекрута, кровотечения или разрыва опухоли.
Другими симптомами могут быть жар, аномальное вагинальное кровотечение или асцит. Сывороточный AFP (S-AFP) является полезным маркером, поскольку повышенные уровни S-AFP присутствуют почти в 100% случаев, хотя повышенные уровни могут также присутствовать в других опухолях зародышевых клеток. Более того, уровни S-AFP может использоваться для оценки эффекта лечения и выявления рецидива. Также может присутствовать повышенный уровень СА 125 (S-СА 125) в сыворотке.
Несмотря на высокую злокачественность, ОЖМ эффективно лечатся комбинацией хирургического вмешательства и химиотерапии. До введения платиновой терапии прогноз был пессимистичным: 3-летняя выживаемость составляла 13%. Современные схемы лечения BEP (блеомицин, этопозид, цисплатин) улучшили 5-летнюю выживаемость у женщин с ОЖМ до нынешних показателей 94,8%, 97,1%, 70,9% и 51,6% по данным Международной федерации гинекологии и акушерства (FIGO) опухолей I, II, III и IV стадии соответственно.
Методы
Сотрудники IOTA (International Ovarian Tumor Analysis) были приглашены принять участие в этом ретроспективном исследовании. Мы извлекли случаи с гистологическим диагнозом ОЖМ яичников из базы данных IOTA и попросили центры предоставить изображения и дополнительные клинические и сонографические данные. Мы также попросили сотрудников IOTA выполнить поиск в своих файлах пациентов, на локальных рабочих станциях с изображениями и в системах архивирования и передачи изображений (PAC) на предмет дополнительных случаев. Критерии включения: предоперационное трансвагинальное УЗИ с подробной документацией в виде архивных изображений, видеороликов или подробного отчета УЗИ. Десять центров УЗИ внесли в исследование 21 случай: Болонья (n = 3); Барселона (n = 3); Рим (n = 3); Монца (n = 3); Милан (Национальный институт рака; n = 1); Бангалор (n = 2); Кальяри (n = 1); Левен (n = 1); Наварра (n = 2); и Стокгольм (n = 2). Женщин из исследований IOTA обследовали в период с 1999 по 2016 год, а женщин, исследованных вне протокола IOTA, обследовали в период с 2007 по 2017 год.
Все пациенты были обследованы до операции с помощью трансвагинального ультразвукового исследования (при необходимости дополненного трансабдоминальным сканированием) с использованием стандартной методики исследования. Все специалисты по ультразвуковому обследованию имели опыт работы в гинекологической ультразвуковой диагностике более 10 лет, и обследования проводились с использованием высококачественного ультразвукового оборудования. Частота внутривагинальных датчиков варьировала от 5,0 до 9,0 МГц, а частота абдоминальных датчиков – от 3,5 до 9,0 МГц.
Были зарегистрированы окончательная гистология, степень опухоли и стадия FIGO. Кроме того, мы попросили исследователей сообщить о онкомаркерах (S-CA 125, S-AFP и β-хорионический гонадотропин человека (β-ХГЧ)) во время постановки диагноза, если они будут проанализированы. Новообразования были описаны с использованием терминов и определений, опубликованных консорциумом IOTA.
Васкуляризация опухолей с помощью цветного допплера описывалась с использованием цветовой шкалы IOTA:
- кровоток не обнаруживается (1);
- минимальный кровоток (2);
- умеренный кровоток (3);
- обильный кровоток (4).
В случаях с двусторонними опухолями, в соответствии с терминами и определениями IOTA, включалась только самая большая опухоль (если она похожа по внешнему виду) или опухоль с наиболее развитой патологией. Был записан конкретный диагноз, предложенный первоначальным исследователем УЗИ в базе данных IOTA или в исходном отчете УЗИ.
Результаты
21 пациентка с гистологическим диагнозом ОЖМ яичников была идентифицирована и включена в это исследование. Все случаи были чистыми ОЖМ, за исключением одного (20/21), который представлял собой смешанную опухоль из зародышевых клеток, состоящую из 80% ОЖМ и 20% эмбриональной карциномы. 10 (48%) пациенток ранее были включены в исследования IOTA, а остальные 11 были идентифицированы из местных клинических баз данных и баз данных изображений.
Средний возраст составлял 25,0 (IQR, 19,5–30,5) лет, 76% (16/21) женщин были нерожавшими и 76% (16/21) имели опухоль I – II стадии по классификации FIGO.
Уровень S-AFP был повышен в 95% случаев, а уровень S-CA 125 был повышен в 75% случаев. Уровень β-ХГЧ был измерен в 11 случаях и не был повышен ни в одном из них. У одной женщины в анамнезе была серозная пограничная опухоль яичников.
Обзор ультразвуковых характеристик показан в таблице 1.
| Характеристика | Значение |
| Первичный осмотр | |
| Боль при осмотре | 11/19 (58) |
| Наибольший диаметр опухоли (мм) | 157 (107–181) |
| Максимальный диаметр твердого компонента (мм) | 110 (66–159) |
| Односторонний | 20 (95) |
| Тип опухоли | |
|
|
|
|
| Количество локул | |
|
5 (24) |
|
5 (24) |
|
11 (52) |
| Папиллярные выросты | 2 (10) |
| Неровное поражение | 19 (90) |
| Эхогенность жидкости | |
|
5 (24) |
|
6 (29) |
|
2 (10) |
|
4 (19) |
|
4 (19) |
| Цветовая гамма | |
|
1 (5) |
|
0 (0) |
|
10 (48) |
|
10 (48) |
| Знак полумесяца яичника | 1 (5) |
| Затенение | 0 (0) |
| Асцит | 8 (38) |
| Видны метастазы | 3 (14) |
| Диагноз, предложенный врачом УЗИ | |
|
0 (0) |
|
1 (5) |
|
0 (0) |
|
5 (24) |
|
15 (71) |
| Обзор изображений и видеороликов | |
| Гиперэхогенно-солидная ткань | |
|
16/18 (89) |
|
2/18 (11) |
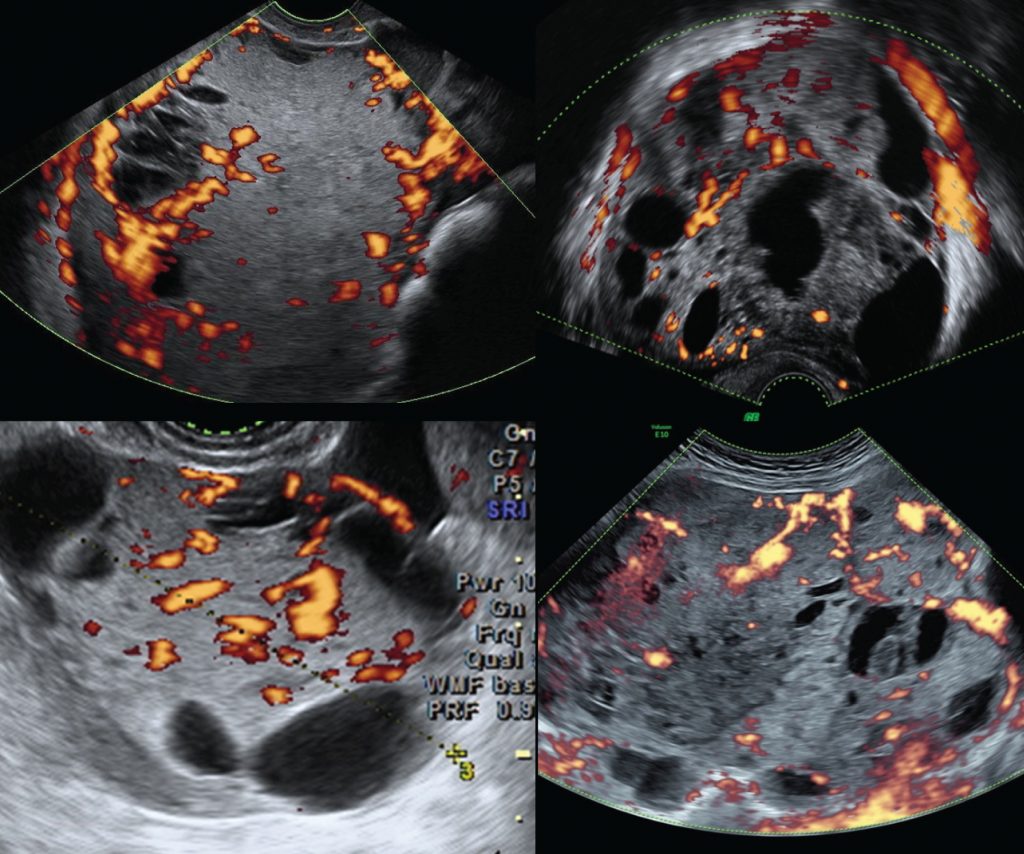
Рисунок 4: Типичные результаты цветного допплера для четырех различных опухолей желточного мешка яичника.
18 случаев с изображениями и / или видеоклипами достаточного качества были повторно оценены субъективно двумя наблюдателями (P.A. и E.E.). Два наблюдателя, которые оценивали ультразвуковые изображения согласились со следующим описанием:
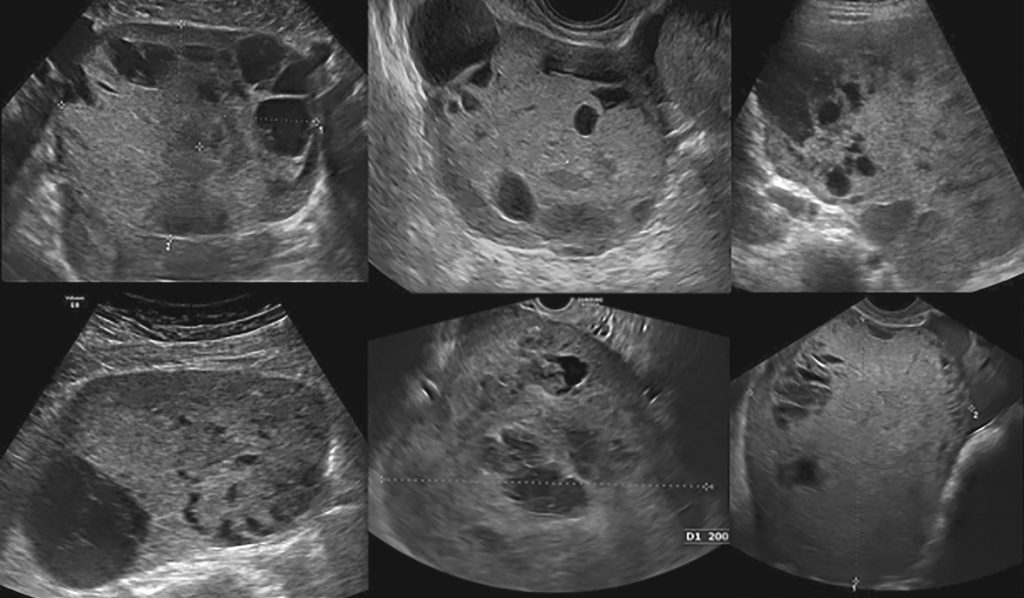
“Опухоли были классифицированы как солидные (рисунки 2 и 5) или мультилокулярно-солидные (рисунки 3 и 6). Большинство (16/18; 89%) опухолей имели негомогенную, но все же мелкозернистую и слегка гиперэхогенную твердую ткань; в солидных опухолях это привело к появлению лунной поверхности.”
Ультразвуковые изображения двух случаев с сосочковыми проекциями показаны на Рисунке 7. Два случая без гиперэхогенной твердой ткани были мультилокулярными солидными опухолями с> 10 локулами (Рисунок 8). Мультилокулярные солидные опухоли напоминали другие типы мультлокулярных солидных опухолей, например, гранулезно-клеточную опухоль с видом швейцарского сыра.
Рисунок 5: Ультразвуковые изображения шести различных солидных опухолей желточного мешка яичника.
Рисунок 6: Ультразвуковые изображения шести различных мультилокулярно-солидных опухолей желточного мешка яичника.
Рисунок 7: Ультразвуковые изображения двух опухолей желточного мешка яичника с сосочковыми выступами.
Рисунок 8: Ультразвуковые изображения двух опухолей желточного мешка яичника без гиперэхогенной твердой ткани.
Обсуждение
На УЗИ злокачественные ОЖМ яичников представляют собой односторонние, большие, хорошо васкуляризованные, многоточечные, твердые или солидные поражения.
Насколько нам известно, это первое исследование, описывающее трансвагинальное сонографическое проявление ОЖМ. Сильной стороной этого исследования является то, что все, кроме одного случая, имели чистый ОЖМ, что делает наши сонографические данные репрезентативными для этого конкретного гистологического объекта. Ограничениями являются небольшой размер выборки, ретроспективный дизайн исследования и в некоторых случаях отсутствие изображений оптимального качества. Эти факты могли ограничивать возможность описания всех вариаций и особенностей ОЖМ, что в некоторых случаях также приводило к отсутствию клинической информации о S-AFP и S-CA 125.
В этой серии, по сравнению с предыдущими исследованиями, возраст (медиана, 25 лет против 18-25 лет) и частота опухолей стадии I – II по FIGO (76% против 38-70%) были в верхнем диапазоне. Одним из объяснений немного более высокого среднего возраста в этой серии может быть то, что ОЖМ часто присутствуют в педиатрической популяции и управляются педиатрами, при этом трансвагинальное ультразвуковое исследование обычно не проводится, хотя трансректальное ультразвуковое исследование может быть ценным вариантом.
Значительно повышенные уровни S-AFP (медиана, 4755 мкг / л) и S-CA 125 (медиана, 126 kU / л) в этом исследовании согласуются с результатами других исследований. Большинство пациентов сообщали о боли во время обследования. Боль, вероятно, вызвана либо быстрым ростом опухоли, приводящим к некрозу, либо большим размером опухоли.
Мы знаем, что ОЖМ могут присутствовать вместе с другими доброкачественными или злокачественными опухолями зародышевых клеток в смешанной форме примерно в 50% случаев. Ультразвуковые характеристики чистых ОЖМ могут не совпадать с ультразвуковыми характеристиками смешанных ОЖМ.
Сочетание сонографических характеристик с клинической информацией (например, возрастом, симптомами) и онкомаркерами может дать ключ к наиболее вероятному диагнозу. Сонографический вид может определять, какие опухолевые маркеры следует оценивать, чтобы отличить неэпителиальные опухоли от эпителиальных, а также подсказывать конкретный диагноз; например, дисгерминомы могут проявляться повышенным уровнем ЛДГ и β-ХГЧ, опухолями гранулезных клеток с повышенным уровнем эстрогена и ингибина, опухолями клеток Сертоли-Лейдига с повышенным уровнем тестостерона или андостендиона, незрелой тератомой с повышенным уровнем АФП и СА 19-920 и ОЖМ с повышенным уровнем АФП.