Авторы: Gregor S. Zimmermann, Alexander A. Fingerle, Bernhard Renger, Karl-Ludwig Laugwitz, Hubert Hautmann, Andreas Sauter, Felix Meurer, Florian Tilman Gassert, Jannis Bodden, Christina Müller-Leisse, Martin Renz, Ernst J. Rummeny, Marcus R. Makowski, Konstantin Willer, Wolfgang Noichl, Fabio De Marco, Manuela Frank, Theresa Urban, Rafael C. Schick, Julia Herzen, Thomas Koehler, Bernhard Haller, Daniela Pfeiffer & Franz Pfeiffer
Аннотация
Предпосылки
Спирометрия и обычная рентгенография грудной клетки имеют ограничения в исследовании ранней эмфиземы, тогда как компьютерная томография, эталонный метод визуализации в этом контексте, не является частью рутинного ухода за пациентами из-за высокой дозы облучения. В этой работе мы исследовали новый низкодозовый метод визуализации – темнопольную рентгенографию грудной клетки – для оценки эмфиземы у пациентов с дефицитом альфа-1-антитрипсина.
Методы
Используя волновые свойства рентгеновских лучей для формирования контраста, темнопольная рентгенография грудной клетки визуализирует структурную целостность альвеол, представленную затемнением над легкими на темнопольном изображении. Мы обследовали четырех пациентов с дефицитом альфа-1-антитрипсина с помощью нового прототипа темнопольного рентгеновского аппарата и одновременного проведения обычной рентгенографии грудной клетки. Степень нарушения легочной функции оценивали с помощью измерения функции легких, а региональное распределение эмфиземы сравнивали с данными КТ у одного пациента.
Результаты
Мы показали, что темнопольная рентгенография грудной клетки визуализирует степень эмфиземы легких, отражая тяжесть и региональные различия. Участки с низким затемнением на темном поле коррелируют с эмфизематозными изменениями, выявленными с помощью компьютерной томографии с порогом -950 единиц Хаунсфилда. Параметры дыхательных путей, полученные с помощью плетизмографии всего тела, и диффузионная способность легких за один вдох по отношению к монооксиду углерода продемонстрировали типичные изменения при прогрессирующей эмфиземе.
Выводы
Темнопольная рентгенография грудной клетки непосредственно визуализирует тяжесть и региональное распределение эмфиземы легких по сравнению с обычной рентгенографией грудной клетки у пациентов с дефицитом альфа-1-антитрипсина. Благодаря сверхнизкой дозе облучения по сравнению с компьютерной томографией, темнопольная рентгенография грудной клетки может быть полезной для длительного наблюдения за этими пациентами.
Основные тезисы
- Темнопольная рентгенография грудной клетки (РГК) визуализирует тяжесть легочной эмфиземы при дефиците альфа-1-антитрипсина.
- Темнопольная РГК визуализирует региональное распределение эмфиземы при низких дозах облучения.
- Темнопольная РГК предоставляет дополнительную информацию об ультраструктуре легких.
- Темнопольная РГК может дополнять обычную РГК и компьютерную томографию грудной клетки.
Предпосылки
Дефицит альфа-1-антитрипсина (ААТД) является одним из самых распространенных генетических нарушений при респираторных заболеваниях. Это аутосомно-рецессивное заболевание связано с повышенным риском развития эмфиземы легких и заболеваний печени [1].
Вследствие генетически обусловленной дисфункции антитрипсина возникает обструктивное заболевание легких, которое характеризуется эмфиземой с необратимым разрушением стенок альвеол и расширением дистальных воздушных пространств, что приводит к прогрессирующей потере функции легких с ограничением толерантности к физической нагрузке, качества жизни и продолжительности жизни [1]. Классическим фенотипом у пациентов с ААТД является базальная панлобулярная эмфизема [1]. Многие больные остаются недиагностированными, или точный диагноз задерживается на многие годы. Во многих случаях диагноз ААТД не устанавливается до стадии, когда эмфизема уже прогрессирует и происходит необратимая потеря легочной функции. Стратифицированные меры скрининга этого заболевания еще не установлены в большинстве стран.
Обычная рентгенография органов грудной клетки (РГК) имеет ограниченное применение как инструмент скрининга эмфиземы, поскольку можно наблюдать только косвенные признаки эмфиземы, которые обычно появляются только на поздних стадиях заболевания. Раннее выявление, оценка регионального распространения и количественная оценка эмфиземы не могут быть достигнуты с помощью обычной рентгенографии грудной клетки [2,3,4]. Поэтому компьютерная томография (КТ) в течение многих лет стала эталонным стандартом для визуализации эмфиземы. На КТ-сканах эмфизема характеризуется аномально низким ослаблением легочной паренхимы, а ее локальное распределение можно оценить визуально или с помощью денситометрии [5,6,7].
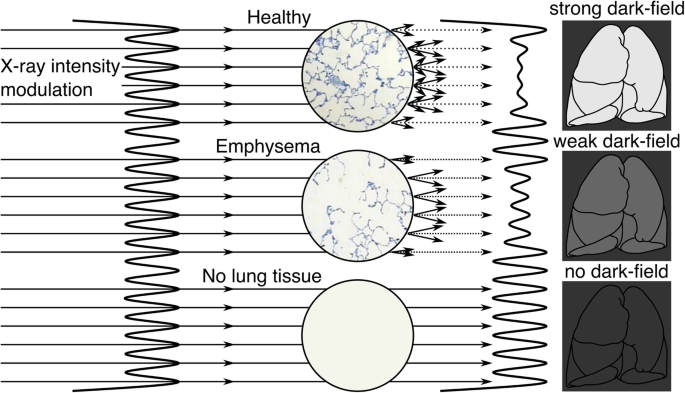
Различные программные приложения предлагают количественную оценку эмфиземы на основе КТ грудной клетки с помощью порогового метода [6, 8, 9]. Эта количественная оценка на основе КТ может быть использована у пациентов с ААТД как продольный параметр [10]. Однако, по сравнению с обычной РГК, КТ подвергает пациента значительно большей дозе облучения (обычно 2-7 мЗв для проведения КТ грудной клетки по сравнению с менее чем 0,05 мЗв для РГК в общем). Таким образом, КТ в настоящее время подходит только как процедура визуализации, основанная на оценке риска, и не подходит как общий метод скрининга [11, 12]. Следовательно, существует высокая потребность в чувствительной технологии визуализации, которая бы позволила раннее выявление и длительное наблюдение эмфиземы, не подвергая пациентов высокой дозе облучения, возникающей при КТ. За последнее десятилетие была разработана новая технология рентгеновской визуализации – темнопольная рентгенография, которая предоставляет информацию о микроструктурной целостности легких [13, 14]. Прокладывая путь к клиническому применению, основной принцип базируется на трехградусном интерферометре для рентгеновских лучей, представленном Пфайффером и др. [15], что позволяет использовать обычные источники рентгеновского излучения [15]. В обычной рентгеновской или компьютерной томографии контрастность изображения основывается исключительно на ослаблении рентгеновского луча при прохождении через объект. Однако темнопольная рентгеновская визуализация использует волновые свойства рентгеновских лучей для формирования контраста путем визуализации малоуглового рассеивания, происходящего на границе раздела, например, между воздухом и тканью в легочных альвеолах или между костью и костным мозгом в трабекулярной кости. С увеличением количества границ раздела происходит больше малоуглового рассеивания, что приводит к более высокому сигналу на темном поле. Принцип формирования контраста при темнопольной рентгенографии грудной клетки изображен на рис. 1.
рис. 1
Принцип формирования контраста при темнопольной рентгенографии грудной клетки. Решетчатый интерферометр генерирует тонкую модуляцию интенсивности (перпендикулярную к направлению луча) на фронте распространяющейся рентгеновской волны. Проникая в области с микроскопическими поверхностями раздела между материалами с разными показателями преломления, эта картина интенсивности искажается в результате многократного преломления. Интенсивность темнопольного сигнала кодируется в уменьшении амплитуды изображения (пограничная контрастность). Здоровая легочная паренхима, состоящая из многих присущих ей поверхностей раздела (воздух и ткань), индуцирует сильное малоугловое рассеивание, что приводит к появлению четкого темнопольного сигнала. Напротив, эмфизематозные участки, где дыхательная поверхность уменьшена или уже полностью исчезла, имеют меньшую активность рассеивания или вообще не рассеивают, что приводит к уменьшению или нулевому темнопольному сигналу.
Интактная легочная паренхима состоит из многочисленных границ между воздухом и мягкими тканями, таким образом представляя собой микроструктуру с различным показателем преломления. Это может вызвать сильное малоугловое рассеивание, что приводит к заметному уменьшению амплитуды изображения на темнопольной рентгенограмме. Это приводит к яркому изображению легких на конечном изображении. Эфизематозная ткань, наоборот, обеспечивает меньшую дыхательную поверхность, поскольку характеризуется патологической деградацией стенок альвеол. Это соответствует меньшему количеству границ между воздухом и мягкими тканями, что приводит к снижению темнопольного сигнала в пораженных участках. Продолжая эту последовательность уменьшения количества границ вплоть до полного их отсутствия, в соответствующих объектах не может возникнуть малоуглового рассеивания, что приводит к нулевому сигналу на темнопольном изображении [16,17,18,19,20].
В многочисленных моделях легочных заболеваний на малых животных было доказано, что темнопольная рентгенография предоставляет дополнительную, диагностически значимую информацию о микроструктурных изменениях легких [16,17,18]. Альвеолярная деструкция, характерная для эмфиземы легких, приводит к уменьшению малоуглового рассеивания. Недавние исследования продемонстрировали, что диагностика, стадирование и картирование локального распространения эмфиземы возможно с помощью темнопольной рентгенографии у мелких животных [4, 14, 21, 22]. Кроме того, технология была протестирована на крупных животных и трупах людей [19, 23, 24] и, наконец, впервые примененная к пациентам [20].
Целью нашего исследования было оценить темнопольную рентгенографию органов грудной клетки для оценки наличия и распространения эмфиземы у пациентов с ААТД по сравнению с обычной РГК и, при наличии, компьютерной томографией. Были рассмотрены дозы облучения для различных методов визуализации. Для измерения параметров функции легких использовали плетизмографию всего тела.
Методы
Подбор пациентов
В нашем сверхрегиональном амбулаторном отделении для пациентов с ААТД мы регулярно проводим аугментационную терапию ингибитором α1-антипротеиназы у некурящих пациентов с генотипом PiZZ или PiZ0 и сниженной функцией легких, согласно заключению ATS/ERS [1, 25]. Для наблюдения мы периодически контролируем объемы легких с помощью тестирования функции легких. По клиническим показаниям проводится обычный РГК. Чтобы рассмотреть возможность уменьшения объема легких, проводится детальная оценка с помощью КТ, если пациент является подходящим кандидатом.
Набор пациентов в пульмонологической амбулатории был частью большего, текущего, первого в мире исследования в отделении радиологии, которое оценивало темнопольную РГК для раннего выявления эмфиземы у пациентов с хроническим обструктивным заболеванием легких (ХОБЛ), включая пациентов с подтвержденным ХОБЛ по данным спирометрии и пациентов без ХОБЛ для сравнения. Чтобы оценить, можно ли визуализировать изменения легочной паренхимы при этом редком заболевании легких, были также включены пациенты с ААТД. Данные пациентов с AATД были объединены из исследования.
Исследование было одобрено институциональной комиссией по этике и Федеральным ведомством по радиационной защите. Все участники дали письменное информированное согласие.
Критерии включения и исключения
Мы включали взрослых пациентов с подтвержденным ААТД и пациентов без ААТД с клинически показанным РГК. Мы исключали пациентов с любыми другими дополнительными легочными заболеваниями, кроме ААТД-ассоциированной эмфиземы, беременных и пациентов, которые не были способны дать согласие на участие в исследовании. Из-за размера прототипа решетчатого интерферометра исследовали только ограниченное видимое поле. Поэтому пациенты с ростом более 182 см или индексом массы тела более 30 были исключены.
План исследования
Пациентам, включенным в это предварительное исследование, выполняли темнопольную рентгенографию в в задне-передней и боковой проекциях, на вдохе и выдохе. Обычная РГК выполнялась в задне-передней и боковой проекциях на вдохе. Проведена плетизмография всего тела. Одному пациенту с ААТД и одному здоровому пациенту было проведено КТ по клиническим соображениям для исключения инфильтратов или злокачественных образований. Дополнительно пациенту с ААТД была проведена КТ для получения информации о распределении эмфиземы при планировании эндоскопического уменьшения объема легких. Результаты четырех пациентов с ААТД сравнивали с результатами, полученными у пациента без ААТД и других легочных заболеваний как референтные (см. раздел “Набор пациентов“).
Темнопольная рентгенография
При визуализации на темном поле на основе решетки на фронт рентгеновской волны накладывается высокочастотная модуляция интенсивности, обычно размером в несколько микрон. Если этот фронт волны проникает в объект с высокими колебаниями показателя преломления в микронном масштабе, амплитуда этой картины уменьшается из-за многократного малоуглового рассеивания. Величина этого уменьшения соответствует интенсивности темнопольного сигнала [22]. Рис.1 схематически иллюстрирует основной принцип работы. Среднее значение картины интенсивности кодирует условный сигнал ослабления, который можно реконструировать в дополнение к темнопольному сигналу из того же набора данных. Таким образом, два идеально зарегистрированных изображения, представляющие различные физические принципы взаимодействия, получаются в одном считывании. Подробная информация о технике сканирования и считывания была описана ранее нашей группой [26]. Клинический прототип системы, разработанный собственными силами, был использован для получения темнопольных рентгенографических изображений грудной клетки у пациентов с ААТД и одного пациента без обструктивных заболеваний легких [20]. Система основана на сочетании трехграткового рентгеновского интерферометра и стандартных медицинских рентгеновских компонентов, таких как генератор высокого напряжения (Velara, Philips Healthcare, Нидерланды), источник (MRC 200 0508 ROT GS, Philips Healthcare, Нидерланды), коллиматор (MTR 302, Ralco, Милан, Италия) и плоский детектор (Pixium FE 4343 F, Trixell, Муаран, Франция). Перед сканированием область, подлежащая сканированию, была отрегулирована в соответствии с размерами пациента. Как и во время обычной КТ, пациент стоял вертикально, и ему рекомендовали задержать дыхание на время получения изображения. Процедура получения изображения основывается на сканировании, при котором активная область размером примерно 42 × 6,5 см2 сканируется по всей грудной клетке пациента примерно за 7 с.
Традиционная рентгеновская и компьютерная томография
Затухающие рентгенограммы были получены с помощью коммерческой рентгенографической системы (DigitalDiagnost, Philips Medical Systems, Гамбург, Германия) с напряжением на трубке 125 кВп. Двум пациентам было проведено КТ грудной клетки с контрастированием (IQon Spectral CT, Royal Philips, Амстердам, Нидерланды) по клиническим показаниям. Напряжение на трубке составляло 120 кВп, использовалась автоматическая угловая модуляция тока трубки. Изображение реконструировали с толщиной среза 0,9 мм, ядром высокого разрешения и уровнем подавления шума 6 (iDose 6, Royal Philips, Амстердам, Нидерланды).
Тест легочной функции (ТЛФ)
Все участники прошли стандартизированное исследование функции легких в нашем центре в соответствии с рекомендациями Европейского респираторного общества [27, 28]. ТЛФ состояла из сочетания спирометрии с плетизмографией всего тела (MasterScreen Body, Jaeger, Вюрцбург, Германия). При необходимости добавляли измерения диффузионной способности монооксида углерода (ДЗОУ) (MS-PFT, Jaeger, Wuerzburg, Германия).
Оценка изображений
На темнопольных рентгенограммах и обычных рентгенограммах легкие были разделены на шесть участков: верхняя, средняя и нижняя зоны правого и левого легкого (RLUZ, RLMZ, RLLZ, LLUZ, LLMZ, LLLZ соответственно). [24]. На изображениях на темном поле мощность легочного сигнала, как маркер целостности альвеол, визуально оценивали для каждой зоны отдельно по 6-балльной шкале в консенсус-чтении (G.S.Z., A.A.F.): 0 (отсутствует), 1 (очень низкий), 2 (низкий), 3 (умеренный), 4 (высокий) и 5 (очень высокий). В эту оценку были включены боковые и задне-передние темнопольные снимки на выдохе. Обычные рентгенограммы оценивали относительно наличия признаков гиперинфляции и сосудистых изменений, связанных с эмфиземой, по 2-балльной шкале: 0 (отсутствуют) и 1 (имеются). Степень эмфиземы на клинически показанной КТ одного пациента визуализировали на коронарном изображении с помощью пороговой плотности легких -950 HU, используя программное обеспечение конкретного производителя (IntelliSpace Portal, Royal Philips, Амстердам, Нидерланды). Считывание проводилось в соответствии со стандартизированным протоколом путем консенсусного считывания. Из-за небольшого размера выборки многократные считывания не проводились.
Результаты
Характеристики пациентов
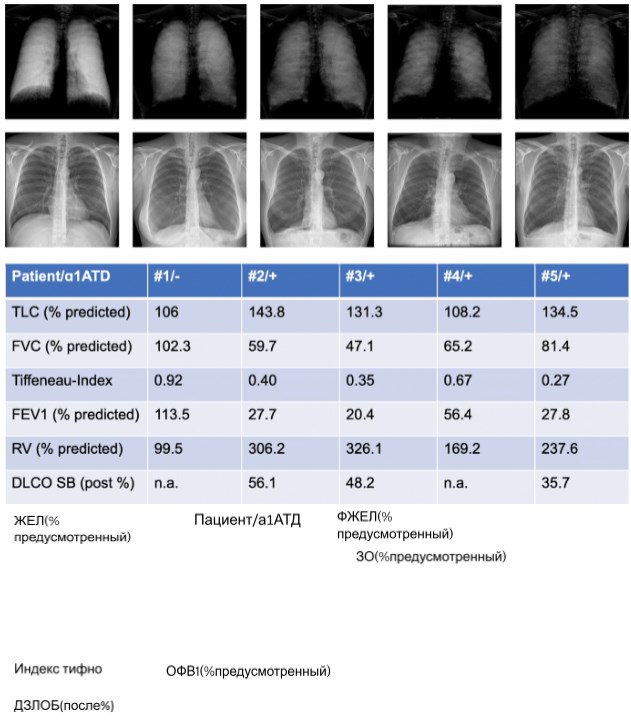
Мы включили четырех пациентов с клиническими показаниями для торакальной визуализации из нашего сверхрегионального амбулаторного отделения для пациентов с AATD. Исследуемая когорта была частью более крупного исследования, в котором оценивали рентгенографию в поле у пациентов с ХОБЛ [20]. Все пациенты с ААТД из этой исследовательской группы были включены в данную работу. Характеристики пациентов представлены в таблице 1.
Таблица 1 Характеристика здорового пациента (№1) и четырех пациентов (№2-5) с дефицитом альфа-1-антитрипсина (ААТД)
|
Характеристики пациентов |
#1 |
#2 |
#3 |
#4 |
#5 |
|
Стать |
Мужчина |
Женщина |
Мужчина |
Мужчина |
Мужчина |
|
Возраст (годы) |
33 |
41 |
48 |
73 |
55 |
|
Подтип ААТД |
– |
PiZZ |
PiZZ |
Pi00 |
PiZZ |
|
Курение (уп/год, бросил) |
Активное |
16, 2017 |
18, 2014 |
Никогда |
13, 2009 |
|
Мед. Леч. (год начала) |
– |
2018 |
2005 |
2014 |
2010 |
|
Продолжительность терапии |
– |
2 |
15 |
6 |
10 |
|
Тест оценки ХОБЛ |
– |
26 |
9 |
17 |
19 |
|
ГИОЛ |
– |
4D |
4A |
2B |
4B |
1. Препараты и продолжительность терапии относятся к терапии альфа-1-антитрипсином., ГИОЛ Глобальная инициатива по хронической обструктивной болезни легких, PiZZ Гомозиготные Z-аллели протеиназы, Pi00 Гомозиготные аллели 0
Тест легочной функции
Все пациенты с ААТД имели обструктивную функцию легких. Средний объем форсированного выдоха за 1 с (ОФВ1) составлял 33,1% от прогнозируемого (четыре значения у №2 27,7%, у №3 20,4%, у №4 56,4% и у №5 27,8%). Среднее значение индекса Тиффно-Пинелли (ОФВ1/ФЖЕЛ) составило 0,42 (четыре значения в №2 – 0,40, в №3 – 0,35, в №4 – 0,67 и в №5 – 0,37). Средняя форсированная жизненная емкость легких (ФЖЕЛ) составила 63,4% от прогнозируемой (четыре значения в №2 59,7%, в №3 47,1%, в №4 65,2% и в №5 81,4%). Средняя общая жизненная емкость легких составила 129,5% от прогнозируемой (четыре значения у №2 143,8%, у №3 131,3%, у №4 108,2% и у №5 134,5%). DCLO было получено у трех пациентов: средний показатель составил 46,7% от прогнозируемого (три значения у №2 56,1%, у №3 48,2% и у №5 35,7%)
Темнопольная рентгенография
Темнопольная рентгенография пациент №1 с нормальным состоянием легких показал высокий уровень сигнала (4 балла) в верхних отделах легких и очень высокий (5 баллов) в средних и нижних отделах легких. У пациента №2 уровень сигнала был оценен как умеренный (3 балла) в верхних и средних зонах легких и низкий (2 балла) в нижних зонах легких. Пациенты №3 и №4 продемонстрировали низкий уровень сигнала во всех зонах легких. У пациента №5 уровень сигнала был низким в верхних и средних зонах легких и очень низким в нижних зонах (показано на рис. 2).
Корреляция темнопольной рентгенограммы грудной клетки (верхний ряд) и обычной РГК (нижний ряд) здорового пациента (№1) и четырех пациентов (№2-5) с дефицитом альфа-1-антитрипсина (ААТД) с параметрами дыхания, полученными с помощью плетизмографии всего тела. ОЕЛ – общая емкость легких; ФЖЕЛ – форсированная жизненная емкость легких; ОФВ1 – объем форсированного выдоха за 1 с; ЗО – остаточный объем; ДЗЛОУ – диффузионная способность легких за один вдох для оксида углерода; % прогнозируемо, по сравнению с референтными значениями; Пост %, после введения бронходилататора, по сравнению с референтными значениями.
Традиционная РГК и КТ
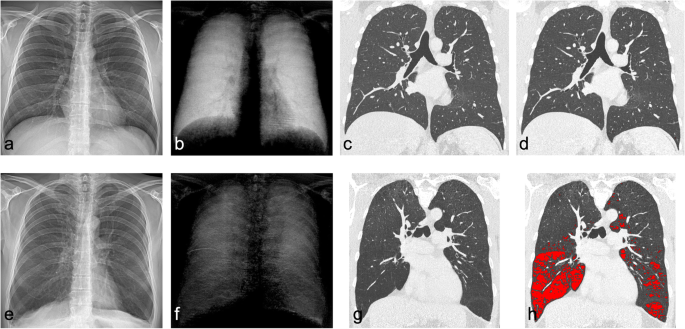
У всех пациентов (№2-5) с ААТД были обнаружены вторичные признаки эмфиземы на обычных РГК, такие как широко расставленные ребра и уплощенные правая и левыя полудиафрагмы. Эмфизематозные участки, определяемые низкими значениями легочной плотности (ниже -950 HU), демонстрировали очень низкий уровень сигнала на соответствующем темнопольном изображении (показано на рис. 3).
Обычная (а) и темнопольная рентгенограмма грудной клетки (b) здорового человека и пациента (№5) с дефицитом альфа-1-антитрипсина (ААТД) (d, е). Для обоих пациентов были применены одинаковые настройки окна/уровня для обычных изображений и темнопольных изображений соответственно. Сигнал темного поля заметно снижен в легких пациента с ААТД (f), особенно в нижних зонах, тогда как здоровые легкие демонстрируют сильный гомогенный сигнал во всех зонах. Соответствующее изображение коронарной компьютерной томографии (КТ) (g) выявляет деструкцию паренхимы легких, подчеркнутую эмфизематозным наложением (красный цвет) с использованием порога -950 единиц Хаунсфилда (h) по сравнению со снимками здорового пациента (c, d). Обычная рентгенограмма грудной клетки не может визуализировать степень паренхиматозного заболевания у пациента с ААТД (e), демонстрируя аналогичную передачу изображения у здорового пациента (a). Только вторичные признаки, такие как уплощение диафрагмы, увеличение объема легких или расширение костофренических углов, указывают на эмфизему (d). В то время как на темнопольном изображении наблюдается общее снижение сигнала в темном поле по всей области легкого, в отличие от нормального легкого, КТ обнаруживает дефекты только в нижних участках, которые соответствуют более сильному проявлению снижения сигнала на темнопольной рентгенограмме.
Доза рентгеновского излучения
Средняя эффективная доза задне-передней темнопольной рентгенографии составляла 0,049 мЗв, 0,032 мЗв, 0,047 мЗв и 0,025 мЗв для пациентов с №2 по №5.
Обсуждение
В этом первом клиническом предварительном исследовании темнопольных РГК у пациентов с ААТД мы показали, что темнопольное изображение позволяет визуализировать степень тяжести и региональное распределение эмфиземы легких, тогда как обычная РГК не была полезной для стадирования эмфиземы из-за ее известных недостатков. Это пилотное исследование имело целью продемонстрировать потенциальную возможность применения темнопольной визуализации. Темнопольное изображение показало заметное снижение сигнала легочной паренхимы у пациентов с ААТД с прогрессирующей эмфиземой, по сравнению с едва заметными признаками при проведении РГК (рис. 2). И наоборот, обычная РГК выявила вторичные признаки эмфиземы у наших пациентов. Однако эти вторичные признаки отражают лишь выражение гиперинфляции и не являются прямыми признаками эмфиземы. Согласно анатомическому определению эмфиземы как потери интактных альвеол, темнополная РГК визуализировала эмфизему за счет снижения уровня сигнала темного поля в этих участках у наших пациентов.
У одного пациента очень низкий темнопольный сигнал в нижних отделах легких совпал с выявлением эмфиземы на КТ, основанной на пороговом значении плотности легких (рис 3). Кроме того, на темнопольном изображении было обнаружено общее снижение темнопольного сигнала по всей области легких, которое трудно было идентифицировать с помощью КТ-денситометрии. Однако, по сравнению с КТ, которая применяется для количественной оценки и определения типа эмфиземы, темнопольная РГК может предоставить аналогичную информацию за меньшую дозу облучения. Доза облучения при темнопольной РГК для референтного лица составляет 0,035 мЗв, что значительно ниже, чем при КТ со средней дозой облучения 2-7 мЗв [11, 12, 20]. Более того, в области визуализации эмфиземы темнопольная РГК может облегчить раннюю диагностику и позволить проводить скрининговые исследования.
Наши результаты согласуются с предыдущими публикациями в исследованиях на животных и организме человека. У мышей ранние стадии эмфиземы были обнаружены с помощью темнопольной рентгеновской томографии, что коррелировало с гистологическими изменениями, в то время как обычная рентгенография не могла выявить ранних стадий эмфиземы [29]. Как было показано в различных исследованиях на небольших моделях животных, этот метод предоставляет дополнительную диагностически важную информацию о макро- и микроструктурной архитектуре легочной паренхимы, визуализируя воспалительные, фиброзные или опухолевые изменения значительно лучше, чем обычная визуализация у мышей. [14, 16,17,18, 30]. Кроме того, неонатальные повреждения можно визуализировать на животной модели с помощью темнопольной рентгеновской визуализации [19, 23, 32] и трупах людей [24, 33, 34] эта методика недавно была впервые успешно применена к пациентам [20]. Это наглядно демонстрирует возможность применения метода с соблюдением клинических ограничений, таких как поле зрения, время сканирования и доза облучения.
Основной проблемой раннего выявления эмфиземы легких является то, что эмфизематозные изменения успешно визуализируются с помощью КТ в большой группе курильщиков даже без спирометрических нарушений [35, 36]. Степень эмфиземы, визуализируемой с помощью КТ, коррелирует с прогнозом пациентов с эмфиземой [35, 36]. Однако даже низкодозовая КТ грудной клетки требует значительно большей лучевой нагрузки, чем РГК. Таким образом, необходима методика визуализации, которая бы позволила раннее выявление эмфиземы у пациентов из группы риска без высокой лучевой нагрузки КТ. В предыдущих исследованиях была описана корреляция ДЗЛОУ, как маркера газообменной поверхности легких, со сниженным темнопольным сигналом [20]. В нашем исследовании мы обнаружили, что, несмотря на одинаковую степень обструкции, уровень темнопольного сигнала был выше у пациента № 2, чем у пациента № 5, что свидетельствует о связи с ДЗЛОУ, который был выше у пациента № 2.
Учитывая, что эмфизема вследствие ААТД обычно выявляется на поздней стадии с прогрессирующим поражением легких, существует насущная необходимость в дополнительных методах ранней диагностики [1, 37], тем более, что существует возможность уменьшить прогрессирование заболевания у этих пациентов путем замены лечения ингибитором альфа-1-протеиназы [10, 38]. Поскольку РГК не подходит для раннего выявления структурных изменений легких, темнопольная рентгенография, благодаря очень низкой лучевой нагрузке, которая примерно вдвое превышает лучевую нагрузку обычной рентгенографии, и ее структурной информации, может особенно хорошо подходить для этой цели.
Основными ограничениями нашего исследования является дизайн одноцентрового исследования и небольшой размер выборки. Поскольку на сегодняшний день существует только один прототип темнопольной РГК для использования на людях, мы включили пациентов с ААТД в нашей специализированной амбулатории, чтобы получить первое представление о том, может ли темнопольная РГК выявить степень тяжести и региональное распределение эмфиземы у этих пациентов. Для подтверждения этого на больших коллективах необходимы дальнейшие исследования. В большем текущем исследовании у пациентов с нормальной функцией легких и эмфиземой вследствие ХОБЛ без ААТД мощность темнопольного сигнала показала более высокую положительную корреляцию с диффузионной способностью, как маркером интактной альвеолярной поверхности, чем количественная оценка эмфиземы на основе КТ [20].
Другим ограничением является прогрессирующая эмфизема у включенных в наше исследование пациентов с ААТД, что не является репрезентативным для ранних стадий эмфиземы. Недавно были опубликованы результаты пациентов с ранними стадиями эмфиземы, которые демонстрируют корреляцию уровня темнопольного сигнала и ДЗЛОB [20]. Таким образом, пониженный сигнал темнопольной РГК может указывать на то, что структурное повреждение уже существует, несмотря на нормальную РГК. Это может инициировать дальнейшие диагностические шаги, такие как пневмологическое обследование на ранней стадии.
Дополнительным ограничением является новизна темнопольной рентгенографии как метода клинической визуализации и недостаточный опыт и подготовка врачей-радиологов, которые читают изображения. Однако наши радиологи имеют многолетний опыт исследований в области чтения изображений на темном поле, полученных во время исследований на животных и людях.
Как вывод, эти предварительные результаты указывают на то, что темнопольная РГК возможна и может исследовать основную микроструктуру легких у пациентов с ААТД, которая остается недоступной с помощью современных методов медицинской визуализации при низких дозах облучения. Это может добавить дополнительную информацию о степени тяжести и региональном распределении эмфиземы легких у пациентов с ААТД. Внедрение темнопольной рентгеновской визуализации в клиническую практику может в корне изменить диагностику легочных заболеваний с помощью сверхнизких доз облучения по сравнению с КТ.
Наличие данных и материалов
Все данные, полученные или проанализированные во время этого исследования, включены в эту опубликованную статью.
Аббревиатуры
ААТД: Дефицит альфа-1-антитрипсина
ХОБЛ: Хроническая обструктивная болезнь легких
РГК: Рентген грудной клетки
ОФВ1: Объем форсированного выдоха за одну секунду
ЖЕЛ: Жизненная емкость легких
ЕХ: Единицы Хаунсфильда
ДФЛ: Диагностика функции легких
Ссылки
- Miravitlles M, Dirksen A, Ferrarotti I, et al (2017) European Respiratory Society statement: diagnosis and treatment of pulmonary disease in alpha1-antitrypsin deficiency. Eur Respir J 50:1700610. https://doi.org/10.1183/13993003.00610-2017
- Muller NL, Coxson H (2002) Chronic obstructive pulmonary disease. 4: imaging the lungs in patients with chronic obstructive pulmonary disease. Thorax 57:982–985. https://doi.org/10.1136/thorax.57.11.982
Article CAS PubMed PubMed Central Google Scholar
- Washko GR (2010) Diagnostic imaging in COPD. Semin Respir Crit Care Med 31:276–285. https://doi.org/10.1055/s-0030-1254068
Article PubMed PubMed Central Google Scholar
- Meinel FG, Schwab F, Schleede S, et al (2013) Diagnosing and mapping pulmonary emphysema on X-ray projection images: incremental value of grating-based X-ray dark-field imaging. PLoS One 8:e59526. https://doi.org/10.1371/journal.pone.0059526
- Cavigli E, Camiciottoli G, Diciotti S, et al (2009) Whole-lung densitometry versus visual assessment of emphysema. Eur Radiol 19:1686–1692. https://doi.org/10.1007/s00330-009-1320-y
- Stoel BC, Stolk J, Bakker ME, Parr DG (2019) Regional lung densities in alpha-1 antitrypsin deficiency compared to predicted values. Respir Res 20:45. https://doi.org/10.1186/s12931-019-1012-3
Article PubMed PubMed Central Google Scholar
- Konietzke P, Jobst B, Wagner WL, et al (2018) Similarities in the computed tomography appearance in alpha1-antitrypsin deficiency and smoking-related chronic obstructive pulmonary disease in a smoking collective. Respiration 96:231–239. https://doi.org/10.1159/000489177
- Stoel BC, Stolk J (2004) Optimization and standardization of lung densitometry in the assessment of pulmonary emphysema. Invest Radiol 39:681–688. https://doi.org/10.1097/00004424-200411000-00006
Article PubMed Google Scholar
- Parr DG, Dirksen A, Piitulainen E, Deng C, Wencker M, Stockley RA (2009) Exploring the optimum approach to the use of CT densitometry in a randomised placebo-controlled study of augmentation therapy in alpha 1-antitrypsin deficiency. Respir Res 10:75. https://doi.org/10.1186/1465-9921-10-75
Article CAS PubMed PubMed Central Google Scholar
- McElvaney NG, Burdon J, Holmes M, et al (2017) Long-term efficacy and safety of alpha1 proteinase inhibitor treatment for emphysema caused by severe alpha1 antitrypsin deficiency: an open-label extension trial (RAPID-OLE). Lancet Respir Med 5:51–60. https://doi.org/10.1016/S2213-2600(16)30430-1
- Mettler FA Jr, Huda W, Yoshizumi TT, Mahesh M (2008) Effective doses in radiology and diagnostic nuclear medicine: a catalog. Radiology 248:254–263. https://doi.org/10.1148/radiol.2481071451
Article PubMed Google Scholar
- Larke FJ, Kruger RL, Cagnon CH, et al (2011) Estimated radiation dose associated with low-dose chest CT of average-size participants in the National Lung Screening Trial. AJR Am J Roentgenol 197:1165–1169. https://doi.org/10.2214/AJR.11.6533
- Bech M, Tapfer A, Velroyen A, et al (2013) In-vivo dark-field and phase-contrast x-ray imaging. Sci Rep 3:3209. https://doi.org/10.1038/srep03209
- Yaroshenko A, Meinel FG, Bech M, et al (2013) Pulmonary emphysema diagnosis with a preclinical small-animal X-ray dark-field scatter-contrast scanner. Radiology 269:427–433. https://doi.org/10.1148/radiol.13122413
- Pfeiffer F, Bech M, Bunk O, et al (2008) Hard-X-ray dark-field imaging using a grating interferometer. Nat Mater 7:134–137. https://doi.org/10.1038/nmat2096
- Yaroshenko A, Hellbach K, Yildirim AO, et al (2015) Improved in vivo assessment of pulmonary fibrosis in mice using x-ray dark-field radiography. Sci Rep 5:17492. https://doi.org/10.1038/srep17492
- Hellbach K, Yaroshenko A, Willer K, et al (2016) Facilitated diagnosis of pneumothoraces in newborn mice using x-ray dark-field radiography. Invest Radiol 51:597–601. https://doi.org/10.1097/RLI.0000000000000285
- Hellbach K, Meinel FG, Conlon TM, et al (2018) X-ray dark-field imaging to depict acute lung inflammation in mice. Sci Rep 8:2096. https://doi.org/10.1038/s41598-018-20193-8
- Hellbach K, Baehr A, De Marco F et al (2018) Depiction of pneumothoraces in a large animal model using x-ray dark-field radiography. Sci Rep 8:2602. https://doi.org/10.1038/s41598-018-20985-y
Article CAS PubMed PubMed Central Google Scholar
- Willer K, Fingerle AA, Noichl W, et al (2021) X-ray dark-field chest imaging for detection and quantification of emphysema in patients with chronic obstructive pulmonary disease: a diagnostic accuracy study. Lancet Digit Health 3:e733–e744. https://doi.org/10.1016/S2589-7500(21)00146-1
- Schleede S, Meinel FG, Bech M, et al (2012) Emphysema diagnosis using X-ray dark-field imaging at a laser-driven compact synchrotron light source. Proc Natl Acad Sci U S A 109:17880–17885. https://doi.org/10.1073/pnas.1206684109
- Meinel FG, Yaroshenko A, Hellbach K, et al (2014) Improved diagnosis of pulmonary emphysema using in vivo dark-field radiography. Invest Radiol 49:653–658. https://doi.org/10.1097/RLI.0000000000000067
- Gromann LB, De Marco F, Willer K et al (2017) In-vivo x-ray dark-field chest radiography of a pig. Sci Rep 7:4807. https://doi.org/10.1038/s41598-017-05101-w
Article CAS PubMed PubMed Central Google Scholar
- Fingerle AA, De Marco F, Andrejewski J et al (2019) Imaging features in post-mortem x-ray dark-field chest radiographs and correlation with conventional x-ray and CT. Eur Radiol Exp 3:25. https://doi.org/10.1186/s41747-019-0104-7
Article PubMed PubMed Central Google Scholar
- American Thoracic Society, European Respiratory Society (2003) American Thoracic Society/European Respiratory Society statement: standards for the diagnosis and management of individuals with alpha-1 antitrypsin deficiency. Am J Respir Crit Care Med 168:818–900. https://doi.org/10.1164/rccm.168.7.818
- Gassert FT, Urban T, Frank M et al (2021) X-ray dark-field chest imaging: qualitative and quantitative results in healthy humans. Radiology 301:389–395. https://doi.org/10.1148/radiol.2021210963
Article PubMed Google Scholar
- Coates AL, Peslin R, Rodenstein D, Stocks J (1997) Measurement of lung volumes by plethysmography. Eur Respir J 10:1415–1427. https://doi.org/10.1183/09031936.97.10061415
Article CAS PubMed Google Scholar
- Wanger J, Clausen JL, Coates A, et al (2005) Standardisation of the measurement of lung volumes. Eur Respir J 26:511–522. https://doi.org/10.1183/09031936.05.00035005
- Hellbach K, Yaroshenko A, Meinel FG, et al (2015) In vivo dark-field radiography for early diagnosis and staging of pulmonary emphysema. Invest Radiol 50:430–435. https://doi.org/10.1097/RLI.0000000000000147
- Scherer K, Yaroshenko A, Bolukbas DA et al (2017) X-ray dark-field radiography – in-vivo diagnosis of lung cancer in mice. Sci Rep 7:402. https://doi.org/10.1038/s41598-017-00489-x
Article CAS PubMed PubMed Central Google Scholar
- Yaroshenko A, Pritzke T, Koschlig M, et al (2016) Visualization of neonatal lung injury associated with mechanical ventilation using x-ray dark-field radiography. Sci Rep 6:24269. https://doi.org/10.1038/srep24269
- De Marco F, Willer K, Gromann LB et al (2019) Contrast-to-noise ratios and thickness-normalized, ventilation-dependent signal levels in dark-field and conventional in vivo thorax radiographs of two pigs. PLoS One 14:e0217858. https://doi.org/10.1371/journal.pone.0217858
Article CAS PubMed PubMed Central Google Scholar
- Willer K, Fingerle AA, Gromann LB, et al (2018) X-ray dark-field imaging of the human lung-a feasibility study on a deceased body. PLoS One 13:e0204565. https://doi.org/10.1371/journal.pone.0204565
- Sauter AP, Andrejewski J, De Marco F et al (2019) Optimization of tube voltage in X-ray dark-field chest radiography. Sci Rep 9:8699. https://doi.org/10.1038/s41598-019-45256-2
Article CAS PubMed PubMed Central Google Scholar
- Lynch DA, Moore CM, Wilson C, et al (2018) CT-based visual classification of emphysema: association with mortality in the COPDGene study. Radiology 288:859–866. https://doi.org/10.1148/radiol.2018172294
- Regan EA, Lynch DA, Curran-Everett D, et al (2015) Clinical and radiologic disease in smokers with normal spirometry. JAMA Intern Med 175:1539–1549. https://doi.org/10.1001/jamainternmed.2015.2735
- McElvaney NG (2015) Diagnosing alpha1-antitrypsin deficiency: how to improve the current algorithm. Eur Respir Rev 24:52–57. https://doi.org/10.1183/09059180.10010814
Article PubMed Google Scholar
- Ma S, Lin YY, Cantor JO et al (2016) The effect of alpha-1 proteinase inhibitor on biomarkers of elastin degradation in alpha-1 antitrypsin deficiency: an analysis of the RAPID/RAPID extension trials. Chronic Obstr Pulm Dis 4:34–