Резюме
Дискуссионным остается вопрос, какая игла имеет явное преимущество в диагностической эффективности при эндоскопической ультразвуковой (ЭУЗИ) тонкоигольной биопсии (ТИБ) солидных образований поджелудочной железы. Целью этого исследования было сравнить эффективность трех игл и определить переменные, которые влияют на точность диагностики. С марта 2014 года по май 2020 года было ретроспективно проанализировано 746 пациентов с солидными образованиями поджелудочной железы, которым было выполнено ЭУЗИ-ТИБ с использованием трех типов игл (игла Franseen, игла с острием Menghini и игла с обратным скосом). Для выявления факторов, связанных с точностью диагностики, использовали многомерный анализ с использованием логистической регрессионной модели. Были выявлены значительные различия между группами по частоте получения гистологического материала и его оптимального качества (Franseen против острия Menghini против иглы с обратным скосом: 98,0% [192/196] против 85,8% [97/113] против 91,9% [331/360], P <0,001 и 95,4% [187/196] против 65,5% [74/113] против 88,3% [318/360], P <0,001, соответственно). Чувствительность и точность при использовании гистологических препаратов составляла 95,03% и 95,92% для игл Franseen, 82,67% и 88,50% для игл с острием Menghini и 82,61% и 85,56% для игл с обратным скосом, соответственно. При прямом сравнении игл с использованием гистологических образцов, игла Franseen показала значительно более высокую точность, чем игла с острием Menghini (P = 0,018) и игла с обратным скосом (P < 0,001). Многофакторный анализ показал, что размер опухоли ≥ 2 см (отношение шансов [ОШ] 5,36, 95% доверительный интервал [ДИ] 3,40-8,47, P < 0,001) и веерная техника (ОШ 1,70, 95% ДИ 1,00-2,86, P = 0,047) были достоверно связаны с точным диагнозом. ЭУЗИ-ТИБ с использованием иглы Franseen позволяет получить больший и более качественный гистологический материал и достичь точного гистологического диагноза при использовании веерной техники (взятие 2-3 фрагментов материала из нескольких мест).
Вступление
Хотя эндоскопическая ультразвуковая диагностика (ЭУЗИ), включая тонкоигольную аспирацию (ТИА) и тонкоигольную биопсию (ТИБ), является стандартной методикой для установления окончательного диагноза и составления индивидуального терапевтического плана при солидных опухолях поджелудочной железы 1, сообщается, что диагностическая эффективность имеет широкий диапазон в зависимости от типа иглы. Недавно было анонсировано несколько модифицированных игл, специально разработанных для получения гистологического материала с интактной архитектурой, чтобы преодолеть эти ограничения конкретных типов игл 2. Эти устройства, получившие общее название иглы ТИБ, были оснащены уникальной формой кончика иглы, которая имеет либо боковую фенестрированную щель (ловушка биопсийного материала), либо специальную геометрию режущего кончика, в то время как стандартные иглы без этих усиливающих геометрий классифицируются как иглы ТИА 3.
Первоначально была разработана новая игла ТИБ с обратным скосом в виде бокового фенестрованого отверстия на стержне иглы, которая в настоящее время доступна на рынке в трех калибрах (19, 22 и 25). Теоретически, она может получить основную ткань, зацепив, разрезав и захватив ее во время движения вперед-назад. Несмотря на гипотетическое предположение, что конструкция с обратным скосом позволит получить большой кусок ткани с сохранением гистологической структуры, может потребоваться специальный маневр (например, выскабливание с помощью силы тяги) во время движения вперед-назад, поскольку она не имеет встроенной системы резки 2. Совсем недавно была разработана игла Franseen, которая имеет новый дизайн с коронкообразным острием с трехплоскостными симметричными режущими краями, что облегчает получение больших по размеру тканей ядра.
Хотя последние клинические руководства 3,4 предполагают, что любой конкретный тип иглы, включая иглы ТИА или ТИБ, не гарантирует более высокой диагностической точности, чем другие, при заборе тканей под контролем ЭУЗИ при солидных опухолях поджелудочной железы, иглы ТИБ, как правило, используются для получения достаточного образца ткани для дифференциации различных опухолей с помощью иммуногистохимического (ИГХ) окрашивания 5,6.
Определение оптимального типа иглы для точной диагностики, особенно при отсутствии быстрой цитологической оценки на месте (ROSE), является критически важным для получения ткани под контролем ЭУЗИ при солидных опухолях поджелудочной железы; однако существует мало убедительной информации касательно относительной диагностической эффективности при сравнении с различными типами игл. Поэтому, чтобы предоставить больше доказательной информации на эту тему, мы сравнили диагностическую эффективность в зависимости от типа иглы (игла Franseen против иглы с обратным скосом против стандартной иглы ТИА) и определили переменные, которые влияют на диагностическую результативность злокачественности при ЭУЗИ-управляемом заборе ткани солидных опухолей поджелудочной железы.
Методы
Пациенты
Это было многоцентровое ретроспективное исследование, проведенное в Университетской больнице Аджоу, больнице Святого Сердца Донгтан при Университете Халлим и больнице Бунданг при Сеульском национальном университете. В исследование были включены пациенты, которым последовательно выполняли ЭУЗИ-ТИБ или ЭУЗИ-ТИА по поводу солидных опухолей поджелудочной железы. Пациенты с кистозным компонентом в образованиях без солидного компонента с подозрением на злокачественную трансформацию были исключены. Демографические, клинические и эндоскопические данные были получены из компьютеризированной клинической информационной системы за предыдущие 7 лет (с марта 2014 года по май 2020 года). Одобрение Институционального наблюдательного совета было получено от больницы Святого Сердца Донгтан Университета Халлима (номер файла IRB: 2021-08-011). Кроме того, все процедуры были выполнены в соответствии с этическими стандартами, изложенными в Хельсинкской декларации. Необходимость получения информированного согласия была отменена из-за ретроспективного характера этого исследования Институциональным наблюдательным советом Комитета по вопросам этики больницы Святого Сердца при Халлимском университете Донгтан.
Эндоскопические процедуры для ЭУЗИ-ТИА или ТИБ
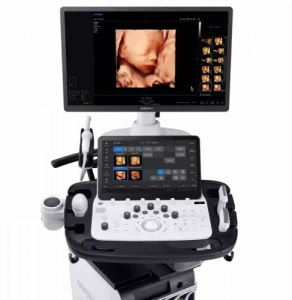
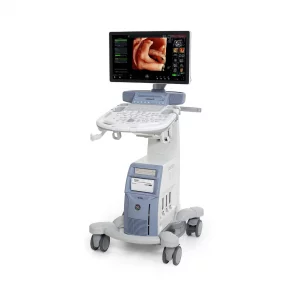
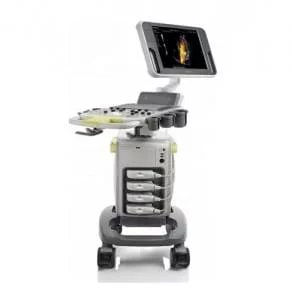
Все процедуры выполняли с помощью эхоэндоскопа с линейной матрицей (EG-530UT2, Fujifilm Medical Systems, Токио, Япония или UCT 260, Olympus Medical Systems, Токио, Япония) опытными эндоскопистами (M.J.Y., J.K. и S.W.P.), которые выполняли более 100 случаев ЭУЗИ-ТИА или ТИБ в год в соответствии с хорошо отработанным стандартным протоколом 7. ЭУЗИ-ТИБ выполняли биопсийной иглой (Franseen; Acquire; Boston Scientific (рис. 1A) или Игла с обратным скосом; EchoTip ProCore; Cook Endoscopy (рис. 1B)) или ЭУЗИ-ТИГ иглой с острием Menghini (EZ shot3, Olympus Medical Systems, Токио, Япония (рис. 1C)) в соответствии с характеристиками и расположением опухоли поджелудочной железы и предпочтений эндоскописта. После подтверждения отсутствия сосудов на ожидаемой траектории иглы с помощью цветного допплера, игла, установленная на стилет, использовалась для прокола желудка для исследования тела/хвоста или двенадцатиперстной кишки для исследования головки/крючковидного отростка. После прокола очага поражения стилет вынимали, и выполняли примерно 10-20 движений вперед-назад в пределах участка образования во время каждого прохождения иглы с непрерывным отсасыванием с помощью шприца объемом 10-20 мл, предоставленного производителем. В частности, 10 мл отрицательного отсасывания было выполнено при применении иглы с обратным скосом, а 20 мл отрицательного отсасывания было выполнено при применении игл EZ shot3 и Franseen. Кроме того, ЭУЗИ-ТА или ТИБ повторяли до получения достаточного количества видимой основной ткани, хотя оптимальное количество проходов иглы определялось на усмотрение эндоскопистов 8. ROSE не была доступна ни в одном учреждении.
Изображение 1
(A) Игла Franseen имеет новый дизайн корончатого наконечника с симметричными режущими кромками в трех плоскостях. (B) Игла с обратным скосом имеет систему обратного скоса в виде бокового фенестрованого отверстия на стержне иглы. (C) Игла с острием Menghini имеет коническую скошенную кромку, которая облегчает вывод ткани в просвет. Хотя она имеет боковое отверстие, она классифицируется как игла ТИА, поскольку боковое отверстие этой системы игл не имеет никаких усиливающих геометрических элементов для разрезания ткани.
Цитопатологический анализ с использованием каждой иглы ТИБ
В этом исследовании цитологические и гистологические оценки выполнялись одним цитопатологом с опытом работы в области панкреатологии в каждом учреждении. Образцы, полученные из каждого прохождения путем введения стилета с иглой, полностью фиксировали в 50% этаноле для оценки клеточных блоков и в бутылках с формалином для гистологической экспертизы 9. Подготовленные гистологические образцы, зафиксированные в растворах формалина, повторно обрабатывали в кассетной форме, помещали в парафин и готовили к окрашиванию гематоксилином и эозином (Г и Э) для оценки тем же патологоанатомом. При необходимости применяли специальное окрашивание, например, ИГХ-окрашивание, чтобы отличить опухолевые клетки от регенеративной атипии или атипичных опухолей, таких как лимфома, метастатическая карцинома, солидные псевдопапиллярные опухоли или даже нейроэндокринные опухоли. Если гистологический материал не был получен, цитопатолог обрабатывает тот же материал, что и клеточный блок для цитологического анализа.
Определение результатов и референтных критериев для диагностики доброкачественных или злокачественных образований поджелудочной железы
Первичным результатом этого исследования была диагностическая эффективность игл. Вторичные результаты были определены как частота получения биопсийного материала оптимального качества для гистологической оценки в соответствии с иглами, которые использовались для процедуры ЭУЗИ-ТИБ, связанные с процедурой нежелательные явления и переменные, влияющие на точность диагностики в модели логистической регрессии. В частности, достаточное количество видимой основной ткани определялось как беловатые или красноватые кусочки ткани с видимым объемом на фильтровальной бумаге или предметном стекле 10.
Окончательный диагноз был установлен как злокачественное или доброкачественное образование на основе одного из следующих референтных критериев: (а) точный диагноз, установленный на основе оценки хирургически резецированных постоянных образцов у прооперированных пациентов, (б) смертность, специфичная для заболевания, и (в) отсутствие признаков регрессии или прогрессирования заболевания в течение более чем 6-месячного периода наблюдения по данным клинического и радиологического обследования только в случаях подозрения на доброкачественное заболевание на момент проведения ЭУЗИ-ТИБ 7,11,12. При первичной классификации как точной или подозрительной злокачественности на основе клеточного блока или гистологического анализа с помощью ЭУЗИ-ТИА или ТИБ случаи, подтвержденные как злокачественные в окончательном диагнозе, считались истинно положительными, тогда как поражения, которые были окончательно диагностированы как доброкачественные заболевания после клинического наблюдения, считались ложноположительными. Аналогично, если первоначальные доброкачественные результаты были окончательно диагностированы как доброкачественные заболевания, они считались истинно отрицательными, тогда как те, что были подтверждены как злокачественные в окончательном диагнозе, считались ложноотрицательными. Кроме того, недиагностические результаты, включая недостаточное количество образцов, считались ложноотрицательными, поскольку процедура не позволила поставить диагноз 13.
Статистический анализ
Непрерывные переменные были представлены в виде среднего значения и стандартного отклонения и сравнивались с помощью t-критерия Стьюдента. Категориальные переменные были представлены в виде чисел (процентов) и сравнивались с помощью χ2-критерия. Для оценки связи между клиническими и эндоскопическими переменными, включая тип иглы, с точным диагнозом применяли одномерные и многомерные логистические регрессионные модели. Переменные, которые оказались значимыми (P <0,20) в однофакторной модели, были введены в многофакторную логистическую регрессионную модель. Диагностическая чувствительность, специфичность, точность, положительная прогностическая ценность (ППЦ) и отрицательная прогностическая ценность (ОПЦ) были оценены для всех типов игл. Все полученные P-values были двусторонними, а P-values <0,05 считались статистически значимыми. Все статистические анализы были проведены с использованием статистического программного обеспечения R (версия 3.3.3; R Foundation for Statistical Computing, Вена, Австрия).
Результаты
Исследуемая популяция и начальные характеристики
За период исследования 828 пациентам было выполнено ЭУЗИ-ТИБ по поводу солидных опухолей поджелудочной железы (рис. 2). Были исключены пациенты с анатомическими изменениями, которые делали невозможным проведение эхоэндоскопа (n = 21), со значительной обструкцией выходного отдела желудка (n = 12), с коллатеральными промежуточными сосудами, которые делали невозможным пункцию иглой (n = 9), а также пациенты с чистыми кистозными поражениями без солидного компонента, которые были возможны только для аспирации, но не для забора ткани (n = 117). Всего в анализ было включено 669 пациентов, которые были распределены на три группы: Franseen (n = 196), острие Menghini (n = 113) и Обратный скос (n = 360).
Изображение 2. Схема потока пациентов в течение исследования.
В таблице 1 В таблице 1 представлены исходные характеристики пациентов в соответствии с каждой группой. Средний возраст в группе где использовалась игла Franseen был значительно выше, чем в других группах (группа Franseen по сравнению с группой острия Menghini и группой иглы с обратным скосом: 66,3 ± 12,0 против 62,5 ± 15,2 против 65,0 ± 12,0 соответственно; P = 0,039). Доля пациентов мужского пола и индекс массы тела между группами не отличались. Кроме того, иглы 22-го калибра преимущественно использовали в группах Franseen и острия Menghini, тогда как иглы 25-го калибра чаще применяли в группе с обратным скосом со значимой разницей (P < 0,001). Во всех трех группах подозрение на злокачественное образование было самым распространенным показанием для проведения ЭУЗИ-ТИА/Б с достоверной разницей (P = 0,008). Чаще всего утолщение располагалось в головке поджелудочной железы (39,3%, 45,1% и 51,9% в группах Franseen, острия Menghini и иглы с обратным скосом соответственно) с достоверными межгрупповыми различиями. Средний размер поражения составил 30,3 мм в группе Franseen, 36,3 мм в группе острия Menghini и 29,9 мм в группе иглы с обратным скосом со значительными межгрупповыми различиями.
Таблица 1 Характеристика пациентов.
| Franseen n = 196 | Острие Menghini n=113 | Обратный скос n=360 | P value | |
|---|---|---|---|---|
| Возраст, год, среднее ±СО | 66.3 ± 12.0 | 62.5 ± 15.2 | 65.0 ± 12.0 | 0.039 |
| Пол (Мужчины), n (%) | 111 (56.6%) | 64 (56.6%) | 192 (53.3%) | 0.694 |
| ИМТ, кг/м2, среднее ± СО | 23.1 ± 3.5 | 22.5 ± 4.3 | 22.6 ± 3.3 | 0.202 |
| Диаметр иглы, n (%) | < 0.001 | |||
| 22-калибр | 180 (91.8%) | 113 (100.0%) | 152 (42.2%) | |
| 25-калибр | 16 (8.2%) | 0 (0.0%) | 208 (57.8%) | |
| Признак ТА, n (%) | 0.008 | |||
| Подозрение на доброкачественное образование | 20 (10.2%) | 25 (22.1%) | 44 (12.2%) | |
| Подозрение на злокачественное образование | 176 (89.8%) | 88 (77.9%) | 316 (87.8%) | |
| Локализация поражения, n (%) | 0.048 | |||
| Крючковидный отросток | 20 (10.2%) | 9 (8.0%) | 41 (11.4%) | |
| Головка | 77 (39.3%) | 51 (45.1%) | 187 (51.9%) | |
| Тело | 72 (36.7%) | 40 (35.4%) | 91 (25.3%) | |
| Хвост | 27 (13.8%) | 13 (11.5%) | 41 (11.4%) | |
| Максимальный размер поражения, мм, среднее ± СО | 30.3 ± 10.9 | 36.3 ± 22.3 | 29.9 ± 10.5 | < 0.001 |
| Начальные лабораторные данные, медиана [IQR] | ||||
| СОЭ, мм3 | 9750.0 [6290.0–12,600.0] | 6400.0 [4700.0–7900.0] | 8700.0 [5735.0–12,500.0] | < 0.001 |
| Гемоглобин, г/дл | 12.6 [11.4–13.7] | 12.6 [11.1–14.1] | 12.6 [11.5–13.6] | 0.831 |
| Тромбоциты, × 1000/мм3 | 221.0 [174.0–268.0] | 230.0 [178.0–266.0] | 222.0 [179.0–275.5] | 0.921 |
| АСТ, МЕ/Л | 32.5 [19.0–116.0] | 24.0 [19.0–42.0] | 33.0 [21.0–122.0] | 0.012 |
| АЛТ, МЕ/Л | 30.0 [15.0–126.0] | 25.0 [15.0–48.0] | 34.0 [16.5–149.5] | 0.053 |
| ЩФ, МЕ/Л | 101.0 [65.0–306.0] | 86.0 [62.0–165.0] | 117.5 [71.0–364.5] | 0.001 |
| ГГТ, МЕ/Л | 96.0 [21.0–592.0] | 48.0 [17.0–198.0] | 108.0 [24.0–634.0] | 0.002 |
| Общий билирубин, мг/дл | 0.7 [0.4–6.0] | 0.6 [0.4–1.0] | 0.8 [0.4–7.1] | 0.003 |
| Амилаза, МЕ/л | 63.0 [38.0–93.0] | 62.0 [47.0–104.0] | 66.5 [44.0–114.0] | 0.608 |
- СО, стандартное отклонение; ИМТ, индекс массы тела; лейкоциты; АСТ, аспартатаминотрансфераза; МЕ, международная единица; АЛТ, аланинаминотрансфераза; ЩФ, щелочная фосфатаза; ГГТ, гамма-глутамилтрансфераза.
Результаты, связанные с процедурой, между тремя группами
Результаты, связанные с процедурой, представлены в таблице 2. Трансдуоденальный доступ был более распространенным, чем трансжелудочный, во всех трех группах, поскольку самой распространенной локализацией поражения во всех группах была головка. Кроме того, количество проходов иглы было выше в группе с обратным скосом, чем в двух других группах (Franseen против острия Menghini против группы с обратным скосом: 2,8 ± 1,0 против 2,9 ± 0,5 против 3,4 ± 1,3, P <0,001). Непрерывное отсасывание с отрицательным давлением с помощью шприца применяли во время ЭУЗИ-ТИА/Б всем пациентам в трех группах. Веерную технику применяли всем пациентам в группе Franseen, тогда как в группе острия Menghini ее выполняли только 53,1% пациентов и 82,2% пациентов в группе иглы с обратным скосом (P < 0,001) с достоверными межгрупповыми различиями.
Таблица 2 Сравнение результатов, связанных с процедурой, между тремя группами.
| Franseen n = 196 | Острие Menghini n=113 | Обратный скос n=360 | P value | ||
|---|---|---|---|---|---|
| Доступы, n (%) | 0.004 | ||||
| Трансдуоденальный | 96 (49.0%) | 60 (53.1%) | 227 (63.1%) | ||
| Трансжелудочный | 100 (51.0%) | 53 (46.9%) | 133 (36.9%) | ||
| Количество прохождений, среднее ± СО | 2.8 ± 1.0 | 2.9 ± 0.5 | 3.4 ± 1.3 | < 0.001 | |
| Применение отсасывания, n (%) | 196 (100.0%) | 113 (100.0%) | 360 (100.0%) | ||
| Количество применений отсасывателя, n (%) | < 0.001 | ||||
| 10 мл | 0 (0.0%) | 0 (0.0%) | 235 (65.3%) | ||
| 20 мл | 196 (100.0%) | 113 (100.0%) | 125 (34.7%) | ||
| Применение стилета, n (%) | 145 (74.0%) | 113 (100.0%) | 275 (76.4%) | < 0.001 | |
| Веерная техника, n (%) | 196 (100.0%) | 60 (53.1%) | 296 (82.2%) | < 0.001 | |
| Технический успех, n (%) | 196 (100.0%) | 113 (100.0%) | 360 (100.0%) | ||
| Нежелательные явления, n (%) | |||||
| Мгновенное кровотечение | 1 (0.5%) | 2 (1.8%) | 5 (1.4%) | 0.546 | |
| Отсроченное кровотечение | 0 (0.0%) | 0 (0.0%) | 0 (0.0%) | ||
| Панкреатит | 3 (1.5%) | 0 (0.0%) | 2 (0.6%) | 0.266 | |
| Инфекция | 0 (0.0%) | 0 (0.0%) | 0 (0.0%) | ||
| Любые сердечно-легочные расстройства. Во время процедуры | 1 (0.5%) | 1 (0.9%) | 0 (0.0%) | 0.263 | |
| Окончательный диагноз, n (%) | 0.010 | ||||
| Воспалительная опухоль | 17 (8.7%) | 19 (16.8%) | 29 (8.1%) | ||
| Доброкачественная опухоль | 18 (9.2%) | 19 (16.8%) | 32 (8.9%) | ||
| ПКБЕ | 1 (0.5%) | 2 (1.8%) | 1 (0.3%) | ||
| Лимфома | 0 (0.0%) | 1 (0.9%) | 3 (0.8%) | ||
| Метастатическая карцинома | 0 (0.0%) | 1 (0.9%) | 3 (0.8%) | ||
| Протоковая аденокарцинома | 160 (81.6%) | 71 (62.8%) | 292 (81.1%) | ||
| Наличие гистологического биопсийного материала, n (%) | 192 (98.0%) | 97 (85.8%) | 331 (91.9%) | < 0.001 | |
| Возможность окрашивания ИГХ, n (%) | 187 (95.4%) | 74 (65.5%) | 318 (88.3%) | < 0.001 | |
- ИГХ – иммуногистохимический; НЭО – нейроэндокринная опухоль; ИПМО – интрапротоковая папиллярно-муцинозная опухоль.
Никаких технических трудностей не возникло ни в одной группе, даже при использовании трансдуоденального доступа. Относительно связанных с процедурой нежелательных явлений, то только у восьми пациентов (8/669, 1,2%) во всей когорте возникло мгновенное кровотечение как нежелательное явление, и всем пациентам в каждой группе было проведено клипирование несколько раз во время одного эндоскопического сеанса. Кроме того, только у пяти пациентов развился легкий острый панкреатит, который потребовал госпитализации в течение 3 дней (1,5% в группе Franseen и 0,6% в группе иглы с обратным скосом P = 0,266). Ни у одного пациента в каждой группе не было существенно отсроченного кровотечения или инфекционных побочных явлений. Гистологическое исследование биопсийного материала было значительно качественнее в группе Franseen, чем в группах с острием Menghini и иглы с обратным скосом (Franseen против острия Menghini против иглы с обратным скосом: 98,0% против 85,8% против 91,9%, P <0,001). Кроме того, образцы биопсии, пригодные для ИГХ-анализа, были получены в 95,4% случаев при использовании иглы Franseen, 65,5% – при использовании иглы с острием Menghini и 88,3% – при использовании иглы с обратным скосом (P < 0,001). Самым распространенным конечным диагнозом в трех группах была протоковая аденокарцинома.
Диагностические характеристики каждой иглы для ЭУЗИД-ТИА/Б
Диагностическая эффективность была рассчитана двумя различными способами с использованием методов обработки образцов. При первичной диагностике с помощью оценки клеточных блоков игла Franseen имела чувствительность 86,09%, специфичность 100,0%, ППЦ 100% и ОПЦ 57,89%, тогда как игла с острием Menghini имела чувствительность 55,71%, специфичность 100,0%, ППЦ 100,0% и ОПЦ 54,41%. (Таблица 3). Кроме того, игла с обратным скосом имела чувствительность 71,98%, специфичность 100,0%, ППЦ 100% и ОПЦ 39,50%. Кроме того, диагностическая точность для иглы Franseen, иглы с острием Menghini и иглы с обратным скосом составляла 88,32%, 71,03% и 76,32%, соответственно. При первичной диагностике с помощью гистологической оценки игла Franseen обеспечила лучшую диагностическую эффективность (чувствительность 95,03%, специфичность 100,0%, ППЦ 100,0% и ОПЦ 81,40%) с точностью 95,92%; игла с острием Menghini обеспечила диагностическую эффективность (82. 67% чувствительность, 100,0% специфичность, ППЦ 100,0% и ОПЦ 74,51%) с точностью 88,50%; в то время как игла с обратным скосом показала диагностическую эффективность (82,61% чувствительность, 100,0% специфичность, ППЦ 100,0% и ОПЦ 53,98%) с точностью 85,56%.
Таблица 3 Эффективность диагностики в соответствии с иглами.
| Franseen, % (95% ДИ) | Острие Menghini, % (95% ДИ) | Обратный скос, % (95% ДИ) | ||||||
|---|---|---|---|---|---|---|---|---|
| Клеточный блок | Гистология | Клеточный блок | Гистология | Клеточный блок | Гистология | |||
| Чувствительность | 86.09% (78.39–91.83) | 95.03% (90.44–97.83) | 55.71% (43.34–67.59) | 82.67% (72.19–90.43) | 71.98% (66.07–77.39) | 82.61% (77.83–86.73) | ||
| Специфичность | 100.00% (84.56–100.00) | 100.00% (90.00–100.00) | 100.00% (90.51–100.00) | 100.00% (90.75–100.00) | 100.00% (92.45–100.00) | 100.00% (94.13–100.00) | ||
| Точность | 88.32% (81.73–93.18) | 95.92% (92.12–98.22) | 71.03% (61.42–79.39) | 88.50% (81.13–93.73) | 76.32% (71.13–80.98) | 85.56% (81.49–89.02) | ||
| Негативное прогностическое значение | 57.89% (46.60–68.42) | 81.40% (69.01–89.58) | 54.41% (47.86–60.82) | 74.51% (64.07–82.73) | 39.50% (34.92–44.26) | 53.98% (47.82–60.03) | ||
| Положительное прогностическое значение | 100.00% (84.56–100.00) | 100.00% (90.00–100.00) | 100.00% (90.51–100.00) | 100.00% (90.75–100.00) | 100.00% (92.45–100.00) | 100.00% (94.13–100.00) | ||
- ДИ – доверительный интервал.
При прямом сравнении диагностических характеристик с использованием гистологических образцов между иглами, игла Franseen показала значительно более высокую чувствительность, чем иглы с острием Menghini (P = 0,003) и иглы с обратным скосом (P < 0,001) (рис. 3). Кроме того, игла Franseen также показала значительно более высокую точность, чем иглы с острием Menghini (P = 0,018) и иглы с обратным скосом (P < 0,001).
Изображение 3. Сравнение эффективности диагностики в соответствии с иглой.
Переменные, связанные с точностью диагностики
Для выявления факторов, связанных с точностью диагностики, были проведены одномерный и многомерный анализы с использованием моделей логистической регрессии (табл. 4). Размер опухоли > 2 см (отношение шансов [ОШ]: 5,36, 95% доверительный интервал [ДИ]: 3,40-8,47) и применение веерной техники (ОШ: 1,70, 95% ДИ: 1,00-2,86) были достоверно связаны с точным диагнозом в многофакторном анализе. Кроме того, игла с острием Menghini была определена как ассоциированная переменная с низкой точностью диагноза (ОШ: 0,54, 95% ДИ: 0,29-1,00, Р = 0,050) с маргинальной значимостью. Кроме того, иглы ТИБ, включая иглы Fransee и иглы с обратным скосом, были достоверно связаны с точным диагнозом по сравнению с иглами ТИБ (иглы с острием Menghini) (ОШ: 2,03, 95% ДИ: 1,21-3,38, P = 0,007).
Таблица 4 Переменные для точного диагноза согласно моделям логистической регрессии.
| Переменная | Одномерный анализ | Многомерный анализ | ||||
|---|---|---|---|---|---|---|
| ОШ (95% ДИ) | P-value | ОШ (95% ДИ) | P-value | |||
| Острие Menghini (vs. Franseen) | 0.43 (0.25–0.73) | 0.002 | 0.54 (0.29–1.00) | 0.050 | ||
| Обратный скос (vs. Franseen) | 1.07 (0.67–1.68) | 0.786 | 1.18 (0.71–1.94) | 0.509 | ||
| 25-калибр (vs. 22-калибр) | 1.23 (0.82–1.87) | 0.320 | ||||
| Размер опухоли ≥ 2 см (против < 2 см) | 5.36 (3.43–8.40) | < 0.001 | 5.36 (3.40–8.47) | < 0.001 | ||
| Трансжелудочный (против транс-дуоденального) | 0.97 (0.66–1.43) | 0.889 | ||||
| Прохождение иглы ≥ 4 (против < 4) | 1.83 (1.14–3.04) | 0.152 | ||||
| Веерная техника (vs без веерной техники) | 2.17 (1.38–3.38) | < 0.001 | 1.70 (1.00–2.86) | 0.047 | ||
| 20 мл отсасывания (против 10 мл отсасывания) | 1.08 (0.73–1.60) | 0.696 | ||||
| Использование стилета (vs. без стилета) | 0.77 (0.46–1.25) | 0.310 | ||||
- ОШ, отношение шансов; ДИ, доверительный интервал.
Обсуждение
Согласно разработке и совершенствованию новых типов игл для ЭУЗИ-ТИА/Б, много исследований 2,14,15,16,17,18,19 показали, что модифицированные с усиленными геометрическими элементами на острие обеспечивают более высокую точность диагностики и забор гистологического материала от солидных опухолей поджелудочной железы. Наше исследование является первым отчетом, в котором сравниваются три типа игл (игла Franseen, игла с обратным скосом и игла с острием Menghini) на предмет соответствия и точности образцов, полученных из каждой иглы. В нашем ретроспективном сравнительном исследовании ЭУЗИ-ТИБ игла Franseen показала более высокий уровень забора гистологического материала, чем иглы с обратным скосом и даже иглы с острием Menghini. Кроме того, игла Franseen продемонстрировала значительно лучшие диагностические показатели, включая 95% чувствительность, 96% точность и 81,4% ОПЦ по сравнению с другими типами игл. В первом предварительном отчете об игле Franseen, Bang и соавт. продемонстрировали, что уникальный корончатый наконечник с трехплоскостными симметричными режущими кромками позволяет лучше таргетировать поражения с меньшей силой проникновения и еще большим захватом ткани 20. После этого они проспективно сравнили клеточную плотность и диагностическую точность четырех типов игл, включая иглы Franseen, иглы с обратным скосом и иглы с острием Menghini 21. В этом исследовании авторы пришли к выводу, что игла Franseen показала самую высокую степень клеточной плотности при солидных опухолях поджелудочной железы, хотя количество пациентов, отнесенных к каждой группе, было относительно небольшим – 32-33 пациента. Кроме того, игла Franseen показала самую высокую диагностическую точность – 92,7%, тогда как иглы с вестями Menghini и с обратным скосом – 74,7% и 67,7% соответственно. Эти результаты полностью согласуются с нашими результатами и гипотезой о том, что патологические результаты ЭУЗИ-ТИА/ТИБ полностью зависят от типа иглы, которая используется для взятия образцов тканей.
Следует отметить, что веерная техника была независимым благоприятным фактором для точной диагностики, хотя первоначальное исследование Bang и соавт. не смогло подтвердить значительное влияние этой техники на диагностические показатели 22. Недавно опубликованное клиническое руководство убедительно свидетельствует, что веерная техника для получения тканей под контролем ЭУЗИ предлагает технически приемлемую реализацию и лучшие диагностические результаты, включая меньшее количество проходов иглы, необходимых для установления точного диагноза, чем стандартная техника 3. Таким образом, наше исследование подтверждает необходимость рутинного применения веерной техники при проведении ЭУЗИ-ТИА/ТИБ согласно клиническим рекомендациям: веерная техника повышает точность диагностики. Теоретически, применение веерной техники может увеличить вероятность достижения точного диагноза, тем самым уменьшая вероятность неубедительных результатов без дополнительного риска возникновения побочных эффектов или медицинских затрат.
Наше исследование имеет несколько ценных выводов. Во-первых, ЭУЗИ-ТИА/ТИБ с использованием иглы Franseen может уменьшить потребность в ROSE, поскольку ее чувствительность и точность диагностики злокачественности по результатам гистологического исследования превышала 95% без ROSE во всех случаях. Хотя ROSE обеспечивает высокую адекватность образца в каждом конкретном случае при меньшем количестве проходов иглы 23, последние данные наблюдений свидетельствуют о противоречивых результатах, в которых ROSE может быть не связана с улучшением диагностической результативности, включая точность и чувствительность 24. Во-вторых, оптимальное качество гистологического материала, которое может быть достигнуто при специальном окрашивании, таком как ИГХ, было получено в 95% случаев при использовании иглы Franseen. Получение надежного и достаточного количества ткани может обеспечить сохраненную гистологическую архитектуру для специального окрашивания и даже молекулярного профилирования, что имеет важное значение для дифференциальной диагностики других опухолей поджелудочной железы или воспалительных образований и персонализированной противораковой терапии 25 В-третьих, хотя недавние рекомендации 3 рекомендуют, что для достижения точного диагноза требуется минимум четыре прокола, а для опухолей менее 2 см может потребоваться более четырех проколов, в нашем исследовании лучшие диагностические показатели были достигнуты при меньшем количестве проколов иглой Franseen, чем иглами с обратным скосом или с острием Menghini. Поэтому в учреждениях, которые используют иглы с обратным скосом и острием Menghini, мы настоятельно рекомендуем проводить три-четыре прохода для достижения точного диагноза.
Хотя наше исследование является первым, оценивающим диагностическую эффективность трех типов игл для ЭУЗИ-ТИА/Б в большой когорте, оно имело некоторые ограничения, которые могли повлиять на наши окончательные выводы. Во-первых, из-за ретроспективного характера исследования не удалось полностью избежать некоторых технических предубеждений, включая применение отсасывания, стилета или веерной техники. Кроме того, при ретроспективном анализе данных может не хватать определенной информации о важных переменных (информационная погрешность). Хотя мы скорректировали потенциально запутанные переменные, включая тип иглы, диаметр иглы, размер опухоли, маршрут приближения, количество проходов иглы, скрытые или неизмеряемые факторы могли остаться. Поэтому это исследование все еще имеет важные ограничения. Мы надеемся, что это ограничение можно будет преодолеть с помощью рандомизированных контролируемых исследований. Во-вторых, цитопатологические результаты определял один патологоанатом в каждом центре, что могло вызвать предвзятость наблюдателя с интер- и интраобсервационными вариациями. В-третьих, наша методология определения доброкачественных заболеваний не была валидирована. Тем не менее, чтобы избежать ненужного хирургического вмешательства, наша стратегия, включавшая клиническое наблюдение в течение ≥ 6 месяцев с повторными обследованиями, была относительно обоснованной для определения доброкачественных заболеваний, хотя, конечно, не идеальной. В-четвертых, между данным исследованием и многими другими исследованиями по определению злокачественности могла существовать гетерогенность, в которых “высоко суггестивные” образцы можно было бы в целом считать диагностическими и приемлемыми 26. Однако, могли возникнуть расхождения в диагностических показателях, если высоко суггестивные образцы были отнесены к категории диагностики злокачественности или нет.
В завершение, для установления оптимальной иглы и техники, которая может обеспечить точный диагноз, мы считаем, что наши предложения по использованию иглы Franseen при веерной технике могут позволить стандартизировать практику получения тканей под контролем ЭУЗИ при раке поджелудочной железы. Кроме того, иглы ТИБ с любой геометрией армирования вместо стандартных игл ТИА могут быть рекомендованы независимо от модели и производителя игл.
Доступность данных
Наборы данных, сгенерированные и/или проанализированные в ходе этого исследования, можно получить у соответствующего автора по обоснованному запросу.
Ссылки на источники
- ASGE Standards of Practice Committee et al. The role of endoscopy in the evaluation and management of patients with solid pancreatic neoplasia. Gastrointest. Endosc. 83, 17–28 (2016).
- Bang, J. Y., Hawes, R. & Varadarajulu, S. A meta-analysis comparing ProCore and standard fine-needle aspiration needles for endoscopic ultrasound-guided tissue acquisition. Endoscopy 48, 339–349 (2016).
- Chung, M. J. et al. Clinical and technical guideline for endoscopic ultrasound (EUS)-guided tissue acquisition of pancreatic solid tumor: Korean society of gastrointestinal endoscopy (KSGE). Gut Liver 15, 354–374 (2021).
- Polkowski, M. et al. Technical aspects of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Technical Guideline—March 2017. Endoscopy 49, 989–1006 (2017).
- Dim, D. C. et al. The usefulness of S100P, mesothelin, fascin, prostate stem cell antigen, and 14-3-3 sigma in diagnosing pancreatic adenocarcinoma in cytological specimens obtained by endoscopic ultrasound guided fine-needle aspiration. Diagn. Cytopathol. 42, 193–199 (2014).
- Hasegawa, T. et al. Evaluation of Ki-67 index in EUS-FNA specimens for the assessment of malignancy risk in pancreatic neuroendocrine tumors. Endoscopy 46, 32–38 (2014).
- Park, S. W. et al. The diagnostic performance of novel torque technique for endoscopic ultrasound-guided tissue acquisition in solid pancreatic lesions: A prospective randomized controlled trial. J. Gastroenterol. Hepatol. 35, 508–515 (2020).
- Sun, B., Yang, X., Ping, B., He, Y. & Zhang, Z. Impact of inconclusive endoscopic ultrasound-guided fine-needle aspiration results in the management and outcome of patients with solid pancreatic masses. Dig. Endosc. 27, 130–136 (2015).
- Matsubayashi, H. et al. Pathological and molecular aspects to improve endoscopic ultrasonography-guided fine-needle aspiration from solid pancreatic lesions. Pancreas 47, 163–172 (2018).
- Oh, D. et al. The impact of macroscopic on-site evaluation using filter paper in EUS-guided fine-needle biopsy. Endosc. Ultrasound 8, 342–347 (2019).
- Iglesias-Garcia, J. et al. Feasibility and yield of a new EUS histology needle: Results from a multicenter, pooled, cohort study. Gastrointest. Endosc. 73, 1189–1196 (2011).
- Fabbri, C. et al. Endoscopic ultrasound-guided fine needle aspiration with 22- and 25-gauge needles in solid pancreatic masses: A prospective comparative study with randomisation of needle sequence. Dig. Liver Dis. 43, 647–652 (2011).
- Park, S. W. et al. Prospective study for comparison of endoscopic ultrasound-guided tissue acquisition using 25- and 22-gauge core biopsy needles in solid pancreatic masses. PLoS ONE 11, e0154401 (2016).
- Chong, C. C. N. et al. EUS-FNA using 22G nitinol or ProCore needles without on-site cytopathology. Endosc. Ultrasound 7, 56–60 (2018).
- Fujie, S. et al. Comparison of the diagnostic yield of the standard 22-gauge needle and the new 20-gauge forward-bevel core biopsy needle for endoscopic ultrasound-guided tissue acquisition from pancreatic lesions. Gut Liver 13, 349–355 (2019).
- Kandel, P. et al. EUS-guided fine needle biopsy sampling using a novel fork-tip needle: A case-control study. Gastrointest. Endosc. 84, 1034–1039 (2016).
- Naveed, M. et al. A Multicenter comparative trial of a novel EUS-guided core biopsy needle (SharkCore™) with the 22-gauge needle in patients with solid pancreatic mass lesions. Endosc. Ultrasound 7, 34–40 (2018).
- Bang, J. Y. et al. Randomized trial comparing the Franseen and Fork-tip needles for EUS-guided fine-needle biopsy sampling of solid pancreatic mass lesions. Gastrointest. Endosc. 87, 1432–1438 (2018).
- Mukai, S. et al. A retrospective histological comparison of EUS-guided fine-needle biopsy using a novel Franseen needle and a conventional end-cut type needle. Endosc. Ultrasound 8, 50–57 (2019).
- Bang, J. Y. et al. Endoscopic ultrasonography-guided biopsy using a Franseen needle design: Initial assessment. Dig. Endosc. 29, 338–346 (2017).
- Bang, J. Y. et al. Comparing needles and methods of endoscopic ultrasound-guided fine-needle biopsy to optimize specimen quality and diagnostic accuracy for patients with pancreatic masses in a randomized trial. Clin. Gastroenterol. Hepatol. 825, 19 (2021).
- Bang, J. Y., Magee, S. H., Ramesh, J., Trevino, J. M. & Varadarajulu, S. Randomized trial comparing fanning with standard technique for endoscopic ultrasound-guided fine-needle aspiration of solid pancreatic mass lesions. Endoscopy 45, 445–450 (2013).
- Matynia, A. P. et al. Impact of rapid on-site evaluation on the adequacy of endoscopic-ultrasound guided fine-needle aspiration of solid pancreatic lesions: A systematic review and meta-analysis. J. Gastroenterol. Hepatol. 29, 697–705 (2014).
- Kong, F. et al. Rapid on-site evaluation does not improve endoscopic ultrasound-guided fine needle aspiration adequacy in pancreatic masses: A meta-analysis and systematic review. PLoS ONE 11, e0163056 (2016).
- Biankin, A. V. & Hudson, T. J. Somatic variation and cancer: Therapies lost in the mix. Hum. Genet. 130, 79–91 (2011).
- Nayar, M. K. et al. Comparison of the diagnostic performance of 2 core biopsy needles for EUS-guided tissue acquisition from solid pancreatic lesions. Gastrointest. Endosc. 85, 1017–1024 (2017).