Ультразвуковая эластография – это новый метод, который генерирует изображения на основе жесткости ткани в отличие от анатомического представления. Многие заболевания органов имеют различные показатели жесткости, которые могут быть обнаружены с помощью эластографии. Ультразвуковая эластография используется для оценки многих органов.
Richard G. Barr, MD, PhD, FACR, FSRU
ОСНОВНЫЕ ПОЛОЖЕНИЯ
Существуют 2 типа эластографии: компрессионная эластография – качественная, и сдвиговолновая эластография – количественная. Хотя очаговые злокачественные поражения печени являются статистически жестче, чем доброкачественные, все же существует значительные сходства между показателями. Поэтому для любого отдельного поражения эластография ограничена характеристикой поражение доброкачественной или злокачественной природы.
Сдвиговолновая эластография является отличным неинвазивным методом для оценки фиброза печени.
Эластография может оценить характер жидкости – серозный или коллоидный.
Измерения жесткости печени и селезенки могут служить неинвазивным методом оценки печеночного венозного давления.
ВВЕДЕНИЕ
Ультразвуковая эластография – это новый метод, который генерирует изображения на основе жесткости ткани в отличие от анатомического представления. Многие заболевания органов имеют различные показатели жесткости, которые могут быть обнаружены с помощью эластографии. Ультразвуковая эластография используется для оценки многих органов.
Существуют 2 типа эластографии: компрессионная эластография (КЭ) – качественная, и сдвиговолновая эластография (СВЭ) – количественная.
Локальные образования печени имеют смешанную картину на эластографии, с большим наложением в жесткости при доброкачественных и злокачественных поражениях, что делает проблемным характеристику этих образований в печени. Тем не менее, диффузные заболевания печени, такие как фиброз, могут быть исследованы, в том числе в динамике с помощью СВЭ. Сдвиг волны не распространяется в простой жидкости. Начальные исследования показывают, что изображение сдвига волны может быть полезным в характеристике кистозных поражениях как серозной, так и муцинозной природы. Оценка других органов брюшной полости – ограничена.
Диффузные заболевания печени являются одними из основных проблем здоровья в мире. Гепатиты представляют собой группу поражений печени, характеризующиеся воспалением печени и некрозом гепатоцитов. Гепатит может быть острым или хроническим, если эти изменения сохраняются в течение, по крайней мере, 6 месяцев. Вирусы гепатита С (HCV) и гепатита В (HBV) являются ведущими причинами хронических заболеваний печени. Считается, что 180 и 350 миллионов человек по всему миру заражены гепатитом С и В соответственно. Годовая смертность – от 500000 до 700000 при С и 350000 человек при В гепатитах соответственно.
У пациентов с HCV, неспособность к самостоятельной эрадикации вируса – от 50% до 90% случаев в зависимости от пути передачи, присутствия симптоматического гепатита и возраста в котором произошло инфицирование. В западных странах гепатит С – основное показание для пересадки печени.
Хроническое поражение печени переходит в печеночный фиброз, характеризующийся увеличением внеклеточного матриксного материала, продуцируемого фибробластоподобными клетками в паренхиме печени. Следовательно, печень становится жестче, чем обычно, и искажение нормального строения печени может привести к портальной гипертензии. Фиброз является основной характеристикой, связанной с прогрессированием хронического гепатита. Это может приводить к циррозу печени, результатом чего может стать печеночная недостаточность, повышается риск гепатоцеллюлярной карциномы (ГЦК), и, в конечном счете, смерти.
Гистологическая оценка биопсии печени осуществляется с применением системы баллов, которые отражают значения для различных категорий воспаления (фаза) и фиброза (стадия). Есть несколько систем оценок, однако все имеют сходные черты. При оценке хронического гепатита С, наиболее воспроизводимая система баллов – Metavir. В этой системе фиброз печени оценивается полуколичественно и стадируется по 5-балльной шкале от 0 до 4 (F0, отсутствует; F1, фиброзное увеличение портального тракта; F2, перипортальный или начальный порто-портальный перегородочный фиброз с нетронутой архитектурой; F3, архитектурная перестройка, но без очевидных признаков цирроза; и F4, цирроз).
Прогрессирование заболевания печени происходит в течение несколько десятилетий и ускоряется воздействием кофакторов, таких как потребление алкоголя, сахарный диабет, пожилой возраст инфицирования, вирус иммунодефицита (ВИЧ), сочетание с другой инфекцией или вирусами. В зависимости от влияния кофакторов, от 10% до 40% случаев у пациентов с хроническим вирусным гепатитом С развивается цирроз. Прогноз хронического заболевания печени сильно зависит от степени фиброза печени с угрожающими жизни осложнениями, которые могут возникнуть у пациентов с циррозом. Смерть, связанная с осложнениями цирроза, составляет примерно 4% в год, в то время как ГЦК в этой группе встречается от 1% до 5% в год. Таким образом, точная оценка степени печеночного фиброза является основной для определения выживаемости, назначения лечения и прогноза.
Цирротическая трансформация печени связана со структурными и биологическими изменениями, ответственными за увеличение портального давления. Хотя биопсия печени остается стандартом для установления диагноза диффузного заболевания печени, это – инвазивный метод, связанный с дискомфортом для пациентов и, в редких случаях, серьезными осложнениями. Он ограничен значительной вариабельностью при оценке исследователями и ошибками при выборе материала. Неинвазивные методы определения фиброза печени позволяют провести скрининг раннего фиброза, что позволяет начать лечение на этапе с наилучшим эффектом. Кроме того, это позволяет неинвазивно мониторировать эффект лечения.
ПРИНЦИПЫ ЭЛАСТОГРАФИИ
Эластография – новый метод в сонографии, который может обеспечить клинически полезной информацией, что было ранее недоступно. Эластография является методом визуализации на основе жесткости ткани, а не анатомии. Пальпация используется для оценки злокачественной опухоли более тысячи лет (24). Ультразвуковую эластографию можно рассматривать как эквивалент изображения пальпации, при этом давая возможность количественно оценить жесткость поражения, которое раньше оценивалось только субъективно при физикальном обследовании. Есть 2 типа эластографии: компрессионная эластография (КЭ) и сдвиговолновая (СВЭ). КЭ воспроизводит изображение на основе того, как ткани реагируют на силу смещения от внешнего источника или самого пациента. Эта сила смещения позволяет провести качественную оценку поражения. При СВЭ применяется специальный сильный низкочастотный акустический импульс (толчковый импульс), который приводит к распространению поперечной волны, что может быть измерено, как скорость сдвига. Поскольку скорость сдвига волны через ткани зависит от жесткости тканей, могут быть получены количественные значения жесткости.
КОМПРЕССИОННАЯ ЭЛАСТОГРАФИЯ
КЭ определяет относительную деформацию или эластичность ткани в пределах контрольного объема/поля зрения (ПЗ). Чем больше деформируется объект при приложении усилия, тем выше упругость и мягче очаг поражения. Чтобы определить упругость ткани или повреждения, необходимо оценить, как поражение деформируется при применении внешнего воздействия. Например, если миндаль положить в сосуд с желатином и надавить на желатин, то последний будет деформирован. Это говорит о том, что он сам по себе мягкий и обладает высокой упругостью. Тем не менее, миндаль не деформируются, потому что он твёрдый и имеет низкую упругость.
КЭ осуществляется на стандартном ультразвуковом оборудовании с определенным программным обеспечением, которое оценивает покадровые различия в деформации при исследовании под внешним воздействием.
Сила может быть как от движения пациента, например, дыхание, сердцебиение, так и внешнего воздействия с ритмичным прижатием ультразвукового преобразователя в качестве источника движения. Получение оптимальных изображений зависит от системы. При КЭ, абсолютное значение деформации не может быть рассчитано, так как сила нажатия не может быть точно измерена. В режиме реального времени изображение КЭ отображается со шкалой, основанной на отношениях натяжения тканей в пределах поля зрения.
Результаты могут быть отображены в сером масштабе или на различных цветных дисплеях; предпочтение чаще определяется самим пользователем, в зависимости от удобства в интерпретации. В сером масштабе мягкие ткани кодируются белым, в то время как твердые – черным. Важно помнить, что при КЭ отображается относительная эластичность и ее не следует путать с изображением СВЭ, где оценивается абсолютная упругость и кодируется в цвете на попиксельной основе. Несколько факторов, влияющих на эластограмму важны при выполнении КЭ, в том числе: что за ткани включены в поле зрения, количество предварительного сжатия и движение ткани.
ЭЛАСТОГРАФИЯ ПРИ ИСПОЛЬЗОВАНИИ АКУСТИЧЕСКОЙ ЛУЧЕВОЙ ИМПУЛЬСНОЙ ВИЗУАЛИЗАЦИИ ARFI
Использование акустической лучевой импульсной визуализации (АЛИВ) (импульсный толчок) может быть использован в качестве источника смещение ткани. Эта техника называется ARFI. Этот толчковый импульс генерирует как осевое смещение, так и поперечное смещение волн. Как появляется изображение смещения поперечных волн описано ниже. Когда измеряется осевое смещение – техника аналогична КЭ, и называется Virtual Touch Imaging (VTI; Siemens Ultrasound, Mountain View, CA, USA) – качественная эластография с помощью сдвиговой волны.
Существует несколько различий между КЭ и VTI. Одним из важных отличий является то, что сила излучение при ARFI максимизируется в точке в фокусе, тогда как при КЭ натяжение тканей фиксируется более равномерно во все стороны, что основано на компрессии датчиком, степени усилия, применяемого локально, и изменяющееся с глубиной. Таким образом, соотношение натяжения тканей для VTI не должны быть использованы в качестве полуколичественного метода. Количественное значение жесткости не могут быть получены с помощью VTI. Сила ARFI импульса ограничивается путями входа энергии в тело и, таким образом, может быть ограничена по глубине проникновения. В общем ARFI толчковый импульс ограничен в перемещении не глубже чем 8-9 см при абдоминальном применении.
Если ARFI толчковый импульс используется для генерации тканевого смещения, то ручное смещение не должно быть использовано. Датчик должен быть зафиксирован, а пациент должен задержать дыхание и оставаться неподвижным при исследовании.
СДВИГОВОЛНОВАЯ ЭЛАСТОГРАФИЯ SWE
Второй метод для определения свойств упругости тканей является СВЭ SWE. При этой технике, начальный ARFI импульс (импульсный толчок) применяется к ткани, которая индуцирует поперечную волну, перпендикулярную ультразвуковому лучу. Этот способ подобен броску камня (толчковый импульс) в пруд с водой, при этом рябь соответствуют поперечным волнам. Обычный B-режим используется для расчета скорости сдвига волны проходящей через ткани. Эта техника показана на рис. 1. Скорость сдвига волны пропорциональна жесткости. Плотность поражения может отображаться как скорость сдвига волны (Vs) (метры /с [м/с]) через ткани, или модуль деформации (кПа [кПа]). При СВЭ количественную оценку жесткости ткани получают либо в предполагаемой точке пересечения или поле зрения кодируется в цвете на попиксельной основе Vs (2-мерная [2D] – СВЭ). Три системы сдвиговолновой эластографии доступны для применения в брюшной полости. В аппарате ACUSON S3000 ultrasound system (Siemens) может быть получено измерение в небольшой зоне (количественное значение степени смещения ткани), а также одно изображение с измерением скорости сдвига волны в выбранной области. Подобная техника доступна на IU22 и EPIQ (Philips Ultrasound, Bothell, WA, USA), который называется ElastPQ. В Aixplorer (SuperSonic Imagine, ix-en-Provence, France) эффект толчковых импульсов усиливается посылкой серий импульсов, сфокусированных на увеличивающейся глубине быстрее, чем скорость сдвига волны, таким образом генерируется больший конус атаки. Высокая частота кадров изображения достигается путем передачи плоских волн, что отображает все поле зрение (ПЗ) в одном исследовании. В результате скорости сдвига волны могут быть измерены и отображены (м/с или кПа) в качестве количественного цветного накладываемого изображения с частотой кадров около 1 кадра в секунду.
Рис. 1. Высокоэнергетические ARFI импульсы (А) являются генераторами поперечных волн, т.е. перпендикулярно толчковому импульсу. Обычный ультразвук используется для мониторинга сдвига волны в ткани (В). Сдвиги волн имеют более высокую интенсивность сигнала ближе к толчковому импульсу, амплитуда пика уменьшается с расстоянием от толчкового импульса (С). Измерив время до пика и расстояние от толчкового импульса (D), может быть вычислена скорость сдвига волны. Это может быть выражено либо в виде скорости в м/с или модуле Юнга в кПа.
ЭЛАСТОГРАФИЯ ПРИ ОЧАГОВЫХ ПОРАЖЕНИЯХ ПЕЧЕНИ
Оба исследования КЭ и СВЭ могут быть использованы для оценки очаговых поражений печени. Так как КЭ является качественным методом, поражение может быть сравнено с “нормальной” печенью, т.е. можно определить, является ли поражение тверже или мягче, чем фоновая ткань печени. Тем не менее, этот метод ограничен тем, что фоновая ткань печени может иметь переменную жесткость в зависимости от степени стеатоза или фиброза. К тому же и доброкачественные и злокачественные поражения печени могут быть и твердыми, и мягкими в сравнении с нормальной печенью. При СВЭ мы получаем величину жесткости, однако в связи с широкой вариабельностью патологической жёсткости, отличить доброкачественное поражения от злокачественного является проблематичным. Например, в серии исследований Yu and Wilson гемангиома имела диапазон Vs от 0,87 до 4,01 м/с, в среднем 0,71 м/с, в то время как ГЦК имела диапазон от 0,77 до 4,34 м/с, в среднем 1,01 м/с. В целом, разница в Vs у злокачественных 2,57 +-1,01 м/с и доброкачественных новообразований 1,73+- 0,8 было статистически значимым (P <0,01); Тем не менее, большой перекрест плотности между доброкачественными и злокачественными образованиями делает технику ненадежной для массовой оценки образований печени в каждом конкретном случае. На Рис. 2 показана эластограмма сдвига волны пациента с множественным метастатическим поражением при колоректальном раке, продемонстрирована изменчивость метастатических поражений у того же пациента.
В настоящее время, использование эластографии не рекомендуется для характеристики фокусных поражений печени. Эластография может быть использована для улучшения визуализации поражения для биопсии (рис. 3) и может быть полезна в оценке эффекта лечения.
ДИФФУЗНЫЕ ПОРАЖЕНИЯ ПЕЧЕНИ
Фиброз печени – серьезная проблема во всем мире. При его прогрессировании, ухудшается функция печени и увеличивается риск рака печени. Эти хронические заболевания печени характеризуется перераспределением фиброзной ткани в печени. Важно определить стадию фиброза печени для прогнозирования выживаемости и выбора вариантов лечения. На ранних стадиях, фиброз является обратимым, в то время как болезни, которые привели к циррозу, наиболее вероятно – необратимы.
Рис. 2. 2D сдвиговолновая эластограмма печени у пациента с диффузной метастатической колоректальной карциномой демонстрирует заметное различие жесткости метастатических поражений (белые кружки), один со средним значением 32 кПа, а другой со значением 81 кПа. Широкий диапазон жесткости перекрывает как доброкачественные, так и злокачественные поражения, значительно ограничивая использование сдвиговолновой эластограммы в характеристике локальных поражений печени.
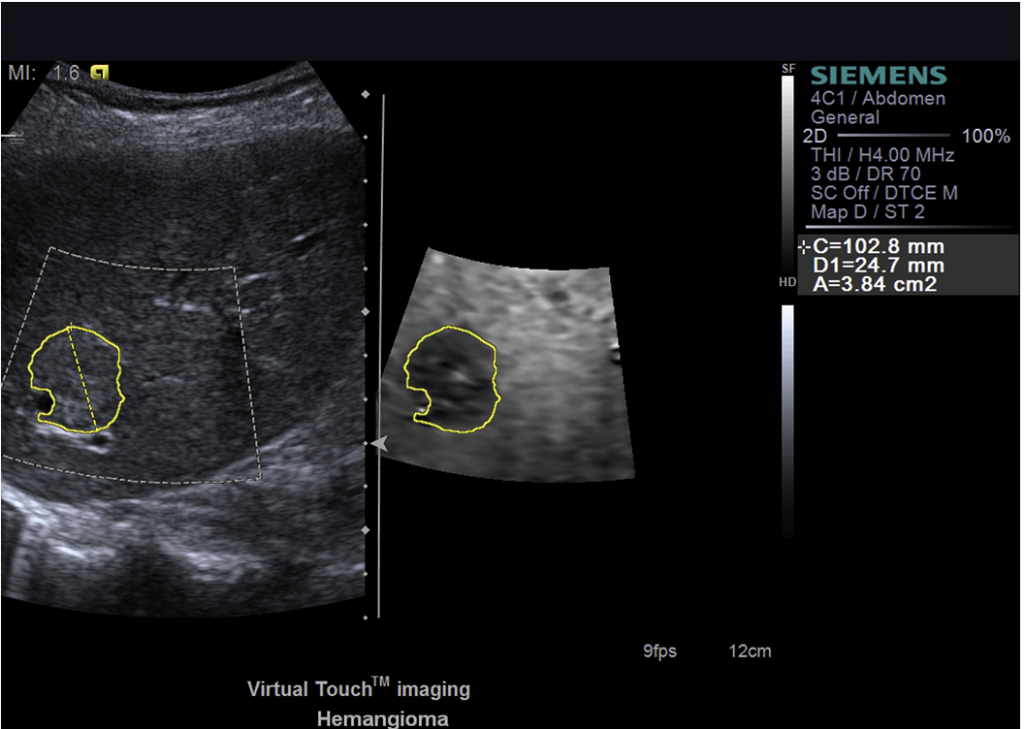
Рис. 3. Virtual Touch Imaging гемангиомы печени. Изображение слева в В-режиме. Гемангиома плохо визуализируется в B-режиме. Изображение справа – Виртуальное сенсорное изображение. Поражение более плотное, чем окружающая печень и таким образом отображается темнее. (Предоставлено Д. Clevert, MD, Мюнхен, Германия.)
В настоящее время единственным методом постановки диагноза фиброз является биопсия печени. Биопсия печени рассматривается как золотой стандарт для оценки фиброза, его классификации и стадии, а также классификации некротически-воспалительной активности. Но необходимо учитывать его инвазивность с потенциальными осложнениями, которые могут быть тяжелыми до 1% случаев. Биопсия печени представляет примерно 1/50000 объема печени, что приводит к вариабельности результатов у разных исследователей при микроскопическом исследовании. Поэтому, неинвазивные методы оценки фиброза печени всегда были в интенсивном исследовании, в том числе эластографические методы, использующие ультразвук и магнитно-резонансную томографию.
Существуют разные направления методов эластографии печени для оценки фиброза, которые не эквивалентны, и это означает, что пороговые величины являются специфичными для определенной системы и не могут быть просто сравнены с другими вариантами исследований.
Существуют много искажающих факторов, которые могут повлиять на результаты эластографии. Эти факторы включают: пациент-зависимые факторы, такие как застойная сердечная недостаточность, обострение острого гепатита, связанное с повышением трансаминаз, прием пищи – все это делает печень жестче. Индуцированное повышение жесткости можно увидеть при внепеченочном холестазе, при использовании бета-блокаторов, а также путем проведения пробы Вальсальвы. Измерения должны проводиться во время задержки дыхания в нейтральном дыхательном положении. Измерения, проведенные в левой доле печени, часто ненадежны и менее воспроизводимы. Жесткость печени выше в районе от 1,5 см до 2,0 см от края капсулы печени и в этом месте не следует проводить измерения. Крупные сосуды также не должны быть включены в области исследования.
ТРАНЗИЕНТНАЯ ЭЛАСТОГРАФИЯ
Транзиентая эластография (TЭ) внедрена в 2003 году как первый ультразвуковой метод эластографии печени, и имеет самое большое количество публикаций. Это исследование осуществляется с помощью FibroScan (Echosens, Париж, Франция). TЭ выполняется на специализированном оборудовании с определенным датчиком через межреберные промежутки. Датчик содержит электродинамический преобразователь, который используется для генерации переходных смещений с частотой 50 Гц с 2-мм двойной амплитудой (с помощью М датчика). Одноэлементный ультразвуковой преобразователь (3.5 МГц с M датчиком) установлен на оси вибратора. Преобразователь используется в обычном эхо приемнике для обеспечения А-режима и M-режима изображения для локализации печени для оператора в режиме реального времени. Когда измерение выполнено, генерируется сверхбыстрый импульс с повторением с частотой 6 кГц при распространении контролируемых поперечных волн. Получение данных длится 80 мс и натяжение. индуцированное в печени путем распространения поперечных волн, измеряется с помощью стандартного автокорреляционного подхода между последовательными ультразвуковыми линиями. Пациент лежит на спине, правая рука за головой. Рекомендуется выполнять 10 полных измерений, чтобы иметь завершенное обследование и при этом медиана всех полных измерений используется в качестве окончательного показателя жесткости печени (ЖП). Значения определяются в килопаскалях. Измерения печени человека колеблются в диапазоне от 1,5 кПа до 75,0 кПа. Весь объем паренхимы печени, исследуемый при ТЭ как минимум в 100 раз больше, чем при биопсии печени. Различные датчики доступны для пациентов с различной конституцией тела. Воспроизводимость измерений ТЭ у одного или нескольких операторов находится на высоком уровне (внутригрупповой коэффициент корреляции [ВКК] 0,98 в обоих случаях) у пациентов без ожирения. Значения TЭ выше у мужчин, чем у женщин.
ТЭ не может быть выполнена у пациентов с асцитом. Изображений в В-режиме нельзя получить на FibroScan. При 13369 исследованиях ЖП, проведенных стандартным датчиком, процент неудачных исследований – 3,1% , а недостоверный результат – в 15,8%. Частота неудачных исследований связана с индексом массы тела (ИМТ) больше, чем 30 кг / м2, возраст – более 52 лет и сахарный диабет 2 типа. В другом исследовании частота неудачных исследований со стандартным датчиком коррелирует с ИМТ. Частота неудачных исследований – 7% для ИМТ больше или равно 30 кг/м2 , 19% – для ИМТ больше или равно 35 кг/м2, 59% – для ИМТ больше или равно 40 кг/м2. Однако частота неудачных исследований значительно снизилась у пациентов при использовании датчика XL.
У пациентов с хроническим гепатитом С ЖП имела значение более чем 6,8 – 7,6 кПа, что означает высокую вероятность значимого фиброза (F=2 и более) при биопсии. Критические значения для прогнозирования цирроза (F=4) варьируют в диапазоне от 11,0 до 13,6 кПa. Хотя TЭ и является менее точной, в оценке различия между стадиями фиброза, но она может отличить отсутствие и легкий фиброз от значительного фиброза и цирроза. Мета-анализ при рецидивирующем посттрансплантационом гепатите С показал 98% чувствительность и 84% специфичность ТЭ для прогнозирования цирроза. Использование TЭ при хроническом гепатите С было одобрено в рекомендациях по лечению вирусного гепатита Европейской ассоциацией по изучению печени.
При хроническом гепатите В, недавний мета-анализ приводит среднюю площадь под рабочей кривой (СППРК) для диагностики значимого фиброза (F2) и цирроза печени (F4) от 0,859 до 0,929. При хроническом гепатите В острое воспаление не является редкостью и может влиять на измерение ЖП. Было высказано предположение, что критические значения должна быть скорректированы в зависимости от уровня аланинаминотрансферазы.
Исследования, проведенные у пациентов с неалкогольной жировой болезнью печени (НАЖБП) и неалкогольным стеатогепатитом (НАСГ), выявили стеатоз, который, как оказалось, не влияет на измерение ЖП. Этот стеатоз не влияет на скорость поперечных волн, но удлиняет их. Wong сравнивает TЭ с биопсией печени у 246 пациентов НАЖБП с 91% чувствительностью и 75% специфичностью для прогнозирования тяжелого фиброза (F=> 3), используя пороговое значение 7,9 кПа.
ТЭ использовалась для оценки многих других диффузных заболеваний печени с похожими хорошими результатами. ТЭ может использоваться как скрининг для выявления фиброза в популяции. 1190 больных старше 45 были исследованы при медосмотре – 7.5% имели ЖП более чем 8 кПа. Биохимия печени была нормальной у этих пациентов, тем не менее, причина хронического поражения печени была обнаружена в 43%.
Изучалось использование ТЭ для прогнозирования осложнений цирроза печени, таких как портальная гипертензия, а также смертности. СППРК для прогнозирования клинически значимой портальной гипертензии (печеночный градиент венозного давления 12 мм рт.ст.) была от 0,94 до 0,99, для порогового значения – от 13,6 до 21 кПa. Также были оценены измерения жесткости селезенки, что показало лучшую корреляцию с портальным давлением (г= 0,89) у больных с циррозом, чем значения ЖП. Жесткость селезенки имела большее значение СППРК (0,966) для идентификации больных с портальной гипертензией с градиентом печеночного венозного давления больше или равным 10 мм Hg. Пороговые значения ТЭ от 19,8 до 47,5 кПа позволяли предсказать варикозное расширение вен пищевода класса 2 или 3 при СППРК от 0,72 до 0.78. Из-за широкого разброса в значениях между исследованиями, TЭ не могжет заменить эндоскопию верхнего отдела желудочно-кишечного тракта для выявления пациентов с варикозным расширением вен пищевода.
В большом проспективном исследовании больных с хроническим гепатитом С ТЭ была более точной чем биопсия печени при прогнозировании. Пациенты при показателях ТЭ более 9,5 кПа имели достоверно низкую 5-летнюю выживаемость.
Два проспективных исследования оценивают риск развития ГЦС, развивающийся в 3-х летний период у 866 больных с хроническим гепатитом С и 1130 с гепатитом В. Риск развития ГЦК параллелен с увеличением ЖП, причем не только у пациентов разделенных на тех, у кого есть цирроз и нет, а и в группах пациентов с различным риском с уже установленным циррозом. Европейская ассоциация ультразвука в медицине приняла следующие рекомендации для клинического использования ТЭ.
TЭ может быть использован для оценки тяжести фиброза печени у пациентов с хроническим вирусным гепатитом, при условии, что искажающие факторы принимаются во внимание, а особенно, чтобы выделить пациентов с нулевым и мягким фиброзом, а также со значительным фиброзом и больных с циррозом. TЭ полезна для оценки фиброза печени у пациентов с НАЖБП, у больных с алкогольными заболеваниями печени, с ВИЧ и гепатитом С. Другие типы хронических заболеваний печени также могут быть исследованы, но применение метода ограничено.
TЭ полезна для оценки фиброза печени у пациентов с посттрансплантационным рецидивом хронического гепатита С.
TЭ имеет значение для прогнозирования осложнений цирроза печени, портальной гипертензии, ГЦК и печень-ассоциированной летальности, но не может заменить эндоскопию для выявления пациентов с варикозно расширенными венами.
ОЦЕНКА СКОРОСТИ СДВИГА ВОЛНЫ
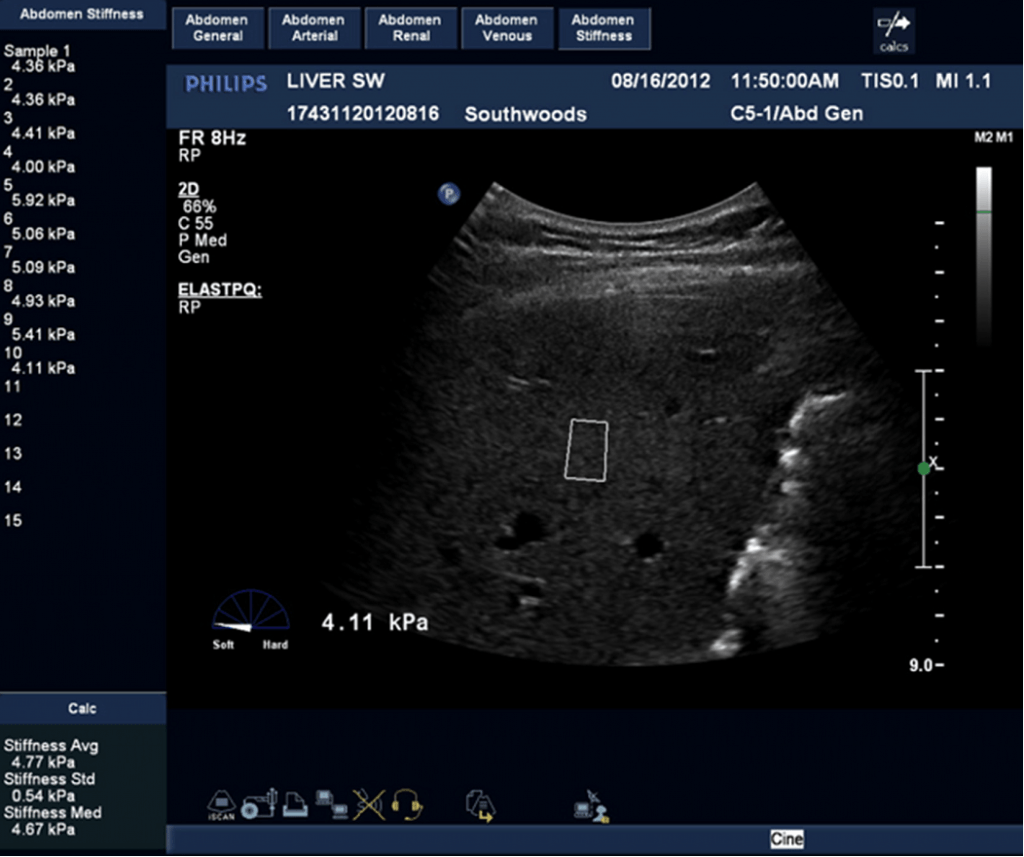
С увеличением фиброза, печень становится плотнее, что можно определить с помощью СВЭ. При этой технике, контрольный объем/поле зрения (ПЗ) помещают в область печени, которая не содержит больших сосудов. Межреберный доступ в 8-м сегменте печени обеспечивает более точные результаты. Серию измерений проводят в то время, как пациент задерживает дыхание. Среднее значение этих измерений используется для оценки степени фиброза печени. На рис. 4 показаны результаты 27-летнего пациента с хроническим гепатитом С. Средняя жесткость 4,77 кПа согласуется с результатами биопсии печени пациента с мягким фиброзом. Рис. 5 представляет собой изображение пациента с выраженным циррозом, определена повышенная жесткость 66 кПа.
Использование этой новой технологии в клинической практике только изучается. Использование этого метода может уменьшить количество биопсий печени, выполняемых для оценки ее хронических заболеваний. Потенциальное применения этой техники включает оценку цирроза печени, заподозренного, но не очевидного на УЗИ в В-режиме, обследование пациентов с хроническим гепатитом С, наблюдение за пациентами для оценки прогрессирования заболевания и необходимости начала лечения.
СВЭ может быть выполнена в небольшом ПЗ (точечная СВЭ (тСВЭ)), или в цветовой кодировке скорости сдвига волны (в м/с или в кПа) в большом ПЗ.
Как и при КЭ, пациенты должны соблюдать диету по крайней мере в течение 4 часов. Измерения СВЭ выполняются в межреберных промежутках над правой долей печени с использованием традиционных изогнутых датчиков. Правая рука находится за головой пациента. Датчик ставится вдоль межреберья, ограничиваясь тенью ребер. ПЗ должно находиться, по крайней мере, на 1,5-2 см ниже капсулы печени так, чтобы не включать в себя крупные сосуды. Рекомендуемая глубина между 3 и 7 см. Пациента просят задержать дыхание, но не на вдохе (проба Вальсальвы). При тСВЭ начинается сканирование и отображается измерения скорости сдвига волны. 2D-СВЭ система позволяет в режиме реального времени визуализировать в цветном отображении скорости сдвига волны. Сканирование от 3 до 4 секунд в одном месте необходимо для стабилизации показателей скорости сдвига волны. Если сигнал слабый или нестабильный, может быть использован пенетрационный режим.
Как и при ТЭ, повышеные уровня аминотрансферазы связаны с более высокими значениями ЖП при СВЭ. СВЭ позволяет проводить измерения в различных точках. Сравнение правых и левых долей показывает тенденцию к более высоким значениям в левой доле; однако, результаты, полученные в правой доле печени, всегда более точные в сравнении с биопсией печени.
Все производители рекомендуют проводить серийные измерения и использовать среднее значение для принятия клинического решения. Количество рекомендуемых измерений варьируется в литературе от 5 до 10. Неточные измерения отбрасываются. Неточные значения могут быть связаны с движением датчика или движениями пациента во время исследования. Большинство систем имеют систему оценки качества адекватности измерения скорости сдвига волны, но без показателей для тСВЭ или цветной 2D-СВЭ. Рекомендованные качественные показатели включают: межквартильный интервал менее 30% и долю успешных исследований более 60%.
Была показана вариабельность у разных исследователей при тСВЭ на хорошем уровне, МКК = 0.87. Воспроизводимость между разными исследователями также была достаточная при использовании 2D-СВЭ.
Пороговые значения от 1,21 до 1,34 м/с являются достоверными для прогнозирования выраженного фиброза (F=>2) с СППРК от 0,85 до 0.89. Для диагностики цирроза печени пороговые значения СВЭ варьируются от 1,55 до 2.0 м/с с СППРК 0,89 до 0.93. В недавно проведенном мета-анализе 518 пациентов с хроническим заболеванием печени СППРК был 0,87 для прогнозирования значимого фиброза (F=>2), 0,91 для выраженного фиброза (F=>3) и 0,93 для цирроза. Значения 2D-СВЭ похожи на тСВЭ с СППРК от 0,95 до 0,98 для F =>2, 0,96 для F=>3 и от 0,97 до 0,98 для F=4 (75,76).
Точность СВЭ для оценки фиброза печени соответствует КЭ (71,77). СВЭ позволяет проводить измерения у пациентов с асцитом, в то время как ТЭ – нет. Предварительные выводы использования СВЭ показали обнадеживающие результаты у больных с НАЖБП и НАСГ, а также после трансплантации.
тСВЭ и 2D-СВЭ могут быть рекомендованы для оценки тяжести фиброза печени у пациентов с хроническим вирусным гепатитом, особенно гепатита С. Но пороговые значения между разными методологиями оценки сдвига волны и для различных марок сканеров, использующих ту же методологию, разные.
Рис. 4. СВЭ 28-летнего пациента с хроническим вирусным гепатитом С. Средняя жесткость 4,77 кПа согласуется с результатом биопсии печени пациента с умеренным фиброзом. Белый прямоугольник показывает поле зрения, где было получено измерение. Обратите внимание, что были сделано 10 измерений. Система вычисляет среднюю жесткость, медиану жесткости и стандартное отклонение.
КОМПРЕССИОННАЯ ЭЛАСТОГРАФИЯ
У большинство крупных производителей КЭ доступна, как минимум, на всех высокопроизводительных системах. КЭ не обеспечивает расчет значения жесткости. Поэтому несколько полуколичественных методов интерпретации были предложены: немецкий критерий эластичности, японский критерий эластичности, а также индекс фиброза печени (индекс ФП). Все они основаны на визуальной оценке пространственных характеристик изображения эластичности в рамках ПЗ. В индексе ФП используется 9 характеристик, для того, чтобы вычислить значение жесткости, в том числе среднее и стандартное отклонение относительной величины деформации, сложность и отношение синей области в ПЗ, асимметрия, эксцесс, энтропия, момент обратной разницы и секундный угловой момент. Опубликовано несколько исследований использования КЭ. Однако применение метода ограничено и не может рекомендоваться для клинического использования. На рис. 6 показан пример эластограммы при диффузном заболевании печени.
Рис. 5. Эластограмма 64-летнего мужчины с выраженным алкогольным циррозом, подтвержденным измерением жесткости печени на уровне 55,9 кПа. Белые кружки поля зрения – места измерение жесткости. Измерение в боковой части ПЗ не должны использоваться, поскольку точность измерения уменьшается в боковых участках ПЗ.
ЭЛАСТОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Образования поджелудочной железы могут быть оценены с помощью эластографии, как эндоскопически, так и трансабдоминально. Поджелудочная железа имеет равномерно промежуточную жесткость, но, с возрастом показатели могут стать неоднородными.
При эндоскопическом подходе, используется классификация на основе цветовой шкалы КЭ (красный – мягкий, синий – твердый). Нормальная поджелудочная железа мягкая и однородная, кодируется зеленым. Доброкачественное воспаление поджелудочной железы может выглядеть как пчелиные соты, преимущественно синего цвета, либо вариант в гетерогенном смешанном цвете с преимущественным зеленым или однородно зеленый вариант. Аденокарцинома имеет однородную синюю окраску (жесткость), а также бывает гетерогенная с преимущественно синим в очаге поражения. Однако, эта картина наблюдается и у половины больных с хроническим панкреатитом, так что специфичность метода в диагностике аденокарциномы составляет около 60%. Нейроэндокринные опухоли поджелудочной железы имеют преимущественно синий вариант пчелиных сот, а также однородный синий вариант, вариант с зеленым центром, окруженным синей тканью или однородный зеленый вариант.
Предварительные исследования показывают, что однородный зеленый вариант может быть использован, чтобы исключить озлокачествление. Однако, клиническая значимость этой техники в дифференциации доброкачественных от злокачественных образований ограничена. Воспалительные поражения поджелудочной железы могут быть жесткими или мягкими в зависимости от стадии воспаления. Неоплазма может иметь некротические области, которые проявляются мягкими областями контрастными с жизнеспособной опухолью, которая твердая. Itokawa выделяет коэффициент плотности (плотность поражения по сравнению с плотностью нормальной поджелудочной железы) – 23,7 +- 12,7 при развитии индуративного панкреатита и 39,1+- 20,5 для рака поджелудочной.
В дифференциации доброкачественных и злокачественных опухолей поджелудочной используются количественные и полуколичественные методы эластографии, которые отличаются достаточно высокой точностью. Два мета-анализа эндоскопической ультразвуковой (ЭУЗ) эластографии показали высокую чувствительность, но низкую специфичность в дифференциации локальных опухолей поджелудочной. Компьютеравтоматизированные методы диагностики предлагаются для повышения точности дифдиагностики образований поджелудочной железы.
Существует ограниченное количество публикаций по использованию СВЭ в оценке кистозных образований поджелудочной железы. СВЭ с использованием метода точечного подсчета может помочь отличить злокачественное поражение с серозным компонентом от муцинозного. Серозные жидкости имеют низкую вязкость и не распространяют поперечные волны. Значение XXX или 0 получаются в зависимости от аппарата, с указанием отсутствия сдвига волны в жидкости.
Рис. 6. SE техника в здорового человека (A) и у пациентов с компенсированным циррозом печени (B). ПЗ цветовой эластографии накладывается на обычный B-режим изображения. Красный цвет означает, что ткань мягкая, а синий – твердая. Отображены эластогистограмма и ЖП. (Предоставлено Г. Ferraioli, MD, Италия.)
Тем не менее, муцинозные кистозные поражения имеют высокую вязкость, и могут распространять поперечные волны. В кистах, которых содержится муцин, можно получить скорость сдвига волны (в м/с или кПа). В исследовании D’Onofrio et al. были изучены 14 муцинозных цистоаденомы, 4 псевдокисты, 3 внутрипротоковые папиллярно-муцинозные опухоли и 2 серозные цистоаденомы. Полученные значения варьировали от ХХХХ /0 до 4,85 м/с в муцинозных цистоаденомах, от ХХХХ /0 до 3,11 м/с в псевдокистах, от XXXX / 0 до 4,57 м/с во внутрипротоковых папиллярно-муцинозных новообразованиях. В серозных цистоаденомах все измеренные значения были XXXX / 0 м/с. Диагностическая точность при доброкачественной и злокачественной дифференцировки панкреатических кист составила 78%.
Рис. 7 демонстрирует использование точечного подсчета сдвига волны (А) и использование изображения упругости (В) у пациента с обострением хронического панкреатита. Недавние исследования показали, что диагноз острый панкреатит может быть поставлен с помощью СВЭ с высокой чувствительностью и специфичностью. При использовании порогового значения 1,63 м/с были получены: чувствительность 100% и специфичность 98%. СВЭ показала себя лучше в диагностике острого панкреатита чем В-режим ультразвука и КТ.
В ведущих европейских руководствах и рекомендациях по клиническому использованию ультразвуковой эластографии отмечены следующие тезисы: (1) ЭУЗ эластография рекомендована в качестве дополнительного метода для характеристики очаговых поражений поджелудочной железы; (2) при серьезном клиническом подозрение на рак поджелудочной железы, в случае, когда биопсия не дает результатов или есть отрицательной, плотное очаговое поражения на эластографии и/или выявленное при ЭУЗ с контрастным усилением (гиповаскулярное поражение), – следует руководствоваться клиническим признаками, назначив повторную ЭУЗ тонкоигольную биопсию или направить больного в хирургию; (3) ЭУЗ эластография в настоящее время не может быть рекомендована для диффдиагностики хронического панкреатита и рака поджелудочной железы в связи с их схожей плотностью ткани в большом проценте случаев.
ЭЛАСТОГРАФИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Эластография может показать слоистую структуру кишечной стенки, но они не всегда соответствуют слоям в В-режиме. Техника называется strain rate imaging (SRI) и была предложена для оценки сократимости стенок желудочно-кишечного тракта (ЖКТ). КЭ может быть использована, чтобы оценить жесткость очаговых поражений ЖКТ. КЭ желудочно-кишечного тракта выполняется линейным датчиком и доступна на многих сканерах. SRI доступна только с определенным программным обеспечением и только на одном сканере.
Рис. 7. У этого пациента, который предъявлял жалобы на боль в животе, на изображении в В-режиме показана увеличенная поджелудочная железа с неравномерным контуром и эхогенностью, множественными петрификатами, с умеренным перипанкреатическим отеком. Повышение скорости сдвига волны 4,96 м/с (А), свидетельствует об остром панкреатите. Соответствующее КЭ изображение (B) показывает повышенную плотность (цветовая гамма с красным – твердые ткани) на протяжении всего тела поджелудочной и ее хвоста, что наводит на мысль об остром воспалении (Предоставлено A. Mateen, MD, Хайдарабад, Индия).
Тени от газа кишечника и перистальтики являются серьезной проблемой для эластографии желудочно-кишечного тракта, ухудшая качество изображения, снижая точность полуколичественных эластографических измерений. Необходимо проведение дополнительных исследований, чтобы установить роль эластографии в оценке патологических процессов и моторики.
Предварительные работы показывают, что эластография может быть полезна в оценке стеноза при болезни Крона, вызванного воспалительным или фиброзным процессом. Фиброзный стеноз выглядит плотным, в то время как воспалительный стеноз – мягким. Пациенты с активной болезнью Крона имеют более высокий коэффициент натяжения между воспаленной и нормальной областью, чем пациенты в стадии ремиссии.
Оценка относительной эластичности мышечного слоя стенки желудка возможна и это позволяет отображать распределение натяжения. Проведенные исследования показывают возможность SRI отличить сократительную активность продольных мышечных слоев от круговых, которые не могут быть оценены в B-режиме. SRI использовалась как in vitrо, так и in vivo для мониторинга ответа на введение препарата. Ahmed et al. смогли идентифицировать подгруппы с диспепсией на основе измерений эластичности стенки желудка при SRI.
Ведущие европейские руководства и рекомендации (EFSUMB) по клиническому использованию ультразвуковой эластографии указывают, что эластография показана:
1. Для характеристики поражений стенки кишечника и, возможно, распознавании активной фазы воспаления от фиброзного стеноза с помощью КЕ.
2. Для оценки сократимости желудка и эластичности стенок ЖКТ при SRI.
РЕЗЮМЕ
Ультразвуковая эластография может обеспечить дополнительной информацией в сравнении с более традиционным ультразвуком при обнаружении и оценке образований брюшной полости. Тем не менее, совпадения значений жесткости при доброкачественных и злокачественных абдоминальных поражениях, например молочной железы и предстательной железы ограничивает применение этого метода. Необходимо проведение дополнительных исследований для определения полезности ультразвуковой эластографии в оценке опухолей брюшной полости.
Предварительные исследования показывают, что эластография может быть полезна для дифдиагностики фиброзных и воспалительных стриктур при болезни Крона.
Оценка ЖП с использованием ультразвуковой эластографии тщательно изучена и при этом показано, что она является точным неинвазивным методом для постановки диагноза фиброза печени. Несколько методов эластографии, включая КЭ и СВЭ, позволяют достаточно точно поставить диагноз фиброза печени и диагностировать явления портальной гипертензии. Рекомендации по использованию КЕ и СВЭ для пациентов с хроническими заболеваниями печени существуют и опубликованы. Можно ожидать, что более широкое использование ультразвуковой эластографии позволит уменьшить количество биопсий печени, выполняющихся для диагностики и постановки диагноза фиброза печени. Использование эластографии позволит улучшить контроль эффективности лечения хронических заболеваний печени.
УЗИ аппарат Siemens Acuson S2000 поддерживает передовую технологию эластографии сдвиговой волны. Лучшие предложения от компании RH.








14.10.2019
Виктория