Резюме
Погано диференційовані нейроендокринні пухлини підшлункової залози (ПДНПЗ) – це підтип раку підшлункової залози, що включає в себе як дрібноклітинні, так і великоклітинні підтипи нейроендокринної карциноми, і характеризується як відмінний з точки зору біології та прогнозу порівняно з більш поширеною аденокарциномою підшлункової залози. До недавнього часу даних про геномні особливості цього типу раку було недостатньо. Ми описуємо пацієнта чоловічої статі з діагнозом ПДНПЗ та обширним метастатичним ураженням печінки на момент встановлення діагнозу. Геномний аналіз показав патогенний варіант зародкової лінії BRCA2 з соматичною втратою гетерозиготності алеля дикого типу BRCA2. Після сприятливої відповіді на хіміотерапію препаратами платини (і додавання імунотерапії) пацієнт отримав підтримуючу терапію олапарибом, що призвело до подальшого зменшення пухлини на контрольній візуалізації (зобр. 1). Після сімнадцяти місяців системного контролю за допомогою олапарибу у пацієнта з’явилися симптоматичні метастази в центральній нервовій системі, які приховували реверсійну мутацію BRCA2. Інших локалізацій прогресування захворювання не спостерігалося. У цій статті ми повідомляємо про винятковий результат завдяки застосуванню персоналізованого підходу до лікування пацієнта з панкреатичним ПДНПЗ, заснованого на комплексному геномному секвенуванні.
Вступ
Нейроендокринні пухлини підшлункової залози (НЕП) зустрічаються з частотою 1,8 на 1 000 000 у жінок і 2,6 на 1 000 000 у чоловіків, згідно з даними програми Національного інституту раку з наглядової епідеміології та кінцевих результатів (SEER)1. Всесвітня організація охорони здоров’я (ВООЗ) характеризує ПДНПЗ високою кількістю мітозів (>20 мітозів/2 мм2) та високим індексом Ki-67 (зазвичай >55%) 2. ПДНПЗ є агресивним раком, часто діагностується на пізніх стадіях і має несприятливий прогноз 3. У цьому випадку ми підкреслюємо цінність підходу точної онкології до лікування пацієнтів з цим рідкісним типом раку, що призводить до унікально сприятливого результату для цього пацієнта.
Результати
Клінічний випадок
66-річний чоловік звернувся зі скаргами на посилення болю в животі, здуття живота, нудоту та втому. При фізикальному обстеженні пацієнт мав поганий зовнішній вигляд зі склеральною іктеричністю та гепатомегалією. Лабораторні дослідження продемонстрували виражену печінкову дисфункцію, зокрема аланінамінотрансферазу 193 (<55 Од/л), аспартатамінотрансферазу 123 (<37 Од/л), лужну фосфатазу 238 (<130 Од/л), загальний білірубін 5,5 (<1,2 мг/дл) та лактатдегідрогеназу 570 (130-250 Од/л). Його минулий анамнез був без особливостей. Сімейний анамнез включає карциному невідомої первинної локалізації у матері у віці 60 років, рак передміхурової залози у батька у віці 85 років та рак легенів у брата у віці 68 років. Пацієнта госпіталізували для прискореного обстеження та лікування.
Комп’ютерна томографія (КТ) продемонструвала утворення в головці підшлункової залози з інвазією у верхню брижову вену, розширену аортокавальну аденопатію (зобр. 1А), білобарні метастази в печінку, розширення внутрішньопечінкових жовчних проток і не злоякісний тромб ворітної вени (зобр. 1Б). Було виконано ендоскопічну ретроградну холангіопанкреатографію (ЕРХПГ), встановлено стенти у загальну жовчну протоку та підшлункову залозу. Біопсія печінки продемонструвала низькодиференційовану карциному, пухлинні клітини були позитивними на цитокератин (ЦK) 7, синаптофізин і хромогранін, аберантну втрату експресії білків P53 і RB та індекс проліферації Ki67 90%, що узгоджується з діагнозом карциноми підшлункової залози походженням ПДНПЗ, без компонента аденокарциноми (зобр. 2A-C).
Зобр. 1: Комп’ютерна томографія (КТ), що демонструє реакцію на терапію.
КТ підшлункової залози з контрастом. На початковому етапі до лікування на КТ видно утворення головки підшлункової залози (червона стрілка), яке проростає у верхню брижову вену (синя стрілка) та закупорює загальну жовчну протоку (зелена стрілка). Збільшення аортокавальних лімфовузлів (чорна стрілка). Через 2 місяці хіміотерапії препаратами платини КТ показує помітне зменшення пухлини підшлункової залози (червона стрілка) та аортокавальних лімфовузлів (чорна стрілка), а також встановлення металевого стента загальної жовчної протоки (зелена стрілка). Через 6 місяців прийому Олапарибу КТ демонструє подальше зменшення пухлини підшлункової залози (червона стрілка) та аортокавальних лімфовузлів (біла стрілка). Через 26 місяців після встановлення діагнозу КТ демонструє триваючу відповідь на іПАРП в пухлині підшлункової залози (червона стрілка) та аортокавальних лімфовузлах (біла стрілка). Б КТ печінки з контрастом. На початковому етапі КТ до лікування показує множинні білобарні метастази в печінці (червоні стрілки), звичайний тромб ворітної вени (сині стрілки) і розширену внутрішньопечінкову жовчну протоку (зелена стрілка). Через 2 місяці хіміотерапії препаратами платини на КТ видно розсмоктування і помітне зменшення метастазів у печінці (червоні стрілки), розсмоктування тромбу ворітної вени і нову пневмобілію (зелена стрілка) від встановлення металевого стента загальної жовчної протоки (не показано). Через 6 місяців лікування олапарибом КТ демонструє подальше зменшення метастазів у печінці (червона стрілка). Через 26 місяців після встановлення діагнозу КТ демонструє триваючу реакцію метастазів у печінці (червона стрілка) на іПАРП. *іПАРП – інгібітор полі (АДФ-рибозної) полімерази.
Зобр. 2: Гістологічні результати діагностичної біопсії печінки, що демонструють низькодиференційовану нейроендокринну карциному.
A Гематоксилін та еозин (Г&Е), збільшення 100х, шкала: 600 мкм, Б Г&Е, збільшення 600×, шкала: 100 мкм). Неопластичні клітини експресують ЦK 7, хромогранін і синаптофізин, аберантну втрату експресії білків P53 і RB та високий індекс мічення Ki67 (C 3,3′-діамінобензидин, збільшення 600×, шкала: 100 мкм).
Пацієнт розпочав хіміотерапію цисплатином та етопозидом, які вводили на 1-3 день кожні 21 день. Протягом двох тижнів після першого циклу пацієнт відчув помітне симптоматичне покращення. Покращилися функціональні печінкові проби. З огляду на те, що пацієнтові діагноз поставили у віці 66 років, а також сімейний анамнез, що включає діагноз раку у його матері у віці 60 років, він погодився пройти тестування зародкової лінії на наявність патогенного варіанту. Патогенний варіант гена BRCA2 в зародковій лінії був ідентифікований, а при соматичному секвенуванні метастазу в печінці виявлено втрату гетерозиготності (ВГ) алеля дикого типу BRCA2. Повторна комп’ютерна томографія (КТ), виконана після трьох циклів лікування, продемонструвала значну відповідь на хіміотерапію у всіх вогнищах захворювання (зобр. 1А, Б). Пацієнт продовжив хіміотерапію платиною/етопозидом протягом трьох додаткових циклів, і хоча це не є рутинною процедурою при позалегеневому ПДНПЗ, але екстраполюючи дані при недрібноклітинному раку легень, які демонструють покращення виживаності при додаванні блокування імунних контрольних точок до хіміотерапії на основі платини, пацієнтці було призначено атезолізамаб, і додавався протягом трьох циклів (загалом шість циклів цисплатину та етопозиду, з додаванням атезолізумабу протягом останніх трьох циклів), після чого спостерігалася подальша радіологічна відповідь як у первинній пухлині підшлункової залози, так і в метастазах у печінці.
Через кумулятивну токсичність, що супроводжувалася втомою та периферичною нейропатією, хіміотерапію та імунотерапію було припинено. Інгібітор полі (АДФ-рибозної) полімерази (іПАРП) олапариб було розпочато на основі мутації BRCA2, екстраполюючи безпосередньо дані, що підтверджують застосування іПАРП в пост-платиновому підтримуючому лікуванні пацієнтів з аденокарциномою підшлункової залози 4, раком яєчників 5, раком молочної залози 6,7 і раком передміхурової залози 8, що мають патогенні варіанти BRCA в зародковій лінії. Подальші КТ-сканування показали подальшу реакцію пухлини та постійний контроль захворювання за допомогою олапарибу (зобр. 1А, Б), і пацієнт зберігав відмінну якість життя (ЯЖ). Через 17 місяців у нього з’явилася слабкість у лівій верхній кінцівці, порушення координації та поява випадків втрати рівноваги та падіння. На магнітно-резонансній томографії (МРТ) було виявлено посилення ураження правої тім’яної частки з навколишнім вазогенним набряком, що відповідає метастазу (додаткове зобр. 1). На повторних томографіях не було виявлено прогресування екстракраніального захворювання. Після мультидисциплінарного обговорення пацієнту виконали резекцію цього ураження, і гістологічне дослідження підтвердило наявність метастазів з ПДНПЗ. Пацієнт пройшов післяопераційну стереотактичну променеву терапію ділянки ложа пухлини. Через вісім тижнів після завершення опромінення у пацієнта з’явилися нові неврологічні симптоми, а на МРТ були виявлені дуральні метастази в тім’яній ділянці. Пацієнту виконали повторну краніотомію, після чого провели променеву терапію, але, незважаючи на ці втручання, прогресування внутрішньочерепного захворювання продовжувалося, без системного рецидиву (зобр. 1А, Б). Пацієнт помер через 26 місяців після встановлення первинного діагнозу.
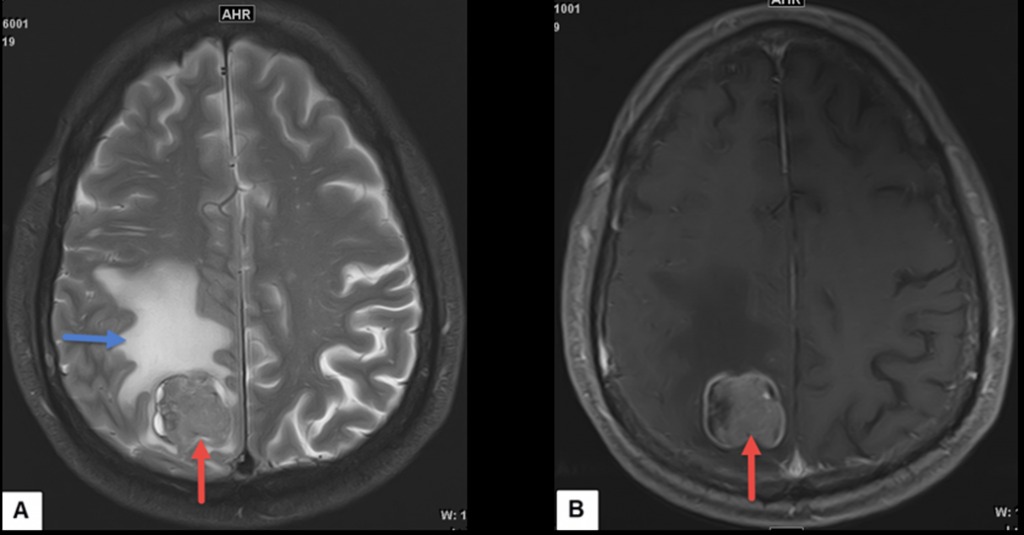
Додаткове зображення 1. Магнітно-резонансна томографія головного мозку. A. Т2-зважена послідовність показує метастаз у правій тім’яній частці (червона стрілка) з вираженим навколишнім набряком (синя стрілка). B. Т1-зважена послідовність після контрастування показує виражене збільшення метастазу (червона стрілка).
Геномний аналіз
Зародкова лінія та соматичне геномне тестування були проведені з використанням затвердженого УПМ Меморіалу Слоуна Кеттерінга (Memorial Sloan Kettering Integrated Mutation Profiling of Actionable Cancer Targets, MSK-IMPACT) на початковому етапі лікування пацієнта до початку системної терапії. На додаток до біалельної втрати функції BRCA2, що відповідає діагнозу ПДНПЗ, пухлина мала біалельні зміни, що зачіпають TP53 і RB1, гомозиготну делецію CDKN1B і мутацію G12R KRAS (зобр. 3). Хоча зміни KRAS і TP53 можуть бути пов’язані з протоковою аденокарциномою підшлункової залози, в сукупності геномний профіль, а також гістопатологічні результати (зобр. 2) відповідали справжньому високому ступеню ПДНПЗ з дефіцитом гомологічної рекомбінації.
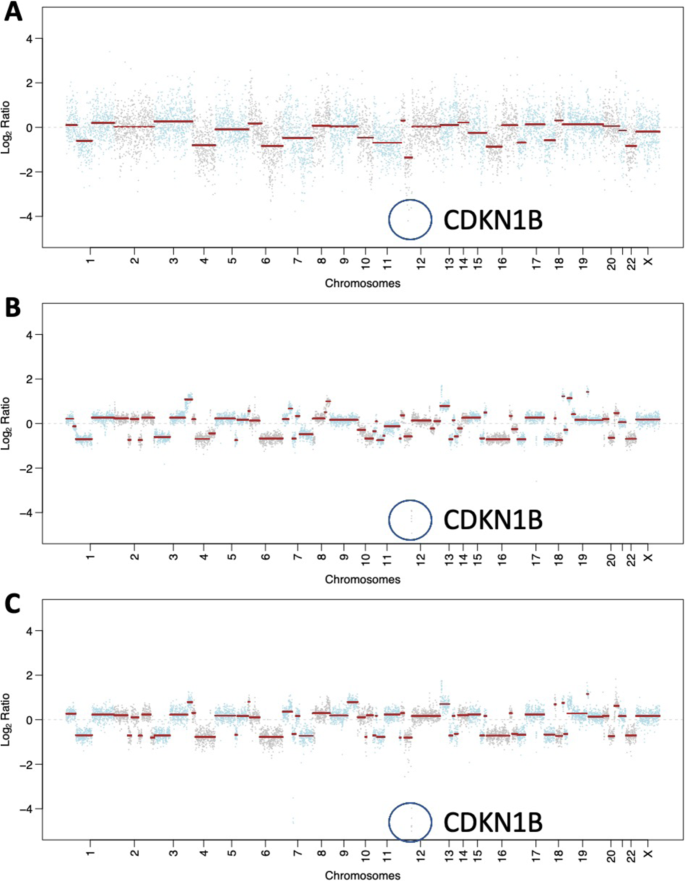
Зобр. 3: Соматичні мутації та зміни кількості копій, отримані за допомогою таргетованого панельного секвенування MSK-IMPACT.
A Графік кількості копій метастазів у печінці до лікування. B Діаграма кількості копій метастазів у ЦНС після хіміотерапії та резекції олапарибом. C Графіки кількості копій метастазів у ЦНС після хіміотерапії, олапарибу та променевої терапії. В A-C геномний локус CDKN1B виділено синім контуром.
Комплексне секвенування пухлин обох резектованих метастазів у ЦНС порівнювали з результатами секвенування базової діагностичної біопсії печінки (зобр. 3). Обидва зразки метастазів головного мозку продемонстрували наявність структурної перебудови BRCA2, що охоплює локус патогенної зміни зародкової лінії BRCA2, яка не була ідентифікована в зразку до лікування. Ця перебудова видалила стоп-кодон, спричинений патогенною мутацією зародкової лінії (зобр. 4), і, ймовірно, призвела до відновлення гомологічної рекомбінаційної репарації ДНК та резистентності до олапарибу. Хоча у двох резектованих зразках ЦНС спостерігався схожий спектр геномних змін, було відзначено очевидну появу різних клонів, хоча ці зразки були отримані з різницею лише в 12 тижнів (зобр. 5).
Зобр. 4: Теплова карта, що демонструє виявлені геномні зміни в кожному зразку (метастази в печінці до лікування, метастази в ЦНС після хіміотерапії та олапарибу, метастази в ЦНС після системної терапії та променевої терапії, як позначено).
Тип альтерації позначається на кольоровій тепловій карті з лівого боку панелі, а фракція ракових клітин (тобто частка ракових клітин, що містять альтерацію) для кожної альтерації позначається на тепловій карті з правого боку панелі.
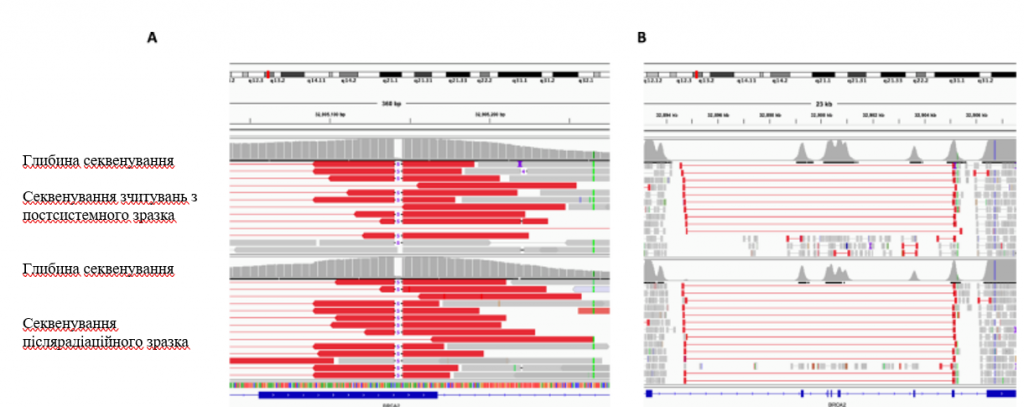
Зобр. 5: Скріншот програми Integrative Genomics Viewer (IGV), що демонструє перекриття між реверсійним структурним варіантом і мутацією зародкової лінії в BRCA2.
Тонкі червоні лінії показують довжину зчитувань, що підтримують структурний варіант, а товсті червоні лінії показують кінці зчитувань, що окреслюють точки розриву структурного варіанту. Тонкі чорні лінії з цифрою “5” посередині демонструють делецію пари основ зародкової лінії 5. Гістограми над зчитуваннями кожного зразка показують глибину секвенування в цьому локусі. A Скріншот IGV, що демонструє перекриття між кінцем реверсивного структурного варіанту і короткою делецією зародкової лінії у зразку після системної терапії (вгорі) і зразку після опромінення (внизу). B Скріншот IGV, що показує область BRCA2, уражену структурним варіантом, у зразку після системної терапії (вгорі) і зразку після опромінення (внизу).
Циркулююча клітинна ДНК (ктДНК) була оцінена під час другого рецидиву внутрішньочерепного захворювання і виявила зміну ATM p.L695Wfs*s, яка не виявляється в зразках пухлини і має низьку фракцію алелів 0,28%, що відповідає клональному гемопоезу з невизначеним потенціалом 9.
Обговорення
Лікування ПДНПЗ першої лінії традиційно слідує за лікуванням недрібноклітинного раку легень, причому найкращі докази підтверджують застосування цисплатину та етопозиду 10,11. Діагноз ПДНПЗ передбачає несприятливий прогноз із середньою виживаністю 5,7 місяців 12. Включення підтримуючої фази терапії в парадигми лікування є предметом дослідження для різних типів раку і має на меті підтримання та/або індукцію регресії захворювання, при цьому, як правило, дозволяє деескалацію або скасування цитотоксичної терапії для зменшення токсичності та максимального покращення якості життя. Важливими прикладами, що стосуються цього випадку, є лікування поширеного недрібноклітинного раку легень, де міжнародні рекомендації включають інгібітори імунних контрольних точок, атезолізумаб або дурвалумаб, у поєднанні з хіміотерапією, з подальшим підтримуючим блокуванням контрольних точок без цитотоксичної терапії до прогресування захворювання, що базується на двох затверджених Управлінням з санітарного нагляду за якістю харчових продуктів і медикаментів США (УПМ) рекомендаціях 13. Крім того, дослідження III фази Pancreas Olaparib Ongoing (POLO) прояснило підхід до лікування поширеної протокової аденокарциноми підшлункової залози (ППАП) на основі біомаркерів і ознаменувало потенційну нову еру точної медицини для цього захворювання 4, продемонструвавши перевагу у виживанні без прогресування над плацебо при застосуванні підтримуючої терапії олапарибом у пацієнтів з мутованою BRCA1/2 зародковою лінією ППАПта чутливою до препаратів платини хворобою. Переваги спостерігалися при різних типах пухлин, включаючи рак яєчників 5, молочної залози 6,7 та передміхурової залози 8, що призвело до регуляторного схвалення іПАРП при цих захворюваннях.
У зразках пухлини цього пацієнта було виявлено соматичну BRCA2 ВГ. Попередні дослідження нашої групи показали, що при ППАП пацієнти з біалельними змінами, що зачіпають гомологічні гени, пов’язані з репарацією рекомбінаційної ДНК (наприклад, BRCA1/2), мають найбільшу ймовірність отримати користь від терапії на основі платини 14,15 і терапії іПАРП 14, при цьому часто спостерігається стійка відповідь. Пацієнти з біалельним статусом, як описано в цій статті, асоціюються з вищим рівнем ЗКМ і мають COSMIC Signature 3, що є показниками більшої геномної нестабільності, які, ймовірно, матимуть більше шансів отримати користь від імунотерапії 16,17 в контексті змін BRCA2 18. Зважаючи на відмінну відповідь на хіміотерапію препаратами платини та екстраполюючи наведені вище дані з метою персоналізації рекомендацій щодо лікування, ми вирішили продовжити підтримуючу терапію іПАРП, що дозволило досягти тривалого періоду системного контролю над захворюванням. Враховуючи початкову драматичну відповідь на хіміотерапію (та імунотерапію) препаратами платини, цілком можливо, що реакції захворювання, виявлені при подальших візуалізаціях, були зумовлені виключно постійною, винятковою відповіддю на хіміотерапію, а не вторинною реакцією на олапариб. Нещодавня серія досліджень Symonds та співавт. 19 продемонструвала чудовий контроль захворювання за допомогою олапарибу у пацієнта з ПДНПЗ передміхурової залози de novo з втратою BRCA2, знову ж таки, після хіміотерапії препаратами платини. У нашому випадку, як і в більшості сценаріїв, початок лікування ПАРПі припав на період відповіді на терапію препаратами платини, тому остаточне визначення того, який препарат призвів до відповіді та контролю захворювання, може виявитися непростим завданням.
Цей випадок демонструє значну користь від результатів геномного тестування для цього пацієнта. Сучасні міжнародні настанови, включаючи настанови Національної комплексної онкологічної мережі (NCCN), рекомендують розглянути можливість генетичного консультування і тестування на спадкові генетичні стани, але не рекомендують універсальне геномне тестування для всіх пацієнтів з нейроендокринними пухлинами, в тому числі з ПДНПЗ 17. Хоча дані, що стосуються комплексного геномного секвенування при НЕП підшлункової залози, традиційно нечисленні, ряд недавніх серій досліджень продемонстрували виявлення збільшення кількості змін в TP53, RB1, APC, KRAS, BRAF 18,19, втрату кількості копій в ARID1A, ATM і ESR1, на додаток до ампліфікацій/зростання в MYC і KDM5A 19. Нещодавні дослідження як панкреатичних, так і непанкреатичних НЕП шлунково-кишкового тракту продемонстрували наявність потенційно активних змін 19,20. Що стосується змін BRCA, то в одній серії досліджень було показано, що 25% пацієнтів з нейроендокринним раком передміхурової залози мали виявлені біалельні зміни BRCA2 16, що підтверджує критичну необхідність рекомендувати геномне тестування для виявлення потенційно активних мішеней і може бути застосоване до всіх типів солідних пухлин. Враховуючи ці дані, а також дані щодо мутованої BRCA аденокарциноми підшлункової залози, які демонструють прогностичне значення біалельного статусу 14, при виявленні соматичних змін BRCA ми пропонуємо розглянути можливість як рефлекторного тестування зародкової лінії, так і визначення біалельного/моноалельного статусу. Потенціал комплексного геномного тестування для надання значущих терапевтичних переваг пацієнтам може бути недооцінений в контексті рідкісних типів раку, для яких було проведено недостатню кількість геномних досліджень.
Хоча початкове обґрунтування застосування атезолізумабу в цьому випадку ґрунтувалося на екстраполяції даних про виживаність при недрібноклітинному раку легень 8, наявність мутації BRCA2 додатково підтвердила доцільність його застосування. У нашій попередній групі пацієнтів з ППАП і мутаціями в генах, пов’язаних з дефіцитом гомологічної рекомбінації (HRd), наприклад, BRCA 1/2, пацієнти з біалельним статусом, як описано в цій статті, були пов’язані з вищою ЗКМ порівняно з пацієнтами з моноалельним статусом або статусом дикого типу HRd, а також демонстрували COSMIC Signature 3, що вказує на більшу геномну нестабільність, і, як передбачалося, мали більшу ймовірність отримати позитивний результат від імунотерапії 21, 22 в контексті зміни BRCA2 23. В даному випадку, через обмежену область геному, яку охоплювало таргетне панельне секвенування MSK-IMPACT, кількість однонуклеотидних варіантів була недостатньою для обчислення мутаційних сигнатур COSMIC із заміною однієї основи. Оптимальний ЗКМ, при якому блокада імунних контрольних точок приносить користь при нейроендокринних пухлинах, залишається відкритим питанням за відсутності рандомізованих даних, однак схвалення УПМ на застосування пембролізумабу при пухлинах з ЗКМ > 10 мутацій на мегабазу (Мутс/Мб) на основі KEYNOTE-158 включало пацієнтів з метастатичними нейроендокринними пухлинами 24. У випадку, описаному в цій статті, спостерігався ТМБ 6,2 Mut/Mb.
Через 22 місяці після встановлення діагнозу у нашого пацієнта розвинулася симптоматична внутрішньочерепна патологія, і, незважаючи на всі зусилля із застосуванням мультимодальних підходів, контролю над внутрішньочерепними захворюваннями досягти не вдалося. Профілактичне опромінення черепа (ПОЧ) не є рутинною рекомендацією в основних міжнародних настановах щодо позалегеневих нейроендокринних карцином, на відміну від поширеного дрібноклітинного раку легень, де ПОЧ розглядається на основі дослідження EORTC, яке продемонструвало перевагу у виживаності 25. Наш випадок відображає проблему прогресування інтракраніального захворювання, яка може обмежити виживання у пацієнтів з відмінним системним контролем захворювання. За відсутності рандомізованих даних наш випадок піднімає питання про те, чи слід розглядати ПОЧ в окремих пацієнтів, у яких зберігається системний контроль захворювання.
До розвитку метастазів у ЦНС у цьому випадку могли призвести кілька потенційних причинних факторів, які заслуговують на увагу. По-перше, в даному випадку не було проведено базового візуалізаційного дослідження центральної нервової системи для оцінки наявності метастазів у головному мозку, тому можливо, що приховані метастази в головному мозку були присутні на момент встановлення діагнозу, хоча на МРТ головного мозку через шість місяців після встановлення діагнозу не було виявлено жодних внутрішньочерепних аномалій. По-друге, наявність мутацій BRCA асоціюється з більшою поширеністю метастазів у ЦНС при раку молочної залози та яєчників 26 , хоча це може пояснюватися кількома потенційними факторами, включаючи збільшення числа потрійних негативних підтипів при раку молочної залози, зумовленому BRCA, а також сприятливе виживання в цих підгрупах. Даних щодо того, чи існує біологічна схильність до метастазування в ЦНС при BRCA-мутованому раку підшлункової залози, бракує. По-третє, хоча в деяких доклінічних моделях іПАРП призводили до ураження ЦНС 27, інші дослідження показали субоптимальну здатність препаратів іПАРП – токапарибу і талазопарибу – проникати через гематоенцефалічний бар’єр 28,29. Вважається, що це частково пов’язано з наявністю Р-глікопротеїну (P-GP/ABCB1) і білка резистентності до раку молочної залози (РМЗ), які функціонують як ефлюксні насоси в гематоенцефалічному бар’єрі і обмежують проникнення в ЦНС. Олапариб також є субстратом цих білків 30, і тому ЦНС може представляти потенційне місце знаходження в цьому контексті. По-четверте, і, можливо, найбільш лаконічний висновок для цього пацієнта, розвиток метастазу в ЦНС після 22 місяців стійкого контролю захворювання найкраще пояснюється розвитком зворотної мутації (перебудова BRCA2: c.316 + 1367 c.717del, зобр. 3 і 4).
Розвиток реверсійних мутацій до таргетної терапії, зокрема, в BRCA1/2, що призводять до резистентності до іПАРП, описано 31,32 , хоча, наскільки нам відомо, не в умовах ізольованого захворювання ЦНС з постійним відмінним системним контролем 33,34,35,36,37. Подолання резистентності до таргетної терапії залишається складним завданням. Додавання імунотерапії до терапії іПАРП досліджується при декількох злоякісних пухлинах (NCT04548752, NCT04493060, NCT0466740), при цьому спостерігається позитивний ефект, як потенційна комбінація для подолання резистентності 38,39. Крім того, комбінація іПАРП з інгібіторами ДНК-полімерази θ (Polθ, також відомої як POLQ) 40 та інгібіторами атаксії телеангіектазії та Rad3-спорідненої (ATR) 41 може становити стратегію подолання резистентності, спричиненої реверсійними мутаціями.
На завершення ми повідомляємо про унікальний випадок пацієнта з ПДНПЗ і мутацією зародкової лінії BRCA2, яка мала вражаючу відповідь на хіміотерапію на основі платини, після чого настав період глибокого і тривалого контролю захворювання за допомогою іПАРП, який в кінцевому підсумку ускладнився пізнім внутрішньочерепним рецидивом через реверсійну мутацію. Ми описуємо, як широке секвенування пухлини виявило, що внутрішньочерепний рецидив, ймовірно, є результатом розвитку реверсійної мутації в умовах тривалого застосування іПАРП. Цей випадок підкреслює цінність прецизійної терапії, яка може призвести до унікально сприятливих результатів для окремих пацієнтів, і в цьому відношенні підтримує розгляд всебічного геномного профілювання, в тому числі в лікуванні пацієнтів з рідкісними типами пухлин, де настанови не обов’язково рекомендують універсальне геномне тестування. Вона також ще раз підкреслює, що при рідкісних злоякісних пухлинах, де бракує рандомізованих даних, слід розглянути можливість екстраполяції парадигм лікування інших злоякісних пухлин зі спільними геномними особливостями. Базова візуалізація ЦНС для оцінки наявності внутрішньочерепних метастазів, а ПОЧ також повинні розглядатися в контексті системного контролю захворювання при ПДНПЗ. Нарешті, цей випадок є прямим доказом цінності послідовних геномних аналізів під час прогресування захворювання на тлі таргетної терапії для оцінки механізмів резистентності.
Методи
Отримання згоди від пацієнта
Усна згода на публікацію цього звіту була надана пацієнтом та його родиною, що задокументовано в медичній документації.
Етичне схвалення
Цей звіт був розглянутий керівництвом Меморіалу Слоуна Кеттерінга 19.10.2022 р. (Е.М. О’Рейлі взяв самовідвід), і робота була визнана такою, що не включає дослідження на людях, а отже, не потребує нагляду з боку IRB.
Матеріали
Зразок метастазу печінки був отриманий за допомогою КТ-керованої пункційної біопсії, а обидва метастази ЦНС були резекційними зразками, взятими під час хірургічного втручання. Всі зразки пухлин були переглянуті гістопатологом з досвідом роботи з раком підшлункової залози в MSK, що підтвердило наявність клітинності пухлини, достатньої для аналізу за допомогою забарвлення гематоксиліном та еозином з блоків, залитих у формалін, зафіксованих у парафіні (ЗФЗП). Для соматичного геномного аналізу всіх зразків ДНК виділяли і очищали, а також проводили секвенування пухлини і нормальне комплексне мультигенне панельне секвенування з використанням схваленого УПМ і Департаментом охорони здоров’я штату Нью-Йорк методу Меморіального інтегрованого мутаційного профілювання ракових мішеней (MSK-IMPACT), який ми вже описували раніше 42. Згода пацієнта на проведення соматичного та геномного аналізу зародкової лінії була отримана відповідно до інституційного протоколу IRB 12-245. Соматичні однонуклеотидні варіанти (СОВ), короткі інсерції та делеції і геномні перебудови були отримані з cBioPortal for Cancer Genomics 43. Були отримані бінарні файли та файли з картуванням вирівнювання (БКВ), а кількість змін копій (КЗК), включаючи втрату гетерозиготності (ВГ), була розрахована за допомогою програми FACETs 44. БКВ файли були перевірені вручну за допомогою програми Integrative Genomics Viewer (IGV) 45 , щоб показати локус BRCA2, на який вплинула мутація та перебудова зародкової лінії. Мутацію класифікували як біалельну, якщо вона відбувалася одночасно з ВГ алеля дикого типу. Фракцію ракових клітин (ФРК) кожної зміни визначали за допомогою програми ABSOLUTE (v1.0.6), при цьому розчини ABSOLUTE переглядали вручну. Зміни класифікували як клональні, якщо ймовірність того, що зміна є клональною, становила >0,5 або якщо нижній довірчий інтервал (ДІ) становив >0,9, як розраховано за допомогою ABSOLUTE 46.
Посилання на джерела
- Halfdanarson, T., Rabe, K., Rubin, J. & Petersen, G. Pancreatic neuroendocrine tumors (PNETs): incidence, prognosis and recent trend toward improved survival. Ann. Oncol. 19, 1727–1733 (2008).
- Rindi, G. et al. Overview of the 2022 who classification of neuroendocrine neoplasms. Endocr. Pathol. 33, 115–154 (2022).
- Basturk, O. et al. Poorly differentiated neuroendocrine carcinomas of the pancreas. Am. J. Surgical Pathol. 38, 437–447 (2014).
- Golan, T. et al. Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. N. Engl. J. Med. 381, 317–327 (2019).
- Moore, K. et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N. Engl. J. Med. 379, 2495–2505 (2018).
- Robson, M. et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N. Engl. J. Med. 377, 523–533 (2017).
- Litton, J. et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N. Engl. J. Med. 379, 753–763 (2018).
- Kaufman, B. et al. Olaparib monotherapy in patients with advanced cancer and a germline BRCA1/2 mutation. J. Clin. Oncol. 33, 244–250 (2015).
- Kar, S. et al. Genome-wide analyses of 200,453 individuals yield new insights into the causes and consequences of clonal hematopoiesis. Nat. Genet. 54, 1155–1166 (2022).
- Iwasa, S. et al. Cisplatin and etoposide as first-line chemotherapy for poorly differentiated neuroendocrine carcinoma of the hepatobiliary tract and pancreas. Jpn J. Clin. Oncol. 40, 313–318 (2010).
- Zhang, P. et al. Etoposide and cisplatin versus irinotecan and cisplatin as the first‐line therapy for patients with advanced, poorly differentiated gastroenteropancreatic neuroendocrine carcinoma: a randomized phase 2 study. Cancer 126, 2086–2092 (2020).
- Dasari, A., Mehta, K., Byers, L., Sorbye, H. & Yao, J. Comparative study of lung and extrapulmonary poorly differentiated neuroendocrine carcinomas: a SEER database analysis of 162,983 cases. Cancer 124, 807–815 (2017).
- Mathieu, L. et al. FDA approval summary: atezolizumab and durvalumab in combination with platinum-based chemotherapy in extensive stage small cell lung cancer. Oncologist 26, 433–438 (2021).
- Momtaz, P. et al. Pancreas cancer and BRCA: a critical subset of patients with improving therapeutic outcomes. Cancer 127, 4393–4402 (2021).
- Park, W. et al. Genomic methods identify homologous recombination deficiency in pancreas adenocarcinoma and optimize treatment selection. Clin. Cancer Res. 26, 3239–3247 (2020).
- Symonds, L. et al. BRCA2 alterations in neuroendocrine/small-cell carcinoma prostate cancer: a case series. JCO Precis. Oncol. 6, e2200091 (2022).
- Shah, M. et al. NCCN guidelines® updates: neuroendocrine and adrenal tumors. J. Natl Compr. Cancer Netw. 19, 839–868 (2022).
- Yachida, S. et al. Comprehensive genomic profiling of neuroendocrine carcinomas of the gastrointestinal system. Cancer Discov. 12, 692–711 (2022).
- Venizelos, A. et al. The molecular characteristics of high-grade gastroenteropancreatic neuroendocrine neoplasms. Endocr.-Relat. Cancer 29, 1–14 (2022).
- Wu, H. et al. Genomic characterization reveals distinct mutation landscapes and therapeutic implications in neuroendocrine carcinomas of the gastrointestinal tract. Cancer Commun. 42, 1367–1386 (2022).
- Connor, A. et al. Association of distinct mutational signatures with correlates of increased immune activity in pancreatic ductal adenocarcinoma. JAMA Oncol. 3, 774 (2017).
- Seeber, A. et al. Molecular characteristics of BRCA1/2 and PALB2 mutations in pancreatic ductal adenocarcinoma. ESMO Open 5, e000942 (2020).
- Samstein, R. et al. Mutations in BRCA1 and BRCA2 differentially affect the tumor microenvironment and response to checkpoint blockade immunotherapy. Nat. Cancer 1, 1188–1203 (2020).
- Marabelle, A. et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 keynote-158 study. Lancet Oncol. 21, 1353–1365, https://doi.org/10.1016/s1470-2045(20)30445-9 (2020).
- Slotman, B. et al. Prophylactic cranial irradiation in extensive small-cell lung cancer. N. Engl. J. Med. 357, 664–672 (2007).
- Szarszewska, M. et al. Significance of BRCA1 expression in breast and ovarian cancer patients with brain metastasis: a multicentre study. Adv. Med. Sci. 64, 235–240 (2019).
- McEllin, B. et al. PTEN loss compromises homologous recombination repair in astrocytes: implications for glioblastoma therapy with temozolomide or Poly(ADP-Ribose) polymerase inhibitors. Cancer Res. 70, 5457–5464 (2010).
- Durmus, S. et al. Breast cancer resistance protein (BCRP/ABCG2) and P-glycoprotein (P-GP/ABCB1) restrict oral availability and brain accumulation of the PARP inhibitor rucaparib (AG-014699). Pharm. Res. 32, 37–46 (2014).
- Kizilbash, S. et al. Restricted delivery of talazoparib across the blood–brain barrier limits the sensitizing effects of parp inhibition on temozolomide therapy in glioblastoma. Mol. Cancer Therapeutics 16, 2735–2746 (2017).
- Sun, K. et al. A comparative pharmacokinetic study of PARP inhibitors demonstrates favorable properties for niraparib efficacy in preclinical tumor models. Oncotarget 9, 37080–37096 (2018).
- Edwards, S. et al. Resistance to therapy caused by intragenic deletion in BRCA2. Nature 451, 1111–1115 (2008).
- Sakai, W. et al. Secondary mutations as a mechanism of cisplatin resistance in BRCA2-mutated cancers. Nature 451, 1116–1120 (2008).
- Ganesan, S. Tumor suppressor tolerance: reversion mutations in BRCA1 and BRCA2 and resistance to PARP inhibitors and platinum. JCO Precis. Oncol. 1–4 https://doi.org/10.1200/po.18.00001 (2018).
- Banda, K., Swisher, E., Wu, D., Pritchard, C. & Gadi, V. Somatic reversion of germline BRCA2 mutation confers resistance to poly(ADP-ribose) polymerase inhibitor therapy. JCO Precis. Oncol. 1–6 https://doi.org/10.1200/po.17.00044 (2018).
- Carneiro, B. et al. Acquired resistance to poly (ADP-ribose) polymerase inhibitor olaparib in BRCA2-associated prostate cancer resulting from biallelic BRCA2 reversion mutations restores both germline and somatic loss-of-function mutations. JCO Precis. Oncol. 1–8 https://doi.org/10.1200/po.17.00176 (2018).
- Cheng, H., Salipante, S., Nelson, P., Montgomery, B. & Pritchard, C. Polyclonal BRCA2 Reversion Mutations Detected in Circulating Tumor DNA After Platinum Chemotherapy in a Patient With Metastatic Prostate Cancer. JCO Precision Oncology 1–5 https://doi.org/10.1200/po.17.00169 (2018).
- Weigelt, B. et al. Diverse BRCA1 and BRCA2 Reversion Mutations in Circulating Cell-Free DNA of Therapy-Resistant Breast or Ovarian Cancer. Clin. Cancer Res. 23, 6708–6720 (2017).
- Domchek, S. et al. Olaparib and durvalumab in patients with germline BRCA-mutated metastatic breast cancer (MEDIOLA): an open-label, multicentre, phase 1/2, basket study. Lancet Oncol. 21, 1155–1164 (2020).
- Drew, Y. et al. Phase II study of olaparib + durvalumab (MEDIOLA): Updated results in germline BRCA-mutated platinum-sensitive relapsed (PSR) ovarian cancer (OC). Ann. Oncol. 30, v485–v486 (2019).
- Zatreanu, D. et al. Polθ inhibitors elicit BRCA-gene synthetic lethality and target PARP inhibitor resistance. Nat. Commun. 12, 3636 (2021).
- Kim, H. et al. Combining PARP with ATR inhibition overcomes PARP inhibitor and platinum resistance in ovarian cancer models. Nat. Commun. 11, 3726 (2020).
- Cheng, D. et al. Memorial Sloan Kettering-Integrated Mutation Profiling of Actionable Cancer Targets (MSK-IMPACT). J. Mol. Diagnostics 17, 251–264 (2015).
- Gao, J. et al. Integrative Analysis of Complex Cancer Genomics and Clinical Profiles Using the cBioPortal. Sci. Signal. 6, pl1 (2013).
- Shen, R. & Seshan, V. FACETS: allele-specific copy number and clonal heterogeneity analysis tool for high-throughput DNA sequencing. Nucleic Acids Res. 44, e131–e131 (2016).
- Robinson, J. et al. Integrative genomics viewer. Nat. Biotechnol. 29, 24–26 (2011).
- Carter, S. L. et al. Absolute quantification of somatic DNA alterations in human cancer. Nat. Biotechnol. 30, 413–421 (2012).