Резюме
Вступ: Аденоміоз – це поширене хронічне захворювання у жінок репродуктивного віку, яке характеризується наявністю ектопічної ендометріальної тканини в міометрії. Незважаючи на те, що аденоміоз проявляється хронічним тазовим болем, менорагією або аномальними матковими кровотечами, дисменореєю та диспареунією, його часто діагностують після гістеректомії. Однак розвиток ультразвукової та магнітно-резонансної томографії покращив передопераційну діагностику захворювання. Гістероскопія надає інформацію в реальному часі з порожнини матки і дає можливість отримати пряму біопсію.
Матеріал і методи: Проведено пошук літератури в Pubmed та Embase за такими рубриками: діагностика аденоміозу або аденоміоми та офісна гістероскопія, результати гістероскопії при аденоміозі або аденоміомі, лікування аденоміозу або аденоміоми за допомогою офісної гістероскопії.
Результати: Аналіз літератури показав, що гістероскопія дозволяє виявити поверхневий аденоміоз. Існують різноманітні гістероскопічні зображення, які можуть бути пов’язані з цим захворюванням. Нове обладнання, таке як спіротом, використовується для доступу до глибших шарів міометрію та отримання біопсій під прямим оглядом з аденоміотичних ділянок. Також були описані різні методи лікування, такі як енуклеація вогнищевої поверхневої аденоміоми, коагуляція, евакуація кістозного аденоміозу, коли ураження менше 1,5 см, і резекція аденоміотичних вузлів у разі більших уражень (>1,5 см). Дифузний поверхневий аденоміоз також лікується шляхом резекції.
Висновки: Гістероскопія зробила революцію в підході до лікування аденоміозу. Вона є корисним інструментом в оцінці переважно поверхневого аденоміозу. Роль гістероскопії в хірургічному лікуванні аденоміозу потребує подальших досліджень.
Ключові слова: аденоміоз; гістероскопія; вагіноскопічний підхід; менеджмент; лікування; діагностика
1. Вступ
Аденоміоз – хронічне захворювання, відоме понад 100 років. Захворюваність на аденоміоз можна оцінити лише в межах 5-70%, оскільки це захворювання, діагноз якого можна підтвердити лише після гістеректомії [1]. Гістологічно аденоміоз характеризується інвазією міометрію з ендометріальних залоз та/або строми глибше 2,5 мм від місця з’єднання ендометрію з міометрієм (зона з’єднання – ЗЗ) [2].
У більшості випадків аденоміоз не має специфічних клінічних симптомів; натомість він спричиняє дисменорею, що починається в ранньому віці, приблизно в період менархе, та хронічний тазовий біль, який не піддається лікуванню анальгетиками або циклічними оральними контрацептивами [3]. Більшість пацієнток з аденоміозом скаржаться на аномальні маткові кровотечі (АМК), здуття живота та низький тазовий тиск. Незалежно від клінічних проявів, одна з трьох жінок з аденоміозом залишається безсимптомною [4]. У багатьох випадках аденоміоз співіснує з ендометріозом, тоді як лише невелика частина пацієнток з ендометріозом не має супутнього аденоміозу [5].
Діагностика аденоміозу все ще залишається суперечливою. У цьому дослідженні ми маємо на меті вивчити діагностичну та терапевтичну роль офісної гістероскопії при аденоміозі, щоб визначити типи аденоміозу, які підходять для гістероскопічної діагностики та потенційного лікування в офісних умовах.
2. Класифікація та діагностика аденоміозу
Аденоміоз можна розрізнити в гістологічному препараті як дифузний або вогнищевий відповідно до інвазії міометрія. При дифузному типі залози та/або строма ендометрію широко розташовані між м’язовими волокнами міометрію, що призводить до збільшення об’єму матки, утворюючи патогномонічну “об’ємну” матку, і традиційно може бути виявлено під час клінічного обстеження. Вогнищевий аденоміоз – це, як правило, єдиний солідний вузол, розташований у міометрії, який характеризується як аденоміома, або аденоміозна кіста, якщо вона має кістозні ознаки [6].
Інша класифікація аденоміозу базується на магнітно-резонансній томографії (МРТ). Оцінка злукової зони (ЗЗ) базується на трьох основних параметрах: товщина, регулярність та переривчастість ЗЗ. Нерегулярність вимірюється як JZdif і вважається додатковою характеристикою, що вказує на аденоміоз [7]. Kishi та ін. [8] створили іншу класифікацію на основі МРТ-характеристик. Підтип I (внутрішній) аденоміоз пов’язаний з внутрішніми структурними компонентами матки, такими як ендометрій і зона злуки. Аденоміоз підтипу II (зовнішній) виникає в зовнішній оболонці матки, порушуючи серозну оболонку, але не зачіпаючи внутрішні компоненти. Аденоміоз підтипу ІІІ (інтрамуральний) локалізувався виключно в міометрії. На решті зображень було виявлено додатковий підтип, підтип IV (невизначений) аденоміоз.
Kobayashi et al. [9] використовували іншу класифікацію аденоміозу, засновану на ураженій ділянці та поширеності аденоміозу. Зокрема, пацієнти були ідентифіковані з трьома типами аденоміозу: внутрішнім, зовнішнім та іншими типами. Внутрішній тип визначається як аденоміоз, присутній у внутрішньому шарі матки, який не зачіпає зовнішні структури міометрію. Зовнішній тип визначається як аденоміоз, що виникає в зовнішньому шарі матки, не зачіпаючи внутрішні структури. Ступінь ураження аденоміозом поділяється на три ступені (<1/3, <2/3 або >2/3 стінки матки). A1, A2 і A3 визначаються як “ураження обмежене внутрішньою 1/3 міометрію матки”, “ураження обмежене внутрішніми 2/3 міометрію матки” і “ураження виходить за межі внутрішніх 2/3 міометрію і частина ураження досягає серозної оболонки матки”. B1, B2 і B3 визначаються як “ураження обмежене зовнішньою 1/3 міометрію матки”, “ураження обмежене внутрішніми 2/3 міометрію матки” і “ураження виходить за межі зовнішніх 2/3 міометрію і частина ураження досягає ендометрію матки”. Якщо ураження поширюється на весь міометрій, А3 і В3 не можна розрізнити за допомогою МРТ і патології. Пацієнтки також можуть бути віднесені до “іншого типу”, коли вони не належать ні до типу А, ні до типу В.
Жінки з аденоміозом мають не однакову клінічну картину. Крім того, для деяких з них необхідно зберегти матку. Як наслідок, існує необхідність передопераційного виявлення аденоміозу, щоб обрати найкраще лікування і правильну хірургічну техніку та досягти найкращих результатів для кожної пацієнтки [10]. Сьогодні більш реально, ніж раніше, діагностувати аденоміоз за допомогою гістероскопії, трансвагінальної сонографії (ТВС) та магнітно-резонансної томографії (МРТ), не вдаючись до гістеректомії [11]. МРТ раніше була оптимальним методом виявлення аденоміозу [12], але вона не є економічно ефективною і не завжди доступна [13]. ТВС є більш прийнятним варіантом, і його точність у діагностиці аденоміозу значно підвищилася після вдосконалення сонографічного обладнання та програмного забезпечення [14,15]. Пряма візуалізація порожнини матки, яку пропонує гістероскопія, розширює можливості діагностики аденоміозу, пропонуючи в той же час деякі інтервенційні властивості [16,17].
Гістероскопічна техніка та обладнання змінювалися протягом багатьох років, що зробило її доступною в амбулаторних умовах. Спочатку гістероскопія проводилася тільки в операційній під загальним знеболенням, але з тих пір гістероскопія була впроваджена в офісних умовах, де не використовується ні анестезія, ні знеболення, в основному завдяки мінімізації обладнання та впровадженню нової, “безконтактної” техніки, яка називається вагіноскопія [18]. Проведення гістероскопії в офісних умовах дає можливість надавати послуги за принципом “побачити і вилікувати”, тобто гістероскопіст може дослідити, діагностувати, а в деяких випадках і вилікувати патологію ендометрія за один прийом [18].
3. Матеріал і методи
Матеріал і методи: Пошук літератури проводили через Pubmed та Embase за такими рубриками: діагностика аденоміозу або аденоміоми та офісна гістероскопія, результати гістероскопії при аденоміозі або аденоміомі, лікування аденоміозу або аденоміоми за допомогою офісної гістероскопії. Дослідження були включені тільки в тому випадку, якщо в них були представлені дані про офісну гістероскопію та її застосування у випадках аденоміозу, включаючи тільки діагностичну або тільки оперативну гістероскопію.
4. Гістероскопічна діагностика аденоміозу
Важко визначити роль гістероскопії у виявленні аденоміозу. Гістероскопіст може візуалізувати порожнину ендометрія в режимі реального часу, а також отримувати біопсію ендометрія під прямим контролем, що підвищує безпеку пацієнтки та мінімізує кількість хибнонегативних результатів [16]. Однак, досі не існує специфічних характеристик, які б могли безпечно визначити діагноз аденоміозу [19]. Важливим обмеженням методу є те, що гістероскопія дозволяє спостерігати лише поверхню ендометрія. Як наслідок, аденоміоз, який зазвичай виявляється в більш глибокому шарі міометрію, неможливо ідентифікувати [5,10].
Наступні гістероскопічні картини зазвичай вважаються ознаками аденоміозу [20]:
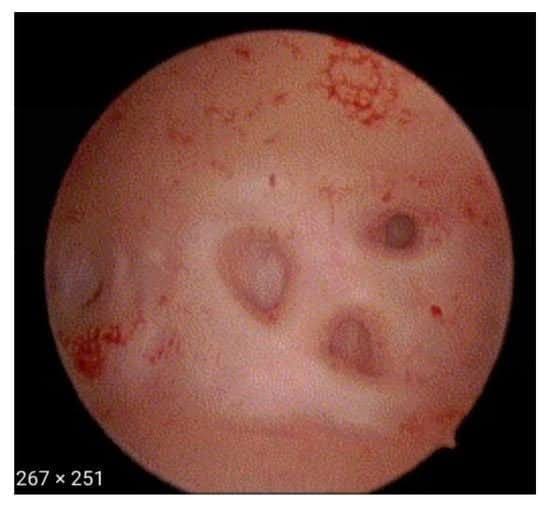
- Нерегулярний ендометрій з крихітними отворами на поверхні ендометрію (Рис. 1)
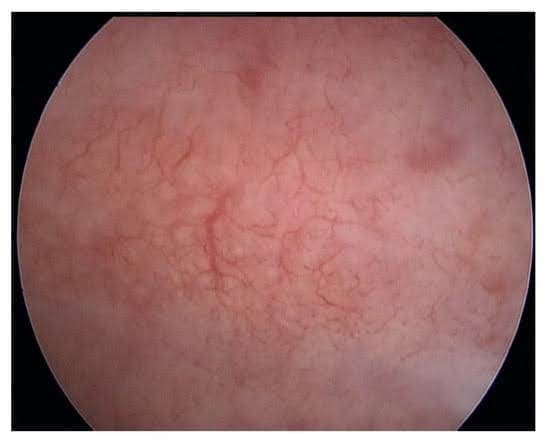
- Гіперваскуляризація (Рис. 2)
- Ендометрій у вигляді “полунички” (Рис. 3)
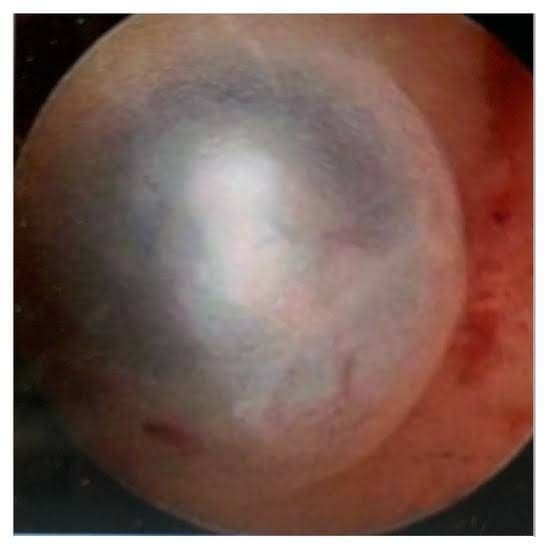
- Фіброзно-кістозний вигляд внутрішньоматкових уражень (Рис. 4)
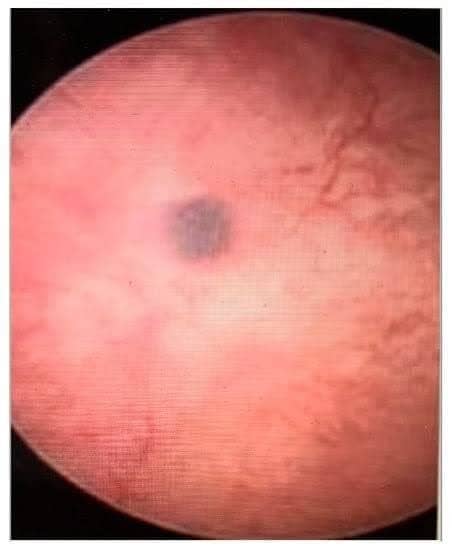
- Геморагічні кістозні ураження, що мають темно-синій або шоколадно-коричневий вигляд (Рис. 5)
Рисунок 1. Нерегулярний ендометрій з отворами.
Рисунок 2. Гіперваскуляризація.
Рисунок 3. Ендометріальний “полуничний” візерунок.
Рисунок 4. Фіброзно-кістозний вигляд внутрішньоматкових уражень.
Рисунок 5. Геморагічні кістозні ураження, що мають темно-синій або шоколадно-коричневий вигляд.
У пацієнток з аденоміозом лише гістероскопія може дати уявлення про можливі аденоміотичні ураження з нерівномірним розподілом судин під час проліферативної та секреторної фази, але не завжди може встановити діагноз. Однак вона дозволяє проводити пряму біопсію зразків, отриманих з ендометрію та підлеглого міометрію за допомогою механічних інструментів (біопсійні або захоплюючі щипці, ножиці) або біполярних електродів [16,21].
За наявності будь-якої гістероскопічної картини, що вказує на захворювання, хірург може використовувати резектоскоп з діатермічною петлею для виконання резекції ендо-міометріального шару. Для отримання адекватної біопсії при такому підході необхідно отримати зразки як з ендометрію, так і з міометрію, що полегшує точну гістологічну діагностику. З вищезазначеної причини, друга біопсія повинна слідувати за первинною, щоб отримати більш глибокі зразки, які включають лише тканину міометрію [6]. Наступні три результати біопсії за допомогою резектоскопа свідчать про аденоміоз: (1) нерегулярний субендометріальний міометрій (спіральний та/або фіброзний); (2) нерегулярна архітектура міометрія під час резекції; (3) наявність інтрамуральних ендометріом [6]. Використання міні-резектоскопа потенційно дозволить отримувати біопсії у випадках аденоміозу в офісних умовах завдяки його розмірам, які роблять досвід офісної гістероскопії більш комфортним для пацієнток [20].
Vercellini та ін. [22] припустили, що голкова біопсія забезпечує високу специфічність (95%), хоча і з низькою чутливістю (44,8%). Навіть коли голчасту біопсію поєднували із застосуванням трансвагінального ультразвуку, покращення чутливості не відбулося. Darwish et al. довели, що резектоскопічна техніка є кращою за жорсткі біопсійні щипці [23], а McCausland був першим, хто описав техніку біопсії міометрія через гістероскопію [17]. Він діагностував аденоміоз у 66% випадків і виявив кореляцію між глибиною та клінічними симптомами. Goswami та ін. [24], використовуючи петльову резекцію, виявили частоту аденоміозу в 60%, що контрастувало з контрольною групою з 33%. Середня глибина інвазії становила 4,103 мм у групі з менорагією та 2,03 мм у контрольній групі. Fedele та ін. [25] використовували як поріг 2,5 мм і діагностували аденоміоз у 51% випадків. Хоча немає єдиної думки щодо діагностичних гістероскопічних критеріїв аденоміозу, здається, що гістероскопія може відігравати важливу роль у діагностиці цієї патології. Якщо порівнювати застосування голкової біопсії з використанням резектоскопа як діагностичного інструменту, то перевага надається другому [24].
Gordts et al. описали використання альтернативної системи – трофічного гістероскопа (Karl Storz, Німеччина). Ця система може змінюватися від діагностичної, з гістероскопом діаметром 2,9 мм, до операційної, з діаметром 4,4 мм, без необхідності вилучення гістероскопа [21]. Подальші інструменти 5-Fr можна вводити через операційну оболонку і використовувати для дисекції або коагуляції. Ендоміометріальна біопсія показала специфічність 78,46% з низькою чутливістю 54,32%, що в основному пов’язано з великою кількістю хибнонегативних результатів у випадках глибокого аденоміозу [26]. На противагу цьому, УЗД має чутливість 72% [27]. Використання маткового спіротома забезпечує більш глибоку і пряму біопсію як з ендометрію, так і з міометрію одночасно. Спіротом працює з двома пристроями: приймальною голкою з ріжучою спіраллю на дистальному кінці та ріжучою канюлею у вигляді зовнішнього листа; напрямок і положення точки спіралі повинні бути під безперервним ультразвуковим та гістероскопічним контролем [21]. Через неоптимальні розміри, використання вищезгаданого гістероскопа розглядається лише під загальною анестезією, що обмежує його застосування операційними.
Dakhly et al. представили підхід до гістероскопічного забору тканин для діагностики аденоміозу з подальшим підтвердженням патології гістеректомією. Гістероскопічна біопсія проводилася з задньої стінки матки з використанням лише гістероскопічних ножиць і захватів. Цей метод показав чутливість 54,3% і специфічність 78,5% для діагностики аденоміозу серед 292 жінок у пременопаузі, яким планували провести гістеректомію з приводу дисменореї та сильних менструальних кровотеч [26].
Існує великий діапазон чутливості методів забору тканин під час гістероскопії. Більшість опублікованих робіт повідомляють про неоптимальну та низьку чутливість для діагностики аденоміозу. Однак це можливо, оскільки кількість біопсій, локалізація біопсії та оптимальна техніка біопсії є потенційними факторами, які визначають чутливість гістероскопічної діагностики аденоміозу. Неоднорідність методик, представлених в літературі, унеможливлює їх порівняння та отримання об’єктивних результатів [28].
Гістероскопія дає можливість проводити пряму біопсію, націлену на ділянки, що становлять інтерес. Результати гістероскопії співставляються з ультразвуковими зображеннями. Клініцисти можуть підходити до жінок з аденоміозом по-іншому, більш консервативно і без необхідності гістеректомії [29] для встановлення остаточного діагнозу. Слід зазначити, що доказів на користь застосування гістероскопії, особливо офісної гістероскопії, як методу дослідження та діагностики аденоміозу недостатньо. Існує не так багато досліджень, які підтримують використання внутрішньоматкових методів, таких як гістероскопія, для діагностики аденоміозу [30]. Тим не менш, гістероскопія є менш інвазивним методом порівняно з гістеректомією, і, безумовно, необхідно повністю вивчити її роль при аденоміозі.
5. Офісна гістероскопія як метод лікування аденоміозу
Аденоміоз можна лікувати консервативно або хірургічно. Традиційно найпоширенішим способом лікування цього хронічного захворювання є гістеректомія. Передопераційна діагностика аденоміозу була значно покращена, зокрема, з’явилася необхідність пропонувати індивідуальне лікування залежно від віку пацієнтки, бажання мати вагітність у майбутньому та симптоматики [31].
Що стосується медикаментозного лікування, то доступні варіанти є первинними, спрямованими на зменшення локальної гіперестрогенії та покращення найтяжчих симптомів аденоміозу, таких як рясні менструальні кровотечі, дисменорея та хронічний тазовий біль, не пов’язаний з менструацією. Медикаментозне лікування аденоміозу включає агоністи або антагоністи гонадотропін-рилізинг-гормону, внутрішньоматкову спіраль, що вивільняє левоноргестрел, комбіновані оральні контрацептиви, прогестагени, уліпристалу ацетат і нестероїдні протизапальні препарати (НПЗП); методи, подібні до тих, що застосовуються для лікування ендометріозу, використовуються і для лікування ендометріозу [31, 32]. Основним недоліком цих методів лікування є те, що вони спричиняють регресію, а не усунення патології, з рецидивом симптомів після відміни препарату [33].
Вогнищевий аденоміоз видаляють за допомогою лапароскопії або лапаротомії, подібно до міомектомії. Однак іноді це може бути складно, оскільки аденоміоз іноді не має чіткої площини розрізу, і існує ризик того, що лікар видалить більше тканини, ніж це необхідно [26]. Гістероскопія можлива лише у випадках, коли вогнищевий або дифузний аденоміоз розташований близько до ендометрію [20]. Гістероскопія не вважається першочерговим методом лікування жінок з аденоміозом, хоча існують окремі випадки, які доводять, що гістероскопія може відігравати важливу роль у лікуванні аденоміозу [19,20].
Крім того, Di Spezio та ін. [20] запропонували енуклеацію як метод лікування вогнищевих аденоміом діаметром менше 1,5 см, розташованих близько до порожнини ендометрія, з використанням механічних інструментів та/або біполярних електродів. Це лікування застосовується у випадках, коли ділянки аденоміозу видно при гістероскопії, оскільки вони проростають у порожнину ендометрія. Обґрунтуванням цього є те, що аденоміоз може бути видалений за допомогою мінімально інвазивної дисекції і може відбуватися в офісних умовах за допомогою міні-гістероскопа і резектоскопа. Техніка, що використовується в амбулаторних умовах, є такою ж, як і для енуклеації підслизових міом, що мають інтрамуральні компоненти. Однак процедура включає значний елемент обережного дослідження через відсутність чіткої площини розсічення, необхідної для адекватної ідентифікації здорової тканини міометрія [16]. У випадку аденоміоїдного вузла розміром понад 1,5 см доцільним варіантом лікування може бути резектоскопічне лікування [20]. Резектоскопічне видалення можливе в офісних умовах за допомогою міні-резектоскопа [34]. Однак докази щодо використання цієї оперативної технології для лікування аденоміозу обмежені.
Абляція ендометрія пропонується переважно жінкам, які не бажають вагітності в майбутньому, і при її виконанні видаляється дефектний міометрій, що лежить в основі [34]. У цьому випадку важливо виявити жінок, які потенційно можуть виконати процедуру в офісних умовах через додаткові витрати часу, а також дискомфорт, який це може спричинити [34]. У випадках глибокого дифузного аденоміозу, коли аденоміотичні ураження розташовані глибше, ніж поверхневий шар ендометрію, гістероскопія не вважається належним підходом, як це очікується. McCausland et al. показали, що в цих випадках резектоскопічне лікування не може поліпшити симптоми, що скаржаться, і більше того, може приховати глибокий аденоміоз, дозволяючи персистуючий розвиток захворювання нижче ендо-міометріальної рубцевої тканини [35].
Оперативна гістероскопія може бути доцільною у випадках поверхневих аденоміоїдних вузлів та дифузного поверхневого аденоміозу як метод лікування [20]. Якщо аденоміому видно в порожнині матки, може бути застосована техніка адено-міомектомії, подібна до міомектомії [36]. Xia та ін. [37] представили дані 51 жінки, яким була виконана гістероскопічна резекція аденоміозу під контролем УЗД, і довели клінічну доцільність гістероскопічної резекції для лікування симптоматичного аденоміозу, що лежить в глибоких шарах міометрія. Інтраопераційна та післяопераційна безпека і низька частота рецидивів менорагії та дисменореї протягом 2-річного спостереження продемонстрували потенційні можливості застосування гістероскопії в лікуванні аденоміозу, як повідомлялося раніше [38,39]. На жаль, гістероскопія надає інформацію лише про стан ендометрію, і гістероскопіст стикається зі значними обмеженнями щодо площини розрізу та простору. Крім того, м’язова тканина тонка і легко перфорується, тому дуже важливо ретельно відбирати пацієнток і переконатися, що це хірургічне втручання виконує кваліфікований хірург [37]. Зокрема, Xia та ін. [37] представили технічні етапи видалення аденоміоми за допомогою гістероскопічної резекції. Після розрізання ендометрію, який покриває аденоміотичні ураження, оголюються рожеві ектопічні ураження ендометрію в міометрії. Потім поступово видаляють ектопічний ендометрій та аденоміотичні вогнища в міометрії. Під час резекції вогнищ ураження виявляють кілька інтрамуральних мікрокіст з широкими основами. Розтин мікрокісти призводить до відтоку густої коричневої рідини, переважно старої крові. Потім ендометріоподібну тканину та мікрокісти видаляють за допомогою петлі. Під час резекції судини міометрія коагулюють, щоб уникнути надмірного всмоктування рідини. Після відкачування рідини внутрішній огляд мікрокісти виявляє наявність рожевої ектопічної ендометріоподібної тканини. Операція вважається завершеною, коли з’являється рожева пучкова структура міометрія [37]. Через характер процедури вважається, що її небезпечно виконувати за допомогою офісного гістероскопічного обладнання [37].
Поверхневий дифузний аденоміоз можна також лікувати за допомогою ендоміометріальної абляції [20]. Цей підхід суттєво відрізняється від традиційного методу ендометріальної абляції. Резекція повинна поширюватися далі в міометрій, принаймні на 10 мм в глибину, в той час як аденоміозне ураження повинно бути в межах 3-10 см. Потім гістероскопіст повинен буде продовжувати вирізати шар міометрію до тих пір, поки не буде розпізнаний здоровий міометрій. Коагуляція завершує процедуру, яка виконується за допомогою прямих петель діаметром 3 мм або 5 мм для абляції дна матки і класичних ріжучих петель для абляції стінок матки [20]. Якщо симптоми не зникають, може бути проведена повторна хірургічна процедура для оцінки ефективності гістероскопічної техніки при лікуванні аденоміозу [20]. Немає даних для оцінки цього методу в умовах кабінету лікаря.
Preutthipan та ін. [32] представили свої результати після гістероскопічної роликової абляції ендометрію. З жінок, які брали участь у цьому дослідженні, 98,4% повідомили про зменшення кровотечі. Лише 1,6% пацієнток довелося виконати гістеректомію для лікування персистуючих симптомів. Це дослідження довело, що гістероскопічна роликова абляція ендометрію, як хірургічна альтернатива висіченню аденоміозу, є ефективною і безпечною процедурою. Крім того, вона також може зменшити потребу в непотрібних великих втручаннях, таких як гістеректомія. Тим не менш, основним обмеженням вищезгаданого дослідження був обмежений розмір вибірки і його ретроспективний характер. У цьому дослідженні також представлені результати гістероскопії, виконаної в операційній під загальною анестезією [32].
Коли кістозні ураження передопераційно розпізнаються глибше в міометрії, ефективним підходом може бути використання спіротома [19]. Gordts et al. показали, що за допомогою спіротома під контролем УЗД можна усунути аденоміотичні кістозні ділянки навіть у тих випадках, коли внутрішньопорожнинні компоненти не видно [19]. Пристрій створює канал і забезпечує гістероскопічний доступ до кістозної структури, що дозволяє проводити подальше лікування за допомогою біполярної коагуляції або резекції [21]. Механічне розсічення маленькими ножицями або розтин кісти і коагуляція невеликих аденоміоїдних кістозних стінок і крипт в зоні злуки також можуть бути виконані під ультразвуковим контролем, хоча ця процедура описана лише в деяких випадках [40,41,42,43].
Як повідомлялося раніше, не існує загальноприйнятого методу гістероскопічного лікування аденоміозу. Деякі автори представляють власний досвід. У цьому дослідженні ми маємо на меті представити ці різні методи. Однак ми не можемо довести, який з них є найкращим, через їхню неоднорідність, навіть у принципах і даних, наведених у кожному рукописі.
6. Висновки
Гістеректомія завжди буде стандартним методом лікування аденоміозу, але все більша кількість жінок бажає використовувати підходи, що зберігають фертильність. У цьому випадку можна запропонувати медикаментозне лікування захворювання або гістероскопічний підхід, якщо він показаний окремим пацієнткам. Покращення дисменореї та менорагії досягається у понад 81% та 50% пацієнток відповідно [20]. Здається, що консервативне медикаментозне лікування є більш ефективним щодо аденоміозу, але докази все ще обмежені, щоб підтвердити його перевагу щодо репродуктивного результату [20]. Це підкреслює важливість постійного вивчення впливу гістероскопічного лікування аденоміозу.
Гістероскопія надає додаткову інформацію в розумінні аденоміозу як патологічного стану, забезпечуючи діагностику та лікування конкретних типів захворювання. Коли аденоміоз розташований близько до ендометрію, можна виявити гістероскопічні ознаки, які надають додаткову інформацію про порожнину матки ураженої пацієнтки [20]. Вона пропонує додаткову перевагу отримання біопсії під прямим контролем зору або під контролем УЗД у випадках більш глибокого аденоміозу для підтвердження ендоскопічного діагнозу [5]. Діагностична гістероскопія при аденоміозі може бути проведена в офісних умовах з оптимальними результатами [20]. Загальна або місцева анестезія не потрібна, а гістероскопіст може використовувати інструменти меншого діаметру і ефективно підходити до порожнини ендометрія, що дозволяє легко отримати біопсію під прямим оглядом [20].
Консервативне, маткозберігаюче лікування аденоміозу видається можливим та ефективним. Гістероскопія може запропонувати варіант лікування аденоміозу. Необхідні подальші дослідження для кращого розуміння показань до гістероскопічного лікування аденоміозу та його впливу на життя жінок [20], особливо в офісних умовах, оскільки наявної інформації поки що недостатньо для підтримки лікування аденоміозу за допомогою офісної гістероскопії [39,40].
Посилання на джерела
- Azziz, R. Adenomyosis: Current perspectives. Obstet. Gynecol. Clin. N. Am. 1989, 16, 221–235.
- Habiba, M.; Benagiano, G. Uterine Adenomyosis; Springer: Cham, Switzerland, 2016.]
- Ryo, E.; Takeshita, S.; Shiba, M.; Ayabe, T. Radiofrequency ablation for cystic adenomyosis: A case report. J. Reprod. Med. 2006, 51, 427–430.
- Peric, H.; Fraser, I.S. The symptomatology of adenomyosis. Best Pract. Res. Clin. Obstet. Gynaecol. 2006, 20, 547–555.
- Gordts, S.; Grimbizis, G.; Campo, R. Symptoms and classification of uterine adenomyosis, including the place of hysteroscopy in diagnosis. Fertil. Steril. 2018, 109, 380–388.e1.
- Harmsen, M.J.; Bosch, T.V.D.; de Leeuw, R.A.; Dueholm, M.; Exacoustos, C.; Valentin, L.; Hehenkamp, W.J.K.; Groenman, F.; De Bruyn, C.; Rasmussen, C.; et al. Consensus on revised definitions of Morphological Uterus Sonographic Assessment (MUSA) features of adenomyosis: Results of modified Delphi procedure. Ultrasound Obstet. Gynecol. 2021, 60, 118–131.
- Ascher, S.M.; Arnold, L.L.; Patt, R.H.; Schruefer, J.J.; Bagley, A.S.; Semelka, R.C.; Zeman, R.K.; Simon, J.A. Adenomyosis: Prospective comparison of MR imaging and transvaginal sonography. Radiology 1994, 190, 803–806.
- Kishi, Y.; Suginami, H.; Kuramori, R.; Yabuta, M.; Suginami, R.; Taniguchi, F. Four subtypes of adenomyosis assessed by magnetic resonance imaging and their specification. Am. J. Obstet. Gynecol. 2012, 207, 114.e1–114.e7.
- Kobayashi, H.; Matsubara, S.; Imanaka, S. Clinicopathological features of different subtypes in adenomyosis: Focus on early lesions. PLoS ONE 2021, 16, e0254147.
- Keckstein, J. Hysteroscopy and adenomyosis. Contrib. Gynecol. Obstet. 2000, 20, 41–50.
- Van den Bosch, T.; De Bruijn, A.M.; De Leeuw, R.A.; Dueholm, M.; Exacoustos, C.; Valentin, L.; Bourne, T.; Timmerman, D.; Huirne, J.A. Sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet. Gynecol. 2019, 53, 576–582.
- Bazot, M.; Cortez, A.; Darai, E.; Rouger, J.E.; Chopier, J.; Antoine, J.M.; Uzan, S. Ultrasonography compared with magnetic resonance imaging for the diagnosis of adenomyosis: Correlation with histopathology. Hum. Reprod. 2001, 16, 2427–2433.
- Cody, R.F.J.; Ascher, S.M. Diagnostic value of radiological tests in chronic pelvic pain. Best Pract. Res. Clin. Obstet. Gynaecol. 2000, 14, 433–466.
- Bosch, T.V.D.; Dueholm, M.; Leone, F.P.G.; Valentin, L.; Rasmussen, C.K.; Votino, A.; Van Schoubroeck, D.; Landolfo, C.; Installé, A.J.F.; Guerriero, S.; et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: A consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet. Gynecol. 2015, 46, 284–298.
- Lazzeri, L.; Morosetti, G.; Centini, G.; Monti, G.; Zupi, E.; Piccione, E.; Exacoustos, C. A sonographic classification of adenomyosis: Interobserver reproducibility in the evaluation of type and degree of the myometrial involvement. Fertil. Steril. 2018, 110, 1154–1161.e3.
- Molinas, C.R.; Campo, R. Office hysteroscopy and adenomyosis. Best Pract. Res. Clin. Obstet. Gynaecol. 2006, 20, 557–567.
- McCausland, A.M. Hysteroscopic myometrial biopsy: Its use in diagnosing adenomyosis and its clinical application. Am. J. Obstet. Gynecol. 1992, 166 Pt 1, 1618–1619.
- Bettocchi, S.; Selvaggi, L. A vaginoscopic approach to reduce the pain of office hysteroscopy. J. Am. Assoc. Gynecol. Laparosc. 1997, 4, 255–258.
- Brosens, I.; Gordts, S.; Habiba, M.; Benagiano, G. Uterine Cystic Adenomyosis: A Disease of Younger Women. J. Pediatr. Adolesc. Gynecol. 2015, 28, 420–426.
- Sardo, A.D.S.; Calagna, G.; Santangelo, F.; Zizolfi, B.; Tanos, V.; Perino, A.; De Wilde, R.L. The Role of Hysteroscopy in the Diagnosis and Treatment of Adenomyosis. BioMed Res. Int. 2017, 2017, 1–7.
- Gordts, S.; Campo, R.; Brosens, I. Hysteroscopic diagnosis and excision of myometrial cystic adenomyosis. Gynecol. Surg. 2014, 11, 273–278.
- Tresserra, F.; Grases, P.; Ubeda, A.; Pascual, M.A.; Grases, P.J.; Labastida, R. Morphological changes in hysterectomies after endometrial ablation. Hum. Reprod. 1999, 14, 1473–1477.
- Darwish, A.M.; Makhlouf, A.M.; Youssof, A.A.; Gadalla, H.A. Hysteroscopic myometrial biopsy in unexplained abnormal uterine bleeding. Eur. J. Obstet. Gynecol. Reprod. Biol. 1999, 86, 139–143.
- Goswami, A.; Khemani, M.; Logani, K.B.; Anand, R. Adenomyosis: Diagnosis by hysteroscopic endomyometrial biopsy, correlation of incidence and severity with menorrhagia. J. Obstet. Gynaecol. Res. 1998, 24, 281–284.
- Fedele, L.; Bianchi, S.; Dorta, M.; Zanotti, F.; Brioschi, D.; Carinelli, S. Transvaginal ultrasonography in the differential diagnosis of adenomyoma versus leiomyoma. Am. J. Obstet. Gynecol. 1992, 167, 603–606.
- Dakhly, D.M.R.; Abdel Moety, G.A.F.; Saber, W.; Gad Allah, S.H.; Hashem, A.T.; Abdel Salam, L.O.E. Accuracy of Hysteroscopic Endomyometrial Biopsy in Diagnosis of Adenomyosis. J. Minim. Invasive Gynecol. 2016, 23, 364–371.
- Champaneria, R.; Abedin, P.; Daniels, J.; Balogun, M.; Khan, K.S. Ultrasound scan and magnetic resonance imaging for the diagnosis of adenomyosis: Systematic review comparing test accuracy. Acta Obstet. Gynecol. Scand. 2010, 89, 1374–1384.
- Movilla, P.; Morris, S.; Isaacson, K. A Systematic Review of Tissue Sampling Techniques for the Diagnosis of Adenomyosis. J. Minim. Invasive Gynecol. 2020, 27, 344–351.
- Luciano, D.E.; Exacoustos, C.; Albrecht, L.; LaMonica, R.; Proffer, A.; Zupi, E.; Luciano, A.A. Three-Dimensional Ultrasound in Diagnosis of Adenomyosis: Histologic Correlation With Ultrasound Targeted Biopsies of the Uterus. J. Minim. Invasive Gynecol. 2013, 20, 803–810.
- Chapron, C.; Vannuccini, S.; Santulli, P.; Abrão, M.S.; Carmona, F.; Fraser, I.S.; Gordts, S.; Guo, S.-W.; Just, P.-A.; Noël, J.-C.; et al. Diagnosing adenomyosis: An integrated clinical and imaging approach. Hum. Reprod. Updat. 2020, 26, 392–411.
- Stratopoulou, C.A.; Donnez, J.; Dolmans, M.-M. Conservative Management of Uterine Adenomyosis: Medical vs. Surgical Approach. J. Clin. Med. 2021, 10, 4878.
- Preutthipan, S.; Herabutya, Y. Hysteroscopic rollerball endometrial ablation as an alternative treatment for adenomyosis with menorrhagia and/or dysmenorrhea. J. Obstet. Gynaecol. Res. 2010, 36, 1031–1036.
- Matsushima, T.; Akira, S.; Yoneyama, K.; Takeshita, T. Recurrence of uterine adenomyosis after administration of gonadotropin-releasing hormone agonist and the efficacy of dienogest. Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. 2020, 36, 521–524.
- De Silva, P.M.; Stevenson, H.; Smith, P.P.; Clark, T.J. Pain and Operative Technologies Used in Office Hysteroscopy: A Systematic Review of Randomized Controlled Trials. J. Minim. Invasive Gynecol. 2021, 28, 1699–1711.
- McCausland, A.M.; McCausland, V.M. Long-term complications of endometrial ablation: Cause, diagnosis, treatment, and prevention. J. Minim. Invasive Gynecol. 2007, 14, 399–406.
- Taran, F.A.; Stewart, E.A.; Brucker, S. Adenomyosis: Epidemiology, Risk Factors, Clinical Phenotype and Surgical and Interventional Alternatives to Hysterectomy. Geburtshilfe Frauenheilkd. 2013, 73, 924–931.
- Xia, W.; Zhang, D.; Zhu, Q.; Zhang, H.; Yang, S.; Ma, J.; Pan, H.; Tong, T.; Sun, J.; Zhang, J. Hysteroscopic excision of symptomatic myometrial adenomyosis: Feasibility and effectiveness. BJOG Int. J. Obstet. Gynaecol. 2017, 124, 1615–1620.
- Nishida, M.; Takano, K.; Arai, Y.; Ozone, H.; Ichikawa, R. Conservative surgical management for diffuse uterine adenomyosis. Fertil. Steril. 2010, 94, 715–719.
- Pontis, A.; D’Alterio, M.N.; Pirarba, S.; de Angelis, C.; Tinelli, R.; Angioni, S. Adenomyosis: A systematic review of medical treatment. Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. 2016, 32, 696–700.
- Giana, M.; Montella, F.; Surico, D.; Vigone, A.; Bozzola, C.; Ruspa, G. Large intramyometrial cystic adenomyosis: A hysteroscopic approach with bipolar resectoscope: Case report. Eur. J. Gynaecol. Oncol. 2005, 26, 462–463.
- Kamio, M.; Taguchi, S.; Oki, T.; Tsuji, T.; Iwamoto, I.; Yoshinaga, M.; Douchi, T. Isolated adenomyotic cyst associated with severe dysmenorrhea. J. Obstet. Gynaecol. Res. 2007, 33, 388–391.
- Sun, W.; Guo, X.; Zhu, L.; Fei, X.; Zhang, Z.; Li, D. Hysteroscopic Treatment of a Uterine Cystic Adenomyosis. J. Minim. Invasive Gynecol. 2018, 25, 374–375.
- Takeuchi, H.; Kitade, M.; Kikuchi, I.; Kumakiri, J.; Kuroda, K.; Jinushi, M. Diagnosis, laparoscopic management, and histopathologic findings of juvenile cystic adenomyoma: A review of nine cases. Fertil. Steril. 2010, 94, 862–868.