Автори: Carrie B. Betel, Phyllis Glanc
КЛЮЧОВІ СЛОВА:
яєчник, кіста, ультразвук, візуалізація, низький злоякісний потенціал
Досягнення в області ультрасонографії, включаючи датчики з більш високою частотою і рутинне використання трансвагінальної ультрасонографії, привели до збільшення частоти виявлення кістозних уражень яєчників. На щастя, ці успіхи також привели і до збільшення роздільної здатності, яка дозволяє охарактеризувати приблизно 90% новоутворень придатків тільки за допомогою ультрасонографії. У цій статті описується ультразвукова техніка та особливості патології яєчників. Також обговорюються і інші методи візуалізації, які є в арсеналі для характеристики ураження яєчників. Потім в статті оцінюються різні кістозні ураження яєчників, включаючи граничні пухлини. Також обговорюються клінічні міркування і можливе лікування. Ця стаття обмежена тільки внутрішньою патологією яєчників. Екстраоваріальні кістозні ураження і ураження під час вагітності не обговорюються, проте читач може звернутися до інших літературних джерел за додатковою інформацією.
ВІЗУАЛІЗАЦІЯ
Ретельна методика проведення сонографії має велике значення для точної характеристики уражень яєчників. Трансабдомінальне сканування забезпечує більш широке поле зору для великих уражень і здатне візуалізувати яєчники, які лежать вище або латеральніше в області тазу. Однак трансвагінальна ультрасонографія є основою сонографічної оцінки. Будь-яке ураження має бути визуалізовано цілком, як мінімум, в двох площинах. Тканина яєчника, яка оточує зону ураження, для підтвердження її оваріального походження, повинна бути чітко ідентифікована.
У численних дослідженнях проводилися спроби скласти список сонографічних критеріїв, які могли б точно прогнозувати злоякісність, але жоден з них не володіє достатньою специфічністю і чутливістю для підтвердження або виключення злоякісного процесу. Існує велика кількість подібних візуальних характеристик між доброякісними і злоякісними ураженнями. В кінцевому підсумку було показано, що техніка суб’єктивного розпізнавання характеру уражень краща, ніж бальні системи оцінки, при дослідженні патології придатків з чутливістю від 88% до 100%, специфічністю від 62% до 96%, позитивним прогностичним значенням 99% і негативним прогностичним значенням 73%.
Морфологічні ознаки в сірій шкалі є визначальними характеристиками при диференційній оцінці доброякісних або злоякісних уражень. Особливості, які вказують на злоякісний процес, включають: потовщена і нерівна стінка або перегородка (> 3 мм), папілярні розростання (> 3 мм). Однак потовщення стінок або перетинки можна спостерігати і при багатьох доброякісних станах, таких як ендометріоз, абсцес і доброякісні пухлини.
Доплерографія може бути якісною або кількісною і використовується в якості доповнення до ультрасонографії в відтінках сірого. При якісній доплерівській оцінці, в злоякісних пухлинах через неоангіогенез визначається централізований кольоровий потік в твердих компонентах і перегородках. Однак і в цьому випадку подібне спостерігається і з доброякісними ураженнями. У дослідження Stein і його колег вивчалася наявність внутрішнього кольорового потоку в 170 пухлинах придатків. При цьому визначена чутливість 77%, специфічність 69%, негативна прогностична значимість 89% і позитивна прогностична значимість – 49%. При якісній доплерівській оцінці, злоякісні пухлини мали більш низький індекс пульсації (ІП), нижчий резистивний індекс (РІ) і більш високу швидкість. Це пов’язано з більш низьким опором, що залежить від ступеня розвитку неоваскуляризації і аномальних артеріовенозних шунтів. Граничні значення, які пропонуються для визначення пухлини, як злоякісної, включають РІ – менше 0,4, IП – менше 1,0, максимальна швидкість – понад 15 см/с і відсутність діастолічної западини. Однак при цьому визначається частковий збіг параметрів, через який не може бути чітко задано певне числове порогове значення. Наприклад, в одному дослідження було показано, що 6 з 8 злоякісних уражень мали РІ більше 0,4. Злоякісні новоутворення можуть мати високий ІП або РІ через утворення судинних пухлинних тромбів, судинного стенозу, аневризматичної дилатації і аномального розгалуження судин.
Допоміжні сонографічні особливості, які можуть прогнозувати малігнізацію, включають залучення в процес прилеглих органів тазу і бічних стінок, асцит, лімфаденопатію і збільшення перитонеальних, брижових або оментальних лімфовузлів. Доступно небагато інформації про роль 3-вимірної ультрасонографії, але вона може мати значення для визначення джерела походження осередку ураження. Ультрасонографія з контрастними мікробульбашками може бути ефективна для виявлення неоваскуляризації, яка пов’язана з раком яєчників на ранній стадії і проявляється в злоякісних пухлинах яєчників у вигляді великого пікового посилення, більш тривалого часу елімінації і збільшення судинного об’єму.
Чутливість комп’ютерної томографії (КТ) для виявлення і характеристики пухлин придатків нижча, ніж для ультрасонографії. КТ має чутливість 90%, специфічність 89%, позитивне прогностичне значення 78%, негативне прогностичне значення 95% і точність 89%. КТ перевершує ультрасонографію при оцінці поширеності патологічного процесу і у виявленні дрібних перитонеальних імплантатів і лімфаденопатії. КТ також може виявляти макроскопічні ділянки жирової тканини, що дозволяє характеризувати дермоїди. Магнітно-резонансна томографія (МРТ) є ефективним доповненням до ультрасонографії через її підвищену тканинну специфічність і більш широке поля зору. МРТ може диференціювати жирову тканину, кров і просту рідину, при цьому може вирішувати діагностичні проблеми, коли ультрасонографія неінформативна. Цей метод може виявляти яєчник, коли він не визначається при ультрасонографії, особливо у випадках порушеної анатомії, що ефективно для визначення джерела розвитку патологічного процесу. Чутливість МРТ зображень становить від 91% до 100%, а специфічність від 78% до 93%.
Позитронно-емісійна томографія (ПЕТ) з фтордезоксиглюкозою F18 не рекомендується для первинного виявлення раку яєчників. Метод має чутливість від 74% до 100%, а специфічність від 81% до 100%. Перевага даного методу полягає в плануванні лікування, подальшого спостереження, виявленні рецидивів захворювання. Хибнонегативні результати визначаються в граничних і високо диференційованих пухлинах, в той час як хибнопозитивні результати реєструються при гідросальпінксі, фібромі і ендометріомі.
ФІЗІОЛОГІЧНІ КІСТИ
Прості кісти яєчників є анехогенними і тонкостінними, з дистальним акустичним посиленням і не містять твердих компонентів (рис. 1).
Рис. 1. Проста кіста яєчника у 28-річної жінки. Стрілка вказує на навколишню паренхіму яєчника, що говорить про внутрішньооваріальне розташування. За даними доплерографії внутрішній кровотік не визначається (зображення не показані).
Як правило, наявність однієї тонкої (<3 мм) перетинки також дозволяє характеризувати кісту як просту, і вона може спостерігатися аналогічним чином. Більшість простих кіст у жінок у пременопаузі – це фізіологічні фолікули. Ці кісти можуть збільшуватися до 3 см і зазвичай зникають через 1-2 місяці. Іноді вони можуть призводити до крововиливів, що характеризуються більш складною візуальною картиною. Деякі прості кісти насправді є доброякісними цистаденомами (особливо кісти розміром> 10 см і у жінок похилого віку).
Численні статті були присвячені простим кістам у жінок в постменопаузі. Спочатку такі кісти вважалися патологічними, але, оскільки роздільна здатність ультразвукових пристроїв поліпшується, і ці кісти стали визначатися частіше, їх значення було переоцінено. В даний час в декількох дослідженнях було показано, що прості кісти зустрічаються у 10-20% жінок в постменопаузі і не пов’язані із замісною гормональною терапією або часом від моменту менопаузи.
Дослідження 1769 безсимптомних жінок в постменопаузі показало, що 6,6% (116 жінок) мали прості кісти розміром менше 5 см. З них 24% кіст зникли самостійно, 59% кіст зберігалися і 17% пацієнток пропали з поля зору. З 27 кіст, які зникли, 56% зникли через 6 місяців, а решта протягом наступних двох років. З персистуючих кіст, 26% зазнали хірургічного втручання, при цьому 67% з них були серозними цистаденомами.
В іншому дослідженні під спостереженням перебувало 3259 простих однокамерних кіст у 2763 жінок у віці від 50 років із середнім часом спостереження – 6,3 року. З них 69% (2 261) кіст зникли самостійно (66% протягом 3 місяців). Не було зареєстровано випадків раку яєчників, який почав би свій ріст з однієї з цих кіст. Дослідники прийшли до висновку, що однокамерні кісти мають надзвичайно низький потенціал розвитку злоякісних новоутворень (<1% з 95% довірчим інтервалом).
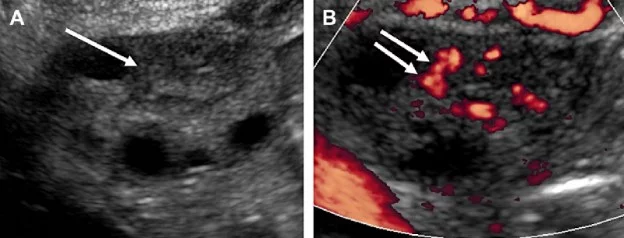
Жовті тіла – це залишки домінантного фолікула після овуляції. Зазвичай вони односторонні і розміром менше 3 см. Їх сонографічні особливості включають наявність внутрішніх ехо-сигналів, товстої дрібнозубчастої стінки і периферичну васкуляризацію (яка називається вогняним кільцем) (рис. 2).
Рис. 2. Жовте тіло у 28-річної жінки. На сонограмі у відтінках сірого (A) показана правобічна кіста яєчника з внутрішнім ехо-сигналом (стрілка). Кольорова доплерограма (B) показує навколо «вогняне кільце» (подвійна стрілка).
Внутрішній крововилив може сприяти збільшенню розмірів до 5 см і більше. Ці кісти звичайно регресують протягом 14-16 тижнів від моменту їх утворення. В ідеалі, ультрасонографія жінок в пременопаузі повинна виконуватися в 5-9 дні менструального циклу (до овуляції), щоб звести до мінімуму появу подібних змін.
СИНДРОМ ПОЛІКІСТОЗНИХ ЯЄЧНИКІВ
Синдром полікістозних яєчників (СПКЯ) (відомий також як синдром Штейна-Левенталя) являє собою ендокринний розлад, який діагностується при біохімічному або патогістологічному дослідженні. Сонографічно, яєчник може бути нормальним, проте наявність даної патології підозрюється в тому випадку, якщо яєчники збільшені і містять кілька невеликих, менше сантиметра фолікулів. В одному дослідженні 28 пацієнток у віці від 17 до 39 років з біохімічними ознаками, характерними для СПКЯ, середній об’єм яєчників був збільшений до 14 см3 (проти нормального 9,8 см3). Однак нормальний розмір яєчників був виявлений у 29,7% жінок. З часу появи первинних ультрасонографічних критеріїв для діагностики полікістозних яєчників, які були описані в 1986 році, вони постійно вдосконалювалися. За Ротердамськими критеріями від 2003 року полікістозними яєчники вважалися в разі наявності 12 або більше фолікулів, розміром між 2 і 9 мм і/або збільшеного об’єму яєчників (> 10 мл). Наявність одного яєчника, який відповідає цьому опису, дозволяє поставити діагноз полікістозного яєчника. Додаткові характеристики, представлені в різних варіаціях, включають ознаки периферичного розташування фолікулів і гіперехогенну центральну строму. Найбільш свіже визначення СПКЯ, опубліковане суспільством Androgen Excess і PCOS, включає гіперандрогенізм (клінічний або біохімічний), дисфункцію яєчників (олігоановуляцію і/або полікістозні яєчники) і виключення пов’язаних з ними розладів. Синдром Штейн-Левенталя характеризується тріадою: аменорея, гірсутизм і ожиріння. Ці пацієнти схильні до ризику раку ендометрію через підвищення рівня естрогену. Вони також мають підвищений ризик розвитку пухлин яєчників з частотою від 4,6% до 17,0%.
СИНДРОМ ГІПЕРСТИМУЛЯЦІЇ ЯЄЧНИКІВ
Синдром гіперстимуляції яєчників спостерігається у пацієнтів, які отримують препарати для індукції овуляції. Цей стан призводить до двостороннього збільшення полікістозних яєчників (рис. 3) і може супроводжуватися асцитом і плевральним випотом.
Рис. 3. Синдром гіперстимуляції яєчників у 35-річної жінки. Правий яєчник (А) візуалізовано при трансабдомінальному дослідженні, а лівий яєчник (В) – при трансвагінальному. Обидва яєчника містять множинні кісти.
ГЕМОРАГІЧНІ КІСТИ
Крововилив зазвичай зустрічається всередині жовтого тіла, але іноді з’являється і в фізіологічних кістах. Сонографічна картина кіст варіює, залежно від тривалості перебування в них крові, і в більшості випадків вони виявляються при скануванні. Зазвичай спостерігаються внутрішні ехо-сигнали, іноді необхідно збільшити сонографічне посилення для отримання незначних ехо-сигналів. Часто визначаються внутрішні ниткоподібні структури, які пов’язані з фібрином. На відміну від перетинок, вони численні, тонкі, слабкі відображають ультразвук і не перетинають всю кісту. Їх візуальний прояв описується як «сітка», «мереживо» або «павутина». Згусток всередині може імітувати твердий компонент. Однак в згустках не визначається васкуляризація, вони мають увігнуті межі або наявність кутів через ретракцію тромба (Рис. 4).
Рис.4. Геморагічна кіста у 33-річної жінки. Кіста правого яєчника з внутрішньою ехогенною ділянкою на сонограмі в відтінках сірого, що відповідає току крові (A); стрілка вказує на увігнутий край, характерний для згустку крові. На кольоровій доплерограмі (B) показана внутрішня васкуляризація.
Згусток крові також може мати желеподібний рух при компресії датчиком. Можуть також визначатися рівень рідина-рідина, периферичний судинний рух і потовщені стінки. Геморагічні кісти зазвичай регресують протягом 8 тижнів. Значимість візуалізації характерних особливостей крововиливів всередині осередка ураження полягає в тому, що вони практично завжди зустрічаються при доброякісних процесах. Хоча геморагічна кіста часто вважалася складною для діагностики патологією, специфічні сономорфологічні особливості дозволяють поставити специфічний діагноз в 90% випадків геморагічних кіст.
ЕНДОМЕТРІОМИ
Ендометріоз визначається як наявність функціональної тканини ендометрію поза порожниною матки. Осередкове кістозне ураження називається ендометріома. Захворюваність становить від 5 до 10%, причому переважно у жінок дітородного віку. Протяжність патологічного процесу не завжди корелює з виразністю симптомів. Множинність уражень допомагає підтвердити діагноз, причому яєчник є найбільш поширеним місцем. Приблизно в 50% випадків процес є двостороннім.
Сонографічна картина ендометріоми варіабельна. Класично – це однокамерне або багатокамерне кістозне ураження, з аваскулярним гомогенним низькочастотним внутрішнім ехо-сигналом. Такі ознаки визначаються приблизно в 95% ендометріом (рис. 5). Ехогенні внутрішньостінкові осередки виявляються в 36% випадків ендометріом, можливо, це внутрішньостінкові порожнечі від розчиненого холестерину (рис. 6).
Рис.5. Ендометріоми у 41-річної жінки (А) з внутрішнім низькорівневим ехо-сигналом (стрілка). Ендометріоми у 28-річної жінки (B) з внутрішнім низькорівневим ехо-сигналом і ехогенним внутрішньостінковим вузликом (стрілка). На кольоровій доплерограмі (С) внутрішня васкуляризація не визначається.
Рис.6. Ендометріома у 36-річної жінки. У ендометріомі визначаються низькорівневі ехо-сигнали і ехогенні внутрішньостінкові осередки (стрілки).
В одному дослідженні було показано, що відношення правдоподібності ендометріоми при кістозному ураженні з низькорівневим ехо-сигналом становить 5, збільшується до 8 при відсутності неопластичних ознак і зростає до 48, коли визначаються багатокамерні або ехогенні внутрішньостінкові утворення. Менш характерним є анехогенне кістозне ураження, в якому визначається рівень рідина-рідина або перетинка, або яке включає в себе внутрішні кальцифікати. Тверді вузлики візуалізуються в 4-20% ендометріом, що являють собою тромбоз або тканину ендометрію (див. Рис. 5B і C). При цьому на доплерограмі визначається кровоток, якщо у вузлі присутня тканина ендометрію. Сканування в режимі реального часу з мануальною компресією може бути ефективним для визначення таких вторинних ознак розвитку злук, як заднє зміщення і фіксоване положення органів малого таза.
Сонографічна картина може перегукуватися з геморагічними кістами, дермоїдом або кістозними неопластичними процесами. Подальша ультрасонографія через 6-12 тижнів у жінок в пременопаузі ефективна для диференціальної діагностики від геморагічної кісти.
МРТ може підтвердити діагноз, тому що ендометріоїдні вогнища виглядають досить яскравими на Т1-зважених зображеннях (навіть з сатурацією жирової тканини) і темними на Т2-зважених зображеннях (які називаються T2-затемненням). МРТ значно ефективніше при оцінці поширеності ураження, через більш широке поле зору, і при виявленні невеликих ендометріоїдних вогнищ. Чутливість, специфічність і точність МРТ складають 90%, 98% і 96% відповідно.
Малігнізація досить рідкісне явище і зустрічається у від 0,6% до 0,8% жінок з ендометріозом. Патогенез до кінця невизначений, проте можливо, процес розвивається в результаті тривалого впливу естрогену. Найбільш поширеними гістологічними типами є ендометріоїдна і виразкова карцинома. Близько 75% випадків є внутрішньооваріальними. Ця патологія найчастіше зустрічається у жінок старше 45 років, при розмірах уражень більше 9 см. Слід звернути на це увагу, коли визначаються васкуляризовані внутрішньостінкові вузлики або в разі прискорення патологічного процесу. На МРТ зображенні може зникати T2-затінення через розведення геморагічної рідини пухлинним секретом. Іноді під час вагітності ендометріоми можуть стати децидуалізованими, що призводить до розвитку васкуляризованих внутрішньостінкових вузликів, які імітують картину злоякісних новоутворень. Ця децидуалізація обумовлена збільшенням рівня прогестерону, що викликає гіпертрофію стромальних клітин ендометрію.
ДЕРМОЇД
Дермоїди також називаються зрілими кістозними тератомами, є найбільш поширеними доброякісними пухлинами яєчників у молодих жінок і часто визначаються випадково. Ці пухлини складають 20% пухлин яєчників у дорослих, 50% у дітей і 95% пухлин зародкових клітин. Інші пухлини зародкових клітин обговорюються в цій статті далі. Хоча ці пухлини і спостерігаються найчастіше у жінок репродуктивного віку, вони також можуть визначатися у дівчаток і жінок в постменопаузі. Дермоїди розвиваються із зародкових клітин зрілих тканин ектодермального, ендодермального і мезодермального походження.
Сонографічно, 88% дермоїдів являють собою однокамерну кісту, а в 10% мають двобічну локалізацію. Кістозне ураження може містити жирову тканину, осередки кальцифікації, вузол Рокітанського або дермоїдну сітку (рис. 7А).
Рис. 7. Дермоїд в лівому яєчнику у 28-річної жінки (хрестики), з класичними ознаками (A). Серед них визначаються: ехогенний вузол Рокітанського (стрілка), акустична тінь (подвійна стрілка) і дермоїдна сітка (наконечник стрілки). У дермоїді 75-річної жінки (B) визначається рівень рідина-рідина (велика стрілка). (C) КТ зображення з контрастним посиленням у тієї ж 75-річної пацієнтки демонструє макроскопічне жирове вогнище всередині дермоїда (вигнута стрілка).
Макроскопічне вогнище жирової тканини визначається в 93% дермоїдів, а осередки кальцифікації в 56%. Вогнища кальцифікації найчастіше є зубом або кісткою, зуби виявляються в 31% випадків. Ознака кальцифікації не є специфічною, оскільки вона також може візуалізуватися при злоякісних новоутвореннях. Вузол Рокітанського (або дермоїдна пробка) являє собою внутрішньостінковий вузол, що складається з жирової тканини, волосся, компонентів сальної залози і вогнища кальцифікації. Цей вузол часто має високоехогенну текстуру з акустичним затіненням. Гіперехогенність має позитивне прогностичне значення в 98% і визначається в 58% тератом. Затінення розвиваються в результаті внутрішньої кальцифікації, та мають позитивне прогностичне значення в 96% і спостерігається в 86% тератом. Дермоїдна мережа візуалізується у вигляді внутрішніх гіперехогенних ліній і точок. Ця характеристика має позитивне прогностичне значення в 98% і спостерігається в 61% тератом. Рівні жир-рідина, з ехогенним жиром у вільному положенні, виявлялися при ультрасонографії з позитивним прогностичним значенням 60% і спостерігалися у 8% тератом (див. Рис. 7B). В одному клінічному спостереженні описуються множинні ехогенні плаваючі кульки, які при патогістологічному дослідженні являли собою десквамативні утворення кератину. Геморагічні кісти також можуть бути ехогенними, але без формування акустичного затінення.
Під час діагностики дермоїда ультрасонографія має чутливість 58% і специфічність 99%. КТ може виявляти зони кальцифікації і жир всередині кісти (див. Рис. 7C). У той же час, 15% дермоїдних кіст не містять жиру, жирові осередки можуть не визначатися через усереднення за обсягом з оточуючою жировою тканиною, в свою чергу ліполейоміоми також містять жир. На МРТ зображеннях макроскопічна внутрішня жирова тканина визначається у вигляді яскравого вогнища в T1-зважених послідовностях, і згасанням сигналу на послідовностях з частотно-селективною сатурацією жиру. Артефакт хімічного зсуву спостерігається в 62% -87% випадків. Дермоїди бувають двобічними в 10%.
Ускладнення зустрічаються рідко і включають в себе: розрив, перекрут, малігнізацію, інфекцію (1%) і аутоімунні гемолітичні анемії (<1%). Розрив (1% -4%) з поширенням вмісту сальних залоз може викликати запалення. Перекрут (3% -16%) може призвести до утворення повнокровних кровоносних судин і відхилення матки в бік перекрута. Малігнізація зустрічається від 0,17% до 2,00% і в більш ніж 80% випадків – це плоскоклітинний рак. Вузол Рокітанського є найбільш поширеним місцем злоякісної трансформації. Особливості, які сприяють злоякісному переродженню, включають: жінки в постменопаузі, утворення, розмір яких перевищує 10 см, наявність твердого компонента, центральний судинний кровообіг і екстракапсулярне розростання пухлини. Були також описані внутрішні ізоехогенні розгалужені структури. Як правило, злоякісний процес являє собою випадкове мікроскопічне вогнище, але іноді можна виявити локальну інвазію і метастази.
ПУХЛИНИ ЯЄЧНИКА
Загальний ризик розвитку у жінки оваріального раку становить 1,8%. Пухлини яєчника класифікуються Всесвітньою організацією охорони здоров’я гістологічно, як: пухлини з клітин поверхневого епітелію, герміноклітинні і стромальні пухлини. Також зустрічаються метастази і інші рідкісні патологічні стани, такі як: карциносаркоми, ембріональна нейроендокринна пухлина і лімфома. Герміноклітинні і стромальні пухлини клітин є переважно доброякісними. Більшість пухлин мають змішану кістозну і солідну будову. Однак деякі з них переважно солідної (твердої) структури, а саме: пухлина Бреннера, дисгермінома, гранульомоклітинні пухлини, стромально-клітинні пухлини, метастази і лімфоми.
ЕПІТЕЛІАЛЬНІ ПУХЛИНИ ЯЄЧНИКА
Епітеліальні (або поверхнево-епітеліальні) пухлини яєчників включають 90% ракових захворювань яєчників в західному світі і класифікуються як серозні (60%), муцинозні (10%), ендометріоїдні (15%), світлоклітинні (мезонефроїдні 5%), пухлина Бреннера (так звана перехідна пухлина, 5%), змішаний епітеліальний і недиференційований рак (8%). Тип клітин при наявності епітеліального раку може бути доброякісним, граничним або злоякісним. Пік розвитку епітеліальних пухлин перепадає на шосте-сьоме десятиліття. Ці пухлини переважно кістозної будови, проте часто містять внутрішні перетинки і вузлики.
Серозні пухлини
Серозні пухлини є найбільш поширеними серед доброякісних і злоякісних новоутворень яєчників. Вони складають 25% доброякісних новоутворень яєчників і до 50% випадків раку яєчників. З них 60% є доброякісними, 15% граничними і 25% злоякісними.
Серозні цистаденоми є доброякісними. Вони являють собою чітко відмежовані, великі кістозні утворення, які в 20% випадків є двобічними. Ці ураження часто однокамерні з перетинками і папілярними виростами.
Серозні цистаденокарциноми є злоякісними. Ці ураження також кістозної структури з перетинками і папілярними виростами, але частіше за все мають більш складну будову, ніж їх доброякісні аналоги (рис. 8).
Рис. 8. Серозна цистаденокарцинома у 56-річної жінки. Сонограма при трансабдомінальному скануванні кісти правого яєчника з папілярними виростами.
Близько 50% цистаденокарцином є двобічними. Більше 90% пацієнток мають підвищений рівень антигену 125 (CA 125). Більшість пацієнток звертаються за медичною допомогою із запущеною стадією захворювання.
Муцинозні пухлини
Ці пухлини зустрічаються рідше, ніж серозні пухлини. Їхня доля складає до 20% всіх пухлин яєчників, 41% доброякісних новоутворень яєчників і 10% злоякісних пухлин яєчників. З них 80% є доброякісними, 10% – граничними і 5% – злоякісних. Ці пухлини є зазвичай однобічними, приблизно 2% -5% є двобічними.
Муцинозні цистаденоми являють собою великі багатокамерні кісти. Перетинки гладкі і тонкі. Внутрішні камери можуть бути ехогенними при ультрасонографії і мати гіператенуацію (гіперпослаблення) на КТ. При МРТ камери мають різну інтенсивність сигналу на T1- і T2-зважених зображеннях через різницю кількості внутрішнього вмісту білка, муцина і крові. Така картина нагадує вид вітражного скла.
Муцинозна цистаденокарцинома має схожу будову, однак має велику кількість папілярних виростів. В цілому, даний вид пухлини містить менше твердих компонентів, ніж серозні пухлини (рис. 9).
Коли ці пухлини метастазують або розриваються, може мати місце розвиток перитонеальної псевдоміксоми, при цьому муцинові пухлинні імплантати починають розвиватися на перитонеальних поверхнях. Цей стан зазвичай визначається в граничних або злоякісних муцинозних пухлинах.
Рис. 9. Муцинозна цистаденокарцинома у 41-річної жінки. Правий яєчник заміщений великим кістозним утворенням з внутрішніми перетинками і камерами (А). Кольорова доплерограмма показує артеріальну васкуляризацію в перетинці (B). КТ з контрастним посиленням (С) того ж пацієнта також показує велике кістозне ураження з внутрішніми перетинками (стрілка).
Ендометріоїдні пухлини
Ендометріоїдні пухлини складають 17,5% випадків раку яєчників. Ці пухлини майже завжди злоякісні і рідко бувають доброякісними або граничними. Вони є двобічними в 25% випадків. Вони можуть розвиватися з клітин поверхневого епітелію або ендометріоми. Ці пухлини пов’язані з гіперплазією ендометрію або раком в 20-33% випадків. Ендометріоїдні пухлини мають варіабельну візуальну картину і можуть бути змішаними кістозно-солідними, або повністю солідними.
Світлоклітинні пухлини
Світлоклітинні пухлини становлять 7,4% випадків раку яєчників. Ці пухлини майже завжди злоякісні. Близько 75% визначаються в 1 стадії захворювання, тоді відзначається хороший прогноз з 50-відсотковою виживаністю протягом 5 років. Світлоклітинні пухлини мають варіабельну візуальну картину, яка часто являє собою однокамерну кісту з внутрішньостінковими вузликами.
Пухлини Бреннера
Пухлини Бреннера складають менше 3% епітеліальних пухлин яєчників і часто виявляються випадково. Ці пухлини рідко є злоякісними і зазвичай носять односторонній характер. Це невеликі, тверді, чітко відмежовані пухлини, також можуть мати велику аморфну зону внутрішньої кальцифікації. У 20% випадків пухлини Бреннера пов’язані з іпсилатеральними муцинозними кістозними пухлинами, і, таким чином, візуально може визначатися картина солідного або кістозного утворення. Внутрішня фіброзна строма генерує низький Т2 сигнал при проведенні МРТ.
Інші пухлини
Недиференційована карцинома має клітинну диференціацію, яка є недостатньою для її точної характеристики. Ці пухлини при їх виявленні зазвичай великі і пов’язані з поганим прогнозом.
Цистаденофіброми представляють собою підгрупу епітеліальних новоутворень яєчників, які зазвичай є доброякісними. Вони являють собою багатокамерні кістозні утворення з перетинками і твердими компонентами (рис. 10). Вузли можуть мати низький Т2 сигнал при проведенні МРТ через наявність фіброзного компонента.
Рис. 10. Цистаденофіброма у 71-річної жінки. На сонограмі визначаються внутрішні солідні компоненти в межах кістозного ураження.
ГЕРМІНОГЕННІ ПУХЛИНИ
Герміногенні пухлини (пухлини зародкових клітин) включають тератоми, дисгерміноми, хоріокарциноми, ендодермальні синусові пухлини, ембріональні карциноми і пухлини із змішаних зародкових клітин. Тератоми яєчника розділяються на зрілі тератоми, незрілі тератоми і монодермальні тератоми. Герміногенні пухлини складають від 15% до 20% всіх новоутворень яєчників, при цьому 95% з них є зрілими тератомами, які обговорюються в розділі «Дермоїд». Крім тератом, герміногенні пухлини спостерігаються у дітей і молодих людей з високою ймовірністю малігнізації. Крім зрілих тератом, пухлини зародкових клітин являють собою великі, переважно щільні новоутворення, які можуть мати внутрішні кістозні компоненти. При деяких з них відзначаються підвищені рівні сироваткового а-фетопротеїну (АФП) і рівень хоріонічного гонадотропіну людини (ХГЛ).
Незрілі тератоми (також відомі як злоякісні тератоми) складають менше 1% тератом і найчастіше зустрічаються у підлітків і молодих жінок. Вони складаються з незрілих або ембріональних тканин, є злоякісними і часто діагностуються вже в запущеній стадії і з поганим прогнозом. Половина пацієнток має підвищений рівень АФП. Ці пухлини в основному солідної структури з внутрішніми кістозними зонами і жиром, та мають досить великий розмір (12-25 см) (рис. 11).
Рис. 11. Незріла тератома у 28-річної жінки, яка була вагітна (гестаційний вік 22 тижні). Визначається ехогенне тверде утворення з невеликими кістозними ділянками (А). На кольоровій доплерограмі визначається внутрішня васкуляризація за артеріальним типом (B).
Незрілі тератоми можуть містити кальцифікати, які представляють собою хрящ або кістку (на відміну від дермоїдів, для яких кальцифікати зазвичай представлені зубами). Ці пухлини пов’язані зі зрілими тератомами, які визначаються в тому ж яєчнику в 26% випадків і в контралатеральному яєчнику в 10% випадків. При проведенні хіміотерапії, незрілі тератоми можуть піддаватися процесу дозрівання, тоді вони виглядають схожими на зрілу тератому, що називається ретроконверсією.
Монодермальні тератоми – це тератоми з переважанням одного типу тканин, серед яких: струма яєчників, карциноїд яєчників і пухлина з невральних клітин. Струма яєчників є тератомою, яка переважно містить тканину щитовидної залози. З них 95% є доброякісними і 5% викликають тиреотоксикоз. З 5% злоякісних пухлин, найчастіше визначається папілярний рак щитовидної залози. Ці новоутворення зазвичай великого розміру (> 6 см) і зустрічаються у літніх жінок. Карциноїд яєчників визначається як тверде новоутворення, яке може бути представлено острівцевими клітинами (інсулярними), а також трабекулярними або муцинозними. Ці пухлини діагностуються у жінок в пременопаузі і в постменопаузі та зазвичай є доброякісними, проте мають злоякісний потенціал (<2%). Карциноїдний синдром зустрічається рідко.
Інші пухлини зародкових клітин зазвичай представляють собою однобічні новоутворення, переважно солідної структури з внутрішніми кістозними або некротичними компонентами. Дисгермінома становить менше 2% випадків раку яєчників. Це найбільш поширена злоякісна пухлина яєчників у дітей, підлітків і молодих жінок (80% пацієнтів, які звертаються за допомогою, у віці до 30 років). Хоріокарцинома становить менше 1% пухлин яєчників і є агресивним процесом з підвищеним рівнем ХГЛ в сироватці. Процес може розвиватися як ектопічний (початковий) або гестаційний. Ендодермальна синусова пухлина (так звана пухлина жовткового мішка) є рідкісною злоякісною герміногенною пухлиною. Вона протікає агресивно, часто з підвищеним рівнем АФП і пов’язана з поганим прогнозом.
СТРОМАЛЬНІ ПУХЛИНИ
Стромальні пухлини походять з клітин строми ( «підтримуючі» клітини яєчника) і складають 8% новоутворень яєчників. Вони включають в себе гранульозноклітинні пухлини, фіброми і пухлини Сертолі-Лейдіга. Дві третини цих пухлин виробляють гормони, багато з яких мають явні ендокринні прояви. Ці прояви включають в себе: нерегулярні менструальні цикли, менорагію, аменорею і гіперплазію ендометрію. Гранульозноклітинні пухлини і текоми проявляються гіперестрогенією, тоді як пухлини Сертолі-Лейдіга проявляються гіперандрогенізмом.
Гранульозноклітинні пухлини є найбільш поширеними злоякісними стромальними пухлинами і складають від 1% до 2% всіх пухлин яєчників, і складають 70% серед всіх стромальних пухлин яєчників. Виділяють пухлини, характерні для дорослих (95%) і ювенільні пухлини. Ці ураження мають варіабельну структуру. Найчастіше це багатокамерні утворення з перетинками, які також можуть бути і солідними (рис. 12).
Рис. 12. Гранульозноклітинна пухлина у 59-річної жінки. Пухлина має солідну структуру з невеликими кістозними ділянками. Визначається внутрішня васкуляризація (зображення не показано).
Понад 95% утворень є однобічними. Аномалії ендометрію, такі як гіперплазія, спостерігаються в 80% випадків через продукцію естрогену і в 10% визначаються раком ендометрію. Ці пухлини мають хороший прогноз, але можуть рецидивувати навіть через 25 років.
Фіброми, текоми і фібротекоми – це солідні внутрішньооваріальні утворення, які розвиваються зі стромальних статевих клітин. Вони майже завжди доброякісні і складають від 4% до 5% від всіх утворень яєчників. Фіброми складаються з фібробластів і колагену, тоді як компоненти теком включають поверхневі клітини, жирову і фіброзну тканину. Фіброми найчастіше виявляються випадково у жінок середнього віку і, як правило, носять однобічний характер, хоча вони можуть бути двобічними при синдромі базально-клітинного невуса. Текоми продукують естроген, що може привести до гіперплазії і раку ендометрія. Однак це зустрічається рідше, ніж при гранульозноклітинних пухлинах. Сонографічно текоми виглядають як солідні утворення яєчників з дистальним акустичним послабленням (рис. 13 і 14).
Рис. 13. Фіброма в лівому яєчнику 46-річної жінки. Визначається виражене акустичне затінення.
Рис.14. Фібротекома у 55-річної жінки – частково кістозно-солідне утворення з внутрішніми товстими перетинками і твердими вузликами.
Вони можуть включати невеликий кістозний компонент. Дистальне акустичне послаблення спостерігається в 18% -52% фібром. При проведенні МРТ текоми мають однорідний низький сигнал на зважених T1- і T2 зображеннях з помірним посиленням. Синдром спостерігається в 1% фібром і проявляється тріадою: доброякісна пухлина яєчників (зазвичай фіброма), асцит і плевральний випіт. Цей синдром може імітувати рак яєчників, але всі симптоми зникають після резекції пухлини. Хибний синдром Мейгса – це асцит і плевральний випіт, пов’язаний зі зрілою тератомою, лейоміомою, цистаденомою або злоякісною пухлиною яєчника.
Пухлини Сертолі-Лейдіга складають менше 1% пухлин яєчників. Вони є найбільш поширеними вірилізуючими новоутвореннями. Половина є гормонально неактивними, 30% є вірилізуючими, а невелика кількість – супроводжується гіперестрогенією. Три чверті пацієнтів у віці менше 30 років. Ці пухлини часто визначаються як однобічні солідні дрібні утворення, проте також можуть містити кісти. Тільки 1,5% з них є двобічними. Пухлини Сертолі-Лейдіга зазвичай доброякісні, але можуть також метастазувати або рецидивувати після видалення (20%).
ПУХЛИНИ НИЗЬКОГО ЗЛОЯКІСНОГО ПОТЕНЦІАЛУ
Пухлини з низьким злоякісним потенціалом також називаються граничними або атиповими проліферативними пухлинами і є злоякісними. Ці пухлини займають від 15% до 20% епітеліальних новоутворень яєчників з поширеністю від 1,5 до 2,5 на 100 000 жінок на рік. Ці пухлини зазвичай визначаються у білих жінок репродуктивного віку, при цьому жінки трохи молодші, ніж у випадку зі злоякісними пухлинами яєчників. В цілому, третина всіх злоякісних новоутворень яєчників у жінок молодше 40 років є граничними пухлинами. В одному дослідженні медіана віку при постановці діагнозу становила 39 років, 69% пацієнток були молодше 45 років. Симптоми патології неспецифічні, а 16% і зовсім є безсимптомними на момент постановки діагнозу. Рівень СА 125 може незначно збільшуватися.
Хоча ці пухлини зазвичай мають серозну або муцинозну будову, також зустрічаються ендометріоїдні, світлоклітинні і пухлини Бреннера. В одному дослідженні було встановлено, що 60% пухлин були серозними, 37% – муцинозними і 3% іншої структури (з яких 4 з 10 були ендометріоїдними).
Гістологічно визначається клітинна проліферація і помірна ядерна атипія, але ключем до діагнозу є відсутність стромальної інвазії.
Найбільш поширеним є серозний підтип. Ці пухлини поширюються повільно за рахунок перитонеальної імплантації та регіональної лімфаденопатії. Гістологічно, в 90% випадків вони є типовими, а в 10% – мікропапілярними. Одна третина уражень – двобічні. Вони являють собою складні кістозні утворення з тонкими перетинками і твердими компонентами (рис. 15).
Рис. 15. Гранична серозна пухлина у 23-річної жінки. Як правий (A), так і лівий (B) яєчник мають пухлини, які мають кістозну структуру з внутрішнім твердим компонентом. Кольорова доплерографія (C) демонструє артеріальний тип кровотоку в твердому компоненті правого яєчника (в лівому яєчнику також виявлено кровотік, зображення не показано).
Муцинозний підтип під час гістологічного дослідження в 90% має кишкове походження і в 10% розвивається з Мюлерової протоки. Кишковий підтип зазвичай носить однобічний характер і в 17% випадків може супроводжуватися перитонеальною псевдоміксомою. Мюллерів підтип є двобічним у 40% і супроводжується ендометріомами від 20% до 30% випадків. Таке утворення являє собою однокамерну або багатокамерну кісту з перетинками і твердими компонентами, та може бути схожим на серозний підтип, але часто набагато більшого розміру (рис. 16). При Мюлеровому підтипі, як правило, визначається менше камер.
Рис. 16. Гранична муцинозна пухлина у 38-річної жінки. 2 роки тому була видалена гранична серозна пухлина зліва (зображень немає). Лівий яєчник містить кістозну пухлину з внутрішнім солідним вузликом (А). Кольорова доплерографія демонструє артеріальний тип кровотоку в твердому компоненті (B).
В цілому, даний тип пухлин має менш складну будову, ніж злоякісні пухлини яєчників і трохи більш складну, ніж цистаденоми. Granberg і його колеги показали, що папілярні розростання спостерігаються в 20% доброякісних, 62% граничних і 92% злоякісних епітеліальних пухлин яєчників, при цьому доброякісні розростання менші в розмірі і менш численні. Можлива наявність асциту.
КТ і МРТ ефективні в діагностиці перитонеальних імплантатів. Ці пухлини не визначаються при ПЕТ.
Ці пухлини є підгрупою епітеліальних раків з більш сприятливим прогнозом. Більше 75% діагностуються на 1-й стадії з 5-річною виживаністю більш 95%. При серозному підтипі пухлин, на момент звернення за медичною допомогою, 70% утворень знаходяться в 1-й стадії, обмеженою яєчником, зі 100% виживаністю. При муцинозному підтипі, 82% пухлин обмежуються яєчником на момент звернення, з виживанням від 99% до 100%. При цьому 18% пацієнток мають запущену стадію з 50%-ною смертністю.
Існує певна невизначеність щодо того, чи є ці пухлини попередниками карциноми яєчників. Було висловлено припущення, що ці пухлини є попередниками низькодиференційованого серозного або муцинозного раку яєчників, оскільки вони часто мають загальну мутацію KRAS або BRAF генів, тоді як високодиференційовані пухлини, зазвичай, виникають de novo в результаті мутації гена p53. В одному ретроспективному дослідженні, граничні і високодиференційовані карциноми з однаковою KRAS мутацією знаходилися в одному і тому ж новоутворенні яєчника в 2 з 210 випадків серозної карциноми, що вказує на спільне джерело розвитку цих уражень.
МЕТАСТАЗИ
Метастази яєчників складають 5% пухлин яєчників і 10% раків яєчників. Найбільш поширеними джерелами походження метастазів є: молочна залоза, лімфатичні вузли, таз і шлунково-кишковий тракт (шлунок, жовчні шляхи, підшлункова залоза, ободова кишка. Крукенбергівськими пухлинами є метастази в яєчники, що складаються з заповнених муцином перснеподібних клітин, зазвичай антрального раку шлунка, а також товстої кишки, апендикса, молочної залози і рідше жовчного міхура, жовчної протоки, шийки матки і сечового міхура.
Ці пухлини часто є двобічними. Вони можуть бути солідними, частково кістозними або майже повністю кістозними, також можуть нагадувати первинні раки яєчника (рис. 17). Метастази лімфоми великі, двобічні і в основному солідні без кістозних зон або кальцифікатів (рис. 18).
Рис.17. Метастази яєчників з первинного раку товстої кишки у 61-річної жінки.
Рис. 18. Метастаз лімфоми яєчника у 55-річної жінки.
КЛІНІЧНІ ФАКТОРИ
Фактори ризику розвитку раку яєчників пов’язані з надзвичайно великою кількістю овуляцій і включають безплідність, раннє менархе, пізню менопаузу, вік понад 50 років (постменопаузальний) і дисгенез статевих залоз. Ендометріоз збільшує ризик до 30%, можливо через запалення. Використання пероральних протизаплідних таблеток (ППТ) знижує ризик, в тому числі до вагітності та лактації. Ризик знижується від 30 до 40% при будь-якому попередньому використанні ППТ і потім на 10-12% з кожним роком використання. Ефект починається протягом декількох місяців використання і може тривати більше 10 років після припинення лікування. Перев’язка труб зменшує ризик на 40% -70%. Цей ефект, ймовірно, пов’язаний зі зменшенням обсягу судинного харчування яєчника або блокування можливих ретроградних менструацій, які викликають запалення.
Менше 10% випадків раку яєчників пов’язані з відомою генетичною мутацією, як правило, BRCA1 або BRCA2. Для жінок з цими мутаціями ризик захворіти протягом життя становить 39-46% для BRCA1, і 12% – 20% для BRCA2. Існує також підвищений ризик розвитку у пацієнток зі спадковим неполіпозним колоректальним раком.
Симптоми при цьому неспецифічні і можуть включати абдомінальний і тазовий біль, відчуття розпирання, прискорене сечовипускання, раннє насичення і запор.
CA 125 є сироватковим онкомаркером, який підвищується приблизно у 80% пацієнтів з раком яєчників, але тільки у 50% пацієнтів зі стадією 1. Він визначається в 69% муцинозних пухлин. Однак хибнопозитивні результати спостерігаються і при доброякісних процесах, особливо у жінок в пременопаузі, включаючи вагітність, ендометріоз, фіброми, захворювання печінки, доброякісні кісти яєчників і інші злоякісні пухлини (товстої кишки, матки, фаллопієвих труб, шлунка, підшлункової залози). Таким чином, цей маркер більш ефективний у жінок в постменопаузі, а також для моніторингу відповіді на терапію і повторного лікування рецидивів.
ТАКТИКА ЛІКУВАННЯ
Коли кіста яєчника при проведенні первинної ультрасонографії чітко не може бути визначена як проста або доброякісна, існує кілька варіантів подальшої тактики. Вони включають: короткострокове динамічне спостереження, МРТ візуалізацію або хірургічне втручання. Знання особливостей патогенезу і сонографічних ознак найбільш характерних для кістозних уражень яєчників допомагає визначити, чи можна від цього патологічного процесу очікувати спонтанного вилікування, або чи потрібні термінові додаткові дослідження.
Товариство радіологів та фахівців ультразвукової діагностики нещодавно опублікувало рекомендації щодо тактики лікування безсимптомних кіст придатків матки у жінок поза вагітністю (як в пременопаузальному періоді, так і після менопаузи), що також відображено в цій статті.
У спробі зменшити кількість контрольних досліджень, дослідники говорять про те, що проста кіста розміром менше 5 см у жінки в пременопаузі не потребує подальшого спостереження. Для простої кісти від 5 до 7 см, яка певно є доброякісною, рекомендується щорічне динамічне спостереження. Якщо була ідентифікована проста кіста розміром більше 7 см, рекомендується проведення МРТ або хірургічної діагностичної процедури. Останніми рекомендаціями визнається обмеження ультрасонографії в характеристиці великих уражень.
У жінок в постменопаузі, в зв’язку з великим поширенням невеликих простих кіст, ті з них, які становлять 1 см або менше, не потребують повторного спостереження. При кістах розміром від 1 до 7 см рекомендовано щорічне спостереження для підтвердження стабільності процесу, хоча вони також, у більшості випадків , доброякісні. У пацієнток в пременопаузі, кіста розміром більше 7 см вимагає подальшого дослідження за допомогою МРТ або хірургічної діагностичної процедури. Це дослідження також рекомендуються, коли кіста повністю не може бути описана при ультрасонографії.
Понад 70% кіст у жінок в пременопаузі зникають протягом 6-тижневого періоду. Крім того, період 6 тижнів гарантує те, що жінка буде в іншій фазі менструального циклу, переважно в фолікулярній фазі (дні 3-10).
Якщо для складної кісти переконливо підтвердженою є її геморагічна природа, проведення подальшого спостереження вона не потребує, при цьому розмір кісти не повинен перевищувати 5 см. У цьому випадку доречним буде короткострокове спостереження через 6-12 тижнів. Якщо складна кіста чітко визначається як ендометріома, рекомендується щорічний контрольний огляд. При класичному дермоїді, необхідне початкове регулярне спостереження протягом 6-12-тижнів, для підтвердження стабільності процесу.
Тому, коли ви не впевнені, діагностичне спостереження повинно бути першим кроком. Якщо кістозне ураження чітко не диференціюється, але має ознаки доброякісного ураження, тоді проводиться динамічне спостереження від 6 до 12 місяців, для оцінки самостійного лікування. Якщо кіста зберігається або має підозрілий зовнішній вигляд, слід вдатися до проведення МРТ або хірургічної діагностичної процедури.
РЕЗЮМЕ
Трансвагінальна ультрасонографія є основним методом візуалізації, який використовується для характеристики кістозних уражень яєчників, і часто є самодостатнім методом діагностики. Цей метод набуває великого значення в умовах значного збільшення частоти виявлення таких уражень. Більшість цих уражень є доброякісними. Однак важливо ідентифікувати патологію, яка може бути злоякісною, і пам’ятати, що деякі утворення є злоякісними пухлинами з низьким злоякісним потенціалом. Знання патогенезу кістозних уражень яєчників, характерних візуальних особливостей і опублікованих рекомендацій дозволяють проводити лікування для більшості з них. При оцінці пацієнток необхідно враховувати всі клінічні фактори. Весь комплекс даних може допомогти лікарю, який інтерпретує сонограму, демістифікувати діагностику і лікування невідомого кістозного ураження яєчника, що, в свою чергу, дозволяє проводити більш чітку диференціальну діагностику і застосовувати специфічне лікування.