Д.м.н. Мехмет Рухи Онур (Mehmet Ruhi Onur), д. м. н. Ахмет Курсад Пойраз (Ahmet Kursad Poyraz), д. м. н. ЗулкифБозгеик (Zulkif Bozgeyik), д. м. н. Ахмет Курсад Пойраз (Ahmet Kursad Poyraz), д. м. н. Ирфан Орхан (Irfan Orhan)
Цель – Целью данного исследования было определение роли компрессионной эластографии полуколичественным методом для дифференциации доброкачественных и злокачественных твердых почечных опухолей.
Методы – Семьдесят один пациент с твердыми почечными опухолями был проспективно обследован с помощью ультразвуковой эластографии после ультразвуковой в режиме серой шкалы. Компрессионная эластография использовалась для сравнения плотности почечных опухолей и паренхимы почек. Отношение эластичности почечной опухоли и ближней паренхимы почек определено как показатель индекса эластичности. Сравнивались средние показатели индекса эластичности доброкачественных опухолей (n = 29; 24 случая ангиомиолипомы и 5 онкоцитомы) и злокачественных опухолей (n = 42; 34 случая почечно-клеточной карциномы, 4 случая переходно-клеточной карциномы, 3 случая метастазов и 1 случай лимфомы).
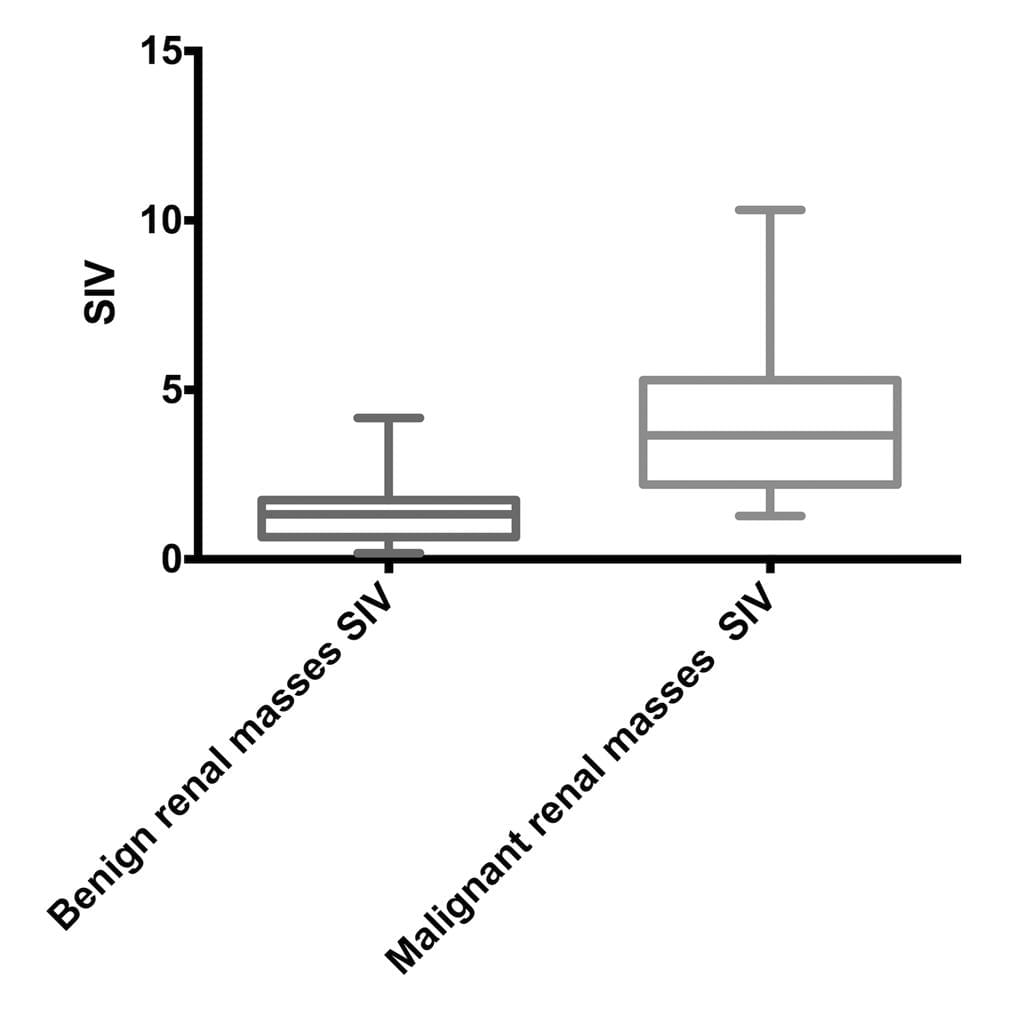
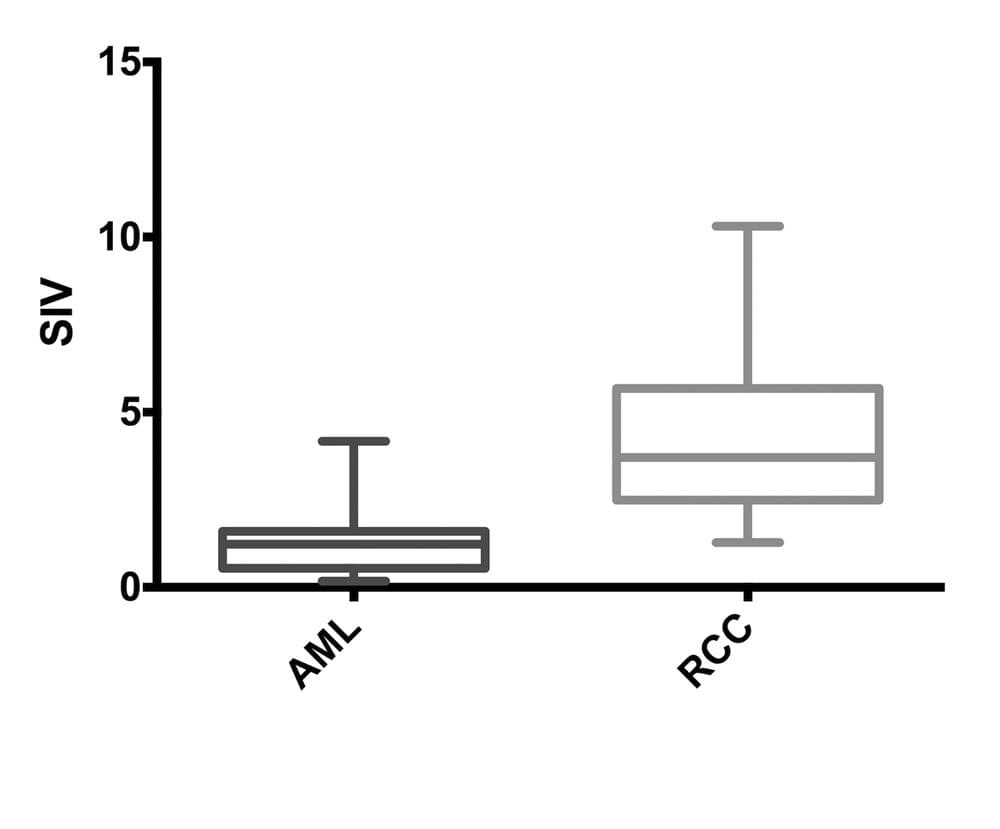
Результаты – не наблюдалось значительных различий в показателях среднего возраста пациентов, среднего диаметра опухолей и средних отклонений образцов опухолей между группами пациентов с доброкачественными и злокачественными опухолями. Средний показатель индекса эластичности ± SD для злокачественных опухолей (4,05 ± 2,17) был значительно выше показателя доброкачественных опухолей (1,43 ± 0,94; P <05). Средний показатель индекса эластичности для почечно-клеточной карциномы (4,30 ± 2,27) был значительно выше показателя индекса эластичности ангиомиолипомы (1,28 ± 1,01; P <0,0001).
Выводы – Компрессионная эластография может стать полезным методом визуализации для дифференциации доброкачественных и злокачественных твердых почечных опухолей.
Твердые почечные опухоли довольно часто обнаруживают при ультразвуковом исследовании брюшной полости. Обнаружение почечной опухоли требует определения характеристик опухоли как доброкачественной или злокачественной с целью принятия решения о медицинской тактике и лечении. Наблюдение за доброкачественными опухолями может происходить с помощью методов визуализации или возможной процедуры биопсии, в то время как злокачественные опухоли необходимо удалять хирургическим путем. Для дифференциации доброкачественных и злокачественных почечных опухолей использовались ультразвуковое исследование в режиме серой шкалы и доплеровское ультразвуковое исследование, компьютерная томография (КТ), магнитно-резонансная томография (МРТ). 1–4 Однако, дифференциация этих опухолей может осложняться сходством между их визуальными признаками.5 Хотя некоторые из визуальных признаков доброкачественных и злокачественных почечных опухолей определены в литературе, Кутиков и др.6 отмечали, что 6,9% пациентов, перенесших операцию по поводу подозрения наличия почечно-клеточной карциномы, имели патологически подтвержденную ангиомиолипому.6
В последнее время, для определения разницы между доброкачественными и злокачественными опухолями используют количественные визуальные характеристики почечных опухолей, такие как показатели контрастности и соотношение на КТ и МРТ, а также показатели внешнего коэффициента диффузионно-взвешенной МРТ.7 Однако, совпадение между параметрами количественных визуальных показателей доброкачественных и злокачественных опухолей на КТ и МРТ ограничивает диагностические возможности этих визуальных средств для дифференциации опухолей.7,8
Ультразвуковая эластография стала новой визуальной методикой для измерения плотности и эластичности биологических тканей. В качестве полуколичественного эластографического метода, компрессионная эластография позволяет сравнить плотность опухоли органа с ближней паренхимой здорового органа. Результативный показатель индекса эластичности является соотношением плотности опухоли со здоровой паренхимой. Компрессионная эластография использовалась для дифференциации различных доброкачественных и злокачественных опухолей щитовидной железы, молочных желез, простаты, яичка и печени.9-13 В данном исследовании мы пытались определить возможность применения компрессионной эластографии для дифференциации доброкачественных и злокачественных почечных опухолей.
Пациенты и методы
Данное проспективное исследование было утверждено Экспертным Советом организации нашего института, а также от каждого из исследуемых пациентов было получено письменное информированное согласие. С июля 2012 до февраля 2014 состояние 85 пациентов, обратившихся в нашу больницу по поводу твердых почечных опухолей, было исследовано с помощью методов ультразвуковой диагностики. Шесть пациентов были исключены из исследования из-за кистозных образований в почечной опухоли и еще 8 пациентов были исключены из исследования, поскольку не могли задерживать дыхание и, таким образом, невозможно было выполнить процедуру компрессионной эластографии. Таким образом, к исследованию был привлечен 71 пациент (38 мужчин и 33 женщины, средний возраст – 58 лет, от 23 до 84 лет) с твердыми почечными опухолями. У этих пациентов не наблюдались гидронефроз или киста почек совместно с почечной опухолью. У трех пациентов были 2 ангиомиолипомы, поэтому исследование включало большие опухоли.
После оценки при помощи ультразвукового исследования, плотность почечных опухолей была измерена с помощью компрессионной эластографии полуколичественным методом. Эластографические исследования “free-hand” в режиме реального времени осуществлялись с помощью конвексного датчика 3,5 МГц на ультразвуковом аппарате Aplio XG (Toshiba Medical Systems, Co, Ltd, Ottawara, Japan) врачом-радиологом, специализирующимся на ультразвуковом исследовании брюшной полости в течение 10 лет и имеющего трехлетний опыт проведения компрессионной эластографии. Пациентов располагали в боковом положении, на сторону противоположную расположению почечной опухоли, для всех процедур компрессионной эластографии использовалось подреберное сканирование. После того, как пациент глубоко вдыхал и задерживал дыхание, после визуального определения почечной опухоли и ближней почечной паренхимы в поле зрения, врач, выполняющий исследования, осуществлял вертикальное давление на область поясницы с помощью ультразвукового датчика. Движение опухоли и паренхимы в ответ на сжатие и ослабление давления наблюдалось в режиме реального времени. Во время компрессионной эластографии контрольный объем располагали так, чтобы закрывать опухоль и ближнюю почечную паренхиму. Во время продвижения ультразвукового датчика, вместе со снимками эластографии на экране отображалась серая шкала сонограммы. После 7-8 циклов сжатия и ослабления давления, сбор снимков эластографии был завершен, снимки автоматически были обработаны ультразвуковым аппаратом путем анализа смежных кадров при сжатии и ослаблении давления на ткани. Колебания сжатия и ослабления давления отображались на экране эластографа в виде синусоид над и под осью шкалы колебаний, соответственно.
Эластография кодировала ткани в соответствии с их эластичностью, что проявлялось в степени смещения ткани в ответ на осуществляемое давление. Ткани с высокой эластичностью смещались больше, чем ткани с низкой эластичностью в ответ на сжатие и ослабление давления. Ткани с высокой эластичностью (например, мягкие ткани), средней эластичностью и низкой эластичностью (твердые ткани) были обозначены красным, зеленым и синим цветом соответственно. Для уменьшения вариативности между различными исследованиями, количественные параметры эластичности, которые использовались для вычисления соотношения эластичности в нашем исследовании, были получены с декомпрессионных волн и имели синусоидальную форму и гладкие контуры. Показатели эластичности измерялись путем установления контрольных объемов (ROI) одинакового или почти одинакового размера на опухоли и почечной паренхиме. Участки исследования опухолей и почечной паренхимы устанавливались на одном уровне, насколько это было возможно. Показатели индекса эластичности для опухолей измерялись путем установления участков исследований на не некротические участки опухолей. У врача-радиолога, проводившего исследования, не было информации о гистопатологических результатах опухолей при выполнении процедуры компрессионной эластографии и измерения эластичности. После измерения эластичности, сравнили показатели индекса эластичности доброкачественных и злокачественных опухолей, а также почечно-клеточной карциномы и ангиомиолипомы. Сравнивали также средний возраст пациентов, средний размер опухолей и средние расстояния между датчиком и опухолью доброкачественных и злокачественных опухолей для определения влияния размера опухолей и расстояния между датчиком и опухолью на показатели индекса эластичности.
Диагнозы всех случаев почечно-клеточной карциномы и переходно-клеточной карциномы были установлены в результате хирургических операций. Гистопатологические подтипы почечно-клеточной карциномы: светлоклеточная карцинома (28 случаев), хромофобная карцинома (4 случая), папиллярная карцинома (2 случая).
С помощью биопсии были диагностированы метастазы (3 случая) и лимфома (1 случай). Случаи ангиомиолипомы были диагностированы путем процедуры биопсии (3 случая), операции (1 случай), согласно результатам КТ (11 случаев) и МРТ (9 случаев), которые обнаружили макроскопическую плотность жировой клетчатки и интенсивность сигнала, соответственно. В двух случаях из 5, онкоцитома была удалена хирургическим путем; в 1 случае проведена биопсия; у 2 пациентов диагноз установили согласно результатам ультразвукового исследования, контрастного КТ и МРТ.
Для проведения статистического анализа, показатели эластичности почечных опухолей и паренхимы были выражены в виде среднего ± стандартного отклонения и проанализированы с помощью программного обеспечения GraphPad Prism версия 6 (GraphPad Software, Inc, San Diego, CA). Использовался тест Д’Агостино-Пирсона на нормальность распределения для определения достоверности происхождения показателей по распределению Гаусса. Средний возраст пациентов, средний размер опухолей и средние расстояния между датчиком и опухолью доброкачественных и злокачественных опухолей сравнивались с помощью t-критериев Стьюдента. Сравнение средних показателей индекса эластичности доброкачественных и злокачественных опухолей проводились с помощью t-критериев Стьюдента. Для определения влияния размера опухоли и расстояния между датчиком и опухолью на показатели эластичности опухоли мы сравнили средние показатели индекса эластичности доброкачественных и злокачественных опухолей размером менее и более 4 см с помощью t-критериев Стьюдента. Сравнение между средними показателями индекса эластичности доброкачественных и злокачественных опухолей с расстоянием между датчиком и опухолью меньше и более 4 см выполнялось с помощью t-критериев Стьюдента. Различия считались статистически достоверными при P <чем, 05. Был выполнен ROC-анализ для определения предельных показателей индекса эластичности для дифференциации доброкачественных и злокачественных опухолей, а также почечно-клеточной карциномы и ангиомиолипомы.
Результаты
Не наблюдалось значительной разницы между средним возрастом пациентов в группах с доброкачественными (58 лет; в диапазоне 26-81 лет) и злокачественными опухолями (63 года; в диапазоне 23-84 года), (P =, 58). Средний размер доброкачественных опухолей (29,18 ± 19,37 мм; в диапазоне 14-63 мм) был значительно меньше этого показателя у злокачественных опухолей (50,75 ± 20,57мм; в диапазоне 20-75 мм; P =, 0008 ). Средний размер опухолей ангиомиолипомы (25,5 ± 15,3 мм; в диапазоне 14-52 мм) был значительно меньше этого показателя почечно-клеточной карциномы (51,6 ± 21,9 мм; в диапазоне 20-75 мм; P <, 001). Среднее расстояние между датчиком и опухолью доброкачественных опухолей (34,77 ± 3.16 мм; в диапазоне 14-60 мм) не отличалась от данного показателя для злокачественных опухолей (30,55 ± 1.74 мм; в диапазоне 16-60 мм) (P =, 24). Средние показатели индекса эластичности для всех доброкачественных и злокачественных подгрупп приведены в Таблице 1.
Средний показатель индекса эластичности доброкачественных опухолей был значительно ниже показателя злокачественных опухолей (P <0001; Таблица 2 и Диаграммы 1-3). Средний показатель индекса эластичности ангиомиолипомы был значительно ниже показателя почечно-клеточной карциномы (P <0001; Таблица 1 и Диаграммы 4-6). Средний показатель индекса эластичности доброкачественных опухолей меньше 4 см был значительно ниже показателя злокачественных опухолей меньше 4 см (P <0001; Таблица 2). Также, средний показатель индекса эластичности доброкачественных опухолей больше 4 см был значительно ниже показателя злокачественных опухолей больше 4 см (P <0011; Таблица 2). Расстояние между датчиком и опухолью не изменяло различия между показателями индекса эластичности доброкачественных и злокачественных опухолей. Средние показатели индекса эластичности доброкачественных опухолей с расстоянием между датчиком и опухолью меньше или больше 4 см были значительно ниже показателей злокачественных опухолей с расстоянием между датчиком и опухолью меньше или больше 4 см (Р <0,01 для каждой группы; Таблица 2).
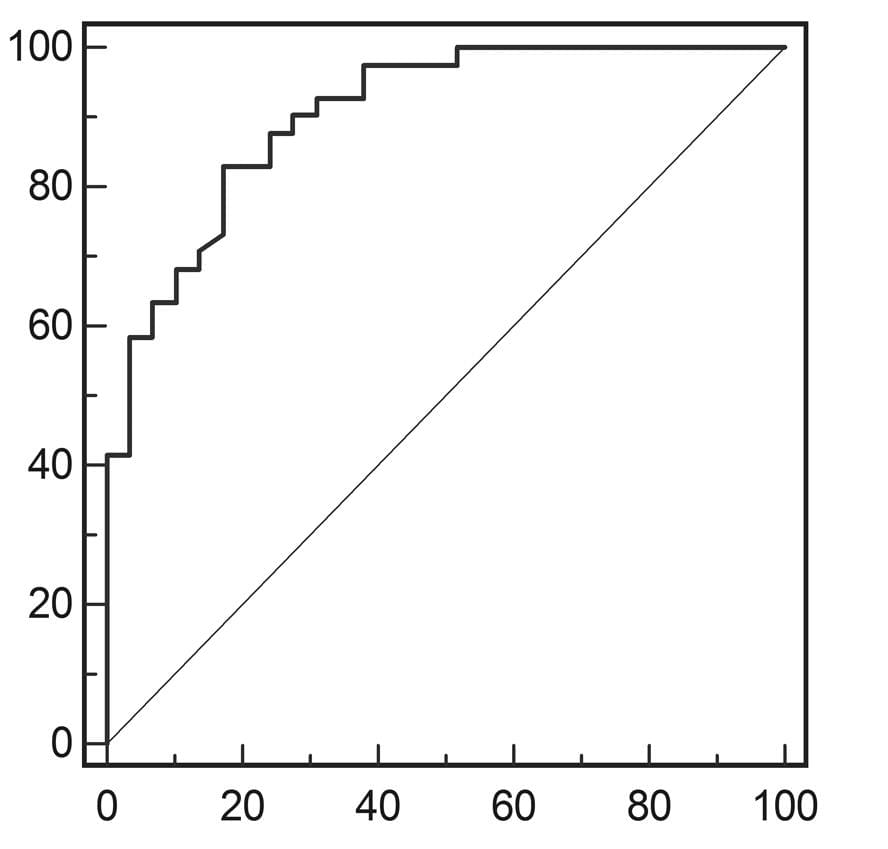
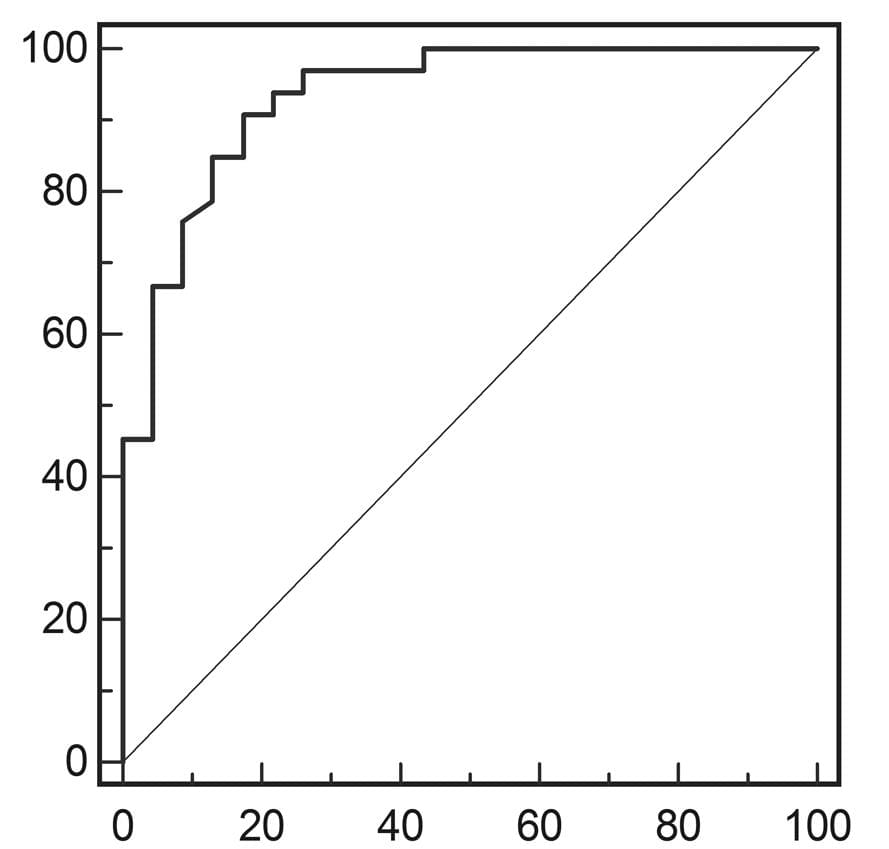
Результаты ROC-анализа показателей индекса эластичности для дифференциации доброкачественных и злокачественных опухолей, а также ангиомиолипомы и почечно-клеточной карциномы суммарно отражены в таблице 3 и Диаграмме 7.
Таблица 1. Показатели Индекса эластичности для доброкачественных и злокачественных почечных опухолей
|
Опухоль |
Пациенты, чел. |
ПИЭ |
||||
|
Ангиомиолипома |
24 |
1,28 ± 1,01 (0,18-4,17) |
||||
|
Онкоцитома |
5 |
1,79 ± 0,26 (1,33-2,10) |
||||
|
Почечно-клеточная карцинома |
34 |
4,30 ± 2,27 (1,28-10,31) |
||||
|
Переходно-клеточная карцинома |
4 |
2,43 ± 1,03 (1,42-3,88) |
||||
|
Метастазы |
3 |
2,54 ± 1,53 (1,46-4,53) |
||||
|
Лимфома |
1 |
4,73 |
||||
|
Данные представлены в среднем значении ± SD (диапазон) при необходимости ПИЭ означает показатель индекса эластичности |
||||||
Таблица 2. Сравнение показателей индекса эластичности доброкачественных и злокачественных почечных опухолей
|
Доброкачественные |
Злокачественные |
||||||||
|
Группа |
количество |
ПИЭ |
количество |
ПИЭ |
П |
||||
|
Все опухоли |
29 |
1,43 ± 0,94 (0,18-4,10) |
42 |
4,05 ± 2,17 (1,28-10,30) |
<0001 |
||||
|
Диаметр <4 см |
22 |
1,28 ± 0,82 (0,18-3,01) |
18 |
3,66 ± 2,32 (1,28-9,60) |
<0001 |
||||
|
Диаметр <4 см |
7 |
1,87 ± 1,28 (0,60-4,17) |
24 |
4,44 ± 2,01 (1,81-10,31) |
,0011 |
||||
|
Расстояние между датчиком и опухолью <4 см |
16 |
1,43 ± 0,94 (0,18-4,17) |
19 |
4,94 ± 2,77 (2,16-10,31) |
<0001 |
||||
|
Расстояние между датчиком и опухолью <4 см |
13 |
1,27 ± 1,08 (0,19-3,99) |
23 |
3,90 ± 1,97 (1,28-9,60) |
<0001 |
||||
|
Данные представлены в среднем значении ± SD (диапазон) при необходимости ПИЭ означает показатель индекса эластичности |
|||||||||
Таблица 3. Результаты ROC-анализа для дифференциации доброкачественных и злокачественных опухолей, а также ангиомиолипомы и почечно-клеточной карциномы.
|
Сравнение |
Предельный ПИЭ |
Точность, % |
Специфичность, % |
ППЗ, % |
ОПЗ, % |
95% ДИ |
ПФК |
|||
|
Доброкачественные в сравнении со злокачественными |
1,93 |
82,9 |
82,7 |
87,2 |
77,4 |
0,81-0,96 |
0,90 |
|||
|
АМЛ против ПКК |
1,68 |
90,9 |
82,6 |
88,2 |
86,4 |
0,83-0,98 |
0,93 |
|||
АМЛ означает ангиомиолипома; ПФК, площадь под фармакокинетической кривой; ДИ, доверительный интервал; ППС, положительное прогностическое значение; ОПЗ, отрицательное прогностическое значение; ПКК, почечно-клеточная карцинома; ПИЭ, показатель индекса эластичности.
Диаграмма 1. Показатель индекса эластичности (ПИЭ) для доброкачественных и злокачественных опухолей.
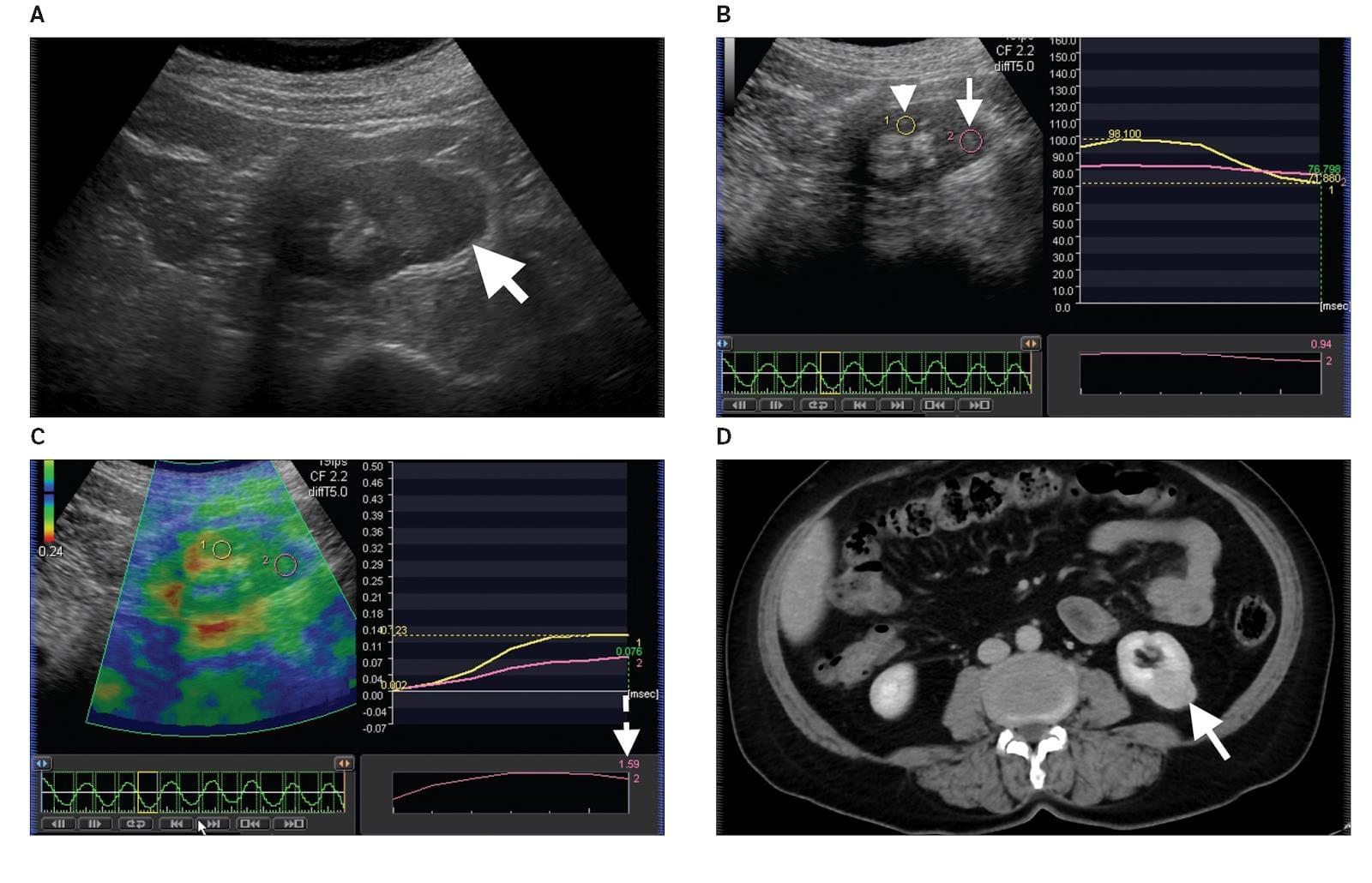
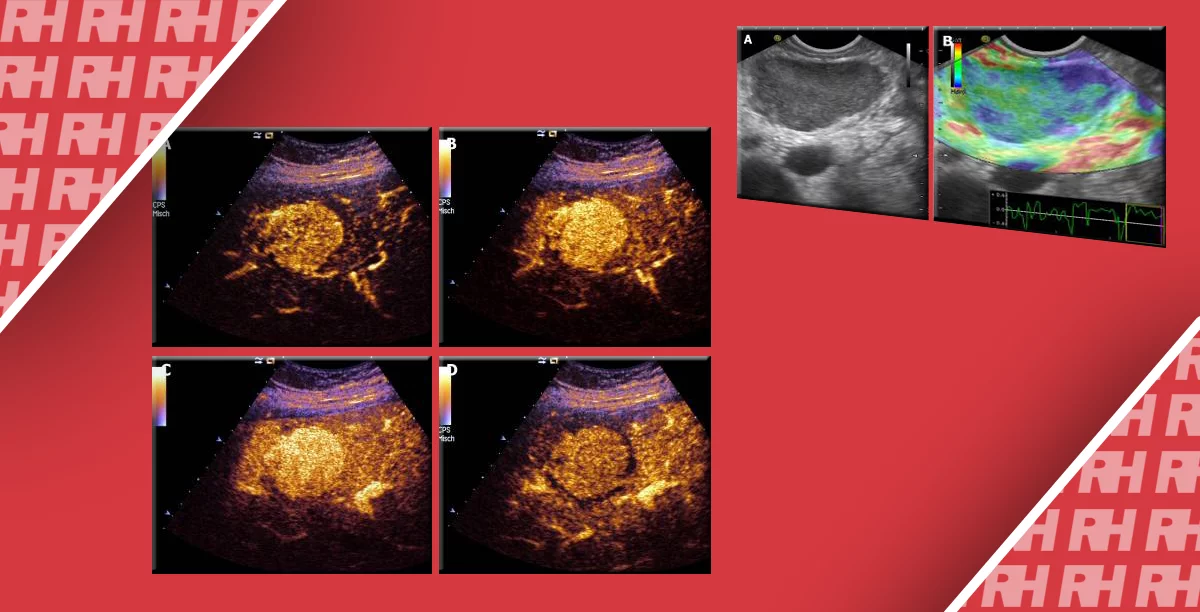
Диаграмма 2. Онкоцитома А, Серая шкала сонограммы показывает гипоэхогенную опухоль почки. В, Серая шкала изображения компрессионной эластографии показывает расположение ROI 1 в почечной паренхиме (стрелка-указатель) и ROI 2 (стрелка) в опухоли. С, Обозначенное цветом изображение компрессионной эластографии показывает показатель индекса эластичности 1,59 (стрелка пунктиром), что означает повышенную плотность опухоли по сравнению с почечной паренхимой. D, Контрастная КТ показывает твердую почечную опухоль (стрелка), которая была удалена и диагностирована как Онкоцитома согласно гистопатологическому исследованию.
Обсуждение
Ультразвуковая эластография является неконтрастным, простым для выполнения методом визуализации для оценки эластичности тканей. Данная техника может выполняться качественным, полуколичественным и количественным методами. Качественная эластография отражает различные цвета в соответствии с плотностью ткани. Полуколичественная эластография отражает обозначенные цветами признаки тканей и показатели индекса эластичности, соответствующие соотношению деформации тканей в ответ на примененное давление. Количественные методы эластографии, такие как ARFI измеряют скорость сдвиговых волн, созданных акустической радиационной силой в тканях, и представляет количественные данные, отражающие плотность тканей. В нашем исследовании мы использовали компрессионную эластографию и сравнивали показатели индекса эластичности для дифференциации доброкачественных и злокачественных опухолей.
Компрессионная эластография использовалась для оценки очаговых образований в различных органах, таких как молочные железы, щитовидная железа, печень и простата, показатели индекса эластичности злокачественных опухолей оказались выше показателей доброкачественных опухолей.9-13 Насколько нам известно, компрессионная эластография использовалась для оценки почечных опухолей только в двух недавних исследованиях.14,15 В первом исследовании, авторы оценивали роль скорости сдвиговых волн в изучении почечно-клеточной карциномы, в результате была обнаружена неэффективность использования скорости сдвиговых волн для дифференциации различных подтипов почечно-клеточной карциномы.14 Во втором исследовании Тан и др.15 сравнивали соотношение деформации ангиомиолипомы и почечно-клеточной карциномы и обнаружили, что показатели индекса эластичности почечно-клеточной карциномы были значительно выше этих же показателей ангиомиолипомы. Согласно показателям индекса эластичности, они обнаружили, что опухоли почечно-клеточной карциномы были в 4 раза плотнее, чем опухоли ангиомиолипомы.15 В наше исследование были включены и другие подтипы доброкачественных и злокачественных почечных опухолей, таких как Онкоцитома, переходно-клеточная карцинома, метастазы и лимфома. Мы обнаружили, что показатели индекса эластичности злокачественных опухолей значительно выше показателей доброкачественных, что свидетельствует о большей плотность злокачественных почечных опухолей. Сравнение показателей индекса эластичности доброкачественных и злокачественных опухолей в нашем исследовании обнаружило, что злокачественные опухоли были в 2,8 раза плотнее, чем доброкачественные со средними показателями индекса эластичности 4,05 и 1,43 соответственно. Точность (82,9%), специфичность (82,7%), положительное прогностическое значение (87,2%) и отрицательное прогностическое значение (77,4%) компрессионной эластографии в нашем исследовании были ниже результатов контрастного ультразвукового исследования, которые показали высокую диагностическую точность, с показателями высокой точности (100%), специфичности (95,0%), положительного прогностического значения (94,7%) и отрицательного прогностического значения (100%) для дифференциации доброкачественных и злокачественных опухолей.16
Почечно-клеточная карцинома и ангиомиолипома являются наиболее распространенными доброкачественными и злокачественными образованиями почек, соответственно.17 Хотя гиперэхогенные включения на серой шкале ультразвукового исследования предполагает наличие ангиомиолипомы, 30% почечно-клеточных карцином имеют гиперэхогенные свойства на ультразвуковом исследовании.18 Однако, дифференциация между ангиомиолипомой и почечно-клеточной карциномой невозможна только по показателям серой шкалы ультразвукового исследования. В нашем исследовании мы обнаружили, что опухоли почечно-клеточной карциномы в 3,36 раза плотнее чем опухоли ангиомиолипомы с показателями индекса эластичности 4,30 и 1,28, соответственно. Выявление гиперэхогенной почечной опухоли на ультразвуковом исследовании требует проведения контрастного КТ или МРТ для определения характеристик опухоли. Однако, как неконтрастный, простой в исполнении и недорогой метод визуализации, компрессионная эластография может использоваться для дифференциации ангиомиолипомы от почечно-клеточной карциномы. Точность (90,9%) компрессионной эластографии для дифференциации ангиомиолипомы от почечно-клеточной карциномы в нашем исследовании была подобной результатам точности (88,2%) контрастного ультразвукового исследования, указанным выше. 17 Мы обнаружили, что специфичность компрессионной эластографии (82,6%) ниже по сравнению со специфичностью контрастного ультразвукового исследования (97,0%). 17 Разница между плотностью опухолей ангиомиолипомы и почечно-клеточной карциномы на компрессионной эластографии может быть использована как дополнительная информация для дифференциации этих опухолей. Компрессионная эластография может быть использована для оценки почечных опухолей у пациентов с аллергией на йод и с нарушениями функции почек, которые могут стать противопоказаниями к контрастному КТ или МРТ.
Размер поражения и расстояние между датчиком и опухолью могут влиять на измерение эластичности почечных опухолей. Результаты нашего исследования свидетельствуют об отсутствии влияния размера опухоли и расстояния между датчиком и опухолью на показатели индекса эластичности. Мы распределили почечные опухоли в соответствии со средним размером на меньшие и большие 4 см, таким образом почечные опухоли меньше и больше 4 см определялись как малые и большие, соответственно.19 В группах доброкачественных и злокачественных опухолей в нашем исследовании не отмечалось значительных различий между количеством опухолей меньше или больше 4 см и опухолями, расстояние от которых до датчика составляла менее или более 4 см. Средние показатели индекса эластичности доброкачественных опухолей меньше или больше 4 см были значительно ниже показателей злокачественных опухолей меньше или больше 4 см Также, средние показатели индекса эластичности доброкачественных и злокачественных опухолей с расстоянием между датчиком и опухолью меньше или больше 4 см имели значительные различия в показателях индекса эластичности. Согласно приведенным результатам, мы предполагаем, что размер опухоли и расстояние между датчиком и опухолью не влияют значительным образом на разницу между показателями индекса эластичности доброкачественных и злокачественных почечных опухолей.
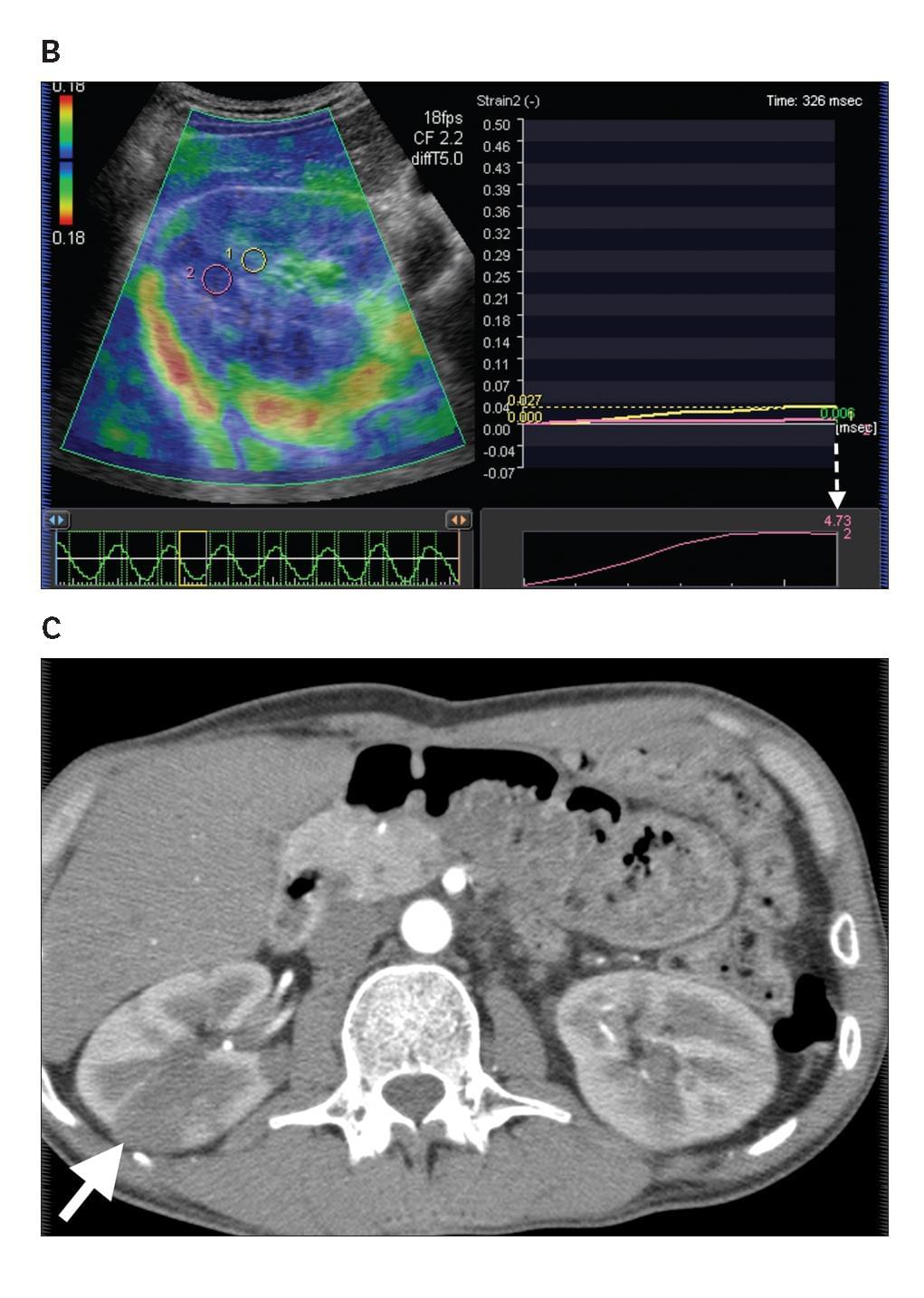
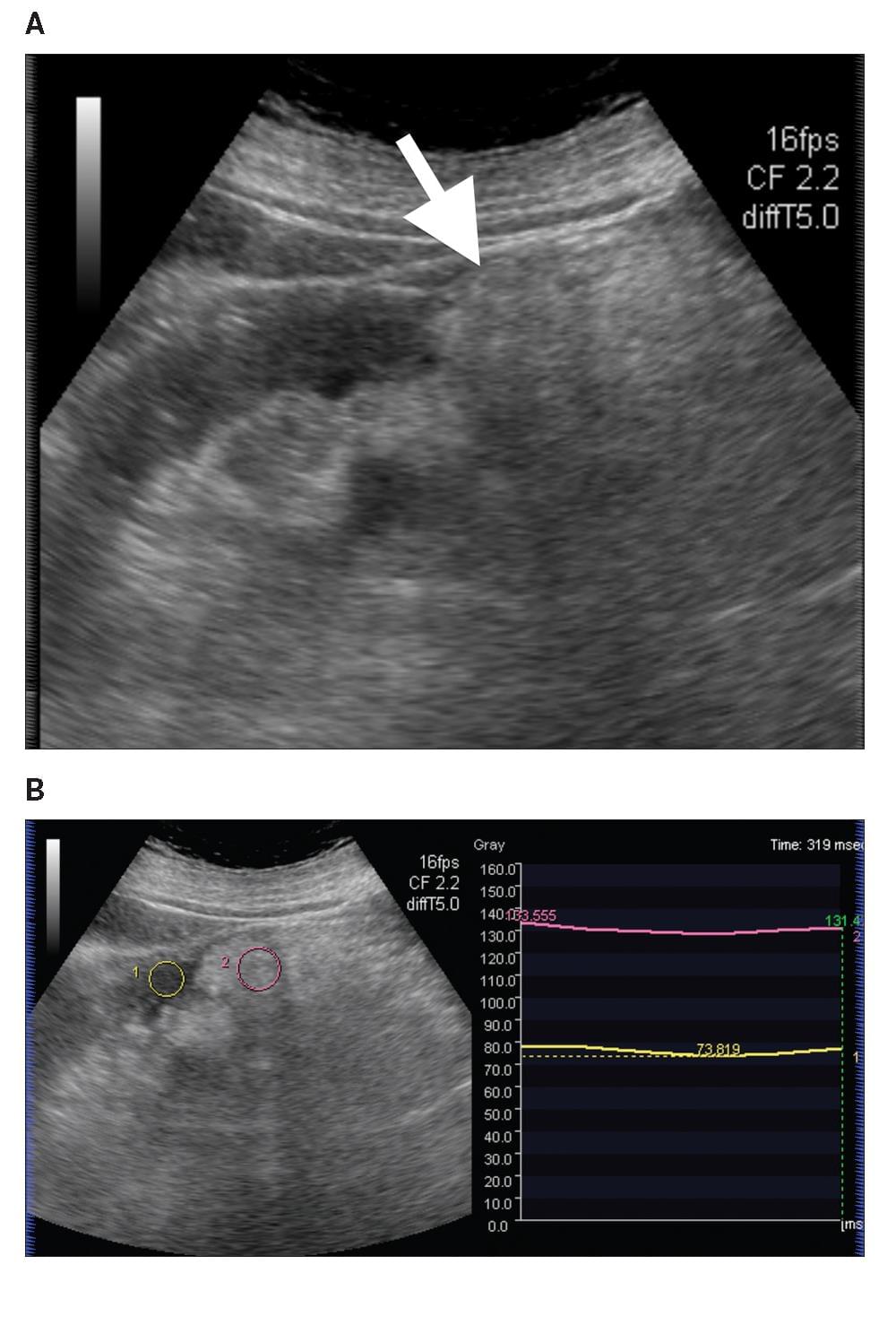
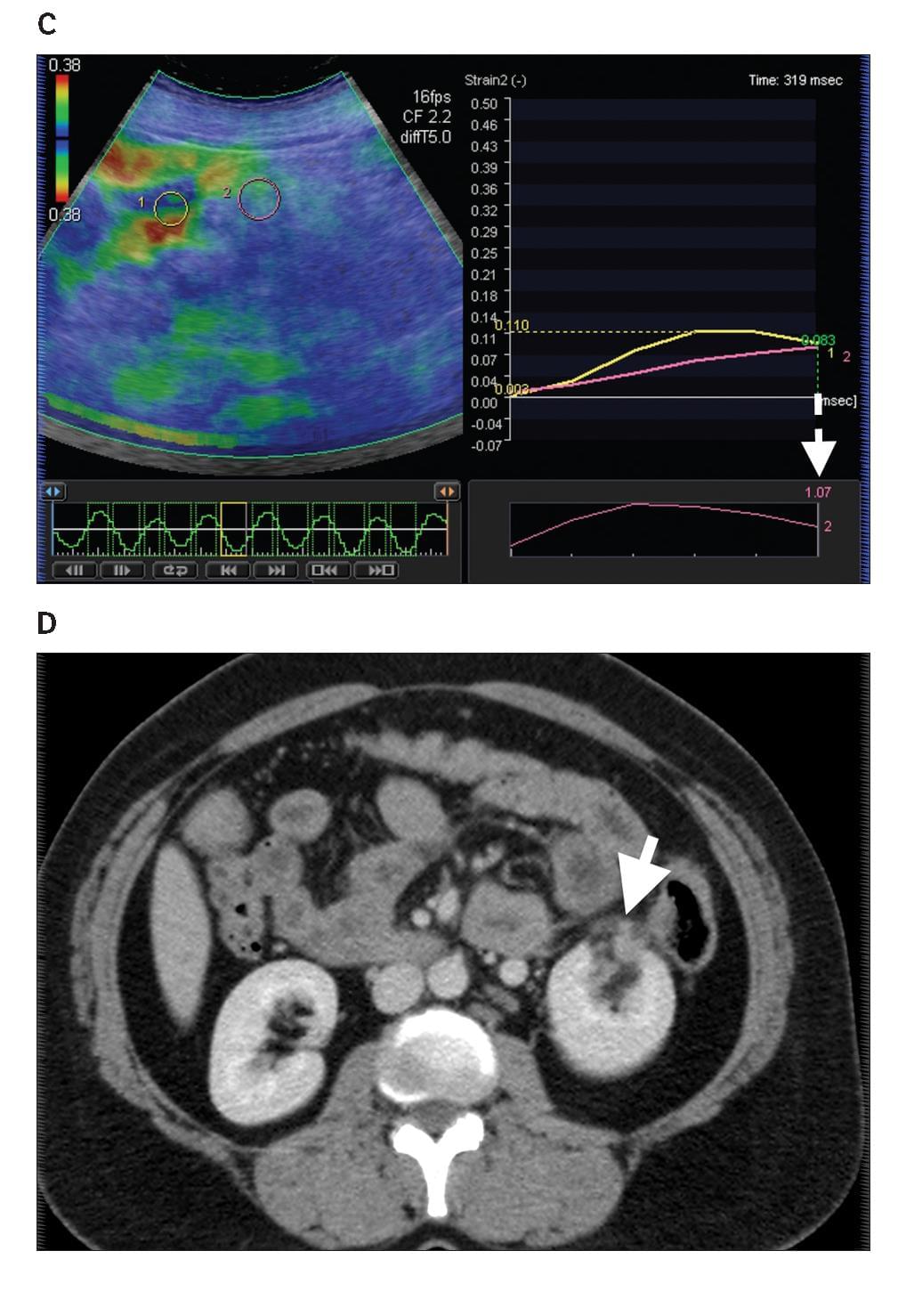
Диаграмма 3. Почечная лимфома. А, Серая шкала сонограммы показывает слабо определенные гипоэхогенные участки (стрелка-указатель) в почечной паренхиме. В, Соотношение эластичности опухоли к почечной паренхиме было определено на уровне 4,73 (стрелка пунктир). С, Контрастная аксиальная КТ показывает инфильтрированную опухоль с пониженной плотностью (стрелка) в паренхиме правой почки, представляя собой поражение лимфомой.
Диаграмма 4. Показатели индекса эластичности (ПИЭ) ангиомиолипомы (АМЛ) и почечно-клеточной карциномы (ПКК).
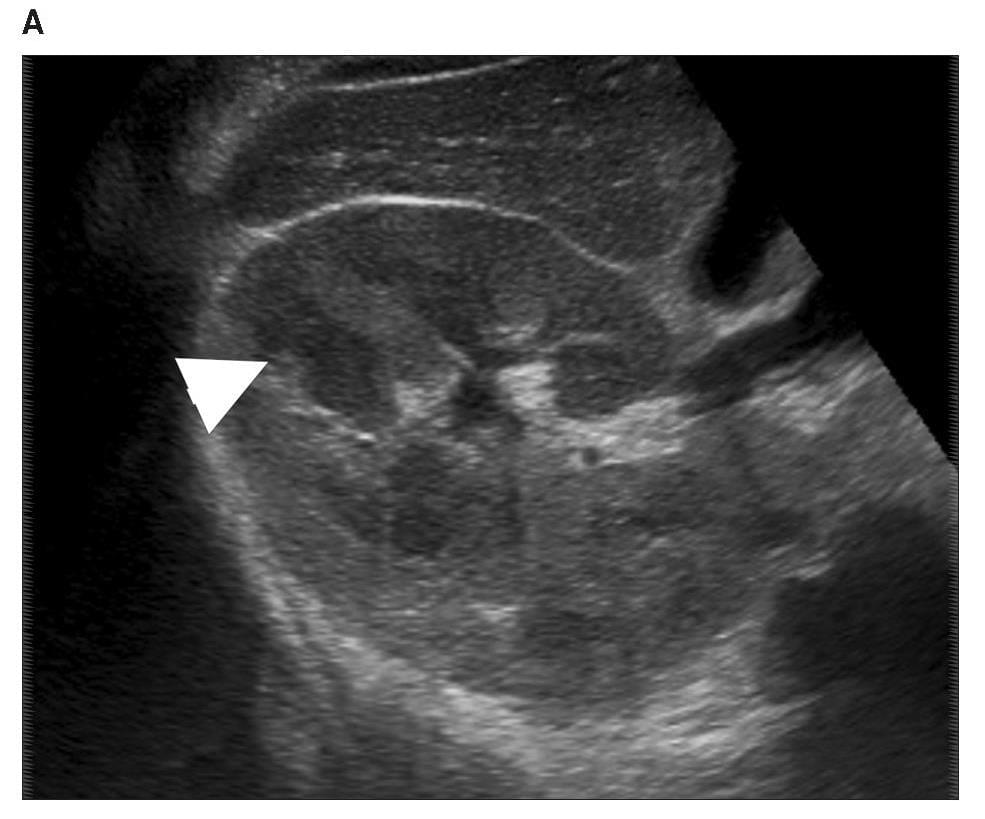
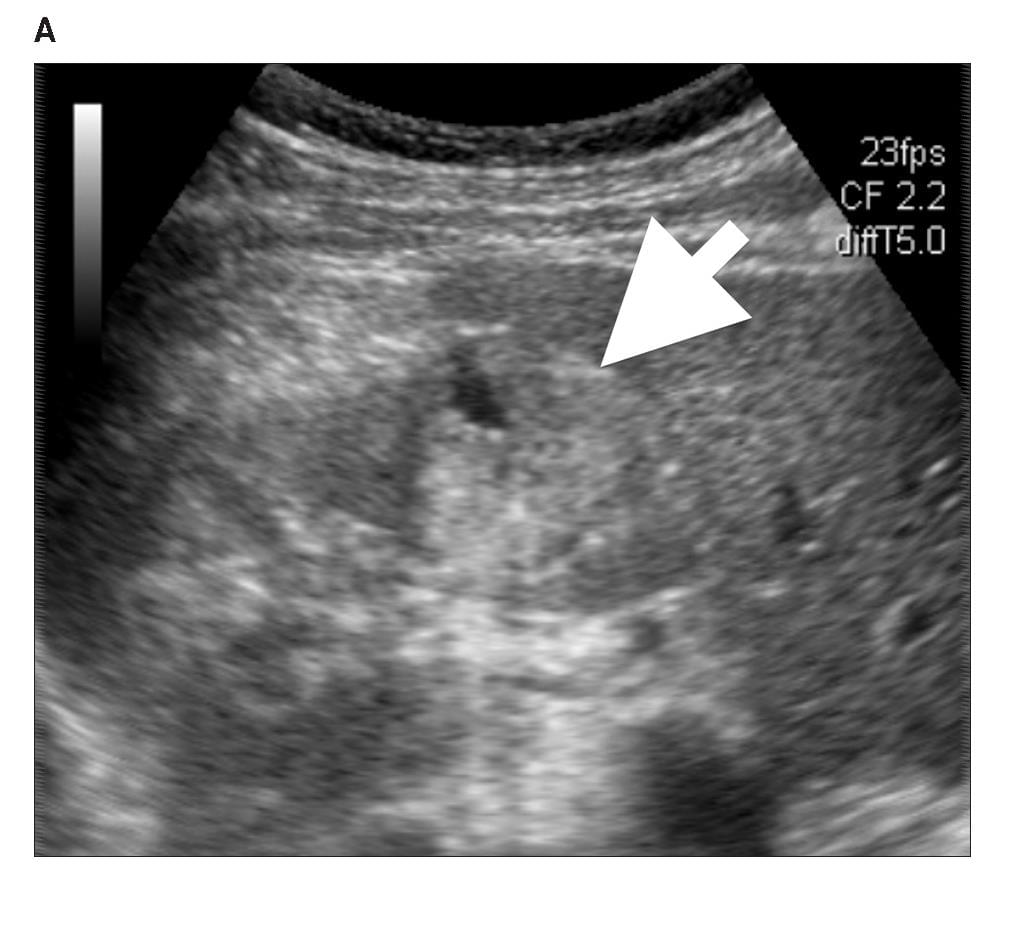
Диаграмма 5. Ангиомиолипома А, Серая шкала сонограммы показывает гиперэхогенную твердую опухоль (стрелка) в почечной паренхиме. В, Серая шкала изображения компрессионной эластографии показывает расположение ROI 1 в почечной паренхиме и ROI 2 в опухоли. С, соответственно обозначенное цветом изображение компрессионной эластографии показывает индекс эластичности 1,07 (стрелка пунктир). D, Контрастная аксиальная КТ показывает жировую опухоль (стрелка), представляющую собой ангиомиолипому.
Ограничения в нашем исследовании. Паранефральная жировая ткань ограничивает прямой доступ к осуществлению внешнего давления на почку, что может ограничить силу внешнего воздействия на почку. Влияние системной погрешности на измерение эластичности можно избежать путем контроля качества, например, калибровкой эластографических модулей ультразвукового оборудования. Малое количество опухолей другого вида, кроме почечно-клеточной карциномы и ангиомиолипомы, ограничило репрезентативную роль опухолей в нашем исследовании для оценки применения компрессионной эластографии для дифференциации доброкачественных и злокачественных опухолей. Отсутствие второго врача-радиолога для осуществления эластографии и недостаточная вариабельность субъективной экспертной оценки собранных данных стали другими ограничениями. Взаимосвязь между результатами эластографии дает представление о надежности метода компрессионной эластографии. Однако, в предыдущих исследованиях было отмечено значительное соотношение согласованности независимых экспертов по оценке почечных опухолей методом компрессионной эластографии.15 Дополнительным ограничением нашего исследования была нехватка измеряемых показателей индекса эластичности различных участков опухолей на одинаковой глубине. Обычно существуют различия в патологических характеристиках почечных опухолей из-за наличия некрозов в злокачественных опухолях и внутренних различий, таких как локализация жира в ангиомиолипоме. Хотя мы исключили некротические участки опухолей при измерении эластичности, показатели индекса эластичности, полученные с различных участков опухолей, могли бы увеличить воспроизводимость компрессионной эластографии путем обеспечения убеждения, что результаты на самом деле представляют всю опухоль. Средние показатели индекса эластичности почечно-клеточной карциномы (4,30) и ангиомиолипомы (1,28) в нашем исследовании отличались от показателей предыдущего исследования, составляли 0,3 для ангиомиолипомы и 0,8 для почечно-клеточной карциномы.15 Расхождения между исследованиями вызванные использованием различных шкал эластичности на разном ультразвуковом оборудовании. Тан и др.15 отмечали, что средний показатель индекса эластичности почечно-клеточной карциномы был в 2,66 раза выше показателя ангиомиолипомы. В нашем исследовании мы обнаружили, что средний показатель индекса эластичности злокачественных почечных опухолей был в 2,83 (4,05 против 1,43) раза выше показателя доброкачественных почечных опухолей, а средний показатель индекса эластичности почечно-клеточной карциномы был в 3,35 (4,30 против 1,28) раза выше показателей ангиомиолипомы. Низкие показатели индекса эластичности почечно-клеточной карциномы и ангиомиолипомы (<1), отмечены в предыдущем исследовании, которое касалось пониженной плотности почечных опухолей по сравнению с почечной паренхимой, 15 были несовместимы с результатами нашего исследования. Стало известно, что образования в различных органах брюшной полости плотнее, чем паренхима.10,11,20-22 Увеличенная плотность и пониженная эластичность почечных опухолей по сравнению с почечной паренхимой наблюдалась в предыдущих исследованиях.20,23 Кескин и др. 23 отмечали средние показатели индекса эластичности доброкачественных и злокачественных опухолей 1,2 ± 0,2 (в диапазоне 0,06-4,06) и 3,4 ± 0,3 (в диапазоне 0,08-9,92), соответственно, что совпадало с повышенной плотностью почечных образований по сравнению с почечной паренхимой. Такие результаты были совместимыми с результатами нашего исследования, указывающие на большую плотность доброкачественных и злокачественных опухолей по сравнению с почечной паренхимой.
Подытоживая исследования, компрессионная эластография может быть чрезвычайно важной для дифференциации доброкачественных и злокачественных опухолей. Показатели индекса эластичности злокачественных опухолей были выше показателей доброкачественных почечных опухолей. Компрессионная эластография может быть использована в качестве дополнительного эластографического метода для оценки почечных опухолей, выявленных на серой шкале ультразвукового исследования.
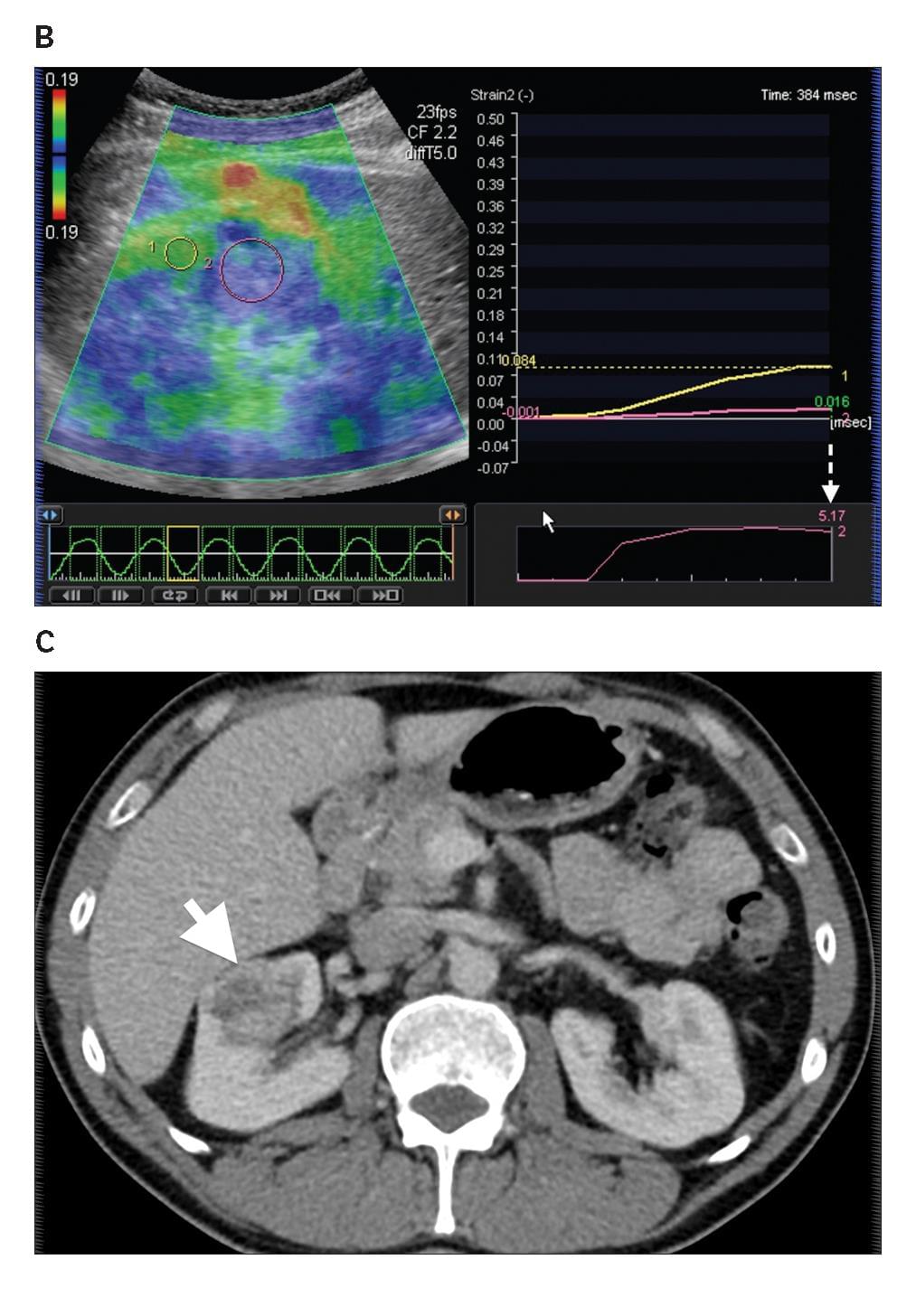
Диаграмма 6. Почечно-клеточная карцинома А, Серая шкала сонограммы показывает гиперэхогенную опухоль (стрелка) правой почки, имитирующую ангиомиолипому. В, Изображение компрессионной эластографии показывает соотношение эластичности 5,17 (стрелка пунктир), что указывает на то, что почечная паренхима смещалась в 5,17 раз больше чем почечная опухоль в ответ на примененное давление. С, Контрастная аксиальная КТ показывает почечно-клеточную карциному правой почки с неправильными контурами и четкостью ниже чем в почечной паренхиме.
Диаграмма 7. А, ROC-кривая показателей индекса эластичности для дифференциации доброкачественных и злокачественных почечных опухолей. В, ROC-кривая показателей индекса эластичности для дифференциации почечно-клеточной карциномы и ангиомиолипомы.
Список литературы
1. А. Гейденрейх, В. Рейвери (Heidenreich A, Ravery V) Европейское сообщество онкологической урологии. Дооперационная визуализация почечно-клеточного рака. World J Urol 2004; 22: 307-315
2. Дж. Чжан, И. М. Техрани, Л. Ван, Н. М. Исхилл, Л. Г. Шварц, Г. Грицак (Zhang J, Tehrani YM, Wang L, Ishill NM, Schwartz LH, Hricak H) почечные опухоли: определение характерных признаков при помощи диффузионно-взвешенной МРТ – предыдущий опыт. Radiology 2008; 247: 458-464
3. Е. М. Гехт, Г. М. Исраэл, Г. А. Крынская и др. (Hecht EM, Israel GM, Krinsky GA, et al.) Почечные опухоли: количественный анализ образований с помощью измерения интенсивности сигнала по сравнению с количественным анализом образований с помощью числовой субтракционной визуализации для диагностики злокачественных опухолей на МРТ. Radiology 2004; 232: 373-378.
4. Р. К. Семелка, Дж П. Шунат, М. А. Крукер, Р. Дж. МакМагон, Г. М. Гринберг (Semelka RC, Shoenut JP, Kroeker MA, MacMahon RG, Greenberg HM). Образования в почках: контролируемое сравнение между результатами КТ и МРТ 1,5 с помощью методик с использованием гадолиния и FLASH с задержкой дыхания Radiology 1992; 182: 425-430.
5. Г. М. Исраэл, С. Г. Силверман (Israel GM, Silverman SG). Почечные опухоли, обнаруженные при исследовании других заболеваний. Radiol Clin North Am 2011; 49: 369-383.
6. А. Кутиков, Л. К. Фоссет, П. Рамандани и др. (Kutikov A, Fossett LK, Ramchandani P, et al.) Частота выявления доброкачественных патологических образований при частичной нефрэктомии твердых опухолей, которые считались почечно-клеточной карциномой согласно дооперационной визуализации. Urology 2006; 68: 737-740.
7 Д. Ганешан, М. Нотогамипроджо, П. Николаидис, Р. Санъял, П. Бхосале (Ganeshan D, Notohamiprodjo M, Nikolaidis P, Sanyal R, Bhosale P.) Последние достижения в поперечной почечной визуализации – перспектива в онкологии: текущие решения и основные задачи в будущем. Журнал Comput Assist Tomogr 2013; 37: 962-970.
8 С. Герст, Л. Е. Ганн, Д. Ли и др. (Gerst S, Hann LE, Li D, et al.) Оценка почечных опухолей с помощью контрастного УЗИ: первичный опыт. AJR Американский журнал по рентгенологии 2011; 197: 897-906.
9. А. Ито, Е. Уэно, Е. Тоно и др. (Itoh A, Ueno E, Tohno E, et al.) Заболевания молочной железы: клиническое применение ультразвуковой эластографии при диагностировании. Radiology 2006; 239: 341-350.
10. Г. Саломон, И. Келлерман, И. Тедеран и др. (Salomon G, Köllerman J, Thederan I, et al.) Оценка выявления рака простаты с помощью ультразвуковой эластографии в режиме реального времени: сравнение с последовательным патологическим анализом секционного материала после радикальной простатэктомии. Eur Urol 2008; 54: 1354-1362
11. М. Г. Онур, А. К. Пойраз, Е. Е. Уджак, С. Бозгеик, И. Х. Езерджан, Е. Огур (Onur MR, Poyraz AK, Ucak EE, Bozgeyik Z, Özercan IH, Ogur E). Полуколичественная эластография опухолей печени. Журнал Ultrasound Med 2012; 31: 1061-1067
12. Н. Чиледаг, К. Арда, Б. К. Арибас, Е. Актас, С. К. Кесе (Ciledag N, Arda K, Aribas BK, Aktas E, Köse SK.) Целесообразность применения ультразвуковой эластографии и технологии MicroPure для дифференциации доброкачественных и злокачественных узелков щитовидной железы. AJR Американский журнал по рентгенологии 2012; 198: 244-249.
13. Ф. Айгнер, Т. Де Зордо, Л. Паллвейн-Преттнер и др. (Aigner F, De Zordo T, Pallwein-Prettner L, et al.) Соноэластография в режиме реального времени для оценки очаговых поражений яичек. Radiology 2012; 263: 584-589.
14. Д. А. Клеверт, К. Сток, Б. Кляйн и др. (Clevert DA, Stock K, Klein B, et al.) Оценка метода акустической лучевой импульсной визуализации (АЛИВ) и контрастного УЗИ почечных образований неизвестной этиологии по сравнению с гистологическими результатами. Clin Hemorheol Microcirc 2009; 43: 95-107.
15. С. Тан, М. Ф. Езджан, Ф. Тезджан и др. (Tan S, Özcan MF, Tezcan F, et al.) Эластография в режиме реального времени для различения ангиомиолипомы и почечно-клеточной карциномы: предварительные результаты исследований. AJR Американский журнал по рентгенологии 2013; 200: W369-W375.
16. Р. Дж. Барр, К. Петерсон, А. Хинди (Barr RG, Peterson C, Hindi A.) Оценка неопределенных опухолей с помощью контрастного УЗИ: диагностическое исследование. Radiology 2014; 271: 133-142.
17. С. Ф. Сюй, Х. С. Сюй, С. И. Се, Г. Цз. Лю, И. Л. Чжэн, М. Д. Люй (Xu ZF, Xu HX, Xie XY, Liu GJ, Zheng YL, Lu MD). Почечно-клеточная карцинома и ангиомиолипома: различия в диагностике с помощью контрастного ультразвукового исследования в режиме реального времени. Журнал Ultrasound Med 2010; 29: 709-717
18. Х. П. Форман, В. Д. Миддлтон, Дж. Л. Мелсон, Б. Л. МакКленнан (Forman HP, Middleton WD, Melson GL, McClennan BL). Гиперэхогенная почечно-клеточная карцинома: увеличение случаев обнаружения с помощью УЗИ. Radiology 1993; 188: 431-434
19. Л. Паллвейн-Преттнер, Д. Флери, К. Р. Роттер и др. (Pallwein-Prettner L, Flöry D, Rotter CR, et al.) Оценка и определение характерных признаков обычных видов опухолей с помощью КТ и МРТ. Insights Imaging 2011; 2: 543-556.
20. Б. Дж. Фахи, Р. К. Нельсон, Д. П. Бредвей, С. Дж. Сюй, Д. М. Дюмон, Дж. Э. Трахи (Fahey BJ, Nelson RC, Bradway DP, Hsu SJ, Dumont DM , Trahey GE). Визуализация злокачественных опухолей брюшной полости in vivo с помощью метода эластографической акустической лучевой импульсной визуализации. Phys Med Biol 2008; 53: 279-293.
21. А. Капоор, А. Капоор, Г Махаджан (Kapoor A, Kapoor A, Mahajan G.) Дифференциация злокачественных и доброкачественных уплотнений стенок желчного пузыря с использованием метода эластографической акустической лучевой импульсной визуализации. Журнал Ultrasound Med 2011; 30: 1499-1507
22. Х. Иглесиас-Гарсия, Х. Ларино-Ноя, И. Абдулкадер, Х. Фортеза, Х. Э. Домингес-Муньос (Iglesias-Garcia J, Larino-Noia J, Abdulkader I, Forteza J, Dominguez- Munoz JE). Количественная эндоскопическая ультразвуковая эластография: точный метод дифференциации твердых опухолей поджелудочной железы. Gastroenterology 2010; 139: 1172-1180
23. С. Кескин, З. Кескин, Х. Озбинер и др. (Keskin S, Keskin Z, Ozbiner H, et al.) Компрессионная эластография для определения характерных признаков почечных опухолей: предварительные результаты Статья представлена на: 2014 Европейский Конгресс радиологии; 6-10 марта, 2014; Вена, Австрия.




14.10.2019
Василиса Кожемякина