Резюме
Это нарративный обзор, целью которого является обсуждение важности эластографических методов в оценке клинически значимой портальной гипертензии (КЗПГ) у пациентов с циррозом печени, где авторы предлагают алгоритм обследования таких пациентов. При компенсированных прогрессирующих хронических заболеваниях печени целью является предупреждение развития КЗПГ, а у тех, кто уже имеет КЗПГ, – предотвращение появления гастроэзофагеального варикоза (ГЭВ) и других осложнений портальной гипертензии. При компенсированном циррозе распространенность ГЭВ составляет 30-40%, из них 10-20% имеют риск кровотечения. Поэтому использование неинвазивных методов освободило бы пациента от необходимости проведения эндоскопии. Печеночная эластография – это неинвазивный, безопасный, воспроизводимый метод, доступный с помощью многих методик: Вибрационно-контролируемая переходная эластография (ВКПЭ), сдвиговолновая эластография (СХЭ) и магнитно-резонансная эластография (МРЭ). На конференции Baveno VII было представлено “правило 5” для ВКПЭ: измерение жесткости печени (ЖП) ≤15 кПа и количество тромбоцитов >150 000/мм3 исключают КЗПГ, в то время как ЖП ≥25 кПа свидетельствует о наличии КЗПГ. Также было предложено “правило 4” для СВЭ: пациенты с кПА≥17 кПа могут рассматриваться как имеющие КЗПГ. Наконец, измерение жесткости селезенки (ВЖС) было предложено как более специфическая методика для прогнозирования наличия КЗПГ. В заключение, эластография завоевала авторитет в неинвазивной оценке пациентов с прогрессирующими хроническими заболеваниями печени, позволяя принимать профилактические меры при подозрении на наличие КЗПГ.
Ключевые слова:
портальная гипертензия; эластография; цирроз печени; эластография
ОСНОВНЫЕ МОМЕНТЫ
– При компенсованому цирозі використання неінвазивних методів звільняє пацієнта від необхідності проведення ендоскопії.
– При компенсированном циррозе использование неинвазивных методов освобождает пациента от необходимости проведения эндоскопии.
– На конференции Baveno VII было представлено “правило 5” для вибрационно-контролируемой транзиентной эластографии: измерение жесткости печени ≤15 кПа и количество тромбоцитов >150 000/мм3 исключает клинически значимую портальную гипертензию (КЗПГ), тогда как при ≥25 кПа существует высокая вероятность наличия КЗПГ.
– Измерение жесткости селезенки было предложено как более специфический метод для прогнозирования наличия КЗПГ.
– Эластография завоевала авторитет в неинвазивном обследовании пациентов с прогрессирующими хроническими заболеваниями печени, позволяя принимать профилактические меры при подозрении на наличие ХЗПГ.
ВСТУПЛЕНИЕ
Оценивая бремя хронических заболеваний печени1, подсчитали, что в мире ими страдают 1,5 миллиарда пациентов, причем наиболее частыми причинами являются неалкогольная жировая болезнь печени (НАЖБП), вирусы гепатита В и С и алкогольная болезнь печени. Хотя эта цифра, вероятно, занижена, хронические заболевания печени являются причиной 2 000 000 смертей в год во всем мире. В Бразилии заболевания печени считаются восьмой по частоте причиной смерти2.
До недавнего времени диагноз хронического заболевания печени ставили с помощью гистологических, клинических, лабораторных и эхографических методов или эндоскопических в случае запущенной болезни. Однако некоторые тесты являются относительно инвазивными и непрактичными для постоянного наблюдения за этими пациентами. Это вызвало интерес к использованию неинвазивных методов для оценки пациентов с компенсированным циррозом, но они, как правило, не были приняты в клинической практике до недавнего времени3 Итак, эластография появилась как надежный и объективный тест для диагностики или исключения тяжелого фиброза/цирроза и клинически значимой портальной гипертензии (КЗПГ) у пациентов с циррозом печени. Соответственно, на консенсусных конференциях Baveno VI и Baveno VII по портальной гипертензии было высказано предположение, что измерение жесткости печени (ВЖП) можно использовать для выявления пациентов с компенсированной прогрессирующей хронической болезнью печени (ПХБП) и КЗПГ4,5.
Это нарративный обзор, целью которого является обсуждение важности эластографических методов в оценке КЗПГ у пациентов с циррозом печени, особенно печеночной и селезеночной эластографии, где авторы, кроме обзора современного состояния науки по этому вопросу, предлагают алгоритм оценки таких пациентов.
Классификация цирроза печени
При классификации цирроза печени необходимо учитывать шесть стадий заболевания 6. 0 стадия – это компенсированное заболевание без КЗПГ. Эта стадия определяется градиентом печеночного венозного давления (ГПВД) между 5 и 10 мм рт.ст. и приемлемым ответом на этиотропное лечение; на 1 стадии заболевание остается компенсированным, но с КЗПГ (ГПВД ≥10 мм рт.ст.) и, следовательно, с более высоким риском развития варикозного расширения вен, гепатоцеллюлярной карциномы и декомпенсации. На 2-й стадии становится очевидным появление гастроэзофагеального варикоза (ГЭВ), а 5-летняя смертность составляет около 10% при отсутствии декомпенсации. На 3-й стадии уже наблюдается кровотечение из-за разрыва варикозно расширенных вен, а 5-летняя смертность составляет 20%, если нет декомпенсации заболевания печени. На 4-й стадии имеется декомпенсация печени (кровотечение не учитывается, поскольку оно чаще связано с наличием асцита), с 5-летней смертностью 55-80%; на 5-й стадии наблюдаются дальнейшие эпизоды декомпенсации со смертностью до 90% за 5 лет. Наконец, на 6 стадии у пациента прогрессирует декомпенсированный цирроз печени (рефрактерный асцит, инфекция, персистирующая печеночная энцефалопатия (ПЭ), желтуха и почечная дисфункция), с высокой смертностью от 60 до 80% в течение 1 года.
Варикозное расширение вен встречается до 40% пациентов с компенсированным циррозом печени (Child А) и до 85% – с декомпенсированным (Child С)7. В исследовании, проведенном в нашем центре, в котором оценивали когорту пациентов с хроническими заболеваниями печени в амбулаторных условиях, желудочно-кишечное кровотечение было вторым по частоте осложнением при госпитализации для этих пациентов8. Мы подчеркиваем, что рецидив кровотечения в течение одного года может составлять до 60%, а фактическая смертность от каждого эпизода кровотечения колеблется от 15 до 20%7.
Скрининг варикозного расширения вен пищевода при циррозе печени
Критерии скрининга ГЭВ еще несколько лет назад базировались исключительно на выполнении эндоскопии верхних отделов пищеварительного тракта при диагностике цирроза печени. В 2015 году консенсус Baveno VI4 рекомендовал, что измерение давления менее 20 кПа при проведении Fibroscan®, связанное с количеством тромбоцитов более 150 000/мм3, освобождает пациента от необходимости проведения эндоскопии. В том же году Европейская ассоциация по изучению печени (EASL) в своем руководстве по оценке неинвазивных тестов при заболеваниях печени9 выразила мнение, что они не должны заменять эндоскопию для выявления варикозного расширения вен. Впоследствии многие авторы поддержали позицию Baveno VI3,10, включая руководство Американской ассоциации по изучению заболеваний печени (AASLD)11, которая повторила эту рекомендацию и предположила, что когда вероятность варикозного расширения вен высокого риска кровотечения (ВРВВ) является низкой, неинвазивные тесты могут позволить избежать выполнения значительного количества эндоскопических исследований. Однако международные научные общества, в том числе EASL12, подчеркивают, что из-за высокого риска ГЭВ у пациентов с декомпенсированным заболеванием эндоскопию таким пациентам следует выполнять ежегодно.
Хотя мы все еще считаем эндоскопию важным инструментом скрининга в нашем центре13, мы имеем в виду, что при компенсированном заболевании распространенность ГЭВ составляет 30-40%, из которых только 10-20% имеют риск кровотечения; поэтому использование неинвазивных методов было бы предпочтительным. Поскольку данные являются отрицательными, вероятность возникновения ВРВВ составляет менее 5%, и можно было бы избежать до 30% эндоскопий14.
Изменение парадигмы в оценке пациентов с циррозом и портальной гипертензией
Как мы можем наблюдать в классификации цирроза печени6, прогноз заболевания начинает более существенно ухудшать выживаемость пациента с 3 стадии, когда возникает кровотечение вследствие разрыва ГЭВ. Однако наиболее очевидным это становится на 4-й стадии (первый эпизод декомпенсации), когда смертность значительно возрастает. Таким образом, предпосылкой должно быть избежание кровотечений и других осложнений у пациентов с циррозом печени, основной причиной которых является КЗПГ.
При ПХБП без КЗПГ, когда эластография не указывает на КЗПГ (стадия 0), целью, которую следует рассматривать, является предотвращение развития КЗПГ путем лечения или исключения причины заболевания печени. У тех, кто уже имеет КЗПГ (стадия 1), целью является предотвращение появления ГЭВ и других осложнений портальной гипертензии (асцит, ГЭ). Для этого, когда это еще не сделано, необходимо лечить причину цирроза печени и адаптировать образ жизни пациента. Однако во многих случаях, даже после успешного лечения, КЗПГ может сохраняться15, что позволяет сделать вывод о необходимости принятия других мер, поскольку это является маркером эпизодов печеночной декомпенсации. Таким образом, необходимо начать лечение препаратами, действующими именно путем снижения портального давления (НСББ)16.
Недавно, когда была переоценена роль гипердинамического кровообращения при циррозе печени и ответ на НСББ, было показано, что пациенты без КЗПГ имеют меньшую гипердинамику кровообращения и меньшее снижение портальной гипертензии при применении НСБТ по сравнению с пациентами с КЗПГ17. На основе этого предположения было разработано исследование PREDESCI18, в котором оценивалась роль НСББ у пациентов с КЗПГ. Это рандомизированное, проспективное, контролируемое, многоцентровое, двойное слепое исследование проводилось у пациентов с компенсированным циррозом печени и КЗПГ. Пациенты, которые остро реагировали на НСББ, были рандомизированы в группы пропранолола и плацебо, а те, кто не реагировал, – в группу карведилола и плацебо. Группа, которая применяла фармакологическую терапию, продемонстрировала лучшую динамику, и авторы пришли к выводу, что НСББ увеличивают выживаемость без декомпенсации (повышая роль меньшей частоты асцита). Это исследование стало важной вехой в лечении пациентов с циррозом печени. Отныне, когда мы сталкиваемся с пациентом с ПХБП, основное внимание должно быть сосредоточено на лечении КЗПГ, а не только на лечении ГЭВ.
Основные исследования, которые способствовали изменениям в медицинском менеджменте, а также те, которые установили предельные значения для неинвазивной оценки КЗПГ, можно увидеть в Таблице 1.
Таблица 1
| Автор | Структура/N | Цель/первичная конечная точка | Результаты/вывод |
| Groszmann RJ, et al.19 | Проспективное исследование N=213 пациентов с циррозом печени без варикозного расширения вен, получавших тимолол (n=108) по сравнению с плацебо (n=105) | Развитие варикозного расширения вен пищевода или варикозного кровотечения | НСББ неэффективны для профилактики варикоза/кровотечений (39% лечения против 40% плацебо; P=0,89) и ассоциируются с нежелательными явлениями |
| Villanueva C, та співавт.17 | Проспективное, многоцентровое, перекрестное исследование N=273 больных циррозом печени с ПН (194 с КЗПГ и 79 с субклинической ПН) | Охарактеризовать гемодинамический профиль каждой стадии ФП при компенсированном циррозе печени и ответ на НСББ в соответствии со стадией | Пациенты с субклинической формой ПН имеют меньшую гипердинамику кровообращения и меньшее снижение портального давления при применении НСББ по сравнению с пациентами с КЗПГ, что позволяет предположить, что НСББ являются более подходящими для предотвращения декомпенсации цирроза печени у пациентов с КЗПГ, чем на ранних стадиях заболевания. |
| Villanueva C, та співавт.18 | Многоцентровое проспективное, двойное слепое, RCT (PREDESCI). N=201 пациент с компенсированным циррозом печени и КЗПГ без сердечной недостаточности (100 получали пропранолол или карведилол и 101 – плацебо) | НСББ для предотвращения декомпенсации цирроза печени с РН | Декомпенсация возникла у 16/100 (16%) пациентов в группе НСББ против 27/101 (27%) пациентов в группе плацебо (P = 0,041). Длительное лечение НСББ может увеличить выживаемость без декомпенсации у пациентов с компенсированным циррозом печени и КЗПГ |
| Albrades JC, та співавт.3 | Проспективное, многоцентровое исследование N=518 пациентов с ПХБП | Разработать модели прогнозирования риска на основе неинвазивных тестов для оценки риска у пациентов с ПХБП в месте оказания медицинской помощи | Тромбоциты ≥150 000 и значение ВЖП 20 кПа имели бы прогностическую вероятность ВРВВ 5%, а у 30% пациентов прогностическая вероятность ВРВВ была ниже 5%. |
| Pons M, та співавт.43 | Международное когортное исследование N=836 компенсированных циррозов (358 HCV; 248 НАСГ; 203 злоупотребления алкоголем и 27 HBV) | Исследовать распространенность ПГ при наиболее распространенных этиологиях у пациентов с ПХБП и разработать классификационные правила на основе ВЖП, которые можно было бы легко использовать для диагностики или исключения КЗПГ. | ВЖП ≥25 кПа является достаточным для диагностики КЗПГ при большинстве этиологий, в том числе у пациентов без ожирения с НАСГ, но не у пациентов с ожирением с НАСГ. ВЖП≤15 кПа плюс тромбоциты ≥150 000 исключают КЗПГ при большинстве этиологий |
| Rabiee A, та співавт.45 | Валидационное исследование N=245 пациентов с компенсированным циррозом печени с НАСГ | Валидация моделей ANTICIPATE с использованием исходных данных многоцентровых РКИ; а также разработка и валидация модели с использованием лабораторных показателей (FIB4+) | Модели ANTICIPATE хорошо показали себя в прогнозировании наличия КЗПГ при циррозе печени при НАСГ. Модель с использованием FIB-4 плюс альбумин (FIB4+) может быть использована для прогнозирования КЗПГ, когда ВКПЭ недоступна |
- НСББ: неселективные ß-блокаторы; ПГ: портальная гипертензия; КЗПГ: клинически значимая портальная гипертензия; РКИ: рандомизированное контролируемое исследование; ВРВВ: варикозное расширение вен высокого риска кровотечения; ПХБП: компенсированная прогрессирующая хроническая болезнь печени; ВЖП:
- измерение жесткости печени; ВГС: вирус гепатита С; НАСГ: неалкогольный стеатогепатит; ВГ: вирус гепатита В; AUC: площадь под кривой; ВКПЭ: виброконтролируемая переходная эластография.
Обобщение данных исследований по оценке портальной гипертензии у пациентов с циррозом печени.
Снижение портального давления улучшает эволюцию цирроза печени при наличии или отсутствии асцита, что было продемонстрировано в недавнем мета-анализе с участием более 1100 пациентов20. При оценке первичной профилактики около половины пациентов, получивших НСББ, кроме меньшего количества кровотечений из-за разрыва варикозных вен, имели меньше осложнений, связанных с декомпенсацией цирроза, меньшую потребность в трансплантации печени и более низкую смертность.
Несмотря на отсутствие прямых сравнительных исследований между двумя основными НСББ, доступными в нашей стране (пропранолол vs карведилол), существует большая тенденция к использованию карведилола, поскольку считается, что он играет более значимую роль в снижении ГВПТ 21. Применение карведилола увеличивает долю респондентов до 75% по сравнению с 50% при применении других традиционных НСББ 22.
В систематическом обзоре и мета-анализе четырех рандомизированных контролируемых исследований с участием 352 пациентов с компенсированным циррозом печени и КЗПГ (без предыдущих кровотечений) карведилол снижал риск декомпенсации и смертности пациентов 23. Эти данные были подтверждены в недавнем исследовании в американской когорте после 3 лет наблюдения за пациентами с циррозом печени Child-A с уровнем тромбоцитов от 30 000 до 150 000/мм3 и без декомпенсации в анамнезе 24.
Консенсус Baveno VII 5, занимая позицию по профилактике первой декомпенсации у пациентов с КЗПГ, предлагает использовать НСББ, отдавая предпочтение карведилолу, поскольку он более эффективен в снижении ГВПТ и предотвращении декомпенсации, снижает смертность и лучше переносится. Она повторяет, что пациентам с НСББ и ПХБП не нужно проходить скрининговую эндоскопию, и рекомендует эндоскопическое бандажное лигирование тем пациентам с ВРВВ, у которых есть противопоказания/непереносимость этих препаратов.
Таким образом, новая реальность может заключаться в том, чтобы больше сосредоточиться на КЗПГ и меньше – на наличии ГЭВ. Лечение основного заболевания и применение НСББ остаются основными методами терапии, а вскоре к существующим терапевтическим возможностям добавятся новые средства, способные действовать на уровне портального давления, такие как статины.
На основе новых данных парадигма изменилась, сосредоточившись на лечении КЗПГ, а не только ВРВВ, и предотвращении любой декомпенсации (варикозное кровотечение, асцит или ПЭ)25. Таким образом, возвращаясь к классификации цирроза печени6, мы бы начинали клиническое вмешательство уже на 1-й стадии (наличие КЗПГ без ГЭВ), а не на 2-й стадии. Однако КЗПГ определяется с помощью ГВПТ ≥10 мм рт.ст., и для подтверждения этого диагноза нам пришлось бы выполнить инвазивную процедуру, которая доступна не во всех медицинских центрах. Это может завести в тупик, но мы считаем, что с годами появилось больше доказательств в пользу неинвазивных методов диагностики КЗПГ, хотя золотым стандартом остается определение ГВПТ. Среди этих методов большой авторитет в литературе получила печеночная эластография.
Печеночная эластография
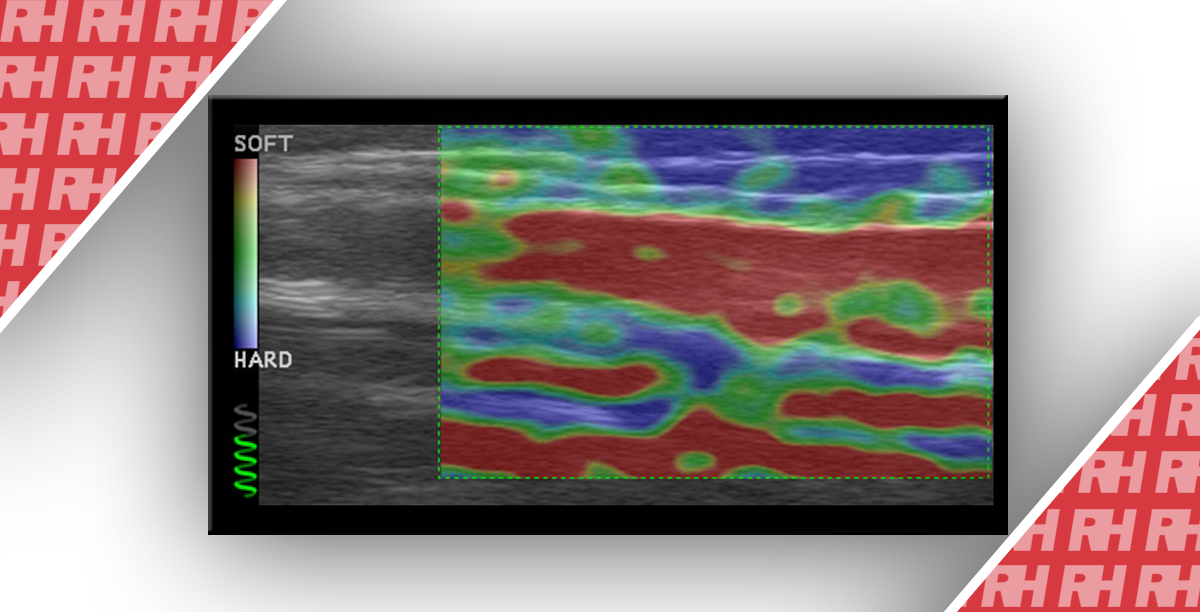
Эластография печени – это неинвазивный, безопасный, воспроизводимый метод с высокой точностью оценки фиброза печени. Механические изменения, которые происходят в печени в результате фиброза, способствуют повышению резистентности органа. Эластографические методы стали стандартом для оценки биомеханических свойств тканей 26,27. Так, сдвиговые волны (СС) генерируются, когда к ткани прикладывается направленная сила.
Ультразвуковая эластография заключается в оценке ВЖП через оценку скорости сдвиговых волн, которые могут быть механически созданы внешним стимулом, как при вибрационно-управляемой переходной эластографии – ВКПЭ, используемой в переходной эластографии печени – Fibroscan®, или через ультразвуковые импульсы, присутствующие в методах сдвиговых волн, таких как точечная сдвиговая волна (ТСВ) и двумерная сдвиговая волна (2D-СВ) 28-31. Так же магнитно-резонансная эластография (МРЭ) также использует внешние стимулы 29,30. Первой и наиболее валидированной методикой является ВКПЭ: специальный зонд создает вибрационную волну в правом межреберье над участком печени, которая передается на печень. Результат выражается в килопаскалях (кПа). В этом методе оператор имеет незначительный контроль над оцениваемым участком, а изображение является одномерным 32. Появились более новые методы, в которых сдвиговые волны генерируются акустическим импульсом ультразвукового луча непосредственно в печени, так называемые методы импульса силы акустического излучения (ИСАВ), генерирующие снимки в одной точке (ТСХЭ) или в больших частях оцениваемой области интереса (2D-СХЭ). Все эти последние методы позволяют визуализировать область интереса в реальном времени, с результатом, выраженным в м/с или кПа 26,33.
ВКПЭ – это одномерная методика, которая использует эластичные ЗХ (50 Гц) и низкочастотный ультразвук, распространяющийся через кожу и подкожную клетчатку к печени, которая выполняется с помощью системы FibroScan® (Echosens, Франция). Скорость распространения УЗ напрямую связана с жесткостью ткани 34, то есть чем более устойчивой является ткань, тем быстрее происходит манипуляция с колебаниями. ВКПЭ проста в исполнении, воспроизводима, быстрая (занимает 5-10 минут) и может проводиться у постели больного или в амбулаторных условиях. Результаты, выраженные в кПа, в диапазоне от 1,5 до 75 кПа, доступны немедленно. Это метод с высокой внутренней и межнаблюдательной согласованностью. Однако согласованность между наблюдателями становится значительно ниже у пациентов с индексом массы тела (ИМТ) ≥25 кг/м², со стеатозом ≥25% гепатоцитов, фиброзом печени <2 (по шкале METAVIR), а также у лиц с узкими межреберными промежутками 35.
ТСХЭ была пионером во включении специального программного обеспечения, совмещенного с традиционным ультразвуковым аппаратом для выполнения эластографии. Изображение, проецируемое на экран в В-режиме, позволяет визуализировать орган и выбрать зону интереса (ЗИ) для получения скорости сдвиговых волн. Кратковременные акустические импульсы излучаются через датчик, генерируя ЗХ в выбранной оператором области интереса.
Ультрасонографические изображения используются для определения местоположения ЗИ, а измерение возможно даже при наличии асцита 26. Результатом будет медиана 10 измерений, а надежность результата достигается при интерквартильном диапазоне – ИКР/медиана ниже 15%; чем ниже ИКР, тем выше надежность результата теста. ТСХЭ имеет отличную внутри- и межоператорскую воспроизводимость для оценки эластографии печени у здоровых лиц и пациентов с хроническими заболеваниями печени 26.
2D-СХЭ следует тем же принципам, описанным для ТСХЭ, но с возможностью получения количественных изображений СВ с более высокой ЗИ фокусировкой на нескольких участках, последовательно определяя время поступления СВ в несколько боковых участков паренхимы печени 26.
МРЭ было выделено в неинвазивной оценке фиброза печени. Выявление и стадирование фиброза печени является основным клиническим применением МРЭ, и он считается самым точным неинвазивным методом выявления и стадирования фиброза печени, с отличной внутри- и межнаблюдательной согласованностью 36. По сравнению с другими методами, это единственный неинвазивный метод, способный диагностировать фиброз печени легкой степени с достаточной точностью 37.
Факторы, которые могут влиять на эффективность методов
Необходимо подчеркнуть, что из-за неправильной интерпретации результатов, в основном при использовании ВКПЭ и СХЭ 38, следует исключить влияние таких факторов, как воспаление (уровень аминотрансфераз в пять раз превышает верхнюю границу нормы), застойные явления в печени, механический холестаз, сердечная недостаточность, обструкция желчевыводящих путей, а также употребление пищи, что может привести к неправильной интерпретации результатов.
Хотя большинство исследований использовали ВКПЭ в качестве референтного показателя, исследования с использованием ТСХЭ или 2-D СХЭ почти всегда давали сходные результаты, что свидетельствует о том, что одни и те же самые факторы, которые могут влиять на все методы, должны присутствовать во всех исследованиях. У пациентов с ложно завышенными показателями эластографии печени из-за алкогольного гепатита жесткость печени уменьшается после 1-4 недель воздержания от алкоголя. Другие заболевания, которые повышают жесткость печени, независимо от фиброза печени, включают амилоидоз, лимфомы и экстрамедулярное кроветворение 26,28,39. Стеатоз печени также вызывает ослабление ИСАБ и может приводить к большей вариабельности измерений 26.
Магнитно-резонансная томография в течение десятилетий признана важным методом визуализации печени. Хотя обычные анатомические изображения предоставляют полезную диагностическую информацию, они имеют ограниченную роль в диагностике фиброза печени на ранних стадиях и ПХБП 40. Park и соавт. выполнили проспективное исследование, в котором сравнивали эффективность МРЭ и ВКПЭ для диагностики фиброза у пациентов с НАЖБП. Было проведено перекрестное исследование 104 последовательных взрослых, которым проводили МРЭ, ВКПЭ и биопсию печени. Авторы обнаружили, что МРЭ является более точным, чем ВКПЭ, в выявлении фиброза печени (1 стадия или более) 41.
Американская ассоциация гастроэнтерологов (AGA) сообщила, что для диагностики цирроза печени у взрослых с НАЖБП использование МРЭ является более предпочтительным, чем ВКПЭ, в условиях высокой распространенности цирроза, поскольку дает меньше ложноположительных результатов, уменьшая количество пациентов, которым проводят биопсию печени 42. Возможность оценки большого объема образца, с потенциалом оценки всего объема печени, признана одним из основных преимуществ МРЭ по сравнению с другими методами стадирования фиброза печени. Эта характеристика является большим преимуществом при стадировании, поскольку фиброз часто имеет гетерогенное распределение. Для сравнения, биопсия охватывает около 1/50 000 объема печени, а ВКПЭ – около 1/100 36.
Основными ограничениями МРЭ являются низкая доступность, высокая стоимость, неудачи из-за перегрузки печени железом и некоторые общие противопоказания для проведения магнитного резонанса. Кроме того, пределы жесткости для различных этиологий еще не установлены 36. МРТ является наиболее точным неинвазивным методом выявления и стадирования фиброза печени, особенно у пациентов с ожирением и асцитом.
Печеночная эластография в диагностике КЗПГ
Неинвазивная диагностика КЗПГ у пациентов с ПХГП различной этиологии недавно была оценена в когортном исследовании с участием 836 пациентов с ВКПЭ в сочетании с ГПВД, где пациенты с ВЖП ≥10 кПа и без предшествующей декомпенсации заболевания печени 43. Портальная гипертензия наблюдалась у более 90% больных ПХБП независимо от этиологии, за исключением пациентов с неалкогольным стеатогепатитом – НАСГ (60,9%). В последней популяции этот факт был более очевидным у пациентов с ожирением с НАСГ (53,3%). При оценке наличия КЗПГ поведение было подобным, также ниже у пациентов с НАСГ (50,5%), особенно при ожирении (30,8%).
ВЖП≤15 кПа при уровне тромбоцитов ≥150 000/мм3 исключает наличие КЗПГ в большинстве этиологий, тогда как лучшей точкой отсечения для определения КЗПГ при алкогольной болезни печени, хроническом гепатите В, хроническом гепатите С и у пациентов с НАСГ было ≥25 кПа. У пациентов с ожирением с НАСГ положительное прогностическое значение составляло лишь 62,8%, поэтому была предложена номограмма для прогнозирования КЗПГ у пациентов с НАСГ (ANTICIPATE-NASH), в которой также учитывался ИМТ 43.
Интересно, что исследование демонстрирует, что декомпенсация при прогрессирующей НАЖБП может происходить при более низких уровнях ПВГ 44. Это исследование имеет обоснование, что точность ГПВД при НАЖБП может не отражать фактическое давление в воротной вене. Это многоцентровое поперечное исследование 548 пациентов с прогрессирующей НАЖБП по сравнению с 444 пациентами с ПХБП, вызванной вирусом гепатита С. Медиана ГПВД была ниже в группе с прогрессирующей НАЖБП (13 против 15 мм рт.ст.), несмотря на подобную функцию печени и более высокие показатели декомпенсации в группе с прогрессирующей НАЖБП (32% против 25%; P=0,019). Авторы делают вывод, что пациенты с прогрессирующей НАЖБП имеют более высокую распространенность декомпенсации при любом оцениваемом уровне портальной гипертензии (по сравнению с пациентами с прогрессирующим хроническим заболеванием печени, вызванным вирусом гепатита С).
На последней встрече в Бавено 5 было представлено “правило 5”. ВЖП <10 кПа при отсутствии клинических или визуализационных событий исключает КЗПГ, при которой существует небольшая вероятность (<1%) декомпенсации или смертности. ВЖП между 10 и 15 кПа указывает на ПХБП; ВЧД ≤15 кПа и тромбоциты >150. 000/мм3 исключают КЗПГ (чувствительность и НПВ>90%); ВЖП ≥15 кПа с высокой вероятностью указывает на ПХБП, а ВЖП ≥25 кПа с высокой вероятностью указывает на КЗПГ (специфичность и НПВ>90%). В этом сценарии существует высокий риск эндоскопических признаков портальной гипертензии и декомпенсации (меньше у пациентов с ожирением и НАЖБП). Хотя модель ANTICIPATE-NASH (ВЖП, тромбоциты, ИМТ) требует валидации, ее можно использовать для прогнозирования риска КЗПГ у пациентов с компенсированным НАСГ-ПБП. Недавно проведенное валидационное исследование подтвердило, что модель ANTICIPATE хорошо прогнозирует наличие КЗПГ при циррозе печени с НАСГ, и предложило новую модель с использованием показателя FIB-4 плюс альбумин (FIB4+) для прогнозирования КЗПГ, когда ВКПЭ недоступна 45.
Учитывая стоимость ВКПЭ с помощью Fibroscan®, интересно оценить другие неинвазивные методы диагностики КЗПГ. Хотя большинство исследований были проведены с использованием Fibroscan®, может также существовать место для методов ИСАБ. В связи с этим в обновленном консенсусе Общества радиологов по ультразвуковой эластографии печени 31 было предложено “правило 4” в оценке пациентов с ПХБП, включая пациентов с вирусной этиологией и НАЖБП. По этому сценарию пациенты с ≥17 кПа (2,4 м/с) могут рассматриваться как имеющие КЗПГ. В ней не упоминается о какой-либо разнице в использовании ТСХЭ по сравнению с 2D-СХЭ, хотя указывается, что для более точного ответа относительно уровней отсечения, используемых для прогнозирования различных стадий заболевания, необходимы дополнительные исследования.
Vuille-Lessard и соавт. 46 считают, что для неинвазивного выявления КЗПГ у ПХБП не рекомендуется использовать ТСХЭ. Однако, учитывая, что результаты 2D-СХЭ, вероятно, согласуются с ВКПЭ, гетерогенность пороговых значений (от 16 до 38 кПа) указывает на недостаточную стандартизацию. Хотя метод выглядит многообещающим, ожидается больше данных.
При наблюдении за пациентами с ПХБП ВЖП<20 кПа и тромбоциты >150 000/мм3 указывают на низкую вероятность КЗПГ, что исключает потребность в эндоскопии. Однако эти пациенты должны ежегодно наблюдаться с помощью эластографии. У пациентов с противопоказанием/непереносимостью НСББ эндоскопию следует выполнять, если ВЧД ≥20 кПа и тромбоциты <150 000/мм 35.
Бавено VII рекомендует наблюдать пациентов с ВЧД между 7-10 кПа и продолжающимся поражением печени. Снижение ВЖП коррелирует с меньшим риском декомпенсации и смерти (снижение на ≥20% при ВЖП <20 кПа или снижение до менее чем 10 кПа)5.
Относительно снижения ВЖП, в одном исследовании оценивали неинвазивные тесты для диагностики КЗПГ после излечения гепатита С 47. Они оценивали 418 пациентов с ГПВД≥6 мм рт.ст. и устойчивым вирусологическим ответом (УВО), которые прошли ГПВД после лечения. Триста двадцать четыре пациента также имели парные данные ВЖП/тромбоциты. У этих пациентов была подтверждена декомпенсация у 755 пациентов с СВВ-ПХБП. В когорте ГПВД/неинвазивного тестирования для пациентов с ПХБП распространенность КЗПГ до/после лечения составляла 80% и 54% соответственно. Для определенных значений ВЖП/тромбоциты, ГПВД имела тенденцию к снижению после лечения, что указывает на необходимость применения специфических алгоритмов. Комбинация ВЖП/тромбоциты после лечения обеспечила высокую диагностическую точность у пациентов с КЗПГ с ПХБП (AUC 0,884; 95% ДИ 0,843-0,926). ВЖП<12 кПа и тромбоциты >150 000/мм3 после лечения исключали КЗПГ (чувствительность 99,2%), тогда как ВЖП≥25 кПа было высокоспецифичным для КЗПГ (93,6%). В валидационной когорте 3-летний риск декомпенсации составлял 0% у пациентов, которые соответствовали критериям ВЖП<12 кПа и тромбоцитов >150 000/мм3, тогда как у пациентов с ВЖП≥25 кПа после лечения риск декомпенсации составлял 9,6%. Авторы делают вывод, что неинвазивные тесты могут оценить вероятность развития КЗПГ после лечения гепатита С и спрогнозировать клинические результаты. Таким образом, пациенты с ВЖП<12 кПа и количеством тромбоцитов >150 000/мм3 могут быть выписаны из-под наблюдения за портальной гипертензией при отсутствии кофакторов, тогда как пациенты с ВЖП ≥25 кПа нуждаются в наблюдении/лечении.
В консенсусе Baveno VII 5 предложено, что после устранения/подавления этиологических факторов у пациентов с ПХБП следует проводить наблюдение по критериям de Baveno VI, особенно когда этиология заболевания печени связана с вирусами гепатитов В и С. После СВВ наблюдение больше не требуется, если ВЖП<12 кПа и количество тромбоцитов >150 000/мм3. При ПХБП с использованием НСББ без КЗПГ после устранения/угнетения этиологических факторов рекомендуется эндоскопия через 1-2 года, а при отсутствии ГЭВ – приостановление приема НСББ 48.
Эластография селезенки в диагностике КЗПГ
Жесткость печени коррелирует с выраженностью фиброза печени до порога КЗПГ49. У пациентов с КЗПГ сила корреляции между жесткостью печени и фиброзом уменьшается, что, вероятно, связано с возрастанием роли внепеченочных факторов, особенно с увеличением портального венозного притока по мере прогрессирования портальной гипертензии50. Таким образом, жесткость селезенки была предложена как более специфический метод оценки фиброза печени у пациентов с КЗПГ. Однако еще не проведено исследований, которые бы позволили получить надежные значения отсечения 31.
Показано, что измерение жесткости селезенки (ВЖС) связано с прогрессированием фиброза печени, а у пациентов с инфекцией гепатита В или С ВЖС увеличивается, даже если ИММ не меняется 51,52. Дальнейшие исследования продемонстрировали, что ВЖС положительно коррелирует с ГПВД и имеет хорошие показатели в прогнозировании КЗПГ и ГЭВ у пациентов с ПХГП 53,54. Также было отмечено, что хотя ВЖС и ассоциируется с портальной гипертензией, этого недостаточно для точной оценки ее тяжести 55. Дальнейшие исследования показали, что ВЖС может достоверно исключить наличие ВРВВ у пациентов с циррозом печени независимо от этиологии цирроза 56,57.
Также в недавнем систематическом обзоре и метаанализе оценивали исследования относительно диагностической точности ВЖС в выявлении КЗПГ, тяжелой портальной гипертензии, ГЭВ и ВРВВ у пациентов с ПХБП. В этом исследовании было идентифицировано 32 исследования (3 952 пациента), в которых сообщалось о точности ВЖС в диагностике портальной гипертензии и/или ГЭВ у взрослых с ПХБП. Результаты этого мета-анализа показали, что ВЖС по современным методикам имеет хорошую точность в выявлении портальной гипертензии и ГЭВ у пациентов с ПХБП. AUC для диагностики КЗПГ превышала 90%, а AUC для диагностики любого ГЭВ и ВРВВ достигала 87% и 83% соответственно. ВЖС был способен прогнозировать наличие КЗПГ с хорошей чувствительностью и специфичностью (85% и 86%, соответственно). ВЖС считается перспективным методом выявления портальной гипертензии и ГЭВ с хорошей диагностической точностью, и может быть полезным неинвазивным инструментом наблюдения для клиницистов при ведении пациентов с ПХБП58.
Техника получения данных такая же, как и для печени, за исключением измерения между левыми ребрами в положении пациента лежа на спине или слегка на правом боку. Учитывая, что при низких уровнях фиброза значительного портального давления не ожидается, ВЖП следует проводить только у пациентов с ПХБП31. Оказывается, что ВЖС имеет лучшую корреляцию с портальным давлением, чем ВЖП53. Портальная гипертензия приводит к застойным явлениям в селезенке, увеличивая ее ригидность, и может даже вызвать фиброз селезенки59. У здоровых людей селезенка более жесткая, чем печень. Несколько исследований, большинство из которых были выполнены с помощью виброконтролируемой транзиторной эластографии, показали, что ВЖС является более надежным методом оценки риска КЗПГ и варикозного расширения вен пищевода у пациентов с портальной гипертензией, чем ВЖП53,60,61. Однако существуют различия в значениях отсечения между исследованиями, а уровень доказательности все еще слишком низкий, чтобы рекомендовать ВЖС в диагностике пациентов с циррозом печени31. Ограниченное количество исследований свидетельствует о том, что толщина брюшной стенки и продольный диаметр селезенки являются независимыми предикторами успешного проведения ВЖС59. При использовании 2D СХЭ было продемонстрировано, что у пациентов портальная гипертензия маловероятна в случае ВЖС менее 26,6 кПа (3,0 м/сек)62. Предложены алгоритмы, которые сочетают ВЧП и ВЖС или количество тромбоцитов63. В многоцентровом исследовании, в котором ВЖП и ВЖС были доступны у 109 пациентов, этот алгоритм имел чувствительность 89,2% и специфичность 91,4% для установления диагноза КЗПГ55. Однако в серии из 191 пациента64 этот алгоритм не был валидирован. Консенсус Baveno VII рекомендует использовать ВЖП с использованием ВКПЭ при ПХБП, вызванном вирусным гепатитом, для исключения и подтверждения диагноза КЗПГ (ВЖП <21 кПа и ВЖП >50 кПа, соответственно). Необходима валидация наилучшего отсечения с помощью 100 Гц специфического ВКПЭ-зонда, а также с помощью ТСХЭ и 2D-СХЭ. Кроме того, ВЖП ≤40 кПа с помощью ВКПЭ можно использовать для идентификации пациентов с низкой вероятностью ВВРВ, у которых можно избежать эндоскопии5.
Высокая частота неудач (15-30%), наблюдаемая при ВЖС, в основном при ВКПЭ и 2D-СХЭ, а также верхний предел измерения 75 кПа (специфичный для ВКПЭ) сделали ВКТ сложным для внедрения до сих пор. Использование тех же датчиков и программного обеспечения для ВЖП может быть нецелесообразным, но ВЖС при ВКПЭ значительно улучшилась благодаря использованию специального исследования селезенки при ВКПЭ, где частота СВ устанавливается на уровне 100 Гц вместо 50 Гц46.
ЗАКЛЮЧЕНИЕ
Было бы интересно провести исследование по оценке эволюционных последствий заболевания печени, в котором бы изучалась роль карведилола по сравнению с плацебо у пациентов с КЗПГ, диагностированной с помощью неинвазивных тестов. Мы часто применяли карведилол у пациентов с циррозом печени с признаками КЗПГ при отсутствии противопоказаний. У тех, у кого КЗПГ определяется только с помощью неинвазивных методов (тромбоциты и эластография), мы предлагаем индивидуализировать применение препарата.
ССЫЛКИ НА ИСТОЧНИКИ
- Moon AM, Singal AG, Tapper EB. Contemporary Epidemiology of Chronic Liver Disease and Cirrhosis. Clin Gastroenterol Hepatol 2020;18:2650-66.
- Nader LA, Mattos AA, Bastos GA. Burden of liver disease in Brazil. Liver Int. 2014;34:844-9.
- Abraldes JC, Bureau C, Stefanescu H, Augustin S, Ney M, Blasco H, та співавт. Noninvasive tools and risk of clinically significant portal hypertension and varices in compensated cirrhosis: The “Anticipate” study. Hepatology. 2016;64:2173-84.
- de Franchis R. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015;63:743-52.
- de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C. Baveno VII Faculty. Baveno VII – Renewing consensus in portal hypertension. J Hepatol. 2022;76:959-74.
- D’Amico G, Morabito A, D’Amico M, Pasta L, Malizia G, Rebora P, et al. Clinical states of cirrhosis and competing risks. J Hepatol. 2018;68:563-76.
- Magaz M, Baiges A, Hernández-Gea V. Precision medicine in variceal bleeding: Are we there yet? J Hepatol. 2020;72:774-84.
- John JA, de Mattos AA, da Silva Miozzo SA, Comerlato PH, Porto M, Contiero P, et al. Survival and risk factors related to death in outpatients with cirrhosis treated in a clinic in Southern Brazil. Eur J Gastroenterol Hepatol. 2015;27:1372-7.
- EASL/ALEH. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63:237-64.
- Ding N, Nguyen T, Iser DM, Hong T, Flanagan E, Wong A, et al. Liver stiffness plus platelet count can be used to exclude high-risk oesophageal varices. Liver Int. 2016;36:240-5.
- Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology. 2017;65:310-35.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018;69:406-46.
- Mattos AZ, Schacher FC, Neto GJ, Mattos AA. Screening for esophageal varices in cirrhotic patients – Non-invasive methods. Ann Hepatol. 2019;18:673-678.
- Jakab S, Garcia-Tsao G. Screening and Surveillance of Varices in Patients With Cirrhosis. Clin Gastroenterol Hepatol . 2019;17:26-9.
- Lens S, Baiges A, Alvarado-Tapias E, LLop E, Martinez J, Fortea JI, et al. Clinical outcome and hemodynamic changes following HCV eradication with oral antiviral therapy in patients with clinically significant portal hypertension. J Hepatol. 2020;73:1415-24.
- Garbuzenko DV, Arefyev NO. Primary prevention of bleeding from esophageal varices in patients with liver cirrhosis: An update and review of the literature. J Evid Based Med. 2020;13:313-24.
- Villanueva C, Albillos A, Genescà J, Abraldes JG, Calleja JL, Aracil C, et al. Development of hyperdynamic circulation and response to β-blockers in compensated cirrhosis with portal hypertension. Hepatology. 2016;63:197-206.
- Villanueva C, Albillos A, Genescà J, Garcia-Pagan JC, Calleja JL, Aracil C, et al. β blockers to prevent decompensation of cirrhosis in patients with clinically significant portal hypertension (PREDESCI): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet. 2019;393:1597-1608.
- Groszmann RJ, Garcia-Tsao G, Bosch J, Grace ND, Burroughs AK, Planas R, et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. Portal Hypertension Collaborative Group. N Engl J Med. 2005;353:2254-61.
- Turco L, Villanueva C, La Mura V, García-Pagán JC, Reiberger T, Genescà J, et al. Lowering Portal Pressure Improves Outcomes of Patients With Cirrhosis, With or Without Ascites: A Meta-Analysis. Clin Gastroenterol Hepatol . 2020;18:313-27.
- Garcia-Tsao G, Abraldes JG. Non-selective beta-blockers in compensated cirrhosis: Preventing variceal hemorrhage or preventing decompensation? Gastroenterology. 2021;161:770-3.
- Rabiee A, Garcia-Tsao G, Tapper EB. Nonselective Beta-Blockers in Portal Hypertension: Why, When, and How? Clin Liver Dis (Hoboken). 2022;19:118-23.
- Villanueva C, Torres F, Sarin SK, Shah HÁ, Tripathi D, Brujats A, et al. Carvedilol reduces the risk of decompensation and mortality in patients with compensated cirrhosis in a competing-risk meta-analysis. J Hepatol. 2022;77:1014-25.
- Serper M, Kaplan DE, Taddei TH, Tapper EB, Cohen JB, Mahmud N. Nonselective beta blockers, hepatic decompensation, and mortality in cirrhosis: A national cohort study. Hepatology. 2023;77:489-500. doi: 10.1002/hep.32737.
- Jakab SS, Garcia-Tsao G. Evaluation and Management of Esophageal and Gastric Varices in Patients with Cirrhosis. Clin Liver Dis . 2020;24:335-50.
- Dietrich CF, Bamber J, Berzigotti A, Bota S, Cantisani V, Castera L, et al. EFSUMB Guidelines and Recommendations on the Clinical Use of Liver Ultrasound Elastography, Update 2017 (Long Version). Ultraschall Med. 2017;38:e48.
- Petitclerc L, Sebastiani G, Gilbert G, Cloutier G, Tang A. Liver fibrosis: Review of current imaging and MRI quantification techniques. J Magn Reson Imaging. 2017;45:1276-95.
- Ferraioli G, Filice C, Castera L, Choi BI, Sporea I, Wilson SR, et al. WFUMB guide-lines and recommendations for clinical use of ultrasound elastography: part3: liver. Ultrasound Med Biol. 2015;41:1161-79.
- Tang A, Cloutier G, Szeverenyi NM, Sirlin CB. Ultrasound elastography and MRelastography for assessing liver fibrosis: part 1, principles and techniques. AJRAm J Roentgenol. 2015;205:22-32.
- Tang A, Cloutier G, Szeverenyi NM, Sirlin CB. Ultrasound elastography andMR elastography for assessing liver fibrosis: part 2, diagnostic performance, confounders, and future directions. AJR Am J Roentgenol. 2015;205:33-40.
- Barr G, Wilson SR, Rubens D, Garcia-Tsao G, Ferraioli G. Update to the society of radiologists in ultrasound liver elastography consensus statement. Radiology. 2020;296:263-74.
- Friedrich-Rust M, Poynard T, Castera L. Critical comparison of elastography methods to assess chronic liver disease. Nat Rev Gastroenterol Hepatol. 2016;13:402-11.
- Ferraioli G. Review of Liver Elastography Guidelines. J Ultrasound Med. 2019;38:9-14.
- Sandrin L, Fourquet B, Hasquenoph JM, Yon S, Fournier C, Mal F, et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol . 2003;29:1705-13.
- Fraquelli M, Rigamonti C, Casazza G, Conte D, Donato MF, Ronchi G, et al. Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease. Gut. 2007;56:968-73.
- Babu AS, Wells ML, Teytelboym OM, Mackey JE, Miller FH, Yeh BM, et al. Elastography in Chronic Liver Disease: Modalities, Techniques, Limitations, and Future Directions. Radiographics. 2016;36:1987-2006.
- Bonekamp S, Kamel I, Solga S, Clark J. Can imaging modalities diagnose and stage hepatic fibrosis and cirrhosis accurately? J Hepatol. 2009;50:17-35.
- Patel K, Sebastiani G. Limitations of non-invasive tests for assessment of liverfibrosis. JHEP Rep. 2020;2:100067.
- Barr RG, Ferraioli G, Palmeri ML, Goodman ZD, Garcia-Tsao G, Rubin J, et al. Elastography Assessment of Liver Fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement. Ultrasound Q. 2016;32:94-107.
- Venkatesh SK, Yin M, Takahashi N, Glockner JF, Talwalkar JA, Ehman RL. Non-invasive detection of liver fibrosis: MR imaging features vs. MR elastography. Abdom Imaging. 2015;40:766-75.
- Park CC, Nguyen P, Hernandez C, Bettencourt R, Ramirez K, Fortney L, et al. Magnetic Resonance Elastography vs Transient Elastography in Detec¬tion of Fibrosis and Noninvasive Measurement of Steatosis in Patients With Biopsy-Proven Nonalcoholic Fatty Liver Disease. Gastroenterology. 2017;152:598-607.
- Lim JK, Flamm SL, Singh S, Falck-Ytter YT. Clinical Guidelines Committee of the American Gastroenterological Association. American Gastroen¬terological Association Institute Guideline on the Role of Elastography in the Evaluation of Liver Fibrosis. Gastroenterology. 2017;152:1536-43.
- Pons M, Augustin S, Scheiner B, Guillaume M, Rosselli M, Rodrigues SG, et al. Noninvasive Diagnosis of Portal Hypertension in Patients With Compensated Advanced Chronic Liver Disease. Am J Gastroenterol. 2021;116:723-32.
- Bassegoda O, Olivas P, Turco L, Mandorfer M, Serra-Burriel M, Tellez L, et al. Decompensation in Advanced Nonalcoholic Fatty Liver Disease May Occur at Lower Hepatic Venous Pressure Gradient Levels Than in Patients With Viral Disease. Clin Gastroenterol Hepatol . 2022;20:2276-2286.e6.
- Rabiee A, Deng Y, Ciarleglio M, Chan JL, Pons M, Genesca J, Garcia-Tsao G. Noninvasive predictors of clinically significant portal hypertension in NASH cirrhosis: Validation of ANTICIPATE models and development of a lab-based model. Hepatol Commun. 2022;6:3324-34.
- Vuille-Lessard E, Rodrigues SG, Berzigotti A. Noninvasive Detection of Clinically Significant Portal Hypertension in Compensated Advanced Chronic Liver Disease. Clin Liver Dis . 2021;25:253-89.
- Semmler G, Lens S, Meyer EL, Baiges A, Alvardo-Tapias E, Llop E, et al. Non-invasive tests for clinically significant portal hypertension after HCV cure. J Hepatol. 2022;77:1573-85.
- Tosetti G, Degasperi E, Farina E, D’Ambrosio R, Soffredini R, Borghi M, et al. Decompensation in Direct-Acting Antiviral Cured Hepatitis C Virus Compensated Patients With Clinically Significant Portal Hypertension: Too Rare to Warrant Universal β-Blocker Therapy. Am J Gastroenterol . 2021;116:1342-4.
- Berzigotti A. Non-invasive evaluation of portal hypertension using ultrasound elastography. J Hepatol. 2017;67:399-411.
- Augustin S, Pons M, Maurice JB, Maurice JB, Bureau C, Stefanescu H, et al. Expanding the Baveno VI criteria for the screening of varices in patients with compensated advanced chronic liver disease. Hepatology. 2017;66:1980-8.
- Leung VY, Shen J, Wong VW, Abrigo J, Wong GL, Chim AM, et al. Quantitative elastography of liver fibrosis and spleen stiffness in chronic hepatitis B carriers: comparison of shear-wave elastography and transiente elastography with liver biopsy correlation. Radiology. 2013;269:910-8.
- Pawluś A, Inglot M, Chabowski M, Szymańska K, Inglot M, Patyk M, et al. Shear wave elastography (ЗХЕ) of the spleen in patients with hepatitis B and C but without significant liver fibrosis. Br J Radiol. 2016;89:20160423.
- Colecchia A, Montrone L, Scaioli E, Bacchi-Reggiani ML, Colli A, Casazza G, et al. Measurement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis. Gastroenterology. 2012;143:646-54.
- Abe H, Midorikawa Y, Matsumoto N, Moriyama M, Shibutani K, Okada M, et al. Prediction of esophageal varices by liver and spleen MR elastography. Eur Radiol. 2019;29:6611-9.
- Jansen C, Bogs C, Verlinden W, Thiele M, Möller P, Görtzen J, et al. Shear-wave elastography of the liver and spleen identifies clinically significant portal hypertension: a prospective multicentre study. Liver Int. 2017;37:396-405.
- Takuma Y, Nouso K, Morimoto Y, Tomokuni J, Sahara A, Toshikuni N, et al. Measurement of spleen stiffness by acoustic radiation force impulse imaging identifies cirrhotic patients with esophageal varices. Gastroenterology. 2013;144:92-101.e102
- Karagiannakis DS, Voulgaris T, Koureta E, Chloupi E, Papatheodoridis GV, Vlachogiannakos J. Role of spleen stiffness measurement by 2D-shear wave elastography in ruling out the presence of high-risk varices in cirrhotic patients. Dig Dis Sci. 2019;64:2653-60.
- Hu X, Huang X, Hou J, Ding L, Su C, Meng F. Diagnostic accuracy of spleen stiffness to evaluate portal hypertension and esophageal varices in chronic liver disease:a systematic review and meta-analysis. Eur Radiol. 2021;31:2392-2404.
- Mejias M, Garcia-Pras E, Gallego J, Mendez R, Bosch J, Fernandez M. Relevance of the mTOR signaling pathway in the pathophysiology of splenomegaly in rats with chronic portal hypertension. J Hepatol. 2010;52:529-39.
- Manatsathit W, Samant H, Kapur S, Ingviya T, Esmadi M, Wijarnpreecha K, et al. Accuracy of liver stiffness, spleen stiffness, and LS-spleen diameter to platelet ratio score in detection of esophageal varices: Systemic review and meta-analysis. J Gastroenterol Hepatol. 2018;33:1696-1706.
- Ma X, Wang L, Wu H, Feng Y, Han X, Bu H, et al. Spleen Stiffness Is Superior to Liver Stiffness for Predicting Esophageal Varices in Chronic Liver Disease: A Meta-Analysis. PLoS One. 2016;11:e0165786.
- Jansen C, Bogs C, Verlinden W, Thiele M, Möller P, Görtzen J, et al. Algorithm to rule out clinically significant portal hypertension combining Shear-wave elastography of liver and spleen: a prospective multicentre study. Gut. 2016;65:1057-8.
- Colecchia A, Ravaioli F, Marasco G, Colli A, Dajti E, Di Biase AR, et al. A combined model based on spleen stiffness measurement and Baveno VI criteria to rule out high-risk varices in advanced chronic liver disease. J Hepatol. 2018;69:308-17.
- Elkrief L, Ronot M, Andrade F, Dioguardi Burgio M, Issoufaly T, Zappa M, et al. Non-invasive evaluation of portal hypertension using shear-wave elastography: analysis of two algorithms combining liver and spleen stiffness in 191 patients with cirrhosis. Aliment Pharmacol Ther. 2018;47:621-30.