Авторы: Divya Singh, Ladbans Kaur
РЕЗЮМЕ:
На протяжении многих лет кесарево сечение сыграло ключевую роль в снижении материнской и перинатальной заболеваемости и смертности. С ростом тенденции этой операции, значительному числу беременных женщин проводится кесарево сечение. Рубец после операции может служить местом развития серьезной патологии при последующих беременностях, а именно: беременности в зоне кесарева рубца, патологического прикрепления и приращения плаценты и расхождения краев рубца. Сонографическое исследование стало надежным инструментом для диагностики этих потенциально опасных для жизни состояний. В этом обзоре освещаются ключевые сонографические особенности различных осложнений, которые могут возникать на участке рубца после кесарева сечения при последующих беременностях.
КЛЮЧЕВЫЕ СЛОВА:
кесарево сечение; рубец; беременность; ультразвук; патологическое прикрепление и приращение плаценты
ВВЕДЕНИЕ
Кесарево сечение является одной из наиболее часто выполняемых операций у женщин. Эта процедура прошла долгий путь для сокращения как перинатальной, так и материнской заболеваемости и смертности. В последнее время наблюдается тенденция к снижению частоты кесарева сечения. Частота повторного кесарева сечения в Соединенных Штатах составляет 91%. Как и любая другая операция, у нее есть определенные непосредственные, отсроченные и отдаленные осложнения. Частота осложнений выше после проведения экстренных процедур, чем после плановых. Рубец после кесарева сечения может служить местом развития патологических состояний при последующих беременностях, а именно, беременности кесарева рубца (БКР), патологического прикрепления плаценты (ППП) и расхождение/разрыв рубца. Эти патологические процессы могут вызывать значительную материнскую и перинатальную заболеваемость. Знание этих состояний является обязательным, и их следует выявлять как можно скорее, для того чтобы провести своевременное и эффективное вмешательство. Будучи безопасным и широко доступным, ультразвуковое исследование (УЗИ) является методом выбора визуальной диагностики этих состояний.
БЕРЕМЕННОСТЬ В РУБЦЕ ПОСЛЕ КЕСАРЕВА СЕЧЕНИЯ
БКР – это редкий тип внематочной беременности. Она встречается в 1:1800-1:2226 всех беременностей. Однако наблюдается устойчивый рост развития БКР. Это можно объяснить увеличением частоты кесарева сечения, а также ранним выявлением при проведении УЗИ с высоким разрешением.
ПАТОГЕНЕЗ
Точный патогенез БКР неизвестен. Предполагается, что эта патология связана с имплантацией бластоциста в соединительную ткань при клиновидном дефекте миометрия в рубце в переднем нижнем сегменте матки (НСМ). Полагают, что этот дефект является следствием неполного заживления или чрезмерного фиброза. Vial и др. описали два типа БКР. Первый тип возникает в результате имплантации амниотического мешка на участок рубца, что приводит к развитию беременности в шейно-перешеечном пространстве и полости матки. Второе – следствие глубокой имплантации в дефект кесарева рубца с прогрессированием и развитием кровотечения и разрыва в течение первого триместра. Хотя рубец после беременностей чаще всего наблюдают после кесарева сечения, об его развитии также сообщается после таких процедур, как дилатация и кюретаж, миомэктомия, метропластика, гистероскопия и ручное удаление плаценты. Большинство БКР развиваются у женщин, у которых было два или более кесарева сечения. Множественные операции увеличивают риск развития фиброза на месте рубцов, что препятствует нормальному заживлению, а также приводит к увеличению площади поверхности рубца, тем самым возрастает вероятность БКР. Считается, что БКР является предшественником ППП, так как оба процесса имеют одинаковое гистопатологическое строение. Если это состояние остается не диагностированным, БКР может вызвать разрыв матки и массивное кровотечение с катастрофическими последствиями. Поэтому важно как можно раньше диагностировать БКР для проведения соответствующих лечебных мероприятий.
УЛЬТРАЗВУКОВЫЕ ОСОБЕННОСТИ
Первоначально выполняется трансабдоминальная сонография с оптимально заполненным мочевым пузырем с целью общего осмотра органов таза и взаимоотношений между маткой и мочевым пузырем. Однако она имеет более низкое разрешение и поэтому исключительно на это исследование полагаться нельзя. Трансвагинальная УЗИ является методом выбора для обнаружения БКР. Были предложены различные ультразвуковые критерии для диагностики БКР в первом триместре. К ним относятся: пустая полость матки с четко очерченным эндометрием; пустой шеечный канал; наличие гестационного мешка (ГМ) на месте рубца, то есть в передней стенке НСМ, истонченный (<5 мм) или отсутствующий миометрий между ГМ и мочевым пузырем, и высокоскоростной (> 20 см/с) с низким импедансом (индекс пульсативности <1) перитрофобластный поток вокруг мешка на цветной доплерограмме. В недавнем исследовании Timor-Tritsch и др. использовали расположение центра ГМ между 5 и 10 неделями беременности, в качестве признака, который помогал дифференцировать БКР от внутриутробной беременности с чувствительностью и специфичностью 93% и 98,9% соответственно. Эта идея была основана на том наблюдении, что большинство БКР расположены ближе к средней оси матки, тогда как большинство нормальных внутриутробных беременностей расположены более дистально.
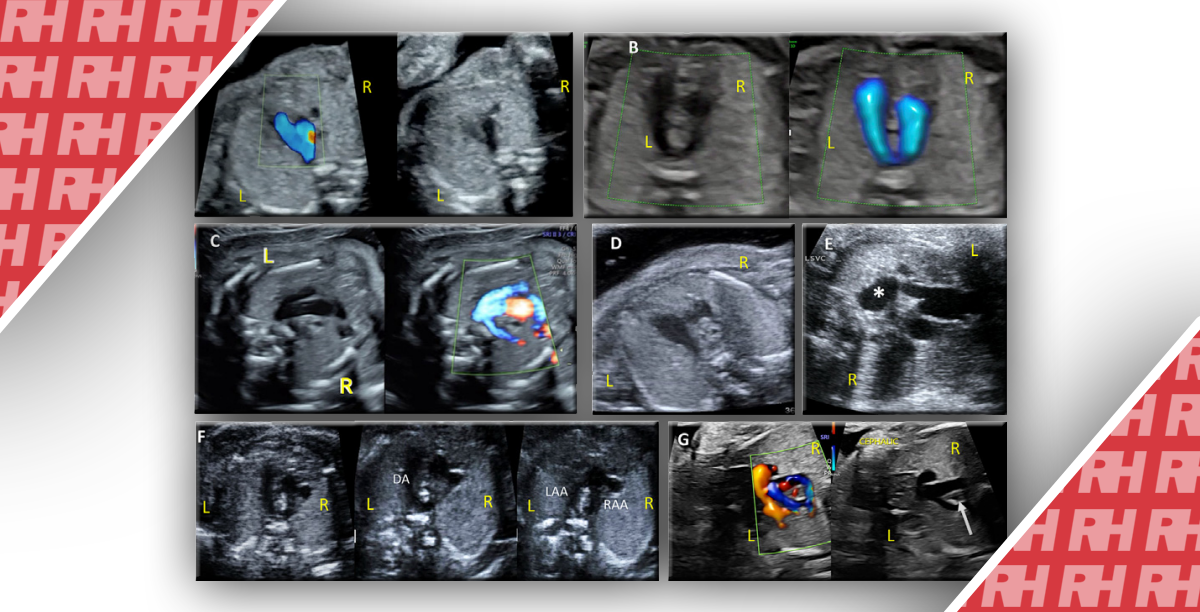
На рисунке 1 показан случай БКР, при исследовании с помощью двумерного и трехмерного ультразвукового исследования. Добавление трехмерного УЗИ дает панорамный вид взаимоотношений ГМ с полостью матки, миометрием и стенкой мочевого пузыря. УЗИ также эффективно для динамического наблюдения за пациентами, которые лечатся консервативно.
Рис. 1. Беременность кесарева рубца на 7 неделе беременности. (A) Трансабдоминальная продольная сонограмма таза с мочевым пузырем (BL) (который обеспечивает акустическое окно) показывает пустую полость матки (UT) с низко расположенным ГМ (стрелка), вблизи шейки (CX). (B) Трансвагинальная сагиттальная сонограмма показывает низкую имплантацию ГМ вблизи шейки матки (CX) на месте рубца с почти незаметным гипоэхогенным миометрием перед эхогенной трофобластической тканью (*). (C) Трансвагинальная сагиттальная доплерограмма показывает перитрофобластную васкуляризацию. (D) Трансвагинальная продольная сонограмма матки показывает желточный мешок (белая стрелка) и фетальный полюс (красная стрелка) внутри ГМ. (E) Коронарное трехмерное объемное контрастное Omniview изображение показывает взаимоотношение гестационного мешка и пустой полости матки (CAV) и шейки матки (CX). Обратите внимание на нормальный гипоэхогенный миометрий (*). Трофобластическая ткань «выпирает» через истонченный миометрий на участке рубца после кесарева сечения.
Измерение объема ГМ и степени васкуляризации можно использовать для оценки ответа на проводимое лечение. Магнитно-резонансная томография (МРТ) редко необходима для диагностики БКР. Однако она применяется в случаях неоднозначных результатов исследований.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Возможной диагностической дилеммой является дифференциальная диагностика беременности в рубце от самопроизвольного аборта или шеечной эктопической беременности. Первым этапом визуализации, который позволяет отличить шеечную эктопию от БКР, является местоположение эктопии в канале шейки при нормальной толщине миометрия спереди. Классическая БКР расположена в НСМ с истонченным миометрием спереди. При цветной доплерографии в случае самопроизвольного аборта отсутствует нормальный перитрофобластный поток. ГМ в шейке матки можно смещать путем нежной компрессии с помощью эндовагинального датчика. Наконец, в случае самопроизвольного аборта во время динамического ультразвукового наблюдения можно обнаружить, что гестационный мешок не фиксирован в каком-либо месте и при этом не увеличивается в размере.
ЛЕЧЕНИЕ
Существуют консервативные и хирургические варианты, которые доступны для лечения БКР. Однако не существует единого мнения об оптимальном протоколе лечения. Из-за развития серьезных последствий рекомендуется раннее прерывание беременности. План лечения должен быть адаптирован к каждому случаю с учетом гестационного возраста, жизнеспособности и плана будущей беременности. Консервативное лечение включает местную инстилляцию эмбриоцидных продуктов, таких как метотрексат, хлорид калия и гипертоническая глюкоза. Эти препараты могут вводиться в ГМ под ультразвуковым наведением из трансабдоминального, либо трансвагинального доступа. Трансвагинальный подход имеет преимущество, поскольку он позволяет лучше визуализировать иглу, обеспечивает более короткую траекторию иглы и снижает риск повреждения мочевого пузыря. В недавнем обзоре литературы Cheung и др. зарегистрировали долю успешных процедур при местном применении метотрексата – 73,9%. Использовалось также системное введение метотрексата. Для достижения оптимальных результатов при системном применении метотрексата рекомендуется чтобы уровень сыворотки был менее 5000 мМЕ/мл β-субъединицы человеческого хорионического гонадотропина (ß-ХГЧ ). Иногда потребуется несколько доз из-за короткого периода полувыведения и медленной системной абсорбции. В ходе экспертного обзора частота осложнений при системном использовании метотрексата составила 62%. Это объясняется медленным действием препарата и его сомнительной способностью вызывать остановку сердечной деятельности и расширение плаценты. В некоторых случаях ожидание эффекта от препарата приводило к росту ГМ, эмбриона и плацентарной васкуляризации, что в результате способствовало увеличению осложнений. Также было предложено сочетание местной и системной терапии. Timor-Tritsch и др. сообщили об успешном лечении 19 случаев БКР с использованием комбинированных внутримышечного и внутриматочного введений метотрексата. Также для лечения БКР использовалась эмболизация маточной артерии в комбинации с метотрексатом.
Консервативное лечение помогает избежать операции с сохранением фертильности. Оно подходит для неразорвавшейся БКР у гемодинамически стабильной пациентки с гестационным возрастом менее 8 недель и тонким (<2 мм) передним миометрием между ГМ и мочевым пузырем. Тщательный мониторинг пациентки после проведения процедуры имеет важное значение, поскольку может возникать угрожающее жизни кровотечение. Выведение ß-ХГЧ может занять до 9 недель, в то время как очищение от ГМ может занять до 3 месяцев после проведения консервативного лечения. Пациентке следует следить еженедельно за уровнем ß-ХГЧ в сыворотке до тех пор, пока он не станет < 5 мМЕ/мл. Некоторые авторы рекомендуют проводить ежемесячные трансвагинальные ультразвуковые исследования (ТВУЗИ) для оценки остаточных элементов беременности. Интересным наблюдением, которое было отмечено после проведения консервативного лечения, является транзиторное повышение уровня сывороточного ß-ХГЧ, объема ГМ и его васкуляризации. Это явление объясняется некрозом трофобластов, что приводит к высвобождению ß-ХГЧ. Трофобластический некроз вызывает перитофобластную воспалительную реакцию, которая приводит к увеличению объема и васкуляризации мешка. Это транзиторное повышение не должно быть ошибочно воспринято, как отсутствие ответа на проводимое лечения. В подобном случае рекомендуется выжидательная тактика. Пока уровень сывороточного β-ХГЧ снижается, ультразвуковое исследование показано только в том случае, если у пациентки появляются новые симптомы.
Хирургические варианты лечения включают аспирацию ГМ или его удаление с помощью гистероскопии, лапароскопии или лапаротомии. Открытая хирургия может быть предпочтительным методом лечением у пациенток с более поздним гестационным сроком или после неудачных консервативных мероприятий. Тем не менее, такая операция связана с риском длительного периода послеоперационного восстановления, ухудшения фертильности и развития патологического прикрепления и приращения плаценты при последующей беременности. Дилатация и выскабливание не рекомендуется, так как это может привести к повреждению стенки матки и мочевого пузыря, что приводит к профузному кровотечению. Описана новая, минимально инвазивная методика с использованием катетера с двойным баллоном для расширения шейки матки для лечения пациентов с БКР и цервикальной беременностью. Однако она требует дальнейшего изучения.
Не существует рекомендаций относительно необходимого времени покоя до следующей беременности. Некоторые авторы предлагают избегать беременности в течение 12-24 месяцев. Исследование показало хорошие результаты репродуктивности у женщин с БКР, которым было проведено нехирургическое лечение в первом триместре. Это подчеркивает необходимость ранней диагностики для своевременного вмешательства.
ПАТОЛОГИЧЕСКОЕ ПРИКРЕПЛЕНИЕ ПЛАЦЕНТЫ
ППП относится к аномальной имплантации плаценты к миометрию матки. Этот термин охватывает приросшую, врастающую и прорастающую плаценту. Эти варианты характеризуются различной степенью проникновения плацентарных трофобластических ворсинок в миометрий матки. При приросшей плаценте (placenta accreta) отмечается связь ворсинок с миометрием. При врастающей плаценте (placenta increta) они внедряются в миометрий, а при прорастающей плаценте (placenta percreta) они проникают в миометрий, а также в серозный слой. Из всех ППП 75% – это приросшая плацента, 18% – врастающая, а 7% – прорастающая плацента.
Необходимо обнаруживать аномальную плацентацию как можно раньше, поскольку при этом состоянии повышается частота развития осложнений и смертности. Это патология была впервые описана в 1937 году. В настоящее время частота приросшей плаценты составляет 3 на 1000 родов. Увеличение ее распространенности, вероятно, связано с увеличением числа выполняемых кесаревых сечений.
ФАКТОРЫ РИСКА
Кесарево сечение в анамнезе и предлежание плаценты являются двумя наиболее важными предрасполагающими факторами развития ППП. Риск приросшей плаценты при наличии предлежания плаценты у пациентки с тремя предшествующими кесаревыми сечениями достигает 40%, по сравнению с менее 1%, в случае отсутствия предлежания плаценты. Следовательно, наличие предлежания плаценты у пациентки с наличием кесарева рубца служит «красным флагом» для возможного плацентарного приращения. Другими факторами риска являются: пожилой возраст матери, многоплодная беременность, предшествующие хирургические вмешательства на матке, абляция эндометрия, синдром Ашермана, лейомиомы матки, аномалии матки, гипертоническая болезнь во время беременности и курение.
Точное патогенетическое обоснование ППП остается загадкой. Считается, что это состояние связано с патологической децидуализацией и чрезмерной трофобластической пролиферацией на месте рубца.
УЛЬТРАЗВУКОВЫЕ ОСОБЕННОСТИ
Ультразвуковая визуализация, которая включает как исследование в оттенках серого, так и цветную доплерографию, является первой линией диагностики у пациенток с риском развития ППП. ТВУЗИ – это метод выбора, поскольку он позволяет получать изображения с высоким разрешением плаценты и смежных с ней структур. Несколько ультразвуковых находок приросшей плаценты были описаны во втором и третьем триместре беременности. К признакам, которые характеризуют данное состояние, относятся: наличие предлежания плаценты, аномальные лакуны плаценты, потеря нормальной гипоэхогенной ретроплацентарной чистой зоны, толщина ретроплацентарного миометрия <1 мм, выпячивание плаценты за пределы серозной оболочки матки, локальное экзофитное образование, которое проходит через щель в серозной оболочке матке, аномалии взаиморасположения матки и мочевого пузыря. Характерными особенностями по данным цветной доплерографии являются: турбулентный поток в лакунах плаценты, наличие сосудистых мостиков и утеро-везикальная и субплацентарная гиперваскуляризация. Не так давно «Европейская рабочая группа по аномально инвазивной плаценте» предложила стандартизированные определения ультразвуковых дескрипторов ППП. Каждый дескриптор был связан с характерными изображениями на сонограмме. Использование стандартизованной терминологии позволит обеспечить единообразие в описании аномальной плацентации, которая будет полезна для клинических, образовательных и исследовательских целей.
Плацентарные лакуны представляют собой гипоэхогенные пространства неправильной формы в ткани плаценты, которые имеют нечеткие края и характеризуются турбулентным потоком. В отличие от них, плацентарные озера более округлые и характеризуются ламинарным потоком. Множественные лакуны могут придавать плаценте вид «швейцарского сыра» или «изъеденного молью». Наличие лакун имеет чувствительность 80% -90% для диагностики приросшей плаценты во втором триместре. Плацентарные лакуны были оценены Finberg и Williams следующим образом: 0-я степень, когда лакуны не видны; 1-я степень, когда имеется 1-3 небольших лакуны; 2-я степень, если имеется 4-6 больших и более аномальных лакун; 3-я степень, когда вдоль всей плаценты определяется отдельные аномальные лакуны. Важно отметить, что диагностировались случаи приросшей плаценты без наличия сосудистых лакун.
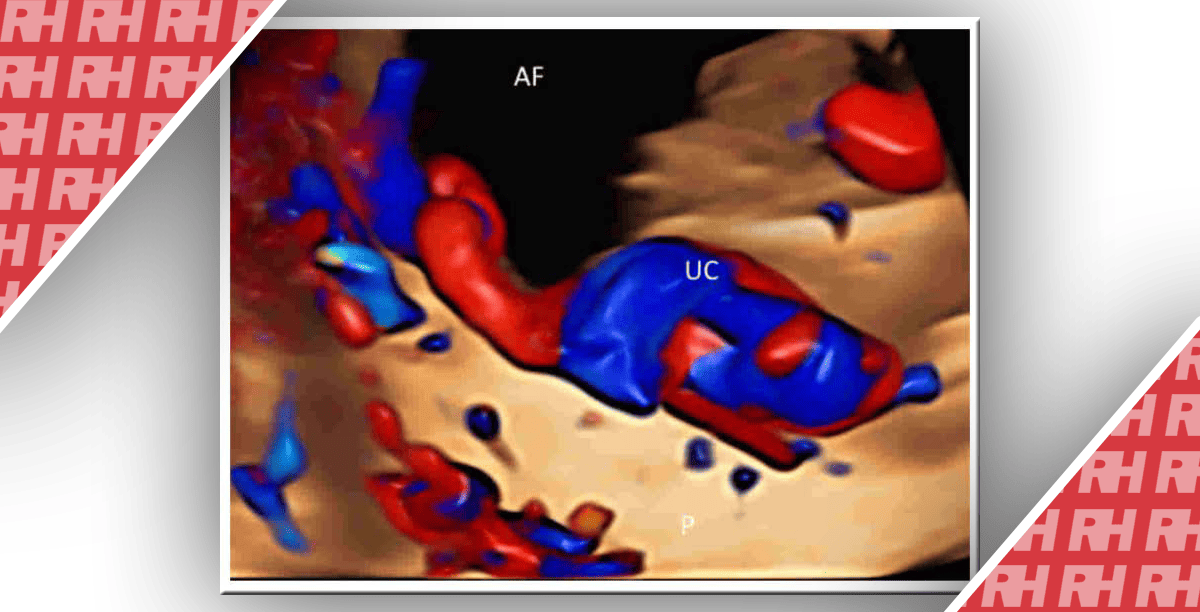
Нормальное ретроплацентарное пространство определяется как гипоэхогенная зона между плацентой и маткой. Исчезновение этого пространства является маркером приросшей плаценты с чувствительностью – 52% и специфичностью – 57%. Визуализация ретроплацентарного пространства зависит от угла инсонации. Следует учитывать вероятность артефактной невизуализации пространства в случае переднего расположения плаценты, что приводит к ложноположительной диагностике. Поэтому исчезновение ретроплацентарного пространства не должно интерпретироваться изолированно. На рис. 2 показан случай приросшей плаценты у пациентки с двумя предшествующими кесаревыми сечениями и предлежанием плаценты в имеющейся беременности.
Рис. 2. Приросшая плацента на 21 неделе беременности. (A) Сагиттальная трансвагинальная цветная доплерограмма показывает плаценту, которая расположена спереди и прикрывает внутренний зев матки. Определяется повышенная субплацентарная васкуляризация. PL – плацента; BL – мочевой пузырь; CX – шейка матки. (B) Трансвагинальная сонограмма плаценты в оттенках серого показывает анэхогенные лакуны (*). (C) Трансвагинальная сагиттальная сонограмма демонстрирует исчезновение ретроплацентарного чистого пространства (стрелки). PL – плацента; BL – мочевой пузырь. (D) Трехмерная томографическая сонографическая визуализация отражает степень аномальной васкуляризации. (E) Объемное трехмерное трансвагинальное доплеровское изображение демонстрирует интенсивную васкуляризацию на границе матки и мочевого пузыря. PL – плацента; BL – мочевой пузырь. (F) Объемная трехмерная сонограмма демонстрирует картину плаценты в виде «швейцарского сыра» из-за многочисленных лакун. PL – плацента; BL – мочевой пузырь.
Ретроплацентарная толщина миометрия измеряется между эхогенной серозной оболочкой матки и ретроплацентарными сосудами. Толщина менее 1 мм была идентифицирована как фактор риска плацентарной инвазии с чувствительностью – 100% и специфичностью – 72%.
Нормальная граница между серозной оболочкой матки и стенкой мочевого пузыря определяется как гладкая, тонкая эхогенная линия без сосудистых сигналов. В случае плацентарной инвазии эта линия образует выпячивания неправильной формы, определяются варикозно расширенные вены и повышенная васкуляризация.
Прорастающая плацента диагностируется тогда, когда плацентарная ткань определяется в мочевом пузыре. Повышенная субплацентарная васкуляризация, утеро-везикальная васкуляризация и наличие аномальных сосудов, которые простираются от плаценты до мочевого пузыря и нарушают привычную границу между маткой и мочевым пузырем, являются признаками приросшей плаценты при цветной доплерографии. Трехмерное УЗИ дает глобальную картину внутриплацентарной гиперваскуляризации в случаях плацентарной инвазии.
В недавнем метаанализе D’Antonio и др. сообщили о чувствительности – 91% и специфичности – 97% для УЗИ в диагностике ППП. Они отметили, что среди различных ультразвуковых признаков, наличие аномальной васкуляризации при цветной доплерографии было наиболее чувствительным, в то же время аномалия границы матки и мочевого пузыря была наиболее специфическим признаком. Наличие плацентарных лакун и исчезновение ретроплацентарного чистого пространства не соответствовали ультразвуковым данным плацентарной инвазии. Исследователи предложили балльную систему оценки для прогнозирования плацентарной инвазии, объединив клинические и ультразвуковые параметры. Rac и др. разработали «Индекс приросшей плаценты». Он основан на количестве предыдущих кесаревых сечений, наличии плацентарных лакун 2-й и 3-й степени, наименьшей толщине миометрия в сагиттальной плоскости и наличии переднего предлежания плаценты и сосудистых мостиков. Полученный таким образом индекс приросшей плаценты определяет вероятность, чувствительность, специфичность и прогностическую ценность плацентарной инвазии, которые могут определять тактику лечения. Недавно Tovbin и др. предложили систему балльной оценки для прогнозирования ППП, используя число предыдущих кесаревых сечений и несколько ультразвуковых параметров в серой шкале и цветной доплерографии. В своем проспективном исследовании система балльной оценки была достаточно прогностически точной для ППП.
В настоящее время основное внимание уделяется раннему выявлению приросшей плаценты, для обеспечения соответствующей консультативной помощи и планирования направления дальнейших действий. Характерные ультразвуковые прогностические признаки приросшей плаценты в первом триместре включают: низкая имплантация ГМ в полости матки вблизи послеоперационного рубца, множественные пространства неправильной формы в плацентарном сосудистом ложе, тонкая передняя часть миометрия в сагиттальной плоскости. Толщина миометрия <2 мм, который расположен над плацентой в первом триместре, связана с ППП при родах.
МРТ не является первой линией диагностики при приросшей плаценте. Эта методика зарезервирована для случаев, когда плацента имеет заднее расположение или у пациенток с ожирением, когда ультразвуковое исследование является субоптимальным. Palacios и др. оценивали эффективность МРТ в диагностике приращения плаценты и обнаружили, что МРТ не добавляла диагностической информации к данным УЗИ. Однако МРТ более подробно описывала степень плацентарной инвазии, что потенциально могло бы помочь в планировании хирургического лечения.
ЛЕЧЕНИЕ
ППП является потенциально опасным для жизни состоянием. Его лечение требует усилий согласованной многодисциплинарной команды. Среди осложнений встречаются: массивные кровотечения, травмы мочеполовой системы, эмболии амниотической жидкостью, коагулопатия потребления, гемотрансфузионные осложнения, острый респираторный дистресс-синдром, послеоперационная тромбоэмболия, сепсис и полиорганная недостаточность. Родоразрешение выполняется хирургическим методом. Однако оптимального хирургического подхода на данный момент пока не установлено. Обычно рекомендуется избегать попыток отделить плаценту, поскольку это может вызвать массивное кровотечение. Тяжесть этого состояния подчеркивает значение точной пренатальной диагностики, поскольку она оказывает огромное влияние на тактику и результаты лечения пациенток.
РАСХОЖДЕНИЕ И РАЗРЫВ РУБЦА НА МАТКЕ
Образованный рубец в матке после кесарева сечения склонен к расхождению/разрыву при последующих беременностях. Это также может случаться после других операций на матке, таких как: миомэктомия, метропластика и септопластика. Расхождение рубца определяется как нарушение целостности миометрия с интактной серозной оболочкой. В случае разрыва матки нарушается целостность как миометрия, так и серозной оболочки. Частота разрывов рубца у женщин с родами через естественные родовые пути после кесарева сечения составляет от 0,2% до 1,5%. Риск расхождения рубцов выше при классическом разрезе, чем при поперечном. Расхождение рубца может иметь разнообразную клиническую картину. Это состояние может оставаться бессимптомным или характеризоваться болью внизу живота, чувством тяжести или вагинальным кровотечением.
УЛЬТРАЗВУКОВЫЕ ОСОБЕННОСТИ
Ультразвуковая оценка НСМ используется в качестве предиктора риска разрыва матки во время попытки вагинальных родов после предшествующего кесарева сечения (ПВРПКС) (индуцированные роды). Точное прогнозирование риска расхождения рубца необходимо, так как это может увеличить безопасность проведения ПВРПКС. Рубец после кесарева сечения описывается как клиновидная гипоэхогенная область в передней стенке нижнего сегмента небеременной матки. Цветная доплерография показывает относительную аваскулярность на месте рубца. Чем дольше время, прошедшее после операции, тем меньше размер клиновидного дефекта. Слово «ниша» было введено Monteagudo и др., чтобы описать треугольную анэхогенную область на предполагаемом участке хирургического разреза при соногистерографии во время инфузии солевого раствора. Naji и др. предложили стандартизованный подход для описания кесаревых рубцов при ТВУЗИ. Они описали рубец как гипоэхогенное углубление в передней стенке НСМ между маточно-мочепузырной складкой и внутренним зевом. В сагиттальной и поперечной плоскостях измеряются три измерения рубца: длина, ширина и глубина. Размеры кесарева рубца изменяются на протяжении всей беременности. Разрыв рубца во время ПВРПКС напрямую связан с меньшей остаточной толщиной миометрия (ОТМ) во время беременности. Исследователи полагают, что модель, включающая изменения ОТМ от первого до второго триместра, может предсказывать успешное проведение ПВРПКС у женщин с одним кесаревым сечением в анамнезе.
Несколько попыток были проведены для прогнозирования риска разрыва рубца путем измерения толщины всего НСМ или только ОТМ на месте рубца. Bujold и др. измеряли полную толщину НСМ и толщину миометрия при трансабдоминальном и трансвагинальном сканировании у беременных женщин в возрасте от 35 до 38 недель. Они отметили, что толщина НСМ <2,5 мм была связана с более 10% частотой разрыва матки с приблизительной специфичностью 90%. Мартинс и др. пришли к выводу, что измерение мышечной толщины НСМ при трансвагинальной сонографии было более надежным, чем оценка всей толщины НСМ при трансабдоминальном доступе. В недавнем метаанализе Kok и др. заметили, что пороговое значение всей толщины НСМ – 3,1-5,1 мм и пороговое значение толщины миометрия – 2,1-4,0 мм имели сильное отрицательное прогностическое значение для развития дефекта во время ПВРПКС у женщин с кесаревым сечением в анамнезе. Пороговое значение толщины миометрия между 0,6 и 2,0 мм имело сильное положительное прогностическое значение для развития дефекта. Анализ нескольких исследований для прогнозирования риска разрыва рубца показывает, что не существует стандартного протокола с достаточно высокой чувствительностью и специфичностью. Также не существует консенсуса относительно идеального доступа к проведению УЗИ (трансабдоминального или трансвагинального), стандартизации метода измерения толщины НСМ или времени проведения исследований. На рис. 3 показано расхождение рубца у пациентки, которая попала на ультразвуковое исследование на 37 недели гестации с жалобами на боль внизу живота и чувство тяжести.
Рис. 3. Расхождение рубца матки на 37-й неделе беременности. Трансвагинальная сагиттальная сонограмма у пациентки с кесаревым сечением в анамнезе, жалобами на боль внизу живота и чувство тяжести, демонстрирует истончение нижнего сегмента матки с невыраженным миометрием на месте рубца. Эхогенная серозная оболочка (*) не повреждена. BL – мочевой пузырь; CX – шейка матки; FH – головка плода.
Несмотря на то, что МРТ не является первой линией диагностики, она помогает визуализировать степень расхождения рубца в неоднозначных случаях и у пациентов с ожирением, которые не могут быть адекватно оценены с помощью УЗИ. Также эта методика способна различать сопутствующие гематомы от скоплений жидкости.
ЛЕЧЕНИЕ
После постановки диагноза расхождения рубца, метод родоразрешения является только хирургическим с устранением дефекта или гистерэктомией в зависимости от клинического состояния пациентки и желания последующей фертильности.
ЗАКЛЮЧЕНИЕ
Рубец от кесарева сечения может способствовать развитию патологических состояний при последующих беременностях. Он может быть более, чем невинным свидетелем таких состояний, как беременность кесарева рубца, патологическое прикрепление плаценты и расхождение или разрыв рубца. Ультразвуковое исследование является надежным инструментом для ранней диагностики этих состояний. Оно помогает инициировать своевременные и эффективные действия, которые способствуют снижению материнской и перинатальной заболеваемости и смертности.


















14.10.2019
елена