Резюме
Введение: Аденомиоз – это распространенное хроническое заболевание у женщин репродуктивного возраста, которое характеризуется наличием эктопической эндометриальной ткани в миометрии. Несмотря на то, что аденомиоз проявляется хронической тазовой болью, меноррагией или аномальными маточными кровотечениями, дисменореей и диспареунией, его часто диагностируют после гистерэктомии. Однако развитие ультразвуковой и магнитно-резонансной томографии улучшило предоперационную диагностику заболевания. Гистероскопия предоставляет информацию в реальном времени из полости матки и дает возможность получить прямую биопсию.
Материал и методы: Проведен поиск литературы в Pubmed и Embase по таким рубрикам: диагностика аденомиоза или аденомиомы и офисная гистероскопия, результаты гистероскопии при аденомиозе или аденомиоме, лечение аденомиоза или аденомиомы с помощью офисной гистероскопии.
Результаты: Анализ литературы показал, что гистероскопия позволяет выявить поверхностный аденомиоз. Существуют разнообразные гистероскопические изображения, которые могут быть связаны с этим заболеванием. Новое оборудование, такое как спиротом, используется для доступа к более глубоким слоям миометрия и получения биопсий под прямым осмотром из аденомиотических участков. Также были описаны различные методы лечения, такие как энуклеация очаговой поверхностной аденомиомы, коагуляция, эвакуация кистозного аденомиоза, когда поражение менее 1,5 см, и резекция аденомиотических узлов в случае больших поражений (>1,5 см). Диффузный поверхностный аденомиоз также лечится путем резекции.
Выводы: Гистероскопия произвела революцию в подходе к лечению аденомиоза. Она является полезным инструментом в оценке преимущественно поверхностного аденомиоза. Роль гистероскопии в хирургическом лечении аденомиоза требует дальнейших исследований.
Ключевые слова: аденомиоз; гистероскопия; вагиноскопический подход; менеджмент; лечение; диагностика; аденомиоз
1. Вступление
Аденомиоз – хроническое заболевание, известное более 100 лет. Заболеваемость аденомиозом можно оценить лишь в пределах 5-70%, поскольку это заболевание, диагноз которого можно подтвердить только после гистерэктомии [1]. Гистологически аденомиоз характеризуется инвазией миометрия из эндометриальных желез и/или стромы глубже 2,5 мм от места соединения эндометрия с миометрием (зона соединения – ЗС) [2].
В большинстве случаев аденомиоз не имеет специфических клинических симптомов; вместо этого он вызывает дисменорею, которая начинается в раннем возрасте, примерно в период менархе, и хроническую тазовую боль, которая не поддается лечению анальгетиками или циклическими оральными контрацептивами [3]. Большинство пациенток с аденомиозом жалуются на аномальные маточные кровотечения (АМК), вздутие живота и низкое тазовое давление. Независимо от клинических проявлений, одна из трех женщин с аденомиозом остается бессимптомной [4]. Во многих случаях аденомиоз сосуществует с эндометриозом, тогда как лишь небольшая часть пациенток с эндометриозом не имеет сопутствующего аденомиоза [5].
Диагностика аденомиоза все еще остается противоречивой. В этом исследовании мы имеем целью изучить диагностическую и терапевтическую роль офисной гистероскопии при аденомиозе, чтобы определить типы аденомиоза, которые подходят для гистероскопической диагностики и потенциального лечения в офисных условиях.
2. Классификация и диагностика аденомиоза
Аденомиоз можно различить в гистологическом препарате как диффузный или очаговый в соответствии с инвазией миометрия. При диффузном типе железы и/или строма эндометрия широко расположены между мышечными волокнами миометрия, что приводит к увеличению объема матки, образуя патогномоничную “объемную” матку, и традиционно может быть обнаружено во время клинического обследования. Очаговый аденомиоз – это, как правило, единственный солидный узел, расположенный в миометрии, который характеризуется как аденомиома, или аденомиозная киста, если она имеет кистозные признаки [6].
Другая классификация аденомиоза базируется на магнитно-резонансной томографии (МРТ). Оценка спаечной зоны (ЗЗ) базируется на трех основных параметрах: толщина, регулярность и прерывистость ЗЗ. Нерегулярность измеряется как JZdif и считается дополнительной характеристикой, указывающей на аденомиоз [7]. Kishi и др. [8] создали другую классификацию на основе МРТ-характеристик. Подтип I (внутренний) аденомиоз связан с внутренними структурными компонентами матки, такими как эндометрий и зона спайки. Аденомиоз подтипа II (наружный) возникает в наружной оболочке матки, нарушая серозную оболочку, но не затрагивая внутренние компоненты. Аденомиоз подтипа ІІІ (интрамуральный) локализовался исключительно в миометрии. На остальных изображениях был обнаружен дополнительный подтип, подтип IV (неопределенный) аденомиоз.
Kobayashi et al. [9] использовали другую классификацию аденомиоза, основанную на пораженном участке и распространенности аденомиоза. В частности, пациенты были идентифицированы с тремя типами аденомиоза: внутренним, внешним и другими типами. Внутренний тип определяется как аденомиоз, присутствующий во внутреннем слое матки, который не затрагивает внешние структуры миометрия. Внешний тип определяется как аденомиоз, возникающий в наружном слое матки, не затрагивая внутренние структуры. Степень поражения аденомиозом подразделяется на три степени (<1/3, <2/3 или >2/3 стенки матки). A1, A2 и A3 определяются как “поражение ограничено внутренней 1/3 миометрия матки”, “поражение ограничено внутренними 2/3 миометрия матки” и “поражение выходит за пределы внутренних 2/3 миометрия и часть поражения достигает серозной оболочки матки”. B1, B2 и B3 определяются как “поражение ограничено внешней 1/3 миометрия матки”, “поражение ограничено внутренними 2/3 миометрия матки” и “поражение выходит за пределы внешних 2/3 миометрия и часть поражения достигает эндометрия матки”. Если поражение распространяется на весь миометрий, А3 и В3 нельзя различить с помощью МРТ и патологии. Пациентки также могут быть отнесены к “другому типу”, когда они не относятся ни к типу А, ни к типу В.
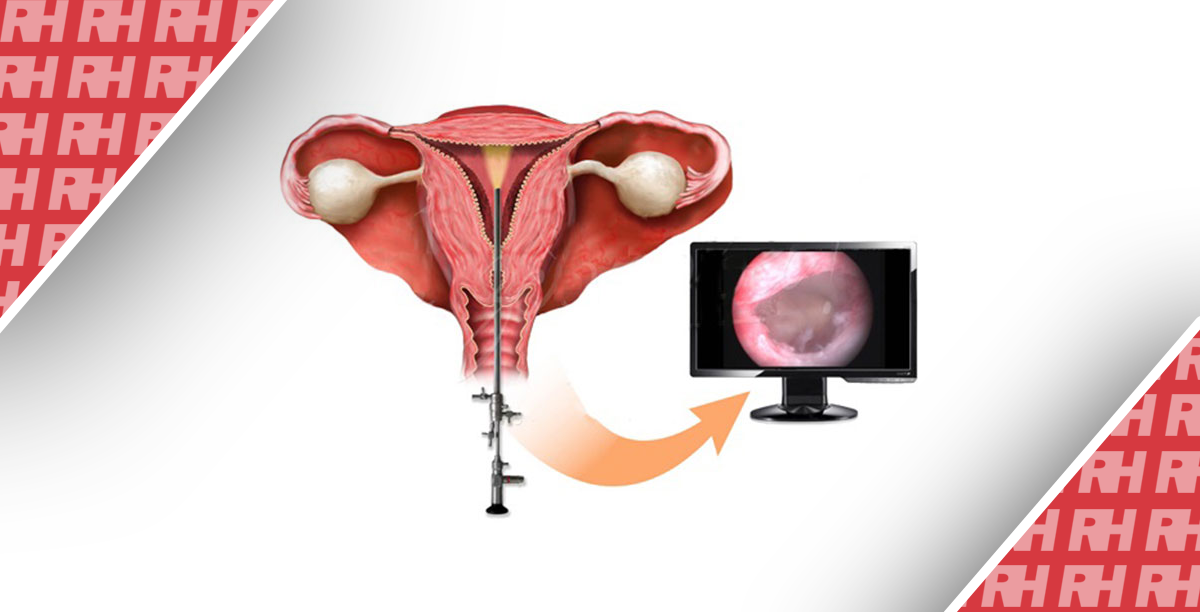
Женщины с аденомиозом имеют не одинаковую клиническую картину. Кроме того, для некоторых из них необходимо сохранить матку. Как следствие, существует необходимость предоперационного выявления аденомиоза, чтобы выбрать лучшее лечение и правильную хирургическую технику и достичь наилучших результатов для каждой пациентки [10]. Сегодня более реально, чем раньше, диагностировать аденомиоз с помощью гистероскопии, трансвагинальной сонографии (ТВС) и магнитно-резонансной томографии (МРТ), не прибегая к гистерэктомии [11]. МРТ ранее была оптимальным методом выявления аденомиоза [12], но она не является экономически эффективной и не всегда доступна [13]. ТВС является более приемлемым вариантом, и его точность в диагностике аденомиоза значительно повысилась после совершенствования сонографического оборудования и программного обеспечения [14,15]. Прямая визуализация полости матки, которую предлагает гистероскопия, расширяет возможности диагностики аденомиоза, предлагая в то же время некоторые интервенционные свойства [16,17].
Гистероскопическая техника и оборудование менялись в течение многих лет, что сделало ее доступной в амбулаторных условиях. Первоначально гистероскопия проводилась только в операционной под общим обезболиванием, но с тех пор гистероскопия была внедрена в офисных условиях, где не используется ни анестезия, ни обезболивание, в основном благодаря минимизации оборудования и внедрению новой, “бесконтактной” техники, которая называется вагиноскопия [18]. Проведение гистероскопии в офисных условиях дает возможность оказывать услуги по принципу “увидеть и вылечить”, то есть гистероскопист может исследовать, диагностировать, а в некоторых случаях и вылечить патологию эндометрия за один прием [18].
3. Материал и методы
Материал и методы: Поиск литературы проводили через Pubmed и Embase по следующим рубрикам: диагностика аденомиоза или аденомиомы и офисная гистероскопия, результаты гистероскопии при аденомиозе или аденомиоме, лечение аденомиоза или аденомиомы с помощью офисной гистероскопии. Исследования были включены только в том случае, если в них были представлены данные об офисной гистероскопии и ее применении в случаях аденомиоза, включая только диагностическую или только оперативную гистероскопию.
4. Гистероскопическая диагностика аденомиоза
Трудно определить роль гистероскопии в выявлении аденомиоза. Гистероскопист может визуализировать полость эндометрия в режиме реального времени, а также получать биопсию эндометрия под прямым контролем, что повышает безопасность пациентки и минимизирует количество ложноотрицательных результатов [16]. Однако, до сих пор не существует специфических характеристик, которые могли бы безопасно определить диагноз аденомиоза [19]. Важным ограничением метода является то, что гистероскопия позволяет наблюдать только поверхность эндометрия. Как следствие, аденомиоз, который обычно обнаруживается в более глубоком слое миометрия, невозможно идентифицировать [5,10].
Следующие гистероскопические картины обычно считаются признаками аденомиоза [20]:
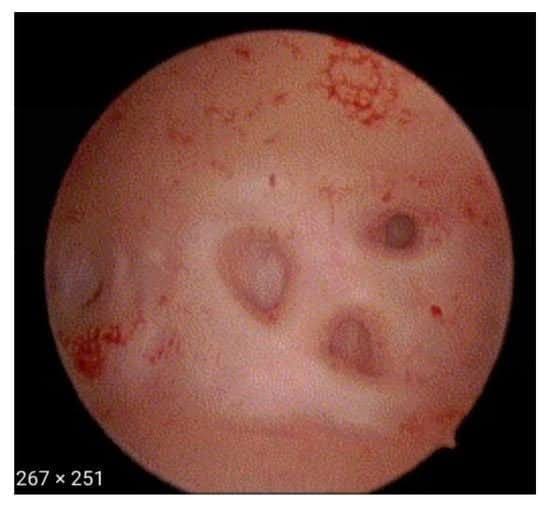
- Нерегулярный эндометрий с крошечными отверстиями на поверхности эндометрия (Рис. 1)
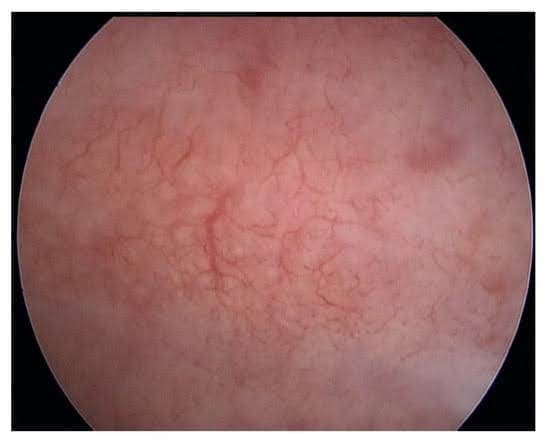
- Гиперваскуляризация (Рис. 2)
- Эндометрий в виде “клубнички” (Рис. 3)
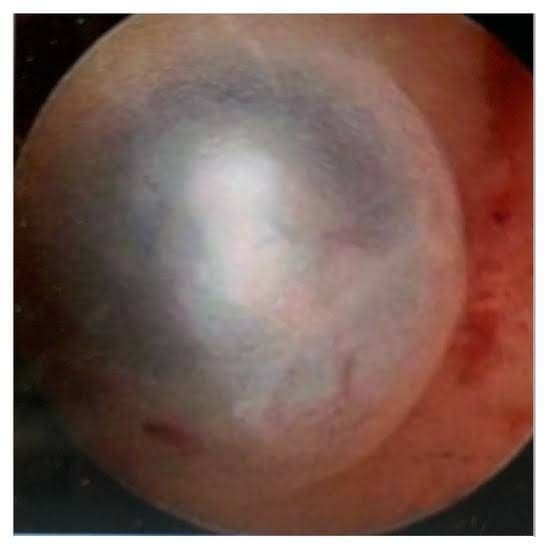
- Фиброзно-кистозный вид внутриматочных поражений (Рис. 4)
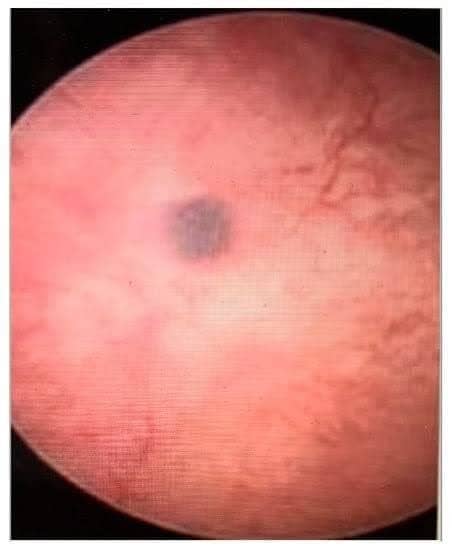
- Геморрагические кистозные поражения, имеющие темно-синий или шоколадно-коричневый вид (Рис. 5)
Рисунок 1. Нерегулярный эндометрий с отверстиями.
Рисунок 2. Гиперваскуляризация.
Рисунок 3. Эндометриальный “клубничный” узор.
Рисунок 4. Фиброзно-кистозный вид внутриматочных поражений.
Рисунок 5. Геморрагические кистозные поражения, имеющие темно-синий или шоколадно-коричневый вид.
У пациенток с аденомиозом только гистероскопия может дать представление о возможных аденомиотических поражениях с неравномерным распределением сосудов во время пролиферативной и секреторной фазы, но не всегда может установить диагноз. Однако она позволяет проводить прямую биопсию образцов, полученных из эндометрия и подлежащего миометрия с помощью механических инструментов (биопсийные или захватывающие щипцы, ножницы) или биполярных электродов [16,21].
При наличии любой гистероскопической картины, указывающей на заболевание, хирург может использовать резектоскоп с диатермической петлей для выполнения резекции эндо-миометриального слоя. Для получения адекватной биопсии при таком подходе необходимо получить образцы как из эндометрия, так и из миометрия, что облегчает точную гистологическую диагностику. По вышеупомянутой причине, вторая биопсия должна следовать за первичной, чтобы получить более глубокие образцы, которые включают только ткань миометрия [6]. Следующие три результата биопсии с помощью резектоскопа свидетельствуют об аденомиозе: (1) нерегулярный субэндометриальный миометрий (спиральный и/или фиброзный); (2) нерегулярная архитектура миометрия во время резекции; (3) наличие интрамуральных эндометриом [6]. Использование мини-резектоскопа потенциально позволит получать биопсии в случаях аденомиоза в офисных условиях благодаря его размерам, которые делают опыт офисной гистероскопии более комфортным для пациенток [20].
Vercellini и др. [22] предположили, что игольчатая биопсия обеспечивает высокую специфичность (95%), хотя и с низкой чувствительностью (44,8%). Даже когда игольчатую биопсию сочетали с применением трансвагинального ультразвука, улучшения чувствительности не произошло. Darwish et al. доказали, что резектоскопическая техника лучше жестких биопсийных щипцов [23], а McCausland был первым, кто описал технику биопсии миометрия через гистероскопию [17]. Он диагностировал аденомиоз в 66% случаев и обнаружил корреляцию между глубиной и клиническими симптомами. Goswami и др. [24], используя петлевую резекцию, обнаружили частоту аденомиоза в 60%, что контрастировало с контрольной группой с 33%. Средняя глубина инвазии составляла 4,103 мм в группе с меноррагией и 2,03 мм в контрольной группе. Fedele и др. [25] использовали в качестве порога 2,5 мм и диагностировали аденомиоз в 51% случаев. Хотя нет единого мнения относительно диагностических гистероскопических критериев аденомиоза, кажется, что гистероскопия может играть важную роль в диагностике этой патологии. Если сравнивать применение игольной биопсии с использованием резектоскопа в качестве диагностического инструмента, то предпочтение отдается второму [24].
Gordts et al. описали использование альтернативной системы – трофического гистероскопа (Karl Storz, Германия). Эта система может меняться от диагностической, с гистероскопом диаметром 2,9 мм, до операционной, с диаметром 4,4 мм, без необходимости извлечения гистероскопа [21]. Дальнейшие инструменты 5-Fr можно вводить через операционную оболочку и использовать для диссекции или коагуляции. Эндомиометриальная биопсия показала специфичность 78,46% с низкой чувствительностью 54,32%, что в основном связано с большим количеством ложноотрицательных результатов в случаях глубокого аденомиоза [26]. В противоположность этому, УЗИ имеет чувствительность 72% [27]. Использование маточного спиротома обеспечивает более глубокую и прямую биопсию как из эндометрия, так и из миометрия одновременно. Спиротом работает с двумя устройствами: приемной иглой с режущей спиралью на дистальном конце и режущей канюлей в виде внешнего листа; направление и положение точки спирали должны быть под непрерывным ультразвуковым и гистероскопическим контролем [21]. Из-за неоптимальных размеров, использование вышеупомянутого гистероскопа рассматривается только под общей анестезией, что ограничивает его применение операционными.
Dakhly et al. представили подход к гистероскопическому забору тканей для диагностики аденомиоза с последующим подтверждением патологии гистерэктомией. Гистероскопическая биопсия проводилась с задней стенки матки с использованием только гистероскопических ножниц и захватов. Этот метод показал чувствительность 54,3% и специфичность 78,5% для диагностики аденомиоза среди 292 женщин в пременопаузе, которым планировали провести гистерэктомию по поводу дисменореи и сильных менструальных кровотечений [26].
Существует большой диапазон чувствительности методов забора тканей во время гистероскопии. Большинство опубликованных работ сообщают о неоптимальной и низкой чувствительности для диагностики аденомиоза. Однако это возможно, поскольку количество биопсий, локализация биопсии и оптимальная техника биопсии являются потенциальными факторами, которые определяют чувствительность гистероскопической диагностики аденомиоза. Неоднородность методик, представленных в литературе, делает невозможным их сравнение и получение объективных результатов [28].
Гистероскопия дает возможность проводить прямую биопсию, нацеленную на участки, представляющие интерес. Результаты гистероскопии сопоставляются с ультразвуковыми изображениями. Клиницисты могут подходить к женщинам с аденомиозом по-другому, более консервативно и без необходимости гистерэктомии [29] для установления окончательного диагноза. Следует отметить, что доказательств в пользу применения гистероскопии, особенно офисной гистероскопии, как метода исследования и диагностики аденомиоза недостаточно. Существует не так много исследований, которые поддерживают использование внутриматочных методов, таких как гистероскопия, для диагностики аденомиоза [30]. Тем не менее, гистероскопия является менее инвазивным методом по сравнению с гистерэктомией, и, безусловно, необходимо полностью изучить ее роль при аденомиозе.
5. Офисная гистероскопия как метод лечения аденомиоза
Аденомиоз можно лечить консервативно или хирургически. Традиционно самым распространенным способом лечения этого хронического заболевания является гистерэктомия. Предоперационная диагностика аденомиоза была значительно улучшена, в частности, появилась необходимость предлагать индивидуальное лечение в зависимости от возраста пациентки, желания иметь беременность в будущем и симптоматики [31].
Что касается медикаментозного лечения, то доступные варианты являются первичными, направленными на уменьшение локальной гиперэстрогении и улучшение тяжелых симптомов аденомиоза, таких как обильные менструальные кровотечения, дисменорея и хроническая тазовая боль, не связанная с менструацией. Медикаментозное лечение аденомиоза включает агонисты или антагонисты гонадотропин-рилизинг-гормона, внутриматочную спираль, высвобождающую левоноргестрел, комбинированные оральные контрацептивы, прогестагены, улипристала ацетат и нестероидные противовоспалительные препараты (НПВП); методы, подобные тем, что применяются для лечения эндометриоза, используются и для лечения эндометриоза [31, 32]. Основным недостатком этих методов лечения является то, что они вызывают регрессию, а не устранение патологии, с рецидивом симптомов после отмены препарата [33].
Очаговый аденомиоз удаляют с помощью лапароскопии или лапаротомии, подобно миомэктомии. Однако иногда это может быть сложно, поскольку аденомиоз иногда не имеет четкой плоскости разреза, и существует риск того, что врач удалит больше ткани, чем это необходимо [26]. Гистероскопия возможна только в случаях, когда очаговый или диффузный аденомиоз расположен близко к эндометрию [20]. Гистероскопия не считается первоочередным методом лечения женщин с аденомиозом, хотя существуют отдельные случаи, которые доказывают, что гистероскопия может играть важную роль в лечении аденомиоза [19,20].
Кроме того, Di Spezio и др. [20] предложили энуклеацию как метод лечения очаговых аденомиом диаметром менее 1,5 см, расположенных близко к полости эндометрия, с использованием механических инструментов и/или биполярных электродов. Это лечение применяется в случаях, когда участки аденомиоза видны при гистероскопии, поскольку они прорастают в полость эндометрия. Обоснованием этого является то, что аденомиоз может быть удален с помощью минимально инвазивной диссекции и может происходить в офисных условиях с помощью мини-гистероскопа и резектоскопа. Техника, используемая в амбулаторных условиях, является такой же, как и для энуклеации подслизистых миом, имеющих интрамуральные компоненты. Однако процедура включает значительный элемент осторожного исследования из-за отсутствия четкой плоскости рассечения, необходимой для адекватной идентификации здоровой ткани миометрия [16]. В случае аденомиоидного узла размером более 1,5 см целесообразным вариантом лечения может быть резектоскопическое лечение [20]. Резектоскопическое удаление возможно в офисных условиях с помощью мини-резектоскопа [34]. Однако доказательства по использованию этой оперативной технологии для лечения аденомиоза ограничены.
Абляция эндометрия предлагается преимущественно женщинам, не желающим беременности в будущем, и при ее выполнении удаляется дефектный миометрий, лежащий в основе [34]. В этом случае важно выявить женщин, которые потенциально могут выполнить процедуру в офисных условиях из-за дополнительных затрат времени, а также дискомфорта, который это может вызвать [34]. В случаях глубокого диффузного аденомиоза, когда аденомиотические поражения расположены глубже, чем поверхностный слой эндометрия, гистероскопия не считается надлежащим подходом, как это ожидается. McCausland et al. показали, что в этих случаях резектоскопическое лечение не может улучшить жалующиеся симптомы, и более того, может скрыть глубокий аденомиоз, позволяя персистирующее развитие заболевания ниже эндо-миометриальной рубцовой ткани [35].
Оперативная гистероскопия может быть целесообразной в случаях поверхностных аденомиоидных узлов и диффузного поверхностного аденомиоза как метод лечения [20]. Если аденомиома видна в полости матки, может быть применена техника адено-миомэктомии, подобная миомэктомии [36]. Xia и др. [37] представили данные 51 женщины, которым была выполнена гистероскопическая резекция аденомиоза под контролем УЗИ, и доказали клиническую целесообразность гистероскопической резекции для лечения симптоматического аденомиоза, лежащего в глубоких слоях миометрия. Интраоперационная и послеоперационная безопасность и низкая частота рецидивов меноррагии и дисменореи в течение 2-летнего наблюдения продемонстрировали потенциальные возможности применения гистероскопии в лечении аденомиоза, как сообщалось ранее [38,39]. К сожалению, гистероскопия предоставляет информацию только о состоянии эндометрия, и гистероскопист сталкивается со значительными ограничениями относительно плоскости разреза и пространства. Кроме того, мышечная ткань тонкая и легко перфорируется, поэтому очень важно тщательно отбирать пациенток и убедиться, что это хирургическое вмешательство выполняет квалифицированный хирург [37]. В частности, Xia и др. [37] представили технические этапы удаления аденомиомы с помощью гистероскопической резекции. После разрезания эндометрия, который покрывает аденомиотические поражения, обнажаются розовые эктопические поражения эндометрия в миометрии. Затем постепенно удаляют эктопический эндометрий и аденомиотические очаги в миометрии. Во время резекции очагов поражения обнаруживают несколько интрамуральных микрокист с широкими основаниями. Вскрытие микрокисты приводит к оттоку густой коричневой жидкости, преимущественно старой крови. Затем эндометриоподобную ткань и микрокисты удаляют с помощью петли. Во время резекции сосуды миометрия коагулируют, чтобы избежать чрезмерного всасывания жидкости. После откачки жидкости внутренний осмотр микрокисты выявляет наличие розовой эктопической эндометриоподобной ткани. Операция считается завершенной, когда появляется розовая пучковая структура миометрия [37]. Из-за характера процедуры считается, что ее опасно выполнять с помощью офисного гистероскопического оборудования [37].
Поверхностный диффузный аденомиоз можно также лечить с помощью эндомиометриальной абляции [20]. Этот подход существенно отличается от традиционного метода эндометриальной абляции. Резекция должна распространяться дальше в миометрий, по крайней мере на 10 мм в глубину, в то время как аденомиозное поражение должно быть в пределах 3-10 см. Затем гистероскопист должен будет продолжать вырезать слой миометрия до тех пор, пока не будет распознан здоровый миометрий. Коагуляция завершает процедуру, которая выполняется с помощью прямых петель диаметром 3 мм или 5 мм для абляции дна матки и классических режущих петель для абляции стенок матки [20]. Если симптомы не исчезают, может быть проведена повторная хирургическая процедура для оценки эффективности гистероскопической техники при лечении аденомиоза [20]. Нет данных для оценки этого метода в условиях кабинета врача.
Preutthipan и др. [32] представили свои результаты после гистероскопической роликовой абляции эндометрия. Из женщин, участвовавших в этом исследовании, 98,4% сообщили об уменьшении кровотечения. Только 1,6% пациенток пришлось выполнить гистерэктомию для лечения персистирующих симптомов. Это исследование доказало, что гистероскопическая роликовая абляция эндометрия, как хирургическая альтернатива иссечению аденомиоза, является эффективной и безопасной процедурой. Кроме того, она также может уменьшить потребность в ненужных обширных вмешательствах, таких как гистерэктомия. Тем не менее, основным ограничением вышеупомянутого исследования был ограниченный размер выборки и его ретроспективный характер. В этом исследовании также представлены результаты гистероскопии, выполненной в операционной под общей анестезией [32].
Когда кистозные поражения предоперационно распознаются глубже в миометрии, эффективным подходом может быть использование спиротома [19]. Gordts et al. показали, что с помощью спиротома под контролем УЗИ можно устранить аденомиотические кистозные участки даже в тех случаях, когда внутриполостные компоненты не видны [19]. Устройство создает канал и обеспечивает гистероскопический доступ к кистозной структуре, что позволяет проводить дальнейшее лечение с помощью биполярной коагуляции или резекции [21]. Механическое рассечение маленькими ножницами или вскрытие кисты и коагуляция небольших аденомиоидных кистозных стенок и крипт в зоне спайки также могут быть выполнены под ультразвуковым контролем, хотя эта процедура описана лишь в некоторых случаях [40,41,42,43].
Как сообщалось ранее, не существует общепринятого метода гистероскопического лечения аденомиоза. Некоторые авторы представляют собственный опыт. В этом исследовании мы имеем целью представить эти различные методы. Однако мы не можем доказать, какой из них является лучшим, из-за их неоднородности, даже в принципах и данных, приведенных в каждой рукописи.
6. Выводы
Гистерэктомия всегда будет стандартным методом лечения аденомиоза, но все большее количество женщин желает использовать подходы, сохраняющие фертильность. В этом случае можно предложить медикаментозное лечение заболевания или гистероскопический подход, если он показан отдельным пациенткам. Улучшение дисменореи и меноррагии достигается у более 81% и 50% пациенток соответственно [20]. Кажется, что консервативное медикаментозное лечение является более эффективным в отношении аденомиоза, но доказательства все еще ограничены, чтобы подтвердить его преимущество в отношении репродуктивного результата [20]. Это подчеркивает важность постоянного изучения влияния гистероскопического лечения аденомиоза.
Гистероскопия предоставляет дополнительную информацию в понимании аденомиоза как патологического состояния, обеспечивая диагностику и лечение конкретных типов заболевания. Когда аденомиоз расположен близко к эндометрию, можно обнаружить гистероскопические признаки, которые предоставляют дополнительную информацию о полости матки пораженной пациентки [20]. Она предлагает дополнительное преимущество получения биопсии под прямым контролем зрения или под контролем УЗИ в случаях более глубокого аденомиоза для подтверждения эндоскопического диагноза [5]. Диагностическая гистероскопия при аденомиозе может быть проведена в офисных условиях с оптимальными результатами [20]. Общая или местная анестезия не требуется, а гистероскопист может использовать инструменты меньшего диаметра и эффективно подходить к полости эндометрия, что позволяет легко получить биопсию под прямым осмотром [20].
Консервативное, маткосберегающее лечение аденомиоза представляется возможным и эффективным. Гистероскопия может предложить вариант лечения аденомиоза. Необходимы дальнейшие исследования для лучшего понимания показаний к гистероскопическому лечению аденомиоза и его влияния на жизнь женщин [20], особенно в офисных условиях, поскольку имеющейся информации пока недостаточно для поддержки лечения аденомиоза с помощью офисной гистероскопии [39,40].
Ссылки на источники
- Azziz, R. Adenomyosis: Current perspectives. Obstet. Gynecol. Clin. N. Am. 1989, 16, 221–235.
- Habiba, M.; Benagiano, G. Uterine Adenomyosis; Springer: Cham, Switzerland, 2016.]
- Ryo, E.; Takeshita, S.; Shiba, M.; Ayabe, T. Radiofrequency ablation for cystic adenomyosis: A case report. J. Reprod. Med. 2006, 51, 427–430.
- Peric, H.; Fraser, I.S. The symptomatology of adenomyosis. Best Pract. Res. Clin. Obstet. Gynaecol. 2006, 20, 547–555.
- Gordts, S.; Grimbizis, G.; Campo, R. Symptoms and classification of uterine adenomyosis, including the place of hysteroscopy in diagnosis. Fertil. Steril. 2018, 109, 380–388.e1.
- Harmsen, M.J.; Bosch, T.V.D.; de Leeuw, R.A.; Dueholm, M.; Exacoustos, C.; Valentin, L.; Hehenkamp, W.J.K.; Groenman, F.; De Bruyn, C.; Rasmussen, C.; et al. Consensus on revised definitions of Morphological Uterus Sonographic Assessment (MUSA) features of adenomyosis: Results of modified Delphi procedure. Ultrasound Obstet. Gynecol. 2021, 60, 118–131.
- Ascher, S.M.; Arnold, L.L.; Patt, R.H.; Schruefer, J.J.; Bagley, A.S.; Semelka, R.C.; Zeman, R.K.; Simon, J.A. Adenomyosis: Prospective comparison of MR imaging and transvaginal sonography. Radiology 1994, 190, 803–806.
- Kishi, Y.; Suginami, H.; Kuramori, R.; Yabuta, M.; Suginami, R.; Taniguchi, F. Four subtypes of adenomyosis assessed by magnetic resonance imaging and their specification. Am. J. Obstet. Gynecol. 2012, 207, 114.e1–114.e7.
- Kobayashi, H.; Matsubara, S.; Imanaka, S. Clinicopathological features of different subtypes in adenomyosis: Focus on early lesions. PLoS ONE 2021, 16, e0254147.
- Keckstein, J. Hysteroscopy and adenomyosis. Contrib. Gynecol. Obstet. 2000, 20, 41–50.
- Van den Bosch, T.; De Bruijn, A.M.; De Leeuw, R.A.; Dueholm, M.; Exacoustos, C.; Valentin, L.; Bourne, T.; Timmerman, D.; Huirne, J.A. Sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet. Gynecol. 2019, 53, 576–582.
- Bazot, M.; Cortez, A.; Darai, E.; Rouger, J.E.; Chopier, J.; Antoine, J.M.; Uzan, S. Ultrasonography compared with magnetic resonance imaging for the diagnosis of adenomyosis: Correlation with histopathology. Hum. Reprod. 2001, 16, 2427–2433.
- Cody, R.F.J.; Ascher, S.M. Diagnostic value of radiological tests in chronic pelvic pain. Best Pract. Res. Clin. Obstet. Gynaecol. 2000, 14, 433–466.
- Bosch, T.V.D.; Dueholm, M.; Leone, F.P.G.; Valentin, L.; Rasmussen, C.K.; Votino, A.; Van Schoubroeck, D.; Landolfo, C.; Installé, A.J.F.; Guerriero, S.; et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: A consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet. Gynecol. 2015, 46, 284–298.
- Lazzeri, L.; Morosetti, G.; Centini, G.; Monti, G.; Zupi, E.; Piccione, E.; Exacoustos, C. A sonographic classification of adenomyosis: Interobserver reproducibility in the evaluation of type and degree of the myometrial involvement. Fertil. Steril. 2018, 110, 1154–1161.e3.
- Molinas, C.R.; Campo, R. Office hysteroscopy and adenomyosis. Best Pract. Res. Clin. Obstet. Gynaecol. 2006, 20, 557–567.
- McCausland, A.M. Hysteroscopic myometrial biopsy: Its use in diagnosing adenomyosis and its clinical application. Am. J. Obstet. Gynecol. 1992, 166 Pt 1, 1618–1619.
- Bettocchi, S.; Selvaggi, L. A vaginoscopic approach to reduce the pain of office hysteroscopy. J. Am. Assoc. Gynecol. Laparosc. 1997, 4, 255–258.
- Brosens, I.; Gordts, S.; Habiba, M.; Benagiano, G. Uterine Cystic Adenomyosis: A Disease of Younger Women. J. Pediatr. Adolesc. Gynecol. 2015, 28, 420–426.
- Sardo, A.D.S.; Calagna, G.; Santangelo, F.; Zizolfi, B.; Tanos, V.; Perino, A.; De Wilde, R.L. The Role of Hysteroscopy in the Diagnosis and Treatment of Adenomyosis. BioMed Res. Int. 2017, 2017, 1–7.
- Gordts, S.; Campo, R.; Brosens, I. Hysteroscopic diagnosis and excision of myometrial cystic adenomyosis. Gynecol. Surg. 2014, 11, 273–278.
- Tresserra, F.; Grases, P.; Ubeda, A.; Pascual, M.A.; Grases, P.J.; Labastida, R. Morphological changes in hysterectomies after endometrial ablation. Hum. Reprod. 1999, 14, 1473–1477.
- Darwish, A.M.; Makhlouf, A.M.; Youssof, A.A.; Gadalla, H.A. Hysteroscopic myometrial biopsy in unexplained abnormal uterine bleeding. Eur. J. Obstet. Gynecol. Reprod. Biol. 1999, 86, 139–143.
- Goswami, A.; Khemani, M.; Logani, K.B.; Anand, R. Adenomyosis: Diagnosis by hysteroscopic endomyometrial biopsy, correlation of incidence and severity with menorrhagia. J. Obstet. Gynaecol. Res. 1998, 24, 281–284.
- Fedele, L.; Bianchi, S.; Dorta, M.; Zanotti, F.; Brioschi, D.; Carinelli, S. Transvaginal ultrasonography in the differential diagnosis of adenomyoma versus leiomyoma. Am. J. Obstet. Gynecol. 1992, 167, 603–606.
- Dakhly, D.M.R.; Abdel Moety, G.A.F.; Saber, W.; Gad Allah, S.H.; Hashem, A.T.; Abdel Salam, L.O.E. Accuracy of Hysteroscopic Endomyometrial Biopsy in Diagnosis of Adenomyosis. J. Minim. Invasive Gynecol. 2016, 23, 364–371.
- Champaneria, R.; Abedin, P.; Daniels, J.; Balogun, M.; Khan, K.S. Ultrasound scan and magnetic resonance imaging for the diagnosis of adenomyosis: Systematic review comparing test accuracy. Acta Obstet. Gynecol. Scand. 2010, 89, 1374–1384.
- Movilla, P.; Morris, S.; Isaacson, K. A Systematic Review of Tissue Sampling Techniques for the Diagnosis of Adenomyosis. J. Minim. Invasive Gynecol. 2020, 27, 344–351.
- Luciano, D.E.; Exacoustos, C.; Albrecht, L.; LaMonica, R.; Proffer, A.; Zupi, E.; Luciano, A.A. Three-Dimensional Ultrasound in Diagnosis of Adenomyosis: Histologic Correlation With Ultrasound Targeted Biopsies of the Uterus. J. Minim. Invasive Gynecol. 2013, 20, 803–810.
- Chapron, C.; Vannuccini, S.; Santulli, P.; Abrão, M.S.; Carmona, F.; Fraser, I.S.; Gordts, S.; Guo, S.-W.; Just, P.-A.; Noël, J.-C.; et al. Diagnosing adenomyosis: An integrated clinical and imaging approach. Hum. Reprod. Updat. 2020, 26, 392–411.
- Stratopoulou, C.A.; Donnez, J.; Dolmans, M.-M. Conservative Management of Uterine Adenomyosis: Medical vs. Surgical Approach. J. Clin. Med. 2021, 10, 4878.
- Preutthipan, S.; Herabutya, Y. Hysteroscopic rollerball endometrial ablation as an alternative treatment for adenomyosis with menorrhagia and/or dysmenorrhea. J. Obstet. Gynaecol. Res. 2010, 36, 1031–1036.
- Matsushima, T.; Akira, S.; Yoneyama, K.; Takeshita, T. Recurrence of uterine adenomyosis after administration of gonadotropin-releasing hormone agonist and the efficacy of dienogest. Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. 2020, 36, 521–524.
- De Silva, P.M.; Stevenson, H.; Smith, P.P.; Clark, T.J. Pain and Operative Technologies Used in Office Hysteroscopy: A Systematic Review of Randomized Controlled Trials. J. Minim. Invasive Gynecol. 2021, 28, 1699–1711.
- McCausland, A.M.; McCausland, V.M. Long-term complications of endometrial ablation: Cause, diagnosis, treatment, and prevention. J. Minim. Invasive Gynecol. 2007, 14, 399–406.
- Taran, F.A.; Stewart, E.A.; Brucker, S. Adenomyosis: Epidemiology, Risk Factors, Clinical Phenotype and Surgical and Interventional Alternatives to Hysterectomy. Geburtshilfe Frauenheilkd. 2013, 73, 924–931.
- Xia, W.; Zhang, D.; Zhu, Q.; Zhang, H.; Yang, S.; Ma, J.; Pan, H.; Tong, T.; Sun, J.; Zhang, J. Hysteroscopic excision of symptomatic myometrial adenomyosis: Feasibility and effectiveness. BJOG Int. J. Obstet. Gynaecol. 2017, 124, 1615–1620.
- Nishida, M.; Takano, K.; Arai, Y.; Ozone, H.; Ichikawa, R. Conservative surgical management for diffuse uterine adenomyosis. Fertil. Steril. 2010, 94, 715–719.
- Pontis, A.; D’Alterio, M.N.; Pirarba, S.; de Angelis, C.; Tinelli, R.; Angioni, S. Adenomyosis: A systematic review of medical treatment. Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. 2016, 32, 696–700.
- Giana, M.; Montella, F.; Surico, D.; Vigone, A.; Bozzola, C.; Ruspa, G. Large intramyometrial cystic adenomyosis: A hysteroscopic approach with bipolar resectoscope: Case report. Eur. J. Gynaecol. Oncol. 2005, 26, 462–463.
- Kamio, M.; Taguchi, S.; Oki, T.; Tsuji, T.; Iwamoto, I.; Yoshinaga, M.; Douchi, T. Isolated adenomyotic cyst associated with severe dysmenorrhea. J. Obstet. Gynaecol. Res. 2007, 33, 388–391.
- Sun, W.; Guo, X.; Zhu, L.; Fei, X.; Zhang, Z.; Li, D. Hysteroscopic Treatment of a Uterine Cystic Adenomyosis. J. Minim. Invasive Gynecol. 2018, 25, 374–375.
- Takeuchi, H.; Kitade, M.; Kikuchi, I.; Kumakiri, J.; Kuroda, K.; Jinushi, M. Diagnosis, laparoscopic management, and histopathologic findings of juvenile cystic adenomyoma: A review of nine cases. Fertil. Steril. 2010, 94, 862–868.